通过微生物核糖体免疫沉淀快速检测抗微生物剂耐药性的制作方法
[0001]
本发明涉及生物医学和诊断学的领域,尤其涉及用于以快速且可靠的方式确定生物样品对于抗生素的耐药性,从而使amr的风险最小化并且允许定义所选抗生素的治疗性潜力的方法和试剂盒
背景技术:
[0002]
抗生素的出现代表一场世界范围内的社会和医学革命。由于发现了青霉素,在1928年,以前致命的感染变成了微不足道的小病。然而,抗微生物剂药物的误用和滥用导致呈现抗微生物剂耐药性(amr)的病原性细菌菌株的选择。
[0003]
amr已经成为世界范围内的流行病,一些估计表明截止2050年,在世界范围内每年将有1千万人由于细菌抗生素耐药性而死亡。目前,每年在欧洲有超过23.000例由amr导致的死亡,并且在美国有相似的数量,全球每年700.000例死亡。此外,amr与发病率增加、住院时间更长(多达15天)和相关联的医疗成本(针对amr的cdc核心措施)显著增加相关联。在一些情况下,amr的出现和扩散导致多重耐药性菌株(还被称为超级细菌)的出现,这些多重耐药性菌株中的一些对于所有或几乎所有已知的抗生素具有耐药性。结合新抗生素开发的低成功率,有返回到抗生素时代前的风险,这无疑将带来严重的后果。
[0004]
因此,若干公共和政府机构诸如世界卫生组织(who)、美国疾控中心(cdc)或欧盟委员会(ec)致力于建立逆转这种情况的程序。在所提出的不同方针中,首要任务之一是优化现有诊断方法和开发新型诊断方法。
[0005]
遗憾的是,当前的诊断法依赖于细菌培养。该系统虽然具有信息性,但是也有若干注意事项,诸如长周转时间(对于一些细菌菌株,其可以多达两周)、低敏感性和需要至少在一定程度上对于推定的致病菌具有先前信息(bursle,e.等人,2016)。这些诊断延迟可能导致施用广谱第一防御抗生素或试错治疗,这可能促使amr发生并且可能导致对于患者健康的有害作用。
[0006]
最近,已经描述了新的不依赖培养的诊断系统。在这些诊断系统中,基因组水平的诊断测试受到关注。在这一方面,最近开发了基于核酸的系统。较早的方法依赖于16s核糖体基因的pcr扩增作为鉴定病原性细菌但不确定其对于抗生素的耐药性的手段(bosshard,p.p.等人,2003和rampini,s.k.等人,2011)
[0007]
随着下一代测序(ngs,还被称为高通量测序)的出现,提出了允许生物样品的深度测序的系统(otto,m.2017和cangelosi,g.a.等人2014),但是由于需要昂贵的装备和高度专业化的人员,它们在诊所中仍然很少使用。值得注意的是,虽然允许快速且特异性地检测amr,但是基于dna的ngs方法和基于rna的检测方法呈现若干限制。首先,鉴于dna分子的稳定性,由于这些方法在区分来自活细胞或非活细胞的dna信号方面的较差能力,假阳性的诊断成为了一个问题。此外,dna水平提供细胞的代谢或生理状态的较差表示(milner,m.g.等人2001),这将阻碍紧密监测细菌对于抗生素治疗的应答。例如,在cangelosi,g.a.等人,2014中,检测到总dna和响应于营养刺激合成大分子的能力,但是来自相同致病菌的这两个
参数不一定具有信息性。
[0008]
wo 2014/072349 a1和us 2015/141274 a1涉及基于核糖体-rna复合物的免疫沉淀以及核糖体缔和的rna种类的随后分析的翻译组学的领域。然而,它们均未披露或提出使用所披露的分析方法来检测耐药性相关联的微生物核酸。
技术实现要素:
[0009]
本发明提供了用于以快速且可靠的方式确定生物样品对于抗生素的耐药性,从而使amr的风险最小化并且允许定义所选抗生素的治疗性潜力的方法和试剂盒。通过本发明的方法,获得来自广泛范围的基因定义的细菌的培养物的实时综合翻译谱。
[0010]
因此,本发明的第一方面涉及一种用于通过检测来自生物样品中的微生物的耐药性基因的至少一种转录物来确定微生物对于药物的耐药性的方法,该方法包括以下步骤:
[0011]
(i)将该样品经受化学或机械细胞裂解方法,从而获得裂解物和细胞碎片;
[0012]
(ii)使用特异性地结合微生物-核糖体蛋白的抗体或其片段从该裂解物获得核糖体-抗体复合物;
[0013]
(iii)通过核酸提取方法纯化与该核糖体-抗体复合物缔和的mrna;以及
[0014]
(iv)将所得的mrna经受特异性基因检测方法,从而鉴定该生物样品的该至少一种耐药性基因转录物。
[0015]
如本领域中技术人员所理解的,该生物样品可以是怀疑包含抗生素耐药性微生物的生物来源的任何样品,诸如临床样品、环境样品、农业样品、动物样品或食物样品。
[0016]
本发明的另一方面涉及试剂盒用于检测来自生物样品中的微生物的耐药性基因的至少一种转录物的用途,该试剂盒包括:(i)特异性地结合微生物-核糖体蛋白的抗体或其片段;以及(ii)用于分离该核糖体-抗体复合物的手段。
[0017]
本文提供的工作实例证明了该方法的优点。简而言之,本文的工作实例尤其证明了以下问题:
[0018]
实例1和图1证明了本发明的方法能够选择性的检测用赋予分别对于抗生素氨苄西林(ampr阳性)或卡那霉素(kanr阳性)的耐药性的质粒转化的大肠杆菌细菌培养物的抗生素耐药性。使用本发明的方法和针对细菌核糖体亚基的抗体,可以特异性地鉴定转化的大肠杆菌培养物中的富集的抗生素耐药性基因。
[0019]
实例2和图2证明了该方法允许在不同的抗生素耐药性基因的存在下区分活性相对于非活性翻译基因的增加。用含有针对两种抗生素(氨苄西林和新霉素)的耐药性盒的质粒转化大肠杆菌培养物,同时仅对氨苄西林施加选择性压力。因此,使用该方法,可以检测ampr基因的表达的选择性增加(尤其是在指数增长期间),同时基本上不影响neor,从而突出了该方法提供对于转录活性基因的更高检测范围的能力。
[0020]
进一步地,实例3和图3示出了该方法不仅能够在具有单一细菌物种的样品中,也可以在混合培养物中监测抗生素诱导的动态表达变化,从而模拟真实的临床样品。
[0021]
因此,证明了完全组装的细菌核糖体的选择性免疫沉淀和核糖体缔和的转录物的分离可用作在广泛范围的基因定义的细菌培养物中评估amr的快速且动态的方法。
[0022]
本文证明了在耐药性群体中高度表达、从而呈递更高的rna量的amr相关基因的直接检测可以有效地用于以简单且直接的方式确定amr。因此,作为一个有利的点,该方法提
供了与基于dna的方法相比增加的敏感性,因为如上所解释的,这些其他方法不能区分活细胞和非活细胞。此外,dna水平提供细胞的代谢或生理状态的较差表示,这将阻碍紧密监测细菌对于抗生素治疗的应答。
[0023]
本发明的方法能够以快速且准确的方式评定耐药性基因的表达模式的变化。rna水平是细菌代谢状态的密切相关物,在指数生长期中具有40倍rna:dna比率。rna丰度增加使得测试敏感性增加,并且同时,rna的易变性和降解速率增加降低在非活细胞中检测rna的概率。
[0024]
作为另一个有利点,样品的下游应用(诸如杂交或qrt-pcr)非常简单,从而避免了测序所需的冗长样品处理。在这一方面,本发明的方法可以与当前可用的基于rna-芯片的方法结合,从而允许在20分钟内快速检测转录物,前提是存在足够的起始材料。
[0025]
此外,鉴于整个程序可以在仅几小时内进行的事实,该方法提供快速回答,与其他方法诸如细菌培养形成鲜明对比。该快速处理对于疾病进展和细菌对于治疗的应答的更动态监测,从而实现(几乎)实时监测。
[0026]
有利地,不需要在应用该方法之前知道样品中所含的细菌物种。本发明的方法能够确定样品的抗生素耐药性,无论样品中所含的细菌或细菌的混合物如何,从而与其他方法相比更快并且直接针对问题。如之前所述,其他方法需要先前培养样品和鉴定导致感染的病原体,这是非常耗时的并且不提供amr的信息。
[0027]
根据本发明的方法能够在不培养病原体和不扩增的情况下由样品直接快速鉴定抗生素耐药性。此外,使用该方法,可以容易地检测或排除针对所选抗生素的耐药性的存在。这些测定被设计来减少处理和周转时间以能够进行筛选程序,诸如针对例如mrsa和/或orsa筛选所有的进入患者。
[0028]
通过快速检测临床样品中的微生物的抗生素耐药性谱,可以在早期感染阶段开始特定疗法。快速鉴定和表征抗生素耐药性可以进行患者的早期隔离,从而使得减少感染中的抗生素耐药性。此外,快速检测患者样品中的抗生素耐药性可以使得选择怀疑在该患者中具有活性的特定抗生素,从而导致减少昂贵的广谱抗生素的使用。
[0029]
不受理论的约束,据信这是首次获得直接针对来自混合细菌培养物的抗生素抗耐药性基因且不预鉴定导致amr的细菌的综合和实时翻译谱。必须克服一些困难。首先,单链rna分子诸如mrna比dna显著更不稳定且易变。第二,细菌mrna种类与其真核生物对应物不同,含有不同的调控序列和稳定化序列,从而阻碍直接应用基于真核生物的方法。进一步地,导致耐药性的基因可以是组成型基因或含在质粒中。此外,未表征细菌核糖体蛋白对于完整核糖体-mrna集合体中的抗体的可及性。
[0030]
因此,基于本领域的知识,技术人员不能预见本文所述的方法以如实例中所示的显著实验作用工作且克服以上提及的缺点的合理成功预期。
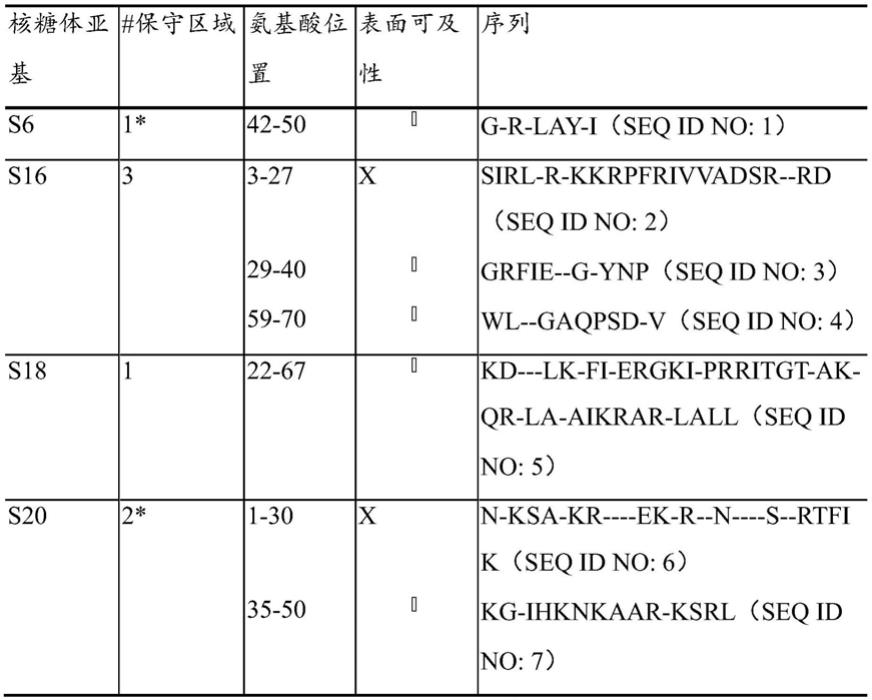
[0031]
贯穿本说明书和权利要求书,词语“包含/包括(comprise)”及其变形诸如“包含/包括(comprising)”并不旨在排除其他的技术特征、添加、组分、或步骤。当审查本说明书时,本发明的另外的目的、优点以及特征对本领域技术人员而言将变得显而易见,或可以通过本发明的实践来获悉。此外,本发明涵盖本文所述的具体以及优选实施例的所有可能的组合。本文出于说明性目的提供以下实例和附图,并且不旨在限制本发明。
附图说明
[0032]
图1:免疫沉淀之后特定转录物的检测。用氨苄西林和卡那霉素引物测试两种免疫沉淀物(x轴中的amp和kan)以鉴定抗生素耐药性基因的存在或不存在。x轴是治疗类型(氨苄西林-amp-或卡那霉素-kan-)并且y轴是归一化的log比率。使用两个技术重复和五个生物重复(标准误差平均值sem)进行实验。每个样品加载10ng rna。如果拷贝数(cn)低于最低标准,则认为样品低于检测的限值。*p<0.05。进一步的细节参见本文的工作实例1。
[0033]
图2:氨苄西林转化的大肠杆菌培养物中ampr表达的选择性增加。x轴是时间点(t),并且y轴是拷贝数(cn)。t1:0.5h,t2:2.5h。t3:3.5h。*p<0.05相对于新霉素。进一步的细节参见本文的工作实例2。
[0034]
图3:混合大肠杆菌培养物中基因表达的抗生素诱导的动态改变,*p<0.05相对于卡那霉素。x轴是在0h、2.5h、3.5h和24h处的时间点(t),并且y轴是拷贝数(cn%)。进一步的细节参见本文的工作实例3。
具体实施方式
[0035]
用于通过检测来自生物样品中的微生物的耐药性基因的至少一种转录物来确定微生物对于药物的耐药性的方法
[0036]“微生物”包括细菌、酵母、霉菌和真核生物寄生虫。在一个具体实施例中,微生物是细菌。细菌通常分类为革兰氏阳性细菌和革兰氏阴性细菌。革兰氏染色分类根据细菌的细胞壁组分将细菌分开。革兰氏染色几乎总是细菌生物的初步鉴定的第一步骤。虽然革兰氏染色在临床和研究环境两者中均是有价值的诊断工具,但是并不是所有的细菌都可以通过该技术明确地分类。这产生了革兰氏不定组和革兰氏未确定组。因此,在该环境中,术语细菌还包括革兰氏不定组和革兰氏未确定组。具体地,革兰氏阳性微生物选自由葡萄球菌属(staphylococcus)、肠球菌属(enterococcus)、链球菌属(streptococcus)和梭菌属(clostridium)组成的组。革兰氏阴性微生物可以选自肠杆菌科(enterobacteriaceae)。来自肠杆菌科的革兰氏阴性微生物可以选自大肠杆菌(escherichia coli)、克雷伯氏菌属物种(klebsiella spp.)、变形杆菌属物种(proteus spp.)、沙门氏菌属种(salmonella spp.)、肠杆菌属物种(enterobacter spp.)和粘质沙雷菌(serratia marcescens)。革兰氏阴性微生物还可以选自铜绿假单胞菌(pseudomonas aeruginosa)、不动杆菌属种(acinetobacter spp.)、伯克霍尔德氏菌种(burkholderia spp.)、寡养食单胞菌属(stenotrophomonas)和流感嗜血杆菌(haemophilusinfluenzae)。
[0037]
更具体地,微生物选自由以下组成的组:耐甲氧西林葡萄球菌、耐苯唑西林葡萄球菌、耐万古霉素葡萄球菌、耐万古霉素肠球菌、耐万古霉素梭菌和耐高水平氨基糖苷类肠球菌。
[0038]
甚至更具体地,微生物选自由以下组成的组:金黄色葡萄球菌(staphylococcus aureus)、耐甲氧西林金黄色葡萄球菌(mrsa)、耐苯唑西林金黄色葡萄球菌(orsa)、耐万古霉素金黄色葡萄球菌(vrsa)、耐万古霉素葡萄球菌(vrs)、耐万古霉素肠球菌(vre)、肺炎链球菌(streptococcus pneumoniae)、耐药物肺炎链球菌(drsp)和耐氨基糖苷类肠球菌(hlar)、耐万古霉素艰难梭菌(vrcd)。
[0039]
在一个具体实施例中,微生物是导致根据(美国疾病预防与控制中心(cdc))的最
紧急的临床威胁的微生物,即艰难梭菌(cdiff)、耐碳青霉烯的肠杆菌科(cre)和淋病奈瑟菌(neisseria gonorrhoeae)。
[0040]
在另一个具体实施例中,微生物是导致根据cdc的最严重的威胁的微生物,即耐多种药物的不动杆菌属、耐药弯曲杆菌属、广谱肠杆菌科(esbl)、耐多种药物的铜绿假单胞菌、耐药的非伤寒沙门氏菌、耐药伤寒血清型沙门氏菌、耐药志贺氏菌属、耐多种药物的结核病。
[0041]
在另一个具体实施例中,微生物属于肠杆菌属物种,例如阴沟肠杆菌(enterobacter cloacae)、鸡肠杆菌(enterobactergallinarum)和粪肠杆菌(enterobacterfaecalis),全部与通常医院来源的胃肠道和泌尿系统感染相关。
[0042]
术语“药物”在上下文中被理解为针对微生物起作用的任何药剂,其通常被称为抗微生物剂或抗生素。“抗微生物剂”是杀死微生物(细菌、真菌和其他病原体)的一般类别的化合物。术语“抗微生物剂”在本发明中具有本领域中的正常含义,即杀死微生物或抑制其生长的药剂。它们可以根据它们主要作用于,例如作用于细菌(抗细菌剂)和作用于真菌(抗真菌剂)的微生物来进一步分组。该术语还包括“防腐剂”,其主要用于阻止细菌生长。一般而言,它们用于在注射之前(例如在血液检验期间)清洁皮肤并且可以用于清理伤口。通常,防腐剂减弱并减慢细菌和其他微生物的生长,这进而帮助防止细菌导致进一步感染。防腐剂导致杀死细菌以及一些类型的真菌和寄生虫。防腐剂通常区别于抗生素,因为抗生素通常通过淋巴系统转运以破坏体内的细菌,并且区别于消毒剂,消毒剂破坏非活物体上存在的微生物。
[0043]
因此,在一个具体实施例中,该方法可用于确定微生物对于抗微生物剂的耐药性;并且更具体的,微生物对于抗生素的耐药性。因此,在一个具体实施例中,微生物是细菌,并且药物是抗生素,并且抗体或其片段特异性地结合细菌-核糖体蛋白。
[0044]
方法的步骤(i):将该样品经受化学或机械细胞裂解方法,从而获得裂解物和细胞碎片
[0045]
化学方法包括例如用裂解缓冲液温育样品。因此,在一个具体实施例中,用确保核糖体和rna完整性的裂解缓冲液温育样品。具体地,裂解缓冲液包含rna酶抑制剂以确保核糖体和rna完整性。这可以替代性地通过选择镁(例如,10mm)或肝素浓度(例如,高达100μg/ml)来实现。
[0046]
在一个具体实施例中,裂解缓冲液由100mm k+谷氨酸盐、20mm hepes-tris(ph 7.5)、0.1mm edta、6.1mmmgoac、14mm b-巯基乙醇、0.05%tween 20、10u/ml dna酶i、0.05mm cacl2、0.1mg/ml溶菌酶、rna酶抑制剂(10u/ul)构成。
[0047]
在一个具体实施例中,通过机械方法裂解样品。机械方法包括用例如钢或陶瓷或硅酸锆珠来对样品进行珠均质化。替代性机械方法是超声处理。在一个具体实施例中,在将样品经受机械方法之前,将稳定缓冲液添加到样品中。稳定缓冲液是确保核糖体和rna完整性的缓冲液。
[0048]
在一个具体实施例中,将样品经受化学裂解方法,接着经受机械方法。更具体地,用裂解缓冲液温育样品一段时间,并且通过基于机械珠的剪切进一步裂解。
[0049]
生物样品
[0050]
在一个具体实施例中,生物样品是人样品。在一个更具体的实施例中,人样品是任
何体液。具体地,人样品选自由血液、血浆、血清、唾液、尿液和脓肿组成的组。
[0051]
样品的预处理
[0052]
在一个具体实施例中,在步骤(i)之前,进行预处理初始生物样品的步骤,并且在初始样品是流体的情况下,该步骤包括浓缩样品。在一个具体实施例中,样品的浓缩通过离心进行。
[0053]
方法的步骤(ii):使用特异性地结合微生物-核糖体蛋白的抗体或其片段从该裂解物获得核糖体-抗体复合物
[0054]
在一个具体实施例中,获得核糖体-抗体复合物的步骤(ii)通过以下程序中的一个进行:
[0055]
(a)首先用抗体或其片段温育裂解物以获得核糖体-抗体复合物,并且随后通过亲和纯化方法分离核糖体-抗体复合物;
[0056]
(b)首先从裂解物分离核糖体,随后用抗体或其片段温育所得的核糖体制品以获得核糖体-抗体复合物,并且随后通过亲和纯化方法分离核糖体-抗体复合物;以及
[0057]
(c)首先用亲和纯化抗体或其片段的手段温育抗体或其片段,并且随后用抗体或其片段和亲和纯化抗体或其片段的手段的前述混合物温育裂解物。
[0058]
在一个更具体的实施例中,从裂解物获得核糖体-抗体复合物的步骤(ii)通过以下程序(a)进行,其中首先用抗体或其片段温育裂解物,以获得核糖体-抗体复合物,并且随后通过亲和纯化方法分离核糖体-抗体复合物。
[0059]
在一个具体实施例中,温育在4℃-37℃之间的温度下进行至少15分钟。更具体地,温育在4℃下通过旋转进行1小时。
[0060]
适当的亲和纯化方法包括例如磁免疫沉淀,基于蛋白质a、蛋白质g、琼脂糖凝胶、l-琼脂糖的免疫沉淀和基于亲和柱的纯化方法,其中抗体-核糖体复合物结合到亲和方法并且通过离心、磁手段或基于亲和力的包封来纯化。
[0061]
在一个具体实施例中,亲和纯化方法包括用涂覆有蛋白质a/g的磁珠温育样品。具体地,亲和纯化方法是通过以下进行的磁免疫沉淀:将磁珠添加到裂解物中并且在4℃-50℃之间的温度下温育至少15分钟,并且更具体地,裂解物在4℃的温度下在旋转情况下温育1小时。
[0062]
当使用步骤(b)时,首先从裂解物分离核糖体,并且随后用抗体或其片段温育所得的核糖体制品,以获得核糖体-抗体复合物。在该情况下,核糖体分离可以通过制备型方法进行,该制备型方法诸如超离心,其可以与基于蔗糖的垫或蔗糖梯度组合,以基于密度实现核糖体单体和聚合物的分离。此类方法不是亲和纯化方法。用抗体或其片段温育所得的核糖体制品,以获得核糖体-抗体复合物。随后,通过亲和纯化方法分离核糖体-抗体复合物。
[0063]
在一个具体实施例中,在步骤(i)与(ii)之间,进行分离从步骤(i)获得的裂解物的步骤,并且因此根据步骤(ii)处理所得的分离的裂解物。具体地,通过高速离心进行裂解物的分离。
[0064]
抗体或其片段
[0065]
在一个具体实施例中,抗体或其片段结合选自由以下组成的组的细菌核糖体亚基:l9、l16、l17、l19、l20、l21、l25、l27、l28、l31、l32、l33、l34、l35、l36、s1、s6、s16、s18、s20、s21、s22和s31。
[0066]
发明人通过生物信息组学确定发现了细菌中推定的保守核糖体序列,其可用于设计抗体或其片段。见实例4。因此,在一个更具体的实施例中,抗体或其片段结合选自由s6、s16、s18和s20组成的组的细菌核糖体亚基。在一个更具体的实施例中,抗体或其片段结合细菌核糖体亚基的具有选自由seq id no:1至7组成的组的表位。
[0067]
在一个更具体的实施例中,抗体或其片段结合细菌核糖体亚基s16,其距离mrna结合位点、trna和翻译因子足够远,并且具有良好的表面可及性。具体地,抗体或其片段结合具有选自由seq id no:2至4组成的组的,并且更具体地具有seq id no:3的序列的表位。
[0068]
抗体可以使用本领域熟知的方法来生成。此类抗体可以包括但不限于多克隆抗体、单克隆抗体和嵌合单链抗体。
[0069]
抗体片段可以使用本领域熟知的方法来生成。例如,此类抗体片段包括但不限于f(ab')2片段,其可以通过抗体分子的胃蛋白酶消化来产生;和fab片段,其可以通过还原f(ab')2片段的二硫桥来生成。替代性地,可以构建fab表达文库,以允许以所需的特异性快速且容易地鉴定单克隆fab片段。
[0070]
方法的步骤(iii):通过核酸提取方法纯化与该核糖体-抗体复合物缔和的mrna
[0071]
技术人员可以选择用于核酸提取的可用的方法和试剂盒。在提取之后,对rna进行定量,并且任选地例如使用变性甲醛凝胶,接着使用溴化乙锭染色来评定rna质量。
[0072]
方法的步骤(iv):将所得的mrna经受特异性基因检测方法,从而鉴定该生物样品的该至少一种耐药性基因转录物。
[0073]“特异性”基因检测方法是能够鉴定特定基因的方法。在一个具体实施例中,用于下游分析(步骤(iv))的特异性基因检测方法是基于扩增的方法、基于测序的方法或基于杂交的方法。
[0074]
在一个更具体的实施例中,特异性基因检测方法选自由以下组成的组:qrt-pcr、rna-rna杂交、rna-dna杂交和下一代核酸测序。更具体地,在临床/医院环境中,特异性基因检测方法是rna-dna杂交,其使用杂交至少一种耐药性基因转录物的核酸序列(探针)。
[0075]
下一代测序(ngs,还被称为高通量测序、大规模平行测序或深度测序)是用于描述多种不同的现代测序技术的总括性术语,这些测序技术包括illumina(solexa)测序、roche 454测序、ion torrent:proton/pgm测序和solid测序。这些最近的技术允许比先前使用的桑格测序(sanger sequencing)更快且便宜地对dna和rna进行测序,并且由此变革了基因组学和分子生物学的研究。
[0076]
在一个具体实施例中,在同一生物样品中检测到来自一种细菌或不同细菌的耐药性基因的多于一种转录物,特异性基因检测方法是基于杂交的方法,并且在同时杂交来自一个样品的不同耐药性基因转录物的多个核酸序列(探针)的情况下使用核酸-芯片。
[0077]
抗生素耐药性基因
[0078]
在一个具体实施例中,耐药性基因转录物选自由以下组成的组:氨苄西林耐药性基因、卡那霉素耐药性基因、新霉素耐药性基因、嘌呤霉素耐药性基因和氯霉素耐药性基因。
[0079]
具体地,抗生素选自由以下组成的组:氨基糖苷类、碳头孢烯、碳青霉烯、头孢菌素、糖肽、大环内酯、单环内酰胺、青霉素、β-内酰胺抗生素、喹诺酮、杆菌肽、磺胺药、四环素、链阳性菌素、氯霉素、克林霉素、噁唑烷酮、安沙霉素、糖肽、脂肽和林可酰胺
(lincosamide)。
[0080]
更具体地,抗生素选自β-内酰胺抗生素、大环内酯、林可酰胺和链阳性菌素。抗生素还可以选自β-内酰胺抗生素。具体地,抗生素可以选择青霉素。在本发明中,β-内酰胺抗生素具体地包括碳青霉烯、头孢菌素、单环内酰胺和青霉素。
[0081]
甚至更具体地,抗生素选自由以下组成的组:阿米卡星、庆大霉素、卡那霉素、新霉素、奈替米星、链霉素、妥布霉素、氯碳头孢、厄他培南、亚胺培南、西拉司丁、美罗培南、头孢羟氨苄、头孢唑林、头孢氨苄、头孢克洛、头孢孟多、头孢西丁、头孢丙烯、头孢呋辛、头孢克肟、头孢地尼、头孢妥仑(cefditoren)、头孢哌酮、头孢噻肟、头孢泊肟酯、头孢他啶、头孢布烯、头孢唑肟、头孢曲松、头孢磺啶、头孢吡肟、替考拉宁、万古霉素、阿奇霉素、克拉霉素、地红霉素、红霉素、罗红霉素、三乙酰竹桃霉素、氨曲南、阿莫西林、氨苄西林、阿洛西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、乙氧萘青霉素(nafcillin)、青霉素、哌拉西林、替卡西林、杆菌肽、黏菌素、多粘菌素b、环丙沙星、依诺沙星、加替沙星、左氧氟沙星、洛美沙星、莫西沙星、诺氟沙星、氧氟沙星、曲伐沙星、磺胺米隆、百浪多息、磺胺醋酰、磺胺甲噻二唑、磺胺(sulfanilimide)、柳氮磺胺吡啶、磺胺异噁唑、甲氧苄啶、磺胺甲氧苄啶(trimethoprim sulfa)、磺胺甲噁唑、复方新诺明(co-trimoxazole)、去甲金霉素、强力霉素、米诺环素、土霉素、四环素、氯霉素、克林霉素、乙胺丁醇、磷霉素、呋喃唑酮、异烟肼、利奈唑酮、甲硝唑、莫匹罗星、呋喃妥因、平板霉素、吡嗪酰胺、奎奴普丁/达福普汀、利福平、大观霉素、两性霉素b、氟康唑(flucanazole)、氟嘧啶、庆大霉素、甲氧西林、苯唑西林和克拉维酸。
[0082]
更具体地,抗生素选自万古霉素、甲氧西林、苯唑西林、克林霉素、甲氧苄啶、磺胺甲氧苄啶、庆大霉素和克拉维酸。
[0083]
进一步允许鉴定微生物的方法
[0084]
在一个具体实施例中,为了进一步确定微生物对于药物的耐药性,鉴定了生物样品中存在的一种或多种微生物。这通过以下进行:将来自步骤(iii)的相同的所得mrna经受特异性基因检测方法,从而鉴定这种微生物的独特基因、变体或序列。因此,微生物的鉴定可以使用相同的特异性基因检测方法,但是添加手段来特异性地鉴定这种微生物的独特基因、变体或序列来与步骤(iv)平行进行。例如,可以将针对这种微生物的独特基因、变体或序列的核酸序列(探针)添加到已经包括杂交耐药性基因转录物的核酸序列的芯片。
[0085]
用于检测来自生物样品中的细菌的耐药性基因的至少一种转录物的试剂盒
[0086]
如之前所述,本发明的另一方面涉及试剂盒用于使用以上所述的方法检测来自生物样品中的细菌的耐药性基因的至少一种转录物的用途,该试剂盒包括:(i)特异性地结合微生物-核糖体蛋白的抗体或其片段;以及(ii)用于分离核糖体-抗体复合物的手段。
[0087]
在另一方面,本发明涉及试剂盒用于遵循第一方面中所述的方法检测来自生物样品中的微生物的耐药性基因的至少一种转录物的用途,该试剂盒包括:(i)特异性地结合微生物-核糖体蛋白的抗体或其片段;以及(ii)用于分离核糖体-抗体复合物的手段。
[0088]
在另一方面,本发明涉及一种用于使用以上所述的方法检测来自生物样品中的细菌的耐药性基因的至少一种转录物的试剂盒,该试剂盒包括:(i)特异性地结合选自由s6、s16、s18和s20组成的组的,并且更具体地结合s16的细菌-核糖体蛋白亚基的抗体或其片段;以及(ii)用于分离核糖体-抗体复合物的手段。具体地,抗体或其片段结合具有选自由
seq id no:2至4组成的组的,并且更具体地具有seq id no:3的序列的表位。
[0089]
另外,试剂盒可以包括确保核糖体和rna完整性的裂解缓冲液和/或用于通过化学或机械方法裂解细胞的手段。
[0090]
使用核酸提取方法纯化与核糖体-抗体复合物缔和的mrna的步骤和通过特异性基因检测方法进行mrna的下游分析的步骤可以用可商购获得的试剂盒进行。然而,在一个具体实施例中,在本发明的试剂盒中额外提供用于纯化与核糖体-抗体复合物缔和的mrna的手段。在另一个具体实施例中,在本发明的试剂盒中额外提供用于特异性基因检测的手段。
[0091]
实例
[0092]
实例1:转化的细菌培养物中抗生素耐药性的选择性检测
[0093]
为了评定细菌核糖体缔和的转录物免疫沉淀的效率,使用用赋予分别对于抗生素氨苄西林(ampr阳性)或卡那霉素(kanr阳性)的耐药性的质粒转化的大肠杆菌培养物进行基因对照的设定。用氨苄西林和卡那霉素引物测试核糖体免疫沉淀物以鉴定抗生素耐药性基因的存在或不存在。使用两个技术重复和五个生物重复(标准误差平均值sem)进行实验。
[0094]
通过使用针对细菌核糖体亚基的抗体的核糖体免疫沉淀,可以通过qrt-pcr特异性地鉴定转化的大肠杆菌培养物中的富集的抗生素耐药性基因(参见图1)。
[0095]
实例2:氨苄西林转化的大肠杆菌培养物中ampr表达的选择性增加
[0096]
为了评定该方法是否允许区分活性相对于非活性翻译基因的增加,用含有针对两种抗生素(氨苄西林和新霉素)的耐药性盒的质粒转化大肠杆菌培养物,同时仅对氨苄西林施加选择性压力。
[0097]
使用该方法,可以检测ampr基因的表达的选择性增加(尤其是在指数增长期间),同时基本上不影响neor(参见图2),从而突出了该方法提供对于转录活性基因的更高检测范围的能力。
[0098]
实例3:混合培养物中抗生素诱导的动态表达变化的监测
[0099]
为了测试该方法确定选择性压力和转录状态的动态变化的能力,我们使用含有耐卡那霉素和耐氨苄西林的细胞两者的混合大肠杆菌培养物,并且将其经受不同的抗生素压力(氨苄西林,持续2.5h,并且然后转换至卡那霉素,持续多达24h)。ampr和kanr基因的后续qrt-pcr结果允许我们紧密监测这些amr基因在回收的免疫沉淀的转录物中的基因表达的相关联变化(参见图3),从而突出了该方法的诊断潜力。
[0100]
实例4:推定的保守核糖体序列的生物信息组学确定
[0101]
核糖体蛋白中的序列同源性是高度可变的。因此,我们决定对保守核糖体蛋白进行生物信息组学分析,以评定其作为抗体设计的靶标的合适性。首先,使用pdb结晶结构目测筛选亚基的抗体结合
[0102]
可及性。随后,使用gblocks来通过多重比对在不同细菌的范围内鉴定蛋白质序列的保守区段。该方法将s6、s16、s18和s20鉴定为高度保守且抗体可及的亚基。4个目的核糖体蛋白的多重比对鉴定了每个蛋白质的保守区域的位置和数量(参见表1)。
[0103]
表1:所选的细菌核糖体蛋白中的高度保守的氨基酸区域
[0104][0105]
*用于保守区段发现的较不严格的gblocks参数
[0106]
实例5:实例1-3中使用的方法
[0107]
细菌和生长条件
[0108]
将细菌在补充有氨苄西林(100μg/ml)或卡那霉素(50μg/ml)的液体肉汤中在37℃的温度下生长。
[0109]
核糖体缔和的转录物分离
[0110]
用特定缓冲液裂解细菌细胞以保留补充有rna酶抑制剂的核糖体-mrna复合物的完整性。裂解缓冲液由100mm k+谷氨酸盐、20mm hepes-tris(ph 7.5)、0.1mm edta、6.1mmmgoac、14mm b-巯基乙醇、0.05%tween 20、10u/ml dna酶i、0.05mm cacl2、0.1mg/ml溶菌酶、rna酶抑制剂(10u/ul)构成。将沉淀物在室温下重悬浮在100μl裂解缓冲液中,持续1分钟。将裂解缓冲液体积调整至700μl,并且通过基于机械珠的剪切进一步裂解细胞。
[0111]
通过免疫沉淀浓缩核糖体-mrna结合的复合物。核糖体-mrna复合物是相当稳定的并且保持完整,直至洗脱rna。在4℃下用针对原核生物核糖体亚基13大肠杆菌的一级单克隆抗体浓缩物(最终抗体浓度2.5μg/μl 193e11e5b11,dshb uiowa-来自爱荷华大学(university of iowa)的发育研究杂交瘤库(dshb))温育细菌裂解物1小时,同时进行摇动。
[0112]
接下来,用涂覆有蛋白质a/g的磁珠(20μl 88802,赛默科技公司(thermo scientific))温育裂解物,以优先结合抗体-核糖体复合物并且允许进行随后的洗涤步骤。用裂解物缓冲液(400μl,在没有还原剂的情况下制备)洗涤磁珠/抗体-核糖体复合物三次,以准备进行一级-二级抗体温育。将ag二级抗体添加到免疫沉淀物(ip)中,并且在4℃下温
acid ratios and growth in listeria monocytogenes"microbiology 147,2689-2696,(2001)
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1