微管溶素及蛋白质-微管溶素偶联物的制作方法
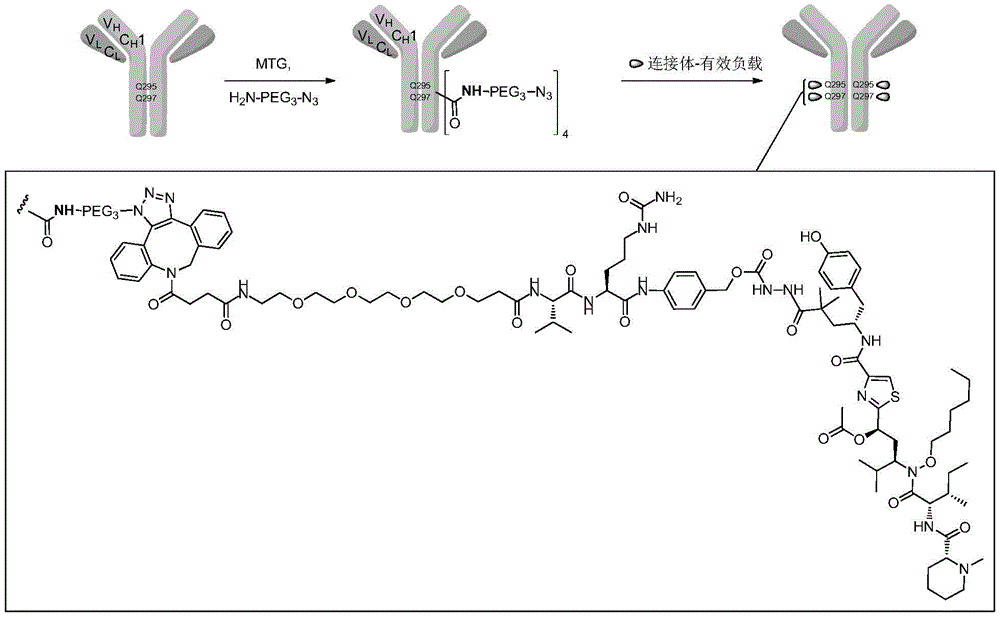
本发明提供了新颖的微管溶素(tubulysins)及其蛋白质偶联物,以及用于治疗多种疾病、病症和病况的方法,包括施用所述微管溶素及其蛋白质偶联物。发明背景虽然抗体-药物偶联物(ADC)在癌症治疗方案中的应用愈来愈多,但新生或治疗中出现的耐药机制可能会损害临床益处。在体外持续ADC暴露下出现的两种耐药机制均包括引起多药耐药性(MDR)的转运蛋白上调和同源抗原表达的丧失。绕过这些耐药性机制的新技术可有助于扩展下一代ADC的效用。微管溶素(tubulysins),首先是从粘细菌培养液中分离出来,是一组极有效的微管蛋白聚合抑制剂,其可迅速分解分裂细胞的细胞骨架并诱导细胞凋亡。微管溶素由N-甲基-D-哌啶酸(Mep)、L-异亮氨酸(Ile)和微管缬氨酸(tubuvaline,Tuv)组成,其中包含不寻常的N,O-缩醛和仲醇或乙酰氧基基团。微管溶素A、B、C、G和I包含C端微管酪氨酸(tubutyrosine,Tut)γ-氨基酸,而D、E、F和H在此位置具有微管苯丙氨酸(tubuphenylalanine,Tup)(Angew.Chem.Int.Ed.Engl.43,4888–4892)。由于微管溶素通过经验证的作用机制在耐药细胞中的强大活性,微管溶素已成为非常有前景的抗癌药物。平均细胞生长抑制活性优于众所周知的埃博霉素、长春碱和紫杉醇10倍至1000倍以上,包括对多药耐药性癌的活性(Biochem.J.2006,396,235-242;Nat.Prod.Rep.2015,32,654-662)。微管溶素对癌细胞(包括多药耐药性KB-V1宫颈癌细胞)具有极强的抗增殖活性。(Angew.Chem.Int.Ed.2004,43,4888-4892;andBiochemicalJournal2006,396,235-242)。发明摘要本发明提供了用于例如抗癌及抗血管生成治疗的化合物。在一个实施方案,本发明提供了具有式I所示结构的化合物:或其药学上可接受的盐,其中,R1是C1-C10烷基;R3是–C(O)C1-C5烷基、–C(O)N(H)C1-C10烷基、或–(C1-C10亚烷基)-NR3aR3b,其中R3a和R3b,在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代;R4和R5,在每种情况下,分别独立地为H或C1-C5烷基;R6是–OH或–NHNH2;R7在每种情况下,分别独立地为H、–OH、卤素、或–NR7aR7b,其中R7a和R7b,在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、酰基、和氨基酸残基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代;R8在每种情况下,分别独立地为H、D、–NHR9、或卤素,其中R9是H、–C1-C5烷基、或–C(O)C1-C5烷基;和m是1或2;Q是–CH2–或–O–,其中当Q是–O–,则R2是C1-C10烷基、C1-C10炔基、–C1-C10亚烷基-(5个原子组成的杂芳基)、–C1-C3亚烷基–Q1–(CH2)n芳基、或C1-C3羟烷基;或当Q是–CH2–,则R2是C5-C10烷基、C1-C10炔基、–C1-C10亚烷基-(5个原子组成的杂芳基)、–C1-C3亚烷基–Q1–(CH2)n芳基、或C1-C3羟烷基;和Q1是–CH2–或–O–;其中所述杂芳基未被取代或被烷基、氨基烷基、羟烷基、羧烷基、苄基、或苯基取代;其中所述芳基未被取代或被硝基或氨基取代;和其中n是从1至5的整数。在一个实施方案,本发明提供了具有式I所示结构的化合物:或其药学上可接受的盐,其中,R1是C1-C10烷基;R3是–C(O)C1-C5烷基、–C(O)N(H)C1-C10烷基、或–(C1-C10亚烷基)-NR3aR3b,其中R3a和R3b,在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代;R4和R5,在每种情况下,分别独立地为H或C1-C5烷基;或者,在某些实施方案,R4和R5同与之连接的所述碳原子一起形成3-8个原子组成的环烷基、取代的环烷基、杂环烷基、或取代的杂环烷基;R6是–OH或–NHNH2;或者,在某些实施方案,R6是-NHSO2R60,其中R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基;R7在每种情况下,分别独立地为H、–OH、卤素、或–NR7aR7b,其中R7a和R7b,在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代;R8在每种情况下,分别独立地为H、D、–NHR9、或卤素,其中R9是H、–C1-C5烷基、或–C(O)C1-C5烷基;和m是1或2;Q是–CH2–或–O–,其中当Q是–O–,则R2是C1-C10烷基、C1-C10炔基、–C1-C10亚烷基-(5个原子组成的杂芳基)、–C1-C3亚烷基–Q1–(CH2)n芳基、或C1-C3羟烷基;或当Q是–CH2–,则R2是C5-C10烷基、C1-C10炔基、–C1-C10亚烷基-(5个原子组成的杂芳基)、–C1-C3亚烷基–Q1–(CH2)n芳基、或C1-C3羟烷基;和Q1是–CH2–或–O–;其中所述杂芳基未被取代或被烷基、氨基烷基、羟烷基、羧烷基、苄基、或苯基取代;其中所述芳基未被取代或被硝基或氨基取代;和其中n是从1至5的整数。在另一实施方案,本发明提供了式A、B、C、或D所示化合物:或其药学上可接受的盐,其中,L是连接体;BA是结合剂;k是从1至30的整数;R1是C1-C10烷基;R3是–C(O)C1-C5烷基、–C(O)N(H)C1-C10烷基、或–(C1-C10亚烷基)-NR3aR3b,其中R3a和R3b,在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代;R4和R5,在每种情况下,分别独立地为H或C1-C5烷基;R6是–OH、–O–、–NHNH2、或–NHNH–;R7在每种情况下,分别独立地为H、–OH、–O–、卤素、或–NR7aR7b,其中R7a和R7b,在每种情况下,分别独立地为键、H、烷基、烯基、炔基、环烷基、芳基、杂芳基、酰基、和氨基酸残基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代;R8在每种情况下,分别独立地为H、D、–NHR9、或卤素,其中R9是H、–C1-C5烷基、或–C(O)C1-C5烷基;和m是1或2;Q是–CH2–或–O–,其中当Q是–O–,则R2是C1-C10烷基、C1-C10炔基、区域异构的C1-C10亚三唑基、–C1-C10亚烷基-(5个原子组成的杂芳基)、区域异构的–C1-C10亚烷基-(5个原子组成的亚杂芳基)、–C1-C3亚烷基–Q1–(CH2)n芳基、C1-C3羟烷基、或C1-C10烷基醚;或当Q是–CH2–,则R2是C5-C10烷基、C1-C10炔基、区域异构的C1-C10亚三唑基、–C1-C10亚烷基-(5个原子组成的杂芳基)、区域异构的–C1-C10亚烷基-(5个原子组成的亚杂芳基)、–C1-C3亚烷基–Q1–(CH2)n芳基、C1-C3羟烷基、或C1-C10烷基醚;和Q1是–CH2–或–O–;其中所述区域异构的亚三唑基未被取代或被烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基取代;其中所述杂芳基或区域异构的亚杂芳基未被取代或被烷基、氨基烷基、–亚烷基-NH–、羟烷基、–亚烷基–O–、羧烷基、–亚烷基-COO–、苄基、或苯基取代;其中所述芳基未被取代或被硝基、氨基、或–NH–取代;和其中n是从1至5的整数。在另一实施方案,本发明提供了式A、B、C、或D所示化合物:或其药学上可接受的盐,其中,L是连接体;BA是结合剂;k是从1至30的整数;R1是C1-C10烷基;R3是–C(O)C1-C5烷基、–C(O)N(H)C1-C10烷基、或–(C1-C10亚烷基)-NR3aR3b,其中R3a和R3b,在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代;R4和R5,在每种情况下,分别独立地为H或C1-C5烷基;R6是–OH、–O–、–NHNH2、或–NHNH–;或者,在某些实施方案,R6是-NHSO2R60,其中R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、取代的杂芳基、或者当与-L-连接时是二价的-亚烷基-、-亚烯基-、-亚炔基-、-亚环烷基-、-亚杂环烷基-、-亚芳基-、-亚杂芳基-、取代的-亚芳基-、或取代的-亚杂芳基-;R7在每种情况下,分别独立地为H、–OH、–O–、卤素、或–NR7aR7b,其中R7a和R7b,在每种情况下,分别独立地为键、H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代,或者当与-L-连接时是二价的-亚烷基-、-亚烯基-、-亚炔基-、-亚环烷基-、-亚芳基-、-亚杂芳基-、或-亚酰基-,其中-亚烷基-、-亚烯基-、-亚炔基-、-亚环烷基-、-亚芳基-、-亚杂芳基-和-亚酰基-均任选地被取代;R8在每种情况下,分别独立地为H、D、–NHR9、或卤素,其中R9是H、–C1-C5烷基、或–C(O)C1-C5烷基;和m是1或2;Q是–CH2–或–O–,其中当Q是–O–,则R2是C1-C10烷基、二价-C1-C10亚烷基-、C1-C10炔基、二价-C1-C10亚炔基-、区域异构的C1-C10烷基三唑基、区域异构的二价-C1-C10烷基亚三唑基-、–C1-C10亚烷基-(5个原子组成的杂芳基)、区域异构的二价–C1-C10亚烷基-(5个原子组成的亚杂芳基)、–C1-C3亚烷基–Q1–(CH2)n芳基、二价–C1-C3亚烷基–Q1–(CH2)n亚芳基-、C1-C3羟烷基、二价-C1-C3羟基亚烷基-、C1-C10烷基醚、或二价-C1-C10烷基醚-;或当Q是–CH2–,则R2是C5-C10烷基、二价-C5-C10亚烷基-、C1-C10炔基、二价-C1-C10亚炔基-、区域异构的C1-C10烷基三唑基、区域异构的二价-C1-C10烷基亚三唑基-、–C1-C10亚烷基-(5个原子组成的杂芳基)、区域异构的二价–C1-C10亚烷基-(5个原子组成的亚杂芳基)-、–C1-C3亚烷基–Q1–(CH2)n芳基、二价–C1-C3亚烷基–Q1–(CH2)n亚芳基-、C1-C3羟烷基、二价-C1-C3羟基亚烷基-、C1-C10烷基醚、或二价-C1-C10烷基醚-;和Q1是–CH2–或–O–;其中所述区域异构的亚三唑基未被取代或被烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基取代;其中所述杂芳基或区域异构的亚杂芳基未被取代或被烷基、氨基烷基、–亚烷基-NH–、羟烷基、–亚烷基–O–、羧烷基、–亚烷基-COO–、苄基、或苯基取代;其中所述芳基未被取代或被硝基、氨基、或–NH–取代;和其中n是从1至5的整数。在一个实施方案,本发明提供了式LPa、LPb、LPc、或LPd所示连接体-有效负载:或其药学上可接受的盐,其中,L是连接体;R1是C1-C10烷基;R3是–C(O)C1-C5烷基、–C(O)N(H)C1-C10烷基、或–(C1-C10亚烷基)-NR3aR3b,其中R3a和R3b,在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代;R4和R5,在每种情况下,分别独立地为H或C1-C5烷基;R6是–OH、–O–、–NHNH2、或–NHNH–;R7在每种情况下,分别独立地为H、–OH、–O–、卤素、或–NR7aR7b,其中R7a和R7b,在每种情况下,分别独立地为键、H、烷基、烯基、炔基、环烷基、芳基、杂芳基、酰基、和氨基酸残基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代;R8在每种情况下,分别独立地为H、D、–NHR9、或卤素,其中R9是H、–C1-C5烷基、或–C(O)C1-C5烷基;和m是1或2;Q是–CH2–或–O–,其中当Q是–O–,则R2是C1-C10烷基、C1-C10炔基、区域异构的C1-C10亚三唑基、–C1-C10亚烷基-(5个原子组成的杂芳基)、区域异构的–C1-C10亚烷基-(5个原子组成的亚杂芳基)、–C1-C3亚烷基–Q1–(CH2)n芳基、C1-C3羟烷基、或C1-C10烷基醚;或当Q是–CH2–,则R2是C5-C10烷基、C1-C10炔基、区域异构的C1-C10亚三唑基、–C1-C10亚烷基-(5个原子组成的杂芳基)、区域异构的–C1-C10亚烷基-(5个原子组成的亚杂芳基)、–C1-C3亚烷基–Q1–(CH2)n芳基、C1-C3羟烷基、或C1-C10烷基醚;和Q1是–CH2–或–O–;其中所述区域异构的亚三唑基未被取代或被烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基取代;其中所述杂芳基或区域异构的亚杂芳基未被取代或被烷基、氨基烷基、–亚烷基-NH–、羟烷基、–亚烷基–O–、羧烷基、–亚烷基-COO–、苄基、或苯基取代;其中所述芳基未被取代或被硝基、氨基、或–NH–取代;和其中n是从1至5的整数。在一个实施方案,本发明提供了式LPa、LPb、LPc、或LPd所示连接体-有效负载:或其药学上可接受的盐,其中,L是连接体;R1是C1-C10烷基;R3是–C(O)C1-C5烷基、–C(O)N(H)C1-C10烷基、或–(C1-C10亚烷基)-NR3aR3b,其中R3a和R3b,在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代;R4和R5,在每种情况下,分别独立地为H或C1-C5烷基;R6是–OH、–O–、–NHNH2、或–NHNH–;或者,在某些实施方案,R6是-NHSO2R60,其中R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、取代的杂芳基、或者当与–L–连接时是二价的-亚烷基-、-亚烯基-、-亚炔基-、-亚环烷基-、-亚杂环烷基-、-亚芳基-、-亚杂芳基-、取代的-亚芳基-、或取代的-亚杂芳基-;R7在每种情况下,分别独立地为H、–OH、–O–、卤素、或–NR7aR7b,其中R7a和R7b,在每种情况下,分别独立地为键、H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代,或者当与–L–连接时是二价的-亚烷基-、-亚烯基-、-亚炔基-、-亚环烷基-、-亚芳基-、-亚杂芳基-、或-亚酰基-,其中-亚烷基-、-亚烯基-、-亚炔基-、-亚环烷基-、-亚芳基-、-亚杂芳基-和-亚酰基-均任选地被取代;R8在每种情况下,分别独立地为H、D、–NHR9、或卤素,其中R9是H、–C1-C5烷基、或–C(O)C1-C5烷基;和m是1或2;Q是–CH2–或–O–,其中当Q是–O–,则R2是C1-C10烷基、二价-C1-C10亚烷基-、C1-C10炔基、二价-C1-C10亚炔基-、区域异构的C1-C10烷基三唑基、区域异构的二价-C1-C10烷基亚三唑基-、–C1-C10亚烷基-(5个原子组成的杂芳基)、区域异构的二价–C1-C10亚烷基-(5个原子组成的亚杂芳基)-、–C1-C3亚烷基–Q1–(CH2)n芳基、二价–C1-C3亚烷基–Q1–(CH2)n亚芳基-、C1-C3羟烷基、二价-C1-C3羟基亚烷基-、C1-C10烷基醚、或二价-C1-C10烷基醚-;或当Q是–CH2–,则R2是C5-C10烷基、二价-C5-C10亚烷基-、C1-C10炔基、二价-C1-C10亚炔基-、区域异构的C1-C10烷基三唑基、区域异构的二价-C1-C10烷基亚三唑基-、–C1-C10亚烷基-(5个原子组成的杂芳基)、区域异构的二价–C1-C10亚烷基-(5个原子组成的亚杂芳基)-、–C1-C3亚烷基–Q1–(CH2)n芳基、二价–C1-C3亚烷基–Q1–(CH2)n亚芳基-、C1-C3羟烷基、二价-C1-C3羟基亚烷基-、C1-C10烷基醚、或二价-C1-C10烷基醚-;和Q1是–CH2–或–O–;其中所述区域异构的亚三唑基未被取代或被烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基取代;其中所述杂芳基或区域异构的亚杂芳基未被取代或被烷基、氨基烷基、–亚烷基-NH–、羟烷基、–亚烷基–O–、羧烷基、–亚烷基-COO–、苄基、或苯基取代;其中所述芳基未被取代或被硝基、氨基、或–NH–取代;和其中n是从1至5的整数。在另一实施方案,本发明提供了包括抗体或其抗原结合片段的抗体-药物偶联物,其中所述抗体或其抗原结合片段偶联至如本发明所述的化合物。在另一实施方案,本发明提供了制备本发明所述化合物、连接体-有效负载或抗体-药物偶联合物、以及组合物的方法。附图简要说明图1-14示出了微管溶素有效负载、微管溶素连接体-有效负载及其蛋白质偶联物的合成化学方案。图15示出了抗STEAP2Ab-LP3、抗STEAP2Ab-LP4、对照Ab-LP3和对照Ab-LP4的尺寸排阻色谱。图16示出了抗STEAP2微管溶素ADC对携带CTG-2440前列腺癌PDX的NOG小鼠表现出显著抗肿瘤功效。图17示出了抗STEAP2微管溶素ADC对携带CTG-2441前列腺癌PDX的NOG小鼠表现出显著抗肿瘤功效。具体实施方式本发明提供了用于治疗例如受试者癌症的化合物、组合物和方法。定义当提及本发明提供的化合物时,除非另有说明,否则以下术语具有下列含义。除非另有定义,否则本发明使用的所有技术术语和科学术语均具有与本领域普通技术人员通常所理解的相同的含义。在本发明提供的术语存在多个定义的情况下,除非另有说明,否则以所述这些定义为准。本发明使用的“烷基”是指一价且饱和的烃基基团部分。烷基任选地被取代,且可以是直链、支链或环状的,即环烷基。烷基包括但不限于具有1-20个碳原子,即C1-20烷基;1-12个碳原子,即C1-12烷基;1-8个碳原子,即C1-8烷基;1-6个碳原子,即C1-6烷基;和1-3个碳原子,即C1-3烷基的那些基团。烷基基团部分的实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、异丁基、戊基基团部分、己基基团部分、环丙基、环丁基、环戊基和环己基。戊基基团部分包括但不限于正戊基和异戊基。己基基团部分包括但不限于正己基。本发明使用的“亚烷基”是指二价烷基基团。除非另有说明,否则亚烷基包括但不限于1-20个碳原子。亚烷基基团任选地被取代,如本发明对烷基所述。在一些实施方案,亚烷基是未取代的。在未指定其立体化学的情况下,氨基酸或氨基酸残基的名称旨在涵盖氨基酸的L形式、氨基酸的D形式或其外消旋混合物。本发明使用的“卤代烷基”是指如上所定义的烷基,其中所述烷基包括至少一个选自卤素例如氟(F)、氯(Cl)、溴(Br)或碘(I)的取代基。卤代烷基的实例包括但不限于,-CF3、-CH2CF3、–CCl2F和–CCl3。本发明使用的“烯基”是指包含至少两个碳原子和一个或多个非芳族碳-碳双键的一价烃基基团部分。烯基任选地被取代,且可以是直链、支链或环状的。烯基包括但不限于具有2-20个碳原子,即C2-20烯基;2-12个碳原子,即C2-12烯基;2-8个碳原子,即C2-8烯基;2-6个碳原子,即C2-6烯基;和2-4个碳原子,即C2-4烯基的那些基团。烯基基团部分的实例包括但不限于乙烯基、丙烯基、丁烯基和环己烯基。本发明使用的“炔基”是指包含至少两个碳原子和一个或多个碳-碳三键的一价烃基基团部分。炔基任选地被取代,且可以是直链、支链或环状的。炔基包括但不限于具有2-20个碳原子,即C2-20炔基;2-12个碳原子,即C2-12炔基;2-8个碳原子,即C2-8炔基;2-6个碳原子,即C2-6炔基;和2-4个碳原子,即C2-4炔基的那些基团。炔基基团部分的实例包括但不限于乙炔基、丙炔基和丁炔基。本发明使用的“烷氧基”是指一价且饱和的烃基基团部分,其中所述烃包括与氧原子连接的单键,和其中所述自由基位于氧原子上,例如乙氧基CH3CH2–O·。烷氧基取代基与它们通过所述烷氧基取代基的氧原子取代的化合物连接。烷氧基任选地被取代,且可以是直链、支链或环状的,即环烷氧基。烷氧基包括但不限于具有1-20个碳原子,即C1-20烷氧基;1-12个碳原子,即C1-12烷氧基;1-8个碳原子,即C1-8烷氧基;1-6个碳原子,即C1-6烷氧基;和1-3个碳原子,即C1-3烷氧基的那些。烷氧基基团部分的实例包括但不限于甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、仲丁氧基、叔丁氧基、异丁氧基、戊氧基基团部分、己氧基基团部分、环丙氧基、环丁氧基、环戊氧基和环己氧基。本发明使用的“卤代烷氧基”是指如上所定义的烷氧基,其中所述烷氧基包括至少一个选自卤素例如F、Cl、Br或I的取代基。本发明使用的“芳基”是指一价基团部分,其是芳族化合物的原子团,其中所述环原子均是碳原子。芳基任选地被取代,且可以是单环或多环的,例如双环或三环。芳基基团部分的实例包括但不限于具有6至20个环碳原子,即C6-20芳基;6至15个环碳原子,即C6-15芳基,和6至10个环碳原子,即C6-10芳基的那些。芳基基团部分的实例包括但不限于苯基、萘基、芴基、薁基、蒽基、菲基和芘基。本发明使用的“芳基烷基”或“芳烷基”是指烷基化合物原子团的一价基团部分,其中所述烷基化合物被芳香族取代基取代,即,所述芳香族化合物包括与烷基基团连接的单键,和其中所述自由基位于所述烷基基团上。芳基烷基基团通过所述烷基基团与所示的化学结构连接。芳基烷基可以由以下结构表示,例如,其中B是芳族基团部分,例如芳基或苯基。芳基烷基任选地被取代,即所述芳基基团和/或所述烷基基团,可以如本发明所述的那样被取代。芳基烷基的实例包括但不限于苄基。本发明使用的“烷基芳基”是指芳基化合物原子团的一价基团部分,其中所述芳基化合物被烷基取代基取代,即,所述芳基化合物包括与烷基基团连接的单键,其中所述自由基位于所述芳基基团上。烷基芳基基团通过所述芳基基团与所示的化学结构连接。烷基芳基可以由以下结构表示,例如,其中B是芳族基团部分,例如苯基。烷基芳基任选地被取代,即所述芳基基团和/或所述烷基基团,可以如本发明所述的那样被取代。烷基芳基的实例包括但不限于甲苯甲酰基。本发明使用的“芳氧基/芳基氧基”是指芳族化合物原子团的一价基团部分,其中所述环原子均为碳原子,和其中所述环被氧基取代,即所述芳族化合物包括与氧原子连接的单键,和其中所述自由基位于氧原子上,例如苯氧基芳氧基取代基与它们通过此氧原子取代的化合物连接。芳氧基任选地被取代。芳氧基包括但不限于具有6至20个环碳原子,即C6-20芳氧基;6至15个环碳原子,即C6-15芳氧基,和6至10个环碳原子,即C6-10芳氧基的那些基团。芳氧基基团部分的实例包括但不限于苯氧基、萘氧基和蒽氧基。本发明使用的“亚芳基”是指芳族化合物的二价基团部分,其中所述环原子仅为碳原子。亚芳基任选地被取代,且可以是单环或多环的,例如双环或三环。亚芳基基团部分的实例包括但不限于具有6至20个环碳原子,即C6-20亚芳基;6至15个环碳原子,即C6-15亚芳基;和6至10个环碳原子,即C6-10亚芳基的那些。本发明使用的“杂烷基”是指其中一个或多个碳原子被杂原子替换的烷基。本发明使用的“杂烯基”是指其中一个或多个碳原子被杂原子替换的烯基。本发明使用的“杂炔基”是指其中一个或多个碳原子被杂原子替换的炔基。合适的杂原子包括但不限于氮、氧和硫原子。杂烷基、杂烯基和杂炔基均任选地被取代。杂烷基基团部分的实例包括但不限于氨基烷基、磺酰基烷基、亚磺酰基烷基。杂烷基基团部分的实例还包括但不限于甲氨基、甲磺酰基和甲基亚磺酰基。本发明使用的“杂芳基”是指芳族化合物原子团的一价基团部分,其中所述环原子包含碳原子和至少一个氧、硫、氮或磷原子。杂芳基基团部分的实例包括但不限于具有5至20个环原子,5至15个环原子,和5至10个环原子的那些。杂芳基任选地被取代。本发明使用的“亚杂芳基”是指其中所述芳环的一个或多个环原子被氧、硫、氮或磷原子替换的二价杂芳基。亚杂芳基任选地被取代。“杂环烷基”是指其中一个或多个碳原子被杂原子替换的环烷基。合适的杂原子包括但不限于氮、氧和硫原子。杂环烷基任选地被取代。杂环烷基基团部分的实例包括但不限于吗啉基、哌啶基、四氢吡喃基、吡咯烷基、咪唑烷基、噁唑烷基、噻唑烷基、二氧杂环戊烷基、二硫杂环戊烷基、四氢吡喃基(oxanyl)或四氢噻喃基(thianyl)。本发明使用的“路易斯酸”是指接受孤对电子的分子或离子。本发明所述方法中使用的路易斯酸是质子以外的那些。路易斯酸包括但不限于非金属酸类,金属酸类,硬路易斯酸类和软路易斯酸类。路易斯酸包括但不限于铝、硼、铁、锡、钛、镁、铜、锑、磷、银、镱、钪、镍和锌的路易斯酸类。示例性路易斯酸包括但不限于:AlBr3,AlCl3,BCl3,三氯化硼甲基硫化物,BF3,三氟化硼甲基醚络合物,三氟化硼甲基硫化物,三氟化硼四氢呋喃,二环己基硼三氟甲烷磺酸盐,溴化铁(III),氯化铁(III),氯化锡(IV),氯化钛(IV),钛(IV)酸异丙酯,Cu(OTf)2,CuCl2,CuBr2,氯化锌,烷基铝卤化物类(RnAlX3-n,其中R是烃基),Zn(OTf)2,ZnCl2,Yb(OTf)3,Sc(OTf)3,MgBr2,NiCl2,Sn(OTf)2,Ni(OTf)2,和Mg(OTf)2。本发明使用的“含N的杂环烷基”是指其中一个或多个碳原子被杂原子替代、和其中至少一个杂原子是氮原子的环烷基。合适的杂原子除氮原子之外,还包括但不限于氧原子和硫原子。含N的杂环烷基任选地被取代。含N的杂环烷基基团部分的实例包括但不限于吗啉基、哌啶基、吡咯烷基、咪唑烷基、噁唑烷基、或噻唑烷基。本发明使用的“任选取代的”或“任选地被取代”,当用于描述基团部分,例如任选取代的烷基时,是指此基团部分任选地与一个或多个取代基连接。此类取代基的实例包括但不限于卤素,氰基,硝基,氨基,羟基,任选取代的卤代烷基,氨基烷基,羟烷基,叠氮基,环氧基,任选取代的杂芳基,任选取代的杂环烷基,其中RA、RB和RC在每次出现时,分别独立地为氢原子、烷基、烯基、炔基、芳基、烷基芳基、芳基烷基、杂烷基、杂芳基、或杂环烷基,或RA和RB同与它们连接的原子一起形成饱和或不饱和的碳环,其中所述环任选地被取代,和其中一个或多个环原子任选地被杂原子替代。在某些实施方案,当基团部分任选地被任选取代的杂芳基、任选取代的杂环烷基或任选取代的饱和或不饱和碳环取代时,所述任选取代的杂芳基、任选取代的杂环烷基或任选取代的饱和或不饱和碳环上的取代基,如果它们被取代,则不被进一步任选地被另外的取代基取代的取代基取代。在一些实施方案,当本发明所述的基团任选地被取代时,除非另有说明,与所述基团连接的取代基是未被取代的。本发明使用的“结合剂”是指能够与给定结合配偶体(例如抗原)特异性结合的任何分子,例如蛋白质、抗体、或其片段。本发明使用的“连接体”是指使所述结合剂与本发明所述的一个或多个化合物(例如,本发明所述的有效负载化合物和增强剂)共价连接的二价、三价、或多价基团部分。本发明使用的“酰胺合成条件”是指适于促进形成酰胺,譬如,通过羧酸、活化的羧酸、或酰卤与胺进行反应的反应条件。在一些实施例,“酰胺合成条件”是指适于在羧酸和胺之间促进形成酰胺键的反应条件。在所述这些实施例的一些中,所述羧酸首先在活化羧酸与胺反应形成酰胺之前转化为活化羧酸。实现酰胺形成的适宜条件包括,但不限于,利用试剂来实现羧酸与胺之间反应的那些,包括但不限于,二环己基碳二亚胺(DCC)、二异丙基碳二亚胺(DIC)、(苯并三氮唑-1-基氧基)三(二甲基氨基)磷鎓六氟磷酸盐(BOP)、(苯并三唑-1-基氧基)三吡咯烷基鏻六氟磷酸盐(PyBOP)、(7-偶氮苯并三氮唑-1-基氧基)三吡咯烷基鏻六氟磷酸盐(PyAOP)、三吡咯烷基溴化鏻六氟磷酸盐(PyBrOP)、O-(苯并三氮唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐(HBTU)、O-(苯并三氮唑-1-基)-N,N,N’,N’-四甲基脲六氟硼酸盐(TBTU)、1-[双(二甲氨基)亚甲基]-1H-1,2,3-三氮唑并[4,5-b]吡啶鎓3-氧化六氟磷酸盐(HATU)、2-乙氧基-1-乙氧羰基-1,2-二氢喹啉(EEDQ),1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDC)、2-氯-1,3-二甲基咪唑鎓六氟磷酸盐(CIP)、2-氯-4,6-二甲氧基-1,3,5-三嗪(CDMT)、和羰二咪唑(CDI)。在一些实施例,首先将羧酸转化为活化的羧酸酯,然后将活化的羧酸酯用胺处理形成酰胺键。在一些实施方案,将羧酸用试剂处理。所述试剂通过使羧酸去质子来活化羧酸,然后由于去质子化的羧酸亲核进攻到质子化试剂上,从而与去质子化的羧酸形成产物复合物。对于某些羧酸,相较羧酸转化成活化酯之前,所述活化羧酸酯更容易受到胺的亲核进攻。此举导致酰胺键形成。因此,所述羧酸被描述为活化的。示例性试剂包括DCC和DIC。本发明使用的“区域异构体”或“区域异构体的混合物”是指得自用合适的炔类化合物处理合适的叠氮化物(例如,-N3或PEG-N3衍生抗体)的1,3-环加成产物或应变促进的炔烃-叠氮化物环加成产物(SPAAC)(也称为点击反应)。在某些实施方案,例如,区域异构体和区域异构体的混合物的特征在于如下所示的点击反应产物:在某些实施方案,可在生成产物的合成方案中使用一种以上的合适的叠氮化物和一种以上的合适的炔烃,其中每对叠氮化物-炔烃可参与一个或多个独立的点击反应以生成区域异构的点击反应产物的混合物。例如,技术人员将认识到,第一合适的叠氮化物可独立地与第一合适的炔烃反应,第二合适的叠氮化物可在生成产物的途中独立地与第二合适的炔烃反应,从而生成四种可能的点击反应区域异构体或所述四种可能的点击反应区域异构体的混合物。本发明使用的术语“残基”是指化合物内化学反应后保留的化学基团部分。例如,术语“氨基酸残基”或“N-烷基氨基酸残基”是指氨基酸或N-烷基氨基酸与合适的偶联配偶体进行酰胺偶联或肽偶联的产物;其中,例如,在氨基酸或N-烷基氨基酸的酰胺偶联或肽偶联之后将水分子排出,从而得到氨基酸残基或N-烷基氨基酸残基掺入其中的产物。术语“氨基酸”是指天然存在及合成的α、β、γ或δ氨基酸,包括但不限于存在于蛋白质中的氨基酸,即甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、苯丙氨酸、色氨酸、脯氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸。在某些实施方案,所述氨基酸呈L-构型。或者,氨基酸可以是丙氨酰、缬氨酰、亮氨酰、异亮氨酰、脯氨酰、苯丙氨酰、色氨酰、蛋氨酰、甘氨酰、丝氨酰、苏氨酰、半胱氨酰、酪氨酰、天冬酰胺酰、谷氨酰胺酰、天冬氨酰、戊二酰、赖氨酰、精氨酰、组氨酰、β-丙氨酰、β-缬氨酰、β-亮氨酰、β-异亮氨酰、β-脯氨酰、β-苯丙氨酰、β-色氨酰、β-蛋氨酰、β-甘氨酰、β-丝氨酰、β-苏氨酰、β-半胱氨酰、β-酪氨酰、β-天冬酰胺酰、β-谷氨酰胺酰、β-天冬氨酰、β-戊二酰、β-赖氨酰、β-精氨酰、或β-组氨酰的衍生物。术语“氨基酸衍生物”是指可衍生自天然或非天然存在的氨基酸的基团,如本发明所述及所例示的。氨基酸衍生物对本领域技术人员而言是显而易见的,并且包括但不限于天然和非天然存在的氨基酸的酯、氨基醇、氨基醛、氨基内酯和N-甲基衍生物类。在某些实施方案,氨基酸残基是其中Sc是天然存在或非天然存在的氨基酸或键(例如,甘氨酸中的H;丝氨酸中的–CH2OH;半胱氨酸中的–CH2SH;赖氨酸中的–CH2CH2CH2CH2NH2;谷氨酸中的–CH2CH2COOH;谷氨酰胺中的–CH2CH2C(O)NH2;或酪氨酸中的–CH2C6H5OH;等等)的侧链;和表示与另一个化学实体的结合。在某些实施方案,Sc选自由H、烷基、杂烷基、芳基烷基和杂芳基烷基组成的组。本发明使用的“治疗有效量”是指足以在患者治疗或控制疾病或病症,或延迟或最小化与疾病或病症相关的一种或多种症状时,提供治疗益处的(化合物或有效负载的)量。本发明使用的“构造异构体(constitutionalisomer)”是指具有相同分子式但由于原子排列方式而产生不同化学结构的化合物。示例性构造异构体包括正丙基和异丙基;正丁基、仲丁基和叔丁基;以及正戊基、异戊基和新戊基等。某些基团、分子/基团部分、取代基、和原子被描述为具有与键相交的波浪线,以指示所述基团、分子/基团部分、取代基、原子通过其进行连接的原子。譬如,被丙基基团取代的苯基基团可表示为:具有下述结构:本发明使用的,通过环原子之间的键连接到环状基团(例如,芳环、杂芳环、稠环、和饱和或不饱和环烷基或杂环烷基)的取代基的例示说明意在表示,除非另有说明,环状基团可根据本发明所阐述的技术或即时公开的涉及本领域已知的技术,在环状基团的任何环位置或稠环基团的任何环上被取代基取代。譬如,所述基团其中下标q是从0至4的整数,和其中取代基R1的位置一般性地描述,即不直接连接至键合线结构的任何顶点,即特定的环碳原子,包括以下,其中取代基R1与特定环碳原子连接的基团的非限制性实例:本发明使用的短语“活性(反应性)连接体”或缩写“RL”是指包含活性(反应性)基团(“RG”)和间隔基团(“SP”)的一价基团,如所示,其中RG是所述活性基团,和SP是所述间隔基团。如本发明所述,活性(反应性)连接体可包含一个以上活性(反应性)基团和一个以上间隔基团。所述间隔基团是将活性(反应性)基团桥接至另一个基团(例如有效负载)的任何二价基团部分。所述活性连接体(RL)同与它们连接的有效负载一起,组成可用作制备本发明所述抗体偶联物的合成前体的中间体(“连接体-有效负载”或LP)。所述活性连接体包含活性基团,其是能够与另一基团(例如抗体、经修饰的抗体、或其抗原结合片段、或增强基团)的活性部分反应的官能团或基团部分。由所述活性基团与所述抗体、经修饰的抗体或其抗原结合片段反应产生的基团部分与所述连接基团一起,组成本发明所述的偶联物的“结合剂连接体”(“BL”)部分。在某些实施方案,所述“活性基团”是与抗体或其抗原结合片段的半胱氨酸或赖氨酸残基反应的官能团或基团部分(例如,马来酰亚胺或N-羟基琥珀酰亚胺(NHS)酯)。在某些实施方案,所述“活性基团”是能够进行点击化学反应(参见,例如clickchemistry,HuisgenProc.Chem.Soc.1961,Wangetal.J.Am.Chem.Soc.2003,和Agardetal.J.Am.Chem.Soc.2004)的官能团或基团部分。在所述点击化学反应的一些实施方案中,所述活性基团是能够与叠氮化物进行1,3-环加成反应的炔烃。此类合适的活性基团包括但不限于应变炔烃类,例如适用于应变促进的炔-叠氮化物环加成(SPAAC)的那些,环炔烃类,例如环辛炔类、苯并环化的炔烃类、和在没有铜催化剂的情况下能够与炔烃类化合物进行1,3-环加成反应的炔烃类。合适的炔烃类还包括但不限于二苯并氮杂环辛炔或二苯并环辛炔或二芳基氮杂环辛炔酮或二氟化环辛炔或取代的,例如氟化炔烃类,氮杂环炔烃类,二环[6.1.0]壬炔或(BCN,其中R是烷基、烷氧基、或酰基),和其衍生物类。特别有用的炔烃类包括包含此类活性基团的连接体-有效负载可用于偶联已用叠氮基官能化的抗体。此类官能化抗体包括用叠氮基-聚乙二醇基团官能化的抗体。在某些实施方案,此类官能化抗体通过在转谷氨酰胺酶的存在下,用带有氨基基团和叠氮基的化合物处理具有至少一个谷氨酰胺残基(例如重链Gln295)的抗体,从而衍生得到。在一些实施例,所述活性基团是炔烃,例如其可通过点击化学与叠氮化物(例如)反应,以形成点击化学产物,例如在一些实施例,所述基团与经修饰的抗体或其抗原结合片段上的叠氮化物反应。在一些实施例,所述活性基团是炔烃,例如其可通过点击化学与叠氮化物(例如)反应,以形成点击化学产物,例如在一些实施例,所述活性基团是炔烃,例如其可通过点击化学与叠氮化物(例如)反应,以形成点击化学产物,例如在一些实施例,所述活性基团是官能团,例如其与抗体或其抗原结合片段上的半胱氨酸残基反应,与其形成C-S键,例如其中Ab是指抗体或其抗原结合片段,S是指半胱氨酸残基上的S原子,所述官能团通过此半胱氨酸残基上的S原子与Ab结合。在一些实施例,所述活性基团是官能团,例如其与抗体或其抗原结合片段上的赖氨酸残基反应,与其形成酰胺键,例如其中Ab是指抗体或其抗原结合片段,NH是指赖氨酸侧链残基上的NH原子,所述官能团通过此赖氨酸侧链残基上的NH原子与Ab结合。本发明使用的短语“可生物降解的基团部分”是指在体内降解为无毒的、可生物相容的组分的基团部分,所述组分可通过普通生物过程从体内清除。在一些实施方案,可生物降解的基团部分在约90天或更短,约60天或更短,或约30天或更短的时间内在体内完全或基本上降解,其中降解的程度基于所述可生物降解基团部分的质量损失百分比,其中完全降解对应于100%质量损失。示例性可生物降解的基团部分包括但不限于脂族聚酯类,例如聚(ε-己内酯)(PCL),聚(3-羟基丁酸酯)(PHB),聚(乙醇酸)(PGA),聚(乳酸)(PLA)和其与乙醇酸的共聚物(即聚(D,L-丙交酯-共乙交酯)(PLGA)(VertM,SchwachG,EngelRandCoudaneJ(1998)JControlRelease53(1-3):85-92;JainRA(2000)Biomaterials21(23):2475-2490;UhrichKE,CannizzaroSM,LangerRSandShakesheffKM(1999)ChemicalReviews99(11):3181-3198;和ParkTG(1995)Biomaterials16(15):1123-1130,各文献均通过引用其全部内容并入本发明)。本发明使用的短语“结合剂连接体”、或“BL”是指使结合剂(例如,抗体或其抗原结合片段)与本发明所述的有效负载化合物(例如,微管溶素)、以及任选地与一个或多个侧链化合物连接、结合或键合的任何二价、三价、或多价基团或基团部分。通常,本发明所述的抗体偶联物的合适的结合剂连接体是足以稳定以利用抗体偶联物的循环半衰期,并且同时能够在抗原介导的偶联物内化后释放其有效负载的那些。连接体可以是可切割的或不可切割的。可切割的连接体是内化后由细胞内代谢进行切割的连接体,例如通过水解、还原或酶促反应进行切割。不可切割的连接体是通过内化后抗体的溶酶体降解来释放附接的有效负载的连接体。合适的连接体包括但不限于酸不稳定连接体,水解不稳定连接体,酶促可切割连接体,还原不稳定连接体,自降解(self-immolative)连接体和不可切割连接体。合适的连接体还包括但不限于,是或包含肽类,葡糖苷酸类,琥珀酰亚胺-硫醚类,聚乙二醇(PEG)单元类,腙类,马来酰亚胺(mal)-己酰单元类,二肽单元类,缬氨酸-瓜氨酸单元类,和对氨基苄氧基羰基(PABC)单元类、对氨基苄基(PAB)单元类的那些。在一些实施方案,所述结合剂连接体(BL)包含通过活性连接体(RL)的活性基团(RG)与结合剂(例如,抗体、经修饰的抗体、或其抗原结合片段)的活性部分进行反应形成的基团部分。在一些实施例,所述BL包含以下基团部分:其中是与所述结合剂连接的键。在一些实施例,所述BL包含以下基团部分:其中是与所述结合剂连接的键。在一些实施例,所述BL包含以下基团部分:其中是与所述结合剂连接的键。在一些实施例,所述BL包含以下基团部分:其中是与所述抗体或其抗原结合片段的所述半胱氨酸连接的键。在一些实施例,所述BL包含以下基团部分:其中是与所述抗体或其抗原结合片段的所述赖氨酸连接的键。当应用于多肽时,短语“基本相似性”或“基本相似”是指两个肽序列在最佳比对时,例如通过程序GAP或BESTFIT,使用默认空位权重,共享至少95%序列同一性,甚至更优选至少98%或99%序列同一性。亦可使用Altschuletal.J.Mol.Biol.215:403-10中描述的BLAST算法(使用已发布的默认设置)来确定序列相似性,或登陆blast.ncbi.nlm.nih.gov/Blast.cgi获悉。优选地,不相同的残基位置因保守氨基酸置换而不同。“保守氨基酸置换”是其中一个氨基酸残基被另一个具有类似化学性质(例如,电荷或疏水性)的侧链(R基团)的氨基酸残基置换。一般而言,保守氨基酸置换基本上不会改变蛋白质的功能特性。在两个或多个氨基酸序列因保守置换而彼此不同的情况下,可上调序列同一性百分比或相似度以校正置换的保守性质。进行此种调整的方法是本领域技术人员公知的。参见,例如Pearson(1994)MethodsMol.Biol.24:307-331。具有类似化学性质的侧链的氨基酸组的实例包括(1)脂肪族侧链类:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;(2)羟基脂肪族侧链类:丝氨酸和苏氨酸;(3)含酰胺侧链类:天冬酰胺和谷氨酰胺;(4)芳族侧链类:苯丙氨酸、酪氨酸和色氨酸;(5)碱性侧链类:赖氨酸、精氨酸和组氨酸;(6)酸性侧链类:天冬氨酸和谷氨酸;和(7)含硫侧链类:半胱氨酸和蛋氨酸。优选的保守氨基酸置换基团是:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸、谷氨酸-天冬氨酸、和天冬酰胺-谷氨酰胺。或者,保守置换是于Gonnetetal.(1992)Science256:1443-1445中公开的PAM250对数似然矩阵中具有正值的任何变化。“适度保守”置换是在PAM250对数似然矩阵中具有非负值的任何变化。化合物或有效负载—Q是C本发明提供了化合物或有效负载。不受任何特定操作理论的束缚,所述化合物包括微管溶素或微管溶素衍生物。在某些实施方案,所述化合物可作为偶联物的一部分递送至细胞。在某些实施方案,所述化合物能够在靶标处或靶标(例如靶细胞)中实施微管溶素或微管溶素衍生物的任何活性。某些化合物可具有一种或多种附加活性。在某些实施方案,所述化合物能够调节叶酸受体、生长抑素受体和/或蛙皮素受体的活性。在某些实施方案,本发明提供了具有式I所示结构的化合物:或其药学上可接受的盐或前药,其中Q是–CH2–;R2是C5-C10烷基;R3是–C(O)C1-C5烷基;R4是H;R5是C1-C5烷基;和R7是卤素。在式I中,在某些实施方案,有用的R1基团包括甲基和乙基。在某些实施方案,有用的R1基团包括丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、及其构造异构体。在一个实施方案,R1是甲基。在一个实施方案,R1是乙基。在一个实施方案,R1是丙基、及其构造异构体。在一个实施方案,R1是丁基、及其构造异构体。在一个实施方案,R1是戊基、及其构造异构体。在一个实施方案,R1是己基、及其构造异构体。在一个实施方案,R1是庚基、及其构造异构体。在一个实施方案,R1是辛基、及其构造异构体。在一个实施方案,R1是壬基、及其构造异构体。在一个实施方案,R1是癸基、及其构造异构体。在式I中,在上述某些实施方案中,有用的R2基团包括正戊基、正己基、正庚基、正辛基、正壬基、和正癸基。在一个实施方案,R2是正戊基、或其构造异构体。在另一实施方案,R2是正己基、或其构造异构体。在另一实施方案,R2是正庚基、或其构造异构体。在另一实施方案,R2是正辛基、或其构造异构体。在另一实施方案,R2是正壬基、或其构造异构体。在另一实施方案,R2是正癸基、或其构造异构体。在一个实施方案,Q-R2是正己基。在上述式I的某些实施方案中,有用的R3基团包括–C(O)Me、–C(O)Et、–C(O)丙基、–C(O)丁基、和–C(O)戊基。在一个实施方案,R3是–C(O)Me。在另一实施方案,R3是–C(O)Et。在另一实施方案,R3是–C(O)丙基、及其构造异构体。在另一实施方案,R3是–C(O)丁基、及其构造异构体。在另一实施方案,R3是–C(O)戊基、及其构造异构体。在上述式I的某些实施方案中,有用的R5基团包括甲基、乙基、丙基、丁基、和戊基。在一个实施方案,R5是甲基。在另一实施方案,R5是乙基。在另一实施方案,R5是丙基、及其构造异构体。在另一实施方案,R5是丁基、及其构造异构体。在另一实施方案,R5是戊基、及其构造异构体。在上述式I的某些实施方案中,R6包括–OH或–NHNH2。在一个实施方案,R6是–OH。在另一实施方案,R6是–NHNH2。在式I中,在上述某些实施方案中,各R7分别独立地包括氟、氯、溴、和碘。在一个实施方案,R7是氟。在另一实施方案,R7是氯。在另一实施方案,R7是溴。在另一实施方案,R7是碘。在式I中,在上述某些实施方案中,R8包含H、D、–NHR9、或卤素。在上述式I的某些实施方案中,R9是H、–C1-C5烷基、或–C(O)C1-C5烷基。在上述式I的某些实施方案中,m是1或2。在一个实施方案,R8是H。在一个实施方案,R8是D。在某些实施方案,R8分别独立地包含氟、氯、溴、和碘。在一个实施方案,R8是氟。在另一实施方案,R8是氯。在另一实施方案,R8是溴。在另一实施方案,R8是碘。在一个实施方案,–NHR9是–NH2。在一个实施方案,–NHR9包括–NHMe、–NHEt、–NHCH2CH2CH3、–NHCH2CH2CH2CH3、和–NHCH2CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHMe。在一个实施方案,–NHR9是–NHEt。在一个实施方案,–NHR9是–NHCH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH2CH3。在一个实施方案,–NHR9包含–NHC(O)Me、–NHC(O)Et、–NHC(O)CH2CH2CH3、–NHC(O)CH2CH2CH2CH3、和–NHC(O)CH2CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)Me。在一个实施方案,–NHR9是–NHC(O)Et。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH2CH2CH3。在一个实施方案,m是1。在一个实施方案,m是2。在某些实施方案,本发明提供了具有式II所示结构的化合物:或其药学上可接受的盐或前药。在某些实施方案,R2、R3、R6和R7均如前述段落中所述。在某些实施方案,本发明提供了具有式I所示结构的化合物、或其药学上可接受的盐或前药,其中Q是–CH2–;R2是C5-C10烷基;R3是–C(O)C1-C5烷基;R4和R5均为甲基;R7是–OH、卤素、或–NH2;R8在每次出现时,分别独立地为H、D、–NHR9、或卤素,其中R9是H或–C1-C5烷基;和m是1或2。在某些实施方案,R1、R2、R3和Q-R2均如上述式I中所述。在上述式I的某些实施方案中,R7包括氟、氯、溴、和碘。在一个实施方案,R7是氟。在另一实施方案,R7是氯。在另一实施方案,R7是溴。在另一实施方案,R7是碘。在一个实施方案,R7是–OH。在一个实施方案,R7是–NH2。在一个实施方案,R8是H。在一个实施方案,R8是氘。在某些实施方案,R8分别独立地包括氟、氯、溴、和碘。在一个实施方案,R8是氟。在另一实施方案,R8是氯。在另一实施方案,R8是溴。在另一实施方案,R8是碘。在一个实施方案,R8是–NHR9。在一个实施方案,–NHR9是–NH2。在一个实施方案,–NHR9包含–NHMe、–NHEt、–NHCH2CH2CH3、–NHCH2CH2CH2CH3、和–NHCH2CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHMe。在一个实施方案,–NHR9是–NHEt。在一个实施方案,–NHR9是–NHCH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH2CH3。在一个实施方案,m是1。在一个实施方案,m是2。在某些实施方案,本发明提供了具有式III所示结构的化合物:或其药学上可接受的盐。在某些实施方案,Q、R2、R3、R7、R8、R9和Q-R2均如上述段落中所述。在某些实施方案,本发明提供了具有式I所示结构的化合物、或其药学上可接受的盐或前药,其中Q是–CH2–;R2是C1-C10炔基;和R6是–OH。在某些实施方案,R1、R3、R4、R5、R7和R8均如上所述。在式I的一个实施方案中,R2是–CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在某些实施方案,本发明提供了具有式IV所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R3、R4、R5、R7和R8均如上述段落中所述。在某些实施方案,本发明提供了具有式I所示结构的化合物、或其药学上可接受的盐或前药,其中Q是–CH2–;R2是区域异构的–C1-C10亚烷基-(5-个原子组成的杂芳基),其中所述杂芳基未被取代或被烷基、氨基烷基、羟烷基、羧烷基、苄基、或苯基取代;R3是–C(O)C1-C5烷基;R4和R5均为C1-C5烷基;R6是–OH;和R7是–NH2。在某些实施方案,R1、R8和R9均如上所述。在上述式I的某些实施方案中,有用的R2基团包括区域异构的–C1-C10亚烷基-(1,2,3-三唑类),其中所述区域异构的1,2,3-三唑类均未被取代或被烷基、氨基烷基、羟烷基、羧烷基、苄基、或苯基取代。在下述实施方案中,所述1,2,3-三唑类衍生自末端炔烃和叠氮化物之间的点击化学反应,产生区域异构产物,如本发明其他地方所述。在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在本段的任一个或多个实施方案中,Y是H、烷基、氨基烷基、羟烷基、羧烷基、苄基、或苯基。在一个实施方案,Y是H。在一个实施方案,Y是烷基。在一个实施方案,Y是氨基烷基。在一个实施方案,Y是羟烷基。在一个实施方案,Y是羧烷基。在一个实施方案,Y是苯基。在上述式I的某些实施方案中,有用的R3基团包括–C(O)Me、–C(O)Et、–C(O)丙基、–C(O)丁基、和–C(O)戊烷。在一个实施方案,R3是–C(O)Me。在另一实施方案,R3是–C(O)Et。在另一实施方案,R3是–C(O)丙基、及其构造异构体。在另一实施方案,R3是–C(O)丁基、及其构造异构体。在另一实施方案,R3是–C(O)戊基、及其构造异构体。在上述式I的某些实施方案中,有用的R4和R5基团分别独立地包括甲基、乙基、丙基及其构造异构体、丁基及其构造异构体、戊基及其构造异构体、和其组合。譬如,在一个实施方案,R4和R5均为Me。作为另一实例,在一个实施方案,R4和R5均为乙基。作为另一实例,R4是甲基,和R5是乙基。作为本段内实施方案的R4和R5的其他示例性组合或变异在本发明中亦被预期。在某些实施方案,本发明提供了具有式V所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R3、R4和R5均如前述段落中所述。在某些实施方案,本发明提供了具有式VI或式VII所示结构的化合物:其中R10是H、甲基、–CH2CH2NH2、–CH2CH2OH、–CH2COOH、–CH2CH2CH2COOH、苄基、或苯基;或其药学上可接受的盐。在一个实施方案,R10是H。在一个实施方案,R10是甲基。在一个实施方案,R10是–CH2CH2NH2。在一个实施方案,R10是–CH2CH2OH。在一个实施方案,R10是–CH2COOH。在一个实施方案,R10是–CH2CH2CH2COOH。在一个实施方案,R10是苄基。在一个实施方案,R10是苯基。在某些实施方案,本发明提供了具有式I、II、III、IV、V、VI、或VII任一所示结构的化合物,其可选自由下列组成的组:其区域异构体;或其药学上可接受的盐。在某些实施方案,本发明提供了具有式XIII所示结构的化合物:或其药学上可接受的盐或前药,其中Q是–CH2–;R2是C5-C10烷基;R3是–C(O)C1-C5烷基;R4是H或C1-C5烷基;R5是C1-C5烷基;或R4和R5同与之连接的所述碳原子一起形成3-8个原子组成的环烷基、取代的环烷基、杂环烷基、或取代的杂环烷基;和R7是卤素。在式XIII中,在某些实施方案,有用的R1基团包括甲基和乙基。在某些实施方案,有用的R1基团包括丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、及其构造异构体。在一个实施方案,R1是甲基。在一个实施方案,R1是乙基。在一个实施方案,R1是丙基、及其构造异构体。在一个实施方案,R1是丁基、及其构造异构体。在一个实施方案,R1是戊基、及其构造异构体。在一个实施方案,R1是己基、及其构造异构体。在一个实施方案,R1是庚基、及其构造异构体。在一个实施方案,R1是辛基、及其构造异构体。在一个实施方案,R1是壬基、及其构造异构体。在一个实施方案,R1是癸基、及其构造异构体。在式XIII中,在上述某些实施方案中,有用的R2基团包括正戊基、正己基、正庚基、正辛基、正壬基、和正癸基。在一个实施方案,R2是正戊基、或其构造异构体。在另一实施方案,R2是正己基、或其构造异构体。在另一实施方案,R2是正庚基、或其构造异构体。在另一实施方案,R2是正辛基、或其构造异构体。在另一实施方案,R2是正壬基、或其构造异构体。在另一实施方案,R2是正癸基、或其构造异构体。在一个实施方案,Q-R2是正己基。在上述式XIII的某些实施方案中,有用的R3基团包括–C(O)Me、–C(O)Et、–C(O)丙基、–C(O)丁基、和–C(O)戊基。在一个实施方案,R3是–C(O)Me。在另一实施方案,R3是–C(O)Et。在另一实施方案,R3是–C(O)丙基、及其构造异构体。在另一实施方案,R3是–C(O)丁基、及其构造异构体。在另一实施方案,R3是–C(O)戊基、及其构造异构体。在一个实施方案,R4是H。在上述式XIII的某些实施方案中,有用的R4基团包括甲基、乙基、丙基、丁基、和戊基。在一个实施方案,R4是甲基。在另一实施方案,R4是乙基。在另一实施方案,R4是丙基、及其构造异构体。在另一实施方案,R4是丁基、及其构造异构体。在另一实施方案,R4是戊基、及其构造异构体。在上述式XIII的某些实施方案中,有用的R5基团包括甲基、乙基、丙基、丁基、和戊基。在一个实施方案,R5是甲基。在另一实施方案,R5是乙基。在另一实施方案,R5是丙基、及其构造异构体。在另一实施方案,R5是丁基、及其构造异构体。在另一实施方案,R5是戊基、及其构造异构体。在一个实施方案,R4和R5均为甲基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环丙基或取代的环丙基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环丁基或取代的环丁基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环戊基或取代的环戊基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环己基或取代的环己基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环庚基或取代的环庚基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环辛基或取代的环辛基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环丙基,其中所述环丙基中的一个亚甲基碳被Z替代,其中Z是O、N、或S。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环丁基,其中所述环丁基中的一个亚甲基碳被Z替代,其中Z是O、N、或S。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环戊基,其中所述环戊基中的一个或多个亚甲基碳被Z替代,其中Z是O、N、或S。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环己基,其中所述环己基中的一个或多个亚甲基碳被Z替代,其中Z是O、N、或S。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环庚基,其中所述环庚基中的一个或多个亚甲基碳被Z替代,其中Z是O、N、或S。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环辛基,其中所述环辛基中的一个或多个亚甲基碳被Z替代,其中Z是O、N、或S。在上述式XIII的某些实施方案中,R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。合适的R60烷基基团包括本段中针对R1描述的那些,例如甲基、乙基等。合适的R60烯基、炔基、芳基和杂芳基均如本发明其他地方所述。合适的R60环烷基和杂环烷基包括针对R4和R5同与之连接的所述碳原子一起所描述的那些,如本段所述。在式XIII中,在上述某些实施方案中,各R7分别独立地包括氟、氯、溴和碘。在一个实施方案,R7是氟。在另一实施方案,R7是氯。在另一实施方案,R7是溴。在另一实施方案,R7是碘。在式XIII中,在上述某些实施方案中,R8包括H、D、–NHR9、或卤素。在上述式XIII的某些实施方案中,R9是H、–C1-C5烷基、或–C(O)C1-C5烷基。在上述式XIII的某些实施方案中,m是1或2。在一个实施方案,R8是H。在一个实施方案,R8是D。在某些实施方案,R8分别独立地包括氟、氯、溴和碘。在一个实施方案,R8是氟。在另一实施方案,R8是氯。在另一实施方案,R8是溴。在另一实施方案,R8是碘。在一个实施方案,–NHR9是–NH2。在一个实施方案,–NHR9包括–NHMe、–NHEt、–NHCH2CH2CH3、–NHCH2CH2CH2CH3、和–NHCH2CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHMe。在一个实施方案,–NHR9是–NHEt。在一个实施方案,–NHR9是–NHCH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH2CH3。在一个实施方案,–NHR9包括–NHC(O)Me、–NHC(O)Et、–NHC(O)CH2CH2CH3、–NHC(O)CH2CH2CH2CH3、和–NHC(O)CH2CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)Me。在一个实施方案,–NHR9是–NHC(O)Et。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH2CH2CH3。在一个实施方案,m是1。在一个实施方案,m是2。在某些实施方案,本发明提供了具有式XIV所示结构的化合物:或其药学上可接受的盐或前药。在某些实施方案,R2、R3、R7和R60均如前述段落中所述。在某些实施方案,本发明提供了具有式XIII所示结构的化合物,或其药学上可接受的盐或前药,其中Q是–CH2–;R2是C5-C10烷基;R3是–C(O)C1-C5烷基;R4和R5均为甲基;R7是–OH、卤素、或–NH2;R8在每次出现时,分别独立地为H、D、–NHR9、或卤素,其中R9是H或–C1-C5烷基;和m是1或2。在某些实施方案,R1、R2、R3和Q-R2均如上述式XIII中所述。在上述式XIII的某些实施方案中,R7包括氟、氯、溴和碘。在一个实施方案,R7是氟。在另一实施方案,R7是氯。在另一实施方案,R7是溴。在另一实施方案,R7是碘。在一个实施方案,R7是–OH。在一个实施方案,R7是–NH2。在一个实施方案,R8是H。在一个实施方案,R8是D。在某些实施方案,R8分别独立地包括氟、氯、溴和碘。在一个实施方案,R8是氟。在另一实施方案,R8是氯。在另一实施方案,R8是溴。在另一实施方案,R8是碘。在一个实施方案,R8是–NHR9。在一个实施方案,–NHR9是–NH2。在一个实施方案,–NHR9包括–NHMe、–NHEt、–NHCH2CH2CH3、–NHCH2CH2CH2CH3、和–NHCH2CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHMe。在一个实施方案,–NHR9是–NHEt。在一个实施方案,–NHR9是–NHCH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH2CH3。在上述式XIII的某些实施方案中,R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。合适的R60烷基基团包括式XIII上下文中针对R1描述的那些,例如甲基、乙基等。合适的R60烯基、炔基、芳基和杂芳基均如本发明其他地方所述。合适的R60环烷基和杂环烷基包括针对R4和R5同与之连接的所述碳原子一起所描述的那些,如式XIII上下文中所述。在一个实施方案,m是1。在一个实施方案,m是2。在某些实施方案,本发明提供了具有式XV所示结构的化合物:或其药学上可接受的盐或前药。在某些实施方案,Q、R2、R3、R7、R8、R9、Q-R2和R60均如前述段落中所述。在某些实施方案,本发明提供了具有式XIII所示结构的化合物,或其药学上可接受的盐或前药,其中Q是–CH2–;R2是C1-C10炔基;和R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。合适的R60烷基基团包括式XIII上下文中针对R1描述的那些,例如甲基、乙基等。合适的R60烯基、炔基、芳基和杂芳基均如本发明其他地方所述。合适的R60环烷基和杂环烷基包括针对R4和R5同与之连接的所述碳原子一起所描述的那些,如式XIII上下文中所述。在某些实施方案,R1、R3、R4、R5、R7和R8均如上所述。在式XIII的一个实施方案中,R2是–CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在某些实施方案,本发明提供了具有式XVI所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R3、R4、R5、R7、R8和R60均如前述段落中所述。在某些实施方案,本发明提供了具有式XIII所示结构的化合物,或其药学上可接受的盐或前药,其中Q是–CH2–;R2是区域异构的–C1-C10亚烷基-(5个原子组成的杂芳基),其中所述杂芳基未被取代或被烷基、氨基烷基、羟烷基、羧烷基、苄基、或苯基取代;R3是–C(O)C1-C5烷基;R4和R5均为C1-C5烷基;R7是–NH2;和R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。合适的R60烷基基团包括式XIII上下文中针对R1描述的那些,例如甲基、乙基等。合适的R60烯基、炔基、芳基和杂芳基均如本发明其他地方所述。合适的R60环烷基和杂环烷基包括对R4和R5同与之连接的所述碳原子一起所描述的那些,如式XIII上下文中所述。在某些实施方案,R1、R8和R9均如上所述。在上述式XIII的某些实施方案中,有用的R2基团包括区域异构的–C1-C10亚烷基-(1,2,3-三唑类),其中所述区域异构的1,2,3-三唑类均未被取代或被烷基、氨基烷基、羟烷基、羧烷基、苄基、或苯基取代。在下述实施方案中,所述1,2,3-三唑类衍生自末端炔烃和叠氮化物之间的点击化学反应,产生区域异构产物,如本发明其他地方所述。在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在一个实施方案,R2是在本段的任一个或多个实施方案中,Y是H、烷基、氨基烷基、羟烷基、羧烷基、苄基、或苯基。在一个实施方案,Y是H。在一个实施方案,Y是烷基。在一个实施方案,Y是氨基烷基。在一个实施方案,Y是羟烷基。在一个实施方案,Y是羧烷基。在一个实施方案,Y是苯基。在上述式XIII的某些实施方案中,有用的R3基团包括–C(O)Me、–C(O)Et、–C(O)丙基、–C(O)丁基、和–C(O)戊烷。在一个实施方案,R3是–C(O)Me。在另一实施方案,R3是–C(O)Et。在另一实施方案,R3是–C(O)丙基、及其构造异构体。在另一实施方案,R3是–C(O)丁基、及其构造异构体。在另一实施方案,R3是–C(O)戊基、及其构造异构体。在上述式XIII的某些实施方案中,有用的R4和R5基团分别独立地包括甲基、乙基、丙基及其构造异构体、丁基及其构造异构体、戊基及其构造异构体、和其组合。譬如,在一个实施方案,R4和R5均为甲基。作为另一实例,在一个实施方案,R4和R5均为乙基。作为另一实例,R4是甲基,和R5是乙基。作为本段内实施方案的R4和R5的其他示例性组合或变异在本发明中亦被预期。在某些实施方案,本发明提供了具有式XVII所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R3、R4、R5和R60均如前述段落中所述。在某些实施方案,本发明提供了具有式XVIII或式XIX所示结构的化合物:其中R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。合适的R60烷基基团包括式XIII上下文中针对R1描述的那些,例如甲基、乙基等。合适的R60烯基、炔基、芳基和杂芳基均如本发明其他地方所述。合适的R60环烷基和杂环烷基包括对R4和R5同与之连接的所述碳原子一起所描述的那些,如式XIII上下文中所述。在某些实施方案,R10是H、甲基、–CH2CH2NH2、–CH2CH2OH、–CH2COOH、–CH2CH2CH2COOH、苄基、或苯基;或其药学上可接受的盐。在一个实施方案,R10是H。在一个实施方案,R10是甲基。在一个实施方案,R10是–CH2CH2NH2。在一个实施方案,R10是–CH2CH2OH。在一个实施方案,R10是–CH2COOH。在一个实施方案,R10是–CH2CH2CH2COOH。在一个实施方案,R10是苄基。在一个实施方案,R10是苯基。在本章节的任一前述实施方案中,R7是–NR7aR7b,其中R7a和R7b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、酰基、和氨基酸残基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在某些实施方案,R7a是H,和R7b是氨基酸残基。化合物或有效负载—Q是O在某些实施方案,本发明提供了具有式I所示结构的化合物:或其药学上可接受的盐或前药,其中Q是–O–;R2是C1-C10烷基;和R7是–OH或–NH2。在式I中,在某些实施方案,有用的R1基团包括甲基和乙基。在某些实施方案,有用的R1基团包括丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、及其构造异构体。在一个实施方案,R1是甲基。在一个实施方案,R1是乙基。在一个实施方案,R1是丙基、及其构造异构体。在一个实施方案,R1是丁基、及其构造异构体。在一个实施方案,R1是戊基、及其构造异构体。在一个实施方案,R1是己基、及其构造异构体。在一个实施方案,R1是庚基、及其构造异构体。在一个实施方案,R1是辛基、及其构造异构体。在一个实施方案,R1是壬基、及其构造异构体。在一个实施方案,R1是癸基、及其构造异构体。在式I中,在上述某些实施方案中,有用的R2基团包括甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基、正辛基、正壬基、和正癸基。在一个实施方案,R2是甲基。在一个实施方案,R2是乙基。在一个实施方案,R2是正丙基、或其构造异构体。在一个实施方案,R2是正丁基、或其构造异构体。在一个实施方案,R2是正戊基、或其构造异构体。在另一实施方案,R2是正己基、或其构造异构体。在另一实施方案,R2是正庚基、或其构造异构体。在另一实施方案,R2是正辛基、或其构造异构体。在另一实施方案,R2是正壬基、或其构造异构体。在另一实施方案,R2是正癸基、或其构造异构体。在某些实施方案,R3是–C(O)C1-C5烷基、–C(O)N(H)C1-C10烷基、或–(C1-C10亚烷基)-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在式I的某些实施方案中,有用的R3基团包括–C(O)Me、–C(O)Et、–C(O)丙基、–C(O)丁基、和–C(O)戊基、及其构造异构体。在一个实施方案,R3是–C(O)Me。在另一实施方案,R3是–C(O)Et。在另一实施方案,R3是–C(O)丙基、及其构造异构体。在另一实施方案,R3是–C(O)丁基、及其构造异构体。在另一实施方案,R3是–C(O)戊基、及其构造异构体。在上述式I的某些实施方案中,有用的R3基团包括–C(O)N(H)Me、–C(O)N(H)Et、–C(O)N(H)丙基及其构造异构体、–C(O)N(H)丁基及其构造异构体、–C(O)N(H)戊基及其构造异构体、–C(O)N(H)己基及其构造异构体、–C(O)N(H)庚基及其构造异构体、–C(O)N(H)辛基及其构造异构体、–C(O)N(H)壬基及其构造异构体、–C(O)N(H)癸基及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)Me。在上述式I的一个实施方案中,R3是–C(O)N(H)Et。在上述式I的一个实施方案中,R3是–C(O)N(H)丙基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)丁基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)戊基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)己基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)庚基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)辛基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)壬基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)癸基、及其构造异构体。在上述式I的某些实施方案中,有用的R3基团包括–CH2-NR3aR3b、–CH2CH2-NR3aR3b、–CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b、和–CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的一个实施方案中,R3是–CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的一个实施方案中,R3是–CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的一个实施方案中,R3是–CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的一个实施方案中,R3是–CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的一个实施方案中,R3是–CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的一个实施方案中,R3是–CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的一个实施方案中,R3是–CH2CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的一个实施方案中,R3是–CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的一个实施方案中,R3是–CH2CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的一个实施方案中,R3是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式I的某些实施方案中,有用的R4基团包括H、甲基、乙基、丙基、丁基、和戊基,及其构造异构体。在一个实施方案,R4是H。在一个实施方案,R4是甲基。在另一实施方案,R4是乙基。在另一实施方案,R4是丙基、及其构造异构体。在另一实施方案,R4是丁基、及其构造异构体。在另一实施方案,R4是戊基、及其构造异构体。在上述式I的某些实施方案中,有用的R5基团包括H、甲基、乙基、丙基、丁基、和戊基,及其构造异构体。在一个实施方案,R5是H。在一个实施方案,R5是甲基。在另一实施方案,R5是乙基。在另一实施方案,R5是丙基、及其构造异构体。在另一实施方案,R5是丁基、及其构造异构体。在另一实施方案,R5是戊基、及其构造异构体。在某些实施方案,R4和R5同与之连接的所述碳原子一起形成3-8个原子组成的环烷基、取代的环烷基、杂环烷基、或取代的杂环烷基。作为本段内实施方案的R4和R5的其他示例性组合或变异在本发明中亦被预期。在上述式I的某些实施方案中,R6包括–OH或–NHNH2。在一个实施方案,R6是–OH。在另一实施方案,R6是–NHNH2。在某些实施方案,R6是–NHSO2R60,其中R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。在上述式I中,在一个实施方案,R7是–OH。在上述式I中,在一个实施方案,R7是–NH2。在式I中,在上述某些实施方案中,R8包含H、D、–NHR9、或卤素。在上述式I的某些实施方案中,R9是H、–C1-C5烷基、或–C(O)C1-C5烷基。在上述式I的某些实施方案中,m是1或2。在一个实施方案,R8是H。在一个实施方案,R8是D。在某些实施方案,R8分别独立地包含氟、氯、溴、和碘。在一个实施方案,R8是氟。在另一实施方案,R8是氯。在另一实施方案,R8是溴。在另一实施方案,R8是碘。在一个实施方案,–NHR9是–NH2。在一个实施方案,–NHR9包括–NHMe、–NHEt、–NHCH2CH2CH3、–NHCH2CH2CH2CH3、和–NHCH2CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHMe。在一个实施方案,–NHR9是–NHEt。在一个实施方案,–NHR9是–NHCH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH2CH3。在一个实施方案,–NHR9包含–NHC(O)Me、–NHC(O)Et、–NHC(O)CH2CH2CH3、–NHC(O)CH2CH2CH2CH3、和–NHC(O)CH2CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)Me。在一个实施方案,–NHR9是–NHC(O)Et。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH2CH2CH3。在一个实施方案,m是1。在一个实施方案,m是2。在某些实施方案,本发明提供了具有式VIII所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R3、R4、R5、R6和R7均如前述段落中所述。在式VIII的一个实施方案中,R3是–C(O)Me,和R2、R4、R5、R6和R7均如前述段落中所述。在式VIII的一个实施方案中,R3是–C(O)N(H)C1-C10烷基,和R2、R4、R5、R6和R7均如前述段落中所述。在某些实施方案,本发明提供了具有式I所示结构的化合物,或其药学上可接受的盐或前药,其中R3是–C(O)N(H)C1-C10烷基;R4是H;R5是C1-C5烷基;和R6与R7均为–OH。在某些实施方案,R2如上述式I中所述。在上述式I的某些实施方案中,有用的R3基团包括–C(O)N(H)Me、–C(O)N(H)Et、–C(O)N(H)丙基及其构造异构体、–C(O)N(H)丁基及其构造异构体、–C(O)N(H)戊基及其构造异构体、–C(O)N(H)己基及其构造异构体、–C(O)N(H)庚基及其构造异构体、–C(O)N(H)辛基及其构造异构体、–C(O)N(H)壬基及其构造异构体、–C(O)N(H)癸基及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)Me。在上述式I的一个实施方案中,R3是–C(O)N(H)Et。在上述式I的一个实施方案中,R3是–C(O)N(H)丙基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)丁基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)戊基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)己基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)庚基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)辛基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)壬基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)癸基、及其构造异构体。在一个实施方案,R5是甲基。在另一实施方案,R5是乙基。在另一实施方案,R5是丙基、及其构造异构体。在另一实施方案,R5是丁基、及其构造异构体。在另一实施方案,R5是戊基、及其构造异构体。在某些实施方案,本发明提供了具有式IX所示结构的化合物:其中R11是C1-C10烷基;或其药学上可接受的盐。在一个实施方案,R11是甲基。在一个实施方案,R11是乙基。在一个实施方案,R11是丙基、及其构造异构体。在一个实施方案,R11是丁基、及其构造异构体。在一个实施方案,R11是戊基、及其构造异构体。在一个实施方案,R11是己基、及其构造异构体。在一个实施方案,R11是庚基、及其构造异构体。在一个实施方案,R11是辛基、及其构造异构体。在一个实施方案,R11是壬基、及其构造异构体。在一个实施方案,R11是癸基、及其构造异构体。在某些实施方案,本发明提供了具有式I所示结构的化合物,或其药学上可接受的盐或前药,其中Q是–O–;R2是C1-C10炔基;R3是–C(O)C1-C5烷基;和R6是–OH。在某些实施方案,R1、R4、R5、R7和R8均如上述式I中所述。在式I的一个实施方案中,R2是–CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在一个实施方案,R3是–C(O)Me。在另一实施方案,R3是–C(O)Et。在另一实施方案,R3是–C(O)丙基、及其构造异构体。在另一实施方案,R3是–C(O)丁基、及其构造异构体。在另一实施方案,R3是–C(O)戊基、及其构造异构体。在某些实施方案,本发明提供了具有式X所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R3、R4、R5和R7均如前述段落中所述。在某些实施方案,本发明提供了具有式I所示结构的化合物,或其药学上可接受的盐或前药,其中Q是–O–;R2是C1-C10炔基;R3是–C(O)N(H)C1-C10烷基;和R6是–OH。在某些实施方案,R1、R4、R5、R7和R8均如上述式I中所述。在式I的一个实施方案中,R2是–CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式I的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在上述式I的一个实施方案中,R3是–C(O)N(H)Me。在上述式I的一个实施方案中,R3是–C(O)N(H)Et。在上述式I的一个实施方案中,R3是–C(O)N(H)丙基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)丁基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)戊基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)己基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)庚基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)辛基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)壬基、及其构造异构体。在上述式I的一个实施方案中,R3是–C(O)N(H)癸基、及其构造异构体。在某些实施方案,本发明提供了具有式XI所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R4、R5和R8均如前述段落中所述。在某些实施方案,本发明提供了具有式I所示结构的化合物,或其药学上可接受的盐或前药,其中Q是–O–;R2是C1-C3亚烷基–Q1–(CH2)n芳基;或C1-C3羟烷基;R3是–C(O)C1-C5烷基;R4是H;R5是C1-C5烷基;和R6与R7均为–OH。在某些实施方案,R1和R8均如上述式I中所述。在某些实施方案,R2是C1-C3亚烷基–Q1–(CH2)n芳基,和Q1是–CH2–。因此,在一个实施方案,R2是–CH2CH2(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2CH2(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2(CH2)np-氨基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2CH2CH2(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2(CH2)np-氨基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2CH2(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2CH2CH2CH2(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2CH2(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2CH2(CH2)np-氨基苯基,和n是1、2、3、4、或5。在某些实施方案,R2是C1-C3亚烷基–Q1–(CH2)n芳基,和Q1是–O–。因此,在一个实施方案,R2是–CH2O-(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2O-(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2O-(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2O-(CH2)np-氨基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2O-(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2CH2O-(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2O-(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2O-(CH2)np-氨基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2O-(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2CH2CH2O-(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2O-(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2O-(CH2)np-氨基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2OH。在一个实施方案,R2是–CH2CH2OH。在一个实施方案,R2是–CH2CH2CH2OH。在上述式I的某些实施方案中,有用的R3包含–C(O)Me、–C(O)Et、–C(O)丙基、–C(O)丁基、和–C(O)戊基、及其构造异构体。在一个实施方案,R3是–C(O)Me。在另一实施方案,R3是–C(O)Et。在另一实施方案,R3是–C(O)丙基、及其构造异构体。在另一实施方案,R3是–C(O)丁基、及其构造异构体。在另一实施方案,R3是–C(O)戊基、及其构造异构体。在上述式I的某些实施方案中,有用的R5基团包括甲基、乙基、丙基、丁基、和戊基,及其构造异构体。在一个实施方案,R5是甲基。在另一实施方案,R5是乙基。在另一实施方案,R5是丙基、及其构造异构体。在另一实施方案,R5是丁基、及其构造异构体。在另一实施方案,R5是戊基、及其构造异构体。在某些实施方案,本发明提供了具有式XII所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2和R3均如前述段落中所述。在式XII的一个实施方案中,R2是C1-C3亚烷基–O–(CH2)n芳基,如前述段落中所述。在式XII的一个实施方案中,R2是C1-C3羟烷基,如前述段落中所述。在某些实施方案,本发明提供了式I、VIII、IX、X、XI、或XII任一所示的化合物,其可选自由下列组成的组:其药学上可接受的盐。在某些实施方案,本发明提供了具有式XIII所示结构的化合物:或其药学上可接受的盐或前药,其中Q是–O–;R2是C1-C10烷基;和R7是–OH或–NH2。在式XIII中,在某些实施方案,有用的R1基团包括甲基和乙基。在某些实施方案,有用的R1基团包括丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、及其构造异构体。在一个实施方案,R1是甲基。在一个实施方案,R1是乙基。在一个实施方案,R1是丙基、及其构造异构体。在一个实施方案,R1是丁基、及其构造异构体。在一个实施方案,R1是戊基、及其构造异构体。在一个实施方案,R1是己基、及其构造异构体。在一个实施方案,R1是庚基、及其构造异构体。在一个实施方案,R1是辛基、及其构造异构体。在一个实施方案,R1是壬基、及其构造异构体。在一个实施方案,R1是癸基、及其构造异构体。在式XIII中,在上述某些实施方案中,有用的R2基团包括甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基、正辛基、正壬基、和正癸基。在一个实施方案,R2是甲基。在一个实施方案,R2是乙基。在一个实施方案,R2是正丙基、或其构造异构体。在一个实施方案,R2是正丁基、或其构造异构体。在一个实施方案,R2是正戊基、或其构造异构体。在另一实施方案,R2是正己基、或其构造异构体。在另一实施方案,R2是正庚基、或其构造异构体。在另一实施方案,R2是正辛基、或其构造异构体。在另一实施方案,R2是正壬基、或其构造异构体。在另一实施方案,R2是正癸基、或其构造异构体。在某些实施方案,R3是–C(O)C1-C5烷基、–C(O)N(H)C1-C10烷基、或–(C1-C10亚烷基)-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在式XIII的某些实施方案中,有用的R3基团包括–C(O)Me、–C(O)Et、–C(O)丙基、–C(O)丁基、和–C(O)戊基、及其构造异构体。在一个实施方案,R3是–C(O)Me。在另一实施方案,R3是–C(O)Et。在另一实施方案,R3是–C(O)丙基、及其构造异构体。在另一实施方案,R3是–C(O)丁基、及其构造异构体。在另一实施方案,R3是–C(O)戊基、及其构造异构体。在上述式I的某些实施方案中,有用的R3基团包括–C(O)N(H)Me、–C(O)N(H)Et、–C(O)N(H)丙基及其构造异构体、–C(O)N(H)丁基及其构造异构体、–C(O)N(H)戊基及其构造异构体、–C(O)N(H)己基及其构造异构体、–C(O)N(H)庚基及其构造异构体、–C(O)N(H)辛基及其构造异构体、–C(O)N(H)壬基及其构造异构体、–C(O)N(H)癸基及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)Me。在上述式XIII的一个实施方案中,R3是–C(O)N(H)Et。在上述式XIII的一个实施方案中,R3是–C(O)N(H)丙基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)丁基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)戊基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)己基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)庚基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)辛基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)壬基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)癸基、及其构造异构体。在上述式XIII的某些实施方案中,有用的R3基团包括–CH2-NR3aR3b、–CH2CH2-NR3aR3b、–CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b、–CH2CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b、和–CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的一个实施方案中,R3是–CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的一个实施方案中,R3是–CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的一个实施方案中,R3是–CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的一个实施方案中,R3是–CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的一个实施方案中,R3是–CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的一个实施方案中,R3是–CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的一个实施方案中,R3是–CH2CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的一个实施方案中,R3是–CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的一个实施方案中,R3是–CH2CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的一个实施方案中,R3是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2-NR3aR3b,其中R3a和R3b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、和酰基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在上述式XIII的某些实施方案中,有用的R4基团包括H、甲基、乙基、丙基、丁基、和戊基,及其构造异构体。在一个实施方案,R4是H。在一个实施方案,R4是甲基。在另一实施方案,R4是乙基。在另一实施方案,R4是丙基、及其构造异构体。在另一实施方案,R4是丁基、及其构造异构体。在另一实施方案,R4是戊基、及其构造异构体。在上述式XIII的某些实施方案中,有用的R5基团包括H、甲基、乙基、丙基、丁基、和戊基,及其构造异构体。在一个实施方案,R5是H。在一个实施方案,R5是甲基。在另一实施方案,R5是乙基。在另一实施方案,R5是丙基、及其构造异构体。在另一实施方案,R5是丁基、及其构造异构体。在另一实施方案,R5是戊基、及其构造异构体。在一个实施方案,R4和R5均为甲基。在某些实施方案,R4和R5同与之连接的所述碳原子一起形成3-8个原子组成的环烷基、取代的环烷基、杂环烷基、或取代的杂环烷基。作为本段内实施方案的R4和R5的其他示例性组合或变异在本发明中亦被预期。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环丙基或取代的环丙基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环丁基或取代的环丁基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环戊基或取代的环戊基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环己基或取代的环己基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环庚基或取代的环庚基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环辛基或取代的环辛基。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环丙基,其中所述环丙基中的一个亚甲基碳被Z替代,其中Z是O、N、或S。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环丁基,其中所述环丁基中的一个亚甲基碳被Z替代,其中Z是O、N、或S。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环戊基,其中所述环戊基中的一个或多个亚甲基碳被Z替代,其中Z是O、N、或S。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环己基,其中所述环己基中的一个或多个亚甲基碳被Z替代,其中Z是O、N、或S。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环庚基,其中所述环庚基中的一个或多个亚甲基碳被Z替代,其中Z是O、N、或S。在一个实施方案,R4和R5同与之连接的所述碳原子一起是环辛基,其中所述环辛基中的一个或多个亚甲基碳被Z替代,其中Z是O、N、或S。在上述式XIII的某些实施方案中,R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。合适的R60烷基基团包括本段中针对R1描述的那些,例如甲基、乙基等。合适的R60烯基、炔基、芳基和杂芳基均如本发明其他地方所述。合适的R60环烷基和杂环烷基包括对R4和R5同与之连接的所述碳原子一起所描述的那些,如本段所述。在上述式XIII中,在一个实施方案,R7是–OH。在上述式XIII中,在一个实施方案,R7是–NH2。在式XIII中,在上述某些实施方案中,R8包含H、D、–NHR9、或卤素。在上述式XIII的某些实施方案中,R9是H、–C1-C5烷基、或–C(O)C1-C5烷基。在上述式XIII的某些实施方案中,m是1或2。在一个实施方案,R8是H。在一个实施方案,R8是D。在某些实施方案,R8分别独立地包含氟、氯、溴、和碘。在一个实施方案,R8是氟。在另一实施方案,R8是氯。在另一实施方案,R8是溴。在另一实施方案,R8是碘。在一个实施方案,–NHR9是–NH2。在一个实施方案,–NHR9包括–NHMe、–NHEt、–NHCH2CH2CH3、–NHCH2CH2CH2CH3、和–NHCH2CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHMe。在一个实施方案,–NHR9是–NHEt。在一个实施方案,–NHR9是–NHCH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH3。在一个实施方案,–NHR9是–NHCH2CH2CH2CH2CH3。在一个实施方案,–NHR9包含–NHC(O)Me、–NHC(O)Et、–NHC(O)CH2CH2CH3、–NHC(O)CH2CH2CH2CH3、和–NHC(O)CH2CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)Me。在一个实施方案,–NHR9是–NHC(O)Et。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH2CH3。在一个实施方案,–NHR9是–NHC(O)CH2CH2CH2CH2CH3。在一个实施方案,m是1。在一个实施方案,m是2。在某些实施方案,本发明提供了具有式XX所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R3、R4、R5、R7和R60均如前述段落中所述。在式VIII的一个实施方案中,R3是–C(O)Me,和R2、R4、R5、R7和R60均如前述段落中所述。在式VIII的一个实施方案中,R3是–C(O)N(H)C1-C10烷基,和R2、R4、R5、R7和R60均如前述段落中所述。在某些实施方案,本发明提供了具有式XIII所示结构的化合物,或其药学上可接受的盐或前药,其中R3是–C(O)N(H)C1-C10烷基;R4是H或C1-C5烷基;R5是C1-C5烷基;R7是–OH;和R60如式XIII的上下文中所述。在某些实施方案,R2如上述式XIII的上下文中所述。在上述式XIII的某些实施方案中,有用的R3基团包括–C(O)N(H)Me、–C(O)N(H)Et、–C(O)N(H)丙基及其构造异构体、–C(O)N(H)丁基及其构造异构体、–C(O)N(H)戊基及其构造异构体、–C(O)N(H)己基及其构造异构体、–C(O)N(H)庚基及其构造异构体、–C(O)N(H)辛基及其构造异构体、–C(O)N(H)壬基及其构造异构体、–C(O)N(H)癸基及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)Me。在上述式XIII的一个实施方案中,R3是–C(O)N(H)Et。在上述式XIII的一个实施方案中,R3是–C(O)N(H)丙基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)丁基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)戊基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)己基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)庚基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)辛基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)壬基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)癸基、及其构造异构体。在一个实施方案,R4是H。在一个实施方案,R4是甲基。在另一实施方案,R4是乙基。在另一实施方案,R4是丙基、及其构造异构体。在另一实施方案,R4是丁基、及其构造异构体。在另一实施方案,R4是戊基、及其构造异构体。在一个实施方案,R5是甲基。在另一实施方案,R5是乙基。在另一实施方案,R5是丙基、及其构造异构体。在另一实施方案,R5是丁基、及其构造异构体。在另一实施方案,R5是戊基、及其构造异构体。在一个实施方案,R4和R5均为甲基。在某些实施方案,本发明提供了具有式XXI所示结构的化合物:其中R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。合适的R60烷基基团包括式XIII上下文中针对R1描述的那些,例如甲基、乙基等。合适的R60烯基、炔基、芳基和杂芳基均如本发明其他地方所述。合适的R60环烷基和杂环烷基包括对R4和R5同与之连接的所述碳原子一起所描述的那些,如式XIII上下文中所述。在某些实施方案,R11是C1-C10烷基;或其药学可接受的盐。在一个实施方案,R11是甲基。在一个实施方案,R11是乙基。在一个实施方案,R11是丙基、及其构造异构体。在一个实施方案,R11是丁基、及其构造异构体。在一个实施方案,R11是戊基、及其构造异构体。在一个实施方案,R11是己基、及其构造异构体。在一个实施方案,R11是庚基、及其构造异构体。在一个实施方案,R11是辛基、及其构造异构体。在一个实施方案,R11是壬基、及其构造异构体。在一个实施方案,R11是癸基、及其构造异构体。在某些实施方案,本发明提供了具有式XIII所示结构的化合物,或其药学可接受的盐或前药,其中Q是–O–;R2是C1-C10炔基;R3是–C(O)C1-C5烷基;和R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。合适的R60烷基基团包括式XIII上下文中针对R1描述的那些,例如甲基、乙基等。合适的R60烯基、炔基、芳基和杂芳基均如本发明其他地方所述。合适的R60环烷基和杂环烷基包括对R4和R5同与之连接的所述碳原子一起所描述的那些,如式XIII上下文中所述。在某些实施方案,R1、R4、R5、R7和R8均如上述式XIII中所述。在式XIII的一个实施方案中,R2是–CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在一个实施方案,R3是–C(O)Me。在另一实施方案,R3是–C(O)Et。在另一实施方案,R3是–C(O)丙基、及其构造异构体。在另一实施方案,R3是–C(O)丁基、及其构造异构体。在另一实施方案,R3是–C(O)戊基、及其构造异构体。在某些实施方案,本发明提供了具有式XXII所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R3、R4、R5、R7和R60均如前述段落中所述。在某些实施方案,本发明提供了具有式XIII所示结构的化合物,或其药学可接受的盐或前药,其中Q是–O–;R2是C1-C10炔基;R3是–C(O)N(H)C1-C10烷基;和R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。合适的R60烷基基团包括式XIII上下文中针对R1描述的那些,例如甲基、乙基等。合适的R60烯基、炔基、芳基和杂芳基均如本发明其他地方所述。合适的R60环烷基和杂环烷基包括对R4和R5同与之连接的所述碳原子一起所描述的那些,如式XIII上下文中所述。在某些实施方案,R1、R4、R5、R7和R8均如上述式XIII中所述。在式XIII的一个实施方案中,R2是–CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在式XIII的一个实施方案中,R2是–CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CCH。在上述式XIII的一个实施方案中,R3是–C(O)N(H)Me。在上述式XIII的一个实施方案中,R3是–C(O)N(H)Et。在上述式XIII的一个实施方案中,R3是–C(O)N(H)丙基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)丁基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)戊基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)己基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)庚基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)辛基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)壬基、及其构造异构体。在上述式XIII的一个实施方案中,R3是–C(O)N(H)癸基、及其构造异构体。在某些实施方案,本发明提供了具有式XXIII所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R4、R5、R8和R60均如前述段落中所述。在某些实施方案,本发明提供了具有式XIII所示结构的化合物,或其药学可接受的盐或前药,其中Q是–O–;R2是C1-C3亚烷基–Q1–(CH2)n芳基;或C1-C3羟烷基;R3是–C(O)C1-C5烷基;R4是H或C1-C5烷基;R5是C1-C5烷基;R7是–OH;和R60是烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂芳基、取代的芳基、或取代的杂芳基。合适的R60烷基基团包括式XIII上下文中针对R1描述的那些,例如甲基、乙基等。合适的R60烯基、炔基、芳基和杂芳基均如本发明其他地方所述。合适的R60环烷基和杂环烷基包括对R4和R5同与之连接的所述碳原子一起所描述的那些,如式XIII上下文中所述。在某些实施方案,R1和R8均如上述式XIII中所述。在某些实施方案,R2是C1-C3亚烷基–Q1–(CH2)n芳基,和Q1是–CH2–。因此,在一个实施方案,R2是–CH2CH2(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2CH2(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2(CH2)np-氨基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2CH2CH2(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2(CH2)np-氨基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2CH2(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2CH2CH2CH2(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2CH2(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2CH2(CH2)np-氨基苯基,和n是1、2、3、4、或5。在某些实施方案,R2是C1-C3亚烷基–Q1–(CH2)n芳基,和Q1是–O–。因此,在一个实施方案,R2是–CH2O-(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2O-(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2O-(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2O-(CH2)np-氨基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2O-(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2CH2O-(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2O-(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2O-(CH2)np-氨基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2O-(CH2)n芳基,其中芳基未被取代或被硝基或氨基取代,和n是从1至5的整数。在一个实施方案,R2是–CH2CH2CH2O-(CH2)n苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2O-(CH2)np-硝基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2CH2CH2O-(CH2)np-氨基苯基,和n是1、2、3、4、或5。在一个实施方案,R2是–CH2OH。在一个实施方案,R2是–CH2CH2OH。在一个实施方案,R2是–CH2CH2CH2OH。在上述式XIII的某些实施方案中,有用的R3基团包括–C(O)Me、–C(O)Et、–C(O)丙基、–C(O)丁基、和–C(O)戊基、及其构造异构体。在一个实施方案,R3是–C(O)Me。在另一实施方案,R3是–C(O)Et。在另一实施方案,R3是–C(O)丙基、及其构造异构体。在另一实施方案,R3是–C(O)丁基、及其构造异构体。在另一实施方案,R3是–C(O)戊基、及其构造异构体。在一个实施方案,R4是H。在上述式I的某些实施方案中,有用的R4基团包括甲基、乙基、丙基、丁基、和戊基,及其构造异构体。在一个实施方案,R4是甲基。在另一实施方案,R4是乙基。在另一实施方案,R4是丙基、及其构造异构体。在另一实施方案,R4是丁基、及其构造异构体。在另一实施方案,R4是戊基、及其构造异构体。在上述式I的某些实施方案中,有用的R5基团包括甲基、乙基、丙基、丁基、和戊基,及其构造异构体。在一个实施方案,R5是甲基。在另一实施方案,R5是乙基。在另一实施方案,R5是丙基、及其构造异构体。在另一实施方案,R5是丁基、及其构造异构体。在另一实施方案,R5是戊基、及其构造异构体。在一个实施方案,R4和R5均为甲基。在某些实施方案,本发明提供了具有式XXIV所示结构的化合物:或其药学上可接受的盐。在某些实施方案,R2、R3和R60均如前述段落中所述。在式XXIV的一个实施方案中,R2是C1-C3亚烷基–O–(CH2)n芳基,如前述段落中所述。在式XXIV的一个实施方案中,R2是C1-C3羟烷基,如前述段落中所述。在本章节的任一前述实施方案中,R7是–NR7aR7b,其中R7a和R7b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、酰基、和氨基酸残基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在某些实施方案,R7a是H,和R7b是氨基酸残基。结合剂本发明提供的任何偶联物的合适结合剂包括但不限于抗体类、淋巴因子类(例如,IL-2或IL-3)、激素类(例如,胰岛素和糖皮质激素类)、生长因子类(例如,EGF、转铁蛋白和III型纤连蛋白)、病毒受体类、白介素类、或任何其他细胞结合分子类或物质类或肽结合分子类或物质类。结合剂还包括但不限于锚蛋白重复蛋白类和干扰素类。在一些实施方案,所述结合剂是抗体或其抗原结合片段。所述抗体可以是本领域技术人员已知的任何形式。本发明使用的术语“抗体”是指包含至少一个互补决定区(CDR)的任何抗原结合分子或分子复合物,所述互补决定区(CDR)与特定抗原特异性结合或相互作用。术语“抗体”包括免疫球蛋白分子,所述免疫球蛋白分子包含四条多肽链,通过二硫键相互连接的两条重(H)链和两条轻(L)链,以及其多聚体(例如IgM)。每条重链包含重链可变区(本发明缩写为HCVR或VH)和重链恒定区。所述重链恒定区包含三个结构域,CH1、CH2和CH3。每条轻链包含轻链可变区(本发明缩写为LCVR或VL)和轻链恒定区。所述轻链恒定区包含一个结构域(CL1)。所述VH区和VL区可进一步细分为高变区,称为互补决定区(CDR),散布有更保守的区域,称为框架区(FR)。各VH和VL分别由三个CDR和四个FR组成,按照以下顺序从氨基端到羧基端排列:FR1,CDR1,FR2,CDR2,FR3,CDR3,FR4。在本发明的不同实施方案中,适用于本发明化合物或有效负载的所述抗体(或其抗原结合部分)的FR可以与人种系序列相同,或者可以是天然、或人工修饰的。可基于两个或更多个CDR的并列分析来定义氨基酸共有序列。本发明使用的术语“抗体”还包括完整抗体分子的抗原结合片段。本发明使用的术语抗体的“抗原结合部分”,抗体的“抗原结合片段”等包括任何天然存在的、可酶促得到的、合成的、或基因工程化的多肽或糖蛋白,其特异性结合抗原以形成复合物。抗体的抗原结合片段可以例如使用任何合适的标准技术,例如涉及操纵和表达编码抗体可变结构域和任选恒定结构域的DNA的蛋白水解消化或重组基因工程技术,由完整抗体分子衍生得到。此种DNA是已知的和/或容易从例如商业来源,DNA文库(包括例如噬菌体-抗体文库)得到,或可以合成得到。可通过化学方法或通过使用分子生物学技术对DNA进行测序和操作,例如,将一个或多个可变结构域和/或恒定结构域排列成合适的构型,或引入密码子,产生半胱氨酸残基,修饰、添加或删除氨基酸等。抗原结合片段的非限制性实例包括:(i)Fab片段;(ii)F(ab')2片段;(iii)Fd片段;(iv)Fv片段;(v)单链Fv(scFv)分子;(vi)dAb片段;和(vii)由模拟抗体(例如,分离的CDR,例如CDR3肽)或受约束的FR3-CDR3-FR4肽的高变区的氨基酸残基组成的最小识别单元。其他工程化分子,如结构域特异性抗体类,单结构域抗体类,结构域缺失抗体类,嵌合抗体类,CDR嫁接抗体类,双抗体类,三抗体类,四抗体类,微抗体类,纳米抗体类(例如,一价纳米抗体类,二价纳米抗体类等),小型模块化免疫药物(SMIP)和鲨鱼可变IgNAR结构域亦均包含在本发明所使用的表述“抗原结合片段”内。抗体的抗原结合片段通常包含至少一个可变结构域。所述可变结构域可具有任何尺寸或氨基酸组成,并且通常包含至少一个CDR,所述至少一个CDR与一个或多个框架序列相邻或位于框内。在具有与VL结构域相关的VH结构域的抗原结合片段中,所述VH和VL结构域可以任何合适的排列相对于彼此进行定位。譬如,所述可变区可以是二聚的并含有VH-VH、VH-VL或VL-VL二聚体。或者,所述抗体的抗原结合片段可包含单体VH或VL结构域。在某些实施方案,抗体的抗原结合片段可包含至少一个可变结构域,所述可变结构域与至少一个恒定结构域共价连接。可在本发明抗体的抗原结合片段内发现的可变结构域和恒定结构域的非限制性示例性构型包括:(i)VH-CH1;(ii)VH-CH2;(iii)VH-CH3;(iv)VH-CH1-CH2;(v)VH-CH1-CH2-CH3;(vi)VH-CH2-CH3;(vii)VH-CL;(viii)VL-CH1;(ix)VL-CH2;(x)VL-CH3;(xi)VL-CH1-CH2;(xii)VL-CH1-CH2-CH3;(xiii)VL-CH2-CH3;和(xiv)VL-CL。在可变结构域和恒定结构域的任何构型中,包括上文列出的任何示例性构型,所述可变结构域和恒定结构域可以彼此直接连接或可以通过完整或部分铰链或连接体区域进行连接。铰链区可由至少2个(例如,5、10、15、20、40、60个或更多个)氨基酸组成,所述氨基酸导致单个多肽分子中相邻可变结构域和/或恒定结构域之间的柔性或半柔性连接。与完整的抗体分子一样,抗原结合片段可以是单特异性或多特异性的(例如,双特异性的)。抗体的多特异性抗原结合片段通常包含至少两个不同的可变结构域,其中每个可变结构域均能够特异性结合单独的抗原或结合同一抗原上的不同表位。任何多特异性抗体形式,包括本发明公开的示例性双特异性抗体形式,均可使用本领域可用的常规技术,适于在本发明抗体的抗原结合片段上下文中使用。在本发明所述的某些实施方案中,本发明所述抗体是人抗体。本发明使用的术语“人抗体”旨在包括具有衍生自人种系免疫球蛋白序列的可变区和恒定区的抗体。本发明的人抗体可包括不由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变而引入的突变),例如在CDR中,特别是在CDR3中。然而,本发明使用的术语“人抗体”不旨在包括其中衍生自另一种哺乳动物物种(例如小鼠)的种系的CDR序列已移植到人框架序列上的抗体。术语“人抗体”不包括在天然存在的、未经修饰的生物体中通常不经修饰或人为干预/操作而存在的天然存在的分子。在一些实施方案,本发明所述抗体可以是重组人抗体。本发明使用的术语“重组人抗体”旨在包括通过重组方式制备、表达、产生或分离的所有人抗体,例如使用转染到宿主细胞中的重组表达载体表达的抗体(下文进一步描述);从重组、组合人抗体文库分离的抗体(下文进一步描述);从动物(例如小鼠)分离的抗体,所述动物是人免疫球蛋白基因的转基因动物(参见例如,Tayloretal.(1992)Nucl.AcidsRes.20:6287-6295);或通过涉及将人免疫球蛋白基因序列剪接到其他DNA序列的任何其他方法制备、表达、产生或分离的抗体。此类重组人抗体具有衍生自人种系免疫球蛋白序列的可变区和恒定区。然而,在某些实施方案,对此种重组人抗体进行体外诱变(或者,当使用转基因人Ig序列的动物时,进行体内体细胞诱变),并因此重组抗体的所述VH区和VL区的氨基酸序列是衍生自人种系VH和VL序列并与之相关、但在体内可不天然存在于人抗体种系库中的序列。人抗体可以与铰链异质性相关的两种形式存在。在一种形式中,免疫球蛋白分子包含约150-160kDa的稳定四链构建体,其中二聚体通过链间重链二硫键连接在一起。在第二种形式中,所述二聚体不通过链间二硫键连接,并且形成约75-80kDa的分子,其由共价偶联的轻链和重链(半抗体)组成。即使在亲和纯化后,这些形式也极难分离。在各种完整IgG同种型中出现第二种形式的频率是由于但不限于,与抗体的铰链区同种型相关的结构差异。人IgG4铰链的铰链区中的单个氨基酸置换可显著地将第二种形式(Angaletal.(1993)MolecularImmunology30:105)的出现降低至通常使用人IgG1铰链观察到的水平。本发明公开内容包括在铰链区、CH2区或CH3区中具有一个或多个突变的抗体,所述突变可能是例如在生成中所需的,以提高所需抗体形式的产量。本发明所述抗体可以是分离的抗体。本发明使用的“分离的抗体”是指已经从其天然环境的至少一种组分中鉴定和分离和/或回收的抗体。例如,出于本发明目的,已从生物体的至少一种组分或从其中天然存在或天然产生的抗体的组织或细胞中分离或移去的抗体是“分离的抗体”。分离的抗体还包括重组细胞内的原位抗体。分离的抗体是已经过至少一个纯化或分离步骤的抗体。根据某些实施方案,分离的抗体可以基本上不含其他细胞材料和/或化学物质。与衍生抗体的相应种系序列相比,本发明使用的抗体可在所述重链和轻链可变结构域的框架和/或CDR区中包含一个或多个氨基酸置换、插入和/或缺失。通过将本发明公开的氨基酸序列与可从例如公共抗体序列数据库获得的种系序列进行比较,可容易地确定此类突变。本发明包括抗体及其抗原结合片段,其衍生自本发明公开的任何氨基酸序列,其中一个或多个框架和/或CDR区内的一个或多个氨基酸突变为衍生抗体的种系序列的相应残基,或突变为另一个人种系序列的相应残基,或突变为相应种系残基的保守氨基酸置换(此类序列变化在本发明中统称为“种系突变”)。本领域普通技术人员从本发明公开的重链和轻链可变区序列开始,可容易地生成许多抗体和抗原结合片段,所述抗体和抗原结合片段包含一个或多个个体种系突变或其组合。在某些实施方案,VH和/或VL结构域内的所有框架和/或CDR残基均突变回在衍生抗体的原始种系序列中发现的残基。在其他实施方案,仅有某些残基突变回原始种系序列,例如,仅在FR1的前8个氨基酸内或在FR4的最后8个氨基酸内发现的突变残基,或仅在CDR1、CDR2或CDR3中发现的突变残基。在其他实施方案,将一个或多个框架和/或CDR残基突变为不同种系序列(即,种系序列不同于最初衍生抗体的种系序列)的相应残基。此外,本发明所述抗体可包含框架和/或CDR区内的两个或更多个种系突变的任何组合,例如,其中某些个体残基突变为特定种系序列的相应残基,而某些与原始种系序列不同的其他残基保持或突变为不同种系序列的相应残基。一旦得到,可容易地测试含有一个或多个种系突变的抗体和抗原结合片段的一种或多种所需特性,例如改善的结合特异性,增加的结合亲和力,改善或增强的拮抗或激动生物学特性(视情况而定),降低的免疫原性等。以这种一般方式得到的抗体和抗原结合片段均包括在本发明中。可用于本发明化合物的抗体还包括此类抗体,其包含具有一个或多个保守置换的本发明公开的HCVR、LCVR和/或CDR氨基酸序列中任一个的变体。术语“表位”是指与抗体分子的可变区中被称为互补位的特定抗原结合位点相互作用的抗原决定簇。单个抗原可具有一个以上的表位。因此,不同的抗体可结合抗原上的不同区域并且可具有不同的生物学效应。表位可以是构象的或线性的。构象表位是由线性多肽链不同区段在空间上并列的氨基酸产生。线性表位是由多肽链中相邻氨基酸残基产生。在某些实施方案,表位可包括抗原上的糖类、磷酰基类或磺酰基类基团部分。在某些实施方案,所述抗体包含轻链。在某些实施方案,所述轻链是κ轻链。在某些实施方案,所述轻链是λ轻链。在某些实施方案,所述抗体包含重链。在一些实施方案,所述重链是IgA。在一些实施方案,所述重链是IgD。在一些实施方案,所述重链是IgE。在一些实施方案,所述重链是IgG。在一些实施方案,所述重链是IgM。在一些实施方案,所述重链是IgG1。在一些实施方案,所述重链是IgG2。在一些实施方案,所述重链是IgG3。在一些实施方案,所述重链是IgG4。在一些实施方案,所述重链是IgA1。在一些实施方案,所述重链是IgA2。在一些实施方案,所述抗体是抗体片段。在一些实施方案,所述抗体片段是Fv片段。在一些实施方案,所述抗体片段是Fab片段。在一些实施方案,所述抗体片段是F(ab')2片段。在一些实施方案,所述抗体片段是Fab'片段。在一些实施方案,所述抗体片段是scFv(sFv)片段。在一些实施方案,所述抗体片段是scFv-Fc片段。在一些实施方案,所述抗体是单克隆抗体。在一些实施方案,所述抗体是多克隆抗体。在一些实施方案,所述抗体是双特异性抗体,包括第一抗原结合结构域(本发明也称为“D1”)和第二抗原结合结构域(本发明也称为“D2”)。本发明使用的表述“抗原结合结构域”是指能够特异性结合特定目的抗原(例如,PRLR或STEAP2)的任何肽、多肽、核酸分子、支架型分子、肽展示分子、或含多肽的构建体。本发明使用的术语“特异性结合”等是指抗原结合结构域与特定抗原形成复合物,其特征在于解离常数(KD)为1μM或更小,并且在一般测试条件下不结合其他无关抗原。“无关抗原”是彼此具有小于95%氨基酸同一性的蛋白质类、肽类或多肽类。可在本发明上下文中使用的抗原结合结构域的示例性类别包括抗体类,抗体的抗原结合部分类,与特定抗原特异性相互作用的肽类(例如肽体类),与特定抗原特异性相互作用的受体分子类,包含特异性结合特定抗原的受体的配体结合部分的蛋白质类,抗原结合支架类(例如,DARPin类、HEAT重复蛋白类、ARM重复蛋白类、三角形四肽重复蛋白类、和其他基于天然存在的重复蛋白的支架类等,[参见,例如BoersmaandPluckthun,2011,Curr.Opin.Biotechnol.22:849-857,以及其中引用的参考文献]),以及适体类或其部分。确定两个分子是否彼此特异性结合的方法是本领域公知的,并且包括例如平衡透析法、表面等离子体共振法等。譬如,在本发明上下文中使用的抗原结合结构域包括结合特定抗原(例如,靶分子[T]或内化效应蛋白[E])或其部分的多肽,如在表面等离子体共振测定法中测定,其KD小于约1μM、小于约500nM、小于约250nM、小于约125nM、小于约60nM、小于约30nM、小于约10nM、小于约5nM、小于约2nM、小于约1nM、小于约500pM、小于约400pM、小于约300pM、小于约200pM、小于约100pM、小于约90pM、小于约80pM、小于约70pM、小于约60pM、小于约50pM、小于约40pM、小于约30pM、小于约20pM、小于约10pM、小于约5pM、小于约4pM、小于约2pM、小于约1pM、小于约0.5pM、小于约0.2pM、小于约0.1pM、或小于约0.05pM。在一些实施方案,所述抗体是嵌合抗体。在一些实施方案,所述抗体是人源化抗体。在一些实施方案,所述抗体是人抗体。在一些实施方案,所述抗体是抗PSMA、抗PRLR、抗MUC16、抗HER2、或抗EGFRvIII、或抗STEAP2抗体。在一些实施方案,所述抗体是抗PRLR或抗HER2抗体。在一些实施方案,所述抗体或其抗原结合片段是抗STEAP2。在一些实施方案,所述抗体或其抗原结合片段是抗PRLR。所述抗体可对本领域技术人员认为合适的任何抗原具有结合特异性。在某些实施方案,所述抗原是跨膜分子(例如受体)。在一个实施方案,所述抗原在肿瘤上表达。在一些实施方案,所述结合剂与肿瘤抗原相互作用或结合肿瘤抗原,包括对一种类型肿瘤特异性的抗原或在特定类型的肿瘤上共有、过表达或修饰的抗原。在一个实施方案,所述抗原在实体瘤上表达。示例性抗原包括但不限于,脂蛋白类;α1-抗胰蛋白酶;细胞毒性T淋巴细胞相关抗原(CTLA),例如CTLA-4;;血管内皮生长因子(VEGF);激素类或生长因子类的受体;蛋白A或蛋白D;成纤维细胞生长因子受体2(FGFR2),EpCAM,GD3,FLT3,PSMA,PSCA,MUC1,MUC16,STEAP,STEAP2,CEA,TENB2,EphA受体类,EphB受体类,叶酸受体,FOLRI,间皮素,畸胎瘤衍化生长因子抗原C端(cripto),αvβ6(alphavbeta6),整合素类,VEGF,VEGFR,EGFR,转铁蛋白受体,IRTA1,IRTA2,IRTA3,IRTA4,IRTA5;CD蛋白质类,例如CD2、CD3、CD4、CD5、CD6、CD8、CD11、CD14、CD19、CD20、CD21、CD22、CD25、CD26、CD28、CD30、CD33、CD36、CD37、CD38、CD40、CD44、CD52、CD55、CD56、CD59、CD70、CD79、CD80、CD81、CD103、CD105、CD134、CD137、CD138、CDI52,或与一种或多种肿瘤相关抗原或细胞表面受体结合的抗体,其公开于美国专利公开号2008/0171040或美国专利公开号2008/0305044中,各所述专利申请通过引用其全部内容并入本发明;促红细胞生成素;骨诱导因子类;免疫毒素类;骨形态发生蛋白(BMP);T细胞受体类;表面膜蛋白类;整合素类,例如CDlla、CDllb、CDllc、CD18、ICAM、VLA-4和VCAM;肿瘤相关抗原,例如AFP、ALK、B7H4、BAGE蛋白质类、β-连环素、brc-abl、BRCA1、BORIS、CA9(碳酸酐酶IX)、半胱天冬酶-8、CD20、CD40、CD123、CDK4、CEA、CLEC12A、c-kit、cMET、CTLA4、细胞周期素-B1、CYP1B1、EGFR、EGFRvIII、内皮糖蛋白、Epcam、EphA2、ErbB2/Her2、ErbB3/Her3、ErbB4/Her4、ETV6-AML、Fra-1、FOLR1、GAGE蛋白质类、GD2、GD3、GloboH、磷脂酰肌醇蛋白聚糖-3、GM3、gp100、Her2、HLA/B-raf、HLA/EBNA1、HLA/k-ras、HLA/MAGE-A3、hTERT、IGF1R、LGR5、LMP2、MAGE蛋白质类、MART-1、间皮素、ML-IAP、Muc1、Muc16、CA-125、MUM1、NA17、NGEP、NY-BR1、NY-BR62、NY-BR85、NY-ESO1、OX40、p15、p53、PAP、PAX3、PAX5、PCTA-1、PDGFR-α、PDGFR-β、PDGF-A、PDGF-B、PDGF-C、PDGF-D、PLAC1、PRLR、PRAME、PSCA、PSGR、PSMA(FOLH1)、RAGE蛋白质类、Ras、RGS5、Rho、SART-1、SART-3、Steap-1(前列腺跨膜上皮抗原-1)、Steap-2、STn、生存素、TAG-72、TGF-β、TMPRSS2、Tn、TNFRSF17、TRP-1、TRP-2、酪氨酸酶、和尿溶蛋白-3(uroplakin-3),以及任何上述多肽的片段;细胞表面表达的抗原类;MUC16;c-MET;分子类,例如A类清道夫受体,包括清道夫受体A(SR-A),以及其他膜蛋白类,例如B7家族相关成员,包括含V-set和Ig结构域4(VSIG4)、集落刺激因子1受体(CSF1R)、去唾液酸糖蛋白受体(ASGPR)和淀粉样β前体样蛋白2(APLP-2)。在一些实施方案,所述抗原是PRLR或HER2。在一些实施方案,所述抗原是STEAP2。在一些实施方案,所述抗原是人STEAP2。在一些实施例,所述MAGE蛋白质类选自MAGE-1、MAGE-2、MAGE-3、MAGE-4、MAGE-6、和MAGE-12。在一些实施例,所述GAGE蛋白质类选自GAGE-1和GAGE-2。示例性抗原还包括但不限于BCMA、SLAMF7、GPNMB和UPK3A。示例性抗原还包括但不限于MUC16、STEAP2和HER2。在一些实施方案,所述抗原包括MUC16。在一些实施方案,所述抗原包括STEAP2。在一些实施方案,所述抗原包括PSMA。在一些实施方案,所述抗原包括HER2。在一些实施方案,所述抗原是催乳素受体(PRLR)或前列腺特异性膜抗原(PSMA)。在一些实施方案,所述抗原是MUC16。在一些实施方案,所述抗原包括PSMA。在一些实施方案,所述抗原是HER2。在一些实施方案,所述抗原是STEAP2。在某些实施方案,所述抗体在EU编号系统中编号为295的一个或多个重链位置处包含谷氨酰胺残基。在本发明中,此位置被称为谷氨酰胺295,或称为Gln295,或称为Q295。技术人员将认识到,其是许多抗体的野生型序列中的保守谷氨酰胺残基。在其他有用的实施方案中,可将抗体设计成包含谷氨酰胺残基。在某些实施方案,所述抗体包含一个或多个N297Q突变。修饰抗体序列以包括谷氨酰胺残基的技术均属于本领域技术人员的技术范围内(参见,例如Ausubeletal.CurrentProtoc.Mol.Biol.)。在一些实施方案,与连接体-有效负载或有效负载偶联的抗体或其抗原结合片段可以是靶向STEAP2的抗体。合适的抗STEAP2抗体或其抗原结合片段包括例如国际公开号WO2018/058001A1中的那些,包括包含其中第75页表1中公开的氨基酸序列的那些。在一些实施方案,抗STEAP2抗体是WO2018/058001A1的H1H7814N,其包含同一出版物中H1M7814N的CDR。在一些实施方案,抗STEAP2抗体包含:重链互补决定区(HCDR)-1,其包含SEQIDNO:2;HCDR2,其包含SEQIDNO:3;HCDR3,其包含SEQIDNO:4;轻链互补决定区(LCDR)-1,其包含SEQIDNO:6;LCDR2,其包含SEQIDNO:7;和LCDR3,其包含SEQIDNO:8。在一些实施方案,抗STEAP2抗体包含:包含SEQIDNO:1的重链可变区(HCVR)和包含SEQIDNO:5的轻链可变区(LCVR)。在任一前述实施方案中,抗STEAP2抗体可通过定点诱变以在位点插入谷氨酰胺残基,而不会导致抗体功能或结合失效,从而制备得到。譬如,在任一前述实施方案中,所述抗STEAP2抗体可包含Asn297Gln(N297Q)突变。此类具有N297Q突变的抗体还可在其可变区包含一个或多个额外的天然存在的谷氨酰胺残基,所述这些残基可被转谷氨酰胺酶接近,因此能够与有效负载或连接体-有效负载(表A)偶联。在某些实施方案,所述抗体或其抗原结合片段包含SEQIDNO:1的重链可变区(HCVR)氨基酸序列内的三个重链互补决定区(HCDR1、HCDR2和HCDR3);以及SEQIDNO:5的轻链可变区(LCVR)氨基酸序列内的三个轻链互补决定区(LCDR1、LCDR2和LCDR3)。在某些实施方案,所述抗体或其抗原结合片段包含SEQIDNO:1的HCVR氨基酸序列;和SEQIDNO:5的LCVR氨基酸序列。国际公开号WO2018/058001A1在此通过引用其全文并入本发明。在一些实施方案,与连接体-有效负载或有效负载偶联的抗体或其抗原结合片段可以是靶向人催乳素受体(PRLR)的抗体。合适的抗PRLR抗体或其抗原结合片段包括例如国际公开号WO2015/026907A1中的那些,包括包含其中第36页表1中公开的氨基酸序列的那些。在一些实施方案,抗PRLR抗体是WO2015/026907A1的H1H6958N2,其包含同一出版物中H2M6958N2的CDR。在一些实施方案,抗PRLR抗体包含:重链互补决定区(HCDR)-1,其包含SEQIDNO:10;HCDR2,其包含SEQIDNO:11;HCDR3,其包含SEQIDNO:12;轻链互补决定区(LCDR)-1,其包含SEQIDNO:14;LCDR2,其包含SEQIDNO:15;和LCDR3,其包含SEQIDNO:16。在一些实施方案,抗PRLR抗体包含:包含SEQIDNO:9的重链可变区(HCVR)和包含SEQIDNO:13的轻链可变区(LCVR)。在任一前述实施方案中,抗PRLR抗体可通过定点诱变以在位点插入谷氨酰胺残基,而不会导致抗体功能或结合失效,从而制备得到。譬如,在任一前述实施方案中,所述抗PRLR抗体可包含Asn297Gln(N297Q)突变。此类具有N297Q突变的抗体还可在其可变区包含一个或多个额外的天然存在的谷氨酰胺残基,所述这些残基可被转谷氨酰胺酶接近,因此能够与有效负载或连接体-有效负载(表A)偶联。在某些实施方案,所述抗体或其抗原结合片段包含SEQIDNO:9的重链可变区(HCVR)氨基酸序列内的三个重链互补决定区(HCDR1、HCDR2和HCDR3);以及SEQIDNO:13的轻链可变区(LCVR)氨基酸序列内的三个轻链互补决定区(LCDR1、LCDR2和LCDR3)。在某些实施方案,所述抗体或其抗原结合片段包含SEQIDNO:9的HCVR氨基酸序列;和SEQIDNO:13的LCVR氨基酸序列。国际公开号WO2015/026907A1在此通过引用其全文并入本发明。表A.示例性抗体H1H7814N(抗STEAP2)和H1H6958N2(抗PRLR)的序列本发明提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含HCVR,所述HCVR包含选自表A所列的任一HCVR氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含LCVR,所述LCVR包含选自表A所列的任一LCVR氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,包含HCVR和LCVR氨基酸序列对(HCVR/LCVR),所述HCVR和LCVR氨基酸序列对(HCVR/LCVR)包含表A所列的任一HCVR氨基酸序列与表A所列的任一LCVR氨基酸序列配对。根据某些实施方案,本发明提供了抗体或其抗原结合片段,其包含HCVR/LCVR氨基酸序列对,所述HCVR/LCVR氨基酸序列对包含在表A所列的任一示例性抗STEAP2抗体内。在某些实施方案,所述HCVR/LCVR氨基酸序列对选自由250/258组成的组;如国际公开号WO2018/058001A1中所述,其内容通过引用其全文并入本发明。本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含重链CDR1(HCDRl),所述重链CDR1(HCDRl)包含选自表A所列的任一HCDRl氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含重链CDR2(HCDR2),所述重链CDR2(HCDR2)包含选自表A所列的任一HCDR2氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含重链CDR3(HCDR3),所述重链CDR3(HCDR3)包含选自表A所列的任一HCDR3氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含轻链CDR1(LCDRl),所述轻链CDR1(LCDRl)包含选自表A所列的任一LCDRl氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含轻链CDR2(LCDR2),所述轻链CDR2(LCDR2)包含选自表A所列的任一LCDR2氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含轻链CDR3(LCDR3),所述轻链CDR3(LCDR3)包含选自表A所列的任一LCDR3氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含HCDR3和LCDR3氨基酸序列对(HCDR3/LCDR3),所述HCDR3和LCDR3氨基酸序列对(HCDR3/LCDR3)包含表A所列的任一HCDR3氨基酸序列与表A所列的任一LCDR3氨基酸序列配对。根据某些实施方案,本发明提供了抗体或其抗原结合片段,其包含HCDR3/LCDR3氨基酸序列对,所述HCDR3/LCDR3氨基酸序列对包含在表A所列的任一示例性抗STEAP2抗体内。在某些实施方案,所述HCDR3/LCDR3氨基酸序列对选自由256/254组成的组;如国际公开号WO2018/058001A1中所述,其内容通过引用其全文并入本发明。本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含六个CDR的集合(即,HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3),所述六个CDR的集合包含在表A所列的任一示例性抗STEAP2抗体内。在某些实施方案,所述HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3氨基酸序列集合选自由以下组成的组:252-254-256-260-262-264;如国际公开号WO2018/058001A1中所述,其内容通过引用其全文并入本发明。在相关实施方案中,本发明还提供了特异性结合STEAP2的抗体或其抗原结合片段,其包含六个CDR的集合(即,HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3),所述六个CDR的集合包含在表A所列的任一示例性抗STEAP2抗体所定义的HCVR/LCVR氨基酸序列对内。譬如,本发明包括特异性结合STEAP2的抗体或其抗原结合片段,其包含所述HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3氨基酸序列集合,所述HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3氨基酸序列集合包含在选自由250/258组成的组的HCVR/LCVR氨基酸序列对内;如国际公开号WO2018/058001A1中所述,其内容通过引用其全文并入本发明。用于识别HCVR和LCVR氨基酸序列内的CDR的方法和技术是本领域公知的,并且可用于识别本发明公开的特定HCVR和/或LCVR氨基酸序列内的CDR。可用于识别CDR边界的示例性约定或惯例包括,例如卡巴(Kabat)定义、柯西亚(Chothia)定义、和AbM定义。一般而言,卡巴(Kabat)定义是基于序列可变性,柯西亚(Chothia)定义是基于结构环路(loop)区域的位置,AbM定义是卡巴(Kabat)和柯西亚(Chothia)方法之间的折衷。参见,例如Kabat,\"SequencesofProteinsofImmunologicalInterest,\"NationalInstitutesofHealth,Bethesda,Md.(1991);Al-Lazikanietal.,J.Mol.Biol.273:927-948(1997);和Martinetal.,Proc.Natl.Acad.Sci.USA86:9268-9272(1989)。公共数据库亦可用于识别抗体内的CDR序列。本发明提供了特异性结合PRLR的抗体或其抗原结合片段,其包含HCVR,所述HCVR包含选自表A所列的任一HCVR氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,其包含LCVR,所述LCVR包含选自表A所列的任一LCVR氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,包含HCVR和LCVR氨基酸序列对(HCVR/LCVR),所述HCVR和LCVR氨基酸序列对(HCVR/LCVR)包含表A所列的任一HCVR氨基酸序列与表A所列的任一LCVR氨基酸序列配对。根据某些实施方案,本发明提供了抗体或其抗原结合片段,其包含HCVR/LCVR氨基酸序列对,所述HCVR/LCVR氨基酸序列对包含在表A所列的任一示例性抗PRLR抗体内。在某些实施方案,所述HCVR/LCVR氨基酸序列对选自由18/26、66/74、274/282、290/298、和370/378组成的组;如国际公开号WO2015/026907A1中所述,其内容通过引用其全文并入本发明。本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,其包含重链CDR1(HCDRl),所述重链CDR1(HCDRl)包含选自表A所列的任一HCDRl氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,其包含重链CDR2(HCDR2),所述重链CDR2(HCDR2)包含选自表A所列的任一HCDR2氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,其包含重链CDR3(HCDR3),所述重链CDR3(HCDR3)包含选自表A所列的任一HCDR3氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,其包含轻链CDR1(LCDRl),所述轻链CDR1(LCDRl)包含选自表A所列的任一LCDRl氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,其包含轻链CDR2(LCDR2),所述轻链CDR2(LCDR2)包含选自表A所列的任一LCDR2氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,其包含轻链CDR3(LCDR3),所述轻链CDR3(LCDR3)包含选自表A所列的任一LCDR3氨基酸序列的氨基酸序列,或其基本相似序列,所述基本相似序列与其具有至少90%、至少95%、至少98%、或至少99%序列同一性。本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,其包含HCDR3和LCDR3氨基酸序列对(HCDR3/LCDR3),所述HCDR3和LCDR3氨基酸序列对(HCDR3/LCDR3)包含表A所列的任一HCDR3氨基酸序列与表A所列的任一LCDR3氨基酸序列配对。根据某些实施方案,本发明提供了抗体或其抗原结合片段,其包含HCDR3/LCDR3氨基酸序列对,所述HCDR3/LCDR3氨基酸序列对包含在表A所列的任一示例性抗PRLR抗体内。在某些实施方案,所述HCDR3/LCDR3氨基酸序列对选自由24/32、72/80、280/288、296/304、和376/384组成的组;如国际公开号WO2015/026907A1中所述,其内容通过引用其全文并入本发明。本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,其包含六个CDR的集合(即,HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3),所述六个CDR的集合包含在表A所列的任一示例性抗PRLR抗体内。在某些实施方案,所述HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3氨基酸序列集合选自由以下组成的组:20-22-24-28-30-32,68-70-72-76-78-80,276-278-280-284-286-288,292-294-296-300-302-304,和372-374-376-380-382-384;如国际公开号WO2015/026907A1中所述,其内容通过引用其全文并入本发明。在相关实施方案中,本发明还提供了特异性结合PRLR的抗体或其抗原结合片段,其包含六个CDR的集合(即,HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3),所述六个CDR的集合包含在表A所列的任一示例性抗PRLR抗体所定义的HCVR/LCVR氨基酸序列对内。譬如,本发明包括特异性结合PRLR的抗体或其抗原结合片段,其包含所述HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3氨基酸序列集合,所述HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3氨基酸序列集合包含在选自由18/26、66/74、274/282、290/298、和370/378组成的组的HCVR/LCVR氨基酸序列对内;如国际公开号WO2015/026907A1中所述,其内容通过引用其全文并入本发明。用于识别HCVR和LCVR氨基酸序列内的CDR的方法和技术是本领域公知的,并且可用于识别本发明公开的特定HCVR和/或LCVR氨基酸序列内的CDR。可用于识别CDR边界的示例性约定或惯例包括,例如卡巴(Kabat)定义、柯西亚(Chothia)定义、和AbM定义。一般而言,卡巴(Kabat)定义是基于序列可变性,柯西亚(Chothia)定义是基于结构环路(loop)区域的位置,AbM定义是卡巴(Kabat)和柯西亚(Chothia)方法之间的折衷。参见,例如Kabat,\"SequencesofProteinsofImmunologicalInterest,\"NationalInstitutesofHealth,Bethesda,Md.(1991);Al-Lazikanietal.,J.Mol.Biol.273:927-948(1997);和Martinetal.,Proc.Natl.Acad.Sci.USA86:9268-9272(1989)。公共数据库亦可用于识别抗体内的CDR序列。所述结合剂连接体可通过抗体或抗原结合分子内特定氨基酸处的附接而与所述结合剂(例如,抗体或抗原结合分子)连接。可在本发明此实施方案的上下文中使用的示例性氨基酸附接包括,例如,赖氨酸(参见例如,US5,208,020;US2010/0129314;Hollanderetal.,BioconjugateChem.,2008,19:358–361;WO2005/089808;US5,714,586;US2013/0101546;和US2012/0585592);半胱氨酸(参见例如,US2007/0258987;WO2013/055993;WO2013/055990;WO2013/053873;WO2013/053872;WO2011/130598;US2013/0101546;和US7,750,116);硒代半胱氨酸(参见例如,WO2008/122039;和Hoferetal.,Proc.Natl.Acad.Sci.,USA,2008,105:12451–12456);甲酰甘氨酸(参见例如,Carricoetal.,Nat.Chem.Biol.,2007,3:321–322;Agarwaletal.,Proc.Natl.Acad.Sci.,USA,2013,110:46–51,和Rabukaetal.,Nat.Protocols,2012,10:1052–1067);非天然氨基酸(参见例如,WO2013/068874,和WO2012/166559),和酸性氨基酸(参见例如,WO2012/05982)。连接体也可通过与碳水化合物的附接而与抗原结合蛋白质偶联(参见例如,US2008/0305497,WO2014/065661,和Ryanetal.,Food&AgricultureImmunol.,2001,13:127–130)。在一些实施例,所述结合剂是抗体或抗原结合分子,和所述抗体通过赖氨酸残基与所述连接体连接。在一些实施方案,所述抗体或抗原结合分子通过半胱氨酸残基与所述连接体连接。连接体还可通过基于转谷氨酰胺酶的化学酶促偶联而偶联至一个或多个谷氨酰胺残基上(参见例如,Dennleretal.,BioconjugateChem.2014,25,569–578)。例如,在转谷氨酰胺酶存在下,抗体的一个或多个谷氨酰胺残基可与伯胺化合物偶联。伯胺类化合物包括例如有效负载或连接体-有效负载,其通过转谷氨酰胺酶介导的偶联直接提供抗体药物偶联物。伯胺类化合物还包括被活性基团官能化的连接体和间隔基团,随后可用进一步的化合物与其反应以合成抗体药物偶联物。包含谷氨酰胺残基的抗体可从天然来源分离得到或经工程改造以包含一个或多个谷氨酰胺残基而得到。用于将谷氨酰胺残基工程化为抗体多肽链(经谷氨酰胺基修饰的抗体或抗原结合分子)的技术均在本领域技术人员的技术范围内。在某些实施方案,所述抗体是无糖基化的。在某些实施方案,所述抗体或经谷氨酰胺基修饰的抗体或抗原结合分子在至少一个多肽链序列中包含至少一个谷氨酰胺残基。在某些实施方案,所述抗体或经谷氨酰胺基修饰的抗体或抗原结合分子包含两个重链多肽,其中每个具有一个Gln295或Q295残基。在进一步的实施方案中,所述抗体或经谷氨酰胺基修饰的抗体或抗原结合分子在除重链295以外的位点处包含一个或多个谷氨酰胺残基。本发明包括具有本发明所述的N297Q突变的本章节的抗体。伯胺类化合物在某些实施方案,可用于由包含谷氨酰胺的抗体(或抗原结合化合物)的转谷氨酰胺酶介导的偶联的伯胺类化合物可以是普通技术人员认为有用的任何伯胺化合物。通常,伯胺化合物具有式H2N-R所示结构,其中R可以是与抗体和反应条件相容的任何基团。在某些实施方案,R是烷基、取代的烷基、杂烷基、或取代的杂烷基。在一些实施方案,所述伯胺化合物包含活性基团或保护的活性基团。有用的活性基团包括叠氮化物类、炔烃类、环炔烃类、硫醇类、醇类、酮类、醛类、羧酸类、酯类、酰胺类、酰肼类、苯胺类、和胺类。在某些实施方案,所述活性基团选自由叠氮化物、炔烃、巯基、环炔烃、醛、和羧基组成的组。在某些实施方案,所述伯胺化合物具有式H2N-LL-X所示结构,其中LL是二价间隔基团,和X是活性基团或保护的活性基团。在特定实施方案,LL是二价聚乙二醇(PEG)基团。在某些实施方案,X是选自由-SH、–N3、炔烃、醛和四唑组成的组。在特定实施方案,X是–N3。在某些实施方案,所述伯胺化合物是具有以下通式之一的结构:H2N-(CH2)n-X;H2N-(CH2CH2O)n-(CH2)p-X;H2N-(CH2)n-N(H)C(O)-(CH2)m-X;H2N-(CH2CH2O)n-N(H)C(O)-(CH2CH2O)m-(CH2)p-X;H2N-(CH2)n-C(O)N(H)-(CH2)m-X;H2N-(CH2CH2O)n-C(O)N(H)-(CH2CH2O)m-(CH2)p-X;H2N-(CH2)n-N(H)C(O)-(CH2CH2O)m-(CH2)p-X;H2N-(CH2CH2O)n-N(H)C(O)-(CH2)m-X;H2N-(CH2)n-C(O)N(H)-(CH2CH2O)m-(CH2)p-X;和H2N-(CH2CH2O)n-C(O)N(H)-(CH2)m-X;其中n是选自1至12的整数;m是选自0至12的整数;p是选自0至2的整数;和X是选自由以下组成的组:–SH、–N3、–C≡CH、–C(O)H、四唑、和以下之一:在上文中,任一所述烷基或亚烷基(即-CH2-)基团均可任选地被例如C1-8烷基、甲基甲酰基、或–SO3H取代。在某些实施方案,所述烷基基团均是未取代的。在某些实施方案,所述伯胺化合物是选自由以下组成的组:在特定实施方案,所述伯胺化合物是:在以下实施例中提供了上述反应的示例性条件。连接体在某些实施方案,本发明所述偶联物的连接体L部分是一个基团部分,例如二价基团部分,其将结合剂共价连接至本发明所述的有效负载化合物。在其他实施例,连接体L是将结合剂共价连接至本发明所述的有效负载化合物的三价或多价基团部分。合适的连接体可在例如Antibody-DrugConjugatesandImmunotoxins;Phillips,G.L.,Ed.;SpringerVerlag:NewYork,2013;Antibody-DrugConjugates;Ducry,L.,Ed.;HumanaPress,2013;Antibody-DrugConjugates;Wang,J.,Shen,W.-C.,andZaro,J.L.,Eds.;SpringerInternationalPublishing,2015中获悉,各文献的内容通过引用其全文并入本发明。在某些实施方案,本发明所述连接体-有效负载的连接体L部分是与本发明所述的有效负载化合物共价连接的基团部分,能够将结合剂二价及共价连接至本发明所述的有效负载化合物。在其他实施例,本发明所述的连接体-有效负载的连接体L部分是与本发明所述的有效负载化合物共价连接的部分,能够作为三价或多价基团部分,将结合剂共价连接至本发明所述的有效负载化合物。有效负载化合物包括上述式I、II、III、IV、V、VI、VII、VIII、IX、X、XI和XII的化合物,以及其与连接体L连接或掺入后的残基是连接体-有效负载。所述连接体-有效负载可进一步与结合剂例如抗体或其抗原结合片段连接以形成抗体-药物偶联物。本领域技术人员将认识到,有效负载基团部分的某些官能团便于连接至连接体和/或结合剂。例如,在某些实施方案,不存在连接体,并且有效负载直接连接至结合剂。在一个实施方案,有效负载包括末端炔烃类,并且结合剂包括叠氮化物类,其中各炔烃和叠氮化物参与区域异构点击化学以将有效负载残基直接连接至结合剂残基。在另一实施方案,有效负载包括羧酸类,并且结合剂包括赖氨酸,其中各羧酸和赖氨酸参与酰胺键形成以将有效负载残基直接连接至结合剂残基。有效负载官能团进一步包括胺类(例如,式C、D、LPc和LPd),季铵离子类(例如,式A和LPa),羟基类(例如,式C、D、LPc和LPd),磷酸酯类,羧酸类(例如,与L连接时呈酯的形式,如式B、D、LPb和LPd中所示),酰肼类(例如,式B和LPb),酰胺类(例如,衍生自式C和LPc的苯胺类,或衍生自式D和LPd的胺类),和糖类。在某些实施方案,所述连接体在生理条件下是稳定的。在某些实施方案,所述连接体是可切割的,例如,能够在酶存在下或在特定pH范围或pH值下释放至少所述有效负载部分。在一些实施方案,连接体包含酶可切割的基团部分。示例性酶可切割的基团部分包括但不限于肽键类、酯键类、腙类、β-葡糖苷酸键类、和二硫键类。在一些实施方案,所述连接体包含组织蛋白酶可切割的连接体。在一些实施方案,所述连接体包含β-葡糖醛酸酶(GUSB)可切割的连接体(参见,例如来自CreativeBiolabs,creative-biolabs.com/adc/beta-glucuronide-linker.htm,或ACSMed.Chem.Lett.2010,1:277–280的GUSB连接体)。在一些实施方案,所述连接体包含不可切割基团部分。在一些实施方案,所述不可切割的连接体衍生自或其残基。在一些实施方案,所述不可切割的连接体-有效负载残基是或其区域异构体。在一些实施方案,所述不可切割的连接体衍生自或其残基。在一些实施方案,所述不可切割的连接体-有效负载残基是或其区域异构体。在一个实施方案,所述连接体是马来酰亚胺环己烷羧酸酯或4-(N-马来酰亚胺基甲基)环己烷羧酸(MCC)。在所述结构中,表示与结合剂连接的键。在所述结构中,在一些实施例,表示由例如具有叠氮化物或炔烃官能团的结合剂与具有互补炔烃或叠氮化物官能团的连接体-有效负载的反应而产生的点击化学残基。在所述结构中,在其他实施例,表示二价硫化物,其由例如一种或多种结合剂半胱氨酸与一种或多种具有马来酰亚胺官能团的连接体或连接体-有效负载经由迈克尔加成反应的反应而产生。在所述结构中,在其他实施例,表示由例如一种或多种结合剂赖氨酸与一种或多种具有活化或未活化羧基官能团的连接体或连接体-有效负载的反应而产生的酰胺键,如本领域技术人员所理解的。在一个实施方案,表示由例如一种或多种结合剂赖氨酸与一种或多种具有活化羧基官能团的连接体或连接体-有效负载的反应而产生的酰胺键,如本领域技术人员所理解的。在一些实施方案,合适的连接体包括但不限于与单一结合剂(例如抗体)的两个半胱氨酸残基进行化学键合的那些。此类连接体可用于模拟由于偶联过程而被破坏的所述抗体的二硫键。在一些实施方案,所述连接体包含一个或多个氨基酸。合适的氨基酸包括天然、非天然的、标准、非标准的、蛋白原、非蛋白原的、和L-型或D-型α-氨基酸。在一些实施方案,所述连接体包含丙氨酸、缬氨酸、甘氨酸、亮氨酸、异亮氨酸、蛋氨酸、色氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺、天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸、或瓜氨酸、或其衍生物、或其任何组合(例如,二肽类、三肽类、寡肽类、多肽类等)。在某些实施方案,所述氨基酸的一个或多个侧链连接至如下所述的侧链基团。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:缬氨酸和瓜氨酸(例如,二价-Val-Cit-或二价-VCit-)。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:丙氨酸和丙氨酸,或二价–AA–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:谷氨酸和丙氨酸,或–EA–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:谷氨酸和甘氨酸,或–EG–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:甘氨酸和甘氨酸,或–GG–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:谷氨酰胺、缬氨酸和瓜氨酸,或–Q-V-Cit–或–QVCit–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:谷氨酸、缬氨酸和瓜氨酸,或–E-V-Cit–或–EVCit–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:–GGGGS–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:–GGGGG–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:–GGGGK–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:–GFGG–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:赖氨酸、缬氨酸和瓜氨酸,或–KVCit–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:–KVA–。在一些实施方案,所述连接体是包含下列氨基酸或由下列氨基酸组成的肽:–VA–。如本领域技术人员将理解的,在本段的任一实施方案中,并贯穿本发明,使用标准的三字母或单字母氨基酸命名。示例性单字母氨基酸名称包括,G代表甘氨酸,K代表赖氨酸,S代表丝氨酸,V代表缬氨酸,A代表丙氨酸,以及F代表苯丙氨酸。在一些实施方案,所述连接体包含自降解(self-immolative)基团。所述自降解基团可以是技术人员已知的任何此类基团。在特定实施方案,所述自降解基团是对氨基苄基(PAB)或其衍生物。有用的衍生物包括对氨基苄氧基羰基(PABC)。本领域技术人员将认识到,自降解基团能够进行化学反应,所述化学反应从有效负载中释放连接体的其余原子。在一些实施方案,所述连接体是:其中:SP1是间隔基团;SP2是间隔基团;是与所述结合剂连接的一个或多个键;是与所述有效负载连接的一个或多个键;各AA分别为氨基酸残基;和n是从1至10的整数。SP1间隔基团是将(AA)n部分连接至结合剂(BA)或连接至与BA连接的活性基团残基的基团部分。合适的SP1间隔基团包括但不限于,包含亚烷基或聚醚或亚烷基和聚醚两者的那些基团。间隔基团的末端,例如间隔基团连接至所述BA或AA的部分,可以是衍生自活性基团部分的基团部分,所述活性基团部分用于在偶联物的化学合成过程中将抗体或AA偶联至间隔基团的目的。在某些实施方案,n是1、2、3、或4。在特定实施方案,n是2。在特定实施方案,n是3。在特定实施方案,n是4。在一些实施方案,SP1间隔基团包含亚烷基。在一些实施方案,SP1间隔基团包含C5-7亚烷基。在一些实施方案,SP1间隔基团包含聚醚。在一些实施方案,SP1间隔基团包含环氧乙烷的聚合物,例如聚乙二醇。在一些实施方案,SP1间隔基团是:其中:RG'是活性基团RG与结合剂反应后的活性基团残基;是与所述结合剂连接的键;是与(AA)n连接的键,其中n是从1至10的整数;和b是从2至8的整数。活性基团RG可以是本领域技术人员已知的能够与结合剂连接形成一个或多个键的任何活性基团。活性基团RG是在其结构中包含能够与结合剂反应(例如,在抗体的半胱氨酸或赖氨酸残基或叠氮化物基团部分处与抗体反应,例如在一个或多个谷氨酰胺残基处与PEG-N3官能化抗体反应)以形成式A、A′、B、B′、C、C′、D、或D′所示化合物的部分的基团部分。与结合剂偶联后,活性基团成为活性基团残基(RG')。示例性活性基团包括但不限于,包含能够与结合剂反应的卤代乙酰基、异硫氰酸酯基、琥珀酰亚胺、N-羟基琥珀酰亚胺、或马来酰亚胺部分的那些活性基团。在某些实施方案,活性基团包括但不限于炔烃类。在某些实施方案,所述炔烃是在不存在铜催化剂的情况下能够与叠氮化物进行1,3-环加成反应的炔烃,如应变炔烃类。应变炔烃是适于应变促进的炔-叠氮化物环加成(SPAAC)的那些,环炔烃类,例如环辛炔类,和苯并环化的炔烃类。合适的炔烃类包括但不限于,二苯并氮杂环辛炔或二苯并环辛炔或二芳基氮杂环辛炔酮或二氟化环辛炔或或取代的,例如氟化炔烃类,氮杂-环炔烃类,二环[6.1.0]壬炔或及其衍生物。特别有用的炔烃包括在某些实施方案,所述结合剂直接连接至RG'。在某些实施方案,所述结合剂通过间隔基团例如SP4(位于和RG'之间)连接至RG'。在特定实施方案,所述结合剂通过SP4(例如,PEG间隔基团)间接连接至RG'。如以下详细讨论的,在某些实施方案,所述结合剂通过采用一个或多个叠氮基进行官能化来制得。每个叠氮基基团分别能够与RG反应形成RG'。在特定实施方案,所述结合剂采用与谷氨酰胺残基连接的–PEG-N3衍生得到。本发明提供了示例性–N3衍生的结合剂,其制备方法,以及其用于与RG反应的方法。在某些实施方案,RG是适于参与1,3-环加成的炔烃,和RG'是由RG与叠氮基官能化的结合剂反应形成的区域异构的1,2,3-三唑基基团部分。作为进一步的实例,在某些实施方案,RG'连接至结合剂,如所示,或各区域异构体的混合物。各R和R'分别具有本发明所述定义或如本发明所例示。SP2间隔基团,当存在时,是将(AA)n部分连接至有效负载的基团部分。合适的间隔基团包括但不限于以上描述为SP1间隔基团的那些。其他合适的SP2间隔基团包括但不限于包含亚烷基或聚醚或亚烷基和聚醚两者的那些。SP2间隔基团的末端(例如,直接连接至有效负载或AA的间隔基团的部分)可以是衍生自活性基团部分的基团部分,其用于在化学合成偶联物的过程中将有效负载或AA与SP2间隔基团偶联的目的。在一些实施例,SP2间隔基团的末端(例如,直接连接至有效负载或AA的SP2间隔基团的部分)可以是活性基团部分的残基,其用于在化学合成偶联物的过程中将有效负载或AA与间隔基团偶联的目的。在一些实施方案,SP2间隔基团,当存在时,选自由以下组成的组:–NH-(p-C6H4)-CH2–、–NH-(p-C6H4)-CH2OC(O)–、氨基酸、二肽、三肽、寡肽、–O–、–N(H)–、及其任何组合。在某些实施方案,各分别为与所述有效负载连接的键,和各分别为与(AA)n连接的键。在上述通式中,各(AA)n分别为氨基酸,或任选地为对氨基苄氧基羰基残基(PABC),如果存在PABC,则优选仅存在一个PABC。优选地,若PABC残基存在,则连接至(AA)n基团中的末端AA,位于有效负载的近端。如果存在,则仅存在。优选地,所述残基,若存在,则通过苄氧羰基基团部分与有效负载连接,并且不存在AA。每个AA的合适氨基酸包括天然、非天然的、标准、非标准的、蛋白原、非蛋白原的、和L-型或D-型α-氨基酸。在一些实施方案,所述AA包含丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、色氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺、天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸、或瓜氨酸、其衍生物、或其任何组合(例如,二肽类、三肽类、和寡肽类等)。在某些实施方案,所述氨基酸的一个或多个侧链连接至如下所述的侧链基团。在一些实施方案,n是2。在一些实施方案,所述(AA)n是缬氨酸-瓜氨酸。在一些实施方案,(AA)n是瓜氨酸-缬氨酸。在一些实施方案,(AA)n是缬氨酸-丙氨酸。在一些实施方案,(AA)n是丙氨酸-缬氨酸。在一些实施方案,(AA)n是缬氨酸-甘氨酸。在一些实施方案,(AA)n是甘氨酸-缬氨酸。在一些实施方案,n是3。在一些实施方案,所述(AA)n是缬氨酸-瓜氨酸-PABC。在一些实施方案,(AA)n是瓜氨酸-缬氨酸-PABC。在一些实施方案,(AA)n是谷氨酸-缬氨酸-瓜氨酸。在一些实施方案,(AA)n是谷氨酰胺-缬氨酸-瓜氨酸。在一些实施方案,(AA)n是赖氨酸-缬氨酸-丙氨酸。在一些实施方案,(AA)n是赖氨酸-缬氨酸-瓜氨酸。在一些实施方案,n是4。在一些实施方案,(AA)n是谷氨酸-缬氨酸-瓜氨酸-PAB。在一些实施方案,(AA)n是谷氨酰胺-缬氨酸-瓜氨酸-PABC。技术人员将认识到PABC是具有以下结构的对氨基苄氧基羰基的残基:所述PABC残基已被证明有助于在体外和体内切割某些连接体。技术人员将认识到PAB为对氨基苄基或–NH-(p-C6H4)-CH2–的二价残基。在一些实施方案,所述连接体是:其中:各分别为与所述结合剂连接的键;各分别为与所述有效负载连接的键;各R9分别为–CH3或–(CH2)3N(H)C(O)NH2;和各A分别为–O–、–NH–、其中ZZ是H、或氨基酸的侧链,如本发明其他地方所讨论。作为另一实例,在一个实施方案,ZZ是C1-6烷基。作为另一实例,在一个实施方案,ZZ是C1-6杂烷基。在本段的特定实施方案中,A可衍生自伯胺化合物或其残基,其中X是–N3,如本发明其他地方所述。在这些实施方案中,1,2,3-三唑残基衍生自叠氮化物与本发明所述化合物或有效负载的炔烃或末端乙炔在参与点击化学反应后的产物,如本发明其他地方所述。因此,在一个非限制性实施例中,A是或其混合物。或者,在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。如上所讨论,与所述结合剂连接的键可以是直接连接,或经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在一些实施方案,所述连接体是:其中:各分别为与所述结合剂连接的键;各分别为与所述有效负载连接的键;各R9分别为–CH3或–(CH2)3N(H)C(O)NH2;和各A分别为–O–、–N(H)–、其中ZZ是H、或氨基酸的侧链,如本发明其他地方所讨论。譬如,在一个实施方案,ZZ是C1-6烷基。作为另一实例,在一个实施方案,ZZ是C1-6杂烷基。在本段的特定实施方案中,A可衍生自伯胺化合物或其残基,其中X是–N3,如本发明其他地方所述。在这些实施方案中,1,2,3-三唑残基衍生自叠氮化物与本发明所述化合物或有效负载的炔烃或末端乙炔参与点击化学反应后的产物,如本发明其他地方所述。因此,在一个非限制性实施例中,A是或其混合物。或者,在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。如上所讨论,与所述结合剂连接的键可以是直接连接,或经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在以上任一个实施方案中,所述(AA)n基团可用一个或多个增强基团进行修饰。有利地,所述增强基团可连接至(AA)n中任何氨基酸的侧链。用于连接增强基团的有用氨基酸包括赖氨酸、天冬酰胺、天冬氨酸、谷氨酰胺、谷氨酸、和瓜氨酸。与增强基团的连接可以是与氨基酸侧链的直接连接,或者所述连接可以是经由间隔基和/或活性基团的间接连接。有用的间隔基团和活性基团包括任何上述基团。所述增强基团可以是本领域技术人员认为有用的任何基团。例如,所述增强基团可以是赋予化合物、有效负载、连接体有效负载、或抗体偶联物有益作用的任何基团,包括但不限于生物学、生化、合成、增溶、成像、检测、和反应性/活性方面作用等。在某些实施方案,所述增强基团是亲水基团。在某些实施方案,所述增强基团是环糊精。在某些实施方案,所述增强基团是烷基磺酸、杂烷基磺酸、亚烷基磺酸、亚杂烷基磺酸、亚杂烷基牛磺酸、亚杂烷基磷酸或磷酸盐/酯、亚杂烷基胺(例如季胺)、或亚杂烷基糖。在某些实施方案,糖包括但不限于单糖类、二糖类和多糖类。示例性单糖包括葡萄糖、核糖、脱氧核糖、木糖、阿拉伯糖、甘露糖、半乳糖、果糖等。在某些实施方案,糖包括糖酸类如葡糖醛酸,进一步包括偶联形式如葡糖苷酸类(即,经由葡糖醛酸化)。示例性二糖包括麦芽糖、蔗糖、乳糖、乳果糖、海藻糖等。示例性多糖包括直链淀粉、支链淀粉、糖原、菊粉、纤维素等。环糊精可以是技术人员已知的任何环糊精。在某些实施方案,所述环糊精是α-环糊精、β-环糊精、或γ-环糊精、或其混合物。在某些实施方案,所述环糊精是α-环糊精。在某些实施方案,所述环糊精是β-环糊精。在某些实施方案,所述环糊精是γ-环糊精。在某些实施方案,所述增强基团能够改善偶联物其余部分的溶解性。在某些实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是取代的或未取代的。在某些实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)1-5SO3H,–(CH2)n–NH-(CH2)1-5SO3H,–(CH2)n–C(O)NH-(CH2)1-5SO3H,–(CH2CH2O)m–C(O)NH-(CH2)1-5SO3H,–(CH2)n–N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,–(CH2)n–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,或–(CH2CH2O)m–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5,和m是1、2、3、4、或5。在一个实施方案,所述烷基磺酸、或亚烷基磺酸是–(CH2)1-5SO3H。在另一实施方案,所述杂烷基磺酸、或亚杂烷基磺酸是–(CH2)n–NH-(CH2)1-5SO3H,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–C(O)NH-(CH2)1-5SO3H,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2CH2O)m–C(O)NH-(CH2)1-5SO3H,其中m是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2CH2O)m–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中m是1、2、3、4、或5。在一些实施方案,所述连接体是:其中:SP1是间隔基团;SP2是间隔基团;SP3是间隔基团,连接至(AA)n中的一个AA;是与所述结合剂连接的一个或多个键;是与所述有效负载连接的一个或多个键;是与所述增强基团EG连接的一个或多个键;各AA分别为氨基酸;和n是从1至10的整数。如上所讨论,与所述结合剂连接的键可以是直接连接、也可以是经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。SP1间隔基团具有如上所述定义。SP2间隔基团具有如上所述定义。各(AA)n基团分别具有如上所述定义。SP3间隔基团是将(AA)n部分连接至增强基团(EG)的基团部分。合适的SP3间隔基团包括但不限于包含亚烷基或聚醚、或亚烷基和聚醚两者的那些。SP3间隔基团的末端(即,直接连接至增强基团或AA的SP3间隔基团的部分)可以是衍生自活性基团部分的基团部分,其用于在化学合成偶联物的过程中将增强基团或AA与SP3间隔基团偶联的目的。在一些实施例,SP3间隔基团的末端(即,直接连接至增强基团或AA的间隔基团的部分)可以是活性基团部分的残基,其用于在化学合成偶联物的过程中将增强基团或AA与间隔基团偶联的目的。在某些实施方案,SP3是间隔基团,连接至(AA)n中的一个且仅一个AA。在某些实施方案,SP3间隔基团连接至(AA)n的赖氨酸残基的侧链。在一些实施方案,SP3间隔基团是:其中:RG'是活性基团RG与增强剂EG反应后的活性基团残基;是与所述增强剂连接的键;是与(AA)n连接的键;a是从2至8的整数;和n是从1至4的整数。活性基团RG可以是本领域技术人员已知的能够与增强剂连接形成一个或多个键的任何活性基团。活性基团RG是在其结构中包含能够与增强基团反应以形成式LPa、LPb、LPc、LPd、LPa′、LPb′、LPc′、LPd′、A、B、C、D、A′、B′、C′、D′、或A″所示化合物的部分的基团部分。与增强基团偶联后,活性基团成为活性基团残基(RG')。活性基团RG可以是上述任何活性基团。示例性活性基团包括但不限于,包含能够与结合剂反应的卤代乙酰基、异硫氰酸酯基、琥珀酰亚胺、N-羟基琥珀酰亚胺、或马来酰亚胺部分的那些活性基团。在某些实施方案,活性基团包括但不限于炔烃类。在某些实施方案,所述炔烃是在不存在铜催化剂的情况下能够与叠氮化物进行1,3-环加成反应的炔烃,如应变炔烃类。应变炔烃是适于应变促进的炔-叠氮化物环加成(SPAAC)的那些,环炔烃类,例如环辛炔类,和苯并环化的炔烃类。合适的炔烃类包括但不限于,二苯并氮杂环辛炔或二苯并环辛炔或二芳基氮杂环辛炔酮或二氟化环辛炔或取代的,例如氟化炔烃类,氮杂-环炔烃类,二环[6.1.0]壬炔或及其衍生物。特别有用的炔烃包括在一些实施方案,所述连接体是:其中:RG'是活性基团RG与结合剂反应后的活性基团残基;PEG是–NH–PEG4–C(O)–;SP2是间隔基团;SP3是间隔基团,连接至(AA)n中的一个AA;是与所述结合剂连接的一个或多个键;是与所述有效负载连接的一个或多个键;是与所述增强基团EG连接的一个或多个键;各AA分别为氨基酸残基;和n是从1至10的整数。如上所讨论,与所述结合剂连接的键可以是直接连接、或经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在某些实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物,其中:各分别为与所述结合剂连接的键;各分别为与所述有效负载连接的键;各分别为与所述增强剂连接的键;各R9分别为–CH3或–(CH2)3N(H)C(O)NH2;和各A分别为–O–、–N(H)–、其中ZZ是H、或氨基酸的侧链,如本发明其他地方所讨论。譬如,在一个实施方案,ZZ是C1-6烷基。作为另一实例,在一个实施方案,ZZ是C1-6杂烷基。在本段的特定实施方案中,A可衍生自伯胺化合物或其残基,其中X是–N3,如本发明其他地方所述。在这些实施方案中,1,2,3-三唑残基衍生自叠氮化物与本发明所述化合物或有效负载的炔烃或末端乙炔参与点击化学反应后的产物,如本发明其他地方所述。因此,在一个非限制性实施例中,A是或其混合物。或者,在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在某些实施方案,1,3-环加成或SPAAC区域异构体、或区域异构体的混合物,衍生自用合适的炔烃处理的PEG-N3衍生化抗体。譬如,在一个实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物。作为另一实例,在一个实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物。作为另一实例,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物。作为另一实例,在一个实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物。如上所述,与所述结合剂连接的键可以是直接连接、也可以是经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在某些实施方案,所述增强剂是亲水基团。在某些实施方案,所述增强剂是环糊精。在某些实施方案,所述增强基团是烷基磺酸、杂烷基磺酸、亚烷基磺酸、亚杂烷基磺酸、亚杂烷基牛磺酸、亚杂烷基磷酸或磷酸盐/酯、亚杂烷基胺(例如季胺)、或亚杂烷基糖。在某些实施方案,糖包括但不限于单糖类、二糖类和多糖类。示例性单糖包括葡萄糖、核糖、脱氧核糖、木糖、阿拉伯糖、甘露糖、半乳糖、果糖等。在某些实施方案,糖包括糖酸类如葡糖醛酸,进一步包括偶联形式如葡糖苷酸类(即,经由葡糖醛酸化)。示例性二糖包括麦芽糖、蔗糖、乳糖、乳果糖、海藻糖等。示例性多糖包括直链淀粉、支链淀粉、糖原、菊粉、纤维素等。环糊精可以是技术人员已知的任何环糊精。在某些实施方案,所述环糊精是α-环糊精、β-环糊精、或γ-环糊精、或其混合物。在某些实施方案,所述环糊精是α-环糊精。在某些实施方案,所述环糊精是β-环糊精。在某些实施方案,所述环糊精是γ-环糊精。在某些实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)1-5SO3H,–(CH2)n–NH-(CH2)1-5SO3H,–(CH2)n–C(O)NH-(CH2)1-5SO3H,–(CH2CH2O)m–C(O)NH-(CH2)1-5SO3H,–(CH2)n–N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,–(CH2)n–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,或–(CH2CH2O)m–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5,和m是1、2、3、4、或5。在一个实施方案,所述烷基磺酸、或亚烷基磺酸是–(CH2)1-5SO3H。在另一实施方案,所述杂烷基磺酸、或亚杂烷基磺酸是–(CH2)n–NH-(CH2)1-5SO3H,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–C(O)NH-(CH2)1-5SO3H,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2CH2O)m–C(O)NH-(CH2)1-5SO3H,其中m是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2CH2O)m–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中m是1、2、3、4、或5。在一些实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物,其中:各分别为与所述结合剂连接的键;各分别为与所述增强剂连接的键;各分别为与所述有效负载连接的键;各R9分别为–CH3或–(CH2)3N(H)C(O)NH2;和各A分别为–O–、–N(H)–、其中ZZ是H、或氨基酸的侧链,如本发明其他地方所讨论。譬如,在一个实施方案,ZZ是C1-6烷基。作为另一实例,在一个实施方案,ZZ是C1-6杂烷基。在本段的特定实施方案中,A可衍生自伯胺化合物或其残基,其中X是–N3,如本发明其他地方所述。在这些实施方案中,1,2,3-三唑残基衍生自叠氮化物与本发明所述化合物或有效负载的炔烃或末端乙炔参与点击化学反应后的产物,如本发明其他地方所述。因此,在一个非限制性实施例中,A是或其混合物。或者,在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。如上所讨论,与所述结合剂连接的键可以是直接连接,或经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在某些实施方案,所述增强剂是亲水基团。在某些实施方案,所述增强剂是环糊精。在某些实施方案,所述增强基团是烷基磺酸、杂烷基磺酸、亚烷基磺酸、亚杂烷基磺酸、亚杂烷基牛磺酸、亚杂烷基磷酸或磷酸盐/酯、亚杂烷基胺(例如季胺)、或亚杂烷基糖。在某些实施方案,糖包括但不限于单糖类、二糖类和多糖类。示例性单糖包括葡萄糖、核糖、脱氧核糖、木糖、阿拉伯糖、甘露糖、半乳糖、果糖等。在某些实施方案,糖包括糖酸类如葡糖醛酸,进一步包括偶联形式如葡糖苷酸类(即,经由葡糖醛酸化)。示例性二糖包括麦芽糖、蔗糖、乳糖、乳果糖、海藻糖等。示例性多糖包括直链淀粉、支链淀粉、糖原、菊粉、纤维素等。环糊精可以是技术人员已知的任何环糊精。在某些实施方案,所述环糊精是α-环糊精、β-环糊精、或γ-环糊精、或其混合物。在某些实施方案,所述环糊精是α-环糊精。在某些实施方案,所述环糊精是β-环糊精。在某些实施方案,所述环糊精是γ-环糊精。在某些实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)1-5SO3H,–(CH2)n–NH-(CH2)1-5SO3H,–(CH2)n–C(O)NH-(CH2)1-5SO3H,–(CH2CH2O)m–C(O)NH-(CH2)1-5SO3H,–(CH2)n–N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,–(CH2)n–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,或–(CH2CH2O)m–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5,和m是1、2、3、4、或5。在一个实施方案,所述烷基磺酸、或亚烷基磺酸是–(CH2)1-5SO3H。在另一实施方案,所述杂烷基磺酸、或亚杂烷基磺酸是–(CH2)n–NH-(CH2)1-5SO3H,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–C(O)NH-(CH2)1-5SO3H,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2CH2O)m–C(O)NH-(CH2)1-5SO3H,其中m是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2CH2O)m–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中m是1、2、3、4、或5。在一些实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物,其中:各分别为与所述结合剂连接的键;各分别为与所述有效负载连接的键;R9是–CH3或–(CH2)3N(H)C(O)NH2;和A是–O–、–N(H)–、其中ZZ是H、或氨基酸的侧链,如本发明其他地方所讨论。譬如,在一个实施方案,ZZ是C1-6烷基。作为另一实例,在一个实施方案,ZZ是C1-6杂烷基。在本段的特定实施方案中,A可衍生自伯胺化合物或其残基,其中X是–N3,如本发明其他地方所述。在这些实施方案中,1,2,3-三唑残基衍生自叠氮化物与本发明所述化合物或有效负载的炔烃或末端乙炔参与点击化学反应后的产物,如本发明其他地方所述。因此,在一个非限制性实施例中,A是或其混合物。或者,在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。如上所讨论,与所述结合剂连接的键可以是直接连接,或经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在一些实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物,其中:各分别为与所述结合剂连接的键;各分别为与所述有效负载连接的键;R9是–CH3或–(CH2)3N(H)C(O)NH2;和A是–O–、–N(H)–、其中ZZ是H、或氨基酸的侧链,如本发明其他地方所讨论。譬如,在一个实施方案,ZZ是C1-6烷基。作为另一实例,在一个实施方案,ZZ是C1-6杂烷基。在本段的特定实施方案中,A可衍生自伯胺化合物或其残基,其中X是–N3,如本发明其他地方所述。在这些实施方案中,1,2,3-三唑残基衍生自叠氮化物与本发明所述化合物或有效负载的炔烃或末端乙炔参与点击化学反应后的产物,如本发明其他地方所述。因此,在一个非限制性实施例中,A是或其混合物。或者,在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。如上所讨论,与所述结合剂连接的键可以是直接连接,或经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在一些实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物,其中:各分别为与所述结合剂连接的键;各分别为与所述有效负载连接的键;各分别为与所述增强基团连接的键;各R9分别为–CH3或–(CH2)3N(H)C(O)NH2;和各A分别为–O–、–N(H)–、其中ZZ是H、或氨基酸的侧链,如本发明其他地方所讨论。譬如,在一个实施方案,ZZ是C1-6烷基。作为另一实例,在一个实施方案,ZZ是C1-6杂烷基。在本段的特定实施方案中,A可衍生自伯胺化合物或其残基,其中X是–N3,如本发明其他地方所述。在这些实施方案中,1,2,3-三唑残基衍生自叠氮化物与本发明所述化合物或有效负载的炔烃或末端乙炔参与点击化学反应后的产物,如本发明其他地方所述。因此,在一个非限制性实施例中,A是或其混合物。或者,在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。如上所讨论,与所述结合剂连接的键可以是直接连接,或经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在某些实施方案,所述增强剂是亲水基团。在某些实施方案,所述增强剂是环糊精。在某些实施方案,所述增强基团是烷基磺酸、杂烷基磺酸、亚烷基磺酸、亚杂烷基磺酸、亚杂烷基牛磺酸、亚杂烷基磷酸或磷酸盐/酯、亚杂烷基胺(例如季胺)、或亚杂烷基糖。在某些实施方案,糖包括但不限于单糖类、二糖类和多糖类。示例性单糖包括葡萄糖、核糖、脱氧核糖、木糖、阿拉伯糖、甘露糖、半乳糖、果糖等。在某些实施方案,糖包括糖酸类如葡糖醛酸,进一步包括偶联形式如葡糖苷酸类(即,经由葡糖醛酸化)。示例性二糖包括麦芽糖、蔗糖、乳糖、乳果糖、海藻糖等。示例性多糖包括直链淀粉、支链淀粉、糖原、菊粉、纤维素等。环糊精可以是技术人员已知的任何环糊精。在某些实施方案,所述环糊精是α-环糊精、β-环糊精、或γ-环糊精、或其混合物。在某些实施方案,所述环糊精是α-环糊精。在某些实施方案,所述环糊精是β-环糊精。在某些实施方案,所述环糊精是γ-环糊精。在某些实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)1-5SO3H,–(CH2)n–NH-(CH2)1-5SO3H,–(CH2)n–C(O)NH-(CH2)1-5SO3H,–(CH2CH2O)m–C(O)NH-(CH2)1-5SO3H,–(CH2)n–N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,–(CH2)n–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,或–(CH2CH2O)m–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5,和m是1、2、3、4、或5。在一个实施方案,所述烷基磺酸、或亚烷基磺酸是–(CH2)1-5SO3H。在另一实施方案,所述杂烷基磺酸、或亚杂烷基磺酸是–(CH2)n–NH-(CH2)1-5SO3H,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–C(O)NH-(CH2)1-5SO3H,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2CH2O)m–C(O)NH-(CH2)1-5SO3H,其中m是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2CH2O)m–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中m是1、2、3、4、或5。在一些实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物,其中:各分别为与所述结合剂连接的键;各分别为与所述有效负载连接的键;各R9分别为–CH3或–(CH2)3N(H)C(O)NH2;和各A分别为–O–、–N(H)–、其中ZZ是H、或氨基酸的侧链,如本发明其他地方所讨论。譬如,在一个实施方案,ZZ是C1-6烷基。作为另一实例,在一个实施方案,ZZ是C1-6杂烷基。在本段的特定实施方案中,A可衍生自伯胺化合物或其残基,其中X是–N3,如本发明其他地方所述。在这些实施方案中,1,2,3-三唑残基衍生自叠氮化物与本发明所述化合物或有效负载的炔烃或末端乙炔参与点击化学反应后的产物,如本发明其他地方所述。因此,在一个非限制性实施例中,A是或其混合物。或者,在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。如上所讨论,与所述结合剂连接的键可以是直接连接,或经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在某些实施方案,所述增强剂是亲水基团。在某些实施方案,所述增强剂是环糊精。在某些实施方案,所述增强基团是烷基磺酸、杂烷基磺酸、亚烷基磺酸、亚杂烷基磺酸、亚杂烷基牛磺酸、亚杂烷基磷酸或磷酸盐/酯、亚杂烷基胺(例如季胺)、或亚杂烷基糖。在某些实施方案,糖包括但不限于单糖类、二糖类和多糖类。示例性单糖包括葡萄糖、核糖、脱氧核糖、木糖、阿拉伯糖、甘露糖、半乳糖、果糖等。在某些实施方案,糖包括糖酸类如葡糖醛酸,进一步包括偶联形式如葡糖苷酸类(即,经由葡糖醛酸化)。示例性二糖包括麦芽糖、蔗糖、乳糖、乳果糖、海藻糖等。示例性多糖包括直链淀粉、支链淀粉、糖原、菊粉、纤维素等。环糊精可以是技术人员已知的任何环糊精。在某些实施方案,所述环糊精是α-环糊精、β-环糊精、或γ-环糊精、或其混合物。在某些实施方案,所述环糊精是α-环糊精。在某些实施方案,所述环糊精是β-环糊精。在某些实施方案,所述环糊精是γ-环糊精。在某些实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)1-5SO3H,–(CH2)n–NH-(CH2)1-5SO3H,–(CH2)n–C(O)NH-(CH2)1-5SO3H,–(CH2CH2O)m–C(O)NH-(CH2)1-5SO3H,–(CH2)n–N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,–(CH2)n–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,或–(CH2CH2O)m–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5,和m是1、2、3、4、或5。在一个实施方案,所述烷基磺酸、或亚烷基磺酸是–(CH2)1-5SO3H。在另一实施方案,所述杂烷基磺酸、或亚杂烷基磺酸是–(CH2)n–NH-(CH2)1-5SO3H,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–C(O)NH-(CH2)1-5SO3H,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2CH2O)m–C(O)NH-(CH2)1-5SO3H,其中m是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2)n–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中n是1、2、3、4、或5。在另一实施方案,所述烷基磺酸、杂烷基磺酸、亚烷基磺酸、或亚杂烷基磺酸是–(CH2CH2O)m–C(O)N((CH2)1-5C(O)NH(CH2)1-5SO3H)2,其中m是1、2、3、4、或5。在一些实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物,其中:各分别为与所述结合剂连接的键;各分别为与所述有效负载连接的键;R9是–CH3或–(CH2)3N(H)C(O)NH2;和A是–O–、–N(H)–、其中ZZ是H、或氨基酸的侧链,如本发明其他地方所讨论。譬如,在一个实施方案,ZZ是C1-6烷基。作为另一实例,在一个实施方案,ZZ是C1-6杂烷基。在本段的特定实施方案中,A可衍生自伯胺化合物或其残基,其中X是–N3,如本发明其他地方所述。在这些实施方案中,1,2,3-三唑残基衍生自叠氮化物与本发明所述化合物或有效负载的炔烃或末端乙炔参与点击化学反应后的产物,如本发明其他地方所述。因此,在一个非限制性实施例中,A是或其混合物。或者,在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。如上所讨论,与所述结合剂连接的键可以是直接连接,或经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在一些实施方案,所述连接体是:或其药学上可接受的盐、溶剂化物、或立体异构体形式,或其区域异构体,或其区域异构体的混合物,其中:各分别为与所述结合剂连接的键;各分别为与所述有效负载连接的键;R9是–CH3或–(CH2)3N(H)C(O)NH2;和A是–O–、–N(H)–、其中ZZ是H、或氨基酸的侧链,如本发明其他地方所讨论。譬如,在一个实施方案,ZZ是C1-6烷基。作为另一实例,在一个实施方案,ZZ是C1-6杂烷基。在本段的特定实施方案中,A可衍生自伯胺化合物或其残基,其中X是–N3,如本发明其他地方所述。在这些实施方案中,1,2,3-三唑残基衍生自叠氮化物与本发明所述化合物或有效负载的炔烃或末端乙炔参与点击化学反应后的产物,如本发明其他地方所述。因此,在一个非限制性实施例中,A是或其混合物。或者,在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。在另一实施方案,A是或其混合物。如上所讨论,与所述结合剂连接的键可以是直接连接,或经由间隔基团连接。在某些实施方案,与所述结合剂连接的键是经由PEG间隔基团连接至所述结合剂的谷氨酰胺残基。在特定实施方案,本发明公开的具有炔烃或末端乙炔的化合物或有效负载可连接至结合剂,所述结合剂采用连接至谷氨酰胺残基的–PEG-N3衍生得到。本发明提供了示例性–N3衍生的结合剂、其制备方法和其使用方法。在某些实施方案,具有本发明所述炔烃的化合物或有效负载适合与用–PEG-N3衍生的结合剂参与1,3-环加成以提供区域异构的1,2,3-三唑基连接基团部分。譬如,在某些实施方案,连接至所述结合剂的化合物或有效负载可以是或其混合物,其中各分别为与所述结合剂连接的键。连接体-有效负载在某些实施方案,连接体-有效负载包括由上述式I、II、III、IV、V、VI、VII、VIII、IX、X、XI或XII中的任一个或多个所包含的与连接体连接的任何特定化合物,其中本发明所述连接体包括与本发明所述抗体或其抗原结合片段反应的基团部分。在特定实施方案,所述连接体与上述式I、II、III、IV、V、VI、VII、VIII、IX、X、XI或XII中任一个或多个中的所述哌啶氮、R2、R6、或R7连接。在一个实施方案,所述连接体-有效负载具有式LPa′所示结构:其中SP1、(AA)p、SP2、R1、Q、Q1、R2、R3、R4、R5、R6、R7和R8均如本发明公开的任一实施方案中所述。在一个实施方案,所述连接体-有效负载具有式LPb′所示结构:其中SP1、(AA)p、SP2、R1、Q、Q1、R2、R3、R4、R5、R6、R7和R8均如本发明公开的任一实施方案中所述。在一个实施方案,所述连接体-有效负载具有式LPc′所示结构:其中SP1、(AA)p、SP2、R1、Q、Q1、R2、R3、R4、R5、R6、R7和R8均如本发明公开的任一实施方案中所述。在一个实施方案,所述连接体-有效负载具有式LPd′所示结构:其中SP1、(AA)p、SP2、R1、Q、Q1、R2、R3、R4、R5、R6、R7和R8均如本发明公开的任一实施方案中所述。在本段的任一实施方案中,式LPa′、LPb′、LPc′、或LPd′可以是其药学上可接受的盐。在本段的任一实施方案中,p是1、2、3、4、5、6、7、8、9、或10。在任一前述实施方案中,芳基包含苯基、萘基、芴基、薁基、蒽基、菲基、和芘基;杂芳基包含呋喃基、噻吩基、吡咯基、噁唑基、噻唑基、咪唑基、吡唑基、异噁唑基、异噻唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、喹啉基、异喹啉基、噌啉基、喹唑啉基、喹喔啉基、酞嗪基、蝶啶基、苯并呋喃基、二苯并呋喃基、苯并噻吩基、苯并噁唑基、苯并噻唑基、二苯并噻吩基、吲哚基、吲哚啉基、苯并咪唑基、吲唑基、和苯并三唑基;和酰基包含–C(O)R3c,其中R3c包含烷基、烯基、炔基、环烷基、芳基、和杂芳基。在一个实施方案,芳基是苯基。在一个实施方案,芳基是萘基。在一个实施方案,芳基是芴基。在一个实施方案,芳基是薁基。在一个实施方案,芳基是蒽基。在一个实施方案,芳基是菲基。在一个实施方案,芳基是芘基。在一个实施方案,杂芳基是呋喃基。在一个实施方案,杂芳基是噻吩基。在一个实施方案,杂芳基是吡咯基。在一个实施方案,杂芳基是噁唑基。在一个实施方案,杂芳基是噻唑基。在一个实施方案,杂芳基是咪唑基。在一个实施方案,杂芳基是吡唑基。在一个实施方案,杂芳基是异噁唑基。在一个实施方案,杂芳基是异噻唑基。在一个实施方案,杂芳基是吡啶基。在一个实施方案,杂芳基是吡嗪基。在一个实施方案,杂芳基是嘧啶基。在一个实施方案,杂芳基是哒嗪基。在一个实施方案,杂芳基是喹啉基。在一个实施方案,杂芳基是异喹啉基。在一个实施方案,杂芳基是噌啉基。在一个实施方案,杂芳基是喹唑啉基。在一个实施方案,杂芳基是喹喔啉基。在一个实施方案,杂芳基是酞嗪基。在一个实施方案,杂芳基是蝶啶基。在一个实施方案,杂芳基是苯并呋喃基。在一个实施方案,杂芳基是二苯并呋喃基。在一个实施方案,杂芳基是苯并噻吩基。在一个实施方案,杂芳基是苯并噁唑基。在一个实施方案,杂芳基是苯并噻唑基。在一个实施方案,杂芳基是二苯并噻吩基。在一个实施方案,杂芳基是吲哚基。在一个实施方案,杂芳基是吲哚啉基。在一个实施方案,杂芳基是苯并咪唑基。在一个实施方案,杂芳基是吲唑基。在一个实施方案,杂芳基是苯并三唑基。在一个实施方案,酰基是–C(O)R3c,和R3c是烷基。在一个实施方案,酰基是–C(O)R3c,和R3c是烯基。在一个实施方案,酰基是–C(O)R3c,和R3c是炔基。在一个实施方案,酰基是–C(O)R3c,和R3c是环烷基。在一个实施方案,酰基是–C(O)R3c,和R3c是芳基。在一个实施方案,酰基是–C(O)R3c,和R3c是杂芳基。在本章节的任一前述实施方案中,R7是–NR7aR7b,其中R7a和R7b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、酰基、和氨基酸残基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在某些实施方案,R7a是H,和R7b是氨基酸残基。偶联物/抗体药物偶联物(ADC)本发明提供了抗体或其抗原结合片段,其中所述抗体与一种或多种本发明所述的式I、II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII的化合物偶联。本发明提供了式A所示偶联物:或其药学上可接受的盐、溶剂化物、区域异构体形式、或立体异构体形式,其中,R1、Q、Q1、R2、R3、R4、R5、R6、R7、R8、R9和m均如上文在式I的上下文中所述,BA是结合剂,L是连接体,和k是1、2、3、4、5、6、7、8、9、或10。在某些实施方案,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在某些实施方案,与式A中—L—BA偶联的化合物包含一个或多个上述式II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII的化合物,其中BA是结合剂;L是连接体;和k是1、2、3、4、5、6、7、8、9、或10。在某些实施方案,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式I的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式II的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式III的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式IV的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式V的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VI的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VII的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VIII的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式IX的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式X的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式XI的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式XII的化合物,如上所述。在本段的任一实施方案中,与式A中—L—BA偶联的任一个或多个式I、II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII的化合物通过所述哌啶氮进行偶联。本发明提供了式B所示偶联物:或其药学上可接受的盐、溶剂化物、区域异构体形式、或立体异构体形式,其中,R1、Q、Q1、R2、R3、R4、R5、R6、R7、R8、R9和m均如上文在式I的上下文中所述,BA是结合剂,L是连接体,和k是1、2、3、4、5、6、7、8、9、或10。在某些实施方案,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在某些实施方案,与式B中—L—BA偶联的化合物包含一个或多个上述式II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII的化合物,其中BA是结合剂;L是连接体;和k是1、2、3、4、5、6、7、8、9、或10。在某些实施方案,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式I的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式II的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式III的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式IV的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式V的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VI的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VII的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VIII的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式IX的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式X的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式XI的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式XII的化合物,如上所述。在本段的任一实施方案中,与式B中—L—BA偶联的任一个或多个式I、II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII的化合物通过二价R6进行偶联。本发明提供了式C所示偶联物:或其药学上可接受的盐、溶剂化物、区域异构体形式、或立体异构体形式,其中,R1、Q、Q1、R2、R3、R4、R5、R6、R7、R8、R9和m均如上文在式I的上下文中所述,BA是结合剂,L是连接体,和k是1、2、3、4、5、6、7、8、9、或10。在某些实施方案,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在某些实施方案,与式C中—L—BA偶联的化合物包含一个或多个上述式II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII的化合物,其中BA是结合剂;L是连接体;和k是1、2、3、4、5、6、7、8、9、或10。在某些实施方案,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式I的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式II的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式III的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式IV的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式V的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VI的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VII的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VIII的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式IX的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式X的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式XI的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式XII的化合物,如上所述。在本段的任一实施方案中,与式C中—L—BA偶联的任一个或多个式I、II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII的化合物通过二价R7进行偶联。本发明提供了式D所示偶联物:或其药学上可接受的盐、溶剂化物、区域异构体形式、或立体异构体形式,其中,R1、Q、Q1、R2、R3、R4、R5、R6、R7、R8、R9和m均如上文在式I的上下文中所述,BA是结合剂,L是连接体,和k是1、2、3、4、5、6、7、8、9、或10。在某些实施方案,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在某些实施方案,与式D中—L—BA偶联的化合物包含一个或多个上述式II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII的化合物,其中BA是结合剂;L是连接体;和k是1、2、3、4、5、6、7、8、9、或10。在某些实施方案,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式I的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式II的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式III的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式IV的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式V的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VI的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VII的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式VIII的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式IX的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式X的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式XI的化合物,如上所述。在本段的任一实施方案中,BA是抗体、或其抗原结合片段,其中所述抗体偶联至式XII的化合物,如上所述。在本段的任一实施方案中,与式D中—L—BA偶联的任一个或多个式I、II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII的化合物通过二价R2进行偶联。在式B的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是C1-C10烷基;R2是C5-C10烷基;R3是–C(O)C1-C5烷基;R4是H;R5是C1-C5烷基;R6是–NHNH–;R7是卤素;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在式B的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4是H;R5是甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R6是–NHNH–;R7是F、Cl、Br、或I;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在一个实施方案,式B的偶联物包含式Bi:其中BA是结合剂;L是连接体;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R5是甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R7是F、Cl、Br、或I;和k是1、2、3、或4。在式Bi的一个实施方案中,BA是结合剂;L是连接体;R1是甲基;R2是戊基、及其构造异构体;R3是–C(O)CH3;R5是甲基;R7是F、Cl、Br、或I;和k是1、2、3、或4。在一个实施方案,式B的偶联物包括下列偶联物:其中BA是结合剂;和k是1、2、3、或4。在本段的任一实施方案中,BA是抗体、或其抗原结合片段。在本段的任一实施方案中,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,k是1。在本段的任一实施方案中,k是2。在本段的任一实施方案中,k是3。在本段的任一实施方案中,k是4。在式B的一个实施方案中,BA是结合剂;L是连接体;Q是–O–;R1是C1-C10烷基;R2是C5-C10烷基;R3是–C(O)C1-C5烷基;R4是H;R5是C1-C5烷基;R6是–NHNH–;R7是–OH;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在式B的一个实施方案中,BA是结合剂;L是连接体;Q是–O–;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4是H;R5是甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R6是–NHNH–;R7是–OH;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在一个实施方案,式B的偶联物包含式Bii:其中BA是结合剂;L是连接体;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R5是甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R7是–OH;和k是1、2、3、或4。在式Bii的一个实施方案中,BA是结合剂;L是连接体;R1是甲基;R2是戊基、及其构造异构体;R3是–C(O)CH3;R5是甲基;R7是–OH;和k是1、2、3、或4。在一个实施方案,式B的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在本段的任一实施方案中,BA是抗体、或其抗原结合片段。在本段的任一实施方案中,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,k是1。在本段的任一实施方案中,k是2。在本段的任一实施方案中,k是3。在本段的任一实施方案中,k是4。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是C1-C10烷基;R2是C5-C10炔基;R3是–C(O)C1-C5烷基;R4和R5分别独立地为C1-C5烷基;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊炔基、己炔基、庚炔基、辛炔基、壬炔基、或癸炔基;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在一个实施方案,式C的偶联物包含式Ci:其中BA是结合剂;L是连接体;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊炔基、己炔基、庚炔基、辛炔基、壬炔基、或癸炔基;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R7是–NH–;和k是1、2、3、或4。在式Ci的一个实施方案中,BA是结合剂;L是连接体;R1是甲基;R2是戊炔基;R3是–C(O)CH3;R4和R5均为甲基;R7是–NH–;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在本段的任一实施方案中,BA是抗体、或其抗原结合片段。在本段的任一实施方案中,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,k是1。在本段的任一实施方案中,k是2。在本段的任一实施方案中,k是3。在本段的任一实施方案中,k是4。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–O–;R1是C1-C10烷基;R2是C5-C10炔基;R3是–C(O)C1-C5烷基;R4和R5分别独立地为C1-C5烷基;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–O–;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊炔基、己炔基、庚炔基、辛炔基、壬炔基、或癸炔基;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在一个实施方案,式C的偶联物包含式Cii:其中BA是结合剂;L是连接体;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊炔基、己炔基、庚炔基、辛炔基、壬炔基、或癸炔基;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R7是–NH–;和k是1、2、3、或4。在式Cii的一个实施方案中,BA是结合剂;L是连接体;R1是甲基;R2是戊炔基;R3是–C(O)CH3;R4和R5均为甲基;R7是–NH–;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在本段的任一实施方案中,BA是抗体、或其抗原结合片段。在本段的任一实施方案中,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,k是1。在本段的任一实施方案中,k是2。在本段的任一实施方案中,k是3。在本段的任一实施方案中,k是4。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是C1-C10烷基;R2是C5-C10炔基;R3是–C(O)C1-C5烷基;R4和R5分别独立地为C1-C5烷基;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊炔基、己炔基、庚炔基、辛炔基、壬炔基、或癸炔基;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在一个实施方案,式C的偶联物包含式Ci:其中BA是结合剂;L是连接体;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊炔基、己炔基、庚炔基、辛炔基、壬炔基、或癸炔基;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R7是–NH–;和k是1、2、3、或4。在式Ci的一个实施方案中,BA是结合剂;L是连接体;R1是甲基;R2是戊炔基;R3是–C(O)CH3;R4和R5均为甲基;R7是–NH–;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在本段的任一实施方案中,BA是抗体、或其抗原结合片段。在本段的任一实施方案中,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,k是1。在本段的任一实施方案中,k是2。在本段的任一实施方案中,k是3。在本段的任一实施方案中,k是4。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–O–;R1是C1-C10烷基;R2是C5-C10烷基;R3是–C(O)C1-C5烷基;R4和R5分别独立地为C1-C5烷基;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–O–;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在一个实施方案,式C的偶联物包含式Cii:其中BA是结合剂;L是连接体;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R7是–NH–;和k是1、2、3、或4。在式Cii的一个实施方案中,BA是结合剂;L是连接体;R1是甲基;R2是戊基;R3是–C(O)CH3;R4和R5均为甲基;R7是–NH–;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在本段的任一实施方案中,BA是抗体、或其抗原结合片段。在本段的任一实施方案中,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,k是1。在本段的任一实施方案中,k是2。在本段的任一实施方案中,k是3。在本段的任一实施方案中,k是4。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是C1-C10烷基;R2是C5-C10炔基;R3是–C(O)C1-C5烷基;R4和R5分别独立地为C1-C5烷基;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊炔基、己炔基、庚炔基、辛炔基、壬炔基、或癸炔基;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在一个实施方案,式C的偶联物包含式Ci:其中BA是结合剂;L是连接体;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊炔基、己炔基、庚炔基、辛炔基、壬炔基、或癸炔基;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R7是–NH–;和k是1、2、3、或4。在式Ci的一个实施方案中,BA是结合剂;L是连接体;R1是甲基;R2是戊炔基;R3是–C(O)CH3;R4和R5均为甲基;R7是–NH–;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在本段的任一实施方案中,BA是抗体、或其抗原结合片段。在本段的任一实施方案中,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,k是1。在本段的任一实施方案中,k是2。在本段的任一实施方案中,k是3。在本段的任一实施方案中,k是4。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是C1-C10烷基;R2是C5-C10烷基;R3是–C(O)C1-C5烷基;R4和R5分别独立地为C1-C5烷基;R6是–OH;R7是–NH–;R8是卤素;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R6是–OH;R7是–NH–;R8是卤素;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在一个实施方案,式C的偶联物包含式Ciii:其中BA是结合剂;L是连接体;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基;R3是–C(O)CH3、–C(O)CH2CH3、–C(O)CH2CH2CH3、–C(O)CH2CH2CH2CH3、或–C(O)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R7是–NH–;R8是卤素;m是1;和k是1、2、3、或4。在式Ciii的一个实施方案中,BA是结合剂;L是连接体;R1是甲基;R2是戊基;R3是–C(O)CH3;R4和R5均为甲基;R7是–NH–;R8是卤素;m是1;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括:其中BA是结合剂;和k是1、2、3、或4。在本段的任一实施方案中,BA是抗体、或其抗原结合片段。在本段的任一实施方案中,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,k是1。在本段的任一实施方案中,k是2。在本段的任一实施方案中,k是3。在本段的任一实施方案中,k是4。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–O–;R1是C1-C10烷基;R2是C5-C10烷基;R3是–C(O)N(H)C1-C10烷基;R4和R5分别独立地为C1-C5烷基;R6是–OH;R7是–NH–;R8是卤素;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–O–;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R3是–C(O)N(H)CH3、–C(O)N(H)CH2CH3、–C(O)N(H)CH2CH2CH3、–C(O)N(H)CH2CH2CH2CH3、或–C(O)N(H)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R6是–OH;R7是–NH–;R8是H;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在一个实施方案,式C的偶联物包含式Cii:其中BA是结合剂;L是连接体;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R3是–C(O)N(H)CH3、–C(O)N(H)CH2CH3、–C(O)N(H)CH2CH2CH3、–C(O)N(H)CH2CH2CH2CH3、或–C(O)N(H)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R7是–NH–;和k是1、2、3、或4。在式Cii的一个实施方案中,BA是结合剂;L是连接体;R1是甲基;R2是戊基;R3是–C(O)N(H)CH3;R4和R5均为甲基;R7是–NH–;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在本段的任一实施方案中,BA是抗体、或其抗原结合片段。在本段的任一实施方案中,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,k是1。在本段的任一实施方案中,k是2。在本段的任一实施方案中,k是3。在本段的任一实施方案中,k是4。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是C1-C10烷基;R2是C5-C10烷基;R3是–C(O)N(H)C1-C5烷基;R4和R5分别独立地为C1-C5烷基;R6是–OH;R7是–NH–;R8是卤素;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在式C的一个实施方案中,BA是结合剂;L是连接体;Q是–CH2–;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基;R3是–C(O)N(H)CH3、–C(O)N(H)CH2CH3、–C(O)N(H)CH2CH2CH3、–C(O)N(H)CH2CH2CH2CH3、或–C(O)N(H)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R6是–OH;R7是–NH–;R8是卤素;m是1;和k是1、2、3、4、5、6、7、8、9、或10。在一个实施方案,式C的偶联物包含式Ciii:其中BA是结合剂;L是连接体;R1是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、或癸基,及其构造异构体;R2是戊基、己基、庚基、辛基、壬基、或癸基;R3是–C(O)N(H)CH3、–C(O)N(H)CH2CH3、–C(O)N(H)CH2CH2CH3、–C(O)N(H)CH2CH2CH2CH3、或–C(O)N(H)CH2CH2CH2CH2CH3;R4和R5分别独立地为甲基、乙基、丙基、丁基、或戊基,及其构造异构体;R7是–NH–;R8是卤素;m是1;和k是1、2、3、或4。在式Ciii的一个实施方案中,BA是结合剂;L是连接体;R1是甲基;R2是戊基;R3是–C(O)N(H)CH3;R4和R5均为甲基;R7是–NH–;R8是卤素;m是1;和k是1、2、3、或4。在一个实施方案,式C的偶联物包括选自由下列组成的组的化合物:其中BA是结合剂;和k是1、2、3、或4。在本段的任一实施方案中,BA是抗体、或其抗原结合片段。在本段的任一实施方案中,k是1-2、1-3、2-3、2-4、3-4或1-4的范围。在本段的任一实施方案中,k是1。在本段的任一实施方案中,k是2。在本段的任一实施方案中,k是3。在本段的任一实施方案中,k是4。在某些实施方案,抗体或其抗原结合片段可直接偶联至式I、II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII中的任一个或多个,如本发明所述。在一个实施方案,抗体-药物偶联物包括抗体或其抗原结合片段,所述抗体或其抗原结合片段偶联至选自由以下组成的组的式I、II、III、IV、V、VI、VII、VIII、IX、X、XI、和/或XII中的任一个或多个,如本发明所述:在一个实施方案,抗体-药物偶联物包括偶联至下式的抗体或其抗原结合片段:在一个实施方案,抗体-药物偶联物包括偶联至下式的抗体或其抗原结合片段:在一个实施方案,抗体-药物偶联物包括偶联至下式的抗体或其抗原结合片段:在一个实施方案,抗体-药物偶联物包括偶联至下式的抗体或其抗原结合片段:在一个实施方案,抗体-药物偶联物包括偶联至下式的抗体或其抗原结合片段:在一个实施方案,抗体-药物偶联物包括偶联至下式的抗体或其抗原结合片段:在一个实施方案,抗体-药物偶联物包括偶联至下式的抗体或其抗原结合片段:在提供的任一化合物或偶联物实施方案中,BA是结合PRLR的抗体或其抗原结合片段。在提供的任一化合物或偶联物实施方案中,BA是结合STEAP2的抗体或其抗原结合片段。在提供的任一化合物或偶联物实施方案中,BA是抗体或其抗原结合片段,并通过至少一个Q295残基进行偶联。在提供的任一化合物或偶联物实施方案中,BA是抗体或其抗原结合片段,并通过两个Q295残基进行偶联。在提供的任一化合物或偶联物实施方案中,BA是N297Q抗体或其抗原结合片段。在提供的任一化合物或偶联物实施方案中,BA是N297Q抗体或其抗原结合片段,并通过至少一个Q295残基和至少一个Q297残基进行偶联。在提供的任一化合物或偶联物实施方案中,BA是N297Q抗体或其抗原结合片段,并通过两个Q295残基和两个Q297残基进行偶联。在特定实施方案,编号是根据EU编号系统进行。在上述任一实施方案中,BA是抗STEAP2抗体。在某些实施方案,BA是以下实施例中描述的抗STEAP2抗体H1H7814N。在某些实施方案,BA是以下实施例中描述的抗STEAP2抗体H1H7814NN297Q。在某些实施方案,BA是包含根据SEQIDNO:1的HCVR和根据SEQIDNO:5的LCVR的抗STEAP2抗体。在某些实施方案,BA是包含根据SEQIDNO:1的HCVR和根据SEQIDNO:5的LCVR的N297Q抗体。在某些实施方案,BA是抗STEAP2抗体,其包含分别根据SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:6、SEQIDNO:7和SEQIDNO:8的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3中的1、2、3、4、5或6个。在某些实施方案,BA是N297Q抗体,其包含分别根据SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:6、SEQIDNO:7和SEQIDNO:8的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3中的1、2、3、4、5或6个。N297Q表示一个或多个残基297从天冬酰胺(N)突变为谷氨酰胺(Q)。优选地,每个残基297分别突变为Q。在优选实施方案,编号是根据EU编号系统进行。在本段的某些实施方案中,k是1至4。在某些实施方案,k是1、2、3或4。在某些实施方案,k是4。在上述任一实施方案中,BA是抗PRLR抗体。在某些实施方案,BA是以下实施例中描述的抗PRLR抗体H1H6958N2。在某些实施方案,BA是以下实施例中描述的抗PRLR抗体H1H6958N2N297Q。在某些实施方案,BA是包含根据SEQIDNO:9的HCVR和根据SEQIDNO:13的LCVR的抗PRLR抗体。在某些实施方案,BA是包含根据SEQIDNO:9的HCVR和根据SEQIDNO:13的LCVR的N297Q抗体。在某些实施方案,BA是抗PRLR抗体,其包含分别根据SEQIDNO:10、SEQIDNO:11、SEQIDNO:12、SEQIDNO:14、SEQIDNO:15和SEQIDNO:16的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3中的1、2、3、4、5或6个。在某些实施方案,BA是N297Q抗体,其包含分别根据SEQIDNO:10、SEQIDNO:11、SEQIDNO:12、SEQIDNO:14、SEQIDNO:15和SEQIDNO:16的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3中的1、2、3、4、5或6个。N297Q表示一个或多个残基297从天冬酰胺(N)突变为谷氨酰胺(Q)。优选地,每个残基297分别突变为Q。在优选实施方案,编号是根据EU编号系统进行。在本段的某些实施方案中,k是从1至4。在某些实施方案,k是1、2、3或4。在某些实施方案,k是4。在本章节的任一前述实施方案中,R7是–NR7aR7b,其中R7a和R7b在每种情况下,分别独立地为H、烷基、烯基、炔基、环烷基、芳基、杂芳基、酰基、和氨基酸残基,其中烷基、烯基、炔基、环烷基、芳基、杂芳基和酰基均任选地被取代。在某些实施方案,R7a是H,和R7b是氨基酸残基。制备化合物或有效负载及连接体-有效负载的方法本发明提供的化合物均可通过本领域技术人员显而易见的任何方法制备、分离或得到。在以下实施例中详细描述了示例性制备方法。在某些实施方案,本发明提供的化合物可根据合成方案A-D制备得到:方案A.示例性制备方案方案B.示例性制备方案方案C.示例性制备方案方案D.示例性制备方案在上述示例性制备方案中,R1、R2、R3、R4、R5、R6、R7、R8均如式I的上下文中所述。在方案A中,氨基酸被同源化,然后在α-碳处进行偕二甲基化。N-磺酰基甲酰胺类化合物可在标准条件下使用H2NSO2R60制备得到,如本领域技术人员所理解的。在方案B中,半胱氨酸在形成噻唑的过程中参与环化,然后是羟醛缩合和Boc保护的N-烷氧基胺类化合物的迈克尔加成。然后将Boc保护的N-烷氧基胺还原为Boc保护的胺衍生物。在方案C中,将Boc保护的N-烷氧基胺进行脱保护和酰化。叠氮化物的Staudinger(施陶丁格)还原之后是酰胺化。醇类化合物的脱保护、酯类化合物的皂化和醇类化合物的酰化提供倒数第二个中间体。羧酸酯的活化随后酰胺化提供式I的化合物。方案D中的反应均是相似的,其中在合成早期进行还原胺化,然后是方案C中的类似步骤,其亦提供式I的化合物。示例性制备方法在下文实施例中详细描述。本发明所述的连接体-有效负载通常可通过如合成方案E-H、J、K、M和N中所示的一系列偶联步骤合成得到:方案E.示例性制备方案方案F.示例性制备方案方案G.示例性制备方案方案H.示例性制备方案方案J.示例性制备方案方案K.示例性制备方案方案M.示例性制备方案方案N.示例性制备方案在上述示例性制备方案中,R1、R2、R3、R4、R5、R6、R7、R8均如式I的上下文中所述。在方案E中,有效负载用苄基卤化物处理以形成季铵连接体-有效负载。在方案F、G、J、M和N中,有效负载用碳酸酯处理以形成连接体-有效负载。在方案H中,有效负载用苄基叠氮化物处理以形成三唑基连接体-有效负载。在方案K中,有效负载用苄醇进行酯化以形成连接体-有效负载。在某些实施方案,本发明提供了选自由下列组成的组的化合物(例如,连接体-有效负载):在本段落的某些实施方案中,所有非对映异构体均被考虑。譬如,在一个实施方案,内的立体化学未进行定义或是外消旋的。作为另一实例,在一个实施方案,内的立体化学是(R)-。作为另一实例,在一个实施方案,内的立体化学是(S)-。作为另一实例,在一个实施方案,内的立体化学是(R)-相对于(S)-过量。作为另一实例,在一个实施方案,内的立体化学是(S)-相对于(R)-过量。本发明所述的偶联物可通过在标准偶联条件下将本发明所述的连接体-有效负载与结合剂(例如抗体)偶联来合成得到(参见例如,Doroninaetal.NatureBiotechnology2003,21,7,778,其通过引用其全部内容并入本发明)。当所述结合剂是抗体时,所述抗体可通过抗体的一个或多个半胱氨酸或赖氨酸残基偶联至连接体-有效负载。连接体-有效负载可以,例如通过使抗体经受还原剂(例如二硫苏糖醇)的作用以切割抗体的二硫键,例如通过凝胶过滤纯化所述还原的抗体,然后用含有合适的活性基团部分(例如马来酰亚胺基)的连接体-有效负载处理所述抗体,从而与半胱氨酸残基偶联。合适的溶剂包括但不限于水、DMA、DMF、和DMSO。含有活性基团例如活化的酯或酰基卤基团的连接体-有效负载可与抗体的赖氨酸残基偶联。合适的溶剂包括但不限于水、DMA、DMF、和DMSO。偶联物可使用已知的蛋白质技术进行纯化,包括例如体积排除色谱法(体积排阻色谱法)、透析法和超滤/渗滤法。结合剂,例如抗体,也可通过点击化学反应进行偶联。在所述点击化学反应的一些实施方案中,连接体-有效负载包括能够与叠氮化物进行区域异构的1,3-环加成反应的活性基团,例如炔。此类合适的活性基团如上所述。所述抗体包括一个或多个叠氮基团。此类抗体包括用例如叠氮基-聚乙二醇基团官能化的抗体。在某些实施方案,此类官能化抗体通过在转谷氨酰胺酶存在下,用伯胺化合物处理具有至少一个谷氨酰胺残基(例如重链Gln295)的抗体,进行衍生得到。在某些实施方案,此类官能化抗体通过在转谷氨酰胺酶存在下,用伯胺化合物处理具有至少一个谷氨酰胺残基(例如重链Gln297)的抗体,进行衍生得到。此类抗体包括Asn297Gln(N297Q)突变体。在某些实施方案,此类官能化抗体通过在转谷氨酰胺酶存在下,用伯胺化合物处理具有至少两个谷氨酰胺残基(例如重链Gln295和重链Gln297)的抗体,进行衍生得到。此类抗体包括Asn297Gln(N297Q)突变体。在某些实施方案,所述抗体具有如本段所述的两条重链,用于总共两个或总共四个谷氨酰胺残基。在某些实施方案,所述抗体包含两个谷氨酰胺残基,每条重链中有一个。在特定实施方案,所述抗体在每条重链中包含Q295残基。在进一步的实施方案,所述抗体包含1、2、3、4、5、6、7、8个、或更多个谷氨酰胺残基。所述这些谷氨酰胺残基可位于重链中、轻链中、或位于重链和轻链两者中。所述这些谷氨酰胺残基可以是野生型残基、或工程化残基。所述抗体可根据标准技术制备得到。本领域技术人员将认识到,抗体通常在重链序列中的残基Q295附近的残基N297处进行糖基化。残基N297处的糖基化可干扰残基Q295处的转谷氨酰胺酶(Dennleretal.,同上)。因此,在有利的实施方案中,所述抗体未被糖基化。在某些实施方案,所述抗体是去糖基化的或无糖基化的。在特定实施方案,所述抗体重链具有N297突变。换言之,所述抗体突变为在位置297处不再具有天冬酰胺残基。在特定实施方案,抗体重链具有N297Q突变。此类抗体可通过定点诱变除去糖基化序列或使糖基化序列失效或通过定点诱变以在任何干扰糖基化位点或任何其他干扰结构之外的位点处插入谷氨酰胺残基,来制备得到。亦可从天然来源或人工来源分离得到此类抗体。然后使不干扰糖基化的抗体与伯胺化合物反应。在某些实施方案,使无糖基化的抗体与伯胺化合物反应以生成经谷氨酰胺基修饰的抗体。在某些实施方案,使去糖基化的抗体与伯胺化合物反应以生成经谷氨酰胺基修饰的抗体。伯胺可以是在转谷氨酰胺酶存在下能够与谷氨酰胺残基形成共价键的任何伯胺。有用的伯胺如下所述。所述转谷氨酰胺酶可以是本领域技术人员认为合适的任何转谷氨酰胺酶。在某些实施方案,所述转谷氨酰胺酶是催化伯胺化合物上的游离胺基团与谷氨酰胺残基侧链上的酰基基团之间的异肽键形成的酶。转谷氨酰胺酶也称为蛋白质-谷氨酰胺-γ-谷氨酰转移酶。在特定实施方案,所述转谷氨酰胺酶被分类为EC2.3.2.13。所述转谷氨酰胺酶可以来自认为合适的任何来源。在某些实施方案,所述转谷氨酰胺酶是微生物。有用的转谷氨酰胺酶已从茂原链轮丝菌(Streptomycesmobaraense)、肉桂链霉菌(Streptomycescinnamoneum)、灰肉链霉菌(Streptomycesgriseo-carneum)、淡紫灰链霉菌(Streptomyceslavendulae)和枯草芽孢杆菌(Bacillussubtilis)中分离得到。也可使用非微生物的转谷氨酰胺酶,包括哺乳动物的转谷氨酰胺酶。在某些实施方案,所述转谷氨酰胺酶可通过任何技术生成或从本领域技术人员认为合适的任何来源得到。在特定实施方案,所述转谷氨酰胺酶得自商业来源。在特定实施方案,所述伯胺化合物包含能够在转谷氨酰胺化之后进一步反应的活性基团。在所述这些实施方案中,可将经谷氨酰胺基修饰的抗体与活性有效负载化合物、或活性连接体-有效负载化合物反应或用活性有效负载化合物、或活性连接体-有效负载化合物处理以形成抗体-有效负载偶联物。在某些实施方案,所述伯胺化合物包含叠氮化物。在某些实施方案,将经谷氨酰胺基修饰的抗体与活性连接体-有效负载反应或用活性连接体-有效负载处理以形成抗体-有效负载偶联物。所述反应可在本领域技术人员认为合适的条件下进行。在某些实施方案,使经谷氨酰胺基修饰的抗体与活性连接体-有效负载化合物在适于在经谷氨酰胺基修饰的抗体与连接体-有效负载化合物之间形成键的条件下接触。合适的反应条件是本领域技术人员周知的。以下实施例中提供了示例性反应。药物组合物和治疗方法本发明提供了治疗和预防疾病、病况或病症的方法,其包含施用治疗或预防有效量的一种或多种本发明公开的化合物,例如一种或多种本发明所提供通式的化合物。疾病、病症和/或病况包括但不限于与本发明所列抗原相关的那些。本发明所述的化合物可以单独施用或与一种或多种附加治疗剂一同施用。可在施用本发明所述化合物之前、同时或之后不久施用一种或多种附加治疗剂。本发明还包括药物组合物,其包含任何本发明所述化合物与一种或多种附加治疗剂组合,以及治疗方法,所述方法包含向有需要的受试者施用此类组合。合适的附加治疗剂包括但不限于:第二微管溶素,自身免疫治疗剂,激素,生物药,或单克隆抗体。合适的治疗剂还包括但不限于本发明所述化合物的任何药学上可接受的盐类、酸类或衍生物类。在本发明所述方法的一些实施方案中,可在限定的时间疗程内向受试者施用多剂量的本发明所述化合物(或包含本发明所述化合物和本发明提及的任何附加治疗剂的组合的药物组合物)。根据本技术实现要素:的此实施方案的方法包括向受试者依次施用多剂量的本发明所述化合物。本发明使用的“依次施用”是指在不同的时间点,例如在以预定间隔(例如,小时、天、周、或月)隔开的不同天数,将化合物的每个剂量施用于受试者。本发明包含以下方法,所述方法包含依次向患者施用单一初始剂量的本发明所述化合物,随后施用一个或多个二次剂量的所述化合物,以及任选地后续施用一个或多个三次剂量的所述化合物。术语“初始剂量”,“二次剂量”,和“三次剂量”是指本发明所述化合物的给药时间顺序。因此,“初始剂量”是在治疗方案开始时给药的剂量(也称为“基线剂量”);“二次剂量”是在所述初始剂量给药后施用的剂量;和“三次剂量”是在所述二次剂量给药后施用的剂量。所述初始、二次和三次剂量均可含有相同量的本发明化合物,但通常可在给药频率方面彼此不同。在某些实施方案,在治疗过程中,所述初始、二次和/或三次剂量中所含的化合物的量彼此变化(例如,酌情上调或下调)。在某些实施方案,在治疗方案开始时,将两种或更多种(例如,2、3、4或5种)剂量施用为“负荷剂量”,随后以较不频繁的方式施用后续剂量(例如“维持剂量”)。在本发明所述的一些示例性实施方案中,每个二次和/或三次剂量在紧随前述剂量之后进行给药1至26周(例如,1、11/2、2、21/2、3、31/2、4、41/2、5、51/2、6、61/2、7、71/2、8、81/2、9、91/2、10、101/2、11、111/2、12、121/2、13、131/2、14、141/2、15、151/2、16、161/2、17、171/2、18、181/2、19、191/2、20、201/2、21、211/2、22、221/2、23、231/2、24、241/2、25、251/2、26、261/2、或更多)。本发明使用的短语“紧随前述剂量”是指在多次给药的序列中,在施用紧邻下一个剂量之前,对患者施用本发明化合物的剂量,在所述给药序列中不存在干预剂量。本发明此实施方案的方法可包含向患者施用任何数量的二次和/或三次剂量的本发明化合物。譬如,在某些实施方案,仅向患者施用单次二次剂量。在其他实施方案,向患者施用两次或更多次(例如,2、3、4、5、6、7、8次或更多次)二次剂量。同理,在某些实施方案,仅向患者施用单次三次剂量。在其他实施方案,向患者施用两次或更多次(例如,2、3、4、5、6、7、8次或更多次)三次剂量。给药方案可在特定受试者的寿命期内无限期地进行,或者直至此种治疗不再是治疗需要或有利的。在涉及多个二次剂量的实施方案中,每个二次剂量可以与其他二次剂量相同的频率施用/给药。譬如,每个二次剂量可在紧随前述剂量之后,对患者进行给药1至2周或1至2个月。同理,在涉及多个三次剂量的实施方案中,每个三次剂量可以与其他三次剂量相同的频率施用/给药。譬如,每个三次剂量可在紧随前述剂量之后,对患者进行给药2至12周。在本发明的某些实施方案中,向患者施用二次和/或三次剂量的频率可在治疗方案的过程中变化。也可根据临床检查后的个体患者的需要,由医师在治疗过程中调整给药频率。本发明包括其中以第一频率(例如,每周一次,每两周一次,每三周一次,每月一次,每两个月一次等)向患者施用2至6次负荷剂量,然后以较不频繁的方式向患者施用两次或更多次维持剂量的给药方案。例如,根据本发明的此实施方案,如果以每月一次的频率施用负荷剂量,那么维持剂量可以每6周施用一次,每两个月施用一次,每三个月施用一次等。本发明包括本发明所述化合物、和/或偶联物(例如式I、II、III、IV、V、VI、VII、VIII、IX、X、XI和XII所示化合物)的药物组合物,譬如,组合物包含本发明所述化合物、其盐、立体异构体、区域异构体、多晶型物,和药学上可接受的载体、稀释剂、和/或辅料。合适的载体、稀释剂和辅料的实例包括,但不限于:用于维持适当组合物pH值的缓冲剂类(例如,柠檬酸盐缓冲液、琥珀酸盐缓冲液、乙酸盐缓冲液、磷酸盐缓冲液、乳酸盐缓冲液、草酸盐缓冲液等),载体蛋白质类(如人血清白蛋白),盐水,多元醇类(例如,海藻糖、蔗糖、木糖醇、山梨糖醇等),表面活性剂类(例如,聚山梨醇酯20、聚山梨醇酯80、聚氧乙烯酸酯(polyoxolate)等),抗微生物剂类,和抗氧化剂类。在一些实施例,本发明提供了治疗癌症的方法,其包含向患有所述癌症的患者施用治疗有效量的式I、II、III、IV、V、VI、VII、VIII、IX、X、XI和XII的化合物、或其药物组合物。在一些实施方案,本发明提供了治疗癌症的方法,其包含向患有所述癌症的患者施用治疗有效量的本发明所述抗体-微管溶素偶联物、或其药物组合物。在一些实施方案,所述偶联物(例如,本发明所述的抗体-药物偶联物)的结合剂(例如,抗体)与肿瘤抗原相互作用或结合肿瘤抗原,包括对一种类型肿瘤特异的抗原、或在特定类型肿瘤上共有、过表达或修饰的抗原。实例包括但不限于,α-辅肌动蛋白-4与肺癌,ARTC1与黑素瘤,BCR-ABL融合蛋白与慢性骨髓性白血病,B-RAF、CLPP或Cdc27与黑素瘤,CASP-8与鳞状细胞癌,和hsp70-2与肾细胞癌,以及以下共享的肿瘤特异性抗原,例如,BAGE-1、GAGE、GnTV、KK-LC-1、MAGE-A2、NA88-A、TRP2-INT2。肿瘤抗原的其他实例包括但不限于PSMA、PRLR、MUC16、HER2、EGFRvIII和抗STEAP2、以及MET。本发明公开的化合物可用于治疗发生于脑和脑膜、口咽、肺和支气管树、胃肠道、男性和女性生殖道、肌肉、骨骼、皮肤及其附件、结缔组织、脾脏、免疫系统、造血细胞和骨髓、肝脏和泌尿道、以及特殊感觉器官(例如眼睛)的原发性和/或转移性肿瘤。在某些实施方案,本发明提供的化合物可用于治疗一种或多种以下癌症:肾细胞癌、胰腺癌、头颈癌(例如,头颈部鳞状细胞癌[HNSCC])、前列腺癌、去势抵抗性前列腺癌、恶性神经胶质瘤、骨肉瘤、结肠直肠癌、胃癌(例如,伴有MET扩增的胃癌)、间皮瘤、恶性间皮瘤、多发性骨髓瘤、卵巢癌、肺癌、小细胞肺癌、非小细胞肺癌、滑膜肉瘤、甲状腺癌、乳腺癌、PRLR阳性(PRLR+)乳腺癌、黑素瘤、急性骨髓性白血病、成人T细胞白血病、星形细胞瘤、膀胱癌、宫颈癌、胆管癌、子宫内膜癌、食道癌、胶质母细胞瘤、卡波西肉瘤(Kaposi'ssarcoma)、肾癌、平滑肌肉瘤、肝癌、淋巴瘤、MFH/纤维肉瘤、鼻咽癌、横纹肌肉瘤、结肠癌、胃癌、子宫癌、残余癌(其中“残余癌”是指在用抗癌疗法治疗后受试者体内一种或多种癌细胞的存在或持续存在)、和维尔姆斯氏瘤(Wilms’tumor)。在一些实施方案,所述癌症是乳腺癌。在一些实施方案,所述癌症是前列腺癌。在一些实施例,本发明提供了预防前列腺癌的方法,其包含向患有所述病症的患者施用预防有效量的式I、II、III、IV、V、VI、VII、VIII、IX、X、XI和XII的化合物、或其药物组合物。实施例本发明提供了新的微管溶素、其蛋白质偶联物,以及治疗疾病、病症和病况的方法,包括施用所述微管溶素和偶联物。表1.微管溶素有效负载表2.微管溶素连接体-有效负载本发明的某些实施方案由以下非限制性实施例进行说明。如本发明使用的,无论是否具体定义了特定缩写,所述这些方法、方案和实施例中使用的符号和惯例均与当代科学文献(例如,《美国化学学会杂志》或《生物化学杂志》)中使用的那些一致。具体但不限于,以下缩写可用于实施例和整个说明书:除非另有明确说明,否则试剂和溶剂均得自商业来源,例如国药集团化学试剂有限公司(SinopharmChemicalReagentCo.(SCRC))、Sigma-Aldrich、Alfa或其他供应商。在BrukerAVIII400或BrukerAVIII500上记录1HNMR和其他NMR光谱。用Nuts软件或MestReNova软件处理数据,测定内标四甲基硅烷(TMS)低磁场的质子位移百万分率(ppm)。HPLC-MS测定在Agilent1200HPLC/6100SQ系统上运行,使用以下条件:用于HPLC-MS测定的方法A包括作为流动相:A:水(0.01%三氟乙酸(TFA))和B:乙腈(0.01%TFA);梯度相:在15分钟(min)内,由5%的B增至95%的B;流速:1.0mL/min;色谱柱:SunFireC18,4.6x50mm,3.5μm;柱温为50℃。检测器:模数转换器(ADC)蒸发光散射检测器(ELSD),二极管阵列检测器(DAD)(214nm和254nm),和电喷雾电离-大气压电离(ES-API)。用于HPLC-MS测定的方法B包括作为流动相:A:水(10mMNH4HCO3),B:乙腈;梯度相:在15分钟(min)内,由5%增至95%的B;流速:1.0mL/min;色谱柱:XBridgeC18,4.6x50mm,3.5μm;柱温:50℃。检测器:ADCELSD,DAD(214nm和254nm),和质量选择检测器(MSD)(ES-API)。LC-MS测定在Agilent1200HPLC/6100SQ系统上运行,使用以下条件:用于LC-MS测定的方法A包括仪器WATERS2767;色谱柱:ShimadzuShim-Pack,PRC-ODS,20x250mm,15μm,两个串联连接;流动相是A:水(0.01%TFA),B:乙腈(0.01%TFA);梯度相:在3分钟内,由5%的B增至95%的B;流速:1.8-2.3mL/min;色谱柱:SunFireC18,4.6x50mm,3.5μm:柱温:50℃。检测器:ADCELSD,DAD(214nm和254nm),ES-API。用于LC-MS测定的方法B包括仪器GilsonGX-281;色谱柱:XbridgePrepC1810umOBD,19x250mm;流动相:A:水(10mMNH4HCO3),B:乙腈;梯度相:在3分钟内,由5%的B增至95%的B;流速:1.8-2.3mL/min;色谱柱:XBridgeC18,4.6x50mm,3.5μm:柱温:50℃。检测器:ADCELSD,DAD(214nm和254nm),和MSD(ES-API)。在GilsonGX-281仪器上采用酸性和碱性溶剂体系进行制备型高压液相色谱(制备型HPLC)。所述酸性溶剂体系采用WatersSunFire10μmC18柱(250x19mm),以及用于制备型HPLC的溶剂A是水/0.05%TFA,和溶剂B是乙腈。洗脱条件是线性梯度,其在20分钟的时间段内以30mL/min的流速,从5%的溶剂B增至100%的溶剂B。碱性溶剂体系包括WatersXbridge10μmC18柱(250x19mm),以及用于制备型HPLC的溶剂A是水/10mM碳酸氢铵(NH4HCO3),和溶剂B是乙腈。洗脱条件是线性梯度,其在20分钟的时间段内以30mL/min的流速,从5%的溶剂B增至100%的溶剂B。使用Agela快速柱(FlashColumn)硅胶-CS(silica-CS)在Biotage仪器上进行快速色谱法。在Biotage仪器上使用BostonODS或AgelaC18柱进行反相快速色谱法。分析型手性HPLC方法–SFC条件a)仪器:SFC方法站(MethodStation)(Thar,Waters)b)色谱柱:CHIRALPAKAD-H/AS-H/OJ-H/OD-H4.6×100mm,5μm(Daicel)c)柱温:40℃d)流动相:CO2/IPA(0.1%DEA)=55/45e)流速:4.0mL/minf)背压:120Barg)进样量:2μL制备型手性HPLC方法–SFC条件a)仪器:SFC-80(Thar,Waters)b)色谱柱:CHIRALPAKAD-H/AS-H/OJ-H/OD-H20×250mm,10μm(Daicel)c)柱温:35℃d)流动相:CO2/IPA(0.2%甲醇-氨)=30/70e)流速:80g/minf)背压:100barg)检测波长:214nmh)循环时间:6.0mini)样品溶液:1500mg溶于70mL甲醇j)进样量:2mL(载量:42.86mg/针)制备方法表1中的微管溶素有效负载(IV、V、VI)是由中间体I(图1)、II和III(图4-6)合成得到。表2中的微管溶素-连接体-有效负载是由具有已知连接体L-1(图8)、L-2、L-3(图9)和L-4(图10A)的微管溶素有效负载合成得到,所述已知连接体均通过市售得到或根据文献(参见,例如US2014/227295;和WO2014/191578A1)合成得到。中间体Ia-c和Ig-l的合成如图1所示。Boc-氨基酸1与2,2-二甲基-1,3-二噁烷-4,6-二酮2缩合,然后用NaBH4还原酮3以提供化合物4。化合物4在加热条件下通过4的脱羧,转化为内酰胺5,用于在一个步骤中开环和随后的关环反应。在5的α-位甲基化,然后碱性水解将内酰胺5转化为酸7,最后Boc脱保护以提供中间体Ia-c和Ig-l。中间体Id-f的合成根据以下文献描述的方法进行:WO2016/138288A1用于Id(R4=F);Org.Lett.2009,11(24),5567-5569用于Ie(R4=OH);和US9,382,289B2用于If(R4=NH2)。中间体17a-c的合成示于图2。噻唑11是由半胱氨酸乙酯8通过与2-氧代-丙醛9进行环化,然后由MnO2氧化得到。α,β-不饱和酮13由11与2-甲基丙醛12进行羟醛缩合得到。羟胺衍生物15与α,β-不饱和酮13进行迈克尔加成,然后由CBS催化还原,提供顺式17和反式17的混合物,通过柱色谱分离并通过手性HPLC或SFC进一步纯化分离以提供所需的手性17a-c。Corey-Bakshi-Shibata还原(又名CBS还原)或Itsuno-Corey还原是一种成熟的且高度对映选择性的酮还原反应。据报道,噁唑硼烷试剂介导酮16A的还原,以提供高ee的醇17A,其中17A和立体异构体17B得到充分表征(Angew.Chem.Int.Ed.2007,46,3526-3529;参见图3)。我们使用CBS-BH3·SMe减少了16a和16b,并分别从反应粗产物中得到了顺式17a或顺式17b(de>90%)以及反式17a或反式17b(de~80%)。这些混合的对映异构体通过手性SFC进一步纯化,以提供纯对映异构体(de>95%)。我们还尝试了其他还原条件,并在硅胶柱色谱法后使用硼氢化钠还原16c,以得到顺式17c和反式17c。每对分离的异构体分别通过手性HPLC进一步分离,得到17c-P1、17c-P2、17c-P3、和17c-P4(所有ee>99%)。为了确定所有四种异构体的手性中心,使用Mo(CO)6切割每种化合物的N-O键,分别提供17A或17B,以及其非对映异构体17A′或17B′。化合物17a-c的手性中心是通过将17A和17B的1HNMR数据和旋光度数据与相同化合物的公开数据进行比较来确定。O-中间体和C-中间体(II和III)的合成示于图4。化合物19a-c由将17a-c进行O-TBS保护,然后将18a-c进行Boc脱保护得到。化合物19d-e分别通过己醛或5-己炔醛20与已知化合物21(欧洲专利申请,2409983,2012年1月25日)的还原胺化反应得到。19c中的三键可以用钯/炭还原,得到19f。化合物19a-e用(2S,3S)-2-叠氮基-3-甲基戊酰氯22处理以提供酰胺23a-e,然后在三苯基膦存在下进行施陶丁格(Staudinger)还原,然后与N-甲基-2R-哌啶羧酸25酰胺化,得到酰胺26a-e。通过用氟化铯进行TBS脱保护以及随后的碱性水解,将化合物26a-e转化为中间体IIa-e。IIc中的三键可用钯/炭还原以提供IIf。中间体IIIa-f由中间体IIa-f的乙酰化得到。通过用TMS-CH2N3进行[3+2]环化,然后用氟化铯进行TBS脱保护,由IIIe得到中间体IIIg。用于制备C-微管溶素衍生物(IV)和O-微管溶素衍生物(V)的合成如图5所示。C-微管溶素衍生物(IV)根据J.Org.Chem.2008,73(12),4362-4369中报告的方法合成得到。如图5所示,中间体IIId-e与五氟苯酚(PFP)在N,N'-二异丙基碳二亚胺(DIC)存在下进行酯化,以提供五氟苯基酯28a-e,其在Fmoc或TMS额外脱保护后(对于TMS脱保护,参见图6A),在酰胺化中用胺Ia-l处理,分别得到C-微管溶素有效负载IVa-g和IVq-x。O-微管溶素衍生物(V)使用上述方法,由IIIa-c和IIIf通过在DIC存在下与PFP酯化,然后与Ia-1酰胺化,合成得到。O-微管溶素衍生物Vb、Ve和Vh均在Fmoc的额外脱保护后得到。O-微管溶素衍生物Vi采用钯/炭进行氢化以提供苯胺衍生物Vj,其进一步加热氢化以提供Vk。C-三唑微管溶素类似物(IVh和j-p)通过图6A所示的两种方法制备得到。在第一种方法中,中间体IIIe在[3+2]点击反应中用TMS-甲基叠氮化物处理以形成IIIg1,然后用氟化铯进行TMS脱保护以提供IIIg2。将IIIg2转化为五氟苯基酯31以及随后的酰胺偶联,在Fmoc脱保护后提供IVh。在第二种方法中,三唑微管溶素类似物IVj-p是采用中间体Fmoc-IVd和不同的叠氮试剂(R5-N3)通过[3+2]点击反应,然后进行Fmoc脱保护制备得到。图7A和7B示出了制备O-微管溶素衍生物VIa-f、h的合成。化合物27a用双(4-硝基苯基)碳酸酯(NPC)处理以形成活化的碳酸酯33,然后用伯胺处理,分别提供化合物34a-e、F、H。氨基甲酸酯VIa-f、h分别由化合物34a-e、F、H与例如中间体Ie的酰胺化得到。用于制备连接体-微管溶素有效负载(LP)的合成如下所示:图8示出了LP1,图9示出了LP2,和图10A示出了LP3和LP4,图10B示出了LP5。有两种方法可制备连接体-有效负载。一种方法是将连接体与在LP1合成中例示的有效负载偶联(图8);另一种方法是将连接体与有效负载的片段连接,然后进行酰胺偶联以制备在LP2合成中例示的连接体-有效负载(图9)。如图8所示,LP1是通过IVa与水合肼反应得到IVa′,然后用MC-VC-PAB-PNP(L-1)处理来合成得到。如图9所示,LP2通过首先将VC-PAB与中间体Ie进行酰肼偶联合成得到。换言之,中间体Ie用水合肼处理形成酰肼35,其用N-Fmoc-VC-PAB-PNP(L-2)处理,在使用TFA进行Boc脱保护后得到化合物37。进行Fmoc脱保护后,37与中间体IIIa进行酰胺化以提供化合物39;39与DIBAC-suc-PEG4-COOH(L-3)进行酰胺化得到LP2。在不同的柱条件下,在手性SFC上分析关键中间体,其中它们均显示>99%ee,详细的保留时间(Rt)总结如下表3所示。表3.手性SFCRt确定中间体的ee如图10A所示,在Boc脱保护后,连接体L-2用中间体7e处理以提供化合物41。Fmoc脱保护后,化合物41与28e或28c进行酰胺偶联反应,分别得到43a或43b。化合物43a或43b与DIBAC-suc-PEG4-NHS(L-4)偶联,分别得到LP3或LP4。实验方法图1中中间体I的合成化合物3的一般方法在0℃下,向化合物1(5g,1.0当量)的DCM(20mL)混合物中加入化合物2(1.1当量)和DMAP(1.5当量),将混合物在0℃下保持30分钟,然后将EDCI(1.1当量)加至反应混合物。所得混合物在室温下搅拌过夜。LCMS显示反应完成。混合物用硫酸氢钾(5%,4x)水溶液和盐水洗。分离有机层,经硫酸钠干燥,真空浓缩。残余物在甲醇中研磨以得到化合物3(50-60%收率)为白色固体。N-[(2S)-1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-1-氧代-3-苯基丙烷-2-基]氨基甲酸叔丁酯(3a)按照化合物3的一般方法,得到化合物3a(4.2g,57%收率)为白色固体。ESIm/z:805(2M+Na)+。1HNMR(500MHz,CDCl3)δ15.57(s,1H),7.34-7.27(m,4H),7.26-7.23(m,1H),5.89(s,1H),5.09-4.79(m,1H),3.25-3.05(m,1H),2.94-2.79(m,1H),1.75(s,3H),1.65(s,3H),1.36(s,9H)ppm。N-[(2S)-1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-3-(4-氟苯基)-1-氧代丙烷-2-基]氨基甲酸叔丁酯(3b)按照化合物3的一般方法,得到化合物3b(4.2g,58%收率)为白色固体。ESIm/z:841(2M+Na)+。1HNMR(500MHz,CDCl3)δ7.30-7.24(m,2H),7.03-6.97(m,2H),5.93-5.78(m,1H),5.08-4.96(m,1H),3.23-3.09(m,1H),2.86-2.74(m,1H),2.06-1.82(m,1H),1.76(s,3H),1.68(s,3H),1.36(s,9H)ppm。(S)-叔丁基1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-3-(4-硝基苯基)-1-氧代丙烷-2-基氨基甲酸酯(3d)按照化合物3的一般方法,得到化合物3c(3.3g,47%收率)为白色固体。ESIm/z:459(M+Na)+。1HNMR(500MHz,CDCl3)δ15.7(s,1H),8.19(d,J=9.0Hz,2H),7.53(d,J=9.0Hz,2H),5.87(s,1H),5.09-5.08(m,1H),3.33-3.31(m,1H),2.90-2.86(m,1H),1.73(s,6H),1.33(s,9H)ppm。1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-3-(4-氟-3-硝基苯基)-1-氧代丙烷-2-基氨基甲酸叔丁酯(3f)按照化合物3的一般方法,得到化合物3f(62g,粗品)为黄色固体,其无需进一步纯化即可用于下一步骤。ESIm/z:477(M+Na)+。(注:化合物1f是根据文献:J.Am.Chem.Soc.,2010,132(22),7776-7783合成得到)。1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-3-(3-氟-4-硝基苯基)-1-氧代丙烷-2-基氨基甲酸叔丁酯(3j)在0℃下,向2-氨基-3-(3-氟-4-硝基苯基)丙酸(3.5g,15mmol;根据MedicinalChemistryLetters2016,7(3),250-255合成得到)的二氧六环(140mL)和水(70mL)溶液中加入碳酸钠(4.8g,46mmol)和Boc2O(3.6g,17mmol)。混合物在室温下搅拌4小时直至反应完成,通过LCMS进行监测。反应混合物用水稀释并用浓HCl酸化至pH值2-3。含水混合物用乙酸乙酯萃取,合并的有机溶液用盐水洗。真空除去挥发物,残余粗产物由25%乙酸乙酯的石油醚溶液进行重结晶,得到化合物1j(4.7g,87%收率)为淡黄色固体。ESIm/z:351.1(M+Na)+。按照化合物3的一般方法,使用化合物1j,得到化合物3j(4.0g,96%粗收率)为棕色固体,其无需进一步纯化即可用于下一步骤。ESIm/z:477.1(M+Na)+。(S)-(3-(4-(苄氧基)-3-硝基苯基)-1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-1-氧代丙烷-2-基)氨基甲酸叔丁酯(3k)按照化合物3的一般方法,使用化合物1k(根据J.Am.Chem.Soc.1980,102,7156-7157合成得到),得到化合物3k(4.8g,97%粗收率)为浅绿色固体,其无需进一步纯化即可用于下一步骤。ESIm/z:565.1(M+Na)+。(3-(3-(苄氧基)-4-硝基苯基)-1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-1-氧代丙烷-2-基)氨基甲酸叔丁酯(3l)按照化合物3的一般方法,使用化合物1l(使用与1k中类似的方法合成,不同之处在于由2-氨基-3-(3-羟基-4-硝基苯基)丙酸(其根据J.Med.Chem.1997,40,3182-3191)合成)作为起始物料,得到化合物3l(4.6g,95%粗收率)为浅色固体,其无需进一步纯化即可用于下一步骤。ESIm/z:565.1(M+Na)+。化合物4的一般方法在0℃下,通过注射器向化合物3(1.0当量)的DCM(20mL)溶液中,分几批依次加入乙酸(11当量)和硼氢化钠(2.5当量)。将反应混合物在0℃下搅拌2小时直至化合物3完全消耗,通过LCMS进行监测。然后在0℃下用盐水淬灭混合物,用DCM萃取(3次)。合并的有机层用硫酸钠干燥,真空浓缩。残余物经硅胶柱色谱法(用乙酸乙酯/DCM洗脱)纯化,得到化合物4(83-96%收率)。N-[(2R)-1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-3-苯基丙烷-2-基]氨基甲酸叔丁酯(4a)按照化合物4的一般方法,在经硅胶柱色谱法(用乙酸乙酯/DCM,v/v=1/10洗脱)纯化后,得到化合物4a(3.8g,95%收率)为无色油状物。ESIm/z:777(2M+Na)+。1HNMR(500MHz,CDCl3)δ7.33-7.28(m,2H),7.25-7.28(m,3H),4.55-4.40(m,1H),4.28-4.18(m,1H),3.98-3.84(s,1H),2.86(d,J=6.3Hz,2H),2.36-2.12(m,2H),1.78(s,3H),1.74(s,3H),1.36(s,9H)ppm。N-[(2R)-1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-3-(4-氟苯基)丙烷-2-基]氨基甲酸叔丁酯(4b)按照化合物4的一般方法,在经硅胶柱色谱法(用乙酸乙酯/DCM,v/v=1/1洗脱)纯化后,得到化合物4b(3.8g,95%收率)为无色油状物。ESIm/z:813(2M+Na)+。1HNMR(400MHz,CDCl3)δ7.20-7.12(m,2H),7.03-6.94(m,2H),4.50-4.40(m,1H),4.25-4.13(m,1H),3.92-3.84(m,1H),2.87-2.74(m,2H),2.34-2.06(m,2H),1.78(s,3H),1.73(s,3H),1.35(s,9H)ppm。N-[(2R)-1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-3-(4-硝基苯基)丙烷-2-基]氨基甲酸叔丁酯(4d)按照化合物4的一般方法,在经硅胶柱色谱法(用乙酸乙酯/DCM,v/v=3/2洗脱)纯化后,得到化合物4d(11g,83%收率)为无色油状物。ESIm/z:867(2M+Na)+。1HNMR(500MHz,CDCl3)δ8.18(d,J=8.6Hz,2H),7.40(d,J=8.6Hz,2H),4.52(d,J=8.4Hz,1H),4.39-4.18(m,1H),3.84(s,1H),3.05-2.87(m,2H),2.39-2.14(m,2H),1.80(s,3H),1.75(s,3H),1.35(s,9H)ppm。1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-3-(4-氟-3-硝基苯基)丙烷-2-基氨基甲酸叔丁酯(4f)按照化合物4的一般方法,得到化合物4f(35g,2步收率为79%)为黄色固体。ESIm/z:463(M+Na)+。1-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)-3-(3-氟-4-硝基苯基)丙烷-2-基氨基甲酸叔丁酯(4j)按照化合物4的一般方法,使用化合物3j,得到化合物4j(3.4g,2步收率为77%)为黄色固体。ESIm/z:463.1(M+Na)+。(S)-(1-(4-(苄氧基)-3-硝基苯基)-3-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)丙烷-2-基)氨基甲酸叔丁酯(4k)按照化合物4的一般方法,在经硅胶柱色谱法(用乙酸乙酯/石油醚,v/v=1/1洗脱)纯化后,得到化合物4k(2.0g,46%收率)为白色固体。ESIm/z:552.1(M+Na)+。(1-(3-(苄氧基)-4-硝基苯基)-3-(2,2-二甲基-4,6-二氧代-1,3-二噁烷-5-基)丙烷-2-基)氨基甲酸叔丁酯(4l)按照化合物4的一般方法,在经硅胶柱色谱法(用乙酸乙酯/石油醚,v/v=1/1洗脱)纯化后,得到化合物4l(2.0g,48%收率)为白色固体。ESIm/z:552.1(M+Na)+。化合物5的一般方法将化合物4的甲苯溶液(0.2-0.5g/mL)于90℃下搅拌3小时,其中通过LCMS监测化合物4向化合物5的转化。然后真空除去挥发物。残余物经硅胶柱色谱法(用乙酸乙酯/石油醚洗脱)纯化,得到化合物5(82-91%收率)为油状物。(2R)-2-苄基-5-氧代吡咯烷-1-羧酸叔丁酯(5a)按照化合物5的一般方法,在经硅胶柱色谱法(用乙酸乙酯/石油醚,v/v=1/9洗脱)纯化后,得到化合物5a(2.3g,82%收率)为无色油状物。ESIm/z:220(M-55)+。1HNMR(500MHz,CDCl3)δ7.35-7.29(m,2H),7.28-7.24(m,1H),7.21-7.17(m,2H),4.40-4.34(m,1H),3.18-3.10(m,1H),2.77-2.70(m,1H),2.35-2.29(m,2H),2.01-1.91(m,1H),1.85-1.77(m,1H),1.59(s,9H)ppm。(2R)-2-[(4-氟苯基)甲基]-5-氧代吡咯烷-1-羧酸叔丁酯(5b)按照化合物5的一般方法,在经硅胶柱色谱法(用乙酸乙酯/石油醚,v/v=1/5洗脱)纯化后,得到化合物5b(5.1g,91%收率)为黄色油状物。ESIm/z:609(2M+Na)+。1HNMR(500MHz,CDCl3)δ7.18-7.13(m,2H),7.04-6.99(m,2H),4.37-4.31(m,1H),3.13-3.07(m,1H),2.76-2.69(m,1H),2.40-2.26(m,2H),2.04-1.91(m,1H),1.81-1.75(m,1H),1.58(s,9H)ppm。(2R)-2-[(4-硝基苯基)甲基]-5-氧代吡咯烷-1-羧酸叔丁酯(5d)按照化合物5的一般方法,在经硅胶柱色谱法(用乙酸乙酯/石油醚,v/v=1/9洗脱)纯化后,得到化合物5d(7.9g,90%收率)为黄色油状物。ESIm/z:663(2M+Na)+。1HNMR(500MHz,CDCl3)δ8.20(d,J=8.6Hz,2H),7.39(d,J=8.6Hz,2H),4.46-4.36(m,1H),3.32-3.24(m,1H),2.88-2.80(m,1H),2.48-2.37(m,2H),2.08-1.97(m,1H),1.80-1.71(m,1H),1.58(s,9H)ppm。2-(4-氟-3-硝基苄基)-5-氧代吡咯烷-1-羧酸叔丁酯(5f)按照化合物5的一般方法,在经硅胶柱色谱法(用DCM洗脱)纯化后,得到化合物5f(15g,78%收率)为黄色油状物。ESIm/z:361(M+Na)+。2-(3-氨基-4-氟苄基)-5-氧代吡咯烷-1-羧酸叔丁酯(5g)向化合物5f(15g,44mmol)的乙酸乙酯(100mL)溶液中加入湿的10%Pd/C(1.5g)。将混合物脱气并用氢气交换3次,所得混合物在氢气球下于室温下搅拌3小时,直至根据LCMS显示反应完成。所得混合物通过硅藻土过滤,滤液真空浓缩,得到粗化合物5g(14g,粗品)为黄色固体,将其直接用于下一步骤。ESIm/z:209.1(M–Boc+H)+。2-(3-(苄氧基羰基氨基)-4-氟苄基)-5-氧代吡咯烷-1-羧酸叔丁酯(5h1)在0℃下,向化合物5g(0.74g,2.4mmol)的THF(10mL)溶液中加入碳酸氢钠(0.30g,3.6mmol)和CbzCl(0.38mL,2.64mmol)。将混合物在室温下搅拌4小时,通过LCMS进行监测。将所得混合物浓缩,残余物经硅胶柱色谱法(0-35%乙酸乙酯的石油醚溶液)纯化,以提供化合物5h1(0.85g,80%收率)为浅黄色油状物。ESIm/z:343.1(M–Boc+H)+。2-(3-(二苄基氨基)-4-氟苄基)-5-氧代吡咯烷-1-羧酸叔丁酯(5i)在室温下,向化合物5g(14g,44mmol)的DMF(200mL)溶液中加入碳酸钾(18g,0.13mol)和苄基溴(13mL,0.11mol)。所得混合物在80℃下搅拌过夜直至根据LCMS不再形成5i。冷却至室温后,将所得混合物倒入水(500mL)中,用DCM(200mLx2)萃取。合并的有机溶液用水(100mLx2)和盐水(200mLx1)洗,经硫酸钠干燥,真空浓缩,得到化合物5i(24g,粗品)为黄色油状物。ESIm/z:489.2(M+H)+。2-(3-氟-4-硝基苄基)-5-氧代吡咯烷-1-羧酸叔丁酯(5j1)按照化合物5的一般方法,使用化合物4j,在经硅胶柱色谱法(用DCM洗脱)纯化后,得到化合物5j1(1.7g,63%收率)为黄色油状物。ESIm/z:361.1(M+Na)+。1HNMR(500MHz,DMSOd6)δ8.15(t,J=8.2Hz,1H),7.48(dd,J=12.3,1.4Hz,1H),7.30(dd,J=8.5,1.2Hz,1H),4.38-4.31(m,1H),3.13(dd,J=13.1,4.4Hz,1H),2.97(dd,J=13.1,8.8Hz,1H),2.59-2.52(m,1H),2.29-2.21(m,1H),1.99(m,1H),1.71-1.62(m,1H),1.44(s,9H)ppm。2-(4-氨基-3-氟苄基)-5-氧代吡咯烷-1-羧酸叔丁酯(5j2)向化合物5j1(1.5g,4.4mmol)的乙酸乙酯(30mL)溶液中加入湿的10%Pd/C(0.30g)。将混合物脱气并用氢气交换3次,所得混合物在室温下于氢气球下搅拌3小时,直至根据LCMS显示反应完成。所得混合物通过硅藻土过滤,真空浓缩滤液,以提供粗化合物5j2(1.4g,粗品)为黄色固体,将其直接用于下一步骤。ESIm/z:209.1(M–Boc+H)+。2-(4-(二苄基氨基)-3-氟苄基)-5-氧代吡咯烷-1-羧酸叔丁酯(5j)在室温下,向化合物5j2(0.22g,0.71mmol)的DMF(3mL)溶液中加入碳酸钾(0.35g,2.5mmol)和苄基溴(0.25mL,2.1mmol)。所得混合物在80℃下搅拌过夜,直至根据LCMS不再存在5j。冷却至室温后,将所得混合物倒入水(50mL)中,用DCM(25mLx2)萃取。合并的有机溶液用水(25mLx2)和盐水(50mLx1)洗,经硫酸钠干燥,真空浓缩,得到化合物5j(0.33g,95%粗收率)为黄色油状物。ESIm/z:489.3(M+H)+。(R)-2-(4-(苄氧基)-3-硝基苄基)-5-氧代吡咯烷-1-羧酸叔丁酯(5k)按照化合物5的一般方法,在经硅胶柱色谱法(用乙酸乙酯/石油醚,v/v=1/1洗脱)纯化后,得到化合物5k(0.5g,62%收率)为白色固体。ESIm/z:327.1(M–Boc+H)+。2-(3-(苄氧基)-4-硝基苄基)-5-氧代吡咯烷-1-羧酸叔丁酯(5l)按照化合物5的一般方法,在经硅胶柱色谱法(用乙酸乙酯/石油醚,v/v=1/1洗脱)纯化后,得到化合物5l(0.6g,74%收率)为白色固体。ESIm/z:327.1(M–Boc+H)+。化合物7(a、b、d、h-j)的一般方法在-78℃下,向化合物5(1.0当量)的THF(0.1g/mL)溶液中加入双(三甲基甲硅烷基)氨基锂的己烷溶液(1M,2.5当量),将混合物在-78℃下搅拌30分钟,然后在-78℃下一次性加入碘甲烷(4当量)。所得混合物在-78℃下搅拌2小时直至化合物5完全消耗,通过LCMS监测。使反应混合物升温至室温,向混合物中加入氢氧化钠水溶液(2M,2-3当量)。将所得混合物在室温下搅拌2小时,通过LCMS监测。反应完成后,将反应冷却至0℃,并通过盐酸(1M)水溶液酸化至pH3。混合物用盐水稀释直至混合物分成两层。水层用乙酸乙酯萃取(3次),合并的有机溶液经硫酸钠干燥,真空浓缩。残余物经反相快速色谱法(5-95%乙腈的水溶液)纯化,得到化合物7(15-46%收率)为浅黄色固体。(4S)-4-{[(叔丁氧基)羰基]氨基}-2,2-二甲基-5-苯基戊酸(7a)按照化合物7的一般方法,得到化合物7a(0.31g,46%收率)为浅黄色油状物。ESIm/z:665(2M+Na)+。(4S)-4-{[(叔丁氧基)羰基]氨基}-5-(4-氟苯基)-2,2-二甲基戊酸(7b)按照化合物7的一般方法,得到化合物7b(0.44g,15%收率)为浅黄色油状物。ESIm/z:701(2M+Na)+。(4S)-4-{[(叔丁氧基)羰基]氨基}-2,2-二甲基-5-(4-硝基苯基)戊酸(7d)按照化合物7的一般方法,得到化合物7d(1.2g,26%收率)为浅黄色油状物。ESIm/z:311(M-55)+。1HNMR(500MHz,CDCl3)δ8.18-8.13(m,2H),7.38-7.31(m,2H),6.98-6.91(m,1H),4.00-3.88(m,1H),2.87-2.68(m,2H),2.26-2.14(m,1H),1.46-1.39(m,1H),1.35(s,1H),1.25-1.13(m,15H)ppm。(4S)-5-(4-氨基苯基)-4-{[(叔丁氧基)羰基]氨基}-2,2-二甲基戊酸(7e)在氮气氛、室温下,向化合物7d(0.50g,1.4mmol)的甲醇(10mL)和乙酸乙酯(3mL)溶液中加入Pd/C(10%Pd,0.10g)。混合物在氢气氛下于室温搅拌2小时,通过LCMS进行监测。反应混合物通过硅藻土过滤,硅藻土用甲醇洗(3次)。合并的滤液真空浓缩,得到化合物7e(0.46g,99%收率)为浅黄色固体,其无需纯化即可用于下一步骤。ESIm/z:281(M–tBu+H)+。(4S)-4-氨基-5-(4-氨基-3-氯苯基)-2,2-二甲基戊酸,TFA盐(A-2b)(图5A)向中间体Boc-A-2d(或7e)(0.55g,1.6mmol)的DMF(10mL)溶液中加入N-氯琥珀酰亚胺(NCS)(0.24g,1.8mmol),混合物在RT下搅拌过夜,由LCMS进行监测。所得混合物用乙酸乙酯(150mL)稀释,用水和盐水洗,经硫酸钠干燥,浓缩。残余物经硅胶柱色谱法(50%乙酸乙酯的石油醚溶液)纯化,得到Boc-A-2b(0.48g,ESIm/z315.0(M–tBu+H)+)为浅黄色固体,将其溶于TFA(2mL)。所得混合物在室温下搅拌15分钟,直至根据LCMS已完全脱去Boc。真空除去挥发物,得到粗化合物A-2b(0.64g,TFA盐,由Boc-A-2d得到的收率为80%)为浅黄色固体,其无需进一步纯化即可直接使用。ESIm/z271.1(M+H)+。(4S)-4-{[(叔丁氧基)羰基]氨基}-5-(4-{[(9H-芴-9-基甲氧基)羰基]氨基}苯基)-2,2-二甲基戊酸(7c)在室温下,向化合物7e(0.46g,1.4mmol)的DCM(10mL)混合物中加入吡啶(0.22g,2.7mmol),将混合物搅拌3分钟,然后加入氯甲酸9-芴基甲酯(Fmoc-Cl,0.53g,2.1mmol)。然后将混合物在室温下搅拌2小时,通过LCMS进行监测。混合物经制备型HPLC(三氟乙酸体系)纯化,得到化合物7c(0.20g,26%收率)为白色固体。ESIm/z:581(M+Na)+。1HNMR(500MHz,CH3OH-d4)δ7.83(d,J=7.5Hz,2H),7.72(d,J=7.2Hz,2H),7.50-7.28(m,6H),7.20-7.05(m,2H),4.55-4.38(m,2H),4.30(t,J=6.7Hz,1H),3.90-3.80(m,1H),2.75-2.50(m,2H),1.90-1.80(m,1H),1.70-1.60(m,1H),1.38-1.10(m,15H)ppm。(S)-4-((叔丁氧基羰基)氨基)-5-(4-((叔丁氧基羰基)氨基)苯基-3,5-d2)-2,2-二甲基戊酸(7g)向化合物7e(0.10g,0.30mmol)的D2O(1mL)混合物中加入浓DCl(0.05mL),其中将化合物7e溶解。将溶液密封,并于140℃下用微波照射2.5小时。冷却至室温后,通过注射器向混合物中加入浓DCl(2mL)。然后通过油浴将密封管加热至120℃。将反应混合物在此温度下搅拌过夜,通过LCMS进行监测。冷却至室温后,混合物用饱和碳酸氢钠溶液中和至pH8。真空浓缩水溶液,残余物用乙酸乙酯和水分离。水层冻干,将残余物(50mg,含无机盐)溶于二氧六环-水的混合物(3mL,v/v=2/1)。在室温下,向所得溶液中加入碳酸钠(66mg,0.63mmol)和Boc2O(50mg,0.23mmol)。混合物在室温下搅拌过夜,通过LCMS进行监测。真空除去挥发物,残余物经反相快速色谱法(5-95%乙腈水溶液(含10mM碳酸氢铵))纯化,得到化合物7g(15mg,11%收率)为白色固体。ESIm/z:461(M+Na)+。5-(3-((苄氧基羰基)(甲基)氨基)-4-氟苯基)-4-(叔丁氧基羰基氨基)-2,2-二甲基戊酸(7h)按照化合物7的一般方法,得到化合物7h(0.23g,21%收率)为无色油状物。ESIm/z:403.2(M-55)+。4-{[(叔丁氧基)羰基]氨基}-5-[3-(二苄基氨基)-4-氟苯基]-2,2-二甲基戊酸(7i)按照化合物7的一般方法,使用化合物5i,得到化合物7i(2.1g,24%收率)为黄色油状物。ESIm/z:535.2(M+H)+。4-{[(叔丁氧基)羰基]氨基}-5-[4-(二苄基氨基)-3-氟苯基]-2,2-二甲基戊酸(7j)按照化合物7的一般方法,使用化合物5j,得到化合物7j(60mg,17%收率)为黄色油状物。ESIm/z:535.2(M+H)+。(S)-5-(4-(苄氧基)-3-硝基苯基)-4-((叔丁氧基羰基)氨基)-2,2-二甲基戊酸(7k)按照化合物7的一般方法,得到化合物7k(0.1g,24%收率)为白色固体。ESIm/z:373.1(M–Boc+H)+。5-(3-(苄氧基)-4-硝基苯基)-4-((叔丁氧基羰基)氨基)-2,2-二甲基戊酸(7l)按照化合物7的一般方法,得到化合物7k(0.2g,36%收率)为白色固体。ESIm/z:373.1(M–Boc+H)+。中间体I的一般方法在室温下,通过注射器向化合物7的DCM溶液(50mg/mL)中加入三氟乙酸(VTFA/VDCM=1/3)。混合物在室温下搅拌2小时,直至根据LCMS已完全脱去Boc。真空除去挥发物,残余物经制备型HPLC(三氟乙酸体系)纯化,得到中间体Ia-c(80-94%收率)为白色固体。(S)-4-氨基-2,2-二甲基-5-苯基戊酸(Ia)按照中间体I的一般方法,得到Ia(0.20g,94%收率)为白色固体。ESIm/z:222(M+H)+。1HNMR(500MHz,DMSOd6)δ12.64(s,1H),7.77(s,2H),7.38-7.33(m,2H),7.30-7.23(m,3H),3.45-3.37(m,1H),2.90-2.74(m,2H),1.83-1.68(m,2H),1.07(s,3H),1.03(s,3H)ppm。(4S)-4-氨基-5-(4-氟苯基)-2,2-二甲基戊酸(Ib)按照中间体I的一般方法,得到Ib(85mg,80%收率)为白色固体。ESIm/z:240(M+H)+。1HNMR(400MHz,MeOH-d4)δ7.36-7.25(m,2H),7.12(t,J=8.7Hz,2H),3.56-3.44(m,1H),3.03-2.81(m,2H),1.97-1.89(m,1H),1.78-1.70(m,1H),1.23(s,3H),1.07(s,3H)ppm。(4S)-4-氨基-5-(4-{[(9H-芴-9-基甲氧基)羰基]氨基}苯基)-2,2-二甲基戊酸(Ic)按照中间体I的一般方法,得到Ic(60mg,92%收率)为白色固体。ESIm/z:459(M+H)+。1HNMR(500MHz,MeOH-d4)δ7.84(d,J=7.5Hz,2H),7.72(d,J=7.5Hz,2H),7.52-7.40(m,4H),7.35(t,J=7.4Hz,2H),7.20(d,J=7.8Hz,2H),4.52(d,J=5.6Hz,2H),4.30(t,J=6.6Hz,1H),3.51-3.44(m,1H),2.94-2.84(m,2H),1.96-1.87(m,1H),1.78-1.72(m,1H),1.23(s,3H),1.09(s,3H)ppm。(S)-4-氨基-5-(4-氨基苯基-3,5-d2)-2,2-二甲基戊酸(Ig)按照中间体I的一般方法,得到中间体Ig(10mg,80%收率)为棕色油状物。ESIm/z:239(M+H)+。4-氨基-5-(3-(((苄氧基)羰基)(甲基)氨基)-4-氟苯基)-2,2-二甲基戊酸(Ih)按照中间体I的一般方法,得到中间体Ih(0.18g,97%收率)为棕色油状物。ESIm/z:403(M+H)+。4-氨基-5-[3-(二苄基氨基)-4-氟苯基]-2,2-二甲基戊酸(Ii)按照中间体I的一般方法,得到中间体Ii(50mg,99%收率)为棕色油状物。ESIm/z:435(M+H)+。4-氨基-5-[4-(二苄基氨基)-3-氟苯基]-2,2-二甲基戊酸(Ij)按照中间体I的一般方法,得到中间体Ij(40mg,99%收率)为棕色油状物。ESIm/z:435(M+H)+。(S)-4-氨基-5-(4-(苄氧基)-3-硝基苯基)-2,2-二甲基戊酸(Ik)按照中间体I的一般方法,得到中间体Ik(78mg,99%收率)为白色固体。ESIm/z:373.1(M+H)+。4-氨基-5-(3-(苄氧基)-4-硝基苯基)-2,2-二甲基戊酸(Il)按照中间体I的一般方法,得到中间体Il(0.1g,99%收率)为白色固体。ESIm/z:373.1(M+H)+。图4中中间体II和III的合成中间体IIa-IIc的合成2-乙酰基噻唑-4-羧酸乙酯(11)(图2)向半胱氨酸盐酸盐乙酯8(15g,81mmol)的乙醇和水(1.5L,v/v=1)混合物的溶液中依次加入碳酸氢钠(6.8g,81mmol)和丙酮醛水溶液9(35%,18mL,0.11mol)。反应混合物在室温下搅拌18小时,然后在<25℃水浴下浓缩至其原始体积的一半。向残余水溶液中加入固体氯化钠直至饱和,并将水溶液用DCM萃取(两次)。合并的有机溶液用硫酸钠干燥,真空浓缩,得到粗化合物10,其无需任何进一步纯化即可直接使用。向化合物10(16g,81mmol)的DCM(0.50L)溶液中加入活化的二氧化锰(0.14kg,1.6mol)。反应混合物在65℃搅拌过夜,通过LCMS进行监测。反应冷却至室温后,悬浮液通过硅藻土垫过滤,硅藻土/残余物用乙酸乙酯(2×200mL)洗。合并的滤液真空浓缩。粗产物经快速色谱法(用乙酸乙酯/己烷,v/v=1:3洗脱)纯化,得到化合物11(5.9g,两步收率为37%)为黄色固体。ESIm/z:199.9(M+H)+.1HNMR(400MHz,CDCl3)δ8.44(s,1H),4.49(q,J=7.1Hz,2H),2.79(s,3H),1.43(t,J=7.1Hz,3H)ppm。2-(4-甲基戊-2-烯酰基)噻唑-4-羧酸乙酯(13)(图2)在氮气氛下,将11(2.9g,15mmol)的无水THF(50mL)溶液冷却至0℃。通过注射器向此溶液中加入四氯化钛的甲苯溶液(1M,32mL,32mmol)。将所得混合物在0℃下搅拌30分钟,然后冷却至-78℃。在-78℃,向混合物中加入TEA(4.5mL,32mmol)。将反应混合物在-78℃下搅拌10分钟,然后滴加纯异丁醛(1.6mL,17mmol)。反应在-78℃下搅拌1小时直至根据LCMS反应完成。将反应升温至室温后,反应用饱和氯化铵水溶液(50mL)淬灭,然后用乙酸乙酯萃取。合并的有机溶液经无水硫酸钠干燥,过滤,真空浓缩。残余物经快速色谱法(用10%乙酸乙酯的己烷溶液洗脱)纯化,得到化合物13(1.5g,41%收率)为无色油状物。ESIm/z:253.9(M+H)+。1HNMR(400MHz,CDCl3)δ8.44(s,1H),7.34-7.34(m,2H),4.49(q,J=7.0Hz,2H),2.64(m,1H),1.45(t,J=7.0Hz,3H),1.18(d,J=7.0Hz,6H)ppm。N-(己氧基)氨基甲酸叔丁酯(15a)(图2)向羟基氨基甲酸叔丁酯(2.1g,16mmol)的乙腈(50mL)溶液中依次加入1-溴己烷(2.7g,18mmol)和DBU(2.5g,17mmol)的DCM或MeCN溶液。将反应在室温下搅拌12小时,通过TLC和LCMS进行监测。反应混合物用HCl(0.1N)水溶液淬灭,然后用乙酸乙酯萃取。合并的有机层用硫酸钠干燥,真空浓缩。残余物经快速色谱法(用0-100%乙酸乙酯的石油醚溶液洗脱)纯化,得到化合物15a(1.7g,50%收率)为无色油状物。1HNMR(400MHz,CDCl3)δ7.17(brs,1H),3.84(t,J=6.7Hz,2H),1.65-1.58(m,2H),1.49(s,9H),1.40-1.26(m,6H),0.89(t,J=6.8Hz,3H)ppm。3-(4-硝基苄氧基)丙氧基氨基甲酸叔丁酯(15b)(图2)将1-(溴甲基)-4-硝基苯(0.10kg,0.46mol)、1,3-丙二醇(0.39L,5.1mol)和氢氧化钾(27g,0.49mol)的混合物在80℃下过夜。反应冷却后,将混合物倒入水(500mL)中,过滤。滤液用DCM(2x400mL)萃取。合并的有机层用水洗,经硫酸钠干燥,真空浓缩,得到3-[(4-硝基苯基)甲氧基]丙烷-1-醇(95g,97%)为棕色油状物[ESIm/z:212(M+H)+。1HNMR(500MHz,CDCl3)δ8.23(d,J=8Hz,2H),7.52(d,J=8Hz,2H),4.65(s,2H),3.83(t,J=6Hz,2H),3.73(t,J=6Hz,2H),2.04(brs,1H),1.96-1.91(m,2H)ppm],其中纯度通过LCMS确定,此物料无需进一步纯化即可用于下一步骤。将粗制的3-[(4-硝基苯基)甲氧基]丙-1-醇(89g,0.42mol)溶于DCM(0.90L),向所得溶液中加入TEA(85g,0.84mol)。将溶液冷却至0℃,然后滴加甲磺酰氯(72g,0.63mol)。将反应混合物在0℃下搅拌30分钟,通过LCMS进行监测,然后用饱和氯化铵水溶液洗(3次)。有机层经硫酸钠干燥,过滤。向滤液中依次加入羟基氨基甲酸叔丁酯(90g,0.68mol)和DBU(90g,0.59mol)的DCM或MeCN溶液。所得混合物在室温下搅拌过夜,然后再次加入羟基氨基甲酸叔丁酯(30g,0.23mol)和DBU(50g,0.33mol)的DCM或MeCN溶液。将混合物在室温下再搅拌2天。LCMS显示大部分起始材料耗尽。反应混合物用饱和氯化铵水溶液洗(3次),经硫酸钠干燥,真空浓缩。残余物经快速色谱法(用0-15%乙酸乙酯的石油醚溶液洗脱)纯化,得到化合物15b(90g,65%收率)为黄色油状物。ESIm/z:349(M+Na)+。1HNMR(500MHz,CDCl3)δ8.23(d,J=8.7Hz,2H),7.53(d,J=8.6Hz,2H),7.18(s,1H),4.64(s,2H),4.01(t,J=6.2Hz,2H),3.68(t,J=6.2Hz,2H),2.00(q,J=6.2Hz,2H),1.50(s,9H)ppm。N-(戊-4-炔-1-基氧基)氨基甲酸叔丁酯(15c)(图2)向羟基氨基甲酸叔丁酯(20g,15mmol)的DMSO(0.50L)溶液中依次加入叔丁醇钾(13g,12mmol)和5-氯-1-戊炔(10g,10mmol)。将反应混合物在室温和氮气下搅拌16小时,通过LCMS进行监测。然后混合物用饱和氯化铵水溶液淬灭。水溶液用乙酸乙酯萃取(两次)。合并的有机溶液用水洗(3次),经硫酸钠干燥,浓缩。粗产物经硅胶柱色谱法(用5-20%乙酸乙酯的石油醚溶液洗脱)纯化,得到化合物15c(7.2g,36%收率)为无色油状物。1HNMR(400MHz,CDCl3)δ7.18(s,1H),3.95(t,J=6.2Hz,2H),2.33(d,J=2.6Hz,2H),1.96(s,1H),1.89-1.81(m,2H),1.49(s,9H)ppm。2-(3-{[(叔丁氧基)羰基](己氧基)氨基}-4-甲基戊酰基)-1,3-噻唑-4-羧酸乙酯(16a)(图2)在氮气下,在0℃下,向化合物15a(2.6g,12mmol)的THF(45mL)溶液中分几批加入氢化钠(60%的矿物油溶液,0.60g,12mmol)。混合物在室温下搅拌20分钟,然后滴加化合物13(1.5g,4.0mmol)的THF(15mL)溶液。所得混合物在室温下搅拌1小时,直至根据TLC(10%乙酸乙酯的己烷溶液)13耗尽。反应混合物用乙酸乙酯和盐水稀释。水层用乙酸乙酯萃取,合并的有机溶液经硫酸钠干燥,真空浓缩。残余物经硅胶柱色谱法(用10%乙酸乙酯的己烷溶液洗脱)纯化,得到化合物16a(0.25g,60%收率)为黄色油状物。1HNMR(400MHz,CDCl3)δ8.42(s,1H),4.45(q,J=7.2Hz,2H),4.38-4.30(m,1H),3.87-3.76(m,2H),3.61-3.53(m,1H),3.43-3.37(m,1H),2.09-1.99(m,1H),1.56-1.43(m,2H),1.46(s,9H),1.43(t,J=7.2Hz,3H),1.33-1.21(m,6H),1.02(t,J=6.7Hz,6H),0.86(t,J=7.1Hz,3H)ppm。2-{3-[10,10-二甲基-1-(4-硝基苯基)-8-氧代-2,6,9-三氧杂-7-氮杂十一烷-7-基]-4-甲基戊酰基}-1,3-噻唑-4-羧酸乙酯(16b)(图2)将化合物15b(5.2g,16mmol)和化合物13(2.7g,11mmol)的甲苯(50mL)混合物用冰水浴冷却至5℃,向所得溶液中加入四丁基溴化铵(0.34g,1.1mmol)和氢氧化钾水溶液(50%,1.4g,13mmol)。混合物在室温下搅拌16小时。将混合物倒入饱和氯化铵水溶液(200mL)中,悬浮液用乙酸乙酯萃取(3次)。合并的有机层用盐水洗,经硫酸钠干燥,真空浓缩。残余物经快速色谱法(用0-30%乙酸乙酯的石油醚溶液洗脱)纯化,得到粗品16b,将其再次通过反相快速色谱法(ODS柱,50-100%乙腈水溶液(含10mM碳酸氢铵))分离,得到化合物16b(3.2g,52%收率)为黄色油状物。ESIm/z:602(M+Na)+。1HNMR(500MHz,CDCl3)δ8.42(s,1H),8.21(d,J=8.6Hz,2H),7.53(d,J=8.4Hz,2H),4.63(s,2H),4.44(q,J=6.8Hz,2H),4.38-4.33(m,1H),4.04-3.96(m,2H),3.64-3.55(m,4H),3.50-3.30(m,1H),2.05-1.90(m,2H),1.47-1.41(m,12H),1.01(d,J=6.7Hz,6H)ppm。2-(3-{[(叔丁氧基)羰基](戊-4-炔-1-基氧基)氨基}-4-甲基戊酰基)-1,3-噻唑-4-羧酸乙酯(16c)(图2)按照制备16b的方法,得到16c(38g,84%收率)为油状物。ESIm/z:475(M+Na)+。1HNMR(400MHz,CDCl3)δ8.42(s,1H),4.44(q,J=6.9Hz,2H),4.36(td,J=9.5,3.8Hz,1H),3.99-3.87(m,3H),3.65-3.67(m,1H),3.45-3.30(m,1H),2.43-2.15(m,3H),1.83-1.70(m,2H),1.46(s,9H),1.43(t,J=7.1Hz,3H),1.01(d,J=6.5Hz,6H)ppm。2-((1R,3R)-3-(叔丁氧基羰基(己氧基)氨基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(17a);和2-((1R,3S)-3-(叔丁氧基羰基(己氧基)氨基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(17a2)(图3)将(S)-2-甲基-CBS-噁唑硼烷的甲苯商购溶液(1M,64μL,64μmol)用无水THF(3mL)稀释,并冷却至0℃。在0℃下,通过注射器向此溶液中加入BH3·Me2S的THF溶液(2M,0.38mL,0.38mmol)。将溶液在0℃下搅拌10分钟,然后滴加16a(0.15g,0.32mmol)的干燥THF(2mL)溶液。将反应升温至室温,搅拌过夜。反应用甲醇(1mL)猝灭,真空除去挥发物。残余物经快速色谱法(用20%乙酸乙酯的己烷溶液洗脱)纯化,得到17a(70mg,Rf=0.3,20%乙酸乙酯的己烷溶液)和非对映异构体17a2(61mg,Rf=0.25,20%乙酸乙酯的己烷溶液)(86%的总收率)。17a:[a]D23=+7.296(c=1.82,CHCl3,手性分离后)。ESIm/z:473(M+H)+。1HNMR(500MHz,CDCl3)δ8.14(s,1H),4.99(d,J=10.2Hz,1H),4.42(q,J=7.1Hz,2H),4.00(dd,J=14.2,6.8Hz,1H),3.92(dd,J=13.7,7.0Hz,2H),2.41(m,1H),2.00(m,1H),1.92(t,J=11.2Hz,1H),1.62(m,2H),1.53(s,9H),1.41(m,5H),1.32(m,5H),1.03(d,J=6.6Hz,3H),0.97(d,J=6.7Hz,3H),0.91(t,J=6.8Hz,3H)ppm。17a2:[a]D23=+28.81(c=1.24,CHCl3)。ESIm/z:473(M+H)+。1HNMR(500MHz,CDCl3)δ8.12(s,1H),5.12(d,J=6.6Hz,1H),4.42(q,J=7.1Hz,2H),4.09(s,1H),3.99(dd,J=14.3,6.9Hz,1H),3.88-3.78(m,2H),2.42(dt,J=14.8,3.3Hz,1H),2.12-2.06(m,1H),1.91(tt,J=13.3,6.6Hz,1H),1.63-1.57(m,2H),1.49(s,9H),1.42-1.33(m,5H),1.31-1.25(m,5H),0.98(dd,J=6.6,4.3Hz,6H),0.88(t,J=6.8Hz,3H)ppm。图3和图4中O-微管溶素手性中心的确定2-((1R,3R)-3-(叔丁氧基羰基氨基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(17A)将化合物17a(500mg,1.06mmol)、Mo(CO)6(1g,3.79mmol)、CH3CN(15mL)和H2O(5mL)的混合物在微波反应器中于120℃下搅拌8h。然后将混合物冷却,过滤,浓缩。向粗混合物中加入MeOH(10mL)和Boc2O(500mg,2.29mmol),所得混合物在室温下搅拌3小时。将混合物浓缩,然后悬浮于CH2Cl2(10mL)中,过滤。滤液浓缩,残余物经快速色谱法(硅胶,PE至PE/EA=60/40)纯化,然后经制备型HPLC(NH4HCO3/H2O/CH3CN)纯化,得到17A(25mg,6.3%)为白色固体。[a]D23=+13.571(c=0.56,CHCl3)。ESIm/z:373(M+H)+。1HNMR(500MHz,CDCl3)δ8.14(s,1H),5.22(d,J=3.8Hz,1H),5.02(d,J=11.2Hz,1H),4.58(d,J=9.6Hz,1H),4.42(q,J=7.1Hz,2H),3.77-3.69(m,1H),2.13-2.03(m,1H),1.85-1.68(m,2H),1.44-1.41(s,9H),1.40(t,J=7.1Hz,3H),0.96(d,J=6.8,3.0Hz,3H),0.95(d,J=6.8Hz,3H)ppm。2-((1R,3S)-3-(叔丁氧基羰基氨基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(17B)将化合物17a2(600mg,1.27mmol)、Mo(CO)6(1.2g,4.55mmol)、CH3CN(12mL)和H2O(4mL)的混合物在微波反应器中于100℃下搅拌2小时,并于120℃搅拌6小时。过滤混合物,浓缩。将混合物溶于MeOH(10mL),加入Boc2O(600mg,2.75mmol)。混合物在室温下搅拌过夜。将混合物浓缩,然后悬浮于CH2Cl2中,经Na2SO4干燥,过滤。滤液浓缩,残余物经快速色谱法(硅胶,PE至PE/EA=50/50)纯化,然后经制备型HPLC(NH4HCO3/H2O/CH3CN)纯化。将所得合并的级分浓缩,冻干,得到17B(85mg,18%)为白色固体。[a]D23=+82.957(c=1.6,CHCl3)。ESIm/z:373(M+H)+。1HNMR(500MHz,CDCl3)δ8.04(s,1H),4.90(s,1H),5.07(s,1H),4.53(d,J=8.9Hz,1H),4.35(q,J=7.1Hz,2H),3.58(m,1H),2.30(d,J=14.8Hz,1H),2.00-1.85(m,2H),1.34(s,9H),1.32(t,J=Hz,3H),0.9(d,J=6.8Hz,3H),0.86(d,J=6.8Hz,3H)。表4总结了氯仿-d中来自17a的17A和来自17a2的17B的1HNMR化学位移,以及(1R,3R)-17A和(1R,3S)-17B的已公布1HNMR数据(OrganicandBiomolecularChemistry2013,11(14),2273-2287)。回顾所有分析数据,结论是:17a是(1R,3R)-17a,其可转化为(1R,3R)-17A,而17a2是(1R,3S)-17a,其可转化为(1R,3S)-17B。表4.(1R,3R)-17A、(1R,3R)-17A、(1R,3S)-17B和(1R,3S)-17B的NMR数据2-((1R,3R)-3-(叔丁氧基羰基(3-(4-硝基苄氧基)丙氧基)氨基)-1-羟基-4–甲基戊基)噻唑-4-羧酸乙酯(17b)使用与上述制备(1R,3R)-17a相似的反应条件,分别得到粗品(1R,3R)-17b(2.7g,80%ee,43%收率)和非对映异构体(1R,3S)-17b(2.5g,39%收率)。化合物17b(粗品)通过手性SFC进一步纯化,得到对映异构体纯(1R,3R)-17b(1.7g,63%收率)为黄色油状物。(1R,3R)-17b的手性使用与17a相同的方法进行鉴定。对于(1R,3R)-17b:ESIm/z:604(M+Na)+。1HNMR(400MHz,CDCl3)δ8.20(d,J=8.7Hz,2H),8.13(s,1H),7.52(d,J=8.7Hz,2H),4.97(d,J=10.0Hz,1H),4.64(s,2H),4.42(q,J=7.1Hz,2H),4.15-4.03(m,3H),3.91(t,J=9.7Hz,1H),3.69(t,J=6.4Hz,2H),2.43-2.36(m,1H),2.03-1.86(m,4H),1.52(s,9H),1.41(t,J=7.1Hz,3H),1.02(d,J=6.6Hz,3H),0.94(d,J=6.7Hz,3H)ppm。手性SFC柱OD-H,CO2/MeOH(0.2%甲醇-氨)。保留时间:5.58min,面积%:>99%。对于(1S,3S)-17b:ESIm/z:604(M+Na)+。1HNMR(500MHz,CDCl3)δ8.21(d,J=8.7Hz,2H),8.13(s,J=4.0Hz,1H),7.51(d,J=8.6Hz,2H),5.15-5.12(m,1H),4.62(s,2H),4.45-4.41(m,2H),4.15(dd,J=14.4,6.3Hz,1H),4.05(dd,J=14.2,6.1Hz,1H),3.95(s,1H),3.80(t,J=8.1Hz,1H),3.66(t,J=6.3Hz,2H),2.43(dt,J=14.8,3.5Hz,1H),2.13-1.89(m,4H),1.50(s,9H),1.42(t,J=7.1Hz,3H),1.00-0.98(m,6H)ppm。手性SFC柱OD-H,CO2/MeOH(0.2%甲醇-氨)。保留时间:4.37min,面积%:>99%。2-((1R,3R)-3-(叔丁氧基羰基(戊-4-炔基氧基)氨基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(17c-P2);和2-((1S,3S)-3-(叔丁氧基羰基(戊-4-炔基氧基)氨基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(17c-P1);2-((1R,3S)-3-(叔丁氧基羰基(戊-4-炔基氧基)氨基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(17c-P3);和2-((1S,3R)-3-(叔丁氧基羰基(戊-4-炔基氧基)氨基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(17c-P4)在0℃下,向化合物16c(93g,0.21mol)的乙醇(0.30L)溶液中分批加入硼氢化钠(7.8g,0.21mol)。将溶液在0℃下搅拌3小时直至根据LCMS反应完成。在0℃下,用水(1L)淬灭反应,然后水溶液用DCM(1.5L)萃取。合并的有机层真空浓缩。粗产物经硅胶柱色谱法(用5-20%乙酸乙酯的石油醚溶液洗脱)纯化,得到顺式17c(粗品)(29g,31%收率)和反式17c(26g,27%收率)。顺式异构体通过手性SFC进一步纯化,得到(1S,3S)-17c(峰1)(6g,21%收率)和纯(1R,3R)-17c(峰2)(8.2g,28%收率,99%ee)。反式17c(2g)通过SFC进行分离得到(1R,3S)-17c-P3(0.52g,26%收率)和(1S,3R)-17c-P4(0.55g,27%收率)。对于(1S,3S)-17c(峰1):ESIm/z:477(M+Na)+。1HNMR(500MHz,CDCl3)δ8.13(s,1H),4.98(d,J=9.5Hz,1H),4.41(q,J=7.1Hz,2H),4.10(dd,J=14.0,6.2Hz,1H),4.03(dd,J=13.6,6.3Hz,1H),3.92(t,J=9.8Hz,1H),2.48-2.39(m,1H),2.36(td,J=6.9,2.5Hz,2H),2.08(t,J=2.4Hz,1H),2.06-1.95(m,1H),1.87(dt,J=13.0,8.9Hz,3H),1.52(s,9H),1.40(t,J=7.1Hz,3H),1.02(d,J=6.5Hz,3H),0.95(d,J=6.7Hz,3H)ppm。所述(1R,3R)-17c(峰2):ESIm/z:477(M+Na)+。1HNMR(500MHz,CDCl3)δ8.13(s,1H),4.98(d,J=9.5Hz,1H),4.41(q,J=7.1Hz,2H),4.10(dd,J=14.0,6.2Hz,1H),4.03(dd,J=13.6,6.3Hz,1H),3.92(t,J=9.8Hz,1H),2.48-2.39(m,1H),2.36(td,J=6.9,2.5Hz,2H),2.08(t,J=2.4Hz,1H),2.06-1.95(m,1H),1.87(dt,J=13.0,8.9Hz,3H),1.52(s,9H),1.40(t,J=7.1Hz,3H),1.02(d,J=6.5Hz,3H),0.95(d,J=6.7Hz,3H)。手性SFC柱EnantioPakOZ-H,CO2/EtOH(0.2%甲醇-氨)。保留时间:0.71,面积%:100%。对于(1R,3S)-17c-P3:ESIm/z:477(M+Na)+。1HNMR(500MHz,CDCl3)δ8.12(s,1H),5.19-5.06(m,1H),4.42(q,J=7.1Hz,2H),4.09(dd,J=14.3,6.1Hz,1H),3.98(dd,J=14.3,6.1Hz,1H),3.91(s,1H),3.80(t,J=8.4Hz,1H),2.42(dt,J=14.9,3.4Hz,1H),2.32(td,J=7.0,2.6Hz,2H),2.12(ddd,J=14.9,10.4,8.9Hz,1H),1.94(dt,J=16.4,4.7Hz,2H),1.83(p,J=6.7Hz,2H),1.50(s,9H),1.40(t,J=7.1Hz,3H),0.99(s,3H),0.98(d,J=0.8Hz,3H)。对于(1S,3R)-17c-P4:ESIm/z:477(M+Na)+。1HNMR(500MHz,CDCl3)δ8.12(s,1H),5.16-5.10(m,1H),4.44-4.39(m,2H),4.13-4.05(m,1H),3.98(dd,J=14.2,6.2Hz,1H),3.91(s,1H),3.80(t,J=8.2Hz,1H),2.42(dt,J=14.9,3.4Hz,1H),2.32(td,J=7.0,2.6Hz,2H),2.18-2.07(m,1H),1.94(dt,J=16.5,4.6Hz,2H),1.83(p,J=6.6Hz,2H),1.50(s,9H),1.40(t,J=7.1Hz,3H),0.99(s,3H),0.98(s,3H)。17c异构体的手性采用与17a相同的方法进行鉴定。对于两种17c顺式异构体:17c-P2转化为(1R,3R)-17A,而17c-P1转化为(1S,3S)-17A。对于两种17c反式异构体:17c-P3转化为(1R,3S)-17B,而17c-P4转化为(1S,3R)-17B。下表5总结了来自17c(P1、P2、P3、P4)的17A和17B异构体在氯仿-d中的1HNMR化学位移。在回顾所有分析数据后,结论是:17c-P2是(1R,3R)-17c,其可转化为(1R,3R)-17A(已报道),而17c-P4是(1S,3R)-17c,其可转化为(1S,3R)-17B(已报道)。表5.(1R,3R)-17A、(1R,3R)-17A、(1S,3S)-17A、(1R,3S)-17B、(1S,3R)-17B和(1R,3S)-17B的NMR数据顺式17c和反式17c的手性SFC分离条件总结在下表6中。表6.2-[(1R,3R)-3-{[(叔丁氧基)羰基](己氧基)氨基}-1-[(叔丁基二甲基甲硅烷基)氧基]-4-甲基戊基]-1,3-噻唑-4-羧酸乙酯(18a)在4℃下,向化合物17a(3.2mmol)的DCM(16mL)溶液中依次加入2,6-二甲基吡啶(1.8mL,38.4mmol)和叔丁基二甲基氯硅烷(TBSCl,1.7mL,19.2mmol)。混合物在4℃下搅拌30分钟。使所得混合物升温至室温并搅拌2小时,直至根据LCMS显示反应完成。然后将反应混合物倒入盐水中。水层用乙酸乙酯萃取。合并的有机层用盐水洗,经硫酸钠干燥,真空浓缩。残余物经快速色谱法(用25%乙酸乙酯的己烷溶液洗脱)纯化,得到化合物18a(1.8g,95%收率)为无色油状物。1HNMR(400MHz,CDCl3):δ9.92(s,1H),5.24(d,J=2.5Hz,1H),4.43-4.36(m,2H),4.13-4.10(m,1H),4.02-3.99(m,1H),3.86(m,1H),2.15-2.09(m,1H),1.89–1.83(m,2H),1.67-1.56(m,2H),1.40(s,9H),1.41–1.25(m,9H),0.95-0.83(m,18H),0.15(s,3H),0.0(s,3H)ppm。2-[(1R,3R)-1-[(叔丁基二甲基甲硅烷基)氧基]-3-[10,10-二甲基-1-(4-硝基苯基)-8-氧代-2,6,9-三氧杂-7-氮杂十一烷-7-基]-4-甲基戊基]-1,3-噻唑-4-羧酸乙酯(18b)向化合物17b(1.7g,2.9mmol)的DMF(50mL)混合物中加入咪唑(2.37g,34.8mmol)和TBSCl(2.69g,17.4mmol),混合物在室温下搅拌3天。将混合物倒入水(140mL)中,然后用乙酸乙酯萃取(两次)。合并的有机层用盐水洗,经硫酸钠干燥,真空浓缩。残余物经快速色谱法(用0-15%乙酸乙酯的石油醚溶液洗脱)纯化,得到化合物18b(1.8g,88%收率)为无色油状物。ESIm/z:696(M+H)+。1HNMR(500MHz,CDCl3)δ8.17(d,J=8.6Hz,2H),8.09(s,1H),7.47(d,J=8.5Hz,2H),5.24(d,J=8.6Hz,1H),4.60(s,2H),4.39(m,2H),4.19(m,2H),3.90(s,1H),3.70(m,2H),2.14(m,1H),2.01(m,2H),1.84(m,2H),1.52(s,9H),1.39(t,J=7.1Hz,3H),0.92(m,15H),0.16(s,3H),-0.08(s,3H)ppm。2-[(1R,3R)-3-{[(叔丁氧基)羰基](戊-4-炔-1-基氧基)氨基}-1-[(叔丁基二甲基甲硅烷基)氧基]-4-甲基戊基]-1,3-噻唑-4-羧酸乙酯(18c)使用与制备18b相同的方法,得到化合物18c(4.4g,70%收率)为油状物。ESIm/z:569(M+H)+。1HNMR(500MHz,CDCl3)δ7.96(s,1H),5.08(d,J=8.5Hz,1H),4.33-4.18(m,2H),4.02(dd,J=12.8,7.1Hz,1H),3.99-3.92(m,1H),3.74(brs,1H),2.23-2.17(m,2H),2.04-1.95(m,1H),1.78-1.65(m,5H),1.36(s,9H),1.25(s,3H),0.80-0.76(m,15H),0.00(s,3H),-0.25(s,3H)ppm。2-[(5R,7R)-2,2,3,3-四甲基-7-(丙烷-2-基)-4,9-二氧杂-8-氮杂-3-硅杂十五烷-5-基]-1,3-噻唑-4-羧酸乙酯(19a)将18a(1.8g,3.1mmol)的10%TFA的DCM(10mL)混合物在室温下搅拌24小时,然后真空浓缩,得到粗化合物19a(1.7g,80%收率),其无需进一步纯化即可用于下一步骤。2-[(8R,10R)-12,12,13,13-四甲基-1-(4-硝基苯基)-8-(丙烷-2-基)-2,6,11-三氧杂-7-氮杂-12-硅杂十四烷-10-基]-1,3-噻唑-4-羧酸乙酯(19b)向化合物18b(1.4g,2.0mmol)的DCM(50mL)混合物中加入TFA(5.0mL),反应混合物在室温下搅拌4小时,直至根据LCMS监测Boc保护基团完全脱去。然后将混合物倒入饱和碳酸氢钠(100mL)水溶液中,用DCM萃取(3次)。合并的有机层经硫酸钠干燥,真空浓缩,得到化合物19b(1.2g,粗品,为TFA盐)为浅黄色油状物。ESIm/z:596(M+H)+。1HNMR(400MHz,CDCl3)δ8.22(d,J=8.8Hz,2H),8.11(s,1H),7.52(d,J=8.8Hz,2H),5.33(dd,J=6.8,3.8Hz,1H),4.62(s,2H),4.50-4.35(m,2H),3.81(t,J=6.3Hz,2H),3.62(t,J=6.4Hz,2H),2.89-2.85(m,1H),2.04-1.98(m,1H),1.97-1.84(m,3H),1.73-1.66(m,1H),1.42(t,J=7.2Hz,3H),0.96(s,9H),0.83(d,J=6.9Hz,6H),0.17(s,3H),0.00(s,3H)ppm。2-[(5R,7R)-2,2,3,3-四甲基-7-(丙烷-2-基)-4,9-二氧杂-8-氮杂-3-硅杂十四烷-13-炔-5-基]-1,3-噻唑-4-羧酸乙酯(19c)使用与制备19b相同的方法,得到化合物19c(3.4g,94%粗收率,为TFA盐)。ESIm/z:469(M+H)+。1HNMR(500MHz,CDCl3)δ8.11(s,1H),5.80(s,1H),5.33(dd,J=7.1,3.5Hz,1H),4.49-4.36(m,2H),3.75(t,J=6.2Hz,2H),2.84(ddd,J=10.0,4.0,1.7Hz,1H),2.27(td,J=7.2,2.6Hz,2H),2.05-1.98(m,1H),1.96(t,J=2.6Hz,1H),1.86(ddd,J=14.6,7.1,1.8Hz,1H),1.82-1.76(m,2H),1.72-1.65(m,1H),1.41(t,J=7.1Hz,3H),0.97(s,9H),0.82(dd,J=6.9,2.3Hz,6H),0.16(s,3H),0.00(s,3H)ppm。19e的合成如图11所示。2-(二甲氧基甲基)噻唑-4-羧酸甲酯(T2)(图11)在室温下,向化合物T1(0.57kg,2.7mol,Rf=0.5和0.6,PE:EA=2:1,20%PMA)的乙腈(15L)溶液中加入二氧化锰(2.5kg),将混合物加热至60℃搅拌6小时。然后将混合物通过硅藻土垫过滤,浓缩。得到化合物T2(0.65kg,Rf=0.55和0.65,PE:EA=2:1,UV)为黄色固体,其无需进一步纯化即可使用。2-甲酰基噻唑-4-羧酸甲酯(T3)在室温下,向化合物T2(0.65kg,3.0mol,Rf=0.55和0.65,PE:EA=2:1,UV)的丙酮(15L)溶液中加入浓盐酸(2.0L,6N),混合物加热至回流并搅拌1小时。然后将混合物冷却至室温,减压浓缩。将粗品溶于乙酸乙酯,有机相用饱和碳酸氢钠水溶液和盐水洗,经硫酸镁干燥,过滤,浓缩。残余物由50%乙酸乙酯的石油醚溶液重结晶,提供化合物T3(66g,三步总收率为14%,Rf=0.7,PE:EA=2:1,UV)为黄色固体。2-((R)-3-((S)-叔丁基亚磺酰亚胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸甲酯(T6)在室温下,将(S)-2-甲基丙烷-2-亚磺酰胺T4(7.3mL,68mmol)溶于100mL四氢呋喃(THF),向其中加入Ti(OEt)4(27mL,130mmol)和3-甲基-2-丁酮(8g,41mmol)。反应混合物回流过夜,然后冷却并加至盐水溶液中。过滤所得混合物,滤饼用EtOAc洗。将有机相浓缩,得到残余物,将其进行硅胶柱色谱法(DCM:EtOAc,4:1)纯化,得到亚磺酰亚胺T5(9.5g,37mmol,75%)为油状物。(参考文献:US9226974,2016)。将0.5M二异丙胺(27mL,0.27mol)的乙醚(0.63L)溶液冷却至0℃,向所得溶液中加入正丁基锂(0.12L,0.29mol,2.5M己烷溶液)。将溶液在0℃下搅拌20分钟,然后冷却至-78℃。缓慢加入亚磺酰胺T5(50g,0.27mol)的乙醚(0.55L)溶液,反应混合物在-78℃下再搅拌30分钟,加入三异丙氧化氯钛(0.14kg,0.53mol)的乙醚(150mL)溶液,将反应混合物在-78℃下再搅拌20分钟。然后向混合物中一次性加入醛T3(29g,0.17mol),将混合溶液在-78℃下搅拌12小时。然后所得溶液在-78℃下用THF/AcOH(150mL,v/v=4:1)溶液中和,然后使其升温至室温。用水(250mL)稀释后,所得混合物通过硅藻土过滤,滤饼用乙酸乙酯充分清洗。合并的滤液用盐水洗,经硫酸镁干燥,过滤,减压浓缩。残余物经硅胶柱色谱法纯化,得到化合物T6(50g,79%;Rf=0.6,PE:EA=1:1,UV)为黄色油状物。2-((1R,3R)-3-((S)-1,1-二甲基乙基亚磺酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸甲酯(T7)在-78℃下,向0.4M亚胺T6(62g,0.17mol)的THF(0.52L)溶液中加入乙醇钛(76mL,0.33mol),然后加入硼氢化钠(26g,0.69mol),然后使溶液在30分钟内缓慢升温至-45℃。将反应混合物在-45℃下搅拌12小时,然后用甲醇(125mL)缓慢稀释,保持反应的内部温度低于-30℃,直至停止逸出气体。将溶液升温至室温,进一步用水(1.4L)淬灭。所得悬浮液通过硅藻土垫过滤,滤饼用乙酸乙酯彻底清洗。合并的滤液用盐水洗一次,干燥,过滤,浓缩。残余物经硅胶柱色谱法纯化,提供T7(31g,50%收率,Rf=0.4,PE:EA=1:1,UV)为黄色油状物。2-((1R,3R)-3-氨基-1-羟基-4-甲基戊基)噻唑-4-羧酸甲酯盐酸盐(T8)向化合物T7(31g,86mmol)的甲醇(0.50L)溶液中加入盐酸盐的二氧六环溶液(1.0L,4.0N)。将反应混合物在室温下搅拌3小时,然后真空除去挥发物,得到粗产物T8为黄色固体,其无需纯化即可用于下一步骤(参见J.Am.Chem.Soc.2006,128,16018-16019)。2-((1R,3R)-3-(叔丁氧基羰基氨基)-1-羟基-4-甲基戊基)噻唑-4-羧酸甲酯(T9)在0℃下,向氨基醇T8(39g,86mmol)的THF(1.5L)溶液中加入三乙胺(21g,0.21mol)和二碳酸二叔丁酯(21g,98mmol)。使反应混合物升温至室温并搅拌过夜。过滤反应混合物,滤液浓缩,提供化合物T9(34g,Rf=0.6,PE:EA=2:1,UV)为白色固体,其无需纯化即可用于下一步骤。2-((5R,7R)-7-异丙基-2,2,3,3,11,11-六甲基-9-氧代-4,10-二氧杂-8-氮杂-3-硅杂十二烷-5-基)噻唑-4-羧酸甲酯(T10)将T9(34g,86mmol,Rf=0.3,PE:EA=3:1,UV)的DMF(450mL)溶液冷却至0℃,向其中加入咪唑(15g,0.22mol)和叔丁基二甲基氯硅烷(32g,0.22mol)。然后使反应混合物升温至室温并搅拌过夜。所得混合物用盐水(1.0L)淬灭,水层用乙酸乙酯萃取。合并的有机溶液用盐水洗,经硫酸镁干燥,过滤,减压浓缩。残余物经硅胶柱色谱法纯化,得到化合物T10(32g,三步收率为78%,Rf=0.7,PE:EA=3:1,UV)为无色油状物。2-((1R,3R)-3-氨基-1-(叔丁基二甲基甲硅烷基氧基)-4-甲基戊基)噻唑-4-羧酸甲酯(T11)在0℃下,向T10(32g,68mmol)的DCM(800mL)溶液中滴加TFA(160mL)。将所得混合物在0℃下搅拌5小时,然后减压除去挥发物。将残余物溶于DCM,用碳酸氢钠洗。有机溶液经硫酸钠干燥,过滤,浓缩。残余物T11(26g,Rf=0.3,PE:EA=3:1,UV)无需纯化即可用于下一步骤。2-((1R,3R)-1-(叔丁基二甲基甲硅烷基氧基)-3-(己基氨基)-4-甲基戊基)噻唑-4-羧酸甲酯(19d)按照以下19e的类似方法,使用化合物T11a(4.2g,9.9mmol)和己醛,得到化合物19d(3.0g,66%收率)为黄色油状物。2-((1R,3R)-1-(叔丁基二甲基甲硅烷基氧基)-3-(己-5-炔基氨基)-4-甲基戊基)噻唑-4-羧酸甲酯(19e)向己-5-炔-1-醇30(23g,0.23mol)的DCM(0.75L)溶液中分批加入氯铬酸吡啶鎓盐(PCC,0.10kg,0.47mol),将反应混合物在室温下搅拌过夜。然后反应混合物用乙醚稀释,并通过硅藻土过滤。滤液浓缩并蒸馏,得到所需的己-5-炔醛31(12g,52%收率)。在0℃下,向化合物T11(26g,67mmol,Rf=0.3-0.5,PE:EA=1:1,UV)的DEM(0.30L)溶液中加入己-5-炔醛(6.5g,67mmol)和三乙酰氧基硼氢化钠(43g,0.20mol)。反应混合物在室温下搅拌6小时,然后用碳酸氢钠淬灭。混合物用DCM萃取,有机溶液经硫酸钠干燥,过滤,真空浓缩。粗产物经硅胶柱色谱法纯化,得到化合物19e(24g,三步收率为78%,Rf=0.3-0.5,PE:EA=1:1,UV)为黄色油状物。(2S,3S)-2-叠氮基-3-甲基戊酸(21)(图12)在冰浴中冷却叠氮化钠(1.78g,27.45mmol)的蒸馏水(4.5mL)和CH2Cl2(7.5mL)溶液。在搅拌下,经5分钟缓慢加入三氟甲磺酸酐(0.93mL,5.55mmol),然后将所得溶液搅拌2小时。分离CH2Cl2相,水相用CH2Cl2(2×3.75mL)萃取。合并含有三氟甲磺酸叠氮化物的有机级分,用饱和Na2CO3洗一次,其无需进一步纯化即可用于下一步骤。(2S,3S)-2-氯-3-甲基-N-戊酸(20,366mg,2.79mmol)与K2CO3(577.5mg,4.19mmol)和CuSO4五水合物(6.98mg,27.9μmol)在蒸馏H2O(9mL)和CH3OH(18mL)中混合。向混合物中加入三氟甲磺酸叠氮化物的CH2Cl2(15mL)溶液,将所得混合物在环境温度下搅拌过夜。真空除去有机溶剂,含水浆液用H2O(50mL)稀释,随后用浓HCl酸化至pH6,然后用pH6.2磷酸盐缓冲液(0.25M,50mL)稀释,并用EtOAc萃取(4次)以除去磺酰胺副产物。然后水相用浓HCl酸化至pH2,然后用EtOAc萃取(3次)。合并EtOAc萃取物,经MgSO4干燥,然后蒸发至干,得到粗化合物21(390mg,89%收率)为浅色油状物。21无需进一步纯化即可使用。对于21:1HNMR(300MHz,CDCl3)δ3.84(d,J=5.8Hz,1H),2.15-1.95(m,2H),1.70-1.55(m,1H),1.45-1.25(m,1H),1.04(d,J=6.8Hz,3H),0.94(t,J=7.4Hz,3H)ppm。(2S,3S)-2-叠氮基-3-甲基戊酰氯(22)(图12)将草酰氯(2.44mL,28.0mmol)和DMF(0.464mL,5.97mmol)加至0.024M叠氮基异亮氨酸21(0.938g,5.97mmol)的己烷溶液中。将反应混合物在室温下搅拌1小时,过滤,真空浓缩。将酰氯22分离,并立即使用而无需进一步纯化。2-[(1R,3R)-3-[(2S,3S)-2-叠氮基-N-(己氧基)-3-甲基戊酰胺基]-1-[(叔丁基二甲基甲硅烷基)氧基]-4-甲基戊基]-1,3-噻唑-4-羧酸乙酯(23a)将0.10M19a(1.46g,3.0mmol,1.0当量)的CH2Cl2(37.3mL)溶液冷却至0℃。向溶液中加入二异丙基乙胺(3.25mL,5.0当量)和酰氯22(1.6当量)。使反应混合物升温至室温并搅拌18小时。然后将盐水(50mL)加至反应混合物中,水层用EtOAc(2×75mL)萃取。合并的有机级分干燥,过滤,真空浓缩。残余物经柱色谱法(1:1己烷/EtOAc)纯化,得到23a(1.31g,70%)为无色油状物。ESIm/z:626(M+H)+。1HNMR(400MHz,CDCl3):8.08(s,1H),4.35(q,2H,J=7.2Hz),4.23(t,2H,J=7.2Hz),3.83(q,1H,J=6.4Hz),3.68(d,1H,J=9Hz),2.24(m,1H),2.09(m,1H),1.89(m,2H),1.75(m,1H),1.58(m,2H),1.35(m,5H),1.26(m,6H),0.95(m,24H),0.09(s,3H),-0.15(s3H)ppm。2-((8R,10R)-7-((2S,3S)-2-叠氮基-3-甲基戊酰基)-8-异丙基-12,12,13,13-四甲基-1-(4-硝基苯基)-2,6,11-三氧杂-7-氮杂-12-硅杂十四烷-10-基)噻唑-4-羧酸乙酯(23b)使用制备23a的类似反应条件,由400mg化合物19b得到化合物23b(310mg,63%)。ESIm/z:735(M+H)+。2-[(1R,3R)-3-[(2S,3S)-2-叠氮基-3-甲基-N-(戊-4-炔-1-基氧基)戊酰胺基]-1-[(叔丁基二甲基甲硅烷基)氧基]-4-甲基戊基]-1,3-噻唑-4-羧酸乙酯(23c)使用制备23b的类似反应条件,由3g19c得到化合物23c(2.3g,60%)。1HNMR(500MHz,CDCl3)δ8.04(s,1H),5.05(dd,J=25.8,7.8Hz,1H),4.40-4.22(m,4H),4.09-4.03(m,1H),3.69(t,J=10.0Hz,1H),2.33-2.28(m,2H),2.27-2.20(m,1H),2.10-2.01(m,1H),1.97-1.86(m,3H),1.81(dd,J=12.1,6.2Hz,2H),1.76-1.64(m,1H),1.33(t,J=7.1Hz,3H),1.27-1.23(m,1H),0.93-0.86(m,21H),0.00(s,3H),-0.07(s,3H)ppm。2-((1R,3R)-3-((2S,3S)-2-叠氮基-N-己基-3-甲基戊酰胺基)-1-(叔丁基二甲基甲硅烷基氧基)-4-甲基戊基)噻唑-4-羧酸甲酯(23d)使用制备化合物23a的类似反应条件,由3.3g19d得到化合物23d(4.1g,92%收率)为无色油状物。2-((1R,3R)-3-((2S,3S)-2-叠氮基-N-(己-5-炔基)-3-甲基戊酰胺基)-1-(叔丁基二甲基甲硅烷基氧基)-4-甲基戊基)噻唑-4-羧酸甲酯(23e)使用制备化合物23a的类似反应条件,由27g化合物19e得到化合物23e(33g,92%收率,Rf=0.95,PE:EA=3:1,UV)为无色油状物。2-((5R,7R)-7-异丙基-2,2,3,3-四甲基-8-((2R,3S)-3-甲基-2-((S)-1-甲基哌啶-2-基)戊酰基)-4,9-二氧杂-8-氮杂-3-硅杂十五烷-5-基)噻唑-4-羧酸乙酯(24a)向叠氮化物23a(2.50g,3.99mmol)的EtOAc(50mL)溶液中加入10%Pd/C(1.38mg)。然后将反应混合物在氢气气氛下搅拌27小时。反应混合物通过硅藻土塞过滤,滤垫用EtOAc洗。合并的滤液不经纯化直接用于下一步骤。ESIm/z600.4(M+H)+。2-((8R,10R)-7-((2S,3S)-2-叠氮基-3-甲基戊酰基)-8-异丙基-12,12,13,13-四甲基-1-(4-硝基苯基)-2,6,11-三氧杂-7-氮杂-12-硅杂十四烷-10-基)噻唑-4-羧酸乙酯(24b)将化合物23b(300mg,0.41mmol)和Ph3P(300mg,1.15mmol)的THF(10mL)和水(5mL)混合物在室温下搅拌过夜。混合物用DCM(100mL)稀释,经Na2SO4干燥,过滤。滤液真空浓缩,残余物经快速柱色谱法(20g硅胶,DCM至DCM/MeOH=95/5)纯化,得到化合物24b为无色油状物(210mg,72%)。ESIm/z:709(M+H)+。1HNMR(400MHz,CDCl3)δ8.17(d,J=8.6Hz,2H),8.09(s,1H),7.46(d,J=8.6Hz,2H),5.11-5.09(m,1H),4.60(s,2H),4.35(m,4H),4.11(dd,J=14.6,6.3Hz,1H),3.68(t,J=6.2Hz,2H),3.53(d,J=6.6Hz,1H),2.35-2.29(m,1H),2.06-1.94(m,4H),1.77-1.71(m,2H),1.39(t,J=7.1Hz,3H),1.16-1.07(m,1H),0.93(m,23H),0.13(s,3H),-0.10(s,3H)ppm。2-[(1R,3R)-3-[(2S,3S)-2-氨基-3-甲基-N-(戊-4-炔-1-基氧基)戊酰胺基]-1-[(叔丁基二甲基甲硅烷基)氧基]-4-甲基戊基]-1,3-噻唑-4-羧酸乙酯(24c)使用制备24b的类似反应条件,由2.2g化合物23c得到化合物24c(1.2g,57%)。ESIm/z:582(M+H)+。1HNMR(500MHz,CDCl3)δ8.11(s,1H),5.10(d,J=7.1Hz,1H),4.50-4.00(m,5H),3.54(d,J=6.6Hz,1H),2.35-2.20(m,3H),2.05-1.90(m,5H),1.90-1.83(m,2H),1.80-1.70(m,2H),1.40(t,J=7.1Hz,3H),1.40-0.91(m,23H),0.13(s,3H),-0.10(s,3H)ppm。2-((1R,3R)-3-((2S,3S)-2-氨基-N-己基-3-甲基戊酰胺基)-1-(叔丁基二甲基甲硅烷基氧基)-4-甲基戊基)噻唑-4-羧酸甲酯(24d)使用制备化合物24a的类似反应条件,由1.6g化合物23d得到粗化合物24d。粗产物24d不经纯化即可用于下一步骤。2-((1R,3R)-3-((2S,3S)-2-氨基-N-(己-5-炔基)-3-甲基戊酰胺基)-1-(叔丁基二甲基甲硅烷基氧基)-4-甲基戊基)噻唑-4-羧酸乙酯(24e)使用制备化合物24a的类似反应条件,由24g化合物23e得到粗化合物24e。粗产物24e不经纯化即可用于下一步骤。2-[(1R,3R)-1-[(叔丁基二甲基甲硅烷基)氧基]-3-[(2S,3S)-N-(己氧基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-羧酸乙酯(26a)向0.4M化合物25(1.72g,12mmol)的EtOAc(30mL,通过活性氧化铝塞过滤)溶液中加入五氟苯酚(2.43g,13.2mmol,1.1当量)和DCC(2.72g,13.2mmol,1.1当量)。将反应混合物在室温下搅拌21小时,然后过滤,残余物用EtOAc(10mL)洗。活化酯无需纯化或浓缩即可立即使用。将活化酯的溶液(0.3M,40mL)加至以上获得的24a的EtOAc(50mL,4.0mmol)溶液中。所得混合物在室温下搅拌过夜。真空除去挥发物,残余物经快速色谱法(0-10%甲醇的EtOAc溶液)纯化,得到化合物26a(2.0g,69%收率)为无色油状物。ESIm/z:725(M+H)+。2-((8R,10R)-8-异丙基-12,12,13,13-四甲基-7-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-1-(4-硝基苯基)-2,6,11-三氧杂-7-氮杂-12-硅杂十四烷-10-基)噻唑-4-羧酸乙酯(26b)在0℃下,通过注射器向化合物25(185mg,1.3mmol)和五氟苯酚(357mg,1.9mmol)的干燥二氯甲烷(25mL)溶液中逐滴加入DIC(245mg,1.9mmol)的二氯甲烷(1.0mL)溶液。将所得溶液再搅拌1小时。然后过滤溶液,将滤液浓缩,得到粗制五氟苯基酯(400mg)。ESIm/z:310.0(M+H)+。将粗制五氟苯基酯溶于无水DCM(11mL)。向所得溶液中加入24b(400mg,565μmol)和DIPEA(275mg,889μmol)。所得溶液在室温下搅拌过夜。将反应溶液浓缩至干,残余物经快速柱色谱法(用EtOAc/PE=1/2然后2/1洗脱)纯化,得到26b(320mg,两步收率为68%)为浅黄色固体。ESIm/z:834.4(M+H)+。1HNMR(DMSOd6,500MHz)δ8.99(d,J=9.0Hz,1H),8.48(s,1H),8.17(d,J=8.5Hz,2H),7.51(d,J=8.5Hz,2H),4.90(d,J=9.5Hz,1H),4.75(t,J=9.0Hz,1H),4.58(s,2H),4.38-4.34(m,1H),4.28(q,J=7.5Hz,2H),4.16-4.06(m,3H),3.82-3.77(m,1H),3.72-3.67(m,1H),3.64-3.60(m,1H),3.36-3.34(m,1H),3.13-3.06(m,1H),2.66(d,J=4.0Hz,3H),2.29-2.23(m,1H),2.07-1.96(m,3H),1.94-1.87(m,3H),1.81-1.78(m,2H),1.68-1.57(m,2H),1.47-1.39(m,2H),1.29(t,J=7.0Hz,3H),1.10-1.05(m,1H),0.93-0.89(m,14H),0.85(d,J=6.0Hz,3H),0.81(t,J=7.5Hz,3H),0.08(s,3H),-0.16(s,3H)ppm。2-[(1R,3R)-1-[(叔丁基二甲基甲硅烷基)氧基]-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-羧酸乙酯(26c)使用制备26b的类似反应条件,由1.8g化合物24c得到化合物26c(1.7g,78%)。ESIm/z:707(M+H)+。1HNMR(500MHz,MeOHd4)δ8.38(s,1H),5.03(d,J=8.1Hz,1H),4.85(t,J=6.3Hz,1H),4.40(q,J=7.5Hz,3H),4.13-4.07(m,1H),4.03-3.86(m,2H),3.52-3.45(m,1H),3.35-3.29(m,1H),2.87(s,3H),2.51-2.35(m,3H),2.25(t,J=2.4Hz,1H),2.23-2.15(m,1H),2.10-1.53(m,11H),1.40(t,J=7.1Hz,3H),1.27-1.19(m,1H),1.08-0.94(m,12H),0.94(s,9H),0.13(s,3H),-0.16(s,3H)ppm。2-((5R,7R)-7-异丙基-2,2,3,3-四甲基-8-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-4,9-二氧杂-8-氮杂-3-硅杂十四烷-5-基)噻唑-4-羧酸乙酯(26f)向化合物26c(20mg,28μmol)的甲醇(5mL)溶液中加入5%钯/炭(5mg),将混合物脱气并用氢气回填3次。所得混合物在氢气气氛下于室温搅拌6小时,直至根据LCMS监测三键完全还原。混合物通过硅藻土过滤,硅藻土用甲醇洗(3次)。合并的滤液真空浓缩,得到化合物26f(18mg,90%粗收率)为白色固体,其不经纯化即可用于下一步骤。ESIm/z:712(M+H)+。2-((3S,6R,8R)-3-仲丁基-5-己基-6-异丙基-10,10,11,11-四甲基-1-((R)-1-甲基哌啶-2-基)-1,4-二氧代-9-氧杂-2,5-二氮杂-10-硅杂十二烷-8-基)噻唑-4-羧酸甲酯(26d)将以上获得的粗品24d溶于DCM(27mL)。向溶液中加入HOBt(0.40g,3.0mmol)和化合物25(0.42g,2.34mmol)。反应混合物冷却至0℃后,依次加入EDCI(0.56g,2.92mmol)和DIPEA(0.49mL,2.813mmol)。所得混合物在室温下搅拌过夜。除去挥发物,残余物通过乙酸乙酯和碳酸氢钠水溶液分离。水溶液用乙酸乙酯萃取,合并的有机溶液经硫酸钠干燥,过滤,浓缩,得到粗品26d(1.7g,由23d得到的收率为89%),其无需纯化即可用于下一步骤。2-((3S,6R,8R)-3-仲丁基-5-(己-5-炔基)-6-异丙基-10,10,11,11-四甲基-1-((R)-1-甲基哌啶-2-基)-1,4-二氧代-9-氧杂-2,5-二氮杂-10-硅杂十二烷-8-基)噻唑-4-羧酸甲酯(26e)使用制备化合物26d的类似反应条件,由53g化合物24e得到化合物26e(39g,收率,Rf=0.6,DCM:甲醇=10:1,UV)。2-[(1R,3R)-3-[(2S,3S)-N-(己氧基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-1-羟基-4-甲基戊基]-1,3-噻唑-4-羧酸乙酯(27a)向26a(2.0)的THF(40mL)溶液中加入TBAF(10mL,1M的THF溶液),所得溶液在室温下搅拌16小时,然后浓缩。残余物经HPFC纯化法(0-5%甲醇的乙酸乙酯溶液)进行纯化,得到27a(1.5g,75%收率)。ESIm/z:611(M+H)+。1HNMR(400MHz,MeOHd4)δ8.33(s,1H),4.88(m,2H),4.40(q,J=7Hz,2H),4.33(t,J=7.6Hz,1H),4.20(m,1H),4.02(m,1H),3.0(m,2H),2.65(m,1H),2.36(s,3H),2.32(m,1H),2.12,(m,1H),2.0(m,2H),1.90(m,2H),1.62-1.70(m,6H),1.5(m,2H),1.40(t,J=7Hz,3H),1.30-1.38(m,8H),1.0(m,9H),0.95(m,6H)ppm。2-((1R,3R)-1-羟基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(3-(4-硝基苄氧基)丙氧基)戊酰胺基)戊基)噻唑-4-羧酸乙酯(27b)将化合物26b(130mg,240μmol)和氟化铯(109mg,720mmol)的DMSO(2.5mL)混合物在室温下搅拌2小时。然后将溶液通过RP柱色谱法(0-100%乙腈的水溶液)纯化,得到化合物27b(140mg,收率81%)为浅黄色固体。ESIm/z:720.3(M+H)+。1HNMR(500MHz,DMSOd6)δ8.42(s,1H),8.16(d,J=8.5Hz,2H),7.59(d,J=8.5Hz,2H),7.52(d,J=9.0Hz,1H),6.37(brs,1H),4.74(t,J=9.0Hz,1H),4.66(s,2H),4.63(d,J=11.0Hz,1H),4.31-4.26(m,3H),4.20-4.15(m,1H),4.01(brs,1H),3.74-3.62(m,2H),2.83-2.80(m,1H),2.47-2.44(m,2H),2.07(s,3H),1.98-1.92(m,4H),1.82-1.77(m,2H),1.59-1.33(m,6H),1.29(t,J=7.0Hz,3H),1.14-1.04(m,2H),0.86(d,J=6.5Hz,9H),0.79(t,J=7.5Hz,3H)ppm。手性SFC>99%(AD-H,AS-H,OJ-H,和OD-H),Rt:2.04min(AD-H),4.39min(AS-H),3.56min(OD-H),和3.72min(OJ-H)。2-((1R,3R)-1-羟基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(戊-4-炔基氧基)戊酰胺基)戊基)噻唑-4-羧酸乙酯(27c)使用制备27b的类似方法,得到化合物27c(43mg,86%收率)为白色固体。ESIm/z:593(M+H)+。2-((1R,3R)-1-羟基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(戊氧基)戊酰胺基)戊基)噻唑-4-羧酸乙酯(27f)使用制备27a的类似方法,得到化合物27f(13mg,86%收率)为白色固体。ESIm/z:597(M+H)+。2-((1R,3R)-3-((2S,3S)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸甲酯(27d)使用制备27a的类似方法,得到粗品27d(1.8g)为粘稠黄色油状物,其无需纯化即可用于下一步骤。2-((1R,3R)-3-((2S,3S)-N-(己-5-炔基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸甲酯(27e)使用制备27a的类似方法,得到粗品化合物27e(44g,Rf=0.55和0.5,DCM:甲醇=10:1,UV),其无需进一步纯化即可使用。中间体II的一般方法向27(1.0当量)的THF(15-20mg/mL)溶液中加入氢氧化锂水溶液(0.5M,VH2O/VTHF=1),将混合物在室温下搅拌10小时直至水解完成,通过LCMS进行监测。然后将反应混合物用乙酸酸化至pH3,并浓缩至1/3体积。残留水溶液直接通过制备型HPLC(碳酸氢铵体系)纯化,得到中间体IIa、IIb、IIc、IIe(66-90%收率),为白色固体。2-((1R,3R)-3-((2S,3S)-N-(己氧基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸(IIa)按照中间体II的一般方法,得到IIa(0.25g,66%收率)为白色固体。ESIm/z:583(M+H)+。1HNMR(400MHz,MeOHd4)δ8.05(s,1H),4.77(d,J=6.9Hz,1H),4.34-4.11(m,2H),3.88(d,J=10.1Hz,1H),3.73(t,J=9.8Hz,1H),3.46(d,J=12.9Hz,1H),2.99(t,J=11.9Hz,1H),2.74(s,3H),2.74-2.62(m,1H),2.24-2.15(m,2H),2.02-1.86(m,4H),1.83-1.71(m,6H),1.40-1.50(m,2H),1.23-1.4(m,6H),1.06-0.90(m,17H)ppm。2-((1R,3R)-1-羟基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(3-(4-硝基苄氧基)丙氧基)戊酰胺基)戊基)噻唑-4-羧酸(IIb)按照中间体II的一般方法,得到IIb(0.10g,81%收率)为白色固体。ESIm/z:692(M+H)+。1HNMR(500MHz,DMSOd6)δ8.26(s,1H),8.17(d,J=8.5Hz,2H),7.60(d,J=8.5Hz,3H),6.27(brs,1H),4.74(t,J=8.5Hz,1H),4.66(s,2H),4.63(d,J=8.0Hz,1H),4.32-4.28(m,1H),4.20-4.15(m,1H),4.02(brs,1H),3.73-3.62(m,3H),2.86-2.83(m,1H),2.55-2.53(m,1H),2.47-2.41(m,1H),2.10(s,3H),2.01-1.94(m,4H),1.83-1.78(m,2H),1.61-1.52(m,3H),1.47-1.35(m,3H),1.16-1.04(m,2H),0.86(d,J=6.5Hz,9H),0.79(t,J=7.5Hz,3H)ppm。手性SFC>95%(AD-H,AS-H,和OJ-H),Rt:2.05min(AD-H),2.66min(AS-H),和1.77min(OJ-H)。2-((1R,3R)-1-羟基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(戊-4-炔基氧基)戊酰胺基)戊基)噻唑-4-羧酸(IIc)按照中间体II的一般方法,得到IIc(37mg,90%收率)为白色固体。ESIm/z:565(M+H)+。2-((1R,3R)-1-羟基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(戊氧基)戊酰胺基)戊基)噻唑-4-羧酸(IIf)按照中间体II的一般方法,得到IIf(20mg,88%收率)为白色固体。ESIm/z:569(M+H)+。2-((1R,3R)-3-((2S,3S)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸(IId)按照中间体II的一般方法,得到粗化合物IId,并且其不经纯化即可用于下一步骤。2-((1R,3R)-3-((2S,3S)-N-(己-5-炔基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸(IIe)按照中间体II的一般方法,得到粗化合物IIe(Rf=0.05,DCM:甲醇=10:1,UV),并且其不经纯化即可用于下一步骤。中间体III的一般方法在0℃下,通过注射器向化合物II(1.0当量)的吡啶(15mg/mL)溶液中加入乙酸酐(3.0当量)。将反应混合物在室温下搅拌10小时,通过LCMS进行监测。在室温下,反应混合物用甲醇(20mL)淬灭,然后在此温度下搅拌过夜。真空除去挥发物,残余物经制备型HPLC纯化,得到中间体III(88-99%收率)为白色固体。2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己氧基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-羧酸(IIIa)按照中间体III的一般方法,得到粗品IIIa(40mg,>99%收率)为白色固体。ESIm/z:625.3(M+H)+。1HNMR(400MHz,MeOHd4)δ8.38(s,1H),7.60(m,1H),4.81(d,J=6.8Hz,1H),4.01-3.95(m,2H),3.67-3.63(m,1H),3.49-3.46(m,1H),3.33-3.25(m,1H),3.21-3.12(m,1H),2.91(s,3H),2.66-2.60(m,1H),2.38-2.19(m,3H),2.15(s,3H),1.99-1.19(m,15H),1.06-0.92(m,17H)ppm。2-((8R,10R)-8-异丙基-7-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-1-(4-硝基苯基)-12-氧代-2,6,11-三氧杂-7-氮杂十三烷-10-基)噻唑-4-羧酸(IIIb)按照中间体III的一般方法,得到IIIb(94mg,88%收率)为白色固体。ESIm/z:734(M+H)+。1HNMR(DMSOd6,500MHz)δ8.34(s,1H),8.18(d,J=8.5Hz,2H),7.67-7.66(m,1H),7.59(d,J=8.5Hz,2H),5.74(d,J=11.5Hz,1H),4.76(t,J=8.5Hz,1H),4.64(s,2H),4.28-4.24(m,1H),4.09-4.05(m,1H),3.99(brs,1H),3.68-3.58(m,3H),2.88-2.85(m,1H),2.63-2.59(m,1H),2.40-2.36(m,1H),2.29-2.25(m,1H),2.14-2.08(m,7H),1.98-1.94(m,3H),1.78-1.76(m,1H),1.67-1.55(m,3H),1.46-1.37(m,3H),1.24-1.15(m,1H),1.05-0.98(m,1H),0.91(d,J=6.5Hz,3H),0.86-0.84(m,6H),0.80(t,J=7.0Hz,3H)ppm。手性SFC>95%(AD-H,AS-H,OJ-H,和OD-H),Rt:1.92min(AD-H),2.06min(AS-H),2.33min(OD-H),和1.60min(OJ-H)。2-((1R,3R)-1-乙酰氧基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(戊-4-炔基氧基)戊酰胺基)戊基)噻唑-4-羧酸(IIIc)按照中间体III的一般方法,得到IIIc(18mg,93%收率)为白色固体。ESIm/z:607(M+H)+。2-((1R,3R)-1-乙酰氧基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(戊氧基)戊酰胺基)戊基)噻唑-4-羧酸(IIIf)按照中间体III的一般方法,得到IIIf(20mg,89%收率)为白色固体。ESIm/z:611(M+H)+。2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-羧酸(IIId)按照中间体III的一般方法,得到IIId(0.81g,从19d的5步收率为49%)。2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-羧酸(IIIe)按照中间体III的一般方法,得到粗化合物IIIe(12g,5步收率为50%,Rf=0.1,DCM:甲醇=10:1,UV)。ESIm/z:603(M-H)-。1HNMR(400MHz,DMSOd6)δ8.11(s,1H),7.75(brs,1H),5.61(d,1H),4.45(t,1H),3.71(t,1H),3.68-2.50(m,5H),2.40-1.90(m,11H),1.90-1.30(m,12H),1.27-0.60(m,14H)ppm。C-微管溶素IV的合成(图5)IV的一般方法在0℃下,通过注射器向中间体III(1.0当量)和PFP(1.5当量)的无水DCM(10-15mg/mL)混合物中滴加N,N'-二异丙基碳二亚胺(DIC,1.5当量)的DCM(7mg/mL)溶液。使所得混合物升温至室温并搅拌16小时,通过LCMS进行监测。真空除去挥发物,将残余物悬浮在乙酸乙酯(III/乙酸乙酯:1mg/mL)中。将悬浮液搅拌20分钟,滤出固体。滤液真空浓缩,得到呈浅黄色油状的粗制五氟苯基酯28,将其溶于干燥DMF(20mg/mL)。随后在室温下向所得溶液中加入DIPEA(2.5当量)和中间体I(0.9-1.2当量)。将反应混合物在室温下搅拌过夜,根据LCMS确认反应完成。对于R4=NHFmoc,然后通过注射器向反应混合物中加入哌啶(0.5-1.0mL),将反应混合物在室温下搅拌2小时,直至根据LCMS已脱去Fmoc。然后混合物经制备型HPLC(碳酸氢铵体系)直接纯化,得到IV(10-60%收率)为白色固体。(IVa)(2S,4R)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氟苯基)-2-甲基戊酸(IVa)按照中间体IV的一般方法,得到Iva(17mg,3%收率)为白色固体。ESIm/z816.5(M+H)+。1HNMR(400MHz,DMSOd6)δ8.18(s,1H),7.90-7.80(m,1H),7.72-7.61(m,1H),7.25-7.17(m,2H),7.10-7.00(m,2H),5.64(d,J=13.2Hz,1H),4.48(t,J=9.2Hz,1H),4.22-4.10(m,1H),3.75-3.60(m,1H),3.11-2.73(m,4H),2.45-2.24(m,3H),2.11(s,3H),2.06(s,3H),2.00-1.78(m,5H),1.65-1.43(m,7H),1.41-1.20(m,9H),1.10-0.91(m,8H),0.90-0.76(m,10H),0.72-0.62(m,3H)ppm。分析型HPLC:>99%,Rt:8.51min(方法A)。(IVb)(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-2,2-二甲基-5-苯基戊酸(IVb)按照IV的一般方法,得到IVb(2.0mg,10%收率)为白色固体。ESIm/z808.3(M+H)+。1HNMR(500MHz,DMSOd6)δ8.15(s,1H),7.72(s,2H),7.28-7.21(m,2H),7.19-7.16(d,J=5.9Hz,2H),5.65(d,J=13.2Hz,1H),4.46(t,J=9.4Hz,1H),4.34-4.24(m,1H),3.76-3.70(m,1H),3.03-2.97(m,1H),2.85-2.81(m,2H),2.76-2.72(m,2H),2.29-2.17(m,4H),2.13(s,3H),2.07(s,3H),1.97-1.84(m,4H),1.84-1.80(m,3H),1.61(d,J=10.3Hz,2H),1.54-1.32(m,7H),1.19-1.06(m,10H),0.95(d,J=6.0Hz,3H),0.86-0.80(m,6H),0.69(d,J=6.0Hz,3H)ppm。分析型HPLC:>99%,Rt:8.51min(方法A)。(IVc)(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氟苯基)-2,2-二甲基戊酸(IVc)按照IV的一般方法,得到IVc(3.1mg,16%收率)为白色固体。ESIm/z826.2(M+H)+。1HNMR(500MHz,DMSOd6)δ8.14(s,1H),7.72-7.68(m,2H),7.21-7.18(m,2H),7.07-7.03(m,2H),5.65(d,J=13.0Hz,1H),4.46(t,J=9.5Hz,1H),4.26-4.23(m,1H),3.75-3.69(m,1H),3.03-2.97(m,1H),2.87-2.79(m,2H),2.76-2.72(m,2H),2.29-2.18(m,4H),2.13(s,3H),2.09(s,3H),1.97-1.84(m,4H),1.77-1.68(m,3H),1.62-1.61(m,2H),1.54-1.37(m,6H),1.27-1.21(m,1H),1.19-1.11(m,2H),1.08-1.06(m,6H),0.96-0.94(m,4H),0.84-0.80(m,6H),0.70-0.68(m,3H)ppm。分析型HPLC:>99%,Rt:8.44min(方法B)。(IVd)(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(IVd)按照IV的一般方法,得到IVd(5.8mg,14%收率)为白色固体。ESIm/z412.3(M/2+H)+,823.3(M+H)+(10%)。1HNMR(500MHz,DMSOd6)δ8.16(s,1H),7.77-7.61(m,2H),6.82(d,J=8.5Hz,2H),6.45(d,J=8.0Hz,2H),5.66(d,J=13.5Hz,1H),4.84(s,2H),4.47(t,J=9.5Hz,1H),4.19-4.16(m,1H),3.76-3.71(m,1H),3.05-2.99(m,1H),2.85-2.82(m,1H),2.74(t,J=2.5Hz,1H),2.64(dd,J=13.5,6.0Hz,1H),2.58-2.53(m,1H),2.31-2.14(m,7H),2.07(s,3H),1.87-1.72(m,7H),1.69-1.52(m,10H),1.19-1.08(m,2H),1.05(d,J=7.5Hz,6H),0.96(d,J=7.5Hz,3H),0.85-0.81(m,6H),0.69(d,J=6.0Hz,3H)ppm。分析型HPLC:>99%,Rt:6.92min(方法A)。(IVe)(2S,4R)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氟苯基)-2-甲基戊酸(IVe)按照IV的一般方法,得到IVe(9.0mg,45%收率)为白色固体。ESIm/z812.4(M+H)+。1HNMR(500MHz,MeOHd4)δ8.11(s,1H),7.26(dd,J=8.4,5.5Hz,2H),6.98(s,2H),5.80(d,J=13.0Hz,1H),4.93(m,1H),4.88-4.84(m,1H),4.66(d,J=9.3Hz,1H),4.36(s,1H),3.86(s,1H),3.19-3.01(m,2H),2.92(d,J=6.8Hz,2H),2.55(s,1H),2.44-2.30(m,6H),2.27-2.22(m,2H),2.19(s,3H),2.05-1.96(m,3H),1.95-1.86(m,3H),1.82-1.58(m,9H),1.45-1.36(m,1H),1.27-1.20(m,1H),1.19(d,J=7.1Hz,3H),1.07(d,J=6.5Hz,3H),1.01(d,J=6.8Hz,3H),0.95(m,3H),0.85(d,J=6.1Hz,3H)ppm。分析型HPLC:>99%,Rt:8.14min(方法A)。手性HPLC:>99%,Rt:1.05min(AD);>99%,1.42min(AS);>99%,0.92min(OD);>99%,2.92min(OJ)。(IVf)(2S,4R)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-羟基苯基)-2-甲基戊酸(IVf)按照IV的一般方法,得到IVf(8.5mg,43%收率)为白色固体。ESIm/z810.3(M+H)+。1HNMR(400MHz,DMSOd6)δ9.19(s,1H),8.18(s,1H),7.71(d,J=10.0Hz,1H),6.96(d,J=10.0Hz,2H),6.63(d,J=8.4Hz,2H),5.64(d,J=12.9Hz,1H),4.46(t,J=9.5Hz,1H),4.14(s,1H),3.74(s,1H),3.01(s,1H),2.82(d,J=11.4Hz,1H),2.75-2.70(m,2H),2.68-2.62(m,1H),2.47-2.45(m,1H),2.39-2.15(m,6H),2.13-2.08(m,4H),2.06(s,3H),1.95-1.72(m,6H),1.62-1.60(m,2H),1.54-1.32(m,7H),1.20-1.08(m,2H),1.05(d,J=7.1Hz,3H),0.96(d,J=6.4Hz,3H),0.85-0.80(m,6H),0.68(d,J=6.1Hz,3H)ppm。分析型HPLC:>99%,Rt:6.83min(方法B)。(IVg)(2S,4R)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氨基苯基)-2-甲基戊酸(IVg)按照IV的一般方法,得到IVg(6.0mg,30%收率)为白色固体。ESIm/z809.2(M+H)+。1HNMR(500MHz,DMSOd6)δ8.18(s,1H),7.89(s,1H),7.70(d,J=9.3Hz,1H),6.82(d,J=8.3Hz,2H),6.45(d,J=8.3Hz,2H),5.65(d,J=13.0Hz,1H),4.84(s,2H),4.46(t,J=9.5Hz,1H),4.09(s,1H),3.74(s,1H),3.05-2.97(m,1H),2.83-2.80(m,1H),2.74(t,J=8.3Hz,1H),2.71-2.63(m,3H),2.60-2.56(m,1H),2.37-2.33(m,1H),2.28-2.24(m,2H),2.19-2.16(m,1H),2.12(s,3H),2.06(s,3H),1.98-1.73(m,7H),1.62-1.60(m,2H),1.49-1.44(m,5H),1.39-1.34(m,1H),1.23(s,3H),1.03(d,J=7.5Hz,3H),0.96(d,J=6.0Hz,3H),0.85-0.80(m,6H),0.68(d,J=6.0Hz,3H)ppm。分析型HPLC:>99%,Rt:6.87min(方法B)。手性HPLC:>99%,Rt:0.8min(AD);>99%,1.24min(AS);>99%,3.1min(OD);>99%,1.47min(OJ)。C-微管溶素VII和VIII的合成(图5A)VII和VIII的一般方法向化合物A-1(1.0当量)的DCM(50mM)溶液中加入化合物A-2(1.5当量)和DIPEA(4.0当量),将反应混合物在室温下搅拌4小时,通过LCMS进行监测。所得混合物经反相快速色谱法(0-30%乙腈的TFA(0.01%)水溶液)直接纯化,得到VII或VIII(7-57%收率)为类白色固体。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氨基-3-氯苯基)-2,2-二甲基戊酸(VII)按照VII和VIII的一般方法,将化合物A-1a用化合物A-2b处理,得到有效负载VII(5.0mg,14%收率)为白色固体。ESIm/z:861.3(M+H)+。1HNMR(400MHz,DMSOd6)δ8.16(s,1H),7.67(d,J=9.6Hz,1H),7.56(brs,1H),7.21(brs,1H),6.94(d,J=0.8Hz,1H),6.82(d,J=8.4Hz,1H),6.65(d,J=8.4Hz,1H),5.65(d,J=13.2Hz,1H),5.32(t,J=5.2Hz,1H),5.15(s,2H),4.48(t,J=9.6Hz,1H),4.22-4.18(m,1H),3.74-3.70(m,1H),3.03-2.96(m,1H),2.83(d,J=11.2Hz,1H),2.60(d,J=6.0Hz,1H),2.33-2.16(m,3H),2.14(s,3H),2.07(s,3H),2.03-1.90(m,3H),1.76-1.55(m,3H),1.33-1.20(m,10H),1.16-1.13(m,2H),1.07-1.04(m,7H),0.95(d,J=6.4Hz,3H),0.86-0.80(m,11H),0.68(d,J=5.6Hz,3H)ppm。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氟苯基)-2,2-二甲基戊酸(VIII)按照VII和VIII的一般方法,将化合物A-1a用化合物A-2c处理,得到有效负载VIII(7.0mg,26%收率)为白色固体。ESIm/z:830.5(M+H)+。1HNMR(400MHz,DMSOd6)δ8.16(s,1H),7.67(d,J=9.6Hz,1H),7.19(dd,J=8.0和6.0Hz,2H),7.06(t,J=8.8Hz,2H),5.64(d,J=12.0Hz,1H),4.48(t,J=9.2Hz,1H),4.27-4.23(m,1H),3.73-3.65(m,1H),3.02-2.93(m,1H),2.84-2.75(m,3H),2.33-1.83(m,12H),1.90-1.40(m,8H),1.28-1.23(m,11H),1.17-1.13(m,1H),1.06(d,J=4.0Hz,6H),0.96(d,J=6.4Hz,3H),0.87-0.79(m,9H),0.68(d,J=6.0Hz,3H)ppm。C-三唑微管溶素有效负载IV的合成(图6A)(IVh)2-((1R,3R)-1-乙酰氧基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(4-(1-((三甲基甲硅烷基)甲基)-1H-1,2,3-三唑-4-基)丁基)戊酰胺基)戊基)噻唑-4-羧酸(IIIg1)向IIIe(80mg,132μmol)、三甲基甲硅烷基甲基叠氮化物(34mg,264μmol)和抗坏血酸钠(80mg,132μmol)的THF(3mL)和水(1mL)混合物中加入1滴硫酸铜水溶液(2.1mg,13μmol)。所得混合物在室温下搅拌1小时,然后过滤,浓缩,得到IIIg1(87mg,89.6%收率)为白色固体。ESIm/z:734.1(M+H)+。2-((1R,3R)-1-乙酰氧基-4-甲基-3-((2S,3S)-3-甲基-N-(4-(1-甲基-1H-1,2,3-三唑-4-基)丁基)-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)戊基)噻唑-4-羧酸(IIIg2)将IIIgl(87mg,118μmol)和CsF(72mg,474μmol)的DMF(1mL)混合物在60℃下搅拌1小时。反应溶液通过硅胶柱色谱法(DCM/MeOH15:1)纯化,得到IIIg2(59mg,75%收率)为白色固体。ESIm/z:663.3(M+H)+。2-((1R,3R)-1-乙酰氧基-4-甲基-3-((2S,3S)-3-甲基-N-(4-(1-甲基-1H-1,2,3-三唑-4-基)丁基)-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)戊基)噻唑-4-羧酸全氟苯酯(31)将IIIg2(59mg,89μmol)、PFP(33mg,178μmol)和DIC(23mg,178μmol)的THF(2mL)混合物在25℃下搅拌18小时。反应溶液经硅胶柱色谱法(DCM/MeOH15:1)纯化,得到31(59mg,75%收率)为白色固体。ESIm/z:828.3(M+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-N-[4-(1-甲基-1H-1,2,3-三唑-4-基)丁基]-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{[(9H-芴-9-基甲氧基)羰基]氨基}苯基)-2,2-二甲基戊酸(32)将化合物31(40mg,40μmol)、DIPEA(15mg,119μmol)和中间体Ic(22mg,119μmol)的DMF(3mL)混合物在25℃下搅拌16小时,反应溶液通过RP色谱法(CH3CN/H2O,0-100%CH3CN)纯化,得到32(23mg,53%收率)为白色固体。ESIm/z:1102.1(M+H)+。(S)-4-(2-((1R,3R)-1-乙酰氧基-4-甲基-3-((2S,3S)-3-甲基-N-(4-(1-甲基-1H-1,2,3-三唑-4-基)丁基)-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(IVh)将化合物32(23mg,21umol)和哌啶(5mg,63μmol)的DMF(1mL)混合物在25℃下搅拌16小时,反应溶液经RP色谱法(0-100%CH3CN的H2O溶液)直接纯化,得到IVh(5mg,27%收率)为白色固体。EISm/z:880.4(M+H)+。1HNMR(500MHz,MeOHd4)δ8.10(s,1H),7.75(s,1H),6.96(d,J=8.2Hz,2H),6.64(d,J=8.2Hz,2H),5.76(d,J=12.5Hz,1H),4.57(d,J=9.3Hz,1H),4.36-4.30(m,1H),4.04(s,3H),3.89-3.78(m,1H),3.19-3.08(m,2H),3.00-2.93(m,1H),2.81-2.63(m,5H),2.38-2.33(m,1H),2.23(s,3H),2.20-2.15(m,4H),2.09-1.86(m,4H),1.84-1.63(m,9H),1.61-1.48(m,3H),1.36-1.27(m,1H),1.13(s,3H),1.10(s,3H),1.05(d,J=6.4Hz,3H),0.92-0.87(m,6H),0.86-0.80(m,3H)ppm。IVj-IVp的一般方法向Fmoc-IVd(1当量)、R5-叠氮化物(2当量)和抗坏血酸钠(2当量)的THF(0.3mL/mgFmoc-IVd)和水(0.1mL)混合物中加入硫酸铜水溶液(0.1当量,1M)。所得混合物在室温下搅拌16小时。混合物经RP色谱法直接纯化,得到32(64%-76%收率)为白色固体。然后将32溶于DMF,并通过注射器加入哌啶(0.1-1.0mL,过量)。反应混合物在室温下搅拌2小时,直到根据LCMS已脱去Fmoc。然后混合物经制备型HPLC(方法B)直接纯化,得到IVj-IVp为白色固体。(IVj)(S)-4-(2-((1R,3R)-3-((2S,3S)-N-(4-(1H-1,2,3-三唑-5-基)丁基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-1-乙酰氧基-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(IVj)按照IVj-IVp的一般方法,得到IVj(2mg,35%收率)为白色固体。ESIm/z:866.5(M+H)+。1HNMR(400MHz,DMSOd6)δ8.15(s,1H),7.70-7.62(m,1H),7.48(s,1H),6.82(d,J=8.2Hz,2H),6.45(d,J=8.1Hz,2H),5.61-5.55(m,1H),5.32(s,1H),4.85(s,2H),4.38(s,1H),4.12-4.03(m,1H),3.77-3.63(m,1H),3.11-2.96(m,1H),2.87-2.79(m,1H),2.74(s,2H),2.69(s,1H),2.67(s,1H),2.33(s,1H),2.25-2.19(m,1H),2.11(s,3H),2.06(s,3H),2.00(d,J=7.4Hz,2H),1.97-1.89(m,3H),1.83-1.73(m,3H),1.63(s,3H),1.47(s,4H),1.45-1.44(m,1H),1.27(s,2H),1.18-1.10(m,2H),0.96(t,J=9.0Hz,9H),0.85(s,3H),0.79(s,3H),0.66(s,3H)ppm。(IVk)(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(4-(1-(2-氨基乙基)-1H-1,2,3-三唑-5-基)丁基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(IVk)按照IVj-IVp的一般方法,得到IVk(2mg,36%收率)为白色固体。ESIm/z:910.5(M+H)+。1HNMR(400MHz,DMSOd6)δ8.17(s,1H),7.83(d,J=10.6Hz,1H),7.67(s,1H),6.79(d,J=8.1Hz,2H),6.44(d,J=8.2Hz,2H),5.64(s,1H),5.32(s,1H),4.85(s,2H),4.43(s,1H),4.28(s,2H),4.15(s,1H),3.06-3.02(m,1H),2.94(s,2H),2.79(s,4H),2.67(s,3H),2.33(s,1H),2.12(t,J=11.7Hz,4H),2.06(s,3H),1.99(s,4H),1.86-1.77(m,3H),1.59(s,6H),1.50(s,4H),1.45-1.35(m,3H),0.97(dd,J=14.6,5.2Hz,8H),0.85(s,1H),0.78(dd,J=16.6,7.2Hz,6H),0.66(s,3H)ppm。(IVl)(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(4-(1-(2-羟乙基)-1H-1,2,3-三唑-5-基)丁基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(IVl)按照IVj-IVp的一般方法,得到IVl(2mg,36%收率)为白色固体。ESIm/z:910.4(M+H)+。1HNMR(400MHz,DMSOd6)δ8.18(s,1H),7.96(s,1H),7.84(s,1H),7.66(s,1H),6.80(d,J=8.2Hz,2H),6.43(d,J=8.2Hz,2H),5.62(d,J=12.5Hz,1H),4.84(s,2H),4.44(s,1H),4.31(t,J=5.4Hz,2H),4.12(s,1H),3.74(d,J=5.5Hz,2H),3.04(s,2H),2.82(d,J=11.7Hz,1H),2.69(d,J=20.5Hz,5H),2.29(d,J=28.0Hz,2H),2.12(s,3H),2.06(s,3H),2.00(d,J=7.2Hz,1H),1.92(d,J=11.8Hz,2H),1.82(s,4H),1.62(s,4H),1.53-1.50(m,1H),1.46(s,3H),1.38-1.34(m,1H),1.23(s,3H),1.17-1.12(m,1H),0.98(d,J=6.7Hz,5H),0.95(d,J=6.4Hz,3H),0.78(dd,J=13.5,6.8Hz,6H),0.67(s,3H)ppm。(IVm)(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(4-(1-(羧甲基)-1H-1,2,3-三唑-4-基)丁基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(IVm)按照IVj-IVp的一般方法,得到IVm(2mg,2步收率为16%)为白色固体。ESIm/z:924.2(M+H)+。1HNMR(400MHz,DMSOd6)δ9.86(s,1H),8.37-8.23(m,1H),8.15(s,1H),8.13-7.81(m,1H),7.75(s,1H),7.62(s,1H),6.79(d,J=8.3Hz,2H),6.42(d,J=8.2Hz,2H),5.61(d,J=13.2Hz,1H),5.31(s,1H),4.93(s,2H),4.48(s,1H),4.17(s,3H),3.66(s,2H),3.00(s,3H),2.66(s,2H),2.32(s,1H),2.22(s,3H),2.12(s,3H),1.99(d,J=7.5Hz,2H),1.91-1.79(m,4H),1.62(d,J=5.3Hz,4H),1.54(d,J=5.2Hz,4H),1.44(s,4H),1.01(d,J=2.3Hz,6H),0.95(d,J=6.5Hz,3H),0.80(t,J=5.6Hz,6H),0.69(s,3H)ppm。(IVn)(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(4-(1-(3-羧丙基)-1H-1,2,3-三唑-4-基)丁基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(IVn)按照IVj-IVp的一般方法,得到IVn(1mg,2步收率为11%)为白色固体。ESIm/z:952.1(M+H)+。1HNMR(400MHz,DMSOd6)δ8.17(s,1H),7.81(s,1H),7.80-7.72(m,1H),7.67(d,J=9.1Hz,1H),6.79(d,J=8.3Hz,2H),6.44(d,J=8.3Hz,2H),5.62(d,J=12.9Hz,1H),4.42(t,J=9.5Hz,1H),4.27(t,J=6.7Hz,2H),4.14(s,2H),3.76(s,1H),3.03-3.00(m,1H),2.82(d,J=5.5Hz,5H),2.66(s,3H),2.22(d,J=12.4Hz,1H),2.12(s,3H),2.06(s,3H),1.93(s,3H),1.81(d,J=7.0Hz,2H),1.74(s,1H),1.65(s,2H),1.59(s,2H),1.51(s,6H),1.48-1.30(m,4H),1.15(d,J=11.9Hz,1H),1.07-1.00(m,1H),0.96(dd,J=11.2,5.0Hz,9H),0.81-0.72(m,6H),0.66(d,J=5.8Hz,3H)ppm。(IVo)(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(4-(1-苄基-1H-1,2,3-三唑-4-基)丁基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(IVo)按照IVj-IVp的一般方法,得到IVo(2.5mg,50%收率)为白色固体。ESIm/z:956.5(M+H)+。1HNMR(500MHz,DMSOd6)δ8.19(s,1H),7.91(s,1H),7.66(s,1H),7.35–7.26(m,5H),6.78(d,J=8.2Hz,2H),6.43(d,J=8.1Hz,2H),5.62(d,J=13.2Hz,1H),5.51(s,2H),4.84(s,2H),4.43(t,J=9.1Hz,1H),4.07(s,1H),3.77–3.67(m,1H),3.07–2.96(s,1H),2.82(d,J=11.5Hz,1H),2.66(s,3H),2.48–2.42(m,2H),2.24(t,J=12.7Hz,1H),2.12(s,3H),2.05(s,3H),2.01–1.88(m,2H),1.89–1.72(m,4H),1.72–1.32(m,10H),1.23(s,2H),1.20–1.10(m,1H),1.06–0.97(m,1H),0.97–0.83(m,9H),0.76(dd,J=17.4,7.0Hz,6H),0.65(s,3H)ppm。(IVp)(S)-4-(2-((1R,3R)-1-乙酰氧基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(4-(1-苯基-1H-1,2,3-三唑-4-基)丁基)戊酰胺基)戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(IVp)按照IVj-IVp的一般方法,得到IVp(3.5mg,40%收率)为无色固体。ESIm/z:942.5(M+H)+。1HNMR(500MHz,DMSOd6)δ8.64(s,1H),8.17(s,1H),7.85(d,J=7.8Hz,2H),7.73-7.61(m,1H),7.56(t,J=7.9Hz,2H),7.45(t,J=7.4Hz,1H),6.80(d,J=8.2Hz,2H),6.43(d,J=8.2Hz,2H),5.64(d,J=13.0Hz,1H),4.84(s,2H),4.38(t,J=9.1Hz,1H),4.09(s,1H),3.84-3.70(s,1H),3.10-3.01(s,1H),2.85-2.62(m,4H),2.48-2.44(m,2H),2.29-2.19(m,1H),2.12(s,3H),2.05(s,3H),2.01-1.90(m,2H),1.88-1.75(m,4H),1.69-1.29(m,10H),1.23(s,2H),1.19-1.10(m,1H),1.02-0.89(m,10H),0.72-0.62(m,9H)ppm。(IVq)(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(IVq)按照IV的一般方法,得到IVg(4.0mg,72%收率)为白色固体。ESIm/z828.3(M+H)+。1HNMR(400MHz,DMSOd6)δ8.19(s,1H),8.04(s,1H),7.65(d,J=8.9Hz,1H),6.81(d,J=8.1Hz,2H),6.44(d,J=8.2Hz,2H),5.64(d,J=13.0Hz,1H),4.84(s,2H),4.49(t,J=9.3Hz,1H),4.43-4.20(m,1H),4.11(s,1H),3.67(d,J=14.8Hz,2H),3.01(d,J=11.0Hz,2H),2.83(d,J=11.4Hz,1H),2.68(d,J=4.7Hz,2H),2.28(dd,J=24.7,12.1Hz,2H),2.13(s,3H),2.07(s,3H),1.98-1.88(m,2H),1.87-1.81(m,2H),1.73(s,1H),1.59(s,2H),1.54(s,2H),1.45(s,2H),1.29(s,6H),1.19-1.06(m,2H),1.00(d,J=9.8Hz,6H),0.95(d,J=6.4Hz,3H),0.83(dd,J=16.5,9.4Hz,10H),0.68(d,J=5.8Hz,3H)ppm。(IVr)(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基-3,5-d2)-2,2-二甲基戊酸(IVr)按照IV的一般方法,得到IVr(2.0mg,34%收率)为白色固体。ESIm/z825.5(M+H)+。1HNMR(500MHz,DMSOd6)δ8.15(s,1H),7.71(s,1H),7.59(s,1H),6.81(s,2H),5.65(d,J=12.4Hz,1H),4.84(s,2H),4.46(t,J=9.3Hz,1H),4.18(s,1H),3.73(s,1H),3.01(s,1H),2.83(d,J=10.7Hz,1H),2.74(s,1H),2.63(dd,J=13.2,6.2Hz,1H),2.57-2.53(m,1H),2.40-2.10(m,7H),2.07(s,3H),2.03-1.69(m,7H),1.69-1.29(m,10H),1.23(s,2H),1.04(d,J=6.7Hz,6H),0.95(d,J=6.1Hz,3H),0.88-0.76(m,6H),0.67(s,3H)ppm。(IVs)(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氨基苯基-3,5-d2)-2,2-二甲基戊酸(IVs)按照IV的一般方法,得到IVs(0.80mg,6%收率)为白色固体。ESIm/z829.5(M+H)+。1HNMR(500MHz,DMSOd6)δ8.16(s,1H),7.67(s,1H),7.53(s,1H),6.80(s,2H),5.65(d,J=13.0Hz,1H),4.80(s,2H),4.48(t,J=9.4Hz,1H),4.19(s,1H),3.70(s,1H),2.99(s,1H),2.81(d,J=15.3Hz,1H),2.68-2.52(m,2H),2.43-2.10(m,7H),2.07(s,3H),2.02-1.73(m,7H),1.73-1.33(m,10H),1.33-1.28(m,2H),1.23(s,2H),1.05(d,J=5.1Hz,6H),0.95(d,J=6.4Hz,3H),0.89-0.78(m,9H),0.68(s,3H)ppm。(IVt)2-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己-5-炔基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(3-((苄氧基羰基)(甲基)氨基)-4-氟苯基)-2,2-二甲基戊酸(IVt1)(图6B)按照IV的一般方法,得到IVt1(6.0mg,47%收率)为白色固体。ESIm/z989.1(M+H)+。4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氟-3-(甲基氨基)苯基)-2,2-二甲基戊酸(IVt)(图6B)在氮气下,向化合物IVt1(6mg,6.1μmol)的溶液中加入湿Pd/C(10%Pd,2mg)。将悬浮液脱气并将气氛用氢气交换3次,然后在室温下在氢气球下搅拌30分钟,通过LCMS进行监测。反应混合物通过硅藻土过滤,滤液真空浓缩。残余物经制备型HPLC(方法B)纯化,得到化合物IVt(2mg,38%收率)为白色固体。ESIm/z859.1(M+H)+。1HNMR(400MHz,DMSOd6)δ8.19(d,J=6.2Hz,1H),7.66(d,J=9.7Hz,1H),6.90-6.77(m,1H),6.38(d,J=8.3Hz,1H),6.32(s,1H),5.63(d,J=12.6Hz,1H),5.36(s,1H),4.48(d,J=6.9Hz,1H),4.21(s,1H),3.70(s,1H),2.97(s,1H),2.81(s,1H),2.70(d,J=21.9Hz,2H),2.55(d,J=4.9Hz,3H),2.22(s,2H),2.12(d,J=3.5Hz,3H),2.06(s,3H),1.97-1.83(m,4H),1.68-1.34(m,9H),1.29(s,8H),1.18-1.13(m,1H),1.04(s,7H),0.95(d,J=6.4Hz,3H),0.88-0.79(m,10H),0.68(d,J=5.9Hz,3H)ppm。(IVuA/B)4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-[3-(二苄基氨基)-4-氟苯基]-2,2-二甲基戊酸(IVu1)按照IV的一般方法,得到IVu1(10mg,40%收率)为白色固体。ESIm/z511.3(M/2+H)+。4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(3-氨基-4-氟苯基)-2,2-二甲基戊酸(IVu)在氮气下,向化合物IVu1(10mg,9.8μmol)的溶液中加入湿Pd/C(10%Pd,3mg)。将悬浮液脱气并将气氛用氢气交换3次,然后在室温下在氢气球下搅拌24小时,通过LCMS进行监测。反应混合物通过硅藻土过滤,滤液真空浓缩。粗产物混合物经制备型HPLC(方法A)纯化,得到化合物IVu为白色固体。IVuA(2mg,23%收率):ESIm/z845.5(M+H)+,LCMS保留时间:1.41min;1HNMR(400MHz,DMSOd6)δ8.21(d,J=8.0Hz,1H),7.64(d,J=9.2Hz,1H),6.83(dd,J=11.4,8.2Hz,1H),6.60(t,J=10.0Hz,1H),6.30(s,1H),5.64(d,J=13.2Hz,1H),5.01(s,2H),4.48(t,J=9.4Hz,1H),4.13(s,1H),3.68(s,1H),3.00(s,2H),2.87-2.65(m,3H),2.25(d,J=11.9Hz,2H),2.12(d,J=4.7Hz,3H),2.06(s,3H),2.00-1.81(m,4H),1.72(brs,1H),1.65-1.25(m,15H),1.18-1.04(m,2H),0.98-0.59(m,22H)ppm。IVuB(2mg,23%收率):ESIm/z845.5(M+H)+,LCMS保留时间:1.42min;1HNMR(400MHz,DMSOd6)δ8.18(s,1H),7.56(s,1H),6.82(dd,J=11.5,8.2Hz,1H),6.67-6.52(m,1H),6.29(s,1H),5.66(s,1H),5.01(s,2H),4.48(t,J=9.1Hz,1H),4.26(s,1H),3.68(s,1H),3.02(s,2H),2.77-2.54(m,3H),2.25(s,2H),2.13(d,J=9.8Hz,6H),1.95-1.50(m,12H),1.35-1.03(m,15H),0.98-0.59(m,17H)ppm。(IVvA/B)4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氨基-3-氟苯基)-2,2-二甲基戊酸(IVv,两个非对映异构体A和B)按照从Ii和IIIe到IVu的类似方法,除了用Ij代替Ii之外,得到作为非对映异构体的化合物IVv,然后通过制备型HPLC(方法A)分离,得到非对映异构体A和非对映异构体B,为白色固体。IVvA(5mg,10%收率):ESIm/z845(M+H)+,LCMS保留时间:1.40min。IVvB(5mg,10%收率):ESIm/z845(M+H)+,LCMS保留时间:1.41min。非对映异构体IVvB如图5A所示。(IVw)(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己-5-炔基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-(苄氧基)-3-硝基苯基)-2,2-二甲基戊酸(IVw1)按照化合物IV的一般方法,得到化合物IVw1(10mg,40%收率)为白色固体。ESIm/z:959.5(M+H)+。(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(3-氨基-4-羟苯基)-2,2-二甲基戊酸(IVw)在氮气下,向化合物IVw1(10mg,0.10mmol)的乙醇(5mL)溶液中加入浓HCl(0.1mL)和湿Pd/C(10%Pd,3mg)。将悬浮液脱气并将气氛用氢气交换3次,然后在室温下在氢气球下搅拌30分钟,通过LCMS进行监测。反应混合物通过硅藻土过滤,滤液真空浓缩。粗产物经制备型HPLC(方法A)纯化,得到化合物IVw(1mg,12%收率)为白色固体。ESIm/z:843.5(M+H)+。(IVx)4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氨基-3-羟基苯基)-2,2-二甲基戊酸(IVx)按照与IVw类似的方法,除了用II代替Ik之外,得到化合物IVx,为白色固体。ESIm/z:843.5(M+H)+。(IVy)(1R,3R)-1-(4-((S)-1-(4-氨基苯基)-5-肼基-4,4-二甲基-5-氧代戊烷-2-基氨基甲酰基)噻唑-2-基)-3-((2S,3S)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基乙酸酯(IVy)向Fmoc-IVq(60mg,60μmol,参见化合物IVq的方法)的无水DMF(2mL)溶液中加入HATU(24mg,66μmol)和DIPEA(24mg,0.18mmol)。混合物在室温下搅拌10分钟,然后加入Boc-肼(8.0mg,60μmol)。将所得溶液在室温下搅拌1小时,通过LCMS进行监测。混合物经反相快速色谱法(5-95%乙腈的水溶液(含0.03%TFA))直接分离,得到Boc-酰肼中间体(70mg,ESIm/z:1163.6(M+H)+)为白色固体。将中间体(10mg,10μmol)溶于DMF(2mL),并向所得溶液中加入1滴哌啶(约0.02mL)。将溶液在室温下搅拌1小时直至根据LCMS已脱去Fmoc。混合物经反相快速色谱法(5-95%乙腈的水溶液(含0.03%TFA))直接分离,得到粗制脱Fmoc中间体(5mg,ESIm/z:421.3((M-Boc)/2+H)+)为白色固体,将其溶于DCM(2mL)。向所得溶液中加入TFA(0.4mL),混合物在室温下搅拌2小时直至根据LCMS已脱去Boc。真空除去挥发物,残余物经制备型HPLC(方法B)纯化,得到化合物Ivy(1mg,由Fmoc-IVq得到收率为11%)为白色固体。ESIm/z:841.5(M+H)+。1HNMR(500MHz,DMSOd6)δ8.75(s,1H),8.17(s,1H),7.64(d,J=9.1Hz,1H),7.50(d,J=8.8Hz,1H),6.80(d,J=8.2Hz,2H),6.44(d,J=8.3Hz,2H),5.60(d,J=12.7Hz,1H),4.85(s,2H),4.49(t,J=9.4Hz,1H),4.07(s,1H),3.91(s,2H),3.68(brs,1H),2.99(s,1H),2.82(d,J=11.5Hz,1H),2.63(dd,J=13.0,6.2Hz,1H),2.47-2.27(m,4H),2.12(s,3H),2.06(s,3H),2.03-1.79(m,5H),1.77-1.39(m,8H),1.32(s,7H),1.23(s,2H),1.00(d,J=8.5Hz,6H),0.96(d,J=6.4Hz,3H),0.90-0.77(m,9H),0.68(d,J=5.5Hz,3H)ppm。O-微管溶素酯V的合成(图5)(Va)(2S,4R)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己氧基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-羟基苯基)-2-甲基戊酸(Va)按照VI(下文)的一般方法,得到Va(8.5mg,28%收率)为白色固体。ESIm/z:830.1(M+H)+。1HNMR(500MHz,DMSOd6)δ9.19(s,1H),8.19(s,1H),7.83(d,J=9.0Hz,1H),7.48(d,J=9.5Hz,1H),6.97(d,J=8.5Hz,2H),6.63(d,J=8.5Hz,2H),5.77(d,J=8.5Hz,1H),4.81-4.78(m,1H),4.16-4.06(m,3H),3.97-3.95(m,1H),2.85-2.83(m,1H),2.75-2.71(m,1H),2.68-2.64(m,1H),2.47-2.36(m,4H),2.11(s,3H),2.10(s,3H),2.07-1.94(m,2H),1.80-1.79(m,2H),1.63-1.61(m,4H),1.54-1.44(m,3H),1.42-1.37(m,4H),1.33-1.26(m,5H),1.18-1.09(m,2H),1.06(d,J=7.5Hz,3H),0.98(d,J=7.0Hz,3H),0.89-0.82(m,12H)ppm。(Vb)(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(Vb)按照VI(下文)的一般方法,得到Vb(6.0mg,30%收率)为白色固体。ESIm/z829.4(M+H)+。1HNMR(400MHz,DMSOd6)δ8.17(s,1H),7.74(brs,1H),7.51(d,J=9.5Hz,1H),6.81(d,J=8.0Hz,2H),6.43(d,J=8.0Hz,2H),5.80(d,J=11.5Hz,1H),4.91-4.78(m,3H),4.19-4.11(m,2H),4.10-4.02(m,1H),3.98-3.93(m,1H),2.87-2.81(m,1H),2.65-2.61(m,1H),2.44-2.32(m,2H),2.11(d,J=14Hz,6H),2.02-1.92(m,2H),1.88-1.78(m,2H),1.66-1.5(m,5H),1.55-1.23(m,11H),1.18-1.14(m,1H),1.03(d,J=11Hz,6H),0.96(d,J=7.0Hz,3H),0.88-0.81(m,12H)ppm。分析型HPLC:95%,Rt:8.55min(方法B)。(Vc)(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-2,2-二甲基-5-苯基戊酸(Vc)按照VI的一般方法,得到Vc(7.0mg,35%收率)为白色固体。ESIm/z810.0(M+H)+。1HNMR(500MHz,DMSOd6)δ8.15(s,1H),7.74(d,J=8.5Hz,1H),7.55(d,J=10.0Hz,1H),7.25-7.22(m,2H),7.18-7.16(m,3H),5.81(d,J=5.0Hz,1H),4.77-4.74(m,1H),4.31-4.22(m,2H),4.08-4.04(m,2H),2.83-2.81(m,3H),2.76-2.71(m,1H),2.34-2.33(m,3H),2.13(s,3H),2.10(s,3H),1.99-1.91(m,3H),1.81-1.80(m,3H),1.69-1.60(m,3H),1.52-1.37(m,4H),1.09-1.08(m,1H),1.06-1.04(m,6H),0.97-0.95(m,6H),0.87-0.81(m,9H)ppm。分析型HPLC:>99%,Rt:8.63min(方法B)。(Vd)(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氟苯基)-2,2-二甲基戊酸(Vd)按照VI的一般方法,得到Vd(8.0mg,40%收率)为白色固体。ESIm/z828.4(M+H)+。1HNMR(400MHz,DMSOd6)δ8.08(s,1H),7.71(d,J=9.2Hz,1H),7.51(d,J=10.0Hz,1H),7.14-7.11(m,2H),7.00-6.95(m,2H),5.74(d,J=10.8Hz,1H),4.68(t,J=9.6Hz,1H),4.18-4.12(m,2H),4.00-3.95(m,2H),2.77-2.64(m,4H),2.29-2.20(m,3H),2.06(s,3H),2.02(s,3H),1.93-1.81(m,3H),1.67-1.62(m,3H),1.57-1.28(m,9H),1.13-1.10(m,2H),1.01(s,3H),0.97(s,3H),0.90-0.88(m,3H),0.81-0.76(m,9H)ppm。分析型HPLC:>99%,Rt:8.40min(方法B)。(Ve)(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氨基苯基)-2,2-二甲基戊酸(Ve)按照VI的一般方法,得到Ve(5.3mg,27%收率)为白色固体。ESIm/z413.3(M/2+H)+,825.3(M+H)+(30%)。1HNMR(500MHz,DMSOd6)δ8.16(s,1H),7.78(d,J=8.5Hz,1H),7.56(d,J=10.0Hz,1H),6.81(d,J=8.5Hz,2H),6.44(d,J=8.0Hz,2H),5.81(d,J=11.0Hz,1H),4.90-4.74(m,3H),4.26-4.23(m,1H),4.15-4.05(m,3H),2.85-2.82(m,2H),2.77(brs,1H),2.68-2.64(m,1H),2.36-2.31(m,3H),2.13(s,3H),2.09(s,3H),2.03-1.96(m,2H),1.89-1.78(m,4H),1.62-1.35(m,9H),1.19-1.05(m,2H),1.04(s,3H),1.00(s,3H),0.96(d,J=5.5Hz,3H),0.89-0.82(m,9H)ppm。分析型HPLC:95%,Rt:6.98min(方法B)。(Vf)(2S,4R)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氟苯基)-2-甲基戊酸(Vf)按照VI的一般方法,得到Vf(4.0mg,20%收率)为白色固体。ESIm/z814.3(M+H)+。1HNMR(500MHz,MeOHd4)δ8.11(s,1H),7.25(dd,J=8.5,5.5Hz,2H),6.96(t,J=9.0Hz,2H),5.92-5.90(m,1H),4.91-4.87(m,1H),4.42-4.38(m,1H),4.36-4.30(m,1H),4.20(dd,J=13.9,6.5Hz,1H),4.09-4.03(m,1H),3.15-3.02(m,2H),2.97-2.90(m,2H),2.75-2.65(m,1H),2.56-2.48(m,1H),2.45-2.34(m,8H),2.20-2.10(m,4H),2.04-1.90(m,5H),1.80-1.57(m,6H),1.46-1.36(m,1H),1.27-1.21(m,1H),1.18(d,J=7.0Hz,3H),1.07(d,J=6.5Hz,3H),1.03-1.01(m,6H),0.95(t,J=7.5Hz,3H)ppm。分析型HPLC:98%,Rt:7.63min(方法B)。(Vg)(2S,4R)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-羟基苯基)-2-甲基戊酸(Vg)按照VI的一般方法,得到Vg(7.8mg,39%收率)为白色固体。ESIm/z812.3(M+H)+。1HNMR(500MHz,MeOHd4)δ8.11(s,1H),7.06(d,J=8.4Hz,2H),6.69(d,J=8.4Hz,2H),5.90(d,J=9.0Hz,1H),4.89-4.85(m,1H),4.64(brs,1H),4.41-4.39(m,1H),4.31-4.26(m,1H),4.20-4.16(m,1H),4.05-3.98(s,1H),3.12-3.30(m,1H),2.86-2.84(m,2H),2.74-2.66(m,1H),2.54-2.49(m,1H),2.43-2.30(m,8H),2.18(s,4H),2.04-1.90(m,5H),1.79-1.56(m,6H),1.46-1.38(m,1H),1.25-1.20(m,1H),1.19(d,J=7.0Hz,3H),1.07(d,J=7.0Hz,3H),1.02(d,J=7.0Hz,6H),0.95(t,J=7.0Hz,3H)ppm。分析型HPLC:>99%,Rt:7.68min(方法A)。(Vh)(2S,4R)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-氨基苯基)-2-甲基戊酸(Vh)按照VI的一般方法,得到Vh(12mg,60%收率)为白色固体。ESIm/z406.2(M/2+H)+,811.2(M+H)+(10%)。1HNMR(500MHz,DMSOd6)δ8.18(s,1H),7.82(d,J=9.0Hz,1H),7.53(d,J=9.5Hz,1H),6.83(d,J=8.5Hz,2H),6.44(d,J=8.5Hz,2H),5.78(d,J=12Hz,1H),4.76(t,J=9.6Hz,1H),4.26-4.12(m,1H),4.10-4.03(m,3H),2.83-2.80(m,2H),2.70-2.65(m,1H),2.60-2.56(m,1H),2.47-2.46(m,1H),2.39-2.28(m,4H),2.12(s,3H),2.09(s,3H),2.03-1.91(m,2H),1.84-1.78(m,4H),1.62-1.35(m,8H),1.18-1.07(m,2H),1.04(d,J=10.5Hz,3H),0.97(d,J=6.5Hz,3H),0.89-0.81(m,9H)ppm。分析型HPLC:>99%,Rt:6.84min(方法A)。(Vi)(2S,4R)-5-(4-羟基苯基)-4-(2-((8R,10R)-8-异丙基-7-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-1-(4-硝基苯基)-12-氧代-2,6,11-三氧杂-7-氮杂十三烷-10-基)噻唑-4-甲酰胺基)-2-甲基戊酸(Vi)按照VI的一般方法,得到Vi(30mg,47%收率)为白色固体。ESIm/z939.5(M+H)+。1HNMR(500MHz,DMSOd6)δ12.08(s,1H),9.15(s,1H),8.19(s,1H),8.17(d,J=8.5Hz,2H),7.86(d,J=8.5Hz,1H),7.56(d,J=8.5Hz,2H),7.51(d,J=10.0Hz,1H),6.96(d,J=8.5Hz,2H),6.62(d,J=8.5Hz,2H),5.77(d,J=12.5Hz,1H),5.77(t,J=8.5Hz,1H),4.59(s,2H),4.31-4.27(m,1H),4.15-4.04(m,3H),3.68-3.58(m,2H),2.85-2.82(m,1H),2.75-2.70(m,1H),2.67-2.62(m,1H),2.42-2.28(m,4H),2.10(s,3H),2.09(s,3H),1.98-1.91(m,4H),1.85-1.74(m,2H),1.63-1.32(m,7H),1.20-1.11(m,1H),1.05-0.99(m,4H),0.93(d,J=6.0Hz,3H),0.84(d,J=7.0Hz,6H),0.79(t,J=7.5Hz,3H)ppm。(Vj)(2S,4R)-4-(2-((8R,10R)-1-(4-氨基苯基)-8-异丙基-7-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-12-氧代-2,6,11-三氧杂-7-氮杂十三烷-10-基)噻唑-4-甲酰胺基)-5-(4-羟基苯基)-2-甲基戊酸(Vj)向化合物Vi(4.0mg,4.2μmol)的乙醇(2.0mL)溶液中加入钯/炭(5%Pd,0.6mg),将混合物脱气并用氢气回填3次。所得混合物在氢气氛下于室温搅拌2小时,直至硝基基团完全还原,通过LCMS进行监测。混合物通过硅藻土过滤,硅藻土用乙醇洗(3x)。合并的滤液真空浓缩。残余物经制备型HPLC(碳酸氢铵体系)纯化,得到化合物Vj(2.0mg,53%收率)为白色固体。ESIm/z:909(M+H)+。1HNMR(500MHz,DMSOd6)δ9.16(s,1H),8.18(s,1H),7.84(d,J=9.2Hz,1H),7.48(d,J=9.6Hz,1H),6.96(d,J=8.4Hz,2H),6.90(d,J=8.0Hz,2H),6.62(d,J=8.4Hz,2H),6.46(d,J=8.4Hz,2H),5.76(d,J=9.6Hz,1H),4.75(t,J=8.4Hz,1H),4.23-4.16(m,3H),4.11(brs,1H),4.04-3.98(m,2H),3.50-3.43(m,2H),2.84-2.81(m,1H),2.75-2.60(m,2H),2.37-2.30(m,3H),2.09-2.07(m,9H),1.97-1.74(m,6H),1.63-1.60(m,2H),1.51-1.33(m,5H),1.23-1.05(m,2H),1.02(d,J=7.6Hz,3H),0.93(d,J=6.4Hz,3H),0.87-0.80(m,9H)ppm。手性SFC>99%(AD-H,AS-H,OJ-H,和OD-H),Rt:1.61min(AD-H),2.71min(AS-H),4.32min(OD-H),和1.97min(OJ-H)。(Vk)(2S,4R)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(3-羟基丙氧基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-羟基苯基)-2-甲基戊酸(Vk)向化合物Vi(17mg,18μmol)的甲醇(4.0mL)溶液中加入钯/炭(5%Pd,1.7mg),将混合物脱气并用氢气回填3次。所得混合物在氢气氛下于室温下搅拌过夜,然后在50℃下再搅拌6小时。LCMS显示Vi和Vj均无剩余。混合物通过硅藻土过滤,硅藻土用乙醇洗(3次)。合并的滤液真空浓缩。残余物经制备型HPLC(碳酸氢铵体系)纯化,得到化合物Vk(6.0mg,41%收率)为白色固体。ESIm/z:804.2(M+H)+。1HNMR(500MHz,DMSOd6)δ9.16(s,1H),8.18(s,1H),7.95(brs,1H),7.51(d,J=10.0Hz,1H),6.98(d,J=8.5Hz,2H),6.63(d,J=8.5Hz,2H),6.80(d,J=11.5Hz,1H),4.79(t,J=8.5Hz,1H),4.26-4.22(m,1H),4.14-4.06(m,3H),3.58-3.56(m,2H),2.85-2.82(m,1H),2.77-2.72(m,1H),2.67-2.63(m,1H),2.48-2.46(m,1H),2.40-2.30(m,2H),2.13(s,3H),2.10(s,3H),2.04-1.91(m,2H),1.85-1.79(m,4H),1.64-1.62(m,2H),1.55-1.32(m,6H),1.20-1.09(m,2H),1.05(d,J=7.0Hz,3H),0.96(d,J=7.0Hz,3H),0.89-0.82(m,10H)ppm。O-微管溶素的合成(图5A)IX和X的一般方法向化合物A-1(1.0当量)的DCM(50mM)溶液中加入化合物A-2(1.5当量)和DIPEA(4.0当量),将反应混合物在室温下搅拌4小时,由LCMS进行监测。所得混合物经反相快速色谱法(0-30%乙腈的TFA(0.01%)水溶液)直接纯化,得到IX或X(7-57%收率)为类白色固体。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-羟基苯基)-2,2-二甲基戊酸(IX)按照IX和X的一般方法,将化合物A-1b用化合物A-2e处理,得到有效负载IX(15mg,12%收率)为白色固体。ESIm/z826.5(M+H)+。1HNMR(400MHz,DMSOd6)δ9.16(s,1H),8.16(s,1H),7.65(d,J=8.4Hz,1H),7.59(d,J=9.6Hz,1H),6.95(d,J=8.4Hz,2H),6.62(d,J=8.4Hz,2H),5.82(d,J=10.0Hz,1H),4.76(t,J=8.4Hz,1H),4.23-4.20(m,2H),4.09-4.01(m,2H),2.90-2.80(m,2H),2.73-2.68(m,1H),2.63-2.58(m,1H),2.39-2.31(m,3H),2.14-2.06(m,6H),2.01-1.87(m,3H),1.84-1.80(m,3H),1.66-1.61(m,3H),1.56-1.53(m,1H),1.46-1.36(m,3H),1.22-1.11(m,2H),1.05-1.03(m,7H),0.96(d,J=6.4Hz,3H),0.88-0.81(m,10H)ppm。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-羟基苯基)-2,2-二甲基戊酸(X)按照IX和X的一般方法,将化合物A-1c用化合物A-2e处理,得到有效负载X(20mg,57%收率)为类白色固体。ESIm/z830.1(M+H)+。1HNMR(400MHz,DMSOd6)δ9.15(s,1H),8.16(s,1H),7.67(brs,1H),7.47(d,J=10.0Hz,1H),6.94(d,J=8.4Hz,2H),6.61(d,J=8.4Hz,2H),5.80(d,J=9.6Hz,1H),4.79(t,J=9.2Hz,1H),4.19-4.04(m,3H),3.95-3.93(m,1H),2.85-2.81(m,1H),2.71-2.62(m,2H),2.43-2.30(m,3H),2.11(d,J=9.6Hz,6H),2.10-1.76(m,4H),1.66-1.10(m,15H),1.04(d,J=6.0Hz,6H),0.96(d,J=6.8Hz,3H),0.88-0.81(m,12H)ppm。O-微管溶素碳酸酯类化合物(VI)的合成化合物33A、33F、33H的一般方法(图7A)向化合物27a、27c、27f(1.0当量)和双(4-硝基苯基)碳酸酯(NPC)(5.0当量)的无水DMF(10mL/g27)混合物中加入DIPEA(3当量),混合物在室温下搅拌16小时直至化合物27a、27c、27f完全消耗,通过LCMS进行监测。将所得混合物倒入饱和碳酸氢钠水溶液中,所得水溶液用乙酸乙酯萃取(4次)。合并的有机溶液用盐水洗,经硫酸钠干燥,过滤,浓缩至干,得到粗化合物33A、33F、33H为黄色油状物,其未经纯化即可用于下一步骤。2-((1R,3R)-3-((2S,3S)-N-(己氧基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基-1-((4-硝基苯氧基)羰氧基)戊基)噻唑-4-羧酸乙酯(33A)向化合物27a(0.10g,0.16mmol)和双(4-硝基苯基)碳酸酯(NPC)(0.25g,0.82mmol)的干燥DMF(1mL)混合物中加入DIPEA(63mg,0.49mmol),混合物在室温下搅拌16小时直至化合物27a完全消耗,通过LCMS进行监测。将所得混合物倒入饱和碳酸氢钠水溶液(10.0mL)中,所得水溶液用乙酸乙酯萃取(4次)。合并的有机溶液用盐水洗,经硫酸钠干燥,过滤,浓缩至干,得到粗化合物33A(430mg)为黄色油状物,其不经纯化即可用于下一步骤。ESIm/z:775.8(M+H)+。化合物34a-e、F、H的一般方法(图7A)通过注射器用R2NH2(2M的THF溶液,4.0当量)处理以上获得的粗品33A、33F、33H(1.0当量,由化合物27a、27c、27f计算)的DCM(5.0mL)溶液。所得溶液在室温下搅拌16小时。然后反应混合物用DCM(5.0mL)稀释,并用饱和碳酸氢钠水溶液(10mL)洗。水层用DCM萃取(两次)。合并的有机溶液用硫酸钠干燥,过滤,真空浓缩,得到粗制氨基甲酸酯,将其溶于水和THF。向所得溶液中加入氢氧化锂水合物(7-8当量)。所得混合物在室温下搅拌过夜。真空除去挥发物,残余的含水混合物用柠檬酸水溶液(1M)酸化至pH6.0。混合物用DCM萃取(3次)。将合并的有机层浓缩,残余物经RP色谱法(0-80%乙腈的水溶液(含或不含0.01%TFA))纯化,得到化合物34a-e、F、H为白色固体。有效负载VIa-f、h的一般方法(图7A)在0℃下,通过注射器向化合物34(1.0当量)和PFP(1.5当量)的干燥DCM(10-15mg/mL)混合物中滴加DIC(1.1当量)的DCM(5-10mg/mL)溶液。使所得溶液升温至室温并搅拌16小时,通过LCMS进行监测。真空除去挥发物,将残余物悬浮于乙酸乙酯中。滤出固体并浓缩滤液。将残余物溶于干燥DMF(15-20mg/mL),向所得溶液中依次加入DIPEA(3.0当量)和中间体Ie或Ic(1.0当量)。反应混合物在室温下搅拌过夜,通过LCMS进行监测。反应混合物经制备型HPLC(碳酸氢铵体系)直接纯化,得到VIa-e或Fmoc-VIf、Fmoc-VIh为白色固体。将化合物Fmoc-VIf、Fmoc-VIh(1当量)溶于DMF(0.15mL/mgFmoc-VIf、Fmoc-VIh)。向所得溶液中加入哌啶(V哌啶/VDMF=1/20,过量),将反应混合物在室温下搅拌1小时直至Fmoc完全脱去,通过LCMS进行监测。反应混合物经制备型HPLC(方法B)直接纯化,得到VIf、VIh为白色固体。2-((5R,7R)-7-异丙基-8-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-3-氧代-4,9-二氧杂-2,8-二氮杂十五烷-5-基)噻唑-4-羧酸三氟乙酸盐(34a)按照34a-e、F、H的一般方法,得到化合物34a(43mg,由27a得到的收率为40%),为三氟乙酸盐。ESIm/z:640.0(M+H)+。1HNMR(400MHz,DMSOd6)δ9.70(brs,1H),8.98-8.96(m,1H),8.42(s,1H),7.46(d,J=4.8Hz,1H),5.62(d,J=7.6Hz,1H),4.78-4.73(m,1H),4.08-4.05(m,1H),3.92-3.82(m,2H),3.63-3.61(m,1H),3.06-2.99(m,1H),2.71(s,3H),2.54-2.51(m,3H),2.17-2.05(m,3H),1.87-1.75(m,1H),1.67-1.66(m,2H),1.58-1.54(m,4H),1.46-1.36(m,4H),1.28-1.27(m,4H),1.16-1.12(m,1H),0.96-0.82(m,17H)ppm。2-((6R,8R)-8-异丙基-9-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-4-氧代-5,10-二氧杂-3,9-二氮杂十六烷-6-基)噻唑-4-羧酸(34b)按照34a-e、F、H的一般方法,得到化合物34b(10mg,由27a得到的收率为10%),为三氟乙酸盐。ESIm/z:654.3(M+H)+。1HNMR(500MHz,DMSOd6)δ8.31(s,1H),7.59(brs,1H),7.51-7.48(m,1H),5.60(d,J=7.0Hz,1H),4.79-4.76(m,1H),4.10-4.06(m,1H),3.95-3.90(m,1H),3.84-3.83(m,1H),3.00-2.94(m,2H),2.89-2.86(m,1H),2.18-2.16(m,4H),2.05-2.03(m,2H),1.82-1.80(m,1H),1.69-1.54(m,6H),1.47-1.37(m,6H),1.29-1.27(m,5H),1.19-1.16(m,1H),1.10-1.06(m,1H),0.99(t,J=7.5Hz,3H),0.94(d,J=6.0Hz,3H),0.91-0.84(m,12H)ppm。2-((7R,9R)-9-异丙基-10-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-5-氧代-6,11-二氧杂-4,10-二氮杂十七烷-7-基)噻唑-4-羧酸三氟乙酸盐(34c)按照34a-e、F、H的一般方法,得到化合物34c(45mg,由27a得到的收率为36%),为三氟乙酸盐。ESIm/z:667.9(M+H)+。1HNMR(400MHz,DMSOd6)δ13.17(brs,1H),9.67(brs,1H),8.99(s,1H),8.42(s,1H),7.59(t,J=5.6Hz,1H),5.62(d,J=11.8Hz,1H),4.77(t,J=8.6Hz,1H),4.16-4.01(m,1H),3.94-3.87(m,1H),3.83(brs,1H),3.63(brs,1H),3.11-2.95(m,1H),2.89(q,J=6.8Hz,2H),2.70(s,3H),2.62-2.53(m,1H),2.26-1.96(m,3H),1.93-1.82(m,1H),1.82-1.52(m,6H),1.51-1.33(m,6H),1.33-1.21(m,4H),1.20-1.08(m,1H),1.00-0.88(m,9H),0.88-0.75(m,9H)ppm。2-((8R,10R)-10-异丙基-11-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-6-氧代-7,12-二氧杂-5,11-二氮杂十八烷-8-基)噻唑-4-羧酸三氟乙酸盐(34d)按照34a-e、F、H的一般方法,得到化合物34d(50mg,由27a得到的收率为44%),为三氟乙酸盐。ESIm/z:682.0(M+H)+。1HNMR(500MHz,DMSOd6)δ13.16(brs,1H),9.69(s,1H),9.01(d,J=9.1Hz,1H),8.42(s,1H),7.57(t,J=5.6Hz,1H),5.62(d,J=11.9Hz,1H),4.76(t,J=8.7Hz,1H),4.11-4.02(m,1H),3.94-3.80(m,2H),3.62(s,1H),3.34(d,J=12.1Hz,1H),3.09-3.00(m,1H),2.97-2.88(m,2H),2.74-2.67(m,3H),2.62-2.54(m,1H),2.18-2.04(m,3H),1.92-1.83(m,1H),1.83-1.54(m,6H),1.49-1.20(m,12H),1.20-1.10(m,1H),0.98-0.88(m,9H),0.88-0.80(m,9H)ppm。2-((9R,11R)-9-异丙基-8-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-13-氧代-7,12-二氧杂-8,14-二氮杂二十烷-11-基)噻唑-4-羧酸三氟乙酸盐(34e)按照34a-e、F、H的一般方法,得到化合物34e(40mg,由27a得到的收率为46%),为三氟乙酸盐。ESIm/z:709.9(M+H)+。(VIa)(2S,4R)-5-(4-羟基苯基)-4-(2-((5R,7R)-7-异丙基-8-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-3-氧代-4,9-二氧杂-2,8-二氮杂十五烷-5-基)噻唑-4-甲酰胺基)-2-甲基戊酸(VIa)按照VIa-f、h的一般方法,得到化合物VIa(16mg,36%收率)为白色固体。ESIm/z:845.0(M+H)+。1HNMR(500MHz,DMSOd6)δ9.70(s,1H),9.22(brs,1H),8.96(d,J=8.5Hz,1H),8.17(s,1H),7.82(d,J=8.5Hz,1H),7.44(d,J=4.5Hz,1H),6.98(d,J=8.0Hz,2H),6.63(d,J=8.0Hz,2H),5.65(d,J=11.5Hz,1H),4.80-4.76(m,1H),4.13-4.11(m,2H),3.98-3.96(m,1H),3.85-3.81(m,2H),3.32(d,J=11.0Hz,1H),3.08-3.01(m,1H),2.74-2.66(m,5H),2.55-2.53(d,J=8.5Hz,3H),2.42-2.38(m,1H),2.25-2.20(m,1H),2.09-2.07(m,2H),1.88-1.82(m,4H),1.78-1.66(m,4H),1.62-1.23(m,10H),1.16-1.11(m,1H),1.07(d,J=7.0Hz,3H),0.98(d,J=7.0Hz,3H),0.92-0.90(m,6H),0.86-0.83(m,6H)ppm。手性SFC:>99%(AD-H和AS-H)。(VIb)(2S,4R)-5-(4-羟基苯基)-4-(2-((6R,8R)-8-异丙基-9-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-4-氧代-5,10-二氧杂-3,9-二氮杂十六烷-6-基)噻唑-4-甲酰胺基)-2-甲基戊酸(VIb)按照VIa-f、h的一般方法,得到化合物VIb(2.0mg,15%收率)为白色固体。ESIm/z:859.5(M+H)+。1HNMR(500MHz,DMSOd6)δ9.17(s,1H),8.15(s,1H),7.76(brs,1H),7.49(t,J=5.5Hz,1H),7.44(d,J=9.5Hz,1H),6.97(d,J=8.5Hz,2H),6.64(d,J=8.5Hz,2H),5.65(d,J=11.0Hz,1H),4.81-4.77(m,1H),4.16-4.11(m,2H),3.97-3.94(m,2H),3.02-2.96(m,1H),2.85-2.82(m,1H),2.75-2.64(m,4H),2.37-2.36(m,1H),2.25-2.19(m,1H),2.10(s,3H),2.04-1.92(m,3H),1.87-1.81(m,2H),1.65-1.48(m,7H),1.41-1.35(m,4H),1.28-1.25(m,5H),1.18-1.15(m,2H),1.05(d,J=7.0Hz,3H),1.02-0.97(m,6H),0.89(d,J=7.0Hz,6H),0.86-0.82(m,6H)ppm。(VIc)(2S,4R)-5-(4-羟基苯基)-4-(2-((7R,9R)-9-异丙基-10-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-5-氧代-6,11-二氧杂-4,10-二氮杂十七烷-7-基)噻唑-4-甲酰胺基)-2-甲基戊酸(VIc)按照VIa-f、h的一般方法,得到化合物VIc(20mg,40%收率)为白色固体。ESIm/z:873.5(M+H)+。1HNMR(500MHz,DMSOd6)δ9.16(s,1H),8.15(s,1H),7.70(d,J=8.8Hz,1H),7.51(t,J=5.6Hz,1H),7.45(d,J=9.4Hz,1H),6.97(d,J=8.3Hz,2H),6.63(d,J=8.3Hz,2H),5.65(d,J=10.8Hz,1H),4.79(d,J=8.0Hz,1H),4.20-4.07(m,2H),4.07-3.90(m,2H),2.91(q,J=6.5Hz,2H),2.87-2.79(m,1H),2.76-2.61(m,2H),2.47-2.34(m,3H),2.27-2.17(m,1H),2.10(s,3H),2.07-1.90(m,2H),1.88-1.76(m,2H),1.67-1.56(m,4H),1.56-1.44(m,3H),1.44-1.31(m,6H),1.29-1.22(m,4H),1.21-1.08(m,2H),1.05(d,J=7.1Hz,3H),0.97(d,J=6.6Hz,3H),0.91-0.78(m,16H)ppm。手性SFC:>99%(AD-H和AS-H)。(VId)(2S,4R)-5-(4-羟基苯基)-4-(2-((8R,10R)-10-异丙基-11-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-6-氧代-7,12-二氧杂-5,11-二氮杂十八烷-8-基)噻唑-4-甲酰胺基)-2-甲基戊酸(VId)按照VIa-f、h的一般方法,得到化合物VId(33mg,50%收率)为白色固体。ESIm/z:887.3(M+H)+。1HNMR(500MHz,DMSOd6)δ9.16(s,1H),8.14(s,1H),7.70(d,J=8.6Hz,1H),7.49(t,J=5.7Hz,1H),7.45(d,J=9.6Hz,1H),6.97(d,J=8.3Hz,2H),6.63(d,J=8.3Hz,2H),5.65(d,J=9.6Hz,1H),4.93-4.62(m,1H),4.20-4.05(m,2H),4.05-3.86(m,2H),2.95(q,J=6.5Hz,2H),2.87-2.78(m,1H),2.78-2.60(m,2H),2.48-2.34(m,3H),2.21(t,J=11.5Hz,1H),2.10(s,3H),2.07-1.90(m,2H),1.89-1.75(m,2H),1.68-1.56(m,4H),1.56-1.44(m,3H),1.42-1.31(m,6H),1.31-1.21(m,6H),1.21-1.07(m,2H),1.05(d,J=7.1Hz,3H),0.97(d,J=6.5Hz,3H),0.93-0.72(m,16H)ppm。手性SFC:>96%(AD-H和AS-H)。(VIe)(2S,4R)-5-(4-羟基苯基)-4-(2-((9R,11R)-9-异丙基-8-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-13-氧代-7,12-二氧杂-8,14-二氮杂二十烷-11-基)噻唑-4-甲酰胺基)-2-甲基戊酸(VIe)按照VIa-f、h的一般方法,得到化合物VIe(21mg,40%收率)为白色固体。ESIm/z:915.5(M+H)+。1HNMR(400MHz,DMSOd6)δ9.17(s,1H),8.15(s,1H),7.71(d,J=9.0Hz,1H),7.58-7.35(m,2H),6.97(d,J=8.3Hz,2H),6.63(d,J=8.3Hz,2H),5.65(d,J=10.0Hz,1H),4.78(d,J=8.4Hz,1H),4.21-4.04(m,2H),4.04-3.86(m,2H),3.01-2.89(m,2H),2.89-2.77(m,1H),2.77-2.59(m,2H),2.48-2.31(m,3H),2.30-2.16(m,1H),2.11(s,3H),2.07-1.90(m,2H),1.90-1.74(m,2H),1.66-1.55(m,4H),1.54-1.44(m,3H),1.43-1.31(m,6H),1.29-1.16(m,12H),1.05(d,J=7.0Hz,3H),0.96(d,J=6.5Hz,3H),0.92-0.77(m,16H)ppm。(VIf)2-[(1R,3R)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]-1-[(4-硝基苯氧基羰基)氧基]戊基]-1,3-噻唑-4-羧酸乙酯(33F)(图7B)按照33A的类似方法,除了用27c代替27a之外,得到化合物33F(120mg,粗品)为黄色油状物,其无需进一步纯化即可用于下一步骤。ESIm/z:758.3(M+H)+。2-[(1R,3R)-1-[(乙基氨基甲酰基)氧基]-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-羧酸(34F)(图7B)按照34b的类似方法,除了用33F代替33A之外,在经反相快速色谱法(45-55%乙腈的TFA(0.01%)水溶液)纯化后,得到化合物34F(25mg,3步收率为52%)。ESIm/z:636.2(M+H)+。(4S)-5-(4-氨基苯基)-4-({2-[(1R,3R)-1-[(乙基氨基甲酰基)氧基]-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-2,2-二甲基戊酸(VIf)(图7B)按照VI的一般方法,除了用34F代替34以及Ic代替Ie之外,得到Fmoc-VIf(15mg)为浅棕色固体。ESIm/z:1076.3(M+H)+。将化合物Fmoc-VIf(15mg)溶于DMF(2.0mL)。向所得溶液中加入哌啶(0.10mL),将反应混合物在室温下搅拌1小时直至Fmoc完全脱去,通过LCMS进行监测。反应混合物经制备型HPLC(方法B)直接纯化,得到VIf(8mg,3步收率为27%)为白色固体。ESIm/z:854.5(M+H)+。1HNMR(MeOHd4,500MHz)δ8.07(s,1H),6.99(d,J=8.4Hz,2H),6.66(d,J=8.4Hz,2H),5.78(dd,J=11.2,1.2Hz,1H),4.90-4.88(m,1H),4.38-4.27(m,2H),4.20-4.15(m,1H),4.00-3.91(m,1H),3.16-3.09(m,3H),3.04-3.01(m,1H),2.94-2.91(m,1H),2.85-2.66(m,3H),2.49-2.12(m,9H),2.06-1.55(m,12H),1.43-1.31(m,1H),1.24-1.00(m,17H),0.94(t,J=7.2Hz,3H)ppm。分析型HPLC:>99%,保留时间:7.85min(方法B)。(VIg)(4S)-5-(4-乙酰胺基苯基)-4-({2-[(1R,3R)-1-[(乙基氨基甲酰基)氧基]-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-2,2-二甲基戊酸(VIg)(图7B)将化合物VIf(1.0mg,1.2μmol)溶于DCM(1.0mL),将所得溶液在冰浴中冷却至0℃。向溶液中加入Ac2O(0.24mg,2.4μmol)的DCM(50μL)溶液和DIPEA(0.30mg,2.4μmol)的DCM(50μL)溶液。将反应混合物在室温下搅拌2小时。LCMS显示起始物料完全消耗,并检测到所需产物。真空除去挥发物,粗产物经制备型HPLC(方法B)直接纯化,得到VIg(0.3mg,收率28%)为白色固体。ESIm/z:896.5(M+H)+。分析型HPLC:100%,保留时间:7.49min(方法B)。(VIh)(S)-5-(4-氨基苯基)-4-(2-((5R,7R)-7-异丙基-8-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰基)-3-氧代-4,9-二氧杂-2,8-二氮杂十四烷-5-基)噻唑-4-甲酰胺基)-2,2-二甲基戊酸(VIh)(图7B)按照由27c得到化合物VIf的类似方法,除了用27f代替27c之外,得到化合物VIh(2mg,由27f得到的收率为4.5%)为白色固体。ESIm/z:844.2(M+H)+。1HNMR(DMSOd6,400MHz)δ8.10(d,J=21.6Hz,1H),7.45(dd,J=30.2,7.1Hz,2H),6.81(d,J=8.2Hz,2H),6.44(d,J=8.3Hz,2H),5.79-5.56(m,1H),4.94-4.63(m,3H),4.14(s,2H),3.95(d,J=7.1Hz,1H),2.85(d,J=11.4Hz,2H),2.70-2.60(m,2H),2.56(d,J=4.6Hz,2H),2.45-2.41(m,1H),2.20(d,J=11.4Hz,1H),2.09(d,J=12.0Hz,3H),2.05-1.90(m,3H),1.81(s,3H),1.61(s,6H),1.50(d,J=20.7Hz,2H),1.35(d,J=4.8Hz,6H),1.14(d,J=28.2Hz,2H),1.08(d,J=9.2Hz,1H),1.03(d,J=7.9Hz,6H),0.96(d,J=6.6Hz,2H),0.90-0.79(m,12H)ppm。示例性制备方案E、H、J、K、M、和N方案E(102和102a)向Fmoc-vc-PAB-X(X=Br、Cl或-OTf)的DMF溶液中加入哌啶,所得溶液在室温下搅拌直至Fmoc-vc-PAB-X完全耗尽,由LCMS进行监测。在催化量NaI存在下提高了收率。按照标准后处理条件,将粗制vc-PAB-X溶于DMF,并加入6-马来酰亚胺基己酸(过量)、HATU和DIPEA。反应在室温下搅拌直至vc-PAB-X完成耗尽,通过LCMS进行监测。按照标准后处理条件,将粗物料经HPLC纯化以提供102。按照相同的方法,除了用L-3(过量)代替6-马来亚氨基己酸(过量)之外,提供了102a。或者,将粗制vc-PAB-X溶于DMF,加入L-4(过量)和DIPEA。将反应在室温下搅拌直至通过LCMS监测vc-PAB-X完成耗尽。按照标准后处理条件,粗物料经HPLC纯化,亦可提供102a。方案E(104和104a)向100的DMF溶液中加入102或102a(过量)。各反应在室温下搅拌直至通过LCMS监测100完全耗尽。按照标准后处理条件,各粗物料经HPLC纯化,分别提供104或104a。或者,将已知的102aa溶于THF(或另一种极性非质子溶剂),并用DIBAL还原,在消耗102aa之后,提供102b,通过LCMS进行监测。在标准后处理和分离条件之后,将102b溶于DMF(或另一种极性非质子溶剂),并在PyBoc和DIPEA存在下于室温下与102c偶联,同样在标准后处理和分离条件之后(注意:已知102d在以下步骤中同样有效),以提供102dd。Fmoc-vc-PAB-X(X=Br、Cl或–OTf)溶于DMF(或另一种极性非质子溶剂),并在催化量NaI、DMAP和吡啶存在下,用102d或102dd处理,以提供粗品102f。在标准后处理和分离条件之后,在DMF(或另一种极性非质子溶剂)中用哌啶进行后续处理以提供102f。将102f溶于DMF(或另一种极性非质子溶剂),并用L-4和DIPEA处理,然后进行标准后处理和分离条件,以提供102h。102h可被进一步操作,如在图4和图5中类似描述的(参见图4,24a-e偶联至25),以得到104a(参见图5,例如,A=Q)。方案H(108和108a)向Fmoc-vc-PAB-Br的DMF(或另一种非质子化有机溶剂)溶液中加入NaN3,所得溶液在室温下搅拌直至Fmoc-vc-PAB-Br完全消耗,通过LCMS进行监测。然后加入哌啶并搅拌,直至通过LCMS已完成Fmoc脱保护。按照标准后处理条件,将粗制vc-PAB-N3溶于DMF(或另一种非质子化有机溶剂),加入6-马来亚氨基己酸(过量)、HATU和DIPEA。将反应在室温下搅拌,直至通过LCMS监测vc-PAB-Br完全耗尽。按照标准后处理条件,粗物料经HPLC纯化以提供108。按照相同的方法,除了用L-3(过量)代替6-马来酰亚胺基己酸(过量)之外,提供了108a。或者,将粗制vc-PAB-N3溶于DMF(或另一种非质子化有机溶剂),然后加入L-4(过量)和DIPEA。反应在室温下搅拌直至通过LCMS监测vc-PAB-N3完全耗尽。按照标准后处理条件,粗物料经HPLC纯化,亦可提供108a。方案H(110和110a)向108或108a(过量)和抗坏血酸钠的THF:水(3:1)溶液中加入106。然后加入1滴硫酸铜水溶液。各混合物在室温下搅拌直至根据LCMS监测106消耗。标准后处理和HPLC纯化分别得到110和110a。方案J(116、116a、116b和116c)向112、L-1(过量)和HOBt的DMF(或另一种非质子化有机溶剂)溶液中加入DIPEA,并搅拌反应直至LCMS监测112消耗。在标准后处理条件下,粗物料经HPLC纯化以提供116。或者,向112、L-2(过量)和HOBt的DMF(或另一种非质子化有机溶剂)溶液中加入DIPEA,搅拌反应直至通过LCMS监测112消耗。按照标准后处理条件,粗物料经HPLC纯化以提供116a。向116a的DMF(或另一种非质子化有机溶剂)溶液中加入哌啶,通过LCMS监测反应直至Fmoc脱保护完成。按照标准后处理条件,粗物料经HPLC纯化以提供116b。向116b的DMF(或另一种非质子化有机溶剂)溶液中加入L-3(过量)、HATU和DIPEA。反应在室温下搅拌直至通过LCMS监测116b完全耗尽。按照标准后处理条件,粗物料经HPLC纯化以提供116c。或者,向116b的DMF(或另一种非质子化有机溶剂)溶液中加入L-4(过量)和DIPEA,将反应在室温下搅拌直至通过LCMS监测116b完全消耗。按照标准后处理条件,粗物料经HPLC纯化,亦可提供116c。方案K(120和120a)向Fmoc-vc-PAB-OH的DCM(或另一种非质子化有机溶剂)溶液中加入TBSCl和NEt3。搅拌反应直至通过LCMS监测消耗Fmoc-vc-PAB-OH。按照标准后处理条件,将粗制Fmoc-vc-PAB-OTBS溶于DMF(或另一种非质子化有机溶剂),并加入哌啶。在标准后处理之后,将粗制vc-PAB-OTBS溶于DMF(或另一种非质子化有机溶剂),加入6-马来酰亚胺基己酸(过量)、HATU和DIPEA。反应在室温下搅拌直至通过LCMS监测消耗vc-PAB-OTBS。然后加入过量的TBAF的THF溶液,在通过LCMS监测完全脱保护后,粗物料经HPLC纯化以提供120。按照相同的方法,除了用L-3(过量)代替6-马来酰亚胺基己酸(过量)之外,提供了120a。或者,将粗制vc-PAB-OTBS溶于DMF(或另一种非质子化有机溶剂),然后加入L-4(过量)和DIPEA。反应在室温下搅拌,直至通过LCMS监测vc-PAB-OTBS完全消耗。然后加入过量的TBAF的THF溶液,在通过LCMS监测完全脱保护后,粗物料经HPLC纯化,亦可提供120a。方案K(122和122a)在0℃下,通过注射器向118和PFP的DCM(或另一种非质子化有机溶剂)溶液中滴加DIC的DCM(或另一种非质子化有机溶剂)溶液。搅拌所得溶液直至通过LCMS监测消耗118。然后真空除去挥发物,将残余物溶于乙酸乙酯。过滤固体,滤液浓缩,以提供中间体五氟苯基酯。将中间体酯溶于DMF,加入DIPEA,然后加入120或120a。各单独的溶液搅拌过夜,并通过HPLC纯化,得到酯122或122a。方案M(128、128a、128b和128c)向124、L-1(过量)和HOBt的DMF(或另一种非质子化有机溶剂)溶液中加入DIPEA,搅拌反应直至根据LCMS监测124耗尽。在标准后处理条件下,粗物料经HPLC纯化,以提供128。或者,向124、L-2(过量)和HOBt的DMF(或另一种非质子化有机溶剂)溶液中加入DIPEA,搅拌反应直至通过LCMS监测124耗尽。按照标准后处理条件,粗物料经HPLC纯化以提供128a。向128a的DMF溶液中加入哌啶,通过LCMS监测反应直至Fmoc脱保护完成。按照标准后处理条件,粗物料经HPLC纯化以提供128b。向128b的DMF(或另一种非质子化有机溶剂)溶液中加入L-3(过量)、HATU和DIPEA。反应在室温下搅拌直至通过LCMS监测128b完全耗尽。按照标准后处理条件,粗物料经HPLC纯化以提供128c。或者,向128b的DMF(或另一种非质子化有机溶剂)溶液中加入L-4(过量)和DIPEA,将反应在室温下搅拌直至通过LCMS监测128b完全耗尽。按照标准后处理条件,粗物料经HPLC纯化,亦可提供128c。方案N(134、134a、134b、和134c)向130、L-1(过量)和HOBt的DMF(或另一种非质子化有机溶剂)溶液中加入DIPEA,搅拌反应直至通过LCMS监测消耗130。在标准后处理条件下,粗物料经HPLC纯化以提供134。或者,向130、L-2(过量)和HOBt的DMF(或另一种非质子化有机溶剂)溶液中加入DIPEA,搅拌反应直至通过LCMS监测消耗130。按照标准后处理条件,粗物料经HPLC纯化以提供134a。向134a的DMF(或另一种非质子化有机溶剂)溶液中加入哌啶,通过LCMS监测反应直至Fmoc脱保护完成。按照标准后处理条件,粗物料经HPLC纯化以提供134b。向134b的DMF(或另一种非质子化有机溶剂)溶液中加入L-3(过量)、HATU和DIPEA。反应在室温下搅拌,直至通过LCMS监测134b完全耗尽。按照标准后处理条件,粗物料经HPLC纯化以提供134c。或者,向134b的DMF(或另一种非质子化有机溶剂)溶液中加入L-4(过量)和DIPEA,将反应在室温下搅拌直至通过LCMS监测134b完全耗尽。按照标准后处理条件,粗物料经HPLC纯化,亦可提供134c。MC-连接体-有效负载的合成(图8)(1R,3R)-1-(4-((2R,4S)-1-(4-氟苯基)-5-肼基-4-甲基-5-氧代戊烷-2-基氨基甲酰基)噻唑-2-基)-3-((2S,3R)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基乙酸酯(IVa′)在-15℃下、于氮气下,向IVa(9mg,0.011mmol)的无水乙酸乙酯(1mL)溶液中加入二异丙基乙胺(14mg,0.11mmol)和氯甲酸异丁酯(15mg,0.11mmol)的混合物。将溶液在-15℃于氮气下再搅拌2小时后,向其中加入NH2NH2·H2O(8mg,0.17mmol)的DMF(0.5mL)溶液。反应混合物在-15℃下搅拌过夜,然后再加热至20℃搅拌45分钟。粗产物经碱性制备型HPLC纯化,得到IVa′(4mg,收率44%)为白色固体。ESI-MS(EI+,m/z):830[M+H]+。(1R,3R)-3-[(2S,3S)-N-(己氧基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-1-(4-{[(2R,4S)-4-(肼羰基)-1-(4-羟基苯基)-4-甲基丁烷-2-基]氨基甲酰基}-1,3-噻唑-2-基)-4-甲基戊基乙酸酯(Va′)将化合物Va(50mg,60.2μmol)、HATU(34mg,90.3μmol)和DIPEA(16mg,120.4μmol)的无水DMF(5.0mL)混合物在室温下搅拌10min,然后向混合物中加入水合肼(95%,9mg,180.7μmol)。将所得溶液再搅拌1小时,通过LC-MS确认反应完成。反应混合物经制备型HPLC(方法B)直接纯化,得到Va′(34mg,收率68%)为白色固体。ESIm/z:844.3(M+H)+。1HNMR(500MHzDMSOd6)δ9.15(s,1H),8.94(s,1H),8.21(s,1H),7.79(d,J=9.0Hz,1H),7.46(d,J=10.0Hz,1H),6.96(d,J=8.5Hz,2H),6.62(d,J=8.5Hz,2H),5.76(d,J=10.5Hz,1H),4.81-4.78(m,1H),4.18-3.94(m,6H),2.85-2.82(m,1H),2.73-2.62(m,2H),2.47-2.28(m,4H),2.12(s,3H),2.10(s,3H),2.03-1.93(m,2H),1.84-1.77(m,2H),1.64-1.61(m,4H),1.56-1.53(m,1H),1.47-1.45(m,2H),1.39-1.35(m,4H),1.27-1.26(m,4H),1.18-1.05(m,2H),0.97(d,J=6.5Hz,6H),0.89-0.82(m,12H)ppm。4-((S)-2-((S)-2-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基-((2S,4R)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3R)-N-己基-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-氟苯基)-2-甲基戊酰基)肼羧酸酯(LP1)向IVa′(3.0mg,0.036mmol)、mc-vc-PAB-PNP(L-1)(8.1mg,0.108mmol)和HOBt(9mg,0.07mmol)的DMF(1mL)溶液中加入DIPEA(0.9mg,0.007mmol)。反应混合物在室温下于N2下搅拌过夜。粗产物经酸性制备型HPLC纯化,得到LP1(3.4mg,66%)为白色固体。ESI-MS(EI+,m/z):1428.7[M+H]+,715.0[M/2+H]+。DIBAC-连接体-有效负载的合成(图9)(2R,4S)-5-肼基-1-(4-羟基苯基)-4-甲基-5-氧代戊烷-2-基氨基甲酸叔丁酯(35)将中间体Ie(500mg,1.5mmol)、HATU(706mg,1.9mmol)和DIPEA(399mg,3.1mmol)的干燥DMF(7.5mL)溶液在室温下搅拌30min,然后加入水合肼(95%,712mg,15.5mmol)。所得溶液搅拌过夜直至LCMS监测反应完成。反应混合物经RP色谱法(0-100%乙腈的水溶液,含10mMNH4HCO3)直接纯化,得到化合物35(450mg,72%)为白色固体。ESIm/z:338.0(M+H)+。1HNMR(500MHz,DMSOd6)δ9.10(s,1H),8.84(s,1H),6.91(d,J=8.5Hz,2H),6.64-6.60(m,3H),4.11-4.07(m,2H),3.40-3.37(m,1H),2.49-2.46(m,2H),2.29-2.25(m,1H),1.68-1.62(m,1H),1.34-1.21(m,10H),0.96(d,J=6.5Hz,3H)ppm。4-((S)-2-((S)-2-(((9H-芴-9-基)甲氧基)羰基氨基)-3-甲基丁酰胺基)-7-氨基-7-氧代庚酰胺基)苄基2-((2S,4R)-4-(叔丁氧基羰基氨基)-5-(4-羟基苯基)-2-甲基戊酰基)肼羧酸酯(36)将化合物35(430mg,1275.9μmol)、DIPEA(317mg,2551.8μmol)和HOBt(258mg,1913.9μmol)的干燥DMF(7.0mL)溶液用Fmoc-vc-PAB-PNP(L-2)(1075mg,1403.5μmol)处理,然后将反应在室温下搅拌3小时直至LCMS监测反应完成。反应完成的溶液经RP色谱法(0-80%乙腈的水溶液,含0.1%TFA)纯化,得到化合物36(800mg,收率65%)为白色固体。ESIm/z:965.4(M+H)+。4-((S)-2-((S)-2-(((9H-芴-9-基)甲氧基)羰基氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基2-((2S,4R)-4-氨基-5-(4-羟基苯基)-2-甲基戊酰基)肼羧酸酯(37)将化合物36(500mg,518.7μmol)的DCM(9.5mL)溶液用TFA(0.5mL)处理,混合物于室温下搅拌1小时直至反应完成。然后将溶液冷却至0℃,用N-甲基吗啉(NMM)中和以达到pH7.0。然后将溶液浓缩,残余物经RP色谱法(0-100%乙腈的去离子水溶液)纯化,得到化合物37(167mg,收率37%)为白色固体。ESIm/z:865.4(M+H)+。1HNMR(400MHz,DMSOd6)δ10.09(s,1H),9.72(s,1H),9.34(s,1H),9.24(s,1H),8.13-8.10(m,1H),7.90-7.86(m,2H),7.75-7.71(m,2H),7.68-7.67(m,2H),7.61-7.58(m,2H),7.44-7.38(m,3H),7.33-7.29(m,4H),7.04-7.69(m,2H),6.71(d,J=8.0Hz,2H),5.99-5.96(m,1H),5.41(s,2H),5.02(s,2H),4.41-4.37(m,1H),4.31-4.19(m,3H),3.94-3.90(m,1H),3.29-3.28(m,1H),3.04-2.90(m,2H),2.71-2.66(m,2H),2.00-1.95(m,1H),1.78-1.33(m,6H),1.00(d,J=6.4Hz,3H),0.88-0.83(m,6H)ppm。手性SFC:>99%(AD-H,AS-H,OJ-H,和OD-H),Rt:2.14min(AD-H),3.89min(AS-H),1.99min(OJ-H),和4.97min(OD-H)。4-((S)-2-((S)-2-(((9H-芴-9-基)甲氧基)羰基氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基2-((2S,4R)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己氧基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-羟基苯基)-2-甲基戊酰基)肼羧酸酯(38)在0℃下,通过注射器向化合物IIIa(125mg,200μmol)和PFP(55mg,300μmol)的无水二氯甲烷(4.0mL)溶液中滴加DIC(38mg,300μmol)的二氯甲烷(1.0mL)溶液。将所得溶液再搅拌1小时。然后真空除去挥发物,将残余物溶于乙酸乙酯(4.0mL)。滤出固体,浓缩滤液,得到呈淡黄色油状的五氟苯基酯(200mg粗品),将其溶于无水DMF(3.0mL)。然后向所得溶液中加入二异丙基乙胺(DIPEA,62mg,480μmol),然后加入化合物37(138mg,160μmol)。将溶液搅拌过夜,然后经RP色谱法(0-100%乙腈的去离子水溶液)纯化,得到化合物38(70mg,两步收率30%)为白色固体。ESIm/z:1471.4(M+H)+,736.3(M/2+H)+。1HNMR(500MHz,DMSOd6)δ10.10(s,1H),9.68(s,1H),9.15(brs,2H),8.22(s,1H),8.14-8.13(m,1H),7.91-7.88(m,3H),7.77-7.73(m,2H),7.62-7.57(m,2H),7.46-7.40(m,3H),7.35-7.23(m,4H),7.00-6.90(m,2H),6.61(d,J=8.0Hz,2H),5.99-5.98(m,1H),5.78-5.74(m,1H),5.42(s,2H),5.02-5.01(m,2H),4.81-4.78(m,1H),4.44-4.40(m,1H),4.32-4.23(m,3H),4.17-4.05(m,3H),3.97-3.92(m,2H),3.04-2.84(m,3H),2.74-2.71(m,2H),2.48-2.34(m,3H),2.11(s,6H),2.03-1.98(m,3H),1.82-1.79(m,2H),1.69-1.32(m,16H),1.27-1.24(m,5H),1.18-1.07(m,2H),1.06-1.03(m,2H),1.00(d,J=7.0Hz,3H),0.90-0.82(m,19H)ppm。手性SFC:>99%(AS-H,OJ-H,和OD-H),Rt:2.19min(AD-H),3.99min(AS-H),2.06min(OJ-H),和6.24min(OD-H)。4-((S)-2-((S)-2-氨基-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基2-((2S,4R)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己氧基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-羟基苯基)-2-甲基戊酰基)肼羧酸酯(39)将化合物38(70.0mg,47.5μmol)的干燥DMF(2.0mL)溶液用哌啶(0.5mL)处理,并在室温下搅拌30分钟。然后将溶液浓缩至干,用石油醚(3x5mL)研磨,经制备型HPLC(碳酸氢铵体系)进一步纯化,得到化合物39(35mg,59%)为白色固体。ESIm/z:1249.5(M+H)+。1HNMR(500MHz,DMSOd6)δ10.16(s,1H),9.67(s,1H),9.16(s,1H),9.13(s,1H),8.21(s,1H),8.14-8.13(m,1H),7.91-7.85(m,1H),7.61(d,J=8.0Hz,2H),7.45(d,J=10.0Hz,1H),7.31(d,J=8.0Hz,2H),6.99(d,J=8.0Hz,2H),6.61(d,J=7.5Hz,2H),6.00-5.99(m,1H),5.76(dd,J=10.5,2.5Hz,1H),5.41(s,2H),5.02(s,2H),4.82-4.78(m,1H),4.49-4.47(m,1H),4.47-3.95(m,4H),3.05-3.00(m,2H),2.96-2.91(m,1H),2.85-2.82(m,1H),2.73-2.64(m,2H),2.47-2.34(m,4H),2.10(s,3H),2.09(s,3H),2.03-1.91(m,3H),1.81-1.77(m,3H),1.70-1.68(m,1H),1.64-1.53(m,7H),1.50-1.32(m,7H),1.30-1.24(m,5H),1.20-1.16(m,1H),1.08-1.02(m,2H),0.97(d,J=6.5Hz,3H),0.90-0.82(m,17H),0.78(d,J=7.0Hz,3H)ppm。手性SFC:Rt:2.37min(AD-H),2.11min(OJ-H),和5.73min(OD-H)。(1R,3R)-1-(4-{[(2R,4S)-4-{N'-[({4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.0^{4,9}]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲氧基)羰基]肼羰基}-1-(4-羟基苯基)-4-甲基丁烷-2-基]氨基甲酰基}-1,3-噻唑-2-基)-3-[(2S,3S)-N-(己氧基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基乙酸酯(LP2)将DIBAC-suc-PEG4-COOH(L-3)(5.7mg,10.4μmol)、HATU(5.9mg,15.6μmol)和DIPEA(2.7mg,20.8μmol)的干燥DMF(1.0mL)溶液在室温下搅拌30分钟,然后加入化合物39(13.0mg,10.4μmol)。所得溶液搅拌过夜直至LCMS监测反应完成。反应混合物经制备型HPLC(方法B)直接纯化,得到LP2(5mg,27%)为类白色固体。ESIm/z:892.5(M/2+H)+。1HNMR(500MHz,DMSOd6)δ10.02(s,1H),9.67(s,1H),9.13(s,1H),8.24-8.18(m,1H),8.13(d,J=6.8Hz,1H),7.88(d,J=8.7Hz,2H),7.77(t,J=5.5Hz,1H),7.68(d,J=7.2Hz,1H),7.64-7.41(m,6H),7.40-7.20(m,4H),7.02-6.84(m,2H),6.70-6.29(m,2H),6.04-5.95(m,1H),5.76(d,J=7.8Hz,1H),5.42(s,2H),5.23-4.93(m,3H),4.84-4.75(m,1H),4.43-4.36(m,1H),4.27-4.20(m,1H),4.20-4.01(m,3H),3.96(d,J=6.6Hz,1H),3.65-3.42(m,12H),3.31-3.24(m,3H),3.15-2.99(m,3H),2.97-2.91(m,1H),2.87-2.81(m,1H),2.77-2.54(m,3H),2.48-2.33(m,5H),2.29-2.19(m,1H),2.15-2.05(m,5H),2.04-1.91(m,4H),1.89-1.68(m,4H),1.67-1.49(m,9H),1.45-1.22(m,13H),1.12-0.92(m,9H),0.92-0.77(m,20H)ppm。图10A中DIBAC-连接体-有效负载的合成(S)-5-(4-((4-((S)-2-((S)-2-(((9H-芴-9-基)甲氧基)羰基氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄氧基)羰基氨基)苯基)-4-氨基-2,2-二甲基戊酸(40)向化合物7e(20mg,59μmol)和L-2(50mg,65μmol)的DMF(2mL)的混合物中加入HOBt(8.0mg,59μmol)和DIPEA(15mg,0.12mmol)。将反应在室温下搅拌16小时并通过LCMS监测。然后所得混合物经反相色谱法(0-100%乙腈的TFA(0.01%)水溶液)直接纯化,得到40(31mg,54%收率)为白色固体。ESIm/z:964.1(M+H)+。(S)-5-(4-((4-((S)-2-((S)-2-(((9H-芴-9-基)甲氧基)羰基氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄氧基)羰基氨基)苯基)-4-氨基-2,2-二甲基戊酸(41)将化合物40(40mg,41μmol)和TFA(0.5mL)的DCM(5mL)混合物在25℃下搅拌0.5h,然后真空浓缩,得到41(36mg,100%收率)为棕色油状物。ESIm/z:432.6(M+2H)/2+。(S)-5-(4-((4-((S)-2-((S)-2-(((9H-芴-9-基)甲氧基)羰基氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄氧基)羰基氨基)苯基)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己-5-炔基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-2,2-二甲基戊酸(42a)将化合物41(36mg,41μmol)、DIPEA(21mg,167μmol)和化合物28e(32mg,41μmol)的DMF(2mL)混合物在25℃下搅拌16小时,然后反应溶液经RP色谱法纯化,得到42a(28mg,48%收率)为白色固体。ESIm/z:725(M+2H)/2+。(S)-5-(4-((4-((S)-2-((S)-2-(((9H-芴-9-基)甲氧基)羰基氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄氧基)羰基氨基)苯基)-4-(2-((1R,3R)-1-乙酰氧基-4-甲基-3-((2S,3S)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)-N-(戊-4-炔基氧基)戊酰胺基)戊基)噻唑-4-甲酰胺基)-2,2-二甲基戊酸(42b)将化合物41(40mg,46μmol)、DIPEA(18mg,139μmol)和化合物28c(36mg,46μmol)的DMF(3mL)混合物在25℃下搅拌16小时,然后经RP色谱法纯化,得到42b(30mg,34%收率)为白色固体。ESIm/z:727(M+2H)/2+。(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己-5-炔基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-((4-((S)-2-((S)-2-氨基-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄氧基)羰基氨基)苯基)-2,2-二甲基戊酸(43a)向化合物42a(40mg,41μmol)的DMF(1mL)溶液中加入哌啶(10mg,0.12mmol)。将反应混合物在室温下搅拌2小时,直至根据LCMS监测已完全脱去Fmoc。对所得混合物进行反相快速色谱法(0-100%乙腈的TFA(0.01%)水溶液)纯化,得到43a(36mg)为棕色油状物。ESIm/z:432.6(M+2H)/2+。(S)-4-(2-((1R,3R)-1-乙酰氧基-3-((2S,3S)-N-(己-5-炔基)-3-甲基-2-((R)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-((4-((S)-2-((S)-2-氨基-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄氧基)羰基氨基)苯基)-2,2-二甲基戊酸(43b)将化合物42b(30mg,20.68μmol)和哌啶(7.98mg,165.43μmol)的DMF(1mL)混合物在25℃下搅拌16小时,然后反应溶液经RP色谱法纯化,得到所需产物43b(17mg,收率67%)为白色固体。ESIm/z:615.8(M+2H)/2+。LP3的合成(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{[({4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲氧基)羰基]氨基}苯基)-2,2-二甲基戊酸(LP3)将化合物43a(30mg,24.42μmol)、DIBAC-suc-PEG4-NHS(L-4)(15.86mg,24.42μmol)和DIPEA(5.37mg,41.51μmol)的DMF(2mL)混合物在25℃下搅拌16小时,然后反应溶液经RP色谱法(乙腈/水)纯化,得到LP3(5mg,35%)为白色固体。ESIm/z:882.1(M+2H)/2+。1HNMR(500MHz,DMSOd6)δ12.15(s,1H),10.02(s,1H),9.68(s,1H),8.16(s,2H),7.89(d,J=8.7Hz,1H),7.78(d,J=5.5Hz,2H),7.68(d,J=6.9Hz,1H),7.62(d,J=8.3Hz,4H),7.51-7.43(m,3H),7.35(d,J=8.0Hz,7H),7.07(d,J=8.4Hz,2H),6.00(s,1H),5.65(d,J=13.0Hz,1H),5.43(s,2H),5.03(d,J=14.5Hz,3H),4.46(s,1H),4.38(d,J=5.3Hz,1H),4.24(d,J=6.9Hz,2H),3.74(s,1H),3.59(s,3H),3.47(s,14H),3.31-3.25(m,4H),3.08(s,2H),3.04-2.97(m,2H),2.94(dd,J=13.1,6.4Hz,1H),2.83(d,J=10.7Hz,1H),2.75(s,2H),2.67(dd,J=15.9,9.1Hz,1H),2.59(dd,J=16.2,8.0Hz,1H),2.48-2.45(m,1H),2.36(dd,J=14.3,6.4Hz,1H),2.23(dd,J=15.6,7.8Hz,3H),2.14(s,4H),2.07(s,3H),1.98(ddd,J=20.0,13.8,6.5Hz,4H),1.87(s,3H),1.76(dd,J=15.2,6.8Hz,2H),1.68(d,J=11.2Hz,2H),1.61(d,J=9.8Hz,3H),1.40(dd,J=35.4,22.6Hz,7H),1.26-1.12(m,2H),1.06(d,J=4.2Hz,6H),0.95(d,J=6.3Hz,3H),0.82(d,J=6.6Hz,12H),0.67(s,3H)ppm。LP4的合成(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{[({4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基丁酰胺基]-2-[2-(氨基甲酰基氨基)乙氧基]乙酰胺基]苯基}甲氧基)羰基]氨基}苯基)-2,2-二甲基戊酸(LP4)将化合物43b(17mg,14μmol)、DIBAC-suc-PEG4-NHS(L-4)(9mg,14μmol)和DIPEA(5.4mg,42μmol)的DMF(2mL)混合物在25℃下搅拌16小时,然后反应溶液经RP色谱法(乙腈和水)纯化,得到LP4(5mg,20%;在重复合成中为67%)为白色固体。ESIm/z:883.1(M+2H)/2+。1HNMR(500MHz,DMSOd6)δ12.01(s,1H),11.16(s,1H),10.00(s,1H),9.68(s,1H),9.63(s,1H),8.95(s,1H),8.18(s,1H),8.10(s,1H),7.87(d,J=8.7Hz,1H),7.76(s,2H),7.67(d,J=7.2Hz,1H),7.62(d,J=8.4Hz,3H),7.52-7.42(m,3H),7.33(s,7H),7.07(d,J=8.5Hz,2H),5.99(s,1H),5.82(d,J=10.8Hz,1H),5.42(s,2H),5.05(s,3H),4.75(t,J=8.6Hz,1H),4.42-4.34(m,1H),4.23(d,J=8.4Hz,3H),4.10-3.73(m,2H),3.59(s,3H),3.50-3.43(m,12H),3.29(s,4H),3.08(d,J=5.7Hz,2H),3.02(dd,J=13.4,6.7Hz,2H),2.96-2.91(m,1H),2.83(s,1H),2.77-2.73(m,1H),2.67(d,J=7.4Hz,1H),2.58(dd,J=16.2,8.0Hz,3H),2.46-2.44(m,1H),2.36(dt,J=23.7,9.1Hz,5H),2.23(dd,J=15.5,7.7Hz,1H),2.14(s,3H),2.07(s,1H),2.03-1.88(m,4H),1.83(d,J=6.5Hz,2H),1.75(dd,J=14.0,8.2Hz,2H),1.68(d,J=11.1Hz,2H),1.59(d,J=9.1Hz,2H),1.47-1.34(m,4H),1.24(s,1H),1.13(s,1H),1.06(d,J=11.9Hz,6H),0.97(d,J=6.6Hz,3H),0.89(s,6H),0.87-0.80(m,10H)ppm。DIBAC-VA-连接体-有效负载的合成(图10B)LP5的合成(4S)-4-{[(叔丁氧基)羰基]氨基}-5-{4-[(2S)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]丙酰胺基]苯基}-2,2-二甲基戊酸(40b)向化合物L-5(Fmoc-VA-OH,0.21g,0.50mmol)的DMF(3.0mL)溶液中加入HATU(0.19g,0.50mmol)和DIPEA(0.13g,1.0mmol)。将反应混合物在室温下搅拌10分钟,然后加入化合物7e(0.17g,0.50mmol)。混合物在室温下搅拌2小时,通过LCMS进行监测。混合物经制备型HPLC(方法B)直接纯化,得到化合物40b(0.15g,40%收率)为白色固体。ESIm/z:746.3(M+H2O)+。1HNMR(DMSOd6,400MHz)(含旋转异构体)δ9.88和9.72(s,1H),8.35和8.17(d,J=7.2Hz,1H),7.90-7.87(m,2H),7.76-7.71(m,2H),7.56-7.38(m,5H),7.32(t,J=7.2Hz,2H),7.05(t,J=8.4Hz,2H),6.46(d,J=8.8Hz,1H),7.46-7.39(m,1H),4.33-4.18(m,3H),3.93-3.85(m,1H),3.70-3.60(m,1H),2.60-2.50(m,2H),2.02-1.93(m,1H),1.72-1.65(m,1H),1.57-1.53(m,1H),1.29-1.17(m,12H),1.06-1.02(m,6H),0.89-0.84(m,6H)ppm。分析型HPLC:100%,保留时间:7.39min(方法B)。(4S)-4-氨基-5-{4-[(2S)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]丙酰胺基]苯基}-2,2-二甲基戊酸(41b)按照与40到41类似的方法,除了用40b代替40之外,得到化合物41b(15mg,TFA盐,100%粗收率)为棕色油状物,直接用于下一步骤。ESIm/z:629.3(M+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]丙酰胺基]苯基}-2,2-二甲基戊酸(42c)按照与41到42a类似的方法,除了用41b(15mg,18μmol)代替41之外,得到化合物42c(10mg,2步收率为46%)为白色固体。ESIm/z:1215.6(M+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]丙酰胺基]苯基}-2,2-二甲基戊酸(43c)按照与42a到43a类似的方法,除了用42c(10mg,8.2μmol)代替42a之外,得到化合物43c(5mg,61%收率)为白色固体。ESIm/z:497.4(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基丁酰胺基]丙酰胺基]苯基}-2,2-二甲基戊酸(LP5)向化合物L-3(4.1mg,7.4μmol)的DMF(1mL)溶液中加入HATU(2.9mg,7.5μmol)以及DIPEA(1.3mg,0.01mmol)的DMF(25μL)溶液。将反应混合物在室温下搅拌10分钟,然后加入化合物43c(5.0mg,5.0μmol)。混合物在室温下搅拌1小时,通过LCMS进行监测。混合物经制备型HPLC(方法B)直接纯化,得到化合物LP5(3mg,39%收率)为白色固体。ESIm/z:764.5(M/2+H)+。1HNMR(DMSOd6,400MHz)(含旋转异构体)δ9.85和9.73(s,1H),8.39-8.37和8.17-8.12(m,2H),7.99和7.87(d,J=8.4Hz,1H),7.78-7.26(m,12H),7.10-7.06(m,2H),5.64(d,J=11.2Hz,1H),5.02(d,J=13.6Hz,1H),4.47-4.07(m,5H),3.75-3.26(m,22H),3.09-2.74(m,6H),2.60-2.42(m,2H),2.35-1.03(m,42H),0.94-0.65(m,16H)ppm。分析型HPLC:100%,保留时间:8.18min(方法B)。LP6和LP7的合成(图10C)(4S)-4-{[(叔丁氧基)羰基]氨基}-5-{4-[(2S)-5-(氨基甲酰基氨基)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]戊酰胺基]苯基}-2,2-二甲基戊酸(40c)在氮气氛下,向化合物L-6(Fmoc-Val-Cit-OH,0.60g,1.2mmol)、化合物7e(0.20g,0.06mmol)和EEDQ(0.22g,0.90mmol)的DCM(20mL)混合物中加入10mL甲醇,混合物变澄清。将溶液在室温下于黑暗环境中搅拌过夜,通过LCMS进行监测。混合物真空浓缩,残余物经制备型HPLC(方法B)纯化,得到化合物40c(85mg,17%收率)为白色固体。ESIm/z:815.3(M+H)+。1HNMR(DMSOd6,400MHz)δ9.94(s,1H),8.11(d,J=7.2Hz,1H),7.89(d,J=7.6Hz,2H),7.75(t,J=7.6Hz,1H),7.54-7.30(m,7H),7.05(t,J=8.0Hz,2H),6.47(d,J=8.8Hz,1H),6.02-5.94(m,1H),5.41(s,2H),4.45-4.20(m,4H),3.94-3.90(m,1H),3.70-3.62(m,1H),3.04-2.89(m,2H),2.61-2.50(m,2H),2.02-1.94(m,1H),1.72-1.19(m,15H),1.07-1.03(m,6H),0.89-0.84(m,6H)ppm。分析型HPLC:99%,保留时间:6.90min(方法B)。(4S)-4-氨基-5-{4-[(2S)-5-(氨基甲酰基氨基)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]戊酰胺基]苯基}-2,2-二甲基戊酸(41c)按照与40到41类似的方法,除了用40c代替40之外,得到化合物41c(25mg,TFA盐,100%粗收率)为棕色油状物,直接用于下一步骤。ESIm/z:715.3(M+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-5-(氨基甲酰基氨基)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]戊酰胺基]苯基}-2,2-二甲基戊酸(42d)按照与41到42a类似的方法,不同之处在于用41c(52mg,60μmol)代替41,并用28d(61mg,78μmol)代替28e,化合物42d(52mg,2步收率为66%)为白色固体。ESIm/z:654.3(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}-2,2-二甲基戊酸(43d)按照与42a到43a类似的方法,除了用42d(52mg,40μmol)代替42a之外,得到化合物43d(37mg,85%收率)为白色固体。ESIm/z:543.5(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}-2,2-二甲基戊酸(LP6)按照与43a到LP3类似的方法,除了用43d(24mg,22μmol)代替43a之外,得到化合物LP6(24mg,67%收率)为白色固体。ESIm/z:810.5(M/2+H)+。1HNMR(DMSOd6,400MHz)δ9.87(s,1H),8.17(s,1H),8.08(d,J=7.6Hz,1H),7.95-7.86(m,1H),7.86(d,J=9.2Hz,1H),7.76(t,J=5.6Hz,1H),7.69-7.66(m,1H),7.62(d,J=6.8Hz,1H),7.55-7.43(m,5H),7.40-7.28(m,3H),7.09(d,J=8.4Hz,2H),6.00(t,J=5.6Hz,1H),5.80(dd,J=6.8,2.4Hz,1H),5.41(s,2H),5.03(t,J=14.4Hz,1H),4.82-4.78(m,1H),4.40-4.34(m,1H),4.24-4.03(m,4H),3.98-3.92(m,1H),3.62-3.28(m,23H),3.13-2.89(m,4H),2.85-2.75(m,2H),2.70-2.62(m,1H),2.62-2.32(m,5H),2.28-2.19(m,1H),2.12(s,3H),2.10(s,3H),2.03-1.86(m,5H),1.81-1.28(m,17H),1.04(d,J=8.4Hz,6H),0.97-0.94(m,3H),0.89-0.80(m,18H)ppm。分析型HPLC:100%,保留时间:8.52min(方法B)。LP7的合成(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-5-(氨基甲酰基氨基)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]戊酰胺基]苯基}-2,2-二甲基戊酸(42e)按照与41到42a类似的方法,除了用41c(25mg,40μmol)代替41之外,得到化合物42e(36mg,2步收率70%)为白色固体。ESIm/z:651.3(M/2+H)+。1HNMR(DMSOd6,400MHz)δ9.97(s,1H),8.17(s,1H),8.09(d,J=7.2Hz,1H),7.89(d,J=7.2Hz,2H),7.76-7.67(m,3H),7.52-7.38(m,5H),7.32(t,J=7.2Hz,2H),7.10(d,J=8.0Hz,2H),6.01(t,J=4.8Hz,1H),5.67-5.63(m,1H),5.42(s,2H),4.48-4.21(m,7H),3.94-3.90(m,1H),3.78-3.69(m,1H),3.04-2.90(m,3H),2.83-2.67(m,4H),2.33-1.04(m,41H),0.94-0.80(m,14H),0.68-0.66(m,3H)ppm。分析型HPLC:99%,保留时间:8.35min(方法B)。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-(己-5-炔-1-基)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}-2,2-二甲基戊酸(43e)按照与42a到43a类似的方法,除了用42e(26mg,20μmol)代替42a之外,得到化合物43e(21mg,97%收率)为白色固体。ESIm/z:540.3(M/2+H)+。LP9、LP11、和LP12的合成(图10D)(4S)-4-{[(叔丁氧基)羰基]氨基}-5-{4-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}丙酰胺基]-3-氟苯基}-2,2-二甲基戊酸(B-2)向化合物B-1(0.65g,1.8mmol)的吡啶(10mL)溶液中加入Fmoc-Ala-Cl(0.91g,1.5mmol)和DMAP(10mg,82μmol),反应混合物在室温下搅拌12小时,通过LCMS进行监测。真空除去挥发物,残余物经反相快速色谱法(0-100%乙腈的TFA(0.03%)水溶液)纯化,得到粗制化合物B-2(0.66g,80%纯度,57%收率)为白色固体。ESIm/z548.3(M–Boc+H)+,670.3(M+Na)+。(4S)-5-{4-[(2S)-2-氨基丙酰胺基]-3-氟苯基}-4-{[(叔丁氧基)羰基]氨基}-2,2-二甲基戊酸(B-3)将以上获得的粗制化合物B-2(0.66g,1.0mmol)溶于DMF(2mL),并加入哌啶(0.26g,3.1mmol),将混合物在室温下搅拌12小时,通过LCMS进行监测。反应混合物经反相快速色谱法(0-100%乙腈的TFA(0.03%)水溶液)直接纯化,得到化合物B-3(0.35g,80%收率)为白色固体。ESIm/z370.2(M-tBu+H)+。(4S)-4-{[(叔丁氧基)羰基]氨基}-5-{4-[(2S)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]丙酰胺基]-3-氟苯基}-2,2-二甲基戊酸(B-4)向化合物B-3(42mg,0.10mmol)的DMF(3mL)溶液中加入Fmoc-Val-OSu(45mg,0.11mmol)和DIPEA(40mg,0.31mmol),将反应混合物在室温下搅拌16小时,通过LCMS进行监测。所得混合物经反相快速色谱法(0-100%乙腈的TFA(0.03%)水溶液)直接纯化,得到化合物B-4(37mg,50%收率)为白色固体。ESIm/z647.3(M–Boc+H)+,770.3(M+Na)+。(4S)-4-氨基-5-{4-[(2S)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]丙酰胺基]-3-氟苯基}-2,2-二甲基戊酸(B-5)向化合物B-4(75mg,0.10mmol)的DCM(5mL)溶液中加入TFA(1mL),将反应混合物在室温下搅拌2小时,直至完全脱去Boc,通过LCMS进行监测。真空浓缩所得混合物,得到粗化合物B-5(60mg,收率92%)为白色固体,其无需进一步纯化即可直接用于下一步骤。ESIm/z647.3(M+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]丙酰胺基]-3-氟苯基}-2,2-二甲基戊酸(B-6a)向化合物B-5(65mg,0.10mmol)的DMF(5mL)溶液中加入化合物A-1a(77mg,0.10mmol)和DIPEA(40mg,0.31mmol),反应混合物在室温下搅拌过夜,通过LCMS进行监测。所得混合物经反相快速色谱法(0-100%乙腈的TFA(0.03%)水溶液)直接纯化,得到化合物B-6a(61mg,50%收率)为白色固体。ESIm/z619.5(M/2+H)+,1238.7(M+H)+。(4S)-5-{4-[(2S)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]丙酰胺基]-3-氟苯基}-4-({2-[(1R,3R)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基-1-[(甲基氨基甲酰基)氧基]戊基]-1,3-噻唑-4-基}甲酰胺基)-2,2-二甲基戊酸(B-6b)按照与B-6a类似的方法,除了用A-1d代替A-1b之外,得到化合物B-6b(0.10g,64%收率)为白色固体。ESIm/z626.9(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]丙酰胺基]-3-氟苯基}-2,2-二甲基戊酸(B-7a)向化合物B-6a(61mg,49μmol)的DMF(5mL)溶液中加入哌啶(13mg,0.15mmol),将混合物在室温下搅拌2小时直至完全脱去Fmoc,由LCMS进行监测。所得混合物经反相快速色谱法(0-100%乙腈的TFA(0.03%)水溶液)直接纯化,得到化合物B-7a(41mg,80%收率)为白色固体。ESIm/z508.1(M/2+H)+。(4S)-5-{4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]丙酰胺基]-3-氟苯基}-4-({2-[(1R,3R)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基-1-[(甲基氨基甲酰基)氧基]戊基]-1,3-噻唑-4-基}甲酰胺基)-2,2-二甲基戊酸(B-7b)按照与B-7a类似的方法,除了用B-6b代替B-6a之外,得到化合物B-7b(60mg,70%收率)为白色固体。ESIm/z516.0(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基丁酰胺基]丙酰胺基]-3-氟苯基}-2,2-二甲基戊酸(LP9)向化合物B-7a(20mg,20μmol)的DMF(2mL)溶液中加入B-8a(16mg,25μmol)和DIPEA(7.3mg,57μmol),将反应溶液在RT下搅拌2小时,通过LCMS进行监测。所得溶液经制备型HPLC(0-100%乙腈的碳酸氢铵(10mM)水溶液)直接纯化,得到连接体-有效负载LP9(20mg,65%收率)为白色固体。ESIm/z775.2(M/2+H)+。1HNMR(400MHz,DMSOd6)δ9.56(s,1H),8.22(d,J=6.8Hz,1H),8.17(s,1H),7.87(d,J=8.8Hz,1H),7.81-7.67(m,6H),7.51-7.45(m,3H),7.38-7.28(m,3H),7.05(d,J=11.6Hz,1H),6.92(d,J=7.6Hz,1H),5.65(d,J=12.8Hz,1H),5.03(d,J=14.0Hz,1H),4.52-4.47(m,2H),4.23-4.19(m,2H),3.62-3.56(m,4H),3.47-3.44(m,12H),3.12-3.03(m,2H),3.01-2.88(m,1H),2.87-2.71(m,3H),2.62-2.55(m,1H),2.47-2.41(m,2H),2.38-2.19(m,4H),2.13(s,3H),2.06(m,3H),2.08-1.81(m,6H),1.79-1.31(m,11H),1.28-1.24(m,10H),1.07(s,3H),1.06(s,3H),0.94(d,J=6.4Hz,3H),0.84-0.79(m,18H),0.68(d,J=6.0Hz,3H)ppm。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-[1-({[(1R,8S,9R)-二环[6.1.0]壬-4-炔-9-基甲氧基]羰基}氨基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基丁酰胺基]丙酰胺基]-3-氟苯基}-2,2-二甲基戊酸(LP11)按照与连接体-有效负载LP9类似的方法,除了用B-8b代替B-8a,得到连接体-有效负载LP11(12mg,48%收率)为白色固体。ESIm/z719.7(M/2+H)+。1HNMR(400MHz,DMSOd6)δ9.60(s,1H),8.21(d,J=6.8Hz,1H),8.16(s,1H),7.87(d,J=7.2Hz,1H),7.81-7.71(m,2H),7.64(d,J=7.2Hz,1H),7.07-7.04(m,2H),6.92(d,J=8.4Hz,1H),5.65(d,J=11.6Hz,1H),4.51-4.43(m,3H),4.33-4.26(m,2H),4.23-4.19(m,2H),4.03(d,J=8.0Hz,3H),3.71-3.63(m,6H),3.58-3.56(m,12H),3.13-3.10(m,1H),2.87-2.73(m,2H),2.48-2.42(m,2H),2.39-2.33(m,1H),2.26-2.15(m,6H),2.13(s,3H),2.06(m,3H),1.97-1.82(m,5H),1.75-1.32(m,11H),1.29-1.23(m,12H),1.08(s,3H),1.07(s,3H),0.95(d,J=6.4Hz,3H),0.85-0.80(m,18H),0.68(d,J=6.0Hz,3H)ppm。(4S)-5-{4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基丁酰胺基]丙酰胺基]-3-氟苯基}-4-({2-[(1R,3R)-3-[(2S,3S)-N-己基-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}戊酰胺基]-4-甲基-1-[(甲基氨基甲酰基)氧基]戊基]-1,3-噻唑-4-基}甲酰胺基)-2,2-二甲基戊酸(LP12)按照与连接体-有效负载LP9类似的方法,除了用B-7b代替B-7a,得到连接体-有效负载LP12(20mg,65%收率)为白色固体。ESIm/z783.1(M/2+H)+。1HNMR(400MHz,DMSOd6)δ9.62(s,1H),8.24(d,J=6.7Hz,1H),8.13(s,1H),7.89(d,J=8.8Hz,1H),7.77(s,2H),7.68-7.60(m,3H),7.51-7.29(m,8H),7.09-6.89(m,2H),5.55(s,1H),5.03(d,J=14.0Hz,1H),4.50-4.30(m,4H),3.62(s,1H),3.60-3.55(m,4H),3.49-3.42(m,9H),3.38-3.25(m,4H),3.13-3.03(m,3H),2.95(s,1H),2.90-2.34(m,8H),2.27-2.21(m,1H),2.08-1.70(m,7H),1.70-1.45(m,6H),1.30-1.20(m,12H),1.11-1.02(m,8H),1.00-0.83(m,25H),0.69(s,3H)ppm。LP10和LP15的合成(图10E)(4S)-4-氨基-5-(4-{[({4-[(2S)-5-(氨基甲酰基氨基)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]戊酰胺基]苯基}甲氧基)羰基]氨基}苯基)-2,2-二甲基戊酸(C-2a)向化合物D-1(20mg,59μmol)和Fmoc-vcPAB-PNP(C-1a)(50mg,65μmol)的DMF(2mL)混合物中加入HOBt(8.0mg,59μmol)和DIPEA(15mg,0.12mmol),将反应混合物在RT下搅拌过夜,通过LCMS进行监测。然后将所得混合物通过反相快速色谱法(0-100%乙腈的TFA(0.01%)水溶液)直接纯化,得到Boc-C-2a(31mg,ESIm/z964.1(M+H)+)为白色固体,将其溶于DCM(4mL)。向所得溶液中加入TFA(0.5mL),反应混合物在室温下搅拌半小时直至Boc完全脱去,通过LCMS进行监测。真空除去挥发物,得到化合物C-2a(37mg,54%收率,TFA盐)为棕色油状物。ESIm/z432.6(M/2+H)+。(4S)-4-氨基-5-{4-[(2S)-5-(氨基甲酰基氨基)-2-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-3-甲基丁酰胺基]戊酰胺基]苯基}-2,2-二甲基戊酸(C-2b)在氮气下,向Fmoc-Val-Cit-OH(C-1b)(0.60g,1.2mmol)的DCM(20mL)和甲醇(10mL)混合物中加入化合物D-1(0.20g,0.59mmol)和EEDQ(0.22g,0.90mmol),混合物变澄清。将溶液在室温下于黑暗环境中搅拌过夜,通过LCMS进行监测。真空浓缩混合物,残余物经反相快速色谱法(0-100%乙腈的碳酸氢铵(10mM)水溶液)纯化,得到化合物Boc-C-2b(85mg,ESIm/z:815.3(M+H)+)为白色固体;然后将其溶于DCM(10mL)。向所得溶液中加入TFA(1mL),混合物在室温下搅拌1小时直至Boc完全脱去,通过LCMS进行监测。真空除去挥发物,得到化合物C-2b(84mg,17%收率,TFA盐)为棕色油状物。ESIm/z715.3(M+H)+。化合物C-3和C-4的一般方法向化合物C-2(1.0当量)的DMF(15mM)混合物中加入DIPEA(3.0当量)和五氟苯基酯(A-1b、A-1c、A-1e),将反应混合物在RT下搅拌过夜,由LCMS进行监测。所得混合物经反相快速色谱法(0-100%乙腈的水溶液)直接纯化,得到化合物C-3(30-67%收率)为白色固体;然后将其溶于DMF(40mM)。向所得溶液中加入哌啶(3.0当量),混合物在室温下搅拌2小时直至完全脱去Fmoc,通过LCMS进行监测。所得混合物经反相快速色谱法(0-100%乙腈的TFA(0.01%)水溶液)直接纯化,得到化合物C-4(由活化酯的2步收率为25-67%)。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{[({4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲氧基)羰基]氨基}苯基)-2,2-二甲基戊酸(C-4a)按照化合物C-3和C-4的一般方法,将C-2a用A-1b处理,得到化合物C-4a(17mg,由A-1b得到的收率为67%)为白色固体。ESIm/z615.8(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}-2,2-二甲基戊酸(C-4b)按照化合物C-3和C-4的一般方法,将C-2b用A-1c处理,得到化合物C-4b(37mg,由A-1c得到的收率为56%)为白色固体。ESIm/z543.5(M/2+H)+。(4S)-5-(4-{[({4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲氧基)羰基]氨基}苯基)-2,2-二甲基-4-({2-[(1R,3R)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]-1-[(甲基氨基甲酰基)氧基]戊基]-1,3-噻唑-4-基}甲酰胺基)戊酸(C-4c)按照化合物C-3和C-4的一般方法,将C-2a用A-1e处理,得到化合物C-4c(9mg,由A-1e得到的收率为20%)为白色固体。ESIm/z1250.1(M+H)+。(4S)-5-{4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}-2,2-二甲基-4-({2-[(1R,3R)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]-1-[(甲基氨基甲酰基)氧基]戊基]-1,3-噻唑-4-基}甲酰胺基)戊酸(C-4d)按照化合物C-3和C-4的一般方法,将C-2b用A-1e处理,得到化合物C-4d(9mg,由A-1e得到的收率为29%)为白色固体。ESIm/z1101.1(M+H)+。(4S)-5-{4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}-2,2-二甲基-4-({2-[(1R,3R)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]-1-[(甲基氨基甲酰基)氧基]戊基]-1,3-噻唑-4-基}甲酰胺基)戊酸(LP10)按照LP9的类似方法,除了用C-4d代替B-7a之外,得到连接体-有效负载LP10(7mg,52%收率)为白色固体。ESIm/z818.0(M/2+H)+。1HNMR(400MHz,DMSOd6)δ9.90-9.80(m,1H),8.15(s,4H),7.80(s,1H),7.68(d,J=7.3Hz,1H),7.62(d,J=7.2Hz,1H),7.58-7.27(m,10H),7.09(d,J=8.0Hz,2H),6.01(s,1H),5.67(d,J=10.9Hz,1H),5.43(s,2H),5.02(d,J=13.9Hz,1H),4.78(s,1H),4.35(s,1H),4.25-3.33(m,21H),3.32-2.53(m,14H),2.46-2.43(m,1H),2.32-2.20(m,4H),2.11(s,3H),2.02-1.95(m,5H),1.82-1.70(m,2H),1.65-1.55(m,6H),1.42-1.28(m,9H),1.24(s,1H),1.16-0.80(m,29H)ppm。(4S)-5-(4-{[({4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲氧基)羰基]氨基}苯基)-2,2-二甲基-4-({2-[(1R,3R)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]-1-[(甲基氨基甲酰基)氧基]戊基]-1,3-噻唑-4-基}甲酰胺基)戊酸(LP15)按照连接体-有效负载LP9的类似方法,除了用C-4c代替B-7a之外,得到连接体-有效负载LP15(22mg,80%收率)为白色固体。ESIm/z892.5(M/2+H)+。1HNMR(400MHz,DMSOd6)δ9.99(s,1H),9.61(s,1H),8.11-8.09(m,2H),7.86(d,J=9.2Hz,1H),7.75(t,J=5.6Hz,1H),7.67-7.65(m,1H),7.61-7.59(m,3H),7.50-7.44(m,4H),7.39-7.36(m,2H),7.34-7.20(m,7H),7.05(d,J=8.4Hz,2H),5.97(t,J=5.6Hz,1H),5.67(d,J=11.2Hz,1H),5.40(s,2H),5.04(s,3H),4.78(t,J=8.4Hz,1H),4.40-4.34(m,1H),4.23-4.19(m,2H),4.11-4.09(m,1H),4.03-3.92(m,3H),3.65-3.53(m,6H),3.09-2.90(m,8H),2.86-2.81(m,1H),2.76-2.63(m,3H),2.55(d,J=4.8Hz,3H),2.46-2.43(m,2H),2.39-2.31(m,2H),2.26-2.16(m,3H),2.10(s,3H),2.01-1.92(m,6H),1.88-1.70(m,4H),1.68-1.48(m,9H),1.46-1.27(m,12H),1.04(s,3H),1.02(s,3H),0.94(d,J=6.8Hz,3H),0.86-0.80(m,18H)ppm。LP13、LP14、LP16、LP17、LP18、LP19、LP20、LP21、LP22、LP23和LP24的合成(图10F)(4S)-4-氨基-5-[4-(2-{[(9H-芴-9-基甲氧基)羰基]氨基}乙酰胺基)苯基]-2,2-二甲基戊酸(D-4a)向D-1(Boc-A-2d)(0.34g,1.0mmol)的DCM(10mL)溶液中加入2,6-二甲基吡啶(0.21g,2.0mmol)和Fmoc-Gly-Cl(D-2a)(0.45g,1.5mmol),反应混合物在室温下搅拌3小时,通过LCMS进行监测。所得混合物用乙酸乙酯(50mL)稀释,然后用水和盐水洗,经无水硫酸钠干燥,真空浓缩。残余物经反相快速色谱法(0-100%乙腈的TFA(0.3%)水溶液)纯化,得到化合物D-3a(0.31g,50%收率)为白色固体。ESIm/z516.3(M–Boc+H)+。向D-3a(0.31g,如上获得)的DCM(5mL)溶液中加入TFA(1.0mL),将混合物在室温下搅拌2小时,直至在真空中完全脱去Boc,通过LCMS进行监测。真空除去挥发物,得到粗化合物D-4b(0.30g,由D-1得到收率为58%)为白色固体。ESIm/z516.3(M+H)+。(4S)-4-氨基-5-{4-[(2S)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}丙酰胺基]苯基}-2,2-二甲基戊酸(D-4b)按照D-4a的类似方法,除了用Fmoc-Ala-Cl(D-2b)代替D-2a之外,得到化合物D-4b(0.31g,由D-1得到的收率为58%)为白色固体。ESIm/z530.3(M+H)+。(4S)-4-氨基-5-{4-[(2S)-4-羧基-2-{[(9H-芴-9-基甲氧基)羰基]氨基}丁酰胺基]苯基}-2,2-二甲基戊酸(D-4c)向Fmoc-Glu(OtBu)-OH(0.64g,1.5mmol)的DCM(10mL)溶液中加入草酰氯(4.5mmol),将反应混合物在室温下搅拌1小时。所得混合物真空浓缩,得到化合物Fmoc-Glu(OtBu)-Cl(D-2c),直接用于下一步骤。按照化合物D-4a的类似方法,除了用化合物D-2c(以上获得)代替D-2a,得到化合物D-4c(0.25g,由D-1得到的收率为43%)为白色固体。ESIm/z588.3(M+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-[4-(2-氨基乙酰胺基)苯基]-2,2-二甲基戊酸(D-5a)按照VII和VIII的一般方法,将化合物D-4a用化合物A-1b处理,得到化合物Fmoc-D-5a(77mg,70%收率,ESIm/z552.0(M/2+H)+)为白色固体,将其溶于DMF(1mL)。向所得溶液中加入哌啶(26mg,0.31mmol),反应混合物在室温下搅拌2小时直至完全脱去Fmoc,通过LCMS进行监测。所得溶液经反相快速色谱法(5-75%乙腈的碳酸氢铵(10mM)水溶液)直接纯化,得到化合物D-5a(26mg,50%收率)为白色固体。ESIm/z882.4(M+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-氨基丙酰胺基]苯基}-2,2-二甲基戊酸(D-5b)按照化合物D-5a的类似方法,除了用化合物D-4b代替D-4a之外,得到化合物D-5b(25mg,55%收率)为白色固体。ESIm/z896.5(M+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-氨基-4-羧基丁酰胺基]苯基}-2,2-二甲基戊酸(D-5c)按照化合物D-5a的类似方法,除了用化合物D-4c代替D-4a之外,得到化合物D-5c(30mg,63%收率)为白色固体。ESIm/z478.0(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-[4-(2-氨基乙酰胺基)苯基]-2,2-二甲基戊酸(D-5d)按照化合物D-5a的类似方法,除了用化合物A-1c代替A-1b之外,得到化合物D-5d(15mg,69%收率)为白色固体。ESIm/z886.2(M+H)+。D-7化合物的一般方法向化合物D-5(1.0当量)的DMF(6mM)溶液中加入DIPEA(2.0当量)和肽活性酯D-6(1.0当量),将反应混合物在室温下搅拌3小时,由LCMS进行监测。向反应混合物中加入哌啶(5.0当量),将混合物在室温下搅拌2小时,直至完全脱去Fmoc,通过LCMS进行监测。反应混合物经反相快速色谱法(25-75%乙腈的碳酸氢铵(10mM)水溶液)直接纯化,得到化合物D-7(35-48%收率)为白色固体。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{2-[2-(2-氨基乙酰胺基)乙酰胺基]乙酰胺基}苯基)-2,2-二甲基戊酸(D-7a)按照D-7化合物的一般方法,将D-5a用D-6a处理,得到化合物D-7a(28mg,35%收率)为白色固体。ESIm/z:498.7(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2R)-2-[(2S)-2-氨基丙酰胺基]丙酰胺基]丙酰胺基]苯基}-2,2-二甲基戊酸(D-7b)按照D-7化合物的一般方法,将D-5b用D-6b处理,得到化合物D-7b(30mg,35%收率)为白色固体。ESIm/z:519.8(M/2+H)+。按照D-7化合物的一般方法,制备得到以下化合物:(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-[4-(2-{2-[2-(2-氨基乙酰胺基)乙酰胺基]乙酰胺基}乙酰胺基)苯基]-2,2-二甲基戊酸(D-7c)向化合物D-7a(20mg,20μmol)的DMF(3mL)溶液中加入Fmoc-Gly-OSu(8mg,20μmol)和DIPEA(13mg,0.10mmol)。反应混合物在室温下搅拌3小时,然后加入哌啶(6.0mg,70μmol)。然后将混合物在室温下再搅拌2小时直至完全脱去Fmoc,通过LCMS进行监测。所得混合物经反相快速色谱法(25-75%乙腈的碳酸氢铵(10mM)水溶液)直接纯化,得到化合物D-7c(10mg,47%收率)为白色固体。ESIm/z:527.3(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{2-[(2S)-2-[2-(2-氨基乙酰胺基)乙酰胺基]-3-苯基丙酰胺基]乙酰胺基}苯基)-2,2-二甲基戊酸(D-7d)按照D-7化合物的一般方法,将D-5a用D-6d处理,得到化合物D-7d(11mg,43%收率)为白色固体。ESIm/z:572.3(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-{2-[2-(2-氨基乙酰胺基)乙酰胺基]乙酰胺基}-4-羧基丁酰胺基]苯基}-2,2-二甲基戊酸(D-7e)按照D-7化合物的一般方法,将D-5c用D-6c处理,得到化合物D-7e(15mg,34%收率)为白色固体。ESIm/z:563.3(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-[4-(2-{2-[2-(2-氨基乙酰胺基)乙酰胺基]乙酰胺基}乙酰胺基)苯基]-2,2-二甲基戊酸(D-7f)按照D-7化合物的一般方法,将D-5d用D-6c处理,得到化合物D-7e(10mg,47%收率)为白色固体。ESIm/z:529.3(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{2-[(2S)-2-[2-(2-氨基乙酰胺基)乙酰胺基]-3-苯基丙酰胺基]乙酰胺基}苯基)-2,2-二甲基戊酸(D-7g)按照D-7化合物的一般方法,将D-5d用D-6d处理,得到化合物D-7g(11mg,48%收率)为白色固体。ESIm/z:574.3(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[2-(2-氨基乙酰胺基)乙酰胺基]苯基}-2,2-二甲基戊酸(D-7h)按照D-7化合物的一般方法,将D-5a用D-6e处理,得到化合物D-7h(9mg,48%收率)为白色固体。ESIm/z:470.3(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{2-[2-(2-{2-[(2S)-2-氨基-3-羟基丙酰胺基]乙酰胺基}乙酰胺基)乙酰胺基]乙酰胺基}苯基)-2,2-二甲基戊酸(D-7i)按照D-7化合物的一般方法,将D-5a用D-6f处理,得到化合物D-7i(8mg,35%收率)为白色固体。ESIm/z:570.8(M/2+H)+。连接体-有效负载LP13、LP14、LP16、LP17、LP18、LP19、LP20、LP21、LP22、LP23和LP24的一般方法向化合物D-7(1.0当量)(或化合物D-5)的DMF(10mM)溶液中加入活化酯D-8(1.0当量)和DIPEA(5.0当量),将反应混合物在室温下搅拌3小时,通过LCMS进行监测。所得混合物经制备型HPLC(0-100%乙腈的碳酸氢铵(10mM)水溶液)直接纯化,得到连接体-有效负载LP8-LP17(33-87%),为白色固体。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-[4-(2-{2-[2-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)乙酰胺基]乙酰胺基}乙酰胺基)苯基]-2,2-二甲基戊酸(LP13)根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,将D-7a用D-8a处理,得到连接体-有效负载LP13(10mg,33%收率)为白色固体。ESIm/z:642.5(M/2+H)+。1HNMR(400MHz,DMSOd6)δ9.66(s,1H),8.18-8.12(m,4H),7.78-7.74(m,1H),7.69-7.64(m,1H),7.62-7.60(m,1H),7.58-7.54(m,1H),7.50-7.44(m,4H),7.39-7.28(m,3H),7.10(d,J=8.0Hz,2H),5.81(d,J=11.2Hz,1H),5.02(d,J=14.4Hz,1H),4.75(t,J=7.2Hz,1H),4.25-4.20(m,2H),4.08-4.04(m,2H),3.72(t,J=4.4Hz,2H),3.64-3.63(m,2H),3.07-2.96(m,1H),2.85-2.82(m,3H),2.67-2.61(m,2H),2.42-2.27(m,6H),2.12(s,3H),2.10(s,3H),2.08-1.93(m,5H),1.84-1.77(m,4H),1.67-1.60(m,3H),1.51-1.35(m,5H),1.04(d,J=10.8Hz,6H),0.96-0.94(m,6H),0.88-0.83(m,9H)ppm。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-2-[(2R)-2-[(2S)-2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]丙酰胺基]丙酰胺基]丙酰胺基]苯基}-2,2-二甲基戊酸(LP18)根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,将D-7b用D-8b处理,得到连接体-有效负载LP9(12mg,35%收率)为白色固体。ESIm/z:601.8(M/2+H)+。根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,可制得以下化合物:(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{2-[2-(2-{2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙酰胺基}乙酰胺基)乙酰胺基]乙酰胺基}苯基)-2,2-二甲基戊酸(LP19)根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,将D-7c用D-8b处理,得到连接体-有效负载LP19(10mg,87%收率)为白色固体。ESIm/z:609.4(M/2+H)+。1HNMR(500MHz,DMSOd6)δ9.73(s,1H),8.23-8.17(m,4H),7.84(t,J=5.0Hz,1H),7.55(d,J=9.5Hz,1H),7.47(d,J=8.0Hz,2H),7.11(d,J=8.0Hz,2H),5.80(d,J=10.5Hz,1H),4.75(t,J=8.5Hz,1H),4.32-4.30(m,1H),4.25-4.24(m,1H),4.16-4.14(m,1H),4.06-4.03(m,2H),3.94-3.91(m,1H),3.86-3.80(m,3H),3.79-3.73(m,6H),2.84-2.82(m,3H),2.67-2.63(m,1H),2.40-2.29(m,4H),2.25-2.18(m,1H),2.12(s,3H),2.09(s,3H),2.02-1.90(m,6H),1.87-1.73(m,6H),1.62-1.55(m,6H),1.48-1.32(m,5H),1.18-1.17(m,2H),1.12-1.06(m,1H),1.03-0.95(m,9H),0.88-0.81(m,9H)ppm。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{2-[(2S)-2-{2-[2-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)乙酰胺基]乙酰胺基}-3-苯基丙酰胺基]乙酰胺基}苯基)-2,2-二甲基戊酸(LP20)根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,将D-7d用D-8a处理,得到连接体-有效负载LP20(11mg,80%收率)为白色固体。ESIm/z:716.0(M/2+H)+。1HNMR(500MHz,DMSOd6)δ9.73(s,1H),8.37-8.35(m,1H),8.16(s,1H),8.10-8.09(m,1H),8.05-7.99(m,1H),7.88-7.78(brs,1H),7.69-7.63(m,1H),7.59-7.52(m,2H),7.50-7.42(m,5H),7.37-7.27(m,3H),7.26-7.24(m,4H),7.21-7.16(m,2H),7.11(d,J=8.5Hz,2H),5.82(d,J=11.0Hz,1H),5.23-4.98(m,1H),4.76(t,J=8.0Hz,1H),4.51-4.47(m,1H),4.26-4.23(m,2H),4.06-4.05(m,2H),3.86-3.82(m,2H),3.78-3.69(m,1H),3.62-3.51(m,4H),3.06-3.04(m,2H),2.85-2.78(m,4H),2.70-2.63(m,2H),2.37-2.27(m,4H),2.13(s,3H),2.10(s,3H),2.03-1.94(m,5H),1.84-1.78(m,4H),1.66-1.61(m,3H),1.56-1.52(m,1H),1.47-1.36(m,4H),1.20-1.14(m,1H),1.05(s,3H),1.03(s,3H),0.95(d,J=6.5Hz,3H),0.89-0.82(m,9H)ppm。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[(2S)-4-羧基-2-[2-(2-{2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙酰胺基}乙酰胺基)乙酰胺基]丁酰胺基]苯基}-2,2-二甲基戊酸(LP21)根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,将D-7e用D-8b处理,得到连接体-有效负载LP21(10mg,58%收率)为白色固体。ESIm/z:645.4(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{2-[2-(2-{2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙酰胺基}乙酰胺基)乙酰胺基]乙酰胺基}苯基)-2,2-二甲基戊酸(LP23)根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,将D-7f用D-8b处理,得到连接体-有效负载LP23(8mg,69%收率)为白色固体。ESIm/z:611.5(M/2+H)+。1HNMR(500MHz,DMSOd6)δ9.73(s,1H),8.23-8.15(m,4H),7.85-7.78(m,2H),7.49-7.46(m,3H),7.11-7.10(m,2H),5.80(d,J=10.5Hz,1H),4.81-4.78(m,1H),4.33-4.30(m,1H),4.25-4.16(m,2H),4.09-4.04(m,1H),3.98-3.92(m,2H),3.86-3.80(m,3H),3.79-3.73(m,6H),2.85-2.83(m,1H),2.80-2.76(m,1H),2.70-2.64(m,1H),2.44-2.42(m,1H),2.39-2.32(m,1H),2.27-2.14(m,2H),2.12(s,3H),2.11(s,3H),2.08-2.05(m,1H),2.03-1.90(m,5H),1.85-1.70(m,4H),1.68-1.51(m,8H),1.48-1.29(m,9H),1.20-1.15(m,1H),1.06(s,3H),1.04(s,3H),0.96(d,J=6.5Hz,3H),0.89-0.83(m,12H)ppm。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{2-[(2S)-2-{2-[2-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12),4(9),5,7,13,15-六烯-10-炔-2-基}-4-氧代丁酰胺基)乙酰胺基]乙酰胺基}-3-苯基丙酰胺基]乙酰胺基}苯基)-2,2-二甲基戊酸(LP24)根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,将D-7g用D-8a处理,得到连接体-有效负载LP24(11mg,80%收率)为白色固体。ESIm/z:718.0(M/2+H)+。1HNMR(500MHz,DMSOd6)δ9.26(s,1H),8.37-8.33(m,1H),8.16(s,1H),8.12-8.08(m,1H),8.04-7.97(m,1H),7.82-7.75(brs,1H),7.69-7.63(m,1H),7.58(t,J=6.5Hz,1H),7.48-7.43(m,6H),7.35-7.29(m,3H),7.24-7.23(m,4H),7.21-7.16(m,2H),7.11(d,J=7.5Hz,2H),6.65(s,1H),5.80(d,J=10.0Hz,1H),5.32(t,J=4.5Hz,1H),5.02-4.98(m,1H),4.80(t,J=8.0Hz,1H),4.52-4.47(m,1H),4.24-4.22(m,1H),4.16-4.15(m,1H),4.08-4.04(m,1H),3.97-3.95(m,1H),3.87-3.81(m,2H),3.77-3.69(m,3H),3.64-3.58(m,6H),3.07-3.04(m,1H),2.85-2.76(m,2H),2.70-2.63(m,2H),2.44-2.42(m,1H),2.37-2.36(m,1H),2.35-2.27(m,1H),2.11(s,3H),2.10(s,3H),2.02-1.96(m,5H),1.94-1.91(m,1H),1.80-1.78(m,2H),1.68-1.61(m,4H),1.56-1.53(m,1H),1.47-1.44(m,2H),1.39-1.30(m,5H),1.06(s,3H),1.04(s,3H),0.95(d,J=6.5Hz,3H),0.89-0.81(m,9H)ppm。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-[4-(2-{2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙酰胺基}乙酰胺基)苯基]-2,2-二甲基戊酸(LP17)根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,将D-7h用D-8b处理,得到连接体-有效负载LP17(5mg,47%收率)为白色固体。ESIm/z:552.3(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{2-[2-(2-{2-[(2S)-2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]-3-羟基丙酰胺基]乙酰胺基}乙酰胺基)乙酰胺基]乙酰胺基}苯基)-2,2-二甲基戊酸(LP22)根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,将D-7i用D-8b处理,得到连接体-有效负载LP22(4mg,44%收率)为白色固体。ESIm/z:653.0(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-(4-{2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙酰胺基}苯基)-2,2-二甲基戊酸(LP16)根据连接体-有效负载LP13、LP14和LP16-LP24的一般方法,将D-5a用D-8b处理,得到连接体-有效负载LP16(10mg,48%收率)为白色固体。ESIm/z:523.8(M/2+H)+。LP25和LP26的合成(图10G)N-(2-氨基乙基)-2-(环辛-2-炔-1-基氧基)乙酰胺(E-1)向乙二胺(0.71g,12mmol)的DMF(2.0mL)溶液中缓慢加入DIPEA(0.30g,2.4mmol)和化合物D-8b(0.33g,1.2mmol)的DMF(3.0mL)溶液,将混合物在室温下搅拌30分钟,通过LCMS进行监测。所得混合物经反相快速色谱法(0-100%乙腈的碳酸氢铵(0.8mM)水溶液)纯化,得到化合物E-1(0.18g,68%收率)为无色油状物。ESIm/z:225.2(M+H)+。1HNMR(400MHz,DMSOd6)δ7.74-7.63(m,1H),4.28(t,J=5.8Hz,1H),3.88-3.73(m,2H),3.11-3.00(m,4H),2.58(t,J=6.4Hz,2H),2.27-2.06(m,3H),1.94-1.71(m,4H),1.66-1.54(m,2H),1.45-1.33(m,1H)ppm。(2S,3S,4S,5R,6S)-3,4,5-三(乙酰氧基)-6-[2-({2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙基}氨基甲酰基)-4-(羟甲基)苯氧基]四氢吡喃-2-羧酸甲酯(E-3a)向化合物E-2a(根据WO2018182341A1合成)(0.11g,0.23mmol)和HATU(96mg,0.25mmol)的干燥DMF(4mL)混合物中加入化合物E-1(51mg,0.23mmol)和DIPEA(89mg,0.69mmol),将反应混合物在室温下搅拌2小时,直至E-2a完全消耗,通过LCMS进行监测。所得混合物经反相快速色谱法(0-100%乙腈的TFA(0.01%)水溶液)直接纯化,得到化合物E-3a(0.14g,90%收率)为白色固体。ESIm/z:691.4(M+H)+。1HNMR(400MHz,CDCl3)δ8.06-8.04(m,1H),7.64-7.59(m,1H),7.50-7.47(m,1H),7.22-7.18(m,1H),7.01-6.98(m,1H),5.44-5.28(m,5H),4.68(s,2H),4.30-4.21(m,2H),4.10-4.06(m,1H),3.93-3.88(m,1H),3.75(s,3H),3.67-3.48(m,2H),2.21-2.07(m,15H),1.93-1.79(m,3H),1.70-1.38(m,3H)ppm。[(2R,3R,4S,5R,6S)-3,4,5-三(乙酰氧基)-6-[2-({2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙基}氨基甲酰基)-4-(羟甲基)苯氧基]四氢吡喃-2-基]甲基乙酸酯(E-3b)按照与E-3a类似的方法,除了用E-2b代替E-2a之外,得到化合物E-3b(0.10g,80%收率)为白色固体。ESIm/z:705.3(M+H)+。(2S,3S,4S,5R,6S)-3,4,5-三(乙酰氧基)-6-[2-({2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙基}氨基甲酰基)-4-{[(4-硝基苯氧基羰基)氧基]甲基}苯氧基]四氢吡喃-2-羧酸甲酯(E-4a)在氮气下,于0℃下,向化合物E-3a(0.14g,0.20mmol)的DMF(2.0mL)溶液中加入双(4-硝基苯基)碳酸酯(55mg,0.18mmol)和DIPEA(26mg,0.20mmol)。将反应混合物在0℃下搅拌30分钟,然后在室温下搅拌3小时。反应混合物用水(10mL)稀释,然后用乙酸乙酯(20mL×3)萃取。合并的有机溶液用盐水(10mL)洗,经无水硫酸钠干燥,真空浓缩。残余物经快速色谱法(40-60%乙酸乙酯的石油醚溶液)纯化,得到化合物E-4a(85mg,49%收率)为无色油状物。ESIm/z:856.0(M+H)+。[(2R,3R,4S,5R,6S)-3,4,5-三(乙酰氧基)-6-[2-({2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙基}氨基甲酰基)-4-{[(4-硝基苯氧基羰基)氧基]甲基}苯氧基]四氢吡喃-2-基]甲基乙酸酯(E-4b)按照与E-4a类似的方法,除了用E-3b代替E-3a之外,得到化合物E-4b(62mg,50%收率)为白色固体。ESIm/z:870.3(M+H)+。(4S)-4-氨基-5-{4-[({[3-({2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙基}氨基甲酰基)-4-{[(2S,3R,4S,5S,6S)-3,4,5-三(乙酰氧基)-6-(甲氧基羰基)四氢吡喃-2-基]氧基}苯基]甲氧基}羰基)氨基]苯基}-2,2-二甲基戊酸(E-5a)按照与C-2a类似的方法,除了用E-4a代替C-1a之外,得到化合物E-5a(30mg,63%收率)为白色固体。ESIm/z:953.3(M+H)+。(4S)-4-氨基-5-{4-[({[3-({2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙基}氨基甲酰基)-4-{[(2S,3R,4S,5R,6R)-3,4,5-三(乙酰氧基)-6-[(乙酰氧基)甲基]四氢吡喃-2-基]氧基}苯基]甲氧基}羰基)氨基]苯基}-2,2-二甲基戊酸(E-5b)按照与C-2a类似的方法,除了用E-4b代替C-1a之外,得到化合物E-5b(28mg,58%收率)为白色固体。ESIm/z:967.3(M+H)+。(2S,3S,4S,5R,6S)-6-(4-{[({4-[(2S)-2-氨基-4-羧基-4,4-二甲基丁基]苯基}氨基甲酰基)氧基]甲基}-2-({2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙基}氨基甲酰基)苯氧基)-3,4,5-三羟基四氢吡喃-2-羧酸(E-6a)向化合物E-5a(30mg,31μmol)的甲醇(4mL)混合物中加入氢氧化锂水溶液(0.1M,4mL),将混合物在室温下搅拌1小时,通过LCMS进行监测。用HCl(1N)淬灭至pH4后,所得混合物经反相快速色谱法(5-95%乙腈的TFA(0.01%)水溶液)纯化,得到连接体-有效负载E-6a(18mg,70%收率)为白色固体。ESIm/z:813.3(M+H)+。(4S)-4-氨基-5-{4-[({[3-({2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙基}氨基甲酰基)-4-{[(2S,3R,4S,5S,6R)-3,4,5-三羟基-6-(羟甲基)四氢吡喃-2-基]氧基}苯基]甲氧基}羰基)氨基]苯基}-2,2-二甲基戊酸(E-6b)按照与E-6a类似的方法,除了用E-5b代替E-5a之外,得到化合物E-6b(18mg,78%收率)为白色固体。ESIm/z:799.3(M+H)+。(2S,3S,4S,5R,6S)-6-(4-{[({4-[(2S)-2-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-4-羧基-4,4-二甲基丁基]苯基}氨基甲酰基)氧基]甲基}-2-({2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙基}氨基甲酰基)苯氧基)-3,4,5-三羟基四氢吡喃-2-羧酸(LP25)按照VII和VIII的一般方法,除了用E-6a代替A-2之外,得到连接体-有效负载LP25(10mg,36%收率)为白色固体。ESIm/z:701.3(M/2+H)+。(4S)-4-({2-[(1R,3R)-1-(乙酰氧基)-4-甲基-3-[(2S,3S)-3-甲基-2-{[(2R)-1-甲基哌啶-2-基]甲酰胺基}-N-(戊-4-炔-1-基氧基)戊酰胺基]戊基]-1,3-噻唑-4-基}甲酰胺基)-5-{4-[({[3-({2-[2-(环辛-2-炔-1-基氧基)乙酰胺基]乙基}氨基甲酰基)-4-{[(2S,3R,4S,5S,6R)-3,4,5-三羟基-6-(羟甲基)四氢吡喃-2-基]氧基}苯基]甲氧基}羰基)氨基]苯基}-2,2-二甲基戊酸(LP26)按照VII和VIII的一般方法,除了用E-6b代替A-2之外,得到连接体-有效负载LP26(8mg,29%收率)为白色固体。ESIm/z:694.3(M/2+H)+。ADC偶联物马来酰亚胺-间隔基-有效负载与抗体的非位点特异性偶联如图13所示,以及DIBAC-间隔基-有效负载通过[3+2]点击反应与叠氮基官能化抗体的位点特异性偶联如图14所示。非位点特异性偶联的一般方法本实施例说明了通过形成硫醚键将马来酰亚胺-间隔基-有效负载偶联至抗体或抗原结合片段的链间半胱氨酸的方法。本实施例涉及图13中所示化合物。使用与制备-样ADC的方法类似的方法,分两步进行经由抗体半胱氨酸的偶联(参见Mol.Pharm.2015,12(6),1863-71)。将pH7-8的单克隆抗体(mAb)(10mg/mL的50mMHEPES、150mMNaCl溶液)用1mM二硫苏糖醇(6摩尔当量抗体)或TCEP(2.5摩尔当量抗体)在37℃下还原30分钟。凝胶过滤(G-25,pH6.3,乙酸钠)后,将化合物LP1以1-10mg/mL的DMSO溶液加至经还原的抗体,并将反应在室温下搅拌3-14小时。所得混合物通过SEC进行纯化以得到纯ADC。位点特异性偶联的一般方法本实施例说明了环辛炔-连接体-有效负载与抗体或其抗原结合片段的位点特异性偶联的方法。本实施例涉及图14中所示化合物。在本实施例中,位点特异性偶联物可分两步生成。第一步是基于微生物转谷氨酰胺酶(MTG),将小分子例如叠氮基-PEG3-胺酶促附接至具有N297Q突变的抗体上(以下简称“基于MTG”偶联)。第二步通过[2+3]环加成,例如叠氮化物与环辛炔之间的1,3-偶极环加成(例如,无铜点击化学),将环辛炔-间隔基-有效负载附接至叠氮基官能化抗体。参见,Baskin,J.M.;Prescher,J.A.;Laughlin,S.T.;Agard,N.J.;Chang,P.V.;Miller,I.A.;Lo,A.;Codelli,J.A.;Bertozzi,C.R.PNAS2007,104(43),16793–7。图14中示出的是具有DIBAC基团部分的连接体-间隔基-有效负载通过[2+3]环加成与叠氮基官能化抗体偶联的示例。所述方法以约50-80%的分离收率提供了位点特异性和化学计量的偶联物。步骤1:叠氮基官能化抗体的制备。在PBS(pH6.5-8.0)中,将无糖基化的人抗体IgG(IgG1、IgG4等)或具有N297Q突变的人IgG1同种型与≥200摩尔当量的叠氮基-PEG3-胺(MW=218.26g/mol)混合。将所得溶液与MTG(EC2.3.2.13,来自德国达德施塔特(Darmstadt)的Zedira,或含有来自日本味之素(Ajinomoto)的麦芽糊精的ACTIVATI)(25U/mL;每毫克抗体5UMTG)混合,使得抗体最终浓度为0.5–5mg/mL,然后将溶液在37℃下孵育4–24h,同时轻轻振荡。反应通过ESI-MS进行监测。反应完成后,通过SEC或蛋白A柱色谱法除去过量的胺和MTG,以生成叠氮基官能化抗体。通过SDS-PAGE和ESI分析此产物。在具体实验中,在MTG(0.350mL,35U,mTGase,Zedira,Darmstadt,Germany)存在下,将在7mL无钾PBS缓冲液(pH7.3)中的N297Q抗体(24mg)与>200摩尔当量的叠氮基-PEG3-胺(MW=218.26)一同孵育。将反应在37℃下孵育过夜,同时轻轻混合。通过尺寸排阻色谱法(SEC,Superdex200PG,GEHealthcare)除去过量的叠氮基-PEG3-胺和mTGase。步骤2:通过叠氮基官能化的经谷氨酰胺基修饰的抗体(IgG1、IgG4等)与表7中包含连接体-有效负载(LP)的环辛炔之间的[2+3]点击反应,来制备位点特异性偶联物。一般而言,通过将叠氮基官能化的经谷氨酰胺基修饰的抗体(1mg)在1mL水性培养基(例如,PBS、含5%甘油的PBS、HBS)中与≥6摩尔当量的溶于合适有机溶剂(如DMSO、DMF或DMA;反应混合物含有10-20%有机溶剂,v/v)中的LP,在24℃至32℃下持续孵育超过3小时,从而制得叠氮基官能化的无糖基化抗体-LP偶联物。通过ESI-MS监测反应进程。不存在叠氮基官能化抗体(mAb-PEG3-N3)表示偶联完成。通过SEC(Waters,Superdex200Increase,1.0x30cm,GEHealthcare,流速0.8mg/mL,PBS,pH7.2)用PBS进行洗脱,或通过蛋白A柱色谱法用酸性缓冲液进行洗脱,然后用Tris(pH8)中和,来除去过量的连接体-有效负载(LP)和有机溶剂。通过SEC、SDS-PAGE和ESI-MS来分析经纯化的偶联物。在具体实施例中,将叠氮基官能化抗体(1mg)的0.800mLPBSg(PBS,5%甘油,pH7.4)溶液用6当量的DIBAC-Suc-PEG4-VC-PABC-有效负载(浓10mg/mL的DMSO溶液)在室温下保持6小时,并通过尺寸排阻色谱法(SEC,Superdex200HR,GEHealthcare)除去多余的连接体有效负载(LP)。最终产物通过超速离心法浓缩,并通过UV、SEC、SDS-PAGE和/或ESI-MS进行表征。表7总结了LP、裸抗体(抗PRLRAb、抗FelD1Ab和抗STEAP2Ab)、PEG3-N3官能化抗体(抗PRLRN297QAb-PEG3-N3、抗FelD1N297QAb-PEG3-N3和抗STEAP2N297QAb-PEG3-N3)、及其相应的ADC。在表7中,Ab是指抗体,而Ab-PEG3-N3是指具有PEG3间隔基的叠氮基官能化抗体。抗PRLR抗体具有根据SEQIDNO:9和SEQIDNO:13的HCVR和LCVR(上述H1H6958N2)。抗STEAP2抗体具有根据SEQIDNO:1和SEQIDNO:5的HCVR和LCVR(上述H1H7814N)。表7.位点特异性偶联物列表抗体和ADC表征的一般方法通过SEC(图15)、ESI-MS和SDS-PAGE对经纯化的偶联物进行分析。通过SEC对AD进行表征分析型SEC实验使用Waters1515仪器在SuperdexTM200Increase(1.0x30cm)柱上进行,使用PBSpH7.2,流速为0.80mL/min,并使用Waters2998PDA在λ=280nm处进行监测。分析样品由200μLPBS(pH7.4)和30-100μL测试样品组成。制备型SEC纯化使用GEHealthcare的AKTAAvant仪器在Superdex200PG(2.6x60cm)柱上进行,用PBSpH7.2洗脱,流速为2mL/min,并在λ=280nm处进行监测。图15中的SEC结果表明单体mAb及其偶联物的典型保留时间,其具有最小聚集或降解。通过LC–ESI–MS对ADC进行表征通过LC-ESI-MS对ADC样品的完整质量进行测定,以确定药物-有效负载分布曲线并计算平均DAR。将各个测试样品(20-50ng,5μL)上样至AcquityUPLCProteinBEHC4色谱柱(10Kpsi,1.7μm,75μm×100mm;目录号186003810)。脱盐3分钟后,洗脱蛋白质,并通过WatersSynaptG2-Si质谱仪得到质谱。如表7所总结,大多数位点特异性ADC均接近4DAR。通过SDS–PAGE对ADC进行表征SDS-PAGE用于分析ADC的完整性和纯度。在其中一种方法,SDS-PAGE条件包括非还原和还原样品(2-4μg)以及BenchMark预染色蛋白质阶梯(BenchMarkPre–StainedProteinLadder,Invitrogen,目录号10748-010;L#1671922.),其每泳道载入(1.0mmx10孔)Novex4-20%Tris–甘氨酸凝胶,并在180V、300mA下运行80分钟。使用NovexTris-甘氨酸SDS缓冲液(2倍)(Invitrogen,目录号LC2676)制备分析样品,所述还原样品采用含10%2-巯基乙醇的SDS样品缓冲液(2倍)制得。体外血浆稳定性为了测定含有微管溶素有效负载的代表性ADC的血浆稳定性,将ADC与来自不同物种的血浆在体外进行孵育,并在生理温度(37℃)下孵育3天后评估所述DAR。对于所述测定试验,将每个ADC样品(抗PRLR抗体-LP3或抗PRLR抗体-LP4)的PBS缓冲液溶液分别加至新鲜混合的雄性小鼠、食蟹猴、大鼠、或人血浆中,最终96孔板中浓度为50μg/mL,随后在37℃下孵育72小时。孵育后,将每个样品(100μL终体积)单独在-80℃下冷冻直至进行分析。在KingFisher96磁粉处理器(ThermoElectron)上对血浆样品中的ADC进行亲和捕获。首先,将用myc-myc六组氨酸标签(hPRLR胞外(ecto)-MMH;SEQIDNO:17;100μg/mL)表达的人PRLR的生物素化胞外结构域固定在链霉亲和素顺磁珠(Invitrogen,目录号60210)上。每个含有微管溶素ADC(100μL)的血浆样品在室温下于96孔板中以600rpm与100μL珠粒(商业珠粒以体积计)混合2小时。然后用600μLHBS-EP(GEHealthcare,目录号BR100188)清洗珠粒3次,用600μLH2O洗一次,然后用600μL10%乙腈水溶液洗一次。清洗后,通过在室温下将珠粒与70μL1%甲酸的30%乙腈/70%水溶液一起孵育15分钟来洗脱微管溶素ADC。然后将每个洗脱液样品转移到v型底96孔板中,然后在室温下用5mMTCEP(ThermoFisher,目录号77720)还原20分钟。将经还原的微管溶素ADC样品(10μL/样品)注射到与WatersSynaptG2-Si质谱仪相连的1.7μmBEH300C4柱(WatersCorporation,目录号186005589)上。流速为0.1mL/min(流动相A:0.1%甲酸的水溶液;流动相B:0.1%甲酸的乙腈溶液)。LC梯度从20%B开始,在16分钟内增至35%B,然后在1分钟内达到95%B。使用MaxEntl软件(WatersCorporation)采用以下参数对获得的光谱进行解卷积:质量范围:轻链为20-30kDa,重链为40-60kDa;m/z范围:700Da-3000Da;分辨率:1.0Da/通道;半高宽:1.0Da;最小强度比:33%;迭代最大值:25。在与人、小鼠、大鼠和食蟹猴血浆一起孵育72小时后,从受试ADC中未观察到连接体-有效负载的任何显著损失。然而,据报道,微管溶素有效负载的乙酰基基团可水解为羟基基团(-43Da),同时毒性显著降低。因此,在LC-MS中观察到的水解物质被认为是药物损失。药物/抗体比值(DAR),如表8所示,是基于不同种类重链的相对丰度计算得到,如下所述:表8:抗PRLRN297Q抗体-LP3和抗PRLRN297Q抗体-LP4的体外血浆稳定性在基于细胞的杀伤测定试验中测试微管溶素有效负载为了测试所公开的微管溶素有效负载杀死人细胞系的能力,进行了体外细胞毒性测定。使用CellTiter-Glo检测试剂盒(Promega,目录号G7573)评估所公开的有效负载以及参比化合物的体外细胞毒性,其中使用存在的ATP量来确定培养物中的活细胞数量。对于所述测定试验,将C4-2、HEK293或T47D细胞以4000个细胞/孔接种在Nunclon白色96孔板上的完全生长培养基(针对C42细胞是4:1的DME高葡萄糖:Ham'sF12,10%FBS,100单位/ml青霉素,100ug/ml链霉素,53ug/ml谷氨酰胺,10ug/ml胰岛素,220ng/ml生物素,12.5pg/mlT3,12.5ug/ml腺嘌呤,4ug/ml转铁蛋白;针对HEK293是DME高葡萄糖,10%FBS,100单位/ml青霉素,100ug/ml链霉素,53ug/ml谷氨酰胺;针对T47D细胞是RPMI,10%FBS,100单位/ml青霉素,100ug/ml链霉素,53ug/ml谷氨酰胺,10ug/ml胰岛素,10mMHEPE,200nM丙酮酸钠)中,并在37℃下于5%CO2中生长过夜。对于细胞活力曲线,将1:3连续稀释的有效负载以100nM至15pM的最终浓度添加至细胞中,包括没有处理的对照组,然后孵育5天。孵育5天后,将细胞与100μLCellTiter-Glo试剂在室温下孵育10分钟。在Victor酶标仪(PerkinElmer)上测定相对发光单位(RLU)。IC50值是根据10点响应曲线(GraphPadPrism)上的四参数逻辑斯蒂方程(four-parameterlogisticequation)进行确定。所有IC50值均以摩尔(M)浓度表示。最大测试浓度下的细胞杀伤百分比(杀伤%)由下式(100-活细胞%)进行估算。在重复实验中,包括平均值±标准偏差(SD)。如表9所示,本发明有效负载表明对C4-2细胞的杀伤,IC50值在16.4pM和>100nM之间,并且最大细胞杀伤百分比(%)在8.9%和96.7%之间。测试了一组本发明公开的有效负载,表明对HEK293细胞的杀伤,IC50值在57.2pM和>100nM之间,最大细胞杀伤百分比(%)在4.7%和88.5%之间。所测试的一组本发明公开的有效负载,表明对T47D细胞的杀伤,IC50值在35pM和>100nM之间,最大细胞杀伤百分比(%)在14.6%和84.5%之间。参比化合物MMAE显示对C4-2细胞的杀伤,IC50值为283pM,最大细胞杀伤百分比(%)为93.7%。表9.微管溶素有效负载和参比化合物对C4-2、HEK293和T47D细胞的细胞毒性NT=未测试在基于MDR细胞的杀伤测定试验中测试微管溶素有效负载为了进一步测试本发明所公开的微管溶素有效负载的能力,使用含有或不含维拉帕米(Verapamil)的多药耐药(MDR)细胞系进行细胞毒性测定,维拉帕米是一种已被证明可逆转耐药性的药物(CancerRes.1989Sep15;49(18):5002-6)。除了在含或不含5ug/mL维拉帕米的生长培养基(RPMI,10%FBS,100单位/ml青霉素,100ug/ml链霉素,53ug/ml谷氨酰胺)中使用1000个HCT15细胞(一种结肠直肠癌细胞系)之外,本发明所公开的有效负载以及参比化合物的体外细胞毒性的评价与上述类似。如表10所示,在不含维拉帕米的情况下,本发明有效负载显示对HCT15细胞的杀伤,IC50值在20pM和>100nM之间,最大细胞杀伤百分比(%)在-3.8%和99.7%之间。在含维拉帕米的情况下,本发明有效负载显示对HCT15细胞的杀伤,IC50值在15pM和>100nM之间,最大细胞杀伤百分比(%)在-0.4%和99.1%之间。对于每个有效负载,不含维拉帕米时的HCT-15IC50除以含维拉帕米时的HCT-15IC50(HCT-15IC50/HCT-15+维拉帕米IC50)。几个有效负载的比率<2.0,表明这些有效负载受多药外排泵的影响最小。参比化合物M4(MMAE)的比率为23.7。表10.微管溶素有效负载和参比化合物在含或不含维拉帕米情况下对HCT15细胞的细胞毒性NT=未测试在一组MDR细胞系中测试微管溶素有效负载为了进一步测试本发明所公开的微管溶素有效负载的能力,使用一组多药耐药性(MDR)细胞系进行细胞毒性测定。除了使用以下细胞之外:HCT-15细胞(一种结肠直肠癌细胞系);H69AR,小细胞肺癌癌细胞系NCI-H69的多柔比星抗性MDR衍生物;MES-SA/MX2,一种子宫肉瘤细胞系MES-SA的米托蒽醌抗性MDR衍生物;HL60/MX2,一种急性早幼粒细胞白血病细胞系HL60的米托蒽醌抗性MDR衍生物,对所公开的有效负载以及参比化合物的体外细胞毒性亦按上述方法进行了类似评估。在所述这些测定试验中,在正常生长培养基(针对HCT-15和HL60/MX2是RPMI,10%FBS,100单位/ml青霉素,100ug/ml链霉素和53ug/ml谷氨酰胺;针对H69-AR是RPMI,20%FBS,100单位/ml青霉素、100ug/ml链霉素和53ug/ml谷氨酰胺;针对MES-SA/MX2是Waymouths’s:McCoy's(1:1),10%FBS,100单位/ml青霉素,100ug/ml链霉素和53ug/ml谷氨酰胺)中,以每孔1000个细胞,在与有效负载孵育72小时和144小时后,评估细胞毒性。如表11和表12所示,几个有效负载杀死了整组MDR细胞系,具有亚nMIC50,并接近基线水平,表明这些有效负载克服了受试细胞系中的MDR。表11:微管溶素有效负载和参比化合物对HL60/MX2和MES-SA/MX2细胞的细胞毒性表12:微管溶素有效负载和参比化合物对HCT-15和H69AR细胞的细胞毒性在基于细胞的杀伤测定试验中测试含有微管溶素有效负载的ADC开发生物测定试验以评估与本发明所公开的微管溶素有效负载和参比有效负载偶联的抗PRLR抗体的功效。开发其是为了评估在抗PRLR-微管溶素ADC内化至细胞、有效负载释放以及随后的细胞毒性之后,微管溶素有效负载的活性。对于所述测定试验,设计了HCT15系以表达人全长PRLR(登录号#NP_000940.1)。所得稳定细胞系在本发明中称为HCT15/PRLR。使用HCT15/PRLR细胞,使用或不使用在正常培养基中稀释的5g/mL维拉帕米,如本实施例中所述,对所公开的有效负载、参比化合物和受试ADC的体外细胞毒性进行类似评估。所述这些化合物以100nM的起始浓度,经3倍连续稀释后进行测试。所有IC50值均以nM浓度表示,并且在最大测试浓度下的细胞杀伤百分比(杀伤%)通过下式(100-活细胞%)进行估算。这些数据报告在表13中。如表13所示,在不含维拉帕米的情况下,与本发明公开的连接体-有效负载偶联的抗PRLRADC,即抗PRLR-LP3和抗PRLR-LP4,在基于HCT15/PRLR细胞的测定试验中均表现出细胞毒性,分别如下:IC50值为0.525nM,最大杀伤百分比为90%;和IC50值为3.31nM,最大杀伤百分比为65%。在这些条件下,一种同型对照ADC,即同型对照-LP3,表现出对HCT15/PRLR细胞的一些适度杀伤,最大杀伤百分比为51%,但IC50值>50nM。在不含维拉帕米的情况下,另一种同型对照,即同型对照-LP4未表现出对HCT15/PRLR细胞的任何显著杀伤。在所述这些条件下,本发明的游离有效负载IVd和Ve均表现出对HCT15/PRLR细胞的杀伤,IC50值分别为0.037nM和0.203nM,最大杀伤百分比分别为99%和99%。在含维拉帕米的情况下,与本发明的连接体-有效负载偶联的抗PRLRADC,即抗PRLR-LP3和抗PRLR-LP4在基于HCT15/PRLR细胞的测定试验中均表现出细胞毒性,分别如下:IC50值为0.309nM,最大杀伤百分比为91%;和IC50值为0.196nM,最大杀伤百分比为91%。在所述这些条件下,两种同型对照ADC,同型对照-LP3和同型对照-LP4,均表现出对HCT15/PRLR细胞的杀伤,分别如下:IC50值大于50nM,最大杀伤百分比为82%;和IC50值大于50nM,最大杀伤百分比为76%。在所述这些条件下,本发明公开的游离有效负载IVd和Ve均表现出对HCT15/PRLR细胞的杀伤,IC50值分别为0.015nM和0.033nM,最大杀伤百分比分别为99%和99%。在含或不含维拉帕米的情况下,未偶联的抗PRLR抗体未表现出对HCT15/PRLR细胞有任何杀伤作用。表13.微管溶素有效负载、参比化合物以及ADC在含或不含维拉帕米情况下对HCT15/PRLR细胞的细胞毒性NS=在测试浓度下无显著杀伤为了进一步测试本发明公开的微管溶素有效负载、参比化合物以及使用这些有效负载的抗体药物偶联物的能力,采用本实施例中所述的C4-2细胞进行细胞毒性测定试验(见上文)。对于这些研究,将抗STEAP2抗体偶联至选定的微管溶素有效负载上,并以100nM的起始浓度,经3倍连续稀释后对化合物进行测试。所有IC50值均以nM浓度表示,并且在最大测试浓度下的细胞杀伤百分比由下式(100-活细胞%)进行估算。这些数据报告在表14中。如表14所示,与本发明公开的连接体-有效负载偶联的抗STEAP2ADC,即抗STEAP2-LP3、抗STEAP2-LP4和抗STEAP2-LP5在基于C4-2细胞的测定试验中均显示出细胞毒性,分别如下:IC50值为0.097nM,最大杀伤百分比为99%;IC50值为0.15nM,最大杀伤百分比为99%;和IC50值为0.28nM,最大杀伤百分比为96%。参比ADC,即抗STEAP2-MMAE在基于C4-2细胞的测定试验中显示出细胞毒性,IC50值为0.53nM,最大杀伤百分比为99%。所有三个同型对照,即同型对照-LP3、同型对照-LP4和同型对照-MMAE,仅在最高测试浓度下对C4-2细胞有一定程度的杀伤作用,最大杀伤百分比为16%~48%,但IC50值>100nM。在所述这些条件下,IVd(LP3的游离有效负载)和Ve(LP4的有效负载)均表现出对C4-2细胞的杀伤,IC50值分别为0.022nM和0.063nM,两者均显示出99%的最大杀伤百分比。游离参比有效负载MMAE显示出对C4-2细胞的杀伤,IC50值为0.22nM,最大杀伤百分比为99%。未偶联的抗STEAP2抗体未表现出对C4-2细胞有任何杀伤作用。表14.微管溶素有效负载、参比化合物以及ADC对C4-2细胞的细胞毒性受试样品IC50(nM)杀伤%抗STEAP2-LP30.09799抗STEAP2-LP40.1599抗STEAP2-MMAE0.5399同型对照-LP3>50nM48同型对照-LP4>50nM34同型对照-MMAE>50nM16抗STEAP2Ab>50nM0IVd(LP3的有效负载)0.02299Ve(LP4的有效负载)0.06399MMAE(LP8的有效负载)0.2299抗STEAP2抗体为了测定偶联至微管溶素的抗STEAP2抗体的体内功效,在携带STEAP2阳性C4-2前列腺癌异种移植物的免疫受损小鼠中进行研究。对于所述测定试验,将内源性表达STEAP2的7.5x106C4-2细胞(ATCC,目录号CRL-3314)悬浮在Matrigel(BDBiosciences,目录号354234)中并皮下植入至雄性CB17SCID小鼠(Taconic,HudsonNY)的侧腹。一旦肿瘤达到220mm3的平均体积(大约第15天),将小鼠随机分成7组,并施用单剂量的通过尾静脉注射2.5mg/kg的抗STEAP2偶联抗体(抗STEAP2-LP3、抗STEAP2-LP4、抗STEAP2-MMAE)、同型对照偶联抗体、或溶媒。每周用卡尺测量肿瘤两次,直至溶媒组的平均尺寸达到1500mm3。使用公式(长度x宽度2)/2计算肿瘤尺寸,然后计算平均肿瘤尺寸+/-SEM。根据下式计算肿瘤生长抑制:(1-((T最终-T初始)/(C最终-C初始)))*100,其中治疗组(T)和对照组(C)代表溶媒组达到1500mm3当天的平均肿瘤质量。在这项研究中,将与MMAE偶联的抗STEAP2抗体同与微管溶素连接体-有效负载偶联的抗STEAP2抗体(抗STEAP2-LP3和抗STEAP2-LP4)进行比较,以评估其减少C4-2肿瘤尺寸的能力。如表15所示,在本研究完成时,用抗STEAP2-MMAE参比ADC治疗使得平均81%的肿瘤生长得到抑制。相比之下,用抗STEAP2-LP3ADC和抗STEAP2-LP4ADC治疗分别表现出肿瘤生长平均减少108%和97%。用同型对照ADC治疗使得肿瘤生长平均减少31-33%。所述抗STEAP2抗体包含N297Q突变。表15:在用抗STEAP2ADC治疗的SCID小鼠中研究结束时对C4-2肿瘤生长的抑制STEAP2-微管溶素ADC在CTG-2440和CTG-2441PDX前列腺癌模型中的功效mAb克隆ID:实验方法:将源自前列腺癌患者的CTG-2440或CTG-2441的异种移植(PDX)肿瘤片段皮下植入雄性NOG小鼠的侧腹。一旦肿瘤体积达到约200mm3,将小鼠随机分成八组并根据下表16中所示的时间表进行治疗。植入后监测肿瘤生长60天。表16结果与讨论:评估了STEAP2微管溶素ADC相对于对照ADC在STEAP2阳性PDX模型中的抗肿瘤功效。用对照ADC治疗的CTG-2440肿瘤在28天内生长到方案拟定尺寸限制。用3.72mg/kg的STEAP2微管溶素ADC(每周3次剂量为80ug/kg有效负载)治疗的肿瘤的生长被抑制60天,而对体重变化无有害影响。抗肿瘤功效是剂量依赖性的。采用240ug/kg的总有效负载剂量,观察到完全的肿瘤抑制,而用120ug/kg和40ug/kg的总有效负载剂量则可诱导肿瘤消退。CTG-2440的肿瘤体积数据示出在图16中。CTG-2440的表格数据摘要:用对照ADC治疗的CTG-2441肿瘤在30天内生长到方案拟定尺寸限制。用3.64mg/kg的STEAP2微管溶素ADC(每周3次剂量为80ug/kg有效负载)治疗的肿瘤生长被抑制60天,仅观察到适度的体重减轻。抗肿瘤功效是剂量依赖性的。采用120ug/kg或240ug/kg的总有效负载剂量,观察到完全的肿瘤抑制。在单次施用40ug/kg总有效负载剂量后可诱导肿瘤消退。CTG-2441的肿瘤体积数据示出在图17中。CTG-2441的表格数据摘要:PDX模型和STEAP2表达信息:前列腺癌模型源自转移性去势抵抗性前列腺癌(mCRPC)患者的骨转移。STEAP2表达通过RNA测序数据和RNA原位杂交进行确证。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1