沙门氏菌噬菌体LPST144以及其裂解酶的抗菌应用的制作方法
本发明涉及沙门氏菌噬菌体领域,具体涉及一种沙门氏菌噬菌体lpst144以及其裂解酶的抗菌应用。
背景技术:
沙门氏菌是一种革兰氏阴性杆菌,兼性厌氧型,属于肠杆菌科。根据世界卫生组织(who)显示,食用受病原微生物污染的食物和水导致全世界每年约180万人死亡,其中沙门氏菌是导致感染的主要原因,主要通过污染的食物和水以及携带沙门氏菌的动物进行传播,鸡蛋和蛋制品也是导致沙门氏菌疾病的主要来源之一。目前,已报道沙门氏菌共有2500多个血清型,其中,与人类感染疾病相关的最常见血清型是鼠伤寒沙门氏菌(salmonellatyphimurium)和肠炎沙门氏菌(salmonellaenteritidis)。在我国,每年至少有200万人因感染沙门氏菌而住院甚至死亡。综上所述,控制食品中沙门氏菌的污染是减少由沙门氏菌导致的食源性疾病的有效措施。
噬菌体(bacteriophage)是一类能够特异性感染细菌的病毒。噬菌体是没有任何代谢机制的生物体,通过细菌的遗传物质复制增殖。一方面,噬菌体只感染细菌,仅有蛋白和核酸,对人体无害,用噬菌体防治食源性病原菌无内源性危害。另一方面,噬菌体不会影响食品的性质,如风味、质地和营养成分等,这使得噬菌体成为应用于食品中有吸引力的替代生物制剂。但是在单一噬菌体培养液中,很容易诱导细菌会对噬菌体产生抗性,从而不能有效裂解细菌。裂解酶,是双链dna噬菌体感染细菌后期编码的一类肽聚糖水解酶,裂解酶能直接靶向细菌细胞壁的肽聚糖,破坏细菌细胞壁结构的完整性使细胞壁渗透压不平衡从而导致细菌裂解。因此,噬菌体来源的生物抗菌物质(如裂解酶)可以作为一类新型抗生素替代品。
目前,关于噬菌体裂解酶的应用主要是裂解革兰氏阳性菌,比如金黄色葡萄球菌、李斯特菌、肠球菌等;在革兰氏阴性菌的细胞结构中,其肽聚糖层外存在一层细胞外膜结构,该结构阻碍噬菌体裂解酶进入细菌,无法裂解细菌,因此细胞外膜松散剂可以作为透膜剂协助裂解酶进入革兰氏阴性菌发挥裂菌作用。
综上所述,迫切需要找到一株高效裂解沙门氏菌的噬菌体,开发其裂解酶,对控制沙门氏菌及其污染具有潜在的应用价值。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供了一种沙门氏菌噬菌体lpst144以及其裂解酶的抗菌应用。
为实现上述目的,本发明所设计一种沙门氏菌噬菌体lpst144,所述噬菌体命名为鼠伤寒沙门氏菌噬菌体(salmonellatyphimuriumbacteriophage)lpst144;于2019年7月9日将该噬菌体lpst144保藏于中国典型培养物保藏中心,保藏地址为湖北省武汉市武汉大学,保藏编号为:cctccno:m2019533,保藏日期为:2019年7月9日。
上述沙门氏菌噬菌体lpst144在特异性裂解沙门氏菌中的应用。
上述沙门氏菌噬菌体lpst144在制备裂解酶lyst15中的应用。
本发明还提供了一种沙门氏菌噬菌体裂解酶lyst15,其氨基酸序列为sedidno.1。
编码上述沙门氏菌噬菌体裂解酶的基因orf15,其核苷酸序列如sedidno.2。
本发明还提供了一种重组表达载体pet28b-orf15,所述重组表达载体pet28b-orf15为含有权利要求4所述的基因orf15的表达载体,其中,所述表达载体为原核细胞表达载体pet28b(+)。
含有上述重组表达载体的宿主细胞,所述宿主细胞为大肠杆菌bl21(de3)。
含有上述的基因orf15的细胞系。
利用上述宿主细胞制备裂解酶lyst15的方法:包括以下步骤:
(1)将重组表达载体pet28b-orf15的大肠杆菌感受态细胞bl21培养至od600nm为0.8-1.0,用1mm异丙基硫代半乳糖苷诱导后继续培养6h后离心,8000rpm15min,沉淀用磷酸盐缓冲液pbs重悬,即为悬浮菌液;
(2)在温度为4℃条件下对悬浮菌液进行菌体破碎,离心收集上清,经镍柱亲和层析纯化分离,得到重组的裂解酶lyst15。
本发明还提供了一种上述沙门氏菌噬菌体裂解酶lyst15在下述方面中的应用,
1)上述裂解酶lyst15在特异性裂解沙门氏菌中的应用;
2)上述裂解酶lyst15在制备裂解沙门氏菌的生物制剂中的应用;
3)上述裂解酶lyst15在制备防止沙门氏菌对食品污染的食品添加剂中的应用。
本发明的有益效果:
本发明的沙门氏菌噬菌体lpst144及其裂解酶lyst15,能够裂解沙门氏菌;由于采用噬菌体及其裂解酶特异性裂解沙门氏菌能够防止沙门氏菌进化和减少耐药菌株的产生;由于本发明噬菌体菌株及其裂解酶均有亲水相,通过传统方法很容易配置成喷洒液或是淋洗液,对环境或器具消毒;由于本发明涉及到的噬菌体裂解酶没有毒副作用,在防止食品中沙门氏菌的污染方面具有潜在的应用价值。
附图说明
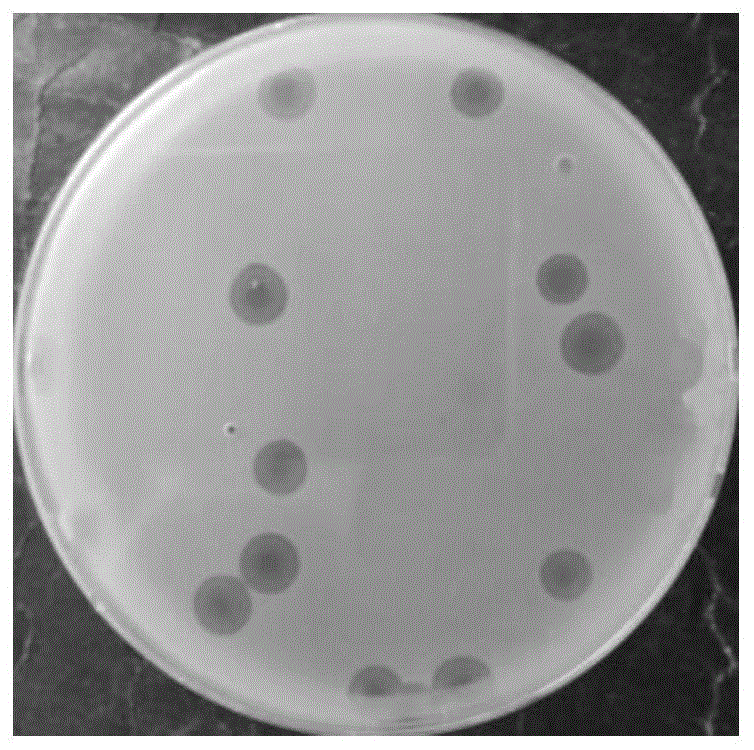
图1为噬菌体lpst144纯化后噬菌斑结果图;
图2为噬菌体lpst144电镜照片;
图3为噬菌体lpst144裂解曲线图;
图4为裂解酶lyst15的纯化图谱;
图5为不同浓度裂解酶lyst15对沙门氏菌atcc13311的作用。
具体实施方式
下面结合具体实施例对本发明作进一步的详细描述,以便本领域技术人员理解。
实施例1噬菌体分离纯化及形态学分析
将从自然界中取样的样品与培养至对数期的鼠伤寒沙门氏菌atcc13311过夜液体培养12h~18h,经0.22μm微孔滤膜过滤,滤液按照上述方法重复一次,得到噬菌体原液。纯化噬菌体采用双层平板法,连续纯化5-10次,直至双层平板出现的噬菌斑大小、透明度一致,即为纯化好的噬菌体(图1)。将噬菌体采用磷钨酸负染色后,置于投射电子显微镜下观察噬菌体形态,具体操作步骤如下:铜网浸没于噬菌体液中10min之后用滤纸吸去多余液体,再将铜网置于磷钨酸染料中染色自然晾干至完全干燥,制备好的铜网在透射电子显微镜下观察噬菌体形态,并用软件digitalmicrographdemo3.9.1测量其大小(图2)。
结果显示:lpst144头部直径49.5±2.0nm,尾长10.2±0.5nm,特征为二十面体头部,尾部短、不可收缩,根据其形态学特征将其归为短尾噬菌体科,将该噬菌体命名为沙门氏菌噬菌体lpst144;于2019年7月9日将该噬菌体lpst144保藏于中国典型培养物保藏中心,保藏地址为湖北省武汉市武汉大学,保藏编号为:cctccno:m2019533,保藏日期为:2019年7月9日。
实施例2噬菌体裂解曲线
设置感染复数moi=1000、100、10、1、0.1、0.01、0.01,各取100μl加入96孔板中,并加入100μl107cfu/ml的宿主菌沙门氏菌菌液。另设阴性对照加入200μltsb培养基;阳性对照加入100μl107cfu/ml的宿主菌沙门氏菌菌液和100μltsb培养基。每隔1h测定600nm处的吸光值,总共测定10h。
结果见图3所示,噬菌体裂解曲线图中阳性对照组的增长趋势与沙门氏菌的正常生长趋势相符。噬菌体在以不同moi感染沙门氏菌时,表现出一定的裂解活性。噬菌体对宿主菌的裂解能力最强,加入噬菌体的实验组细菌光密度维持在初始值且没有增长的趋势,完全能够抑制细菌的增长,但是在8h后光密度有所增加,说明宿主菌没有被完全杀死且菌量有所上升。
实施例3沙门氏菌噬菌体lpst144宿主谱系分析结果
噬菌体宿主谱的测定采用点样法。取100μl培养至对数期的待测定菌液加入到温热的半固体培养基中,混匀后倒入预先制备好的lb平板上,待凝固后,取5μl效价109pfu/ml的噬菌体滴加至上层平板表面,干燥后倒置于37℃培养箱培养4h~6h,观察裂解情况(表1):噬菌体lpst144可以裂解4株不同血清型,其中对宿主菌鼠伤寒沙门氏菌(atcc13311)裂解作用显著,可形成通透清晰的噬菌斑,但是不能裂解大肠杆菌、金黄色葡萄球菌、李斯特菌、副溶血弧菌以及铜绿假单胞菌。上述结果说明,噬菌体lpst144裂解宿主谱较窄,特异性较强。
表1噬菌体lpst144和裂解酶lyst15宿主谱分析结果
注:“++”表示噬菌斑清晰、通透;“+”表示噬菌斑模糊;“”表示无噬菌斑;“-”相对溶解活性低于10%;
“+”相对溶解活性在10%至30%之间;“++”相对溶解活性在31%至60%之间;“+++”相对裂解活性在61%至100%之间。
实施例4沙门氏菌噬菌体lpst144基因组的提取
从固体培养基上挑取沙门氏菌(atcc13311)单个菌落,37℃摇床振荡培养3h至od600nm为0.8-1.0,加入5ml噬菌体lpst144悬液,37℃摇床振荡培养4h-6h至培养液由浑浊变至澄清,取1ml高效价的噬菌体悬液,依次加入脱氧核糖核酸酶和rnasea,37℃孵育40min;加入20μl2mol/lzncl2,37℃温育7min;离心后沉淀用500μltes缓冲液溶解,于65℃水浴15min;用蛋白酶k(20mg/ml)消化后冷却,加入60μl预冷的3mol/l醋酸钾,冰上放置15min,离心后上清用苯酚/氯仿/异戊醇(25:24:1)抽提dna,用70%乙醇洗涤后用te缓冲液溶解dna,获得噬菌体基因组样品,利用第二代测序技术(next-generationsequencing,ngs)测定噬菌体lpst144基因组,应用ncbi的在线软件基本局部比对搜索工具blastprotein对预测的裂解酶相关基因进行逐个检索分析,得到裂解酶基因,得到噬菌体lpst144中存在裂解酶基因orf15,其中,其核苷酸序列如sedidno.2,其氨基酸序列为sedidno.1。
实施例5重组质粒的构建
将预测得到的orf15在c端加上his标签,设计引物在orf15两侧引入xhoi和ncoi限制性内切酶序列,将该片段与空载体pet28b(+)用xhoi和ncoi37℃双酶切过夜,将酶切产物在琼脂糖凝胶电泳上验证后回收,将orf15与pet28b的双酶切产物混合,用t4dna连接酶在16℃条件下过夜连接,连接产物采用热击法转化至dh5α感受态细胞。挑取单菌落于lb培养基中,过夜培养后送去测序,将序列正确的确定为阳性转化子。
实施例6重组裂解酶诱导表达与纯化
将已经转化的感受态细胞加到含卡那霉素(50μg/ml)的lb琼脂培养基上均匀涂开,37℃过夜培养。挑取含重组质粒的单菌落接种于含卡那霉素(50μg/ml)的5mllb培养基中,37℃过夜培养。取200μl转接于20ml含抗性的lb培养基中,37℃培养至od600nm=0.6-0.8,加入iptg(终浓度1mm)后16℃过夜培养。用pbs重悬菌体,超声破碎细胞,分别取样进行sds-page验证表达情况。将镍柱平衡至室温,用洗涤液平衡后,将收集的上清样品过柱,用含20mm咪唑的缓冲液冲洗镍柱,用250mm咪唑的洗脱液洗脱目的蛋白,透析去除多余的咪唑,取样进行sds-page检测,结果如图4所示。
实施例7裂解酶lyst15对沙门氏菌atcc13311的抗菌效果
采用浊度法检测,接种宿主菌鼠伤寒沙门氏菌atcc13311于lb液体培养基中过夜生长,按1:100转接于25ml培养基中振荡培养3h,加入氯仿至终浓度0.5%(v/v),温和震荡后静置15min,采用无菌去离子水离心洗涤3次,将沉淀重悬于含有0.1%tritonx-100的50mmtris-hcl(ph8.2)缓冲液中,并调整od600nm为0.8-1.0,将50μl裂解酶(终浓度为10、2、0.1、0.05μm)加入至200μl细菌重悬液中,使用相同体积的含0.1%tritonx-100的tris-hcl缓冲液代替裂解酶作为对照,在600nm处测定其od值;
结果如图5:不同浓度的裂解酶lyst15均可有效裂解鼠伤寒沙门氏菌atcc13311,与氯仿处理的宿主菌作用5min所示的相对裂解活性均在80%以上。
实施例8裂解酶lyst15的宿主谱结果
接种不同的菌于lb液体培养基中过夜生长,按1:100转接于25ml培养基中振荡培养3h,加入氯仿至终浓度0.5%(v/v),温和震荡后静置15min,采用无菌去离子水离心洗涤3次,将沉淀重悬于含有0.1%tritonx-100的50mmtris-hcl(ph8.2)缓冲液中,并调整od600nm为0.8-1.0,将50μl裂解酶(终浓度为0.1μm)加入至200μl细菌重悬液中,使用相同体积的含0.1%tritonx-100的tris-hcl缓冲液代替裂解酶作为对照,作用30min时观察并测定od600nm值,结果如表1:裂解酶lyst15可以裂解9株沙门氏菌,其中对肠炎沙门氏菌atcc13076、鼠伤寒沙门氏菌atcc13311、猪霍乱沙门氏菌atcc10708及鸡白痢沙门氏菌c79-3相对裂解活性均大于60%,具有较宽的裂解谱。
实施例9基于裂解酶lyst15在环境消毒及食品添加中的应用
裂解酶lyst15可以作为消毒剂的主要成分,用于环境或器具的消毒,主要是为控制其中的沙门氏菌污染。作为消毒剂时配方成分为:20mmol/l乙二胺四乙酸(edta)、5mg/mllyst15,缓冲液为磷酸盐缓冲液(ph7.4),喷洒作用30min,对鼠伤寒沙门氏菌(atcc13311)的抑制率为55%。裂解酶lyst15也可作为食品添加剂用来抑制食品中沙门氏菌的生长,以生菜为例,生菜洗净后,将2μmol/l的裂解酶lyst15与0.5mmol/ledta混合后浸泡生菜1h后,对宿主菌的抑制率为62%。
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
序列表
<110>华中农业大学
<120>沙门氏菌噬菌体lpst144以及其裂解酶的抗菌应用
<150>2019106967779
<151>2019-07-30
<160>2
<170>siposequencelisting1.0
<210>1
<211>151
<212>prt
<213>鼠伤寒沙门氏菌噬菌体lpst144(salmonellatyphimuriumbacteriophagelpst144)
<400>1
metserlysvalglnphelysproargalavalthrglualailephe
151015
valhiscysseralathrlysalathrmetasnvalglyleuargglu
202530
ileargglntrphislysgluglnglytrpleuaspvalglytyrhis
354045
pheileileargargaspglythrvalglugluglyargprovalasp
505560
valvalglyserhisvallysasptrpasnserlysservalglyval
65707580
cysleuvalglyglyileaspglulysglylyshisglualaasnphe
859095
thrproalaglnmetglnserleulysglulysleualaaspleulys
100105110
aspleutyrproaspalagluilelysalahishisaspvalalapro
115120125
lysalacysproserpheasnleuserargtrpleulysthrglyglu
130135140
metvalthrserasptrpgly
145150
<210>2
<211>456
<212>dna
<213>鼠伤寒沙门氏菌噬菌体lpst144(salmonellatyphimuriumbacteriophagelpst144)
<400>2
atgagtaaggtacaattcaaaccacgcgctgtgacagaagcaatctttgtccactgtagc60
gcaactaaggcgaccatgaacgttggtctgcgtgaaatccgtcagtggcataaagaacag120
ggctggcttgatgtaggctaccacttcattattcgccgcgatggaaccgttgaggaaggc180
cgtccggtagatgtcgttgggtctcatgtgaaagactggaacagtaagtcagtcggtgtg240
tgtctcgttggtggtatcgacgaaaagggaaaacacgaagctaactttactccagcacag300
atgcagtctcttaaagagaaactggcagacctgaaagacctgtacccggatgctgaaatc360
aaagcgcaccacgatgtcgcacctaaagcatgtccgtcattcaacttgagccgctggctg420
aagactggagagatggtcacgagtgattggggttaa456
- 还没有人留言评论。精彩留言会获得点赞!