茶树类胡萝卜素裂解双加氧酶CsCCD4及其在催化合成β-紫罗酮上的应用的制作方法
本发明属于基因工程领域,具体涉及一种茶树类胡萝卜素裂解双加氧酶csccd4及其在催化合成β-紫罗酮上的应用。
背景技术:
花香可以影响高等植物与传粉者相互作用,也可以起到阻吓食草动物和吸引天敌的作用。作为最传统的无酒精饮料之一,茶(camelliasinensis(l.)o.kuntze)以其温和的口感、宜人的香气及其营养价值在世界享有盛誉。挥发性香气是评价茶叶品质的重要指标,在茶叶生产过程中已发现600多种挥发性化合物,包括脂肪酸衍生物(fadvs)、氨基酸衍生物(aadvs)、挥发性萜烯(vts)、类胡萝卜素衍生物(cdvs)。在茶叶众多的香气物质中,由类胡萝卜素降解产生的香气物质占成品茶香气总量的4.3-46.5%,是茶叶香气的重要组成部分。这些香气物质大多源自次生代谢途径,例如在类胡萝卜素的生物合成中,以类胡萝卜素提供前体生成的α,β-紫罗酮,β-大马酮等,凭借其极低的气味阈值在茶叶风味中起着关键作用。
在类胡萝卜素的酶促氧化途径中,类胡萝卜素裂解双加氧酶(carotenoidcleavagedioxygenases,ccds)是类胡萝卜素降解的关键酶,在类胡萝卜素的酶促氧化中起着至关重要的作用。
1997年研究人员从玉米中提取得到vp14,并被鉴定为脱落酸(abscisicacid,aba)生物合成途径中的关键酶,chernys等在拟南芥中鉴定出可以根据不同底物,在9,10和/或9',10'双键对称地裂解各种类胡萝卜素,形成二醛和c13产物的酶。经过一段时间的研究与鉴定后,研究者们将类胡萝卜素裂解酶基因分为两个亚家族,分别是类胡萝卜素裂解双加氧酶基因(carotenoidcleavagedioxygenases,ccd)和9-顺式-环氧类胡萝卜素裂解双加氧酶基因(nine-cis-epoxy-carotenoiddioxygenases,nceds)。ccds是一类非血红素铁氧合酶,在亚铁离子的协助下,可将类胡萝卜素裂解为脱辅基类胡萝卜素或香气化合物。ccds在自然界中分布广泛,在原核细胞、动物、真菌和绿藻中具有重要的代谢和激素调节功能,此外,在高等植物中,类胡萝卜素裂解产物也可作为信号参与调控花的香味、果实的颜色和香气,吸引传粉者和传播媒介。其中,nced是aba合成途径的关键基因。根据降解底物双键的位置,ccd又被分为ccd1、ccd4、ccd7、ccd8,ccd7和ccd8是合成独脚金内酯的关键基因,ccd1和ccd4可裂解多种胡萝卜素和脱辅基胡萝卜素生成具有花果香气的香气物质。其中,已有文献报道β-紫罗酮是典型的类胡萝卜氧化降解产生的香气物质,它可在茶叶加工过程中通过酶促氧化降解类胡萝卜素得到,是绿茶和红茶重要的香气物质。
β-紫罗酮是一种重要的香料,室温下具有木质香和愉悦诱人的紫罗兰香,在食品、化妆品、烟草和日化用品中有着广泛的应用。gb2760-96规定其为暂时允许使用的食用香料,主要用以配制树莓、樱桃、葡萄、草莓、黑莓、菠萝等型香精,用于日化、食品香精,香水中,还可大量用于生产维生素a、e和胡萝卜素。
尽管β-紫罗酮已被证实是绿茶和红茶的重要风味物质之一,但茶树中ccds降解类胡萝卜素生成β-紫罗酮的机理尚不明确。
技术实现要素:
本发明所要解决的技术问题为:如何提供一种茶树类胡萝卜素裂解双加氧酶csccd4及其编码基因,为人工合成β-紫罗酮提供一种新的途径。
本发明的技术方案为:茶树类胡萝卜素裂解双加氧酶csccd4,其氨基酸序列如seqidno.2所示。
茶树类胡萝卜素裂解双加氧酶基因csccd4,其核苷酸序列为a、b或c中的任一种:
a、如seqidno.1所示,
b、与seqidno.1所示核苷酸序列互补的核苷酸序列,
c、编码seqidno.2所示氨基酸序列的核苷酸序列。
上述所述的茶树类胡萝卜素裂解双加氧酶csccd4或类胡萝卜素裂解双加氧酶基因csccd4在催化β-胡萝卜素生成β-紫罗酮上的应用。
本发明的茶树类胡萝卜素裂解双加氧酶csccd4的制备方法,包括以下步骤:
将茶树类胡萝卜素裂解双加氧酶基因csccd4连接到pgex-4t1载体中,转入大肠杆菌中培养,添加iptg后,16-37℃诱导20-24小时,用gst-树脂进行纯化,纯化后的蛋白用sds-page进行检测。
与现有技术相比,本发明具有以下有益效果:
本发明通过筛选得到类胡萝卜素裂解双加氧酶csccd4及其编码基因,通过原核表达其编码的蛋白能够特异性催化β-胡萝卜素生成大量β-紫罗酮,该发明不仅对茶树β-紫罗酮的积累及分子育种提供分子标记,也为其在茶叶加工过程中的调控提供理论依据。
附图说明
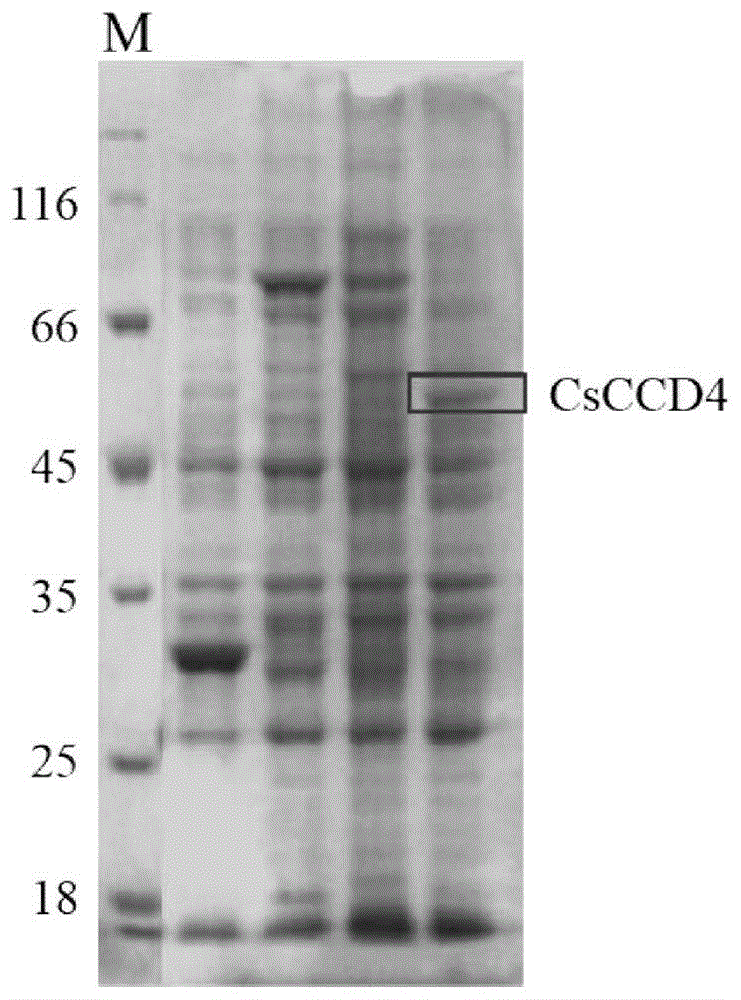
图1csccd4重组蛋白条带,m,marker;
图2hplc检测底物变化情况。与对照相比,转入csccd4的工程菌中,β-胡萝卜素菌块颜色由黄变浅,β-胡萝卜素的含量明显降低;
图3gc-ms检测反应产物,虚线代表对照,实线代表转入目的基因。“1”为检测到的产物:β-紫罗酮;离子谱图代表β-紫罗酮;
图4茶树各部位中β-紫罗酮的相对含量,采用单因素方差分析(anova)和duncan(s)进行统计学分析。不同字母代表各组之间的差异有统计学意义(p<0.05);
图5茶树各部位中csccd4的表达量,采用单因素方差分析(anova)和duncan(s)进行统计学分析。不同字母代表各组之间的差异有统计学意义(p<0.05);
图6不同应激处理对csccd4表达量的影响,对茶苗分别进行低温、失水、低温+机械损伤(采摘)、失水+机械损伤(采摘)处理后csccd4表达量的变化。“-”,完整茶苗;“+”,机械损伤(采摘)。采用单因素方差分析(anova)和duncan(s)进行统计学分析。不同字母代表各组之间的差异有统计学意义(p<0.05)。
具体实施方式
1、基因csccd4的克隆
csccd4基因序列由茶树基因转录组数据筛选得到,并对其orf序列进行特异性引物设计。引物序列如下:
5'-ggatctggttccgcgtggatccatggatgccttctcatcctcat
3'-gctcgagtcgacccgggttagagcttgttgaggtcgc
使用taqmix酶进行pcr反应,反应条件为:94℃预变性3min,94℃变性30s,55℃退火30s,72℃延伸3min,共进行35个循环,最后72℃延伸10min,4℃保存。pcr产物用1.2%琼脂糖凝胶电泳(age)检测.反应体系如下:
2、类胡萝卜素裂解双加氧酶csccd4的制备
把上述基因连接到pgex-4t1载体中,构建得到重组表达质粒pgex-4t1-csccd4;转入bl21或rosetta(de3)大肠杆菌中37℃培养至od600=0.6-0.8,添加1mmiptg后,16-18℃诱导20-24小时(也可以室温或37℃诱导),用gst-树脂进行纯化,纯化后的蛋白用sds-page进行检测(如图1)。
3、双质粒共转化感受态jm109
将能编码合成类胡萝卜素的基因质粒dna,其编号如下:#100(合成β-胡萝卜素)、#102(合成玉米黄质)、#834(合成番茄红素)、#835(合成zeta-胡萝卜素),pgex-4t1载体质粒,以及成功构建的重组表达质粒pgex-4t1-csccd4各1ul,分别共转化感受态jm109,转化体系如下:
表1
转化方法如下:
(1)100μl感受态细胞jm109(×4)悬液冰上溶解,分别各取30μl于4个1.5ml离心管中,按表1分别分组加入两种质粒dna各1μl。
(2)用移液器枪头轻轻将体系搅拌均匀,置于冰上30分钟后,于42℃恒温热水浴中加热90s,然后迅速在冰上冷却3~5min。
(3)加入500μllb液体培养基,37℃200rpm振荡培养lh,使菌体恢复正常生长状态,并扩大培养。
(4)取第一组、第二组500μl菌液均匀涂在同时含有两种抗性的lb平板上(amp+,100mg/l;cl-25mg/l),待lb培养基完全吸收菌液后,将涂布好的培养皿倒放,在37℃培养箱中过夜培养。
(5)挑取单菌落,通过菌落pcr验证转化结果。
4、双质粒重组蛋白共表达
将两组双质粒共转化成功的重组质粒:#100+pgex-4ti,#100+ccd4,#102+pgex-4ti,#102+ccd4,#834+pgex-4ti,#834+ccd4,#835+pgex-4ti,#835+ccd4进行体外表达,加入0.2mmiptg诱导后纯化,离心收集菌液沉淀,观察到β-胡萝卜素颜色变化明显。对沉淀进行萃取后,利用hplc检测底物变化,发现与对照相比,转入csccd4的工程菌中,β-胡萝卜素的含量大幅度下降。(如图2)
5、产物检测:
在上述体系共表达过程中,利用gc-ms对反应产物进行检测。结果显示,csccd4能够特异性降解β-胡萝卜素生成β-紫罗酮。值得注意的是,检测到的β-紫罗酮含量极高。(如图3)
6、应用举例
(1)结合其能降解β-胡萝卜素生成大量β-紫罗酮,通过实时定量pcr对csccd4的在茶树中的表达量进行分析,反应体系为12.5μlofsybr1premixextaqtmii,2μlcdna,,上下游引物(10μm)各1μl,总体积25μl。反应条件为95℃for3min;40cyclesof95℃for10s,62℃for30s。同时分析茶树各个部位的β-紫罗酮含量,如图4和图5所示,csccd4在茶树一二叶中表达量最高,芽次之;在csccd4调控β-紫罗酮合成的研究基础上,发现β-紫罗酮在茶树一二叶中含量最高,芽次之,与csccd4表达量相对应。为茶树β-紫罗酮的积累及分子育种提供分子标记。
(2)结合茶叶加工过程中存在的环境胁迫,对茶苗分别进行低温、失水、低温+机械损伤(采摘)、失水+机械损伤(采摘)处理,处理后的茶苗收取顶芽至三、四叶,液氮速冻,磨碎样品提取rna,反转录后进行实时荧光定量,反应体系为12.5μlofsybr1premixextaqtmii,2μlcdna,,上下游引物(10μm)各1μl,总体积25μl。反应条件为95℃for3min;40cyclesof95℃for10s,62℃for30s。对csccd4的表达量进行分析,结果如图6所示。发现csccd4基因在低温及机械损伤的胁迫下表达量增加,此时可能调控β-紫罗酮含量增加,为其在茶叶加工过程中的调控提供理论依据。
序列表
<110>安徽农业大学
<120>茶树类胡萝卜素裂解双加氧酶csccd4及其在催化合成β-紫罗酮上的应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>1842
<212>dna
<213>camelliasinensis
<400>1
atggatgccttctcatcctcattcctctctacattttcattctcgaatgtctctctaaca60
ccaccaccaccaccaccacaaccacaaccatcaaatcctcctctcctccacatctccgct120
gtccgaatagaagaaaaaccaccaacttcaacttcctcctcctcctccaccaccaccacc180
accaccccccctacaagaacacctcaaatttcaaaaccaatcccacaaaaatccacatca240
aaaaaaccaaccaccacaccaccaccaccaactgcgagacgagcagagccgagcttttcc300
accaccatcttcaacacattcgacgaaatcatcaacaacttcattgacccacccctccgc360
cagtccgtcgacccacgctacgtcctctccgacaacttcgcccccgtcgacgaactccct420
ccgaccaactgcacggtggtggaaggctccctcccgcagtgcctccacggcggagcgtac480
atccgcaacggccccaatccccaattcctcccccgcggcccctaccacctcttcgacggc540
gacggcatgctccacgccatcaaaatctccggccccaccgccgccaccctctgcagccgc600
tacgtgaagacctacaagtacacaatcgagtgcaaaaccggttctccggtcatccccaat660
gtcttctccggcttcaatggcctcaccgcctcagcggcgcgtggggcagtcaccgccgct720
cgagctctcgccggacaattcaaccccaccaatgggattgggcttgcgaacacgagcttg780
gctctcatcggatccaaactctacgctctcggcgagtctgatcttccttacgccgtcgag840
atctcgccggacggcgatataatcactctgggtcgccgtgatttcgccggaaaattgttc900
atgagcatgacggcgcatccgaaacttgacccagataccggcgaggcattcgctttccgg960
tatggtccggtaccgccatttctaacctttttcaggttcaacccagatggctcgaaacaa1020
cctgacgtgccgattttctcattgactactccttcgtttcttcatgattttgcgatcacg1080
aagaagtacgccatttttgttgatattcagatcggaatgaaccccatggagatgatcctc1140
ggagggtcgccggtgggtactgattcggcgaaagtgccgagaatcggcgtgattccgagg1200
tacgcgaaggacgagtcggagatgaggtggtttgaagtgccggggttcaatataatacat1260
gcgataaatgcgtgggatgaggacggtggtgatacggtggtgatggtggcgccgaatata1320
ttggcggtggagcatacgttggagaggatggatttgatacatgcgtcggtggagatggtg1380
aggattgatcttaagagtggggtggtgtccaggtttccggtggcggccaggaatttggat1440
tttgctgtgattaatcacaactacttgggaaagaagaacaggtacgtgtatgcagcaatt1500
ggggatccaatgccgaagatctccggggtggtgaaactcgacgtgtcagtatcagaaggc1560
gaccgccgtgactgcacggtggctagtcggttgttcgggcggggctgttttgggggcgag1620
cccttcttcgtagcaaaggaccctaacaatcccgaggcggacgaggatgatgggtacgta1680
gtaacttatgttcacgatgaatacataggcgagtcgaggtttctagtgatggacgcaaag1740
tctccggacctcgacatcgtggcagccgtgaaattgccccggcgagtaccttacggcttt1800
cacgggttgtttgtgagagaaagcgacctcaacaagctctaa1842
<210>2
<211>613
<212>prt
<213>camelliasinensis
<400>2
metaspalapheserserserpheleuserthrpheserpheserasn
151015
valserleuthrproproproproproproglnproglnproserasn
202530
proproleuleuhisileseralavalargilegluglulyspropro
354045
thrserthrserserserserserthrthrthrthrthrthrpropro
505560
thrargthrproglnileserlysproileproglnlysserthrser
65707580
lyslysprothrthrthrproproproprothralaargargalaglu
859095
proserpheserthrthrilepheasnthrpheaspgluileileasn
100105110
asnpheileaspproproleuargglnservalaspproargtyrval
115120125
leuseraspasnphealaprovalaspgluleuproprothrasncys
130135140
thrvalvalgluglyserleuproglncysleuhisglyglyalatyr
145150155160
ileargasnglyproasnproglnpheleuproargglyprotyrhis
165170175
leupheaspglyaspglymetleuhisalailelysileserglypro
180185190
thralaalathrleucysserargtyrvallysthrtyrlystyrthr
195200205
ileglucyslysthrglyserprovalileproasnvalphesergly
210215220
pheasnglyleuthralaseralaalaargglyalavalthralaala
225230235240
argalaleualaglyglnpheasnprothrasnglyileglyleuala
245250255
asnthrserleualaleuileglyserlysleutyralaleuglyglu
260265270
seraspleuprotyralavalgluileserproaspglyaspileile
275280285
thrleuglyargargaspphealaglylysleuphemetsermetthr
290295300
alahisprolysleuaspproaspthrglyglualaphealaphearg
305310315320
tyrglyprovalpropropheleuthrphepheargpheasnproasp
325330335
glyserlysglnproaspvalproilepheserleuthrthrproser
340345350
pheleuhisaspphealailethrlyslystyralailephevalasp
355360365
ileglnileglymetasnprometglumetileleuglyglyserpro
370375380
valglythraspseralalysvalproargileglyvalileproarg
385390395400
tyralalysaspgluserglumetargtrpphegluvalproglyphe
405410415
asnileilehisalaileasnalatrpaspgluaspglyglyaspthr
420425430
valvalmetvalalaproasnileleualavalgluhisthrleuglu
435440445
argmetaspleuilehisalaservalglumetvalargileaspleu
450455460
lysserglyvalvalserargpheprovalalaalaargasnleuasp
465470475480
phealavalileasnhisasntyrleuglylyslysasnargtyrval
485490495
tyralaalaileglyaspprometprolysileserglyvalvallys
500505510
leuaspvalservalsergluglyaspargargaspcysthrvalala
515520525
serargleupheglyargglycyspheglyglygluprophepheval
530535540
alalysaspproasnasnproglualaaspgluaspaspglytyrval
545550555560
valthrtyrvalhisaspglutyrileglygluserargpheleuval
565570575
metaspalalysserproaspleuaspilevalalaalavallysleu
580585590
proargargvalprotyrglyphehisglyleuphevalarggluser
595600605
aspleuasnlysleu
610
- 还没有人留言评论。精彩留言会获得点赞!