一种极低背景荧光的高灵敏次氯酸根荧光探针的制备方法与流程
本发明属于荧光探针技术领域,具体涉及一种极低背景荧光的高灵敏次氯酸根荧光探针的制备及其在实际水样、活细胞内及斑马鱼体内次氯酸根的检测应用。
背景技术:
次氯酸根(clo-)是一种常见的活性氧(ros),已在我们的日常生活中广泛用作消毒剂和家用漂白剂。通常,其浓度范围为10-104μm。然而,暴露于水中高水平的clo-残留物可能会引起眼睛,鼻子刺激和胃部不适,从而对人体健康造成严重的不利影响。另一方面,在髓过氧化物酶(mpo)的催化下,双氧水(h2o2)与氯离子(cl-)的反应可在生物体内产生clo-。它在人类免疫系统和维持细胞内氧化还原稳态中起着重要作用。但是,人体内clo-浓度的失衡通常会导致与氧化应激损害相关的疾病,例如心血管疾病、肺损伤、类风湿性关节炎等疾病。因此,迫切需要构建检测水样品和生物样品中的clo-的有效方法。
近年来,已经开发出多种检测clo-的方法,包括分光光度法、比色法、化学发光法、电化学分析和荧光探针等。与其它检测方法相比,荧光探针因其高选择性、高灵敏度、操作简便以及以非侵入性方式检测的性质而备受关注。基于次氯酸根的强氧化性,人们设计了含有酰肼、硫、腙、肟、对甲氧基苯酚及碳碳双键等识别基团的荧光探针。这些荧光探针表现出了很好的分析性能,但存在探针分子自身荧光背景较高的问题。而在实际应用中,高背景荧光信号往往会降低检测灵敏度,甚至导致假阳性结果。为了获得准确和可靠的检测,非常需要研制具有极低背景荧光的clo-荧光探针。
技术实现要素:
根据所提出的要求,本发明人对此做了大量的文献调研和深入研究,提供了一种极低背景荧光的高灵敏次氯酸根荧光探针。
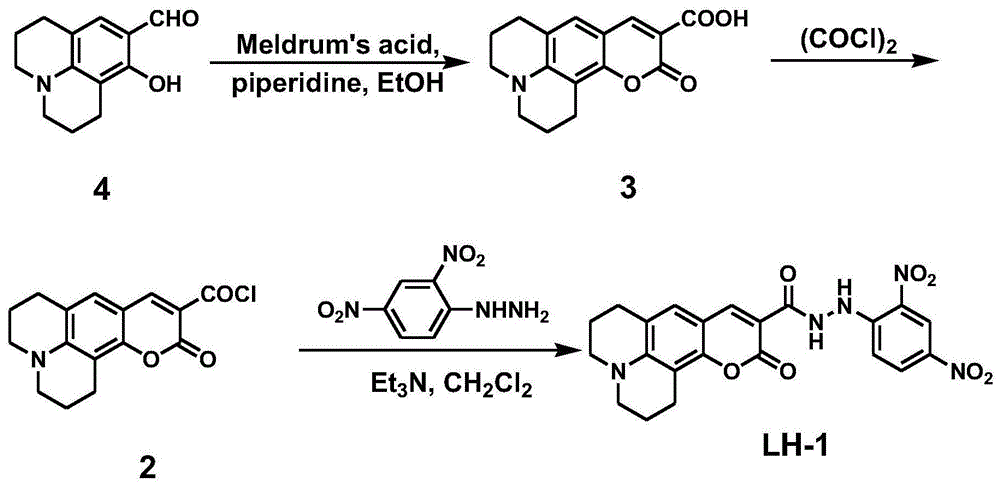
本发明的技术方案是,一种具有极低背景荧光的高灵敏次氯酸根荧光探针,其分子结构如下:
具体合成按照下述步骤进行:
(1)中间体化合物香豆素343的合成:将等当量的8-羟基久洛尼定-9-醛和丙二酸环异丙酯(麦氏酸)溶于乙醇,再将0.1当量的哌啶和乙酸逐滴滴入上述溶液;常温搅拌后,加热回流;冷却后倒入冰水中,抽滤,得到滤饼,用二氯甲烷、甲醇和乙酸为淋洗剂进行硅胶柱柱层析纯化,得到黄色固体,即为香豆素343;
(2)荧光探针分子lh-1的合成:将步骤(1)得到的香豆素343溶于二氯甲烷,冰浴下逐滴滴入20当量的草酰氯,然后再滴入n,n-二甲酰胺(简称dmf),在室温条件下进行第一次搅拌,旋除溶剂,真空干燥得到干燥的产物;
将上述所得产物溶于无水二氯甲烷中,分批加入等当量的2,4-二硝基苯肼,逐滴滴入20当量的无水三乙胺,在室温条件下进行第二次搅拌,旋除溶剂,得到粗产物,用淋洗剂进行硅胶柱柱层析纯化,得到黄色固体,为探针分子化合物lh-1;即为本发明所要制备的极低背景荧光的高灵敏次氯酸根荧光探针。
优选的,步骤(1)中所述8-羟基久洛尼定-9-醛、丙二酸环异丙酯、乙醇、哌啶和乙酸的用量关系为1.12g:0.74g:8ml:0.044g:0.1~0.2ml。
优选的,步骤(1)中所述乙醇和冰水的体积比为8:100。
优选的,步骤(1)中所述常温搅拌的时间为30~40min,加热回流的时间为3h。
优选的,步骤(1)中所述二氯甲烷、甲醇和乙酸的体积比为50∶1∶0.1。
优选的,步骤(2)中所述香豆素343、二氯甲烷、草酰氯和n,n-二甲酰胺的用量关系为100mg:10ml:0.6ml:0.1~0.2ml。
优选的,步骤(2)中所述第一次搅拌的时间为24h,真空干燥的时间为2-3小时。
优选的,步骤(2)中所述香豆素343、无水二氯甲烷、2,4-二硝基苯肼和无水三乙胺的用量关系为100mg:10ml:70mg:1ml。
优选的,步骤(2)中所述第二次搅拌的时间为48h;所述淋洗剂为二氯甲烷。
本发明的有益效果:
(1)本发明所制备极低背景荧光的高灵敏次氯酸根荧光探针lh-1中含有两种淬灭基团:酰肼中的n-n单键和强淬灭基团2,4-二硝基苯基。前者自由旋转可引起探针分子荧光淬灭,后者通过d-pet机制也可以淬灭荧光团的荧光。因此,探针lh-1显示出极低的背景荧光。同时,d-pet机制不受环境介质粘度的影响;即使在具有高粘度的溶液中,探针也会显示出低背景荧光。
(2)本发明所制备极低背景荧光的高灵敏次氯酸根荧光探针lh-1表现出了对次氯酸根良好的光谱响应性能。首先研究该探针的荧光光谱性质。探针本身在488nm处荧光强度极低;当探针中加入次氯酸根后,在488nm处荧光显著增强,并且随着次氯酸根浓度的增大,此处荧光强度大大增强。其次,研究探针的紫外吸收光谱。探针本身在459nm处有强吸收,加入次氯酸根后,蓝移至424nm。然后,研究探针的选择性。考察了探针对常见活性氧(h2o2、·oh、1o2、clo-)和活性氮(no)的荧光响应情况。结果显示,只对目标检测物次氯酸根(clo-)能引起探针显著的荧光强度增强,其它分析物没有明显的荧光强度改变。接着,研究探针对不同浓度次氯酸根的响应时间,均在20分钟之内。最后,研究ph对荧光探针识别次氯酸根的影响。当ph在6.0到11.0时,探针均能用于次氯酸根的检测。此外,还研究了不同检测体系对探针识别次氯酸根的影响。当乙腈与pbs缓冲溶液体积比为2:8时,探针响应性能最佳。
(3)本发明所制备极低背景荧光的高灵敏次氯酸根荧光探针lh-1用于各种实际水样(取自江苏大学校内玉带河、静湖和自来水)中不同浓度clo-回收率测定,结果令人满意。
(4)本发明所制备极低背景荧光的高灵敏次氯酸根荧光探针lh-1已成功用于活细胞中外源性和内源性次氯酸根荧光成像可视化检测。
(5)本发明制备的新型荧光探针lh-1能够用于斑马鱼中的clo-荧光成像可视化检测。
附图说明
图1为荧光探针lh-1的合成路线。
图2中(a)为荧光探针lh-1(10μm)对不同浓度clo-(0-40μm)响应的荧光光谱。插图:在手持型365nm紫外灯下含和不含clo-(40μm)的探针lh-1(10μm)的照片;(b)为荧光探针lh-1(10μm)在488nm处随clo-(0-20μm)浓度变化。
图3为荧光探针lh-1(10μm)与clo-(40μm)作用前后的紫外-可见吸收光谱;其中a为lh-1;b为lh-1+clo-。
图4为荧光探针lh-1(10μm)与40μm的各反应物作用后的荧光强度响应(λex=415nm,λem=488nm);插图:lh-1(10μm)与40μm的各反应物作用后的溶液荧光颜色(从左至右:空白、clo-、h2o2、·oh、1o2和no)。
图5为lh-1(10μm)与不同浓度的clo-(0、10、20、30、40μm)作用后荧光强度随时间变化的关系曲线图(λex=415nm,λem=488nm)。
图6为加入clo-(40μm)前(■)后(●),lh-1(10μm)的荧光强度随ph的变化图(λex=415nm,λem=488nm)。
图7为乙腈与pbs不同体积比时,探针lh-1对clo-的响应性能图。
图8为通过mtt法测定细胞活力。
图9为荧光探针lh-1在hela细胞中检测clo-的荧光图像;(a-e)hela细胞与lh-1(10μm)孵育30min,然后分别加入不同浓度clo-(0μm、5μm、10μm、15μm和30μm)作用后的图像;(f-j)是(a-e)与其对应的明场图像的合并图像;(k)量化(a-e)中的平均荧光强度。
图10为荧光探针lh-1与raw264.7细胞中内源性clo-作用的荧光图像;其中(a)将raw264.7细胞与荧光探针lh-1(10μm)共孵育30min;(b)raw264.7细胞用4-氨基苯甲酸酰肼(abah,200μm)预处理30min,然后加入lh-1(10μm)共孵育30min;(c)用脂多糖(lps,20μg/ml)刺激raw264.7细胞12h,然后与lh-1(10μm)共孵育30min;(d-f)是a-c与其对应的明场图像的合并图像;(g)量化(a-c)中的平均荧光强度。
图11为荧光探针lh-1(10μm)在斑马鱼体内检测clo-作用的荧光成像:(a-b)斑马鱼用lh-1(10μm)孵育30min;(c-d)斑马鱼用lh-1(10μm)孵育30min,然后加入clo-(5μm)再孵育30min;(e-f)用lh-1(10μm)孵育的斑马鱼30min,然后与clo-(10μm)再孵育30min;其中(a,c,e)为明场,(b,d,f)为绿色荧光通道。
具体实施方式
下面结合附图和具体实施实例对本发明做进一步说明,但不限于此。
实施例1:
荧光探针的合成,合成路线如图1;
(1)中间体化合物香豆素343的合成:在100ml圆底烧瓶中,将8-羟基久洛尼定-9-醛(1.12g,5.18mmol)和丙二酸环异丙酯(麦氏酸)(0.74g,5.18mmol)溶于8ml乙醇,再将哌啶(0.044g,0.52mmol)和2滴乙酸(0.1~0.2ml)逐滴滴入上述溶液;常温搅拌30min后,加热回流3h;冷却,倒入100ml冰水中,抽滤,滤饼用体积比为50∶1∶0.1的二氯甲烷、甲醇和乙酸为淋洗剂进行硅胶柱柱层析纯化,得到黄色固体(0.93g,产率63%),即为香豆素343;1hnmr(400mhz,cdcl3)δ(ppm):12.497(s,1h),8.506(s,1h),7.022(s,1h),3.412(q,j=4.8hz,4h),2.903(t,j=6.4hz,2h),2.806(t,j=6.2hz,2h),2.013(t,j=5.6hz,4h);13cnmr(100mhz,dmso-d6)δ(ppm):165.074,161.081,153.103,149.621,149.178,127.940,120.005,107.714,105.438,105.182,50.113,49.580,27.209,20.920,19.954.hrms:m/z:calcdforc16h16no4:286.10793[m+h]+,found:286.10775.
(2)荧光探针分子lh-1的合成:在100ml圆底烧瓶中,将香豆素343(100mg,0.35mmol)溶于10ml二氯甲烷,冰浴下逐滴滴入草酰氯(0.6ml,7.1mmol),然后滴入两滴dmf(0.1~0.2ml),室温搅拌24h,旋除溶剂,真空干燥2-3小时,得到干燥的产物;
将上述所得产物直接溶于10ml无水二氯甲烷中,分批加入等当量的2,4-二硝基苯肼(70mg,0.35mmol),逐滴滴入无水三乙胺(1ml,7.2mmol),室温搅拌48h;旋除溶剂,粗产物用二氯甲烷为淋洗剂进行硅胶柱柱层析纯化,得到黄色固体(84mg,产率51.6%),即为探针分子化合物lh-1。1hnmr(400mhz,cdcl3)δ(ppm):10.721(s,1h),9.725(s,1h),9.163(d,j=2.4hz,1h),8.594(s,1h),8.297(dd,j1=9.2hz,j2=2.4hz,1h),7.057(s,1h),5.322(s,1h),3.412(m,4h),2.931(t,j=6.4hz,2h),2.811(t,j=6hz,2h),2.026(m,4h);13cnmr(100mhz,cdcl3)δ(ppm):163.725,163.046,153.131,149.397,149.298,148.754,130.960,130.199,127.552,123.602,120.382,114.937,108.282,105.780,105.677,53.434,50.438,50.006,27.435,20.960,20.013;ms(esi):m/z:calcdforc22h20n5o7:466.14[m+h]+,c22h19n5o7na488.12[m+na]+.found:466.34and488.41,respectively.
实施例2:
荧光探针和次氯酸根溶液配制;
探针溶液的配制:称取一定量的探针溶解在dmf中,得到1mm的探针溶液储备液。次氯酸根溶液的配制:将一定量的次氯酸钠溶解在超纯水中,转移至100ml的容量瓶中,加水至刻度线,得到浓度为10mm的次氯酸根储备液。将10mm的次氯酸根储备液逐级稀释,得到10~0.1mm的次氯酸根溶液。将20μl的探针储备液和一定体积的次氯酸根溶液加入到2ml离心管中,加入一定体积的乙腈-pbs混合溶液(体积比2:8,pbs为10mmph=7.40的磷酸盐缓冲溶液),总体积为2ml,得到浓度为10μm的荧光探针和0~40μm的次氯酸根混合待测溶液。
实施例3:
荧光探针与clo-作用的荧光光谱测定;
图2中(a)为荧光探针lh-1(10μm)对不同浓度clo-(0~40μm)响应的荧光光谱。实验所用激发光谱为415nm,发射波长范围是434~650nm。激发和发射狭缝宽度均为10nm,所用的荧光测定仪器为thermofisherlumina荧光分光光度计。从图2中(a)可以看出,加入次氯酸根之前,由于酰肼中的n-n单键的自由旋转和强淬灭基团2,4-二硝基苯基的d-pet机制的双重淬灭作用,探针本身荧光强度极低;加入次氯酸根之后,488nm处荧光强度大大增强,且随着次氯酸根浓度的增大,荧光强度逐渐增强。当加入4当量的次氯酸根时,荧光强度增强了739倍。表明次氯酸根的加入,切断了酰肼键,释放出了香豆素343。同时,在365nm手持紫外灯照射下,溶液也从无荧光变为蓝绿色荧光(图(a)插图)。图2中(b)为探针lh-1(10μm)在488处随clo-(0~20μm)浓度变化。探针对次氯酸根的线性响应范围为0~20μm,检测下限为10.5nm。表明探针对次氯酸根的响应是高灵敏的,有望用于活细胞内次氯酸根浓度的微小改变检测。
实施例4:
荧光探针与clo-作用的紫外-可见光谱测定;
图3为荧光探针与次氯酸根作用前后的紫外-可见吸收光谱图。荧光探针的浓度为10μm,次氯酸根浓度为40μm。紫外-可见吸收光谱测定所用的仪器为岛津uv-2600紫外-可见分光光度计。从图3可以看出,探针本身在459nm处有强吸收;加入次氯酸根后,最大吸收波长蓝移至424nm。表明双淬灭基团均已消除,生成了新的化合物。
实施例5:
荧光探针对clo-测定的选择性;
图4为荧光探针对clo-测定的选择图。考察浓度为10μm的荧光探针对浓度40μm的不同活性氧(clo-、h2o2、·oh、1o2)及活性氮(no)的荧光响应情况。从图中可以看出,只有加入clo-才能引起荧光探针荧光光谱的显著增强,其它物质没有引起明显的变化。表明探针对clo-有较好的选择性。图4插图为加入上述物质后,探针溶液的荧光变化图。从图中可以看出,只有clo-加入使得探针溶液从无荧光变为蓝绿色荧光。表明荧光探针可以可视化检测clo-。
实施例6:
荧光探针与不同浓度clo-作用的响应时间测定;
图5为浓度为10μm的荧光探针与不同浓度(0、10、20、30、40μm)的clo-作用的时间响应图。从图中可以看出,荧光探针对clo-响应时间均在20分钟以内,可以满足实际样品监测要求。同时,荧光强度达到最大值后,荧光强度不再随时间延长而变化,表明荧光探针光稳定性好。
实施例7:
溶液ph对荧光探针测定clo-的影响;
图6为加入40μmclo-前(■)后(●),浓度为10μm的荧光探针在488nm处荧光强度随ph的变化。考察的ph范围为2.0~11.0。从图中可以看出,探针本身在该ph范围内基本没有荧光。加入40μmclo-后,在ph≥6.0范围内,探针荧光强度均有较大增强。表明该荧光探针可以用于生理条件下的clo-的检测。
实施例8:
检测体系中乙腈体积对荧光探针测定clo-的影响;
图7为乙腈与pbs不同体积比时,探针lh-1对次氯酸根的响应性能。从图中可以看出,当乙腈体积比为20%时,探针对clo-响应性能最佳。
实施例9:
荧光探针在实际水样检测中的应用;
本发明选取的水样分别来自江苏大学校内的玉带河(yudairiverwater)、静湖(jinglakewater)及工作室内的自来水(tapwater)。实验前,将实际水样用0.45μm微孔滤膜过滤。检测体系为体积比2:8的乙腈和实际水样。检测体系中分别加入一定体积的探针储备液和clo-储备液,使得探针最终浓度为10μm,clo-最终浓度为0、5、10和20μm。
表1为探针对实际水样中clo-浓度的回收率测定结果。
从表中可以看出,三种水体中均含有少量的clo-(均低于限值)。三种水体中clo-回收率均在93%以上,表明荧光探针可以用于实际水样中clo-的定量检测。
实施例10:
荧光探针细胞毒性评价;
将raw264.7细胞或hela细胞以1×105个细胞/孔的密度接种在96孔板的每个孔中,孵育24小时。将荧光探针储备液用含有10%胎牛血清的细胞培养基稀释,探针终浓度为0、10、20、30、40和50μm。取100μl的上述溶液,加入96孔板的每个孔中,孵育12小时。然后向每个孔中加入20μl3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物溶液(5mg﹒ml-1,hepes),37℃下放置4小时。除去残留溶液,将100μl二甲基亚砜添加到每个孔中,以溶解甲瓒晶体,使用synergy|h5微孔板检测仪收集490nm处吸光度。图8为mtt法测定细胞活力图。从图中可以看出,探针表现出低细胞毒性。
实施例11:
荧光探针应用于hela细胞中外源性clo-荧光成像检测;
hela细胞以4×104个/ml-1的细胞密度接种在24孔板上,加入含有10%fbs和1%抗生素(青霉素/链霉素,100u/ml)的培养基,37℃条件下二氧化碳培养箱中孵育24小时。将细胞分为五组,每组分别加入一定体积的荧光探针储备液,使其最终浓度为10μm,孵育30分钟。然后用pbs缓冲液洗涤3次以除去溶液中的荧光探针。加入培养基,每组再分别加入一定体积的clo-储备液,使其最终浓度分别为0、5、10、15、30μm。37℃下再放置30分钟,然后分别用pbs洗涤3次。最后在蔡司gmbh37081型倒置荧光显微镜上用20倍物镜通过倒置荧光显微镜成像。结果如图9所示。从图上可以看出,随着次氯酸根荧光强度的增加,荧光强度逐渐增强,这表明荧光探针可以用于不同浓度外源性次氯酸根的荧光成像检测。
实施例12:
荧光探针应用于raw264.7中内源性clo-荧光成像检测;
raw264.7细胞以6×104个/ml-1的细胞密度接种在24孔板上,加入含有10%fbs和1%抗生素(青霉素/链霉素,100u/ml)的培养基,37℃条件下二氧化碳培养箱中孵育24小时。将细胞分为三组。第一组是将raw264.7巨噬细胞与浓度为10μm荧光探针孵育30分钟。第二组是将raw264.7巨噬细胞与浓度为200μm的4-氨基苯甲酸酰肼(简称abah)孵育30分钟,然后与浓度为10μm荧光探针共孵育30分钟。第三组中是用脂多糖(简称lps,20μg/ml)刺激raw264.7巨噬细胞12h,然后与浓度为10μm荧光探针共孵育30分钟。在成像之前,将以上所有细胞用pbs缓冲液洗涤3次,再加入培养基。最后在蔡司gmbh37081型倒置荧光显微镜上用20倍物镜通过倒置荧光显微镜成像。结果如图10所示。从图上可以看出,raw264.7细胞用荧光探针孵育后,有微弱荧光;加入髓过氧化物酶(mpo)抑制剂abah后,荧光消失。表明raw264.7细胞内含有少量的内源性次氯酸根。众所周知,加入lps能诱导raw264.7细胞内产生更多的次氯酸根。图10c结果显示,lps刺激下,荧光显著增强。以上结果表明,荧光探针可以用于raw264.7细胞内内源性次氯酸根荧光成像检测。
实施例13:
荧光探针应用于斑马鱼体内clo-荧光成像检测;
将3天大的斑马鱼与浓度为10μm荧光探针在光照培养箱中孵育30分钟,然后用斑马鱼胚胎培养液(0.1%nacl、0.003%kcl、0.004%cacl2·h2o和0.008%mgso4)洗涤,以除去剩余的荧光探针。同时,将其它两组的斑马鱼与浓度为10μm荧光探针孵育30分钟,然后与分别加入5、10μmclo-,孵育30分钟,并用培养液洗涤3次。在szx2-illt型立体荧光显微镜上观察荧光成像。结果如图11所示。从图中可以看出,次氯酸根的加入,使得斑马鱼体内显示出绿色荧光;次氯酸根浓度越大,荧光强度越强。表明荧光探针可以用于斑马鱼体内次氯酸根的检测。
说明:以上实施例仅用以说明本发明而并非限制本发明所描述的技术方案;因此,尽管本说明书参照上述的各个实施例对本发明已进行了详细的说明,但是本领域的普通技术人员应当理解,仍然可以对本发明进行修改或等同替换;而一切不脱离本发明的精神和范围的技术方案及其改进,其均应涵盖在本发明的权利要求范围内。
- 还没有人留言评论。精彩留言会获得点赞!