牛粪中非O157产志贺毒素大肠埃希氏菌的分离鉴定方法与流程
本发明涉及微生物检测分离技术领域,具体涉及一种牛粪中非o157产志贺毒素大肠埃希氏菌分离鉴定方法。
背景技术:
产志贺毒素大肠埃希氏菌是一群重要的肠道致病菌,很少的感染剂量(10个菌左右)就可导致感染者出现出血性结肠炎、血栓性血小板减少性紫癜(thromboticthrombocytopenicpurpura,ttp)及溶血性尿毒综合症(hemolytic-uremicsyndrome,hus)等临床症状,患者死亡率高。而目前关于产志贺毒素大肠埃希氏菌的检测,也只是针对steco157∶h7制定了相应的检测标准,对非o157的stec菌株的检测还没有一个明确的分离鉴定方法。本专利依据志贺毒素基因是stec的共有特征,通过pcr扩增志贺毒素基因并结合麦康凯选择性平板来达到对stec的快速分离鉴定方法。
技术实现要素:
为克服现有技术中的不足,本发明的目的在于提供一种牛粪中非o157产志贺毒素大肠埃希氏菌的分离鉴定方法,通过pcr扩增志贺毒素基因并结合麦康凯选择性平板来达到对stec的快速分离鉴定方法,其技术方案如下:
牛粪中非o157产志贺毒素大肠埃希氏菌分离鉴定方法,其特征在于,包括以下步骤:
s1,细菌选择培养:将采集的待测样本与ec肉汤培养基进行首次增菌,然后将增菌液以1:8~12的比例转移至新鲜的ec肉汤培养基进行二次增菌;
s2,stec分离:利用pcr扩增并结合麦康凯选择平板对s1中增菌后的细菌样本进行stec分离;
s3,stec鉴定:将s2中分离得到的阳性单克隆菌株活化于lb平板,然后对活化的菌株进行stx1/2基因扩增、凝胶电泳及成像,显示阳性的,即为stec菌株;
s4,stec保藏,对s3中经过鉴定为stec的菌株进行菌种保藏。
作为本发明进一步的方案:所述的s1中,首次增菌的具体方法为:将收集的样本称取后加入无菌ec肉汤,振荡均匀,然后培养,得到首次增菌液。其中,样本和无菌ec肉汤的质量比为1:8~12,振荡时间10~20s;二次增菌的具体方法为,将首次增菌液振荡均匀后,加入无菌ec肉汤,所述的首次增菌液与无菌ec肉汤的质量比为1:8~12,振荡均匀后进行培养;首次增菌及二次增菌的培养温度都为41~43℃,将混匀的样本悬浮液放置摇床,在转速为180~200rpm的条件下,培养18~24h。
作为本发明进一步的方案:所述的s2的具体操作为:
s2.1,利用pcr扩增stec所共有的志贺毒素基因(stx1/2),然后经过凝胶电泳及成像判断牛粪样本中是否携带stec菌株,
s2.2,将s2.1中判断为阳性及疑似样本的菌液分别稀释涂布于麦康凯平板上,然后在每个样本中挑取20个疑似菌落涂抹于lb平板四个区域,
s2.3,在s2.2中所述的四个区域中,每个区域5株菌混合并进行stx1/2基因扩增,根据凝胶电泳及成像来判断每个区域中的5个菌落中是否存在产志贺毒素菌株,所述基因扩增采用pcr扩增方法。
s2.4,经s2.3检测判断为阳性的区域,则继续将该阳性区域中的每株菌进行stx1/2基因扩增,进而判断哪个菌落为产志贺毒素菌株;所述基因扩增采用pcr扩增方法。
菌液稀释涂布时,阳性及疑似样本的稀释倍数是10-4,10-5和10-6,涂布量为48~52μl;
将菌液滴于麦康凯平板的五个区域,五个区域分别为:左上,左下,右上,右下和中部区域。涂布滴加菌液于五个区域,目的是将菌液均匀涂布;
进行pcr扩增时使用的dna模板均是通过煮沸法制得;
作为本发明进一步的方案:所述的s2.2中菌落挑取具体操作为:选取菌落数在30~300之间的麦康凯平板进行挑菌,一个样本挑取一个平板,将该平板用十字线划分为四个区域。四个区域分别为:左上,左下,右上和右下,十字线划分四个区域,目的是提高目的菌株的挑取概率,在上述的四个区域中,各挑取5个单菌落,置于lb平板对应的四个区域,区域编号为1,2,3和4。
作为本发明进一步的方案:所述的s3的具体步骤为:
s3.1,对已经确定的阳性区域进行单克隆菌株鉴定,具体步骤为:
s3.1.1对经s2中鉴定为阳性区域的5个单克隆菌落进行编号;用无菌牙签取少量的菌体涮于500μl的无菌ddh2o,并做好编号;
s3.1.2涡旋振荡10~20s,13000rpm离心5min,弃去上清,重复两次;将清洗两次的菌体,加入300μl的无菌ddh2o,吹吸混匀,并涡旋振荡10~20s;
s3.1.3将准备好的菌悬液放入事前预热好的金属加热器,100℃加热煮沸15min,然后将煮沸后的菌液于4℃冰箱放置5min;
s3.1.4将煮沸冷却后的菌液与离心机,13000rpm离心10min,吸取200μl上清即为dna模板,然后进行pcr扩增操作,若模板不立即使用,保存于-20℃冰箱中;
s3.2,进行stec鉴定:将扩增后阳性的单克隆菌株活化于lb平板,37℃恒温培养箱培养18~24h,并利用pcr扩增stx1/2基因,再利用凝胶电泳及成像来确定得到的即为产志贺毒素大肠埃希氏菌。
作为本发明进一步的方案:用棉签将菌体涮于装有1.2ml40%lb-甘油的冻存管中,于-80℃的冰箱进行保存。
作为本发明进一步的方案:所述的dna模板的制备方法为:
(1)将金属加热器开至100℃,稳定30min;
(2)取1ml二次增菌液于1.5mlep管中13000rpm离心5min,弃上清;
(3)加500μl无菌ddh2o将菌体沉淀重悬,13000rpm离心5min,弃去上清,重复两次;
(4)将清洗两次的菌体,加300μl无菌ddh2o重悬并用涡旋振荡器振荡10~20s;
(5)将准备好的菌悬液放入事前预热好的金属加热器,加热煮沸15min;
(6)将煮沸后的菌液于4℃冰箱放置5min;
(7)将冷却后煮沸的菌液与离心机13000rpm离心10min,吸取200μl上清即为dna模板,若模板不立即使用,保存于-20℃冰箱中。
作为本发明进一步的方案:所述的pcr扩增时,反应体系和反应条件如下:pcr反应体系:dna模板5μl,10×pcrbuffer2.5μl,mgcl21.5μl,dntp2μl,taqdna聚合酶0.125μl,上下游引物各为0.3μl,ddh2o13.275μl。pcr反应条件:95℃预变性5min;94℃变性30s、58℃退火30s、72℃延伸45s,30个循环;72℃终延伸10min,4℃保存。
作为本发明进一步的方案:所述的pcr扩增操作的具体步骤为,
(a)按照反应体系和样本数量计算试剂总用量(注:通常多算1-2个样的体系)
(b)混合体系的配制:试剂全部溶解后,振荡混匀。根据反应体系按步加入,混匀并且离心,置于冰盒上备用;
(c)分装:将pcr管和已配好的体系都置于冰上,先加入事先配好的体系20μl,然后将5μldna模板加入对应标号的pcr管中,记录编号;
(d)pcr扩增:将pcr管管壁上的溶液进行短暂离心,小心取出,按顺序放入pcr仪,再次确认每个pcr管盖子已盖好。设定pcr程序进行扩增。
作为本发明进一步的方案:所述的凝胶电泳及成像方法的具体操作步骤为:
(i)电泳:配制1%琼脂糖,微波煮沸三次,待冷却到50℃,加入eb染料混匀,缓慢的倒入事先插好梳子的胶板,半小时后拔出梳子,然后每孔上样5μlpcr产物,缓慢放入0.5×tris-borate-edta缓冲区,最后设定程序120v,90ma电泳35min;
(ii)成像:将电泳结束的凝胶放入成像系统中成像,根据成像结果对应的mark区间,是否与引物大小相一致来判断基因的检出,并做好记录。
本发明可以实现以下有益效果:
(1)本发明对牛粪便中非o157产志贺毒素大肠埃希氏菌能够有效的分离,在细菌培培养时,进行两次增菌,由于首次增菌液中有大量牛粪杂质,若进行dna模板提取,杂质较多影响扩增结果,故增加了二次增菌,这样可以提高dna纯度。
(2)首次及二次增菌培养温度为41~43℃,因为较高培养温度可以抑制除目标菌外的菌株生长繁殖,提高目标菌株的筛选几率。首次及二次增菌转速为180~200rpm;这样的转速范围增加菌株接触机会,使菌株大量繁殖。培养时间为18~24h;这样的时间可以保证使菌株处于生长稳定期。
(3)本发明要分离的目标菌株在麦康凯平板菌落颜色为粉红或者紫红色,通过将阳性及疑似样本稀释涂布于麦康凯平板,一方面对初筛的样本是否存在目标菌株再次验证,另一方便稀释涂布后的平板,菌株分布均匀方便挑取。阳性及疑似菌液稀释涂布于麦康凯选择平板,不仅对初筛结果进行验证,而且生长出的菌落形态清晰,便于挑取,为stec菌株的分离降低了难度。
(4)此外,通过增加菌落挑取量尽可能减少漏检的概率。然后对挑取的菌落进行分区域扩增,减少工作量,为快速检测节约了时间。
(5)对各区域5株菌混合扩增鉴定后,进一步对扩增阳性的区域进行单克隆菌株扩增。最后对阳性克隆株,再次进行验证,提高了准确率。
附图说明
图1是是本发明中麦康凯稀释涂布图;
图2为本发明lb分区域培养图;
图3为本发明pcr鉴定stec电泳图。
具体实施方式
以下将参照附图,通过实施例方式详细地描述本发明的技术方案。在此需要说明的是,对于这些实施例方式的说明用于帮助理解本发明,但并不构成对本发明的限定。
本文中术语“和/或”,仅仅是一种描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,单独存在b,同时存在a和b三种情况,本文中术语“/和”是描述另一种关联对象关系,表示可以存在两种关系,例如,a/和b,可以表示:单独存在a,单独存在a和b两种情况,另外,本文中字符“/”,一般表示前后关联对象是一种“或”关系。
牛粪中非o157产志贺毒素大肠埃希氏菌的分离鉴定方法,包括以下步骤:
s1,细菌选择培养:将采集的待测样本与ec肉汤培养基进行首次增菌,然后将增菌液以1:8~12的比例转移至新鲜的ec肉汤培养基进行二次增菌;
其中,首次增菌的具体方法为:将收集的样本称取后加入无菌ec肉汤,振荡均匀,然后培养,得到首次增菌液。其中,样本和无菌ec肉汤的质量比为1:8~12,振荡时间10~20s。
其中,二次增菌的具体方法为,将首次增菌液振荡均匀后,加入无菌ec肉汤,所述的首次增菌液与无菌ec肉汤的质量比为1:8~12,振荡均匀后进行培养。
首次增菌及二次增菌的培养温度都为41~43℃,将混匀的样本悬浮液放置摇床,在转速为180~200rpm的条件下,培养18~24h。
在s1中,进行了两次增菌,由于首次增菌液中有大量牛粪杂质,若进行dna模板提取,杂质较多影响扩增结果,故增加了二次增菌,这样可以提高dna纯度。
首次及二次增菌培养温度为41~43℃,因为较高培养温度可以抑制除目标菌外的生长繁殖,提高目标菌株的筛选几率。
首次及二次增菌转速为180~200rpm;这样的转速范围增加菌株接触机会,使菌株大量繁殖。
培养时间为18~24h;这样的时间可以保证使菌株处于生长稳定期。
s2,stec分离:利用pcr扩增并结合麦康凯选择平板对s1中增菌后的细菌样本进行stec分离,具体步骤为:
s2.1,利用pcr扩增stec所共有的志贺毒素基因(stx1/2),然后经过凝胶电泳及成像判断牛粪样本中是否携带stec菌株,
s2.2,将s2.1中判断为阳性及疑似样本的菌液分别稀释涂布于麦康凯平板上,然后在每个样本中挑取20个疑似菌落涂抹于lb平板四个区域,
s2.3,在s2.2中所述的四个区域中,每个区域5株菌混合并进行stx1/2基因扩增,根据凝胶电泳及成像来判断每个区域中的5个菌落中是否存在产志贺毒素菌株,所述基因扩增采用pcr扩增方法。
s2.4,经s2.3检测判断为阳性的区域,则继续将该阳性区域中的每株菌进行stx1/2基因扩增,进而判断哪个菌落为产志贺毒素菌株;所述基因扩增采用pcr扩增方法。
在进行s2.2中的涂布菌液时,阳性及疑似样本的稀释倍数是10-4,10-5和10-6,涂布量为48~52μl,麦康凯稀释涂布图如图1所示,图中a、b、c三个麦康凯平板对应的稀释倍数分别为10-4,10-5和10-6。图1通过凝胶成像拍摄,可以更加清晰的看到菌落个数。
此处,阳性及疑似样本的稀释倍数是10-4,10-5和10-6:不同菌株存在差异,试验发现10-4,10-5和10-6平板一定存在一个平板菌落数在30~300。而稀释涂布时稀释倍数为10-1~10-3菌落数较多,给菌株挑取增加难度,10-7菌落数较少无法达到所需挑取菌株数。
在具体涂布的时候,将稀释后的菌液滴于麦康凯平板的五个区域,五个区域分别为:左上,左下,右上,右下和中部区域。涂布滴加菌液五个区域,目的是将菌液均匀涂布;
所述的稀释涂布的具体方法为:
(1)将阳性及疑似样本用涡旋振荡器振荡10~20s;
(2)取1ml阳性及疑似样本于1.5mlep管中;
(3)取100μl菌悬液于900μl无菌ddh2o,涡旋振荡10~20s使其混匀,制成10-1倍稀释液;
(4)以此类推制成10-2,10-3,10-4,10-5,10-6和10-7倍稀释液;
(5)取48~52μl10-4,10-5和10-6倍稀释液滴于麦康凯平板的五个区域(五个区域分别为:左上,左下,右上,右下和中部区域),然后用涂布棒均匀涂开;
(6)待平板静置10min后,放置37℃恒温培养箱培养18~24h;
(7)挑取菌落数30~300,且菌落颜色为粉红色或紫红色的平板进行之后试验。
其中所有的dna模板均是通过煮沸法制得;
其中,s2.2中菌落挑取具体操作为:选取菌落数在30~300之间的麦康凯平板进行挑菌,一个样本挑取一个平板,将该平板用十字线划分为四个区域。四个区域分别为:左上,左下,右上和右下,十字线划分四个区域,目的是提高目的菌株的挑取概率,在上述的四个区域中,各挑取5个单菌落,置于lb平板对应的四个区域,区域编号为1,2,3和4。
每个样本挑选20个疑似菌落涂抹于lb平板四个区域:因为除目标菌株外,其余类别大肠杆菌在麦康凯平板菌落颜色都为粉红色或紫红色,无法确定哪些属于目标菌落,故增加挑取菌落量来增加目标菌株的挑取几率。由于菌落挑取量较少漏检概率就大,菌落挑取量较大则检出耗时长无法达到快速检测的目的。最终确定挑取量为20个菌落。
在混合区域扩增具体操作为:将lb平板每个区域的5株菌,分别用牙签挑取少量的菌体涮于含无菌ddh2o的一只ep管中,煮沸法制得dna模板,然后进行pcr扩增。
其中,pcr扩增使用的dna模板通过煮沸法制得。
s3,将s2中分离得到的阳性单克隆菌株活化于lb平板,然后对活化的菌株进行stx1/2基因扩增、凝胶电泳及成像,显示阳性的,即为stec菌株;具体实施步骤如下:
s3.1,对已经确定的阳性区域进行单克隆菌株鉴定,具体步骤为:
s3.1.1对经s2中鉴定为阳性区域的5个单克隆菌落进行编号;用无菌牙签取少量的菌体涮于500μl的无菌ddh2o,并做好编号;
s3.1.2涡旋振荡10~20s,13000rpm离心5min,弃去上清,重复两次;将清洗两次的菌体,加入300μl的无菌ddh2o,吹吸混匀,并涡旋振荡10~20s;
s3.1.3将准备好的菌悬液放入事前预热好的金属加热器,100℃加热煮沸15min,然后将煮沸后的菌液于4℃冰箱放置5min;
s3.1.4将煮沸冷却后的菌液与离心机,13000rpm离心10min,吸取200μl上清即为dna模板,然后进行pcr扩增操作,若模板不立即使用,保存于-20℃冰箱中;
s3.2,进行stec鉴定:将扩增后阳性的单克隆菌株活化于lb平板,37℃恒温培养箱培养18~24h,并利用pcr扩增stx1/2基因,再利用凝胶电泳及成像来确定得到的即为产志贺毒素大肠埃希氏菌。
s4,stec保藏,对pcr鉴定为stec的菌株进行菌种保藏。具体操作为:用棉签将菌体涮于装有1.2ml40%lb-甘油的冻存管中,于-80℃冰箱进行保存。
本方法中,所述的dna模板的制备方法为:
(1)将金属加热器开至100℃,稳定30min;
(2)取1ml二次增菌液于1.5mlep管中13000rpm离心5min,弃上清;
(3)加500μl无菌ddh2o将菌体沉淀重悬,13000rpm离心5min,弃去上清,重复两次;
(4)将清洗两次的菌体,加300μl无菌ddh2o重悬并用涡旋振荡器振荡10~20s;
(5)将准备好的菌悬液放入事前预热好的金属加热器,加热煮沸15min;
(6)将煮沸后的菌液于4℃冰箱放置5min;
(7)将冷却后煮沸的菌液与离心机13000rpm离心10min,吸取200μl上清即为dna模板,若模板不立即使用,保存于-20℃冰箱中。
本方法中在进行所述的pcr扩增时,反应体系和反应条件如下:pcr反应体系:dna模板5μl,10×pcrbuffer2.5μl,mgcl21.5μl,dntp2μl,taqdna聚合酶0.125μl,上下游引物各为0.3μl,ddh2o13.275μl。pcr反应条件:95℃预变性5min;94℃变性30s、58℃退火30s、72℃延伸45s,30个循环;72℃终延伸10min,4℃保存。
本方法中所述的pcr扩增操作的具体步骤为,
(a)按照反应体系和样本数量计算试剂总用量(注:通常多算1-2个样的体系)
(b)混合体系的配制:试剂全部溶解后,振荡混匀。根据反应体系按步加入,混匀并且离心,置于冰盒上备用;
(c)分装:将pcr管和已配好的体系都置于冰上,先加入事先配好的体系20μl,然后将5μldna模板加入对应标号的pcr管中,记录编号;
(d)pcr扩增:将pcr管管壁上的溶液进行短暂离心,小心取出,按顺序放入pcr仪,再次确认每个pcr管盖子已盖好。设定pcr程序进行扩增。
本方法中采用的凝胶电泳及成像的具体操作步骤为:
(i)电泳:配制1%琼脂糖,微波煮沸三次,待冷却到50℃,加入eb染料混匀,缓慢的倒入事先插好梳子的胶板,半小时后拔出梳子,然后每孔上样5μlpcr产物,缓慢放入0.5×tris-borate-edta缓冲区,最后设定程序120v,90ma电泳35min;
(ii)成像:将电泳结束的凝胶放入成像系统中成像,根据成像结果对应的mark区间,是否与引物大小相一致来判断基因的检出,并做好记录。
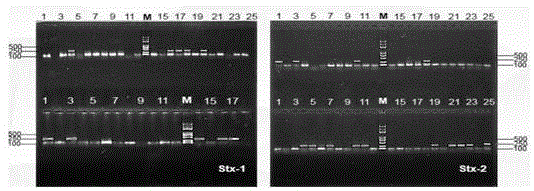
本发明pcr鉴定stec电泳图,如图3所示,阴性均未检出,阳性均有检出,分离的菌株扩增条带于阳性条带一致,故认为属于目标菌株。
本发明中进行pcr扩增stx1和stx2基因时,选择的引物序列及合成引物序列见表1,所有的引物均由北京奥科鼎盛有限公司合成。进行pcr扩增时的反应体系及反应条件见表2。
表1pcr扩增引物
表2pcr反应体系及反应条件
在进行pcr扩增时最重要的是退火温度和循环数,如果温度过高,特异性较强可能部分阳性菌株存在漏检,退火温度过低则特异性较强,可能出现假阳性;循环数过多可能产生引物二聚体,检测时间延长达不到快速检测的目的,循环数过低,目标条带较模糊,影响结果判断。
参加pcr反应的物质主要有五种即引物、酶、dntp、模板和mg2+:引物是pcr特异性反应的关键;酶浓度过高可引起非特异性扩增,浓度过低则合成产物量减少;dntp浓度过高可引起非特异性扩增,浓度过低则合成产物量减少;模板核酸的量与纯化程度,本研究为煮沸法制得模板,纯度及浓度较低,故选用5μl;mg2+浓度过高,反应特异性降低,出现非特异扩增,浓度过低会降低taqdna聚合酶的活性,使反应产物减少。
实施例1
牛粪中非o157产志贺毒素大肠埃希氏菌的分离鉴定方法,包括以下步骤:
s1,细菌选择培养:将采集的待测样本与ec肉汤培养基进行首次增菌,然后将增菌液以1:8的比例转移至新鲜的ec肉汤培养基进行二次增菌;
其中,首次增菌的具体方法为:将收集的样本称取后加入无菌ec肉汤,振荡均匀,然后培养,得到首次增菌液。其中,样本和无菌ec肉汤的质量比为1:8,振荡时间10s。
其中,二次增菌的具体方法为,将首次增菌液振荡均匀后,加入无菌ec肉汤,所述的首次增菌液与无菌ec肉汤的质量比为1:8,振荡均匀后进行培养。
首次增菌及二次增菌的培养温度都为41℃,将混匀的样本悬浮液放置摇床,在转速为180rpm的条件下,培养18h。
s2,stec分离:利用pcr扩增并结合麦康凯选择平板对s1中增菌后的细菌样本进行stec分离,具体步骤为:
s2.1,利用pcr扩增stec所共有的志贺毒素基因(stx1/2),然后经过凝胶电泳及成像,来判断牛粪样本中是否携带stec菌株,
s2.2,将s2.1中判断为阳性及疑似样本的菌液分别稀释涂布于麦康凯平板,然后在每个样本中挑取20个疑似菌落涂抹于lb平板四个区域,
s2.3,在s2.2中所述的四个区域中,每个区域5株菌混合并进行stx1/2基因扩增,根据凝胶电泳及成像来判断每个区域中的5个菌落中是否存在产志贺毒素菌株,所述基因扩增采用pcr扩增方法。
s2.4,经s2.3检测判断为阳性的区域,则继续将该阳性区域中的每株菌进行stx1/2基因扩增,进而判断哪个菌落为产志贺毒素菌株;所述基因扩增采用pcr扩增方法。
在进行s2.2中的涂布菌液时,阳性及疑似样本的稀释倍数是10-4,10-5和10-6,涂布量为48μl,
在具体涂布的时候,将稀释后的菌液滴于麦康凯平板的五个区域,五个区域分别为:左上,左下,右上,右下和中部区域。涂布滴加菌液五个区域,目的是将菌液均匀涂布;
所述的稀释涂布的具体方法为:
(1)将阳性及疑似样本用涡旋振荡器振荡10s;
(2)取1ml阳性及疑似样本于1.5mlep管中;
(3)取100μl菌悬液于900μl无菌ddh2o,涡旋振荡10~20s使其混匀,制成10-1倍稀释液;
(4)以此类推制成10-2,10-3,10-4,10-5,10-6和10-7倍稀释液;
(5)取48μl10-4,10-5和10-6倍稀释液滴于麦康凯平板的五个区域(五个区域分别为:左上,左下,右上,右下和中部区域),然后用涂布棒均匀涂开;
(6)待平板静置10min后,放置37℃恒温培养箱培养18h;
(7)挑取菌落数30~300范围内,且菌落颜色为粉红色或紫红色的平板进行之后试验。
其中所有的dna模板均是通过煮沸法制得;
其中,菌落挑取具体操作为:选取菌落数在30~300之间的麦康凯平板进行挑菌,一个样本挑取一个平板,将该平板用十字线划分为四个区域。四个区域分别为:左上,左下,右上和右下。十字线划分四个区域,目的是提高目的菌株的挑取概率,每个区域挑取5个单菌落于lb平板对应的四个区域,区域编号为1,2,3和4。
在混合区域扩增具体操作为:将lb平板每个区域的5株菌,分别用牙签挑取少量的菌体涮于含无菌ddh2o的一只ep管中,煮沸法制得dna模板,然后进行pcr扩增。
其中,pcr扩增使用的dna模板通过煮沸法制得。
s3,stec鉴定:将s2中分离得到的阳性单克隆菌株活化于lb平板,然后对活化的菌株进行stx1/2基因扩增、凝胶电泳及成像,显示阳性的,即为stec菌株;
s3.1,对已经确定的阳性区域进行单克隆菌株鉴定,具体步骤为:
s3.1.1对经s2中鉴定为阳性区域的5个单克隆菌落进行编号;用无菌牙签取少量的菌体涮于500μl的无菌ddh2o,并做好编号;
s3.1.2涡旋振荡10s,13000rpm离心5min,弃去上清,重复两次;将清洗两次的菌体,加入300μl的无菌ddh2o,吹吸混匀,并涡旋振荡10s;
s3.1.3将准备好的菌悬液放入事前预热好的金属加热器,100℃加热煮沸15min,然后将煮沸后的菌液于4℃冰箱放置5min;
s3.1.4将煮沸冷却后的菌液与离心机,13000rpm离心10min,吸取200μl上清即为dna模板,然后进行pcr扩增操作,若模板不立即使用,保存于-20℃冰箱中;
s3.2,进行stec鉴定:将扩增得到的阳性的单克隆菌株活化于lb平板,37℃恒温培养箱培养18h,并利用pcr扩增stx1/2基因,来确定得到的即为产志贺毒素大肠埃希氏菌。
s4,stec保藏,对pcr鉴定为stec的菌株进行菌种保藏。具体操作为:用棉签将菌体涮于装有1.2ml40%lb-甘油的冻存管中,于-80℃冰箱进行保存。
本方法中,所述的dna模板的制备方法为:
(1)将金属加热器开至100℃,稳定30min;
(2)取1ml二次增菌液于1.5mlep管中13000rpm离心5min,弃上清;
(3)加500μl无菌ddh2o将菌体沉淀重悬,13000rpm离心5min,弃去上清,重复两次;
(4)将清洗两次的菌体,加300μl无菌ddh2o重悬并用涡旋振荡器振荡10~20s;
(5)将准备好的菌悬液放入事前预热好的金属加热器,加热煮沸15min;
(6)将煮沸后的菌液于4℃冰箱放置5min;
(7)将冷却后煮沸的菌液与离心机13000rpm离心10min,吸取200μl上清即为dna模板,若模板不立即使用,保存于-20℃冰箱中。
本方法中在进行所述的pcr扩增时,反应体系和反应条件如下:pcr反应体系:dna模板5μl,10×pcrbuffer2.5μl,mgcl21.5μl,dntp2μl,taqdna聚合酶0.125μl,上下游引物各为0.3μl,ddh2o13.275μl。pcr反应条件:95℃预变性5min;94℃变性30s、58℃退火30s、72℃延伸45s,30个循环;72℃终延伸10min,4℃保存。
本方法中所述的pcr扩增操作的具体步骤为,
(a)按照反应体系和样本数量计算试剂总用量(注:通常多算1-2个样的体系)
(b)混合体系的配制:试剂全部溶解后,振荡混匀。根据反应体系按步加入,混匀并且离心,置于冰盒上备用;
(c)分装:将pcr管和已配好的体系都置于冰上,先加入事先配好的体系20μl,然后将5μldna模板加入对应标号的pcr管中,记录编号;
(d)pcr扩增:将pcr管管壁上的溶液进行短暂离心,小心取出,按顺序放入pcr仪,再次确认每个pcr管盖子已盖好。设定pcr程序进行扩增。
本方法中采用的所述的凝胶电泳及成像方法的具体操作步骤为:
(i)电泳:配制1%琼脂糖,微波煮沸三次,待冷却到50℃,加入eb染料混匀,缓慢的倒入事先插好梳子的胶板,半小时后拔出梳子,然后每孔上样5μlpcr产物,缓慢放入0.5×tris-borate-edta缓冲区,最后设定程序120v,90ma电泳35min;
(ii)成像:将电泳结束的凝胶放入成像系统中成像,根据成像结果对应的mark区间,是否与引物大小相一致来判断基因的检出,并做好记录。
实施例2
牛粪中非o157产志贺毒素大肠埃希氏菌的分离鉴定方法,包括以下步骤:
s1,细菌选择培养:将采集的待测样本与ec肉汤培养基进行首次增菌,然后将增菌液以1:8~12的比例转移至新鲜的ec肉汤培养基进行二次增菌;
其中,首次增菌的具体方法为:将收集的样本称取后加入无菌ec肉汤,振荡均匀,然后培养,得到首次增菌液。其中,样本和无菌ec肉汤的质量比为1:12,振荡时间20s。
其中,二次增菌的具体方法为,将首次增菌液振荡均匀后,加入无菌ec肉汤,所述的首次增菌液与无菌ec肉汤的质量比为1:12,振荡均匀后进行培养。
首次增菌及二次增菌的培养温度都为43℃,将混匀的样本悬浮液放置摇床,在转速为200rpm的条件下,培养24h。
s2,stec分离:利用pcr扩增并结合麦康凯选择平板对s1中增菌后的细菌样本进行stec分离,具体步骤为:
s2.1,利用pcr扩增stec所共有的志贺毒素基因(stx1/2),来判断牛粪样本中是否携带stec菌株,
s2.2,将s2.1中判断为阳性及疑似样本的菌液分别稀释涂布于麦康凯平板,然后在每个样本中挑取20个疑似菌落涂抹于lb平板四个区域,
s2.3,在s2.2中所述的四个区域中,每个区域5株菌混合进行stx1/2基因扩增,根据凝胶电泳检及成像来判断每个区域中的5个菌落中是否存在产志贺毒素菌株,
s2.4,经s2.3判断为阳性的区域,则继续将该阳性区域中的每株菌进行stx1/2基因扩增,进而判断哪个菌落为产志贺毒素菌株。
在进行s2.2中的涂布菌液时,阳性及疑似样本的稀释倍数是10-4,10-5和10-6,涂布量为52μl,在具体涂布的时候,将稀释后的菌液滴于麦康凯平板的五个区域,五个区域分别为:左上,左下,右上,右下和中部区域。涂布滴加菌液五个区域,目的是将菌液均匀涂布;
所述的稀释涂布的具体方法为:
(1)将阳性及疑似样本用涡旋振荡器振荡20s;
(2)取1ml阳性及疑似样本于1.5mlep管中;
(3)取100μl菌悬液于900μl无菌ddh2o,涡旋振荡10~20s使其混匀,制成10-1倍稀释液;
(4)以此类推制成10-2,10-3,10-4,10-5,10-6和10-7倍稀释液;
(5)取48~52μl10-4,10-5和10-6倍稀释液滴于麦康凯平板的五个区域(五个区域分别为:左上,左下,右上,右下和中部区域),然后用涂布棒均匀涂开;
(6)待平板静置10min后,放置37℃恒温培养箱培养24h;
(7)挑取菌落数30~300,且菌落颜色为粉红色或紫红色的平板进行之后试验。
其中所有的dna模板均是通过煮沸法制得;
其中,菌落挑取具体操作为:选取落数在30~300之间的麦康凯平板进行挑菌,一个样本挑取一个平板,将该平板用十字线划分为四个区域。四个区域分别为:左上,左下,右上和右下。十字线划分四个区域,目的是提高目的菌株的挑取概率,每个区域挑取5个单菌落于lb平板对应的四个区域,区域编号为1,2,3和4。
在混合区域扩增具体操作为:将lb平板每个区域的5株菌,分别用牙签挑取少量的菌体涮于含无菌ddh2o的一只ep管中,煮沸法制得dna模板,然后进行pcr扩增。
其中,pcr扩增使用的dna模板通过煮沸法制得。
s3,对s2中分离得到的阳性单克隆菌株活化于lb平板,然后对活化的菌株进行stx1/2基因扩增、凝胶电泳及成像,显示阳性的,即为stec菌株;
s3.1,对已经确定的阳性区域进行单克隆菌株鉴定,具体步骤为:
s3.1.1对经s2中鉴定为阳性区域的5个单克隆菌落进行编号;用无菌牙签取少量的菌体涮于500μl的无菌ddh2o,并做好编号;
s3.1.2涡旋振荡20s,13000rpm离心5min,弃去上清,重复两次;将清洗两次的菌体,加入300μl的无菌ddh2o,吹吸混匀,并涡旋振荡20s;
s3.1.3将准备好的菌悬液放入事前预热好的金属加热器,100℃加热煮沸15min,然后将煮沸后的菌液于4℃冰箱放置5min;
s3.1.4将冷却后煮沸的菌液与离心机,13000rpm离心10min,吸取200μl上清即为pcr模板,然后进行pcr扩增操作,若模板不立即使用,保存于-20℃冰箱中;
s3.2,进行stec鉴定:将扩增得到的阳性的单克隆菌株活化于lb平板,37℃恒温培养箱培养18~24h,并利用pcr扩增stx1/2基因,来确定得到的即为产志贺毒素大肠埃希氏菌。
s4,stec保藏,对pcr鉴定为stec的菌株进行菌种保藏。具体操作为:用棉签将菌体涮于装有1.2ml40%lb-甘油的冻存管中,于-80℃冰箱进行保存。
本方法中,所述的dna模板的制备方法为:
(1)将金属加热器开至100℃,稳定30min;
(2)取1ml二次增菌液于1.5mlep管中13000rpm离心5min,弃上清;
(3)加500μl无菌ddh2o将菌体沉淀重悬,13000rpm离心5min,弃去上清,重复两次;
(4)将清洗两次的菌体,加300μl无菌ddh2o重悬并用涡旋振荡器振荡20s;
(5)将准备好的菌悬液放入事前预热好的金属加热器,加热煮沸15min;
(6)将煮沸后的菌液于4℃冰箱放置5min;
(7)将冷却后煮沸的菌液与离心机13000rpm离心10min,吸取200μl上清即为dna模板,若模板不立即使用,保存于-20℃冰箱中。
本方法中在进行所述的pcr扩增时,反应体系和反应条件如下:pcr反应体系:dna模板5μl,10×pcrbuffer2.5μl,mgcl21.5μl,dntp2μl,taqdna聚合酶0.125μl,上下游引物各为0.3μl,ddh2o13.275μl。pcr反应条件:95℃预变性5min;94℃变性30s、58℃退火30s、72℃延伸45s,30个循环;72℃终延伸10min,4℃保存。
本方法中所述的pcr扩增操作的具体步骤为,
(a)按照反应体系和样本数量计算试剂总用量(注:通常多算1-2个样的体系)
(b)混合体系的配制:试剂全部溶解后,振荡混匀。根据反应体系按步加入,混匀并且离心,置于冰盒上备用;
(c)分装:将pcr管和已配好的体系都置于冰上,先加入事先配好的体系20μl,然后将5μldna模板加入对应标号的pcr管中,记录编号;
(d)pcr扩增:将pcr管管壁上的溶液进行短暂离心,小心取出,按顺序放入pcr仪,再次确认每个pcr管盖子已盖好。设定pcr程序进行扩增。
本方法中采用的所述的凝胶电泳及成像方法的具体操作步骤为:
(i)电泳:配制1%琼脂糖,微波煮沸三次,待冷却到50℃,加入eb染料混匀,缓慢的倒入事先插好梳子的胶板,半小时后拔出梳子,然后每孔上样5μlpcr产物,缓慢放入0.5×tris-borate-edta缓冲区,最后设定程序120v,90ma电泳35min;
(ii)成像:将电泳结束的凝胶放入成像系统中成像,根据成像结果对应的mark区间,是否与引物大小相一致来判断基因的检出,并做好记录。
实施例3
牛粪中非o157产志贺毒素大肠埃希氏菌的分离鉴定方法,包括以下步骤:
s1,细菌选择培养:将采集的待测样本与ec肉汤培养基进行首次增菌,然后将增菌液以1:8~12的比例转移至新鲜的ec肉汤培养基进行二次增菌;
其中,首次增菌的具体方法为:将收集的样本称取后加入无菌ec肉汤,振荡均匀,然后培养,得到首次增菌液。其中,样本和无菌ec肉汤的质量比为1:10,振荡时间15s。
其中,二次增菌的具体方法为,将首次增菌液振荡均匀后,加入无菌ec肉汤,所述的首次增菌液与无菌ec肉汤的质量比为1:10,振荡均匀后进行培养。
首次增菌及二次增菌的培养温度都为42℃,将混匀的样本悬浮液放置摇床,在转速为190rpm的条件下,培养21h。
s2,stec分离:利用pcr扩增并结合麦康凯选择平板对s1中增菌后的细菌样本进行stec分离,具体步骤为:
s2.1,利用pcr扩增stec所共有的志贺毒素基因(stx1/2),来判断牛粪样本中是否携带stec菌株,
s2.2,将s2.1中判断为阳性及疑似样本的菌液分别稀释涂布于麦康凯平板上,然后在每个样本中挑取20个疑似菌落涂抹于lb平板四个区域,
s2.3,在s2.2中所述的四个区域中,每个区域5株菌混合进行stx1/2基因扩增,根据凝胶电泳及成像来判断每个区域中的5个菌落中是否存在产志贺毒素菌株,
s2.4,经s2.3检测判断为阳性的区域,则继续将该阳性区域中的每株菌进行stx1/2基因扩增,进而判断哪个菌落为产志贺毒素菌株。
在进行s2.2中的涂布菌液时,阳性及疑似样本的稀释倍数是10-4,10-5和10-6,涂布量为50μl,在具体涂布的时候,将稀释后的菌液滴于麦康凯平板的五个区域,五个区域分别为:左上,左下,右上,右下和中部区域。涂布滴加菌液五个区域,目的是将菌液均匀涂布;
所述的稀释涂布的具体方法为:
(1)将阳性及疑似样本用涡旋振荡器振荡15s;
(2)取1ml阳性及疑似样本于1.5mlep管中;
(3)取100μl菌悬液于900μl无菌ddh2o,涡旋振荡15s使其混匀,制成10-1倍稀释液;
(4)以此类推制成10-2,10-3,10-4,10-5,10-6和10-7倍稀释液;
(5)取50μl10-4,10-5和10-6倍稀释液滴于麦康凯平板的五个区域(五个区域分别为:左上,左下,右上,右下和中部区域),然后用涂布棒均匀涂开;
(6)待平板静置10min后,放置37℃恒温培养箱培养21h;
(7)挑取菌落数30~300,且菌落颜色为粉红色或紫红色的平板进行之后试验。
其中所有的dna模板均是通过煮沸法制得;
其中,菌落挑取具体操作为:选取落数在30~300之间的麦康凯平板进行挑菌,一个样本挑取一个平板,将该平板用十字线划分为四个区域。四个区域分别为:左上,左下,右上和右下。十字线划分四个区域,目的是提高目的菌株的挑取概率,每个区域挑取5个单菌落于lb平板对应的四个区域,区域编号为1,2,3和4。
在混合区域扩增具体操作为:将lb平板每个区域的5株菌,分别用牙签挑取少量的菌体涮于含无菌ddh2o的一只ep管中,煮沸法制得dna模板,然后进行pcr扩增。
其中,pcr扩增使用的dna模板通过煮沸法制得。
s3,对s2中分离得到的阳性单克隆菌株活化于lb平板,然后对活化的菌株进行stx1/2基因扩增、凝胶电泳及成像,显示阳性的,即为stec菌株;
s3.1,对已经确定的阳性区域进行单克隆菌株鉴定,具体步骤为:
s3.1.1对经s2中鉴定为阳性区域的5个单克隆菌落进行编号;用无菌牙签取少量的菌体涮于500μl的无菌ddh2o,并做好编号;
s3.1.2涡旋振荡10~20s,13000rpm离心5min,弃去上清,重复两次;将清洗两次的菌体,加入300μl的无菌ddh2o,吹吸混匀,并涡旋振荡15s;
s3.1.3将准备好的菌悬液放入事前预热好的金属加热器,100℃加热煮沸15min,然后将煮沸后的菌液于4℃冰箱放置5min;
s3.1.4将冷却后煮沸的菌液与离心机,13000rpm离心10min,吸取200μl上清即为pcr模板,然后进行pcr扩增操作,若模板不立即使用,保存于-20℃冰箱中;
s3.2,进行stec鉴定:将扩增后阳性的单克隆菌株活化于lb平板,37℃恒温培养箱培养18~24h,并利用pcr扩增stx1/2基因,来确定得到的即为产志贺毒素大肠埃希氏菌。
s4,stec保藏,对pcr鉴定为stec的菌株进行菌种保藏。具体操作为:用棉签将菌体涮于装有1.2ml40%lb-甘油的冻存管中,于-80℃冰箱进行保存。
本方法中,所述的dna模板的制备方法为:
(1)将金属加热器开至100℃,稳定30min;
(2)取1ml二次增菌液于1.5mlep管中13000rpm离心5min,弃上清;
(3)加500μl无菌ddh2o将菌体沉淀重悬,13000rpm离心5min,弃去上清,重复两次;
(4)将清洗两次的菌体,加300μl无菌ddh2o重悬并用涡旋振荡器振荡15s;
(5)将准备好的菌悬液放入事前预热好的金属加热器,加热煮沸15min;
(6)将煮沸后的菌液于4℃冰箱放置5min;
(7)将冷却后煮沸的菌液与离心机13000rpm离心10min,吸取200μl上清即为dna模板,若模板不立即使用,保存于-20℃冰箱中。
本方法中在进行所述的pcr扩增时,反应体系和反应条件如下:pcr反应体系:dna模板5μl,10×pcrbuffer2.5μl,mgcl21.5μl,dntp2μl,taqdna聚合酶0.125μl,上下游引物各为0.3μl,ddh2o13.275μl。pcr反应条件:95℃预变性5min;94℃变性30s、58℃退火30s、72℃延伸45s,30个循环;72℃终延伸10min,4℃保存。
本方法中所述的pcr扩增操作的具体步骤为,
(a)按照反应体系和样本数量计算试剂总用量(注:通常多算1-2个样的体系)
(b)混合体系的配制:试剂全部溶解后,振荡混匀。根据反应体系按步加入,混匀并且离心,置于冰盒上备用;
(c)分装:将pcr管和已配好的体系都置于冰上,先加入事先配好的体系20μl,然后将5μldna模板加入对应标号的pcr管中,记录编号;
(d)pcr扩增:将pcr管管壁上的溶液进行短暂离心,小心取出,按顺序放入pcr仪,再次确认每个pcr管盖子已盖好。设定pcr程序进行扩增。
本方法中采用的所述的凝胶电泳及成像方法的具体操作步骤为:
(i)电泳:配制1%琼脂糖,微波煮沸三次,待冷却到50℃,加入eb染料混匀,缓慢的倒入事先插好梳子的胶板,半小时后拔出梳子,然后每孔上样5μlpcr产物,缓慢放入0.5×tris-borate-edta缓冲区,最后设定程序120v,90ma电泳35min;
(ii)成像:将电泳结束的凝胶放入成像系统中成像,根据成像结果对应的mark区间,是否与引物大小相一致来判断基因的检出,并做好记录。
利用本发明方法对收集的样本进行stec菌株的分离,成功的在育成牛和犊牛的14份样本中,分离出了stec菌株,表3所示
表3stec菌株分离情况
综上所述,该方法可以准确地将stec菌株从牛粪样本中分离,并且操作简单,成本低。
现有技术中,对于牛粪样本中非o157产志贺毒素大肠埃希氏菌的分离鉴定还没有一个明确的方法,故本专利利用pcr扩增并结合麦康凯选择平板进行stec分离。通过增加二次增菌,降低培养液中牛粪样本杂质,提高dna纯度,进而减少对样本中stec菌株检测的影响。然后对阳性及疑似样本进行麦康可以凯平板稀释涂布。由于目标菌株在麦康凯平板菌落颜色为粉红或者紫红色,一方面再次对初筛的样本是否存在目标菌株进行验证,另一方面稀释涂布后的平板菌株分布均匀方便对菌株的挑取。此外,非目标菌株的大肠杆菌在麦康凯平板菌落颜色也为粉红或紫红色,通过增加菌落挑取量尽可能减少漏检的概率。然后对挑取的菌落进行分区域扩增,减少了工作量,为快速检测节约了时间。对扩增阳性的区域进行单克隆扩增。最后将阳性克隆株活化于lb平板,再次进行验证,提高了准确率。
本分离鉴定方法简单易操作,通过几次的扩增和鉴定筛选,能够将stec菌株成功分离,且平板混合阳性样本量与分离出的菌株数一致。由此说明本方法适用于目标菌株从牛粪样本中的分离。
以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对该实用进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
序列表
<110>西北农林科技大学
<120>牛粪中非o157产志贺毒素大肠埃希氏菌分离鉴定方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>25
<212>dna
<213>人工序列
<400>1
aaatcgccattcgttgactacttct25
<210>2
<211>25
<212>dna
<213>人工序列
<400>2
tgccattctggcaactcgcgatgca25
<210>3
<211>25
<212>dna
<213>人工序列
<400>3
cagtcgtcactcactggtttcatca25
<210>4
<211>24
<212>dna
<213>人工序列
<400>4
ggatattctccccactctgacacc24
- 还没有人留言评论。精彩留言会获得点赞!