一种利尿活性药物细胞筛选模型及其建立方法和应用与流程
本发明涉及药学领域,具体涉及一种利尿活性药物细胞筛选模型及其建立方法和应用。
背景技术:
根据现有文献报道,药物筛选指的是采用适当的方法,对可能作为药物使用的物质(采样)进行生物活性、药理作用及药用价值的评估过程。药物筛选是生化水平和细胞水平的筛选。
筛选模型就是在药物筛选实验中所应用的药理实验模型,由于药物筛选要求实验方案有标准化和定量化的特征,因而在传统药理实验中常见的动物实验在药物筛选中较少应用,根据实验模型的不同,药物筛选可以分为生化水平的筛选和细胞水平的筛选。细胞水平的药物筛选是更接近生理条件的一种药物筛选模型,其模型是拟设计药物作用的靶细胞,应用细胞培养技术获取所需细胞,将这些细胞与候选化合物相互作用,通过与生化水平筛选类似的检测技术测定化合物的作用能力,从而对化合物进行筛选。
当各种疾病原因引起排尿困难时就会借助药物治疗,以解决排尿难的问题,但如何筛选利尿活性的药物是医药界普遍关注的难题。
传统筛选利尿活性药物没有有效快捷的方法,如公开的文献:叶潇等,川木通对大鼠利尿作用及其物质基础研究[j].中国中药杂志,2019,44(09):1889-1894。郭林新等,三叶木通利尿活性部位筛选及其化学成分[j].中国实验方剂学杂志,2017,23(03):66-70。上述动物水利尿模型筛选方法成本较高,时间较长,不易操作。
为寻找时间周期短、成本较低的快捷的利尿药物筛选方法,本发明采用肾小管细胞模拟氯化钠转运的模型,来筛选利尿活性药物。并在石韦提取单体利尿活性筛选实验证明行之有效,为较为快捷的细胞模型利尿药物筛选模型。
技术实现要素:
本发明的目的是提供一种利尿活性药物细胞筛选模型的建立方法。
本发明的目的是提供一种利尿活性药物细胞筛选模型。
本发明的另一目的是提供的建立方法获得的模型在利尿活性药物中的应用。
本发明所述的一种利尿活性药物细胞筛选模型的建立方法包括以下步骤:1)mdck细胞的培养;2)药物的配制;3)nacl转运浓度的筛选;4)分组、给药与nacl转运实验;5)统计学分析。
本发明所述建立方法中的mdck细胞的培养具体为:购买mdck细胞株,用含5~15%胎牛血清、0.5~1.5%青霉素-链霉素溶液、85~95%的dmem高糖培养基,37℃、co2培养箱mdck细胞培养至对数生长期。
优选的,本发明所述建立方法中的mdck细胞的培养具体为:购买mdck细胞株,用含10%胎牛血清、1%青霉素-链霉素溶液、89%的dmem高糖培养基,37℃、co2培养箱mdck细胞培养至对数生长期;
本发明所述建立方法中的药物配制具体为:取nacl,dmem高糖培养基分别成0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1nacl备用,里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷和氢氯噻嗪用dmso助溶后,dmem高糖培养基分别稀释至100umol·l-1备用;
本发明所述建立方法中的nacl转运浓度的筛选具体为:取对数生长期mdck细胞体外培养,分为生理盐水组0.009g·ml-1和nacl不同浓度梯度组:分别为0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1共9个浓度梯度,取相应浓度nacl药液孵育mdck细胞3~10小时,mtt法检测细胞存活率,确定研究nacl转运的最佳nacl孵育浓度;
优选的,本发明所述建立方法中的nacl转运浓度的筛选具体为:取对数生长期mdck细胞体外培养,分为生理盐水组0.009g·ml-1和nacl不同浓度梯度组:分别为0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1共9个浓度梯度,取相应浓度nacl药液孵育mdck细胞8小时,mtt法检测细胞存活率,确定研究nacl转运的最佳nacl孵育浓度;
本发明所述建立方法中的分组、给药与nacl转运实验具体为:取transwell板,规格:0.4um孔径,24孔,12小室,在小室内每孔接种200ul·孔-1密度为4×105个·ml-1的mdck细胞,小室外每孔给予完全培养基1ml以适应细胞正常生长,细胞贴壁后,测定每孔电阻值,电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积,于37℃测得跨膜电阻值≥300ω·cm2,即可用于下一步实验;取符合实验要求的mdck细胞,随机分为模型组,给予dmem培养基、各石韦提取单体组100umol·l-1、氢氯噻嗪组100umol·l-1,每组3个复孔,37℃二氧化碳培养箱培养20~28h,20~28h后吸弃小室内液体。于transwell板小室内给予含nacl0.015g·ml-1的dmem继续培养,分别于30min、1h、2h、4h分别取小室外液体50ul,酶标仪检测氯离子、尿素吸光度。
优选的,本发明所述建立方法中的分组、给药与nacl转运实验具体为:取transwell板,规格:0.4um孔径,24孔,12小室,在小室内每孔接种200ul·孔-1密度为4×105个·ml-1的mdck细胞,小室外每孔给予完全培养基1ml以适应细胞正常生长,细胞贴壁后,测定每孔电阻值,电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积,于37℃测得跨膜电阻值≥300ω·cm2,即可用于下一步实验;取符合实验要求的mdck细胞,随机分为模型组,给予dmem培养基、各石韦提取单体组100umol·l-1、氢氯噻嗪组100umol·l-1,每组3个复孔,37℃二氧化碳培养箱培养24h,24h后吸弃小室内液体,于transwell板小室内给予含nacl0.015g·ml-1或含尿素15mmol·l-1的dmem继续培养,分别于30min、1h、2h、4h分别取小室外液体50ul,酶标仪检测氯离子、尿素吸光度。
本发明所述建立方法中的统计学分析具体为:实验结果均服从正态分布,数据以x±s表示,采用spss18.0统计软件进行单因素方差分析,p<0.05认为实验结果具有统计学意义。
本发明所述建立方法所得的模型具体为:
1)mdck细胞的培养
购买madin-dabycaninekidneycells(mdck)细胞株,用含10%胎牛血清、1%青霉素-链霉素溶液、89%的dmem高糖培养基,37℃、co2培养箱mdck细胞培养至对数生长期;
2)药物的配制
取nacl,dmem高糖培养基分别成0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1nacl备用;里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷和氢氯噻嗪用dmso助溶后,dmem高糖培养基分别稀释至100umol·l-1备用。
3)nacl转运浓度
取对数生长期mdck细胞体外培养,分为生理盐水组0.015g·ml-1浓度nacl药液孵育mdck细胞8小时,mtt法检测细胞存活率。
4)分组、给药与nacl转运
取transwell板(0.4um孔径,24孔,12小室),在小室内每孔接种200ul·孔-1密度为4×105个·ml-1的mdck细胞,小室外每孔给予完全培养基1ml以适应细胞正常生长。细胞贴壁后,测定每孔电阻值。电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积,于37℃测得跨膜电阻值≥300ω·cm2;
取符合实验要求的mdck细胞,随机分为模型组(给予dmem培养基)、各石韦提取单体组(100umol·l-1)、氢氯噻嗪组(100umol·l-1),每组3个复孔,37℃二氧化碳培养箱培养24h。24h后吸弃小室内液体。于transwell板小室内给予含nacl0.015g·ml-1或含尿素15mmol·l-1的dmem继续培养,于4h以内取小室外液体50ul,酶标仪检测氯离子、尿素吸光度。
5)统计学分析
实验结果均服从正态分布,数据以
本发明所述的任一项建立方法获得的模型在利尿活性药物中的应用。
本发明的原理:利用长满mdck细胞的transwell板小室,模拟体内肾小管上皮细胞的肾小管环境,于细胞贴壁测给予一定浓度的氯化钠,检测对侧氯化钠浓度,具有利尿活性的药物应会抑制氯化钠的重吸收,表现出给予氯化钠的对侧氯离子、钠离子浓度的降低,从而使得肾小管管腔小管液渗透压升高,水分顺浓度梯度流入肾小管管腔产生利尿作用。
发明团队从石韦中提取分离了里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷等18种单体化合物,并用此方法进行了利尿活性的筛选。
mdck是madin-dabycaninekidneycells的简称。
本发明权利要求1所述建立方法中的统计学分析具体为:实验结果均服从正态分布,数据以
本发明所述的青霉素-链霉素溶液中青霉素浓度为10000iu/ml、链霉素的浓度为10mg/ml。
电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积。
有益效果:
1、本方法采用肾小管细胞模拟氯化钠转运的模型,来筛选利尿活性药物,并在石韦提取单体利尿活性筛选实验证明行之有效,为较为快捷的细胞模型利尿药物筛选模型。
2、本发明通过nacl转运浓度的筛选实验,筛选了建模的最佳方案即nacl浓度为0.015g·ml-1,孵育时间为4小时以内,该条件下既能使mdck细胞两侧维持一定的nacl浓度梯度,又不影响细胞活性。
3、本发明通过不同时间点里白烯等石韦提取单体和氢氯噻嗪对cl-转运影响试验证实在给氯化钠孵育30min后,于给氯化钠的细胞对侧取各组细胞培养液各50微升,进行氯离子检测:与模型组没有给药的mdck细胞相比,(23e)-cycloart-23-ene-3β,25-diol组的氯离子浓度显著降低(p<0.05)。显示出(23e)-cycloart-23-ene-3β,25-diol组具有抑制氯离子跨细胞转运的作用。在给氯化钠孵育2小时后,于给氯化钠的细胞对侧取各组细胞培养液各50微升,进行氯离子检测:与正常组没有给药的mdck细胞相比,里白烯组和氢氯噻嗪组的氯离子浓度显著降低(p<0.05)。
4、本发明通过不同时间点里白烯等石韦提取单体和氢氯噻嗪对na+转运影响试验证实,在给氯化钠孵育30min后,于给氯化钠的细胞对侧取各组细胞培养液各50微升,进行钠离子检测:与模型组没有给药的mdck细胞相比,氢氯噻嗪组、β-谷甾醇组的细胞培养液中钠离子浓度显著降低(p<0.05),显示氢氯噻嗪组、β-谷甾醇组具有抑制钠离子跨细胞转运的作用。在给氯化钠孵育4小时后,于给氯化钠的细胞对侧取各组细胞培养液各50微升,进行钠离子检测:与正常组没有给药的mdck细胞相比,各组钠离子浓度均无显著性差异。
附图说明
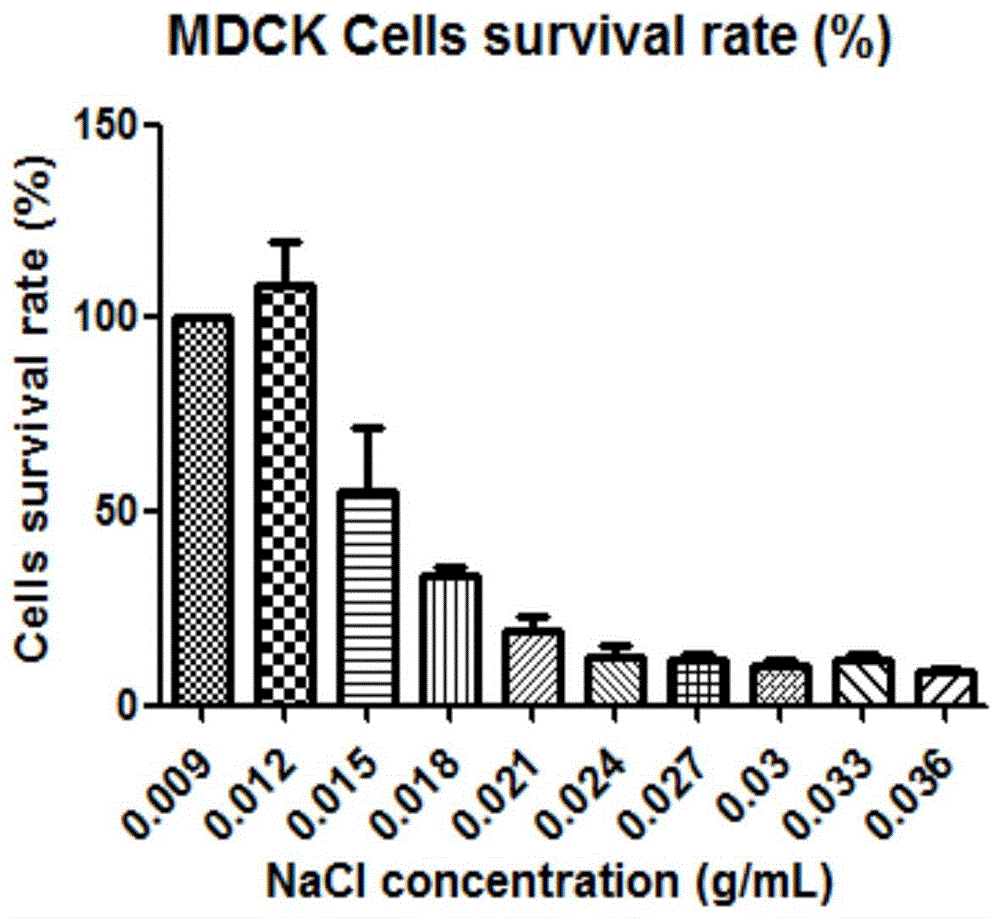
图1不同浓度nacl孵育对mdck细胞存活率的影响(%)。
具体实施方式
下面通过具体实施例,对本发明的技术方案作进一步地具体说明。
实施例1
利尿活性药物细胞筛选模型的建立方法
1、mdck细胞的培养
购买madin-dabycaninekidneycells(mdck)细胞株,用含5%胎牛血清、0.5%青霉素-链霉素溶液、94.5%的dmem高糖培养基,37℃、co2培养箱mdck细胞培养至对数生长期。
2、药物的配制
取nacl,dmem高糖培养基分别成0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1nacl备用。里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷和氢氯噻嗪用dmso助溶后,dmem高糖培养基分别稀释至100umol·l-1备用。
3、nacl转运浓度的筛选
取对数生长期mdck细胞体外培养,分为生理盐水组(0.009g·ml-1)和nacl不同浓度梯度组(分别为0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1共9个浓度梯度),取相应浓度nacl药液孵育mdck细胞3小时,mtt法检测细胞存活率,确定研究nacl转运的最佳nacl孵育浓度。
4、分组、给药与nacl转运实验
取transwell板(0.4um孔径,24孔,12小室),在小室内每孔接种200ul·孔-1密度为4×105个·ml-1的mdck细胞,小室外每孔给予完全培养基1ml以适应细胞正常生长。细胞贴壁后,测定每孔电阻值。电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积,于37℃测得跨膜电阻值≥300ω·cm2,即可用于下一步实验。
取符合实验要求的mdck细胞,随机分为模型组(给予dmem培养基)、各石韦提取单体组(100umol·l-1)、氢氯噻嗪组(100umol·l-1),每组3个复孔,37℃二氧化碳培养箱培养20h,20h后吸弃小室内液体。于transwell板小室内给予含nacl0.015g·ml-1或含尿素15mmol·l-1的dmem继续培养,分别于30min、1h、2h、4h分别取小室外液体50ul,酶标仪检测氯离子、尿素吸光度。
5、统计学分析
实验结果均服从正态分布,数据以
实施例2
利尿活性药物细胞筛选模型的建立方法
1、mdck细胞的培养
购买madin-dabycaninekidneycells(mdck)细胞株,用含15%胎牛血清、1.5%青霉素-链霉素溶液、83.5%的dmem高糖培养基,37℃、co2培养箱mdck细胞培养至对数生长期。
2、药物的配制
取nacl,dmem高糖培养基分别成0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1nacl备用。里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷和氢氯噻嗪用dmso助溶后,dmem高糖培养基分别稀释至100umol·l-1备用。
3、nacl转运浓度的筛选
取对数生长期mdck细胞体外培养,分为生理盐水组(0.009g·ml-1)和nacl不同浓度梯度组(分别为0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1共9个浓度梯度),取相应浓度nacl药液孵育mdck细胞10小时,mtt法检测细胞存活率,确定研究nacl转运的最佳nacl孵育浓度。
4、分组、给药与nacl转运实验
取transwell板(0.4um孔径,24孔,12小室),在小室内每孔接种200ul·孔-1密度为4×105个·ml-1的mdck细胞,小室外每孔给予完全培养基1ml以适应细胞正常生长。细胞贴壁后,测定每孔电阻值。电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积,于37℃测得跨膜电阻值≥300ω·cm2,即可用于下一步实验。
取符合实验要求的mdck细胞,随机分为模型组(给予dmem培养基)、各石韦提取单体组(100umol·l-1)、氢氯噻嗪组(100umol·l-1),每组3个复孔,37℃二氧化碳培养箱培养28h,28h后吸弃小室内液体。于transwell板小室内给予含nacl0.015g·ml-1或含尿素15mmol·l-1的dmem继续培养,分别于30min、1h、2h、4h分别取小室外液体50ul,酶标仪检测氯离子、尿素吸光度。
5、统计学分析
实验结果均服从正态分布,数据以
实施例3
利尿活性药物细胞筛选模型的建立方法
1、mdck细胞的培养
购买madin-dabycaninekidneycells(mdck)细胞株,用含12.3%胎牛血清、0.7%青霉素-链霉素溶液、87%的dmem高糖培养基,37℃、co2培养箱mdck细胞培养至对数生长期。
2、药物的配制
取nacl,dmem高糖培养基分别成0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1nacl备用。里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷和氢氯噻嗪用dmso助溶后,dmem高糖培养基分别稀释至100umol·l-1备用。
3、nacl转运浓度的筛选
取对数生长期mdck细胞体外培养,分为生理盐水组(0.009g·ml-1)和nacl不同浓度梯度组(分别为0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1共9个浓度梯度),取相应浓度nacl药液孵育mdck细胞7小时,mtt法检测细胞存活率,确定研究nacl转运的最佳nacl孵育浓度。
4、分组、给药与nacl转运实验
取transwell板(0.4um孔径,24孔,12小室),在小室内每孔接种200ul·孔-1密度为4×105个·ml-1的mdck细胞,小室外每孔给予完全培养基1ml以适应细胞正常生长。细胞贴壁后,测定每孔电阻值。电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积,于37℃测得跨膜电阻值≥300ω·cm2,即可用于下一步实验。
取符合实验要求的mdck细胞,随机分为模型组(给予dmem培养基)、各石韦提取单体组(100umol·l-1)、氢氯噻嗪组(100umol·l-1),每组3个复孔,37℃二氧化碳培养箱培养22h,22h后吸弃小室内液体。于transwell板小室内给予含nacl0.015g·ml-1或含尿素15mmol·l-1的dmem继续培养,分别于30min、1h、2h、4h分别取小室外液体50ul,酶标仪检测氯离子、尿素吸光度。
5、统计学分析
实验结果均服从正态分布,数据以
实施例4
利尿活性药物细胞筛选模型的建立方法
1、mdck细胞的培养
购买madin-dabycaninekidneycells(mdck)细胞株,用含6.7%胎牛血清、1.3%青霉素-链霉素溶液、92%的dmem高糖培养基,37℃、co2培养箱mdck细胞培养至对数生长期。
2、药物的配制
取nacl,dmem高糖培养基分别成0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1nacl备用。里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷和氢氯噻嗪用dmso助溶后,dmem高糖培养基分别稀释至100umol·l-1备用。
3、nacl转运浓度的筛选
取对数生长期mdck细胞体外培养,分为生理盐水组(0.009g·ml-1)和nacl不同浓度梯度组(分别为0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1共9个浓度梯度),取相应浓度nacl药液孵育mdck细胞9小时,mtt法检测细胞存活率,确定研究nacl转运的最佳nacl孵育浓度。
4、分组、给药与nacl转运实验
取transwell板(0.4um孔径,24孔,12小室),在小室内每孔接种200ul·孔-1密度为4×105个·ml-1的mdck细胞,小室外每孔给予完全培养基1ml以适应细胞正常生长。细胞贴壁后,测定每孔电阻值。电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积,于37℃测得跨膜电阻值≥300ω·cm2,即可用于下一步实验。
取符合实验要求的mdck细胞,随机分为模型组(给予dmem培养基)、各石韦提取单体组(100umol·l-1)、氢氯噻嗪组(100umol·l-1),每组3个复孔,37℃二氧化碳培养箱培养26h,26h后吸弃小室内液体。于transwell板小室内给予含nacl0.015g·ml-1或含尿素15mmol·l-1的dmem继续培养,分别于30min、1h、2h、4h分别取小室外液体50ul,酶标仪检测氯离子、尿素吸光度。
5、统计学分析
实验结果均服从正态分布,数据以
实施例5
利尿活性药物细胞筛选模型的建立方法
1、mdck细胞的培养
购买madin-dabycaninekidneycells(mdck)细胞株,用含10%胎牛血清、1%青霉素-链霉素溶液、89%的dmem高糖培养基,37℃、co2培养箱mdck细胞培养至对数生长期。
2、药物的配制
取nacl,dmem高糖培养基分别成0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1nacl备用。里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷和氢氯噻嗪用dmso助溶后,dmem高糖培养基分别稀释至100umol·l-1备用。
3、nacl转运浓度的筛选
取对数生长期mdck细胞体外培养,分为生理盐水组(0.009g·ml-1)和nacl不同浓度梯度组(分别为0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1共9个浓度梯度),取相应浓度nacl药液孵育mdck细胞8小时,mtt法检测细胞存活率,确定研究nacl转运的最佳nacl孵育浓度。
4、分组、给药与nacl转运实验
取transwell板(0.4um孔径,24孔,12小室),在小室内每孔接种200ul·孔-1密度为4×105个·ml-1的mdck细胞,小室外每孔给予完全培养基1ml以适应细胞正常生长。细胞贴壁后,测定每孔电阻值。电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积,于37℃测得跨膜电阻值≥300ω·cm2,即可用于下一步实验。
取符合实验要求的mdck细胞,随机分为模型组(给予dmem培养基)、各石韦提取单体组(100umol·l-1)、氢氯噻嗪组(100umol·l-1),每组3个复孔,37℃二氧化碳培养箱培养24h。24h后吸弃小室内液体。于transwell板小室内给予含nacl0.015g·ml-1或含尿素15mmol·l-1的dmem继续培养,分别于30min、1h、2h、4h分别取小室外液体50ul,酶标仪检测氯离子、尿素吸光度。
5、统计学分析
实验结果均服从正态分布,数据以
实施例6
利尿活性药物细胞筛选模型
1)mdck细胞的培养
购买madin-dabycaninekidneycells(mdck)细胞株,用含10%胎牛血清、1%青霉素-链霉素溶液、89%的dmem高糖培养基,37℃、co2培养箱mdck细胞培养至对数生长期;
2)药物的配制
取nacl,dmem高糖培养基分别成0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1nacl备用;里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷和氢氯噻嗪用dmso助溶后,dmem高糖培养基分别稀释至100umol·l-1备用。
3)nacl转运浓度
取对数生长期mdck细胞体外培养,分为生理盐水组0.015g·ml-1浓度nacl药液孵育mdck细胞4小时,mtt法检测细胞存活率。
4、分组、给药与nacl转运
取transwell板(0.4um孔径,24孔,12小室),在小室内每孔接种200ul·孔-1密度为4×105个·ml-1的mdck细胞,小室外每孔给予完全培养基1ml以适应细胞正常生长。细胞贴壁后,测定每孔电阻值。电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积,于37℃测得跨膜电阻值≥300ω·cm2;
取符合实验要求的mdck细胞,随机分为模型组(给予dmem培养基)、各石韦提取单体组(100umol·l-1)、氢氯噻嗪组(100umol·l-1),每组3个复孔,37℃二氧化碳培养箱培养24h。24h后吸弃小室内液体。于transwell板小室内给予含nacl0.015g·ml-1或含尿素15mmol·l-1的dmem继续培养,于4h以内取小室外液体50ul,酶标仪检测氯离子、尿素吸光度。
5、统计学分析
实验结果均服从正态分布,数据以
本发明团队通过以下试验筛选本发明的最佳方案及证实其有益效果,具体如下:
传统筛选利尿活性药物没有有效快捷的方法,常用的为动物水利尿模型筛选方法,该方法成本较高,时间较长,不易操作。为寻找时间周期短、成本较低的快捷的利尿药物筛选方法,本方法采用肾小管细胞模拟氯化钠转运的模型,来筛选利尿活性药物。并在石韦提取单体利尿活性筛选实验证明行之有效。为较为快捷的细胞模型利尿药物筛选模型。
原理:利用长满mdck细胞的transwell板小室,模拟体内肾小管上皮细胞的肾小管环境,于细胞贴壁测给予一定浓度的氯化钠,检测对侧氯化钠浓度,具有利尿活性的药物应会抑制氯化钠的重吸收,表现出给予氯化钠的对侧氯离子、钠离子浓度的降低,从而使得肾小管管腔小管液渗透压升高,水分顺浓度梯度流入肾小管管腔产生利尿作用。
我们从石韦中提取分离了里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷等单体化合物,并用此方法进行了利尿活性的筛选。
1.实验方法
1.1mdck细胞的培养
购买madin-dabycaninekidneycells(mdck)细胞株,用含10%胎牛血清、1%penicillin-streptomycinsolution、89%的dmem高糖培养基,37℃、co2培养箱mdck细胞培养至对数生长期。
1.2药物的配制
取nacl,dmem高糖培养基分别成0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1nacl备用。里白烯、22-羟基何伯烷、β-谷甾醇、cycloeucalenone、泽屋萜、dryocrassol、hopan-28,22-olide、齐墩果酸、22,28-epoxyhopane、cyclohopenol、cycloeucalenol、木栓酮、(23e)-cycloart-23-ene-3β,25-diol、(23e)-cycloart-23,25-ene-3β-ol、cyclolaudenol、11-羰基-β-乙酰乳香酸、2',3'-dihydroxypropylpentadecanoate、β-胡萝卜苷和氢氯噻嗪用dmso助溶后,dmem高糖培养基分别稀释至100umol·l-1备用。
1.3nacl转运浓度的筛选
取对数生长期mdck细胞体外培养,分为生理盐水组(0.009g·ml-1)和nacl不同浓度梯度组(分别为0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1共9个浓度梯度),取相应浓度nacl药液孵育mdck细胞8小时,mtt法检测细胞存活率,确定研究nacl转运的最佳nacl孵育浓度。
1.4分组、给药与nacl转运实验
取transwell板(0.4um孔径,24孔,12小室),在小室内每孔接种200ul·孔-1密度为4×105个·ml-1的mdck细胞,小室外每孔给予完全培养基1ml以适应细胞正常生长。细胞贴壁后,测定每孔电阻值。电阻值=(细胞电阻值-空白电阻值)×单层细胞膜面积,于37℃测得跨膜电阻值≥300ω·cm2,即可用于下一步实验。
取符合实验要求的mdck细胞,随机分为模型组(给予dmem培养基)、各石韦提取单体组(100umol·l-1)、氢氯噻嗪组(100umol·l-1),每组3个复孔,37℃二氧化碳培养箱培养24h。24h后吸弃小室内液体。于transwell板小室内给予含nacl0.015g·ml-1的dmem继续培养,分别于30min、1h、2h、4h分别取小室外液体50ul,酶标仪检测氯离子、尿素吸光度。
1.5统计学分析
实验结果均服从正态分布,数据以
2.实验结果
2.1nacl转运浓度的筛选
如图1所示,在给予不同浓度的nacl药液孵育8小时后,随着nacl浓度的升高,mdck细胞存活率逐渐降低,在0.015g·ml-1nacl组中的细胞存活率高于50%,浓度高于0.015g·ml-1的nacl各组细胞存活率均低于50%。最终我们选取了最佳nacl浓度为0.015g·ml-1,孵育时间为4小时以内。该条件下既能使mdck细胞两侧维持一定的nacl浓度梯度,又不影响细胞活性。
取对数生长期mdck细胞体外培养,分为生理盐水组(0.009g·ml-1)和nacl不同浓度梯度组(分别为0.012、0.015、0.018、0.021、0.024、0.027、0.030、0.033、0.036g·ml-1共9个浓度梯度),取相应浓度nacl药液孵育mdck细胞8小时,mtt法检测细胞存活率。
通过试验,最终我们选取了最佳氯化钠浓度为0.015g·ml-1,最佳给药时间定为4小时,此时既能使mdck细胞两侧维持一定的氯化钠浓度梯度,又不影响细胞活性。
2.2不同时间点里白烯等石韦提取单体和氢氯噻嗪对cl-转运影响
实验结果如表1。在给氯化钠孵育30min后,于给氯化钠的细胞对侧取各组细胞培养液各50微升,进行氯离子检测:与模型组没有给药的mdck细胞相比,(23e)-cycloart-23-ene-3β,25-diol组的氯离子浓度显著降低(p<0.05)。显示出(23e)-cycloart-23-ene-3β,25-diol组具有抑制氯离子跨细胞转运的作用。
在给氯化钠孵育2小时后,于给氯化钠的细胞对侧取各组细胞培养液各50微升,进行氯离子检测:与正常组没有给药的mdck细胞相比,里白烯组和氢氯噻嗪组的氯离子浓度显著降低(p<0.05)。
表1不同时间点里白烯等石韦提取单体和氢氯噻嗪对cl-转运影响(n=3,
与同时间段模型组相比,*p<0.05。
2.3不同时间点里白烯等石韦提取单体和氢氯噻嗪对na+转运影响
实验结果如表2,在给氯化钠孵育30min后,于给氯化钠的细胞对侧取各组细胞培养液各50微升,进行钠离子检测:与模型组没有给药的mdck细胞相比,氢氯噻嗪组、β-谷甾醇组的细胞培养液中钠离子浓度显著降低(p<0.05),显示氢氯噻嗪组、β-谷甾醇组具有抑制钠离子跨细胞转运的作用。
在给氯化钠孵育4小时后,于给氯化钠的细胞对侧取各组细胞培养液各50微升,进行钠离子检测:与正常组没有给药的mdck细胞相比,各组钠离子浓度均无显著性差异。
表2不同时间点里白烯等石韦提取单体和氢氯噻嗪对na+转运影响(n=3,
与同时间段模型组相比,*p<0.05。
3.实验结论
通过我们的实验可得,该方法的最佳检测时间为给予氯化钠孵育后4小时以内。与正常不给药物的mdck细胞相比,给予利尿药氢氯噻嗪的组内在给药30min后,其对侧钠离子浓度显著降低(p<0.05),在给药2h后,其对侧氯离子浓度显著降低(p<0.05),显示出良好的抑制氯化钠转运的活性,对比不给药的模型组,可以筛选出同样具有氯化钠转运抑制活性的药物如本实验中的石韦提取单体(23e)-cycloart-23-ene-3β,25-diol,从而为利尿药物筛选提供重要参考依据。虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作出一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!