一种布鲁氏菌外膜蛋白OMP25与周质蛋白BP26的融合蛋白及其表达和应用的制作方法
本发明涉及融合蛋白技术领域,特别是涉及一种布鲁氏菌外膜蛋白omp25与周质蛋白bp26的融合蛋白及其表达和应用。
背景技术:
布鲁氏菌病又称地中海弛张热,马耳他热,是由布鲁氏菌(brucellasp)引起的一种以流产和发热为特征的人畜共患性传染病,在世界许多国家和地区流行,高发地区为地中海地区,亚洲,中南美洲等。能导致多种动物和人发病,是以侵害生殖系统为主的人畜共患性传染病,严重危害动物健康和人类公共卫生安全。布鲁氏菌是革兰氏阴性兼性胞内菌,主要宿主有猪、牛、羊、狗等动物和人,传播途径主要是经消化道、呼吸道和皮肤粘膜。临床分型为急性期、慢性期活动型及慢性期相对稳定型。潜伏期7~60天,平均2周,少数患者可达数月至1年以上。急性期病多缓起,主要症状为发热、多汗、关节痛、睾丸肿痛等。发热多为低热和不规则热,5%~20%出现典型的波浪热。肝脾肿大也很常见。其他尚可有头痛、神经痛、淋巴结肿大,皮疹等。
我国将该病列为二类动物疫病,世界动物卫生组织(oie)将其列为b类流行病。各国对该病的防控十分重视,可靠的诊断和有效的疫苗一直是研究重点。中国流行的主要是羊(br.melitensis)、牛(br.bovis)、猪(br.suis)三种布鲁氏菌,其中以羊布鲁氏菌病最为多见,其次是牛种布鲁氏菌。近几年来随着畜牧业的快速发展,布鲁氏菌病在多数疫区有明显回升的趋势。由于该病的治疗非常困难,目前控制该病主要是采取疫苗免疫与淘汰相结合,对临床检测阳性的动物多采取淘汰处理。因此日常的防控与监测尤为重要。也急需研发出新的基因缺失疫苗,可以免疫后通过诊断来区分自然感染与疫苗免疫。
目前,针对布鲁氏菌的血清学诊断方法主要是平板凝集试验和试管凝集试验,其特异性和敏感性较差,易出现漏检和错检,且试管凝集试验耗时费力。另外基于脂多糖lps的elisa检测方法,可一次性完成大量样本检测,但易与其他类细菌如耶尔森菌等出现交叉反应导致特异性降低。还有胶体金试纸条检测方法,方便省力但敏感性不足。现有方法均无法区分疫苗免疫与自然感染,对布鲁氏菌的临床检疫和诊断带来不便。同时,由于蛋白在急性反应中表现阳性,在隐性感染和慢性感染及恢复期患病动物血清中常常表现阴性,揭示蛋白可作为急性期感染诊断的抗原,对布病早期诊断具有重要意义。因此,选择布鲁氏菌共同的且能引起较强体液免疫反应的蛋白作为抗原,并建立相关的elisa检测方法,对该病的鉴别诊断及亚单位疫苗的研制具有重要意义。
布鲁氏菌细胞膜是一个3层膜结构,由内到外依次为细胞质膜,外周胞质膜和外膜,细胞膜中含有多种外膜蛋白(omps)。目前,国内外科研人员已经发现了许多针对布鲁氏菌的免疫原性蛋白,可用作诊断和亚单位疫苗制备候选蛋白。其中外膜蛋白已经证明在实验室条件下具有良好的免疫活性和保护作用,如omp10、omp16、omp25、omp31、omp2b、omp28(bp26)和l7/l12,尤其25~34kd蛋白是优势抗原。omp25作为重要毒力因子,对布鲁氏菌结构、侵染和致病能力均起重要作用,也有研究表明,该蛋白与布鲁氏菌在宿主细胞内的生存和繁殖相关。在不同种属中高度保守,对宿主具有一定的免疫原性和免疫保护作用。omp28,又称周质蛋白bp26,是一种免疫显性抗原,能引起保护性免疫反应,且在羊、牛、狗和人中均具有很高的免疫原性,常被用作血清学检测的靶蛋白。现有技术中也有单独将omp25、bp26等进行独立克隆、独立构建及独立表达,获得两个单独的蛋白的技术方案,并分别对其免疫学特性验证。但是并没有两个基因同时克隆入一个表达载体、诱导表达一个融合蛋白的技术方案。两个蛋白的表达,需要根据蛋白的性质设计特有的酶切位点,及合适的表达载体。
本发明的创新之处在于,将omp25和bp26两个基因序列进行筛选设计后,同时串联克隆入同一个表达载体,诱导表达后得到的是一个融合蛋白,然后对这个融合蛋白进行相关免疫学验证。
综上所述,omp25和bp26蛋白在布鲁氏菌感染致病以及免疫保护性方面起着重要作用,因此,如何将两者融合起来,作为诊断布病的依据,是本发明要解决的技术问题。
技术实现要素:
本发明就是针对上述存在的缺陷而提供一种布鲁氏菌外膜蛋白omp25与周质蛋白bp26的融合蛋白及其表达和应用。本发明的布鲁氏菌外膜蛋白omp25与周质蛋白bp26的融合蛋白比单独蛋白更经济、方便,抗原性更优。用捕获法或夹心法检测抗布鲁氏菌抗体时,只需标记一个融合蛋白,不需要对两种蛋白分别进行标记。蛋白获得耗时少产量高,避免了活菌的培养和生物安全风险,特异性强,定位布鲁氏菌细胞抗原表位更有利于揭示体液免疫的本质。
本发明的一种布鲁氏菌外膜蛋白omp25与周质蛋白bp26的融合蛋白及其表达和应用技术方案为,一种布鲁氏菌外膜蛋白omp25与周质蛋白bp26的融合蛋白,将omp25蛋白n端信号肽序列与bp26蛋白n端信号肽序列删除,保留其抗原决定簇序列,中间通过linker序列ggaggcgggggttctggaggcgggggttct将之连接成为融合蛋白;所述的omp25蛋白n端信号肽序列为第1个aa~29个aa,所述的bp26蛋白n端信号肽序列为第1个aa~24个aa。
根据pet28a(+)载体的多克隆位点,在omp25蛋白序列的两端分别引入ndei和bamh1两个酶切位点及保护碱基ggaattc和cg,在bp26蛋白序列的两端分别引入bamh1和ecori两个酶切位点及保护碱基cg和c,便于插入表达载体pet28a(+)中。
含有布鲁氏菌外膜蛋白omp25的抗原表位氨基酸序列,第25个aa-第213个aa,共189aa:
含有布鲁氏菌周质蛋白bp26的抗原表位氨基酸序列,第30个aa-第250个aa,共221aa:
构建的含有布鲁氏菌外膜蛋白omp25和周质蛋白bp26的融合蛋白的抗原表位氨基酸序列422aa:
含有布鲁氏菌外膜蛋白omp25的抗原表位基因的dna序列,588bp:ggaattccatatggacgccatccaggaacagcctccggttccggctccggttgaagtagctccccagtatagctgggctggtggctataccggtctttaccttggctacggctggaacaaggccaagaccagcaccgttggcagcatcaagcctgacgattggaaggctggcgcctttgctggctggaacttccagcaggaccagatcgtatacggtgttgaaggtgatgcaggttattcctgggccaagaagtccaaggacggcctggaagtcaagcagggctttgaaggctcgctgcgtgcccgcgttggctacgacctgaacccggttatgccgtacctcacggctggtattgccggttcgcagatcaagcttaacaacggcttggacgacgaaagcaagttccgcgtgggttggacggctggtgccggtctcgaagccaagctgacggacaacatcctcggccgcgttgagtaccgttacacccagtacggcaacaagaactatgatctggccggtacgactgttcgcaacaagctggacacgcaggatttccgcgtcggcatcggctacaagttcggatcccg
含有布鲁氏菌周质蛋白bp26的抗原表位基因的dna序列(681bp):cgggatccgagaatcagatgacgacgcagcccgcgcgcatcgccgtcaccggggaaggcatgatgacggcctcgcccgatatggccattctcaatctctcggtgctacgccaggcaaagaccgcgcgcgaagccatgaccgcgaataatgaagccatgacaaaagtgctcgatgccatgaagaaggccggcatcgaagatcgcgatctccagacaggcggcatcaatatccagccgatttatgtctatcctgacgacaagaacaacctgaaagagcctaccatcaccggctattctgtatccaccagtctcacggttcgcgtgcgcgaactggccaatgttggaaaaattttggatgaatccgtcacgctcggtgttaatcagggcggtgatttgaacctggtcaatgataatccctctgccgtgatcaacgaggcgcgcaagcgcgcagtggccaatgccattgccaaggcgaagacgcttgccgacgctgcaggcgtggggcttggccgtgtggtggaaatcagtgaactgagccgcccgcccatgccgatgccaattgcgcgcggacagttcagaaccatgctagcagccgcaccggacaattccgtgccgattgccgcaggcgaaaacagctataacgtatcggtcaatgtcgtttttgaaatcaagtaagaattcc
构建的含有布鲁氏菌外膜蛋白omp25和周质蛋白bp26的融合蛋白抗原表位基因的dna序列,1289bp:
ggaattccatatggacgccatccaggaacagcctccggttccggctccggttgaagtagctccccagtatagctgggctggtggctataccggtctttaccttggctacggctggaacaaggccaagaccagcaccgttggcagcatcaagcctgacgattggaaggctggcgcctttgctggctggaacttccagcaggaccagatcgtatacggtgttgaaggtgatgcaggttattcctgggccaagaagtccaaggacggcctggaagtcaagcagggctttgaaggctcgctgcgtgcccgcgttggctacgacctgaacccggttatgccgtacctcacggctggtattgccggttcgcagatcaagcttaacaacggcttggacgacgaaagcaagttccgcgtgggttggacggctggtgccggtctcgaagccaagctgacggacaacatcctcggccgcgttgagtaccgttacacccagtacggcaacaagaactatgatctggccggtacgactgttcgcaacaagctggacacgcaggatttccgcgtcggcatcggctacaagttcggaggcgggggttctggaggcgggggttctatgaacgagaatcagatgacgacgcagcccgcgcgcatcgccgtcaccggggaaggcatgatgacggcctcgcccgatatggccattctcaatctctcggtgctacgccaggcaaagaccgcgcgcgaagccatgaccgcgaataatgaagccatgacaaaagtgctcgatgccatgaagaaggccggcatcgaagatcgcgatctccagacaggcggcatcaatatccagccgatttatgtctatcctgacgacaagaacaacctgaaagagcctaccatcaccggctattctgtatccaccagtctcacggttcgcgtgcgcgaactggccaatgttggaaaaattttggatgaatccgtcacgctcggtgttaatcagggcggtgatttgaacctggtcaatgataatccctctgccgtgatcaacgaggcgcgcaagcgcgcagtggccaatgccattgccaaggcgaagacgcttgccgacgctgcaggcgtggggcttggccgtgtggtggaaatcagtgaactgagccgcccgcccatgccgatgccaattgcgcgcggacagttcagaaccatgctagcagccgcaccggacaattccgtgccgattgccgcaggcgaaaacagctataacgtatcggtcaatgtcgtttttgaaatcaagtaagaattcc。
将所述的含有布鲁氏菌外膜蛋白omp25基因(588bp)和周质蛋白bp26基因(681bp)的dna序列分别送至生物公司化学合成,得到的基因片段分别经过酶切后连接至pet28a(+)载体构建重组质粒,将重组质粒进行双酶切和测序鉴定后,确定正确,命名为pet28a-omp25-bp26;
构建的重组质粒表达布鲁氏菌外膜蛋白omp25和周质蛋白bp26的融合蛋白,全长1289bp,422个aa,n端为omp25蛋白片段,长189个aa,c端为bp26蛋白片段,长221个aa,中间含有10个aa的连接片段linker,为4gly1ser4gly1ser。
所述的一种布鲁氏菌外膜蛋白omp25与周质蛋白bp26的融合蛋白的表达,omp25基因片段经ndei和bamh1双酶切,bp26基因片段经bamh1和ecori双酶切后,同时与经ndei和ecori双酶切的pet28a(+)质粒进行连接,使两个蛋白基因插入到载体的ndei和ecori之间,获得表达omp25和bp26融合蛋白的重组质粒。
将重组质粒转化rosetta(de3)表达菌,涂布在含50μg/ml卡那霉素的固体lb平板上,37℃过夜培养;将阳性转化子接种含50μg/ml卡那霉素的液体lb培养基中,37℃,180rpm振荡过夜培养,所得即为表达菌母液;将母液按照1/50比例加入含卡那霉素50μg/ml的新鲜液体lb培养基中,37℃,180rpm振荡3h,加入终浓度为0.5mmol/l的iptg,继续诱导培养6h,12000rpm离心5min收集菌体沉淀,进行sds-page检测;成功表达后获得相对分子量约53kd的重组融合蛋白,对照空质粒转化子无此条带。
所述的一种布鲁氏菌外膜蛋白omp25与周质蛋白bp26的融合蛋白的应用,将表达纯化复性后的融合蛋白,用于疫苗、布鲁氏菌抗体或抗原检测以及免疫制备布鲁氏菌单抗或多抗。
将融合蛋白作包被抗原,建立并优化布鲁氏菌ielisa抗体检测方法。
蛋白包被浓度是4.5mg/l(1/100倍稀释),包被条件是4℃过夜,猪血清作为封闭液,37℃封闭1h,二抗稀释度为1/4000倍,室温显色15min。用建立的ielisa检测方法与传统的虎红平板凝集试验比较,413份羊血清样品的符合率为92.2%,186份牛血清样品的符合率为94.8%。
用辣根过氧化物酶(hrp)标记布鲁氏菌外膜蛋白omp25和周质蛋白bp26的融合蛋白,用捕获法或夹心法检测抗布鲁氏菌igm或igg抗体,用金标法检测抗布鲁氏菌抗体。
本发明的有益效果为:
1.现在市场应用的布鲁氏菌抗体检测elisa试剂盒,一般使用纯化灭活的布鲁氏菌作抗原,或使用脂多糖lps作抗原,细菌培养繁琐,生产成本高,危险性大,且与其他革兰氏阴性细菌有交叉反应等缺点。利用原核生物表达系统制备布鲁氏菌外膜蛋白omp25和周质蛋白bp26的融合蛋白作抗原,可克服以上缺点。
2.将布鲁氏菌外膜蛋白omp25和周质蛋白bp26进行融合表达,不需要单独制备这两种蛋白,也不需要考虑两种蛋白的使用配比,比单独蛋白更经济、方便,抗原性更优。用捕获法或夹心法检测抗布鲁氏菌抗体时,只需标记一个融合蛋白,不需要对两种蛋白分别进行标记。蛋白获得耗时少产量高,避免了活菌的培养和生物安全风险,特异性强,定位布鲁氏菌细胞抗原表位更有利于揭示体液免疫的本质。
3.目前布鲁氏菌疫苗以弱毒苗为主,不仅生产成本高,危险大,容易导致人的感染。本发明的融合蛋白具有安全、低成本等优点,为基因工程疫苗研发奠定基础。
附图说明
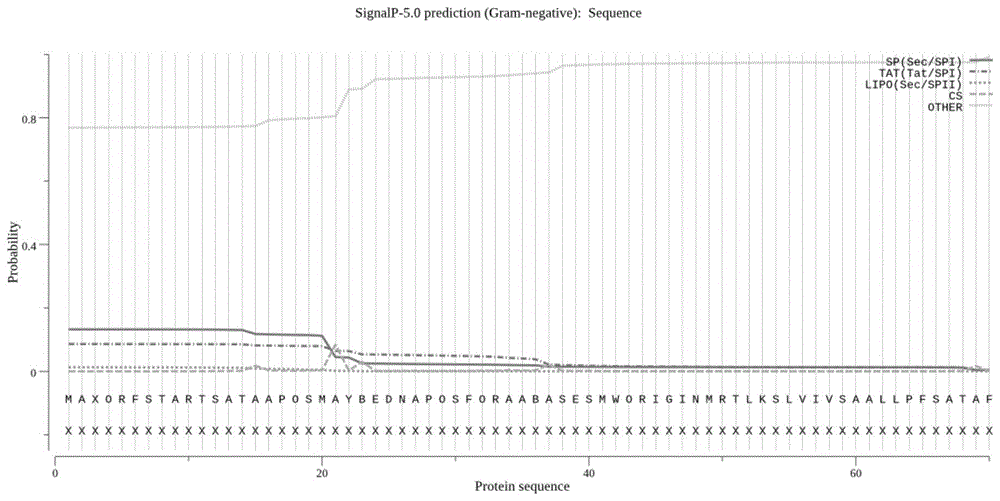
图1所示为omp25蛋白序列信号肽分析图;
图2所示为bp26蛋白序列信号肽分析图;
图3所示为omp25蛋白氨基酸序列抗原表位分析图;
图4所示为bp26蛋白氨基酸序列抗原表位分析;
图5所示为重组质粒的菌落pcr鉴定图,其中,m.dl2000;1-6.不同菌落;
图6所示为融合蛋白表达的sds-page电泳图,其中,1-2.pet28a空质粒转化子诱导表达;m.蛋白marker;3-4.融合蛋白诱导表达;
图7所示为融合蛋白可溶性分析的sds-page电泳图,其中,1.融合蛋白诱导表达前;2.融合蛋白诱导表达后;3.融合蛋白超声波裂解上清;4.融合蛋白超声波裂解沉淀;5.pet28a空质粒诱导后;m.蛋白marker;
图8所示为纯化后的融合蛋白sds-page电泳图,其中,1.融合蛋白500mm咪唑洗脱峰;2.融合蛋白200mm咪唑洗脱峰(纯化后蛋白);3.融合蛋白洗杂峰;4.融合蛋白上样流出液;m.蛋白marker;
图9所示为融合蛋白的westernblot,其中,m.蛋白预染marker;1.牛阳性血清;2.羊阳性血清。
具体实施方式
为了更好地理解本发明,下面用具体实例来详细说明本发明的技术方案,但是本发明并不局限于此。
实施例1
布鲁氏菌外膜蛋白omp25和周质蛋白bp26的基因设计与重组质粒合成及表达
1.主要试剂
dnaquickligationkit,dl2000marker,rtaq,6×dnaloadingbuffer酶等购自大连宝日医生物科技,30%丙烯酰胺,过硫酸铵(aps),sds,temed,sds-page蛋白上样缓冲液(5×),考马斯亮蓝快速染色液,蛋白酶抑制剂,核酸染料等购自山东思科捷科学仪器有限公司,质粒提取试剂盒,胶回收试剂盒购自北京百泰克生物技术有限公司,iptg等购自sigma公司,rosetta(de3)感受态细胞为本实验室保存自制。其他试剂均为国产或进口分析纯。
2.重组蛋白基因设计
利用dnastar、signalp-5.0server、anthewin等软件工具,计算机分析布鲁氏菌外膜蛋白omp25与周质蛋白bp26的氨基酸序列情况。将omp25蛋白n端信号肽序列(第1个aa~29个aa)与bp26蛋白n端信号肽序列(第1个aa~24个aa)删除,保留其抗原决定簇序列,分别是第25个aa-第213个aa,共189aa和第30个aa-第250个aa,共221aa。中间通过linker序列(ggaggcgggggttctggaggcgggggttct)将之连接成为融合蛋白。并根据pet28a(+)载体的多克隆位点,在omp25蛋白序列的两端分别引入ndei和bamh1两个酶切位点及保护碱基ggaattc和cg,在bp26蛋白序列的两端分别引入bamh1和ecori两个酶切位点及保护碱基cg和c,便于插入表达载体pet28a(+)中。
3.重组质粒的构建及诱导表达
经双酶切后连接获得的重组质粒,转化大肠杆菌dh5α,转化产物涂布在固体lb培养基(含卡那霉素),过夜培养后,随机挑选6个菌落进行菌落pcr鉴定,将鉴定正确的菌落送测序进一步鉴定。
将鉴定正确的重组质粒转化rosetta(de3)表达菌,涂布在含卡那霉素(50μg/ml)的固体lb平板上,37℃过夜培养。将阳性转化子接种液体lb培养基中,37℃,180rpm振荡过夜培养,所得即为表达菌母液。将母液按照1/50比例加入新鲜液体lb培养基中(含卡那霉素50μg/ml),37℃,180rpm振荡3h,按0.5mm,1mm和1.5mm比例分别加入iptg诱导剂,在2h、4h、6h、8h分别取样,诱导温度为25℃和37℃,进行最佳表达条件摸索。最终选择的最佳诱导表达条件是iptg诱导剂浓度为0.5mm、37°条件下诱导培养4h收获。
4.融合蛋白超声波裂解
利用摸索好的条件,对融合蛋白进行扩大培养,诱导表达。对培养物离心处理后,菌体沉淀用1/10体积的pbs(ph7.2)缓冲液溶解,冰水浴中进行超声波破碎菌体裂解,条件为强度50%,超声4s,停顿4s,共15min。在11000rpm,4℃条件下离心10min,收集沉淀,用1/10体积的8m尿素溶解,保存待纯化。同时进行sds-page电泳。
5.结果
5.1重组蛋白基因设计及质粒合成
利用dnastar、signalp-5.0server、anthewin等软件工具,计算机分析布鲁氏菌外膜蛋白omp25与周质蛋白bp26的氨基酸序列情况。在设计融合蛋白抗原时,综合考虑到抗原决定簇序列和信号肽对抗原特异性的影响,发现omp25蛋白n端第1个aa~29个aa处存在信号肽序列(说明书附图图1),bp26蛋白n端第1个aa~24个aa处存在信号肽序列(说明书附图图2)。根据氨基酸序列分析结果,omp25蛋白可能的抗原决定簇位于n端第60-190个aa区域(说明书附图图3),bp26蛋白可能的抗原决定簇位于n端第39-176个aa区域(说明书附图图4)。所以选取omp25蛋白的第25个aa-第213个aa,共189aa和bp26蛋白的第30个aa-第250个aa,共221aa为融合蛋白序列。中间通过linker序列(ggaggcgggggttctggaggcgggggttct)将之连接成为融合蛋白。并根据pet28a(+)载体的多克隆位点,在融合蛋白序列的5’端引入ndei酶切位点及7个保护碱基ggaattc,在3’端引入ecori酶切位点及1个保护碱基c,便于插入表达载体pet28a(+)中。
筛选后含有布鲁氏菌外膜蛋白omp25的抗原表位氨基酸序列(第25个aa-第213个aa,共189aa):
筛选后含有布鲁氏菌周质蛋白bp26的抗原表位氨基酸序列(第30个aa-第250个aa,共221aa):
化学合成的含有布鲁氏菌外膜蛋白omp25和周质蛋白bp26的融合蛋白抗原表位氨基酸序列(422aa)
5.2重组质粒的构建及诱导表达
经双酶切后连接获得的重组质粒,转化rosetta(de3)表达菌,转化产物涂布在固体lb培养基(含卡那霉素),过夜培养后,随机挑选6个菌落进行菌落pcr鉴定,将鉴定正确的菌落送测序进一步鉴定。结果6个菌落均阳性(说明书附图图5),测序结果正确。将鉴定正确的重组质粒命名为pet28a-omp25-bp26。
最终确定加入诱导剂iptg终浓度为0.5mmol/l,37℃继续诱导培养6h为融合蛋白最佳表达条件,12000rpm离心5min收集菌体沉淀,进行sds-page检测。成功表达后获得相对分子量约53kd的重组融合蛋白,对照空质粒转化子无此条带(说明书附图图6)。对表达的融合蛋白进行超声波裂解后检测发现,确定融合蛋白以包涵体形式大量表达(说明书附图图7)。
实施例2
布鲁氏菌外膜蛋白omp25和周质蛋白bp26的融合蛋白纯化及westernblot分析
1.主要试剂:
30%丙烯酰胺,过硫酸铵(aps),sds,temed,sds-page蛋白上样缓冲液(5×),考马斯亮蓝快速染色液,脱脂奶粉,蛋白酶抑制剂等购自山东思科捷科学仪器有限公司,his-镍离子亲和层析柱购自ge生命科学,辣根过氧化物酶(hrp)酶标兔抗羊*牛二抗购自河南塞尔维。透析袋购自spectrum美国光谱医学。其他试剂均为国产或进口分析纯。
2.融合蛋白的ni-柱亲和层析纯化
超声波裂解后的融合蛋白液利用akata蛋白纯化系统,经过his-镍离子亲和层析纯化柱(5ml*3)进行亲和层析纯化,所有缓存溶液均含8m尿素并进行0.22μm孔径的滤膜抽滤排气除杂。具体纯化步骤是:用ddh2o清洗柱子(至少10个柱体积)——pbs+8m尿素buffer平衡柱子(10个柱体积)——含30mm咪唑+8m尿素buffer上样50ml——含30mm咪唑+8m尿素buffer洗脱杂蛋白(5个柱体积)——含200mm咪唑+8m尿素buffer洗脱目的蛋白,收集洗脱峰处蛋白液体——含500mm咪唑+8m尿素buffer清洗柱子5个体积——ddh2o清洗柱子(至少10个柱体积)——亲和层析介质用20%乙醇保存。洗杂和洗脱步骤中分别收集峰值处流出的液体,进行sds-page检测。
3.融合蛋白复性
对亲和层析后的蛋白溶液,进行梯度透析除尿素复性。剪取合适大小透析袋,沸水煮沸10min后用超纯水浸泡。取透析袋夹夹住一头,慢慢向其中加入蛋白溶液,后用透析袋夹夹住另一头。将透析袋放入透析液中,透析液及透析条件依次为:6m尿素,室温搅拌透析2h;4m尿素,室温透析搅拌2h;2m尿素,室温透析搅拌2h;1m尿素,4℃透析过夜;0.5m尿素,室温4℃透析过夜;pbsbuffer(ph7.2),4℃透析过夜。分别取透析后的蛋白液进行sds-page检测及含量测定。
4.融合蛋白的westernblot分析
应用羊和牛布鲁氏菌病标准阳性血清为一抗,纯化复性后融合蛋白经sds-page后转移至硝酸纤维素膜上,应用半干法转膜,条件为恒流45ma,30min。分别进行westernblot,确定融合蛋白的抗原性和特异性,同时设羊和牛布鲁氏菌病标准阴性血清为对照。将纯化并鉴定正确的融合蛋白进行冻干保存。
5.结果
对融合蛋白进行ni-柱亲和层析纯化,在洗脱步骤中收集峰值处流出的液体,即为布鲁氏菌外膜蛋白omp25和周质蛋白bp26的融合蛋白,检测含量约450mg/l。其他洗脱峰内无明显融合蛋白条带(说明书附图图8)。融合蛋白的westernblot分析结果表明,布鲁氏菌外膜蛋白omp25和周质蛋白bp26的融合蛋白能与牛和羊的布鲁氏菌阳性血清反应,不与阴性血清发生反应(说明书附图图9)。说明表达的融合蛋白具有较好的抗原性和特异性。
实施例3
基于omp25和bp26的融合蛋白的ielisa检测方法建立及应用
1.主要试剂
triton-100购自山东思科捷科学仪器有限公司,tmb购自北京天根生化科技有限公司,辣根过氧化物酶(hrp)酶标兔抗羊*牛二抗购自河南塞尔维。酶标板购自广州洁特生物过滤制品有限公司。其他试剂均为国产或进口分析纯。
2.融合蛋白抗体ielisa检测方法建立与优化
2.1抗原最佳稀释度与血清最佳稀释倍数优化
采用方阵法,利用纯化后的融合蛋白作为包被抗原,设置1:25、1:50、1:100、1:200、1:400四个稀释度,分别用包被缓冲液稀释后包被elisa板,每孔100μl,选择4℃过夜,37℃1h和37℃2h三个包被条件进行优化;羊和牛布鲁氏菌病标准阳性血清和阴性血清分别按照1:25、1:50、1:100、1:200、1:400四个稀释度,每孔100μl,37℃孵育1h。其余步骤采用常规方法,测定od450值,计算相应阳性血清孔od450值与阴性血清孔od450值的比值,即p/n值。选取p/n值最大孔所对应的抗原包被浓度和阴阳性血清稀释倍数为最佳条件,最终确定抗原与血清最佳稀释度。
2.2封闭条件的确定
封闭液分别选择猪血清和脱脂奶粉,封闭温度选择4℃过夜,37℃1h和37℃2h三个条件进行筛选,用阴阳性血清检测od450值,选取p/n值最大孔所对应的一组条件为最佳封闭条件。
2.3二抗稀释度与tmb底物作用条件的确定
辣根过氧化物酶(hrp)酶标兔抗羊*牛二抗稀释度分别选择1/2000倍,1/4000倍和1/8000倍,其他条件选择优化后的最佳条件进行,选取p/n值最大孔所对应的一组条件为最佳二抗稀释度。底物显色条件分别选择室温15min,37℃15min和室温30min进行优化,其他条件选择优化后的最佳条件进行,选取p/n值最大孔所对应的一组条件为最佳底物作用条件。
2.4阴阳性临界值的确定
选取经虎红平板凝集试验和试管凝集试验检测均阴性的羊布鲁氏菌抗体阴性血清样品110份和牛布鲁氏菌抗体阴性血清样品180份,按照上述优化后的elisa检测条件进行检测,最终确定临界值。临界值=3×标准差sd+阴性血清od450值均值。
2.5ielisa特异性试验
应用建立的布鲁氏菌病血清抗体ielisa检测方法,分别对耶尔森菌、大肠杆菌、沙门氏菌、巴氏杆菌、羊布鲁氏菌病阳性血清和牛布鲁氏菌病阳性血清进行检测,确定其特异性。
3.ielisa标准操作方法确定
按照最佳抗原包被浓度,以100μl/孔包被elisa板,4℃密闭反应过夜;用0.01mol/lpbst(ph值7.4,含0.05%tween20,下同)洗涤4次,250μl/孔;按照最佳封闭液和条件进行封闭,250μl/孔;pbst洗涤4次;按照100μl/孔加入样品,37℃孵育45min;pbst洗涤4次;按照100μl/孔加入稀释后的酶标二抗,37℃孵育30min;pbst洗涤4次;按照100μl/孔加入tmb底物液,避光室温显色15min;按照50μl/孔加入2mol/l硫酸终止反应。在od450处读数,求出p/n值。
4.ielisa临界值及判定标准
分别选择已知羊布鲁氏菌抗体阴性血清样品110份和牛布鲁氏菌抗体阴性血清样品180份,按照上述优化后的条件进行检测,计算平均值和标准差,按照公式:临界值=平均od450值+3×标准差,确定结果判定标准。本ielisa检测方法的临界值为0.1254。当od450值>0.1254时,判为阳性,od450值≤0.1254时,判为阴性。
5.融合蛋白抗体ielisa检测试剂盒组装及应用
利用建立的融合蛋白抗体ielisa检测方法,组建ielisa检测试剂盒,并进行了临床应用。确定试剂盒各组分:阳性、阴性血清各1管,1ml/管;20×浓缩洗涤液1瓶,30ml/瓶;10×样品稀释液1瓶,10ml/瓶;酶标抗体1管,20μl/管;tmb底物液1瓶,20ml/瓶;终止液1瓶,20ml/瓶;96孔反应板2块;96孔稀释板2块;说明书1份。试剂盒外包装采用硬质纸板一次性固压成型,正面贴标签,标注试剂盒名称、生产日期及保存条件等。组装后的试剂盒对采自滨城区、惠民县、经济技术开发区、博兴县等地区的近30家约300份羊血清进行应用检测。
6.结果
以纯化复性后的融合蛋白作为包被抗原,建立了布鲁氏菌抗体ielisa检测方法。经过优化,ielisa方法最佳条件是:蛋白包被浓度是4.5mg/l,包被条件是4℃过夜,猪血清作为封闭液,37℃封闭1h,二抗稀释倍数为1/4000倍,室温显色15min。该ielisa检测方法的临界值为0.1254。用建立的ielisa检测方法与传统的虎红平板凝集试验比较,413份羊血清样品的符合率为92.2%,186份牛血清样品的符合率为94.8%。先后对采自滨城区、惠民县、经济技术开发区、博兴县等地区的近30家近300份羊血清进行了初步检测,结果羊场个体检测阳性率约为0.91%,大体摸清了周边地区多个规模化牛羊场布鲁氏菌病血清学抗体水平情况。累计推广应用50余个,为开展区域布鲁氏菌病基线调查发挥了重要作用。结果表明融合蛋白作为包被抗原建立的ielisa检测方法,适用于牛和羊的血清布病抗体检测。
序列表
<120>一种布鲁氏菌外膜蛋白omp25与周质蛋白bp26的融合蛋白及其表达和应用
<160>7
<170>siposequencelisting1.0
<210>1
<211>30
<212>dna
<213>人工合成(artificialsynthesis)
<400>1
ggaggcgggggttctggaggcgggggttct30
<210>2
<211>189
<212>prt
<213>布鲁氏菌(brucella)
<400>2
aspalaileglngluglnproprovalproalaprovalgluvalala
151015
proglntyrsertrpalaglyglytyrthrglyleutyrleuglytyr
202530
glytrpasnlysalalysthrserthrvalglyserilelysproasp
354045
asptrplysalaglyalaphealaglytrpasnpheglnglnaspgln
505560
ilevaltyrglyvalgluglyaspalaglytyrsertrpalalyslys
65707580
serlysaspglyleugluvallysglnglyphegluglyserleuarg
859095
alaargvalglytyraspleuasnprovalmetprotyrleuthrala
100105110
glyilealaglyserglnilelysleuasnasnglyleuaspaspglu
115120125
serlyspheargvalglytrpthralaglyalaglyleuglualalys
130135140
leuthraspasnileleuglyargvalglutyrargtyrthrglntyr
145150155160
glyasnlysasntyraspleualaglythrthrvalargasnlysleu
165170175
aspthrglnasppheargvalglyileglytyrlysphe
180185
<210>3
<211>221
<212>prt
<213>布鲁氏菌(brucella)
<400>3
gluasnglnmetthrthrglnproalaargilealavalthrglyglu
151015
glymetmetthralaserproaspmetalaileleuasnleuserval
202530
leuargglnalalysthralaargglualametthralaasnasnglu
354045
alametthrlysvalleuaspalametlyslysalaglyilegluasp
505560
argaspleuglnthrglyglyileasnileglnproiletyrvaltyr
65707580
proaspasplysasnasnleulysgluprothrilethrglytyrser
859095
valserthrserleuthrvalargvalarggluleualaasnvalgly
100105110
lysileleuaspgluservalthrleuglyvalasnglnglyglyasp
115120125
leuasnleuvalasnaspasnproseralavalileasnglualaarg
130135140
lysargalavalalaasnalailealalysalalysthrleualaasp
145150155160
alaalaglyvalglyleuglyargvalvalgluilesergluleuser
165170175
argproprometprometproilealaargglyglnpheargthrmet
180185190
leualaalaalaproaspasnservalproilealaalaglygluasn
195200205
sertyrasnvalservalasnvalvalphegluilelys
210215220
<210>4
<211>422
<212>prt
<213>合成(artificialsynthesis)
<400>4
aspalaileglngluglnproprovalproalaprovalgluvalala
151015
proglntyrsertrpalaglyglytyrthrglyleutyrleuglytyr
202530
glytrpasnlysalalysthrserthrvalglyserilelysproasp
354045
asptrplysalaglyalaphealaglytrpasnpheglnglnaspgln
505560
ilevaltyrglyvalgluglyaspalaglytyrsertrpalalyslys
65707580
serlysaspglyleugluvallysglnglyphegluglyserleuarg
859095
alaargvalglytyraspleuasnprovalmetprotyrleuthrala
100105110
glyilealaglyserglnilelysleuasnasnglyleuaspaspglu
115120125
serlyspheargvalglytrpthralaglyalaglyleuglualalys
130135140
leuthraspasnileleuglyargvalglutyrargtyrthrglntyr
145150155160
glyasnlysasntyraspleualaglythrthrvalargasnlysleu
165170175
aspthrglnasppheargvalglyileglytyrlyspheglyglygly
180185190
glyserglyglyglyglysermetasngluasnglnmetthrthrgln
195200205
proalaargilealavalthrglygluglymetmetthralaserpro
210215220
aspmetalaileleuasnleuservalleuargglnalalysthrala
225230235240
argglualametthralaasnasnglualametthrlysvalleuasp
245250255
alametlyslysalaglyilegluaspargaspleuglnthrglygly
260265270
ileasnileglnproiletyrvaltyrproaspasplysasnasnleu
275280285
lysgluprothrilethrglytyrservalserthrserleuthrval
290295300
argvalarggluleualaasnvalglylysileleuaspgluserval
305310315320
thrleuglyvalasnglnglyglyaspleuasnleuvalasnaspasn
325330335
proseralavalileasnglualaarglysargalavalalaasnala
340345350
ilealalysalalysthrleualaaspalaalaglyvalglyleugly
355360365
argvalvalgluilesergluleuserargproprometprometpro
370375380
ilealaargglyglnpheargthrmetleualaalaalaproaspasn
385390395400
servalproilealaalaglygluasnsertyrasnvalservalasn
405410415
valvalphegluilelys
420
<210>5
<211>588
<212>dna
<213>布鲁氏菌(brucella)
<400>5
ggaattccatatggacgccatccaggaacagcctccggttccggctccggttgaagtagc60
tccccagtatagctgggctggtggctataccggtctttaccttggctacggctggaacaa120
ggccaagaccagcaccgttggcagcatcaagcctgacgattggaaggctggcgcctttgc180
tggctggaacttccagcaggaccagatcgtatacggtgttgaaggtgatgcaggttattc240
ctgggccaagaagtccaaggacggcctggaagtcaagcagggctttgaaggctcgctgcg300
tgcccgcgttggctacgacctgaacccggttatgccgtacctcacggctggtattgccgg360
ttcgcagatcaagcttaacaacggcttggacgacgaaagcaagttccgcgtgggttggac420
ggctggtgccggtctcgaagccaagctgacggacaacatcctcggccgcgttgagtaccg480
ttacacccagtacggcaacaagaactatgatctggccggtacgactgttcgcaacaagct540
ggacacgcaggatttccgcgtcggcatcggctacaagttcggatcccg588
<210>6
<211>681
<212>dna
<213>布鲁氏菌(brucella)
<400>6
cgggatccgagaatcagatgacgacgcagcccgcgcgcatcgccgtcaccggggaaggca60
tgatgacggcctcgcccgatatggccattctcaatctctcggtgctacgccaggcaaaga120
ccgcgcgcgaagccatgaccgcgaataatgaagccatgacaaaagtgctcgatgccatga180
agaaggccggcatcgaagatcgcgatctccagacaggcggcatcaatatccagccgattt240
atgtctatcctgacgacaagaacaacctgaaagagcctaccatcaccggctattctgtat300
ccaccagtctcacggttcgcgtgcgcgaactggccaatgttggaaaaattttggatgaat360
ccgtcacgctcggtgttaatcagggcggtgatttgaacctggtcaatgataatccctctg420
ccgtgatcaacgaggcgcgcaagcgcgcagtggccaatgccattgccaaggcgaagacgc480
ttgccgacgctgcaggcgtggggcttggccgtgtggtggaaatcagtgaactgagccgcc540
cgcccatgccgatgccaattgcgcgcggacagttcagaaccatgctagcagccgcaccgg600
acaattccgtgccgattgccgcaggcgaaaacagctataacgtatcggtcaatgtcgttt660
ttgaaatcaagtaagaattcc681
<210>7
<211>1289
<212>dna
<213>合成(artificialsynthesis)
<400>7
ggaattccatatggacgccatccaggaacagcctccggttccggctccggttgaagtagc60
tccccagtatagctgggctggtggctataccggtctttaccttggctacggctggaacaa120
ggccaagaccagcaccgttggcagcatcaagcctgacgattggaaggctggcgcctttgc180
tggctggaacttccagcaggaccagatcgtatacggtgttgaaggtgatgcaggttattc240
ctgggccaagaagtccaaggacggcctggaagtcaagcagggctttgaaggctcgctgcg300
tgcccgcgttggctacgacctgaacccggttatgccgtacctcacggctggtattgccgg360
ttcgcagatcaagcttaacaacggcttggacgacgaaagcaagttccgcgtgggttggac420
ggctggtgccggtctcgaagccaagctgacggacaacatcctcggccgcgttgagtaccg480
ttacacccagtacggcaacaagaactatgatctggccggtacgactgttcgcaacaagct540
ggacacgcaggatttccgcgtcggcatcggctacaagttcggaggcgggggttctggagg600
cgggggttctatgaacgagaatcagatgacgacgcagcccgcgcgcatcgccgtcaccgg660
ggaaggcatgatgacggcctcgcccgatatggccattctcaatctctcggtgctacgcca720
ggcaaagaccgcgcgcgaagccatgaccgcgaataatgaagccatgacaaaagtgctcga780
tgccatgaagaaggccggcatcgaagatcgcgatctccagacaggcggcatcaatatcca840
gccgatttatgtctatcctgacgacaagaacaacctgaaagagcctaccatcaccggcta900
ttctgtatccaccagtctcacggttcgcgtgcgcgaactggccaatgttggaaaaatttt960
ggatgaatccgtcacgctcggtgttaatcagggcggtgatttgaacctggtcaatgataa1020
tccctctgccgtgatcaacgaggcgcgcaagcgcgcagtggccaatgccattgccaaggc1080
gaagacgcttgccgacgctgcaggcgtggggcttggccgtgtggtggaaatcagtgaact1140
gagccgcccgcccatgccgatgccaattgcgcgcggacagttcagaaccatgctagcagc1200
cgcaccggacaattccgtgccgattgccgcaggcgaaaacagctataacgtatcggtcaa1260
tgtcgtttttgaaatcaagtaagaattcc1289
- 还没有人留言评论。精彩留言会获得点赞!