一种用于鉴定三平正并殖吸虫囊蚴的试剂盒及使用方法与流程
本发明属于生物工程领域,涉及一种检测寄生虫的试剂盒和方法,具体来说是一种用于鉴定三平正并殖吸虫囊蚴的试剂盒及使用方法。
背景技术:
三平正并殖吸虫(euparagonimuscenocopiosus)主要分布在我国的粤、闽、赣、皖、浙等省的山区。其生活史的第一中间宿主为川卷螺,第二中间宿主为华溪蟹等淡水蟹。三平正并殖吸虫的囊蚴主要定居在蟹的心脏内,个别可以在胸肌、足肌或甚至背壳内软组织里。在报道动物实验中,三平正并殖吸虫可在大鼠和小鼠体内快速发育成童虫并引起肺部出血;三平正并殖吸虫虽可感染实验犬,但虫体成熟所需的时间较长,一般要在三个月以上,且获虫数少;在犬体内虫体的移行或定居部位为腹腔、胸腔、肺的表面或表层下的囊肿,囊肿内可有1~2条成虫。三平正并殖吸虫也可以感染人体。
由于在三平正并殖吸虫的囊蚴与卫氏并殖吸虫囊蚴、斯氏并殖吸虫的囊蚴均寄生在淡水蟹中,且在并殖吸虫病流行的疫区,有中间宿主淡水蟹同时混合感染卫氏并殖吸虫囊蚴和三平正并殖吸虫囊蚴的报道,这就给三种并殖吸虫的囊蚴形态学鉴定带来了一定的困难。虽然在三平正并殖吸虫的鉴定中也有学者采用常规分子生物学的方法,如pcr等方法,但大多是以成虫为样本进行的研究,成虫需要动物模型才能获取,试验过程耗材耗力且成虫的回收率很低。又因常规的分子检测方法耗时长、检测仪器昂贵、对人员要求高,且需要通过相关技能培训并获得上岗证才能进行鉴定等,满足不了现场即时、快速的检测要求。
实时荧光pcr技术是具有巨大发展潜力的作为当今的高新检测技术。与常规pcr相比,它具有耗时短、特异性强、有效解决pcr污染问自动化程度高等特点,而且解决了动物模型的感染过程,利用检测中间宿主体内的囊蚴,为水产品的食品检验提供了新的方法。
由于目前三平正并殖吸虫成虫样本难以获取,而但中间宿主溪蟹较易采集。本研究建立一种针对三平正并殖吸虫中间宿主溪蟹中囊蚴的及时、快速荧光定量pcr检测方法,开辟了三平正并殖吸虫囊蚴检测的新方法。
技术实现要素:
本发明的目的在于提供一种用于鉴定三平正并殖吸虫囊蚴的试剂盒及使用方法,所述的这种用于鉴定三平正并殖吸虫囊蚴的试剂盒及使用方法要解决现有技术中的鉴定三平正并殖吸虫囊蚴的方法特异性和灵敏性不高的技术问题。
为实现上述目的,本发明采用如下技术方案:
一种用于鉴定三平正并殖吸虫囊蚴的试剂盒,
含有扩增三平正并殖吸虫囊蚴dna的上游引物,其基因序列如seqidno.1所示,
含有扩增三平正并殖吸虫囊蚴dna的下游引物,其基因序列如seqidno.2所示,
含有鉴定三平正并殖吸虫囊蚴dna的探针,其基因序列如seqidno.3所示,在探针的5’端标记荧光基团cy、在3’端标记荧光淬灭基团bhq2。
进一步的,还含有和三平正并殖吸虫的线粒体cox1基因对应一致的一个标准阳性对照质粒dna模板,以及进行实时定量pcr检测所需要的试剂,所述的三平正并殖吸虫的线粒体cox1基因的序列如seqidno.4所示。
本发明还提供了上述的一种用于鉴别三平正并殖吸虫囊蚴的试剂盒使用方法,以待测分离的囊蚴基因组dna为模板,将其与dna聚合酶、缓冲液、灭菌超纯水以及试剂盒中的检测引物和特异性探针按比例混合均匀后,进行实时定量pcr检测,根据反应曲线的ct值确定囊蚴的种类,从而判定溪蟹感染的是否为三平正并殖吸虫囊蚴。
具体的,反应体系总体积20μl,其中2倍反应缓冲液(2×buffer)10μl,dna酶(4u/μl)0.5μl,两种引物10pmol/μl各0.4μl,探针10pmol/μl0.4μl,模板dna2μl,无菌双蒸水8.3μl。其中,2×buffer和qrzdna酶采用的是东洋纺toyobothunderbirdprobeone-stepqrt-pcrkit。检测设备采用实时荧光pcr仪。
本发明提供的引物对与探针在实时荧光定量pcr仪中检测三平正并殖吸虫的线粒体cox1基因。线粒体cox1基因序列是寄生虫分子鉴定常用的靶标。cox1基因序列属于线粒体基因组,母系遗传进化速率较快,适用于种内遗传差异的分析。选取三平正并殖吸虫线粒体cox1基因(genebanktm登录号af159594.1),采用mega6.0与其他并殖吸虫的该基因进行多重比较,筛选出三平正并殖吸虫保守的区域。通过比较pcr扩增过程生成的扩增曲线(ct值)和利用已经生成的标准基线或阈值线(标准曲线ct值),从而达到定性检测淡水溪蟹体内是否存在三平正并殖吸虫囊蚴的检测信号。
本发明的特异性实验显示,本发明方法能特异性的对三平正并殖吸虫分别进行检测,探针与其他寄生虫和宿主无交叉;灵敏度实验表明,本发明方法检测的线性范围宽广,最低能检测出三平正并殖吸虫dna为0.322copies/μl;无论是组内重复性实验还是组间重复性实验,ct值的变异系数控制在统计学有效范围之内,证明本发明方法检测结果的稳定性良好。
本发明将三平正并殖吸虫常规pcr产物连接pmd-18-t载体,经转化、提取质粒、定量,制备阳性质控标准品,以100倍倍比连续稀释,制成0.322-3.22×109copies/μl的阳性质控标准品。取ct值在20左右的标准品(3.22×1010copies/μl)作为检测体系建立时的阳性模板。采用单因子浓度梯度实验逐步改变pcr反应体系各组分浓度,优化实时荧光pcr实验条件,并调节循环参数,建立二温循环实时荧光pcr检测方法。
本发明根据不同浓度梯度的阳性质控标准品制作的定量标准曲线可以看出,不同梯度定量模板数的对数值与ct值之间有较好的相关性,其相关系为0.9995,灵敏度可达0.322copies/μl;对其他寄生虫和健康宿主及水对照进行检测表明,该方法具有很好的特异性。
本发明和已有技术相比,优点在于:通过一次测试,比较pcr扩增过程生成的扩增曲线(ct值)和利用已经生成的标准基线或阈值线(标准曲线ct值),从而达到定性检测淡水溪蟹体内是否存在三平正并殖吸虫被寄生的检测信号。该方法可应用检测淡水溪蟹感染三平正并殖吸虫囊蚴的准确鉴定,即可突破传统而乏味的解剖技术对于解剖经验的依赖,又无需耗时的漫长等待,大大提高工作效率。本发明提供的检测体系具有很好的稳定性,其检测结果变异较小,控制在统计学范围之内。本发明的方法快速、准确、高通量、灵敏度高、特异性强。
附图说明
图1为实时荧光pcr检测技术特异性试验对照图(其中a图曲线1~3:卫氏并殖吸虫囊蚴;4~15:斯氏并殖吸虫、三平正并殖吸虫、大片吸虫、华支睾吸虫、肝片吸虫、旋毛虫、蛔虫、牛带绦虫、溪蟹肌肉的基因组dna、无菌去离子水(2个);b图曲线1~3:斯氏并殖吸虫囊蚴;4~15:卫氏并殖吸虫、三平正并殖吸虫、大片吸虫、华支睾吸虫、肝片吸虫、旋毛虫、蛔虫、牛带绦虫、溪蟹肌肉的基因组dna、无菌去离子水(2个))。
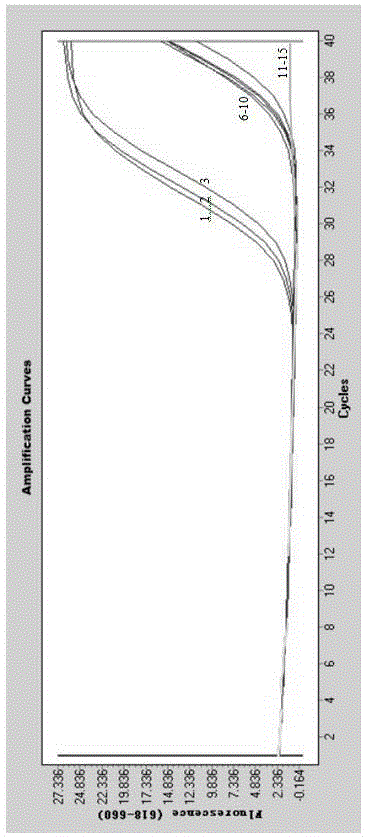
图2为不同拷贝数阳性质控标准品荧光pcr扩增的动力学曲线(从左往右依次是:将dna进行100倍倍比稀释,三平正并殖吸虫稀释梯度为1-6:3.22×109copies/μo、3.22es/7copies/μo、3.22es/5copies/μo、3.22es/3copies/μo、32.2copies/μo、0.322copies/μ.)。
图3为实时荧光pcr标准曲线。
具体实施方式
下面结合具体实施例对本发明作进一步的说明:
1.囊蚴分离:
1.1对捕获的溪蟹测量大小、分雌雄;
1.2将溪蟹头胸甲、螫肢和步足分别剪碎,与其内脏一起置于乳钵内;
1.3竹筒和竹棒(或其他类似替代品)捣碎;
1.4用生理盐水清洗捣碎样品用并用10目网筛过滤,除去粗蟹壳;
1.5滤液再用40目网筛过滤,将获得的滤液置于锥形量筒内,加水至量筒的最大刻度处,自然沉淀洗涤至水清;
1.6将全部沉渣吸入玻璃平皿,在体视显微镜下,收集囊蚴并计数登记;
1.7将收集的囊蚴保存于75%的酒精中或于少量生理盐水中-80℃速冻。
2.基因组dna提取:
2.1取形态特征一致的囊蚴1个~10个放入1.5ml离心管中,加入100μlpbs和少量玻璃珠振荡5min~10min,再按照通用基因组提取试剂盒进行dna提取;
3.pcr引物及探针:选取三平正并殖吸虫线粒体cox1基因(genebanktm登录号af159594.1),采用mega6.0与其他并殖吸虫的该基因进行多重比较,筛选出三平正并殖吸虫保守的区域,利用primerpremier5.0软件进行引物与探针的设计。
设计三平正并殖吸虫荧光定量引物和探针所用的cox1基因序列:
gggtttggggtggtgagacatatttgtatgactatgaccaaaaatgattccttgtttggctactatggtttggtgtttgccatgggagctattgtgtgtttgggcagtgttgtttgagctcatcacatgtttatggtgggtttagatgttaagactgctgtcttttttagatctgttactggtgtcattgggattcctactgggattaaggttttttcttggttgttcatgctggggggcactcgcttgcggttttgagatcctgtggtgtggtggatattggggtttatctttttgttcaccatagggggtgtgactggaattattttgtcttcctctattttggatagtttgttgcatgatacttggtttgtg,所述的三平正并殖吸虫的线粒体cox1基因的序列如seqidno.4所示。
ecf:5′-tgtttgccatgggagctatt-3′,(如seqidno.1所示);
ecr:5′-ggaatcccaatgacaccagtaa,(如seqidno.2所示);
probeecp:5’-cy-ctcaaacaacactgcccaaac-3-bhq2,(如seqidno.3所示);在其5’端标记荧光染料cy,而3’端则标记荧光淬灭基团。
4.阳性质控标准品的制备:
将三平正并殖吸虫的常规pcr产物与克隆载体puc57vector连接,转化入大肠杆菌dh5α,并保存阳性重组菌,参照minibestplasmidpurificationkit说明书制备质粒并进行定量;
4.1大肠杆菌的培养,从平板培养基上挑选单菌落接种至1~4ml的含有抗生素的液体培养基中,37℃过夜培养;
4.2取1~4ml的过夜培养菌液,12000r/min离心2min,弃上清;
4.3用250μl的solutionⅰ(溶解试剂ⅰ)含rnasea1充分悬浮细菌沉淀;
4.4加入250μl的solutionⅱ(溶解试剂ⅱ)轻轻地上下翻转混合5~6次,使菌体充分裂解,形成透明溶液;
4.5加入400μl的4℃预冷的solutionⅲ(溶解试剂ⅲ),轻轻上下翻转混合5~6次,直至形成紧实凝集块,然后室温静置2min;
4.6室温12000r/min离心10min,取上清;
4.7将试剂盒中的旋转柱安置于收集管上;
4.8将上述操作4.6的上清液转移至旋转柱中,12000r/min离心1min,弃滤液;
4.9将500μl的rinsea(洗液a)加入旋转柱,12000r/min离心30s,弃滤液;
4.10将700μl的rinseb(洗液b)加入旋转柱中,12000r/min离心30s,弃滤液;
4.11重复操作步骤4.10;
4.12将旋转柱安置于新的1.5ml的离心管上,在旋转柱膜的中央处加入60μl的灭菌蒸馏水或溶解缓冲液,室温静置1min。
4.1312000r/min离心1min洗脱dna;
在质粒提取后吸取50μl,以5或10的倍比连续稀释制成不同浓度梯度的阳性质控标准品进行定量检测,-20℃保存备用;
其中,在提取质粒后吸取50μl进行定量检测的具体方法如下:取10μl质粒稀释到500μl,测定od260,然后算出质粒的质量,再算出摩尔浓度,最后乘以阿伏伽德罗常数6.02×1023,即为单位体积的拷贝数,计算公式为:阳性质粒拷贝数copies/μl=(od260×50×10-9×稀释倍数×6.02×1023)/(660×碱基数)式中:50代表用1cm的比色杯在od260为1时相对应的双链dna浓度为50μg/ml;660代表双链dna平均每个碱基对的分子量;
5.反应体系的建立与优化:
对不同浓度梯度的阳性质控标准品进行预试验,选取ct在20左右的浓度3.22×1010copies/μo作为体系优化时的模板。
反应体系的建立与优化的步骤包括:
5.1荧光定量pcr反应所用试剂为toyobothunderbirdprobeone-stepqrt-pcrkit(包括2×buffer,qrzdna酶);
5.2qrzdna酶单因子浓度梯度优化在反应体系中其他条件相同的情况下,将qrzdna酶的用量在0.25~2μl,以每0.25μl递增,通过试验结果的比较分析,确定最佳qrzdna酶的用量是0.5μl;
5.3探针单因子浓度梯度优化是在反应体系中其他条件相同的情况下,探针用量范围为每个反应0.10~0.50μl,以每0.05μl递增,对重复试验进行比较分析,确定每个反应的最佳探针用量均为0.40μl;
5.4引物浓度的优化是在反应体系中其他条件相同的情况下,将上下游引物的用量分别设在每个反应0.10~0.90μl,以每0.10μl递增,矩阵分析,确定三平正并殖吸虫荧光定量pcr每个反应的最佳引物用量是上下游引物均为0.40μl;
5.5循环参数的确定:对变性时间、退火温度和延伸温度、时间及循环次数进行适当的调节,选取检测时间最短,扩增曲线最好的循环参数作为pcr的温度和时间参数,即95℃预变性1min;95℃变性15s,60℃退火延伸30s,40cycles,于60℃时收集荧光信号。
利用上述引物和探针进行反应体系的建立,最后确定采用的三平正并殖吸虫实时荧光pcr检测体系为20μl,所需各组分及相应的用量如下所示:
6.所述的pcr扩增反应体系为:
无菌双蒸水8.3μl
2倍反应缓冲液(2×buffer)10μl
引物1(10pmol/μl)0.4μl
引物2(10pmol/μl)0.4μl
探针(10pmol/μl)0.4μl
模板dna2μl
qrzdna酶(4u/μl)0.5μl
反应条件均为:95℃预变性1min;95℃变性15s,60℃退火延伸30s,40cycles;40℃5min,1cycle;于60℃时收集荧光信号。
将三平正并殖吸虫常规pcr产物连接pmd-18-t载体,经转化、提取质粒、定量,制备阳性质控标准品,以100倍倍比连续稀释,制成0.322-3.22×109copies/μl的阳性质控标准品,取ct值在20左右的标准品(3.22×1010copies/μl)作为检测体系建立时的阳性模板。采用单因子浓度梯度实验逐步改变pcr反应体系各组分浓度,优化实时荧光pcr实验条件,并调节循环参数,建立二温循环实时荧光pcr检测方法。
6.特异性试验
用建立的三平正并殖吸虫实时荧光pcr检测方法对卫氏并殖吸虫、斯氏并殖吸虫、三平正并殖吸虫、大片吸虫、华支睾吸虫、肝片吸虫、旋毛虫、蛔虫、牛带绦虫、溪蟹肌肉的基因组dna及水对照进行检测,以探究该方法检测的特异性。
如图1所示,本发明分别以卫氏并殖吸虫、斯氏并殖吸虫、三平正并殖吸虫、大片吸虫、华支睾吸虫、肝片吸虫、旋毛虫、蛔虫、牛带绦虫、溪蟹肌肉的基因组dna进行实验,以探究该方法检测的特异性。其中a图曲线1~3:卫氏并殖吸虫囊蚴;4~15:斯氏并殖吸虫、三平正并殖吸虫、大片吸虫、华支睾吸虫、肝片吸虫、旋毛虫、蛔虫、牛带绦虫、溪蟹肌肉的基因组dna、无菌去离子水(2个);b图曲线1~3:斯氏并殖吸虫囊蚴;4~15:卫氏并殖吸虫、三平正并殖吸虫、大片吸虫、华支睾吸虫、肝片吸虫、旋毛虫、蛔虫、牛带绦虫、溪蟹肌肉的基因组dna、无菌去离子水(2个)。结果仅三平正并殖吸虫能检测到扩增曲线,而其他寄生虫和健康宿主均无荧光信号的增加,证明该方法具有很好的检测特异性和通用性。
7.灵敏性试验
7.1以制备的不同浓度梯度的阳性质控标准品为pcr模板,按上述pcr反应体系和反应程序在荧光pcr仪上进行扩增,经计算机分析得出不同拷贝数的ct值,根据ct值以及相应拷贝数的对数作出标准曲线,计算扩增效率,e=10-1/k-1,其中k值为标准曲线的斜率。
7.2将两种并殖吸虫的阳性质粒进行100倍倍比稀释(三平正并殖吸虫稀释梯度为0.322-3.22×109copies/μl),采用本研究建立的方法进行灵敏度实验,实验结果显示:两种并殖吸虫的单重荧光定量pcr鉴定检测方法的灵敏度分别达到三平正并殖吸虫32.1copies/μl。
如图2所示,将三平正并殖吸虫的dna进行100倍倍比稀释,稀释梯度分别为1-6:3.22×109copies/μl、3.22×107copies/μl、3.22×105copies/μl、3.22×103copies/μl、32.2copies/μl、0.322copies/μl。各取上述浓度的阳性质控标准品1μl,以灭菌双蒸水做阴性对照,进行扩增反应,结果显示每个反应管内的荧光信号达到阈值所需的循环数(ct)和起始模板拷贝数的对数存在明显的线性关系(r2=0.9995),阳性质控标准品在标准曲线上的数据点与曲线拟合均良好。
如图3所示,为三平正并殖吸虫实时荧光pcr标准曲线,r2=0.9995、扩增效率e=105.40%、y=-6.3993x+33.957。ntc(notemplatecontrol)无模板对照均无荧光扩增曲线,为阴性结果,说明本方法具有极高敏感性。
8.重复性试验
8.1对同一阳性质控标准品设3复管同时检测,计算ct值的变异系数,考察检测方法的重复性和稳定性。
8.2灵敏性试验中检测的不同浓度梯度的阳性质控标准品,于-20℃保存30天后重检,两次检测的ct值进行比较假设检验,观察是否存在显著差异,考察本发明方法检测的稳定性。
实时荧光pcr重复3次检测同一阳性质控标准品,检测所得ct值的变异系数为2.4%;两次(间隔30d)检测同一批不同浓度梯度的阳性质控标准品,检测所得ct值经比较假设检验无显著差异,可见本方法具有良好的重复性和稳定性。
序列表
<110>中国疾病预防控制中心寄生虫病预防控制所(国家热带病研究中心)
<120>一种用于鉴定三平正并殖吸虫囊蚴的试剂盒及使用方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
tgtttgccatgggagctatt20
<210>2
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggaatcccaatgacaccagtaa22
<210>3
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>3
ctcaaacaacactgcccaaac21
<210>4
<211>375
<212>dna
<213>三平正并殖吸虫(euparagonimuscenocopioslschen)
<400>4
gggtttggggtggtgagacatatttgtatgactatgaccaaaaatgattccttgtttggc60
tactatggtttggtgtttgccatgggagctattgtgtgtttgggcagtgttgtttgagct120
catcacatgtttatggtgggtttagatgttaagactgctgtcttttttagatctgttact180
ggtgtcattgggattcctactgggattaaggttttttcttggttgttcatgctggggggc240
actcgcttgcggttttgagatcctgtggtgtggtggatattggggtttatctttttgttc300
accatagggggtgtgactggaattattttgtcttcctctattttggatagtttgttgcat360
gatacttggtttgtg375
- 还没有人留言评论。精彩留言会获得点赞!