几丁质酶基因、几丁质酶及其制备方法和应用与流程
本发明属于基因工程技术领域,具体涉及几丁质酶基因chiam及相应的重组表达载体、重组表达菌株,以及几丁质酶chiam及其制备方法和应用。
背景技术:
几丁质是由n-乙酰-β-d-氨基葡萄糖通过β-1,4糖苷键随机连接而成的直链多聚物,其结构与纤维素类似。几丁质是自然界仅次于纤维素的可再生多糖,同时也是最丰富的天然高分子化合物之一。几丁质的水解产物几丁寡糖作为一种生物活性物质具有良好的生理功能,可以应用于生物医药、食品加工、农业种植、畜牧养殖等行业。目前几丁寡糖的制备主要分为物理法、化学法以及酶法。相对于物理法和化学法,酶法制备几丁寡糖具备许多优势,如:反应条件温和、产物结构完整、过程易于控制、对环境无污染等。
几丁质酶作为一种生物酶能够专一性的分解几丁质,从而产生不同分子量的几丁寡糖。由于几丁质酶在几丁寡糖酶法制备过程中发挥着重要作用,国内外许多科学家对其展开了研究。目前限制几丁质酶产业化应用的主要问题在于其发酵活力低,生产成本高。因此降低几丁质酶生产成本,是其广泛应用于不同领域的基础。
技术实现要素:
本发明的目的是提供几丁质酶基因chiam及相应的重组表达载体、重组表达菌株,以及几丁质酶chiam及其制备方法和应用,旨在解决现有几丁质酶存在的发酵活力低的技术问题。
为了实现上述发明目的,本发明一方面,提供了一种几丁质酶基因chiam,其核苷酸序列如seqidno:1所示。
本发明另一方面,提供了一种几丁质酶chiam,所述几丁质酶chiam是本发明提供的几丁质酶基因chiam编码的蛋白,其氨基酸序列如seqidno:2所示。
本发明再一方面,提供了一种重组表达载体,其包括本发明提供的几丁质酶基因chiam。
本发明又一方面,提供了一种重组表达菌株,其包括本发明提供的重组表达载体。
本发明还有一方面,提供了一种几丁质酶chiam的制备方法,其包括如下步骤:
提供几丁质酶基因chiam、表达载体和表达菌株;
对所述几丁质酶基因chiam进行扩增,所得扩增产物与所述表达载体进行连接,得到重组表达载体;
将所述重组表达载体转入表达菌株,得到重组表达菌株;
对所述重组表达菌株进行培养,得到几丁质酶chiam;
其中,所述几丁质酶基因chiam的核苷酸序列如seqidno:1所示,所述几丁质酶chiam的氨基酸序列如seqidno:2所示。
本发明最后一方面,提供了本发明几丁质酶chiam或本发明几丁质酶chiam的制备方法制备得到的几丁质酶chiam在水解几丁质中的应用。
地中海拟无枝菌酸菌amycolatopsismediterranei(genbank:cp003729.1)的发酵液中具有几丁质酶活性,但是活性很低(培养80小时,几丁质酶活性约为0.8u/ml),远低于工业化生产的标准。本发明根据毕赤酵母的密码子偏好性,将来源于地中海拟无枝菌酸菌amycolatopsismediterranei几丁质酶的序列的表达适应指数cai由0.42提升至0.78,gc含量由68%调整至46%,从而得到几丁质酶基因chiam。通过该综合优化,该几丁质酶基因chiam的序列稳定性和密码子适应性都得到显著提高,不仅可实现毕赤酵母表达系统中的高效表达,还可降低几丁质酶chiam的生产成本。
本发明提供的几丁质酶chiam不仅丰富了几丁质酶的种类和来源途径,而且酶比活为48u/mg,在较宽的温度范围和较宽的ph范围内均表现出良好的稳定性,具有良好的应用前景和产业价值。
本发明提供的重组表达载体包括本发明提供的几丁质酶基因chiam,由于该几丁质酶基因chiam根据毕赤酵母的偏好性进行了密码子优化,具有较好的稳定性和密码子适应性,相应地,本发明提供的包括该几丁质酶基因chiam的重组表达载体也具有较好的稳定性,有利于实现几丁质酶基因chiam的稳定、高效表达,对降低几丁质酶基因chiam的生产成本起到重要作用。
本发明提供的重组表达菌株包括本发明提供的重组表达载体,因此可用于表达几丁质酶基因chiam编码的几丁质酶chiam。同时,由于几丁质酶基因chiam的序列具有较好的稳定性和密码子适应性,所得重组表达菌株可以稳定、高效表达几丁质酶chiam。
本发明提供的几丁质酶chiam的制备方法中,采用异源重组的方法,通过将几丁质酶基因chiam进行扩增,得到相应的重组表达载体、重组表达菌株,再经培养得到几丁质酶chiam。本发明提供的制备方法步骤简单,过程容易控制,可稳定、高效、低成本地生产几丁质酶chiamp,具有良好的工业前景。同时,通过本发明提供的几丁质酶chiam的制备方法制备得到的几丁质酶chiam还具有酶活性高、酶学特性稳定的优点。
本发明提供的几丁质酶chiam或本发明提供的几丁质酶chiam的制备方法制备得到的几丁质酶chiam可用于水解几丁质。由于该几丁质酶chiam的酶活较高,且在较宽的温度范围和较宽的ph范围内均表现出良好的稳定性,因此用于水解几丁质时,可使水解反应高效、稳定地进行。
附图说明
图1为本发明实施例5对重组表达菌株进行高密度发酵培养的曲线图;
图2为本发明实施例6所得几丁质酶chiam的sds-page蛋白电泳图;
图3为本发明实施例6所得几丁质酶chiam的最适反应温度及热稳定性图;
图4为本发明实施例6所得几丁质酶chiam的最适反应ph及ph稳定性图;
图5为本发明实施例6所得几丁质酶chiam水解几丁质后所得水解产物的薄层层析结果图。
具体实施方式
为使本发明实施例的目的、技术方案和技术效果更加清楚,对本发明实施例中的技术方案进行清楚、完整地描述,以下所描述的实施例是本发明一部分实施例,而不是全部的实施例。结合本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行;所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
在本发明的描述中,术语“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b的情况。其中a,b可以是单数或者复数。字符“/”一般表示前后关联对象是一种“或”的关系。
需要理解的是,本发明实施例中所提到的相关成分的重量不仅仅可以指代各组分的具体含量,也可以表示各组分间重量的比例关系,因此,只要是按照本发明实施例相关组分的含量按比例放大或缩小均在本发明公开的范围之内。具体地,本发明实施例中所述的重量可以是μg、mg、g、kg等化工领域公知的质量单位。
另外,除非上下文另外明确地使用,否则词的单数形式的表达应被理解为包含该词的复数形式。术语“包括”或“具有”旨在指定特征、数量、步骤、操作、元件、部分或者其组合的存在,但不用于排除存在或可能添加一个或多个其它特征、数量、步骤、操作、元件、部分或者其组合。
需要说明的是,本发明实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行;相关试剂和生物材料,如无特殊说明,均可从商业途径获得。
本发明实施例提供了一种几丁质酶基因chiam,其核苷酸序列如seqidno:1所示。
几丁质酶基因chiam的核苷酸序列(seqidno:1):
atgagaagatctagattggctgctgttggtttggctgctgctactttcactgctactgctgtttctttggttttgggtgctccatctgctactgctgctttgtctaacaactggtacgctgctgctccatacttgatgccacaatctaacaacccaccagacccagttactgttatgaacgctactggtttgaaggctttccaattggctttcatcttggctccaaacggtggtggttgttctccaacttgggacggtacttctgctgtttcttctgacactgctgttgctggtgttatctctagaatcagaggtgctggtggtgacgtttctgtttctgttggtggttacggtggtactaagttgggtcaaacttgtggtactgttgctgctactgctgctgcttaccaacaagttatcactaagtactctttgaaggctatcgacttcgacttggaagaaccagaatacgaaaacactgctgctatcgctaacgaattgggtgctgctaagactttgcaagctaacaacccaggtttgttcgtttctgttactatgccaggtactgctgctggtactggttggttcggtactcaattgatcgaccaagctaagtctatcggtttctctccaaacaacttctctatcatgccattcgacggtggtttcaacggtggttcttctcaagtttctgctttggaagctttccacggtttgttgatgtctcacatgggttgggactctgctactgcttacgctcacgaaggtttctctggtatgaacggtaagtctgacgctgctgaaatgttctacacttctgacttccaaactgtttacgactacgctacttctcacggtttgggtagattcactttctggtctgttaacagagacagagcttgtgttggtactactgacaacggtgtttgttctaacgttccacaaaacgactgggacttcactaagttctctgttagattcgctggtgctactccaccacaaactactccaccagttactactactccaactactccaggtaacggttcttgtactgctgctgaatgggacagaactaaggtttacgttaaggacaacgttgtttctcacaactctcacaagtggactgctaagtggtggactcaaggtgaagaaccaggtactactggtgaatggggtgtttggcaagacaacggtgcttgttaa。
地中海拟无枝菌酸菌amycolatopsismediterranei(genbank:cp003729.1)的发酵液中具有几丁质酶活性,但是活性很低(培养80小时,几丁质酶活性约为0.8u/ml),远低于工业化生产的标准。本发明实施例根据毕赤酵母的密码子偏好性,将来源于地中海拟无枝菌酸菌amycolatopsismediterranei几丁质酶的序列的表达适应指数cai由0.42提升至0.78,gc含量由68%调整至46%,从而得到几丁质酶基因chiam。通过该综合优化,该几丁质酶基因chiam的序列稳定性和密码子适应性都得到显著提高,不仅可实现毕赤酵母表达系统中的高效表达,还可降低几丁质酶chiam的生产成本。
相应地,本发明实施例还提供了一种几丁质酶chiam,其是本发明实施例提供的几丁质酶基因chiam编码的蛋白,其氨基酸序列如seqidno:2所示。
几丁质酶chiam的氨基酸序列(seqidno:2):
mrrsrlaavglaaatftatavslvlgapsataalsnnwyaaapylmpqsnnppdpvtvmnatglkafqlafilapngggcsptwdgtsavssdtavagvisrirgaggdvsvsvggyggtklgqtcgtvaataaayqqvitkyslkaidfdleepeyentaaianelgaaktlqannpglfvsvtmpgtaagtgwfgtqlidqaksigfspnnfsimpfdggfnggssqvsaleafhgllmshmgwdsatayahegfsgmngksdaaemfytsdfqtvydyatshglgrftfwsvnrdracvgttdngvcsnvpqndwdftkfsvrfagatppqttppvtttpttpgngsctaaewdrtkvyvkdnvvshnshkwtakwwtqgeepgttgewgvwqdngac。
本发明实施例提供的几丁质酶chiam不仅丰富了几丁质酶的种类和来源途径,而且酶比活为48u/mg,在较宽的温度范围和较宽的ph范围内均表现出良好的稳定性,具有良好的应用前景和产业价值。
相应地,本发明实施例还提供了一种重组表达载体,其包括本发明实施例提供的几丁质酶基因chiam。
本发明实施例提供的重组表达载体包括本发明实施例提供的几丁质酶基因chiam,由于该几丁质酶基因chiam根据毕赤酵母的偏好性进行了密码子优化,具有较好的稳定性和密码子适应性,相应地,本发明实施例提供的包括该几丁质酶基因chiam的重组表达载体也具有较好的稳定性,有利于实现几丁质酶基因chiam的稳定、高效表达,对降低几丁质酶基因chiam的生产成本起到重要作用。
相应地,本发明实施例还提供了一种重组表达菌株,其包括本发明实施例提供的重组表达载体。
本发明实施例提供的重组表达菌株包括本发明提供的重组表达载体,因此可用于表达几丁质酶基因chiam编码的几丁质酶chiam。同时,由于几丁质酶基因chiam的序列具有较好的稳定性和密码子适应性,所得重组表达菌株可以稳定、高效表达几丁质酶chiam。
相应地,本发明实施例还提供了一种几丁质酶chiam的制备方法,其包括如下步骤:
s1、提供几丁质酶基因chiam、表达载体和表达菌株;
s2、对几丁质酶基因chiam进行扩增,所得扩增产物与表达载体进行连接,得到重组表达载体;
s3、将重组表达载体转入表达菌株,得到重组表达菌株;
s4、对重组表达菌株进行培养,得到几丁质酶chiam;
其中,几丁质酶基因chiam的核苷酸序列如seqidno:1所示,几丁质酶chiam的氨基酸序列如seqidno:2所示。
本发明实施例提供的几丁质酶chiam的制备方法中,采用异源重组的方法,通过将几丁质酶基因chiam进行扩增,得到相应的重组表达载体、重组表达菌株,再经培养得到几丁质酶chiam。本发明实施例提供的制备方法步骤简单,过程容易控制,可稳定、高效、低成本地生产几丁质酶chiamp,具有良好的工业前景。同时,通过本发明实施例提供的几丁质酶chiam的制备方法制备得到的几丁质酶chiam还具有酶活性高、酶学特性稳定的优点。
具体地,s1中,几丁质酶基因chiam的核苷酸序列如seqidno:1所示,该序列是对来源于地中海拟无枝菌酸菌amycolatopsismediterranei几丁质酶的序列(genbank:cp003729.1)进行综合优化得到,具体优化方法及优化后基因的优势如前文所述,此处不再赘述。
表达载体,在本发明实施例中,用于构建表达如seqidno:1所示的几丁质酶基因chiam的重组表达载体。在一些实施例中,选择毕赤酵母表达载体。这是因为本发明实施例提供的几丁质酶基因chiam已根据毕赤酵母的密码子偏好性进行了优化,因此选择毕赤酵母表达载体可以进一步提高几丁质酶基因chiam的表达稳定性和表达量。具体地,可选择毕赤酵母表达载体ppiczαa用于构建重组表达载体,相应地,将所得重组表达载体命名为ppiczαa-chiams。
表达菌株,在本发明实施例中用于构建重组表达菌株。在一些实施例中,选择毕赤酵母表达菌株。这是因为本发明实施例提供的几丁质酶基因chiam根据毕赤酵母的密码子偏好性进行了优化,且毕赤酵母表达系统是本领域中较为成熟的表达系统,具有易于进行基因工程遗传操作、可实现高密度发酵、表达水平较高以及易于分离纯化蛋白、适合工业规模化生产等优点,有利于获得酶活性高且生产成本更低的几丁质酶chiam。具体地,可选择毕赤酵母x33作为表达菌株。
s2中,通过对几丁质酶基因chiam进行扩增,所得扩增产物与表达载体进行连接,即可得到重组表达载体。在一些实施例中,用于扩增几丁质酶基因chiam的引物包括正向引物chiam-f和反向引物chiam-r,且正向引物chiam-f的核苷酸序列如seqidno:3所示,反向引物chiam-r的核苷酸序列如seqidno:4所示。
chiam-f的核苷酸序列(seqidno:3):
agtcgaattcgctttgtctaacaactggtacgctg。
chiam-r的核苷酸序列(seqidno:4):
ttctctagaacaagcaccgttgtcttgccaa。
s3中,将所得重组表达载体转入表达菌株中,得到重组表达菌株,可表达相应的蛋白。本发明实施例对于重组表达菌株的具体构建方法没有特殊要求,采用本领域常规方法即可。
s4中,通过对重组表达菌株进行培养,几丁质酶基因chiam的核苷酸序列随着重组表达菌株的繁殖而复制,然后收集重组表达菌株的培养物,经分离、纯化,得到几丁质酶chiam。在一些实施例中,重组表达菌株进行培养的方法是高密度发酵培养,其方法是:将重组表达菌株接入含bmgy培养基的三角瓶中,在30℃、220rpm条件下进行过夜培养,然后再接入含ypg培养基的三角瓶中,在30℃、200rpm条件下进行振荡过夜培养。将二次过夜培养的重组表达菌株接种至含bsm培养基的发酵罐中,在30℃、ph5.0、搅拌速度500rpm、空气流量为40l/min的条件下进行发酵培养,得到发酵液。将高密度发酵培养所得发酵液进行纯化,得到几丁质酶chiam。
相应地,本发明实施例还提供了本发明实施例提供的几丁质酶chiam或本发明实施例提供的几丁质酶chiam的制备方法制备得到的几丁质酶chiam在水解几丁质中的应用。
本发明实施例提供的几丁质酶chiam或本发明实施例提供的几丁质酶chiam的制备方法制备得到的几丁质酶chiam可用于水解几丁质。由于该几丁质酶chiam的酶活较高,且在较宽的温度范围和较宽的ph范围内均表现出良好的稳定性,因此用于水解几丁质时,可使水解反应高效、稳定地进行。
在一些实施例中,本发明实施例提供的几丁质酶chiam在水解蛋白质的反应中,其反应温度为30℃-60℃,最适反应温度为50℃。
在一些实施例中,本发明实施例提供的几丁质酶chiam在水解蛋白质的反应中,其反应ph为3.0-8.0,最适反应ph为5.0。
为使本发明上述实施细节和操作能清楚地被本领域技术人员理解,以及本发明实施例几丁质酶基因、几丁质酶及其制备方法和应用的进步性能显著的体现,以下通过实施例来举例说明上述技术方案。
以下实施例中涉及到的实验材料和试剂:
菌株与载体:大肠杆菌菌株top10、毕赤酵母x33、表达载体ppiczαa均从商业途径购买获得。
q5高保真taq酶mix购自neb公司;质粒提取、胶纯化试剂盒购自天根生化科技(北京)有限公司;限制性内切酶购自宝日医生物技术(北京)有限公司;博来霉素(zeocin)购自invitrogen公司。
培养基:大肠杆菌培养基为lb(1%(w/v)蛋白胨,0.5%(w/v)酵母提取物,1%(w/v)nacl,ph7.0)。lba为lb培养基加入25μg/ml博来霉素。
酵母培养基为ypd(1%(w/v)酵母提取物,2%(w/v)蛋白胨,2%(w/v)葡萄糖)。酵母筛选培养基为ypdz(ypd+100mg/l博来霉素);
酵母诱导培养基为bmgy(1%(w/v)酵母提取物、2%(w/v)蛋白胨、1.34%(w/v)ynb、0.00004%(w/v)生物素、1%甘油(v/v)),其中,ynb为酵母氮源基础(yeastnitrogenbase)。
bmmy培养基:除了以0.5%(v/v)甲醇代替甘油,其余成分与bmgy相同。
实施例1
本实施例提供了几丁质酶基因序列分析及密码子优化过程,包括如下步骤:
(11)通过分析amycolatopsismediterranei在ncbi基因组数据(genbank:cp003729.1),发现在其基因组7823925-7825130区间的核苷酸为几丁质酶chiam的编码基因,该基因全长为1206bp,编码401个氨基酸(氨基酸序列如seqidno.2所示)。通过信号肽预测软件signalp-5.0server预测分析发现几丁质酶chiam前32个氨基酸为其信号肽。
(12)由于amycolatopsismediterranei和毕赤酵母在基因编码上存在差异,因此需要根据毕赤酵母密码子偏好性对几丁质酶chiam进行优化。优化后的几丁质酶chiam编码基因命名为chiam(核苷酸序列如seqidno.1所示)。与原始基因相比,chiam的gc含量为46%,更接近毕赤酵母编码偏好性(原始基因gc含量为68%);chiam的表达适应指数由原来的0.42提升至0.78,优化后的chiam与原始基因核苷酸相似性为78%。
实施例2
本实施例提供了一种含实施例1所得几丁质酶基因chiam的重组表达载体的构建过程,该重组表达载体以ppiczαa作为表达载体,所用信号肽为ppiczαa所带的α信号肽,因此在构建过程中需要去除chiam本身信号肽。具体如下:
(13)根据合成基因chiam的序列设计一对引物chiam-f和chiam-r,其核苷酸序列分别如seqidno:3-4所示,用于扩增去除信号肽的chiam基因;
(14)通过pcr扩增获得去除信号肽的基因chiams,用限制性内切酶ecori和xbai分别过夜酶切表达载体ppiczαa和基因chiams,将过夜酶切的表达载体ppiczαa和chiams进行纯化回收后进行连接反应;
(15)采用热激法将连接反应产物转入大肠杆菌top10,采用菌液pcr验证重组转化子;
(16)将验证成功的转化子接入lbz液体培养基,提取质粒,进行测序验证,最终获得表达载体ppiczαa-chiams。
实施例3
本实施例提供了一种含实施例1所得重组表达载体的重组毕赤酵母工程菌的构建过程,具体如下:
(17)用限制性内切酶saci线性化表达载体ppiczαa-chiams后,采用电转化法转入毕赤酵母x33,从而获得不同的阳性转化子。重组毕赤酵母的筛选采用24孔板法,具体步骤是:将ypdz平板上的重组转化子用牙签逐个挑至每孔含有2mlbmgy培养基的24孔板,30℃,200rpm过夜培养24小时后,4000rpm离心去掉上清,加入2ml的bmmy培养基,30℃,200rpm培养24小时,测定重组转化子的几丁质酶活性。
(18)几丁质酶活性的测定方法如下:首先将胶体几丁质和酶液在45℃分别进行预热;将预热好的500μl酶液加入10ml玻璃试管,然后在加入500ml胶体几丁质溶液,45℃反应30分钟后加入2mldns试剂终止反应,于100℃沸水浴10分钟进行显色,冷却后离心取上清在540nm下测定吸光值。酶活单位的定义为:每分钟生成1μmol乙酰氨基葡萄糖所用酶的量定义为一个活力单位。通过筛选96个阳性转化子,最终获得3个酶活优势菌株分别命名为ch15(1.1u/ml)、ch66(0.8u/ml)和ch23(0.5u/ml)。
实施例4
本实施例提供了将实施例3所得3个酶活优势菌株分别进行摇瓶发酵培养的过程,具体如下:
(19)首先将相应的重组工程菌种接入含有5mlbmgy培养基的50ml离心管中,30℃,220rpm培养24小时左右,将培养好的重组酵母工程菌种按1%(v/v)的接种量接入含有50mlbmmy培养基的250ml三角瓶中。摇瓶培养条件为30℃,220rpm,每隔24小时加入1%(v/v)的甲醇进行诱导,同时取样进行几丁质酶活性的测定,通过酶活测定发现,诱导培养120小时后ch15、ch66和ch23的酶活分别为3.1u/ml、2.3u/ml和2.1u/ml。
实施例5
本实施例提供了将实施例4摇瓶发酵培养后所得重组工程菌ch15进行高密度发酵培养的过程,具体如下:
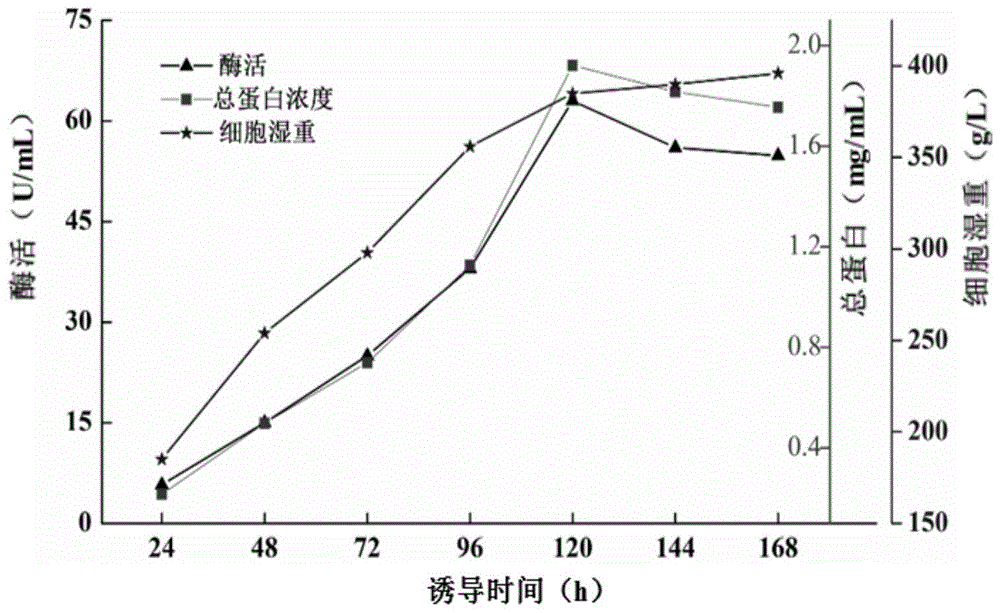
(20)将单菌落重组酵母工程菌接入含有50mlypg培养基的250ml三角瓶中,30℃,200rpm振荡过夜培养。再将过夜培养的重组酵母工程菌按1%(v/v)的接种量接入含有100mlypg培养基的500ml三角瓶中,30℃,200rpm振荡过夜培养,至od600大于10。将二次过夜培养的重组酵母工程菌按10%(v/v)的接种量接入含有2lbsm培养基的5l发酵罐。重组酵母工程菌在5l发酵罐的培养条件为:温度为30℃、ph值5.0、搅拌速度为500rpm、空气流量为40l/min。培养初期,以甘油作为碳源供菌体生长。当菌体湿重达到180g/l左右时,停止流加甘油,待甘油被菌体吸收完后(溶氧迅速上升)开始用甲醇诱导。甲醇的添加量根据溶氧进行调整。培养过程中,每24小时取样测定菌体湿重、酶活和总蛋白浓度。所得高密度发酵培养的曲线图如图1所示。
由图1可知,当诱导培养至120小时,发酵酶活达到最大(63u/ml),总蛋白浓度最大为1.92g/l,细胞湿重则是在诱导至144小时后达到最大(396g/l)。
实施例6
本实施例提供了将实施例5所得发酵液进行纯化,得到几丁质酶chiam的过程,具体如下:
(21)将5l发酵罐的发酵液离心取上清进行纯化回收;
(22)用10kda超滤管将上清酶液进行超滤浓缩;
(23)用ni-ida蛋白纯化试剂盒进行纯化,得到几丁质酶chiam。
通过实验测定,纯化后的几丁质酶chiam酶比活为48u/mg。纯化后的sds-page蛋白电泳结果如图2所示,由图2可知,重组几丁质酶chiam的大小约45kda。
实验例1
在ph5.0条件下测定实施例6所得几丁质酶chiam在30-70℃不同温度下的酶活,以测定酶活最高温度下的酶活为100%,计算其它温度下的相对酶活。检测结果如图3所示。由图3可知,当在30-60℃范围内,几丁质酶chiam的相对酶活均大于60%,最适反应温度为50℃。
热稳定性测定如下:将几丁质酶chiam在30-60℃不同温度下水浴热处理60分钟后测定剩余酶活,以没有做热处理样品的酶活为100%,计算其它温度下的相对剩余酶活。实验结果如图3所示。由图3可知,在30-50℃范围内,几丁质酶chiam具有良好的稳定性,热处理60分钟后,剩余酶活均大于80%%。
实验例2
在50℃条件下,分别测定实施例6所得几丁质酶chiam在ph3.0-8.0条件下的酶活,以测定酶活最高ph下的酶活为100%,计算其它ph下的相对酶活,检测结果如图4所示。由图4可知,几丁质酶chiam的最适反应ph值为5.0,在ph4.0-6.0范围内相对酶活均大于70%,当ph增加到7.0或降到3.0时,相对酶活均急剧下降,分别为25%和8%。
不同ph对几丁质酶chiam稳定性影响测定如下:
将几丁质酶chiam在ph3.0-8.0条件下室温保存6小时测定剩余酶活,以没有做任何处理的样品的酶活为100%,计算其它温度下的相对剩余酶活,检测结果如图4所示。由图4可知,几丁质酶chiam在ph3.0-8.0范围内,室温保存4小时后剩余酶活均大于85%,说明其在该ph范围内具有良好的稳定性。
实验例3
将实施例6所得几丁质酶chiam用于水解几丁质的过程如下:
称取0.2g胶体几丁质溶于50ml乙酸乙酸钠缓冲液(ph5.0),加入100u几丁质酶chiam,50℃,120rpm进行水解反应,水解1小时和3小时分别取样进行薄层层析。薄层层析的方法是:取5μl水解反应产物和5μl几丁寡糖标准混合物,分别点到硅胶板(silicagel60,merck)上;将点好样的硅胶板放置在扩展缸进行扩展,扩展缓冲液为异丙醇、水和氨水混合物(体积比为15:1:7.5);将扩展完的硅胶板从扩展缸取出吹干后喷显示剂(显示剂为丙酮、苯胺、二苯胺和磷酸混合物,体积比为100:2:2:10);吹干后将硅胶板放置在120℃条件下进行高温显色,结果如图5所示。
由图5可知,水解反应进行1小时后,水解产物中主要由乙酰胺基葡萄糖、几丁二糖和几丁三糖构成,当水解反应进行到3小时,水解产物则主要为几丁二糖和几丁三糖。
本发明实施例提供的几丁质酶chiam用于水解几丁质时,所得的主要产物为几丁二糖和几丁三糖,几丁二糖和几丁三糖作为生物活性物质,在医药、农业、食品等行业具有广泛且良好的应用效果和前景。因此,本发明实施例提供的几丁质酶chiam在几丁寡糖的酶解制备领域具有很大的应用潜力。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
序列表
<110>深圳市润康植物营养技术有限公司
<120>几丁质酶基因、几丁质酶及其制备方法和应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>1206
<212>dna
<213>地中海拟无枝菌酸菌(amycolatopsismediterranei)
<400>1
atgagaagatctagattggctgctgttggtttggctgctgctactttcactgctactgct60
gtttctttggttttgggtgctccatctgctactgctgctttgtctaacaactggtacgct120
gctgctccatacttgatgccacaatctaacaacccaccagacccagttactgttatgaac180
gctactggtttgaaggctttccaattggctttcatcttggctccaaacggtggtggttgt240
tctccaacttgggacggtacttctgctgtttcttctgacactgctgttgctggtgttatc300
tctagaatcagaggtgctggtggtgacgtttctgtttctgttggtggttacggtggtact360
aagttgggtcaaacttgtggtactgttgctgctactgctgctgcttaccaacaagttatc420
actaagtactctttgaaggctatcgacttcgacttggaagaaccagaatacgaaaacact480
gctgctatcgctaacgaattgggtgctgctaagactttgcaagctaacaacccaggtttg540
ttcgtttctgttactatgccaggtactgctgctggtactggttggttcggtactcaattg600
atcgaccaagctaagtctatcggtttctctccaaacaacttctctatcatgccattcgac660
ggtggtttcaacggtggttcttctcaagtttctgctttggaagctttccacggtttgttg720
atgtctcacatgggttgggactctgctactgcttacgctcacgaaggtttctctggtatg780
aacggtaagtctgacgctgctgaaatgttctacacttctgacttccaaactgtttacgac840
tacgctacttctcacggtttgggtagattcactttctggtctgttaacagagacagagct900
tgtgttggtactactgacaacggtgtttgttctaacgttccacaaaacgactgggacttc960
actaagttctctgttagattcgctggtgctactccaccacaaactactccaccagttact1020
actactccaactactccaggtaacggttcttgtactgctgctgaatgggacagaactaag1080
gtttacgttaaggacaacgttgtttctcacaactctcacaagtggactgctaagtggtgg1140
actcaaggtgaagaaccaggtactactggtgaatggggtgtttggcaagacaacggtgct1200
tgttaa1206
<210>2
<211>401
<212>prt
<213>地中海拟无枝菌酸菌(amycolatopsismediterranei)
<400>2
metargargserargleualaalavalglyleualaalaalathrphe
151015
thralathralavalserleuvalleuglyalaproseralathrala
202530
alaleuserasnasntrptyralaalaalaprotyrleumetprogln
354045
serasnasnproproaspprovalthrvalmetasnalathrglyleu
505560
lysalapheglnleualapheileleualaproasnglyglyglycys
65707580
serprothrtrpaspglythrseralavalserseraspthralaval
859095
alaglyvalileserargileargglyalaglyglyaspvalserval
100105110
servalglyglytyrglyglythrlysleuglyglnthrcysglythr
115120125
valalaalathralaalaalatyrglnglnvalilethrlystyrser
130135140
leulysalaileasppheaspleuglugluproglutyrgluasnthr
145150155160
alaalailealaasngluleuglyalaalalysthrleuglnalaasn
165170175
asnproglyleuphevalservalthrmetproglythralaalagly
180185190
thrglytrppheglythrglnleuileaspglnalalysserilegly
195200205
pheserproasnasnpheserilemetpropheaspglyglypheasn
210215220
glyglyserserglnvalseralaleuglualaphehisglyleuleu
225230235240
metserhismetglytrpaspseralathralatyralahisglugly
245250255
pheserglymetasnglylysseraspalaalaglumetphetyrthr
260265270
serasppheglnthrvaltyrasptyralathrserhisglyleugly
275280285
argphethrphetrpservalasnargaspargalacysvalglythr
290295300
thraspasnglyvalcysserasnvalproglnasnasptrpaspphe
305310315320
thrlyspheservalargphealaglyalathrproproglnthrthr
325330335
proprovalthrthrthrprothrthrproglyasnglysercysthr
340345350
alaalaglutrpaspargthrlysvaltyrvallysaspasnvalval
355360365
serhisasnserhislystrpthralalystrptrpthrglnglyglu
370375380
gluproglythrthrglyglutrpglyvaltrpglnaspasnglyala
385390395400
cys
<210>3
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>3
agtcgaattcgctttgtctaacaactggtacgctg35
<210>4
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>4
ttctctagaacaagcaccgttgtcttgccaa31
- 还没有人留言评论。精彩留言会获得点赞!