奥硝唑酯类前药、药物组合物及其制备方法和应用与流程
1.本发明涉及一种奥硝唑酯类前药、药物组合物及其制备方法和应用,属于药物化学领域。
背景技术:
2.奥硝唑(ornidazole)为roche开发的第三代硝基咪唑类抗生素,对厌氧菌感染,以及原虫、滴虫感染等有抑制作用。奥硝唑药效持续时间长,其血浆消除半衰期为14.4小时,高于甲硝唑的8.4小时和替硝唑的12.7小时,可减少患者服药次数,方便使用;奥硝唑引入临床后,研究人员发现,与替硝唑、甲硝唑等硝基咪唑类药物相比,该品抗感染优势更为明显。致突变和致畸作用低于甲硝唑与替硝唑;在抗厌氧菌感染方面,最低抑菌浓度和最低杀菌浓度均小于甲硝唑和替硝唑,用药疗效优于甲硝唑和替硝唑。
3.2009年底南京圣和药业研发出了左奥硝唑上市制剂为注射液,左奥硝唑是奥硝唑的左旋体,是我国自主研发的1类新药,具有较好的抗厌氧菌和抗原虫作用,药理研究发现,右奥硝唑是奥硝唑神经毒性的主要来源,左奥硝唑对小脑细胞无损伤,临床应用不良反应显著降低,安全性大大提高。目前还有左奥硝唑口服固体制剂上市。
4.磷酸左奥硝唑酯二钠是奥硝唑左旋异构体磷酸酯衍生物的钠盐,为已上市左奥硝唑的前药。左奥硝唑磷酸酯二钠解决了左奥硝唑水溶性差的问题,但是左奥硝唑磷酸酯二钠在水溶液中不稳定,只能制备成冻干制剂解决制剂贮藏中的稳定性,而使用中的稳定性还是不能解决;文献报道左奥硝唑磷酸酯二钠制剂并没有解决注射部位疼痛问题,可能原因是局部钠离子浓度过高或因左奥硝唑磷酸酯二钠快速水解产生的高浓度左奥硝唑引起的,未达到改良的目的。因此,在目前左奥硝唑的研究基础上,存在对左奥硝唑进一步改造的必要性。
技术实现要素:
5.本发明的目的在于提供一种奥硝唑酯类前药、药物组合物及其制备方法和应用。
6.本发明主要是通过如下技术方案实现的:
7.本发明中通过对消旋奥硝唑或左奥硝唑的羟基进行衍生化,设计并制备得到了一系列酯类前体药物,并将其制成脂肪乳注射制剂,克服了现有奥硝唑临床应用中存在的一些问题,可达到延长半衰期、提高稳定性、提高药效或降低毒副作用等目的。
8.本发明的目的之一是提供了一类奥硝唑酯类前药,即具有结构式(1)所示结构的化合物、其消旋体、立体异构体、药学上可接受的盐或溶剂合物,
[0009][0010]
在结构式(1)中,r1,r2和r3相同或不同,彼此独立地选自氢、c
1-10
烷基、c
2-10
烯基、c2-10
炔基、c
3-8
环烷基、5-10元杂环基、c
6-10
芳基和5-10元杂芳基;其中所述c
1-10
烷基、c
2-10
烯基、c
2-10
炔基、c
1-10
烷氧基、c
3-8
环烷基、c
3-8
环烷基氧基、5-10元杂环基、c
6-10
芳基和5-10元杂芳基可任选地被一个、两个或更多个卤素、羟基、氨基、c
1-8
烷基、c
2-8
烯基、c
2-8
炔基、c
1-8
烷氧基、任选被c
1-10
烷基取代的c
6-10
芳基或任选被c
1-10
烷基取代的5-10元杂芳基取代;0≦n≦6,n为整数。
[0011]
根据本发明的实施方案,在结构式(1)中,r1,r2和r3相同或不同,彼此独立地选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、5-8元杂环基、c
6-8
芳基和5-8元杂芳基;其中所述c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基、c
3-8
环烷基、c
3-8
环烷基氧基、5-8元杂环基、c
6-8
芳基和5-8元杂芳基可任选地被一个、两个或更多个卤素、羟基、氨基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基、任选被c
1-6
烷基取代的c
6-8
芳基或任选被c
1-6
烷基取代的5-8元杂芳基取代。
[0012]
根据本发明的实施方案,在结构式(1)中,r1,r2和r3相同或不同,彼此独立地选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基和c
1-6
烷氧基,其中所述c
1-6
烷基、c
2-6
烯基、c
2-6
炔基和c
1-6
烷氧基可任选地被一个、两个或更多个氟、氯、溴、碘、羟基、氨基或任选地被c
1-6
烷基取代的苯基取代。
[0013]
根据本发明的实施方案,在结构式(1)中,r1为甲基、乙基、丙基、异丙基、正丁基、异丁基、叔丁基;r2为氢、甲基、乙基、丙基、异丙基、正丁基、异丁基、叔丁基;r3为甲基、乙基、丙基、异丙基、正丁基、叔丁基、异丁基、甲氧基、乙氧基、异丙氧基、叔丁氧基、异丁氧基。
[0014]
根据本发明的实施方案,结构式(1)所示的化合物选自以下化合物:
[0015][0016]
根据本发明的实施方案,所述结构式(1)所示的化合物进一步优选自以下化合物及其左旋对映异构体,即1位碳是s构型的异构体。化合物的左旋对映异构体如下所示:
[0017][0018]
本发明的目的之二是提供一类奥硝唑衍生物的制备方法。
[0019]
本发明提供结构式(1)所示的化合物、其消旋体、立体异构体、药学上可接受的盐或溶剂合物的制备方法。
[0020]
根据本发明实施方案,结构式(1)所示化合物的制备包括使化合物1与化合物2反应的步骤,其反应式如下:
[0021][0022]
其中,化合物1选自消旋的、r构型或s构型的奥硝唑;化合物2为卤代有机碳酸酯结构,r1、r2、r3均独立得具有上文所述的定义;x选自氯、溴或碘。
[0023]
其合成方法为:
[0024]
在一定温度下,取一定量的奥硝唑、缚酸剂于反应容器中,加入适量反应溶剂混合,然后向反应容器中缓缓加入化合物2,加毕,将反应液在一定温度下搅拌反应一段时间。反应后处理时,将反应液萃取,洗涤,干燥后浓缩,柱层析得到目标化合物。
[0025]
本发明还提供了化合物2的制备方法,当化合物2结构中的x为氯或碘,r1为烷基、r2为氢、r3为烷氧基时,其反应式如下:
[0026][0027]
其合成方法为:
[0028]
a)化合物2-1与三光气反应,得到氯甲酸酯形式的化合物2-2;
[0029]
b)化合物2-2与醇r
3-oh反应得到氯代有机碳酸酯,即化合物2(x=cl);
[0030]
c)将化合物2(x=cl)与nai反应,得到碘代有机碳酸酯,即化合物2(x=i);
[0031]
当化合物2结构中的x为溴,r1为烷基、r2为氢、r2为烷氧基时,其反应式如下:
[0032][0033]
其合成方法为:
[0034]
a)化合物2-3(有机碳酸二酯)与二溴海因反应得到溴代有机碳酸酯,即化合物2(x=br)。
[0035]
根据本发明的实施方案,所述反应可以在溶剂存在下进行;所述溶剂选自丙酮、二氯甲烷、三氯甲烷、四氯化碳和乙醚中的至少一种;
[0036]
根据本发明的实施方案,所述反应可以在缚酸剂,如碱存在下进行;所述缚酸剂可以选自吡啶、三乙胺、diea、dbu、naoh、koh、k2co3、khco3、naco3和nahco3中的至少一种。
[0037]
根据本发明的实施方案,所述制备方法的反应时间为0.5~3h,例如为1~2h。
[0038]
根据本发明的实施方案,所述步骤a)中,将化合物2-1在低温环境中且在n2保护下进行反应。进一步地,还包括减压抽气(抽除的气体经碱液吸收)残留液于室温下减压浓缩除去溶剂,然后通过蒸馏方法得到化合物2-2的步骤。
[0039]
根据本发明的实施方案,所述步骤b)中,将化合物2-2在无水无氧的溶剂条件下与醇反应。优选地,置于冰浴条件下,向其中加入缚酸剂进而获得化合物2。
[0040]
根据本发明的实施方案,所述方法还包括后处理步骤。如将反应液洗涤、干燥、减压浓缩后得到化合物2。
[0041]
根据本发明实施方案,结构式(1)所示化合物的制备包括使化合物3与化合物4或化合物5反应的步骤,其反应式如下:
[0042][0043]
其合成方法为:
[0044]
在一定温度下,取一定量的化合物3于反应容器中,加入适量反应溶剂溶解,氩气或氮气等气体置换反应容器中空气2~3次,缓慢加入diabl-h,加毕,搅拌一段时间,随后缓慢依次加入缚酸剂、化合物4或5,加毕,在一定温度下搅拌反应一段时间。反应后处理时,将反应液萃取,洗涤,干燥后浓缩,柱层析得到目标化合物。
[0045]
根据本发明的实施方案,所述制备方法的反应温度为-80~50℃,例如为-80~30℃;反应时间为1~16h,例如为2~6h。
[0046]
根据本发明的实施方案,所述制备方法还包括后处理步骤。如将反应液浓缩除去溶剂、洗涤、浓缩或蒸馏得到产物。
[0047]
根据本发明的实施方案,根据本发明的实施方案,所用缚酸剂可以为无机碱如
naoh、koh、k2co3、khco3、naco3、nahco3或有机碱如三乙胺、吡啶、dmap、diea、dbu中的一种或多种;反应溶剂可以为丙酮、二氯甲烷、三氯甲烷、四氯化碳、四氢呋喃、乙腈、dmf、dmac或乙醚中的一种或几种;所用的相转移催化剂可以为四丁基溴化铵、18-冠-6等。
[0048]
本发明还提供了化合物3的制备方法,包括将化合物1与化合物3-1或化合物3-2反应的步骤,其反应式如下:
[0049][0050]
其中,化合物1选自消旋的、r构型或s构型的奥硝唑;r1为烷基,r3为烷基;x选自氯或溴。
[0051]
其合成方法为:
[0052]
在一定温度下,取一定量的奥硝唑、缚酸剂于反应容器中,加入适量反应溶剂混合,氩气或氮气等气体置换反应容器中空气2~3次,然后向反应容器中缓缓加入化合物3-1或3-2,加毕,将反应液在一定温度下搅拌反应一段时间。反应后处理时,将反应液萃取,洗涤,干燥后浓缩,柱层析得到目标化合物3。
[0053]
根据本发明的实施方案,可向上述反应中加入dmap等酰化催化剂或加热加快反应进程。
[0054]
根据本发明的实施方案,所述制备方法的反应温度为-5~80℃,例如为0~50℃;反应时间为1~8h,例如为2~6h。
[0055]
根据本发明的实施方案,所述制备方法还包括后处理步骤。如将反应液浓缩除去溶剂、洗涤、浓缩或蒸馏得到产物。
[0056]
根据本发明的实施方案,所用缚酸剂可以为无机碱如naoh、koh、k2co3、khco3、naco3、nahco3或有机碱如三乙胺、吡啶、dmap、diea、dbu中的一种或多种;反应溶剂可以为丙酮、二氯甲烷、三氯甲烷、四氯化碳、四氢呋喃、乙腈、dmf、dmac或乙醚中的一种或几种;所用的相转移催化剂可以为四丁基溴化铵、18-冠-6等。
[0057]
本发明的目的三是提供了上述结构式(1)所示的化合物、其消旋体、立体异构体、药学上可接受的盐或溶剂合物、或其药学上可接受的盐的溶剂合物在制备药物中的应用。
[0058]
根据本发明的实施方案,所述药物可用于治疗一种或更多种以下的疾病:所述药物用于治疗由脆弱拟杆菌、狄氏拟杆菌、卵园拟杆菌、多形拟杆菌、普通拟杆菌、梭状芽胞杆菌、真杆菌、消化球菌和消化链球菌、幽门螺杆菌、黑色素拟杆菌、梭杆菌、co2噬织维菌、牙龈类杆菌等敏感厌氧菌所引起的多种感染性疾病。
[0059]
本发明的目的四是提供了含有上述结结构式(1)所示的化合物、其消旋体、立体异构体、药学上可接受的盐或溶剂合物、或其药学上可接受的盐的溶剂合物的药物组合物。
[0060]
根据本发明的实施方案,所述药物组合物还包含药学上可接受的辅料。所述药物组合物可以为口服制剂,如片剂、胶囊剂、颗粒剂等,还可以为注射剂、滴眼液、凝胶剂、乳膏剂、软膏剂或巴布剂等。
[0061]
本发明的药物组合物可通过注射途径给药。注射途径包括静脉注射、肌肉注射、皮下注射、皮内注射和穴位注射等。可将本发明的药物组合物制成适合注射途径给药的制剂,例如注射液、注射乳剂、粉针剂等;所述注射乳剂可为脂肪乳注射剂。
[0062]
本发明还提供一种脂肪乳注射剂,其包含:结构式(1)所示的化合物、其消旋体、立体异构体、药学上可接受的盐或溶剂合物、或药学上可接受的盐的溶剂合物,油性物质和乳化剂。
[0063]
适合用于本发明的油性物质为可注射用油酯,选自大豆油、红花油、棉籽油、橄榄油、芝麻油、椰子油、蓖麻油、沙棘油、月见草油、玉米油、鸦胆子油、紫苏油、葡萄籽油、茶油、棕榈油、花生油、中链油(中链甘油三酯)、长链甘油三酯、油酸乙酯、乙酰化单甘油酯、丙二醇双酯、亚油酸甘油酯或聚乙二醇月桂酸甘油酯,或其中两种或更多种的组合。
[0064]
根据本发明的实施方案,所述乳化剂选自天然乳化剂,如大豆卵磷脂、蛋黄卵磷脂、氢化卵磷脂、饱和和不饱和c
12-18
脂肪酰磷脂酰胆碱中的一种、两种或更多种的组合;蛋黄卵磷脂和/或大豆磷脂,或合成非离子乳化剂,如吐温-80、泊洛沙姆-188或其组合。
[0065]
根据本发明的实施方案,所述脂肪乳注射剂中,还可以根据需要进一步加入其它医药学上可接受的辅料如助乳化剂、渗透压调节剂、ph调节剂、抗氧剂、稳定剂、金属螯合剂等。
[0066]
所述助乳化剂为油酸、油酸钠、胆固醇、胆酸、胆酸钠、去氧胆酸钠、甘氨胆酸钠或蛋黄磷脂酰甘油(epg),或其中两种或更多种的组合。
[0067]
所述等渗调节剂选自甘油、山梨醇、葡萄糖、麦芽糖、甘露糖醇或丙二醇,或其中两种或更多种的组合。
[0068]
所述ph调节剂选自氢氧化钠、盐酸、磷酸、磷酸盐、柠檬酸、柠檬酸盐、枸橼酸、枸橼酸盐、醋酸、醋酸盐、甘氨酸或赖氨酸,或其中两种或更多种的组合;根据本发明的实施方案,ph调节剂调节ph值在5.5~8.5之间,优选为6.0~8.0。
[0069]
所述抗氧剂选自亚硫酸钠、亚硫酸氢钠或焦亚硫酸钠,或其中两种或更多种的组合。
[0070]
所述稳定剂为选自油酸、磷脂酰甘油和油酸钠的一种、两种或更多种的组合。
[0071]
所述金属螯合剂为乙二胺四乙酸(edta)或乙二胺四乙酸钠盐(edta-na),特别是乙二胺四乙酸二钠盐。
[0072]
根据本发明的实施方案,所述脂肪乳注射剂可以为脂肪乳注射液或冻干乳。其中所述脂肪乳注射液还包含注射用水。所述脂肪乳注射液经冷冻干燥得到冻干乳;在冷冻干燥前,可向脂肪乳注射液中加入冻干保护剂,所述冻干保护剂可以为乳糖、蔗糖、甘露醇、右旋糖酐20、右旋糖酐40、右旋糖酐70、木糖醇、山梨醇、海藻糖中的一种、两种、三种或更多种的组合。
[0073]
本发明制备的脂肪乳注射剂适宜于以肠胃外给药方式给药,肠胃外给药包括静脉内、动脉内、皮下、腹膜内或肌内注射或输注;或颅内例如鞘内或脑室内给药。可按单次大剂量形式肠胃外给药,或可通过例如连续灌注泵给药。或颅内例如鞘内或脑室内给药;注射剂常用容器有玻璃安瓿、西林瓶、塑料安瓿、预灌封注射器等。
[0074]
本发明所述的脂肪乳注射剂,每毫升含0.01~400毫克活性成分;优选的是每毫升含5~300毫克活性成分;最优选的是每毫升含10~200毫克活性成分的单位质量制剂。
[0075]
本发明所述的脂肪乳注射剂的平均粒径大小在10-1000nm范围,例如20-800nm范围,30-500nm范围,40-400nm范围,50-300nm范围等。
[0076]
本发明还提供所述脂肪乳注射剂的制备方法,其包括以下步骤:将结构式(1)所示
的化合物、其消旋体、立体异构体、药学上可接受的盐或溶剂合物、或药学上可接受的盐的溶剂合物及乳化剂与油相物质混合均匀,得到油相;将任选的助乳化剂、渗透压调节剂、抗氧剂、稳定剂、金属螯合剂和冻干保护剂分散到适量注射用水中,获得水相;将油相与水相混合并乳化,得到初乳;随后用注射用水定容,进一步乳化,加入ph调节剂调节ph,即得脂肪乳注射液。
[0077]
根据本发明的实施方案,所述脂肪乳注射剂的制备方法还任选地包含将所述脂肪乳注射液冷冻干燥得到冻干乳的步骤。
[0078]
有益效果:
[0079]
(1)本发明通过对消旋奥硝唑的羟基进行衍生化,设计并制备得到了一系列奥硝唑酯类前药,本发明化合物经体外血浆试验表明24h内相比对照化合物能较快转化为活性成分左奥硝唑,证明其具有良好的药代动力学性质。
[0080]
(2)奥硝唑的主要药理活性来源于左旋奥硝唑,本发明以左旋奥硝唑为原料定向合成了(1s)构型的左旋奥硝唑衍生物即前药,进一步试验发现奥硝唑前药的左旋对应异构体在油相中,在高温试验(60℃放置6~13天)有关物质均可保持较高的稳定性。
[0081]
(3)本发明进一步试验发现化合物吐温80生理盐水溶液在室温及40℃放置过程中主要降解产生左奥硝唑,相比本发明化合物,左奥硝唑磷酸酯二钠吐温80生理盐溶液在室温及40℃放置过程中主要降解产生未知杂质,说明其水溶液稳定性较差,室温下即发生降解,影响用药安全。
[0082]
(4)本发明制备的一系列奥硝唑衍生物,其侧链含有烷基羧酸酯、烷基碳酸酯结构,改善了脂溶性;该结构化合物具有一定的脂溶性,可溶解在油性物质中制成脂肪乳注射剂,注射途径包括静脉注射、肌肉注射、皮下注射、皮内注射和穴位注射等。
附图说明
[0083]
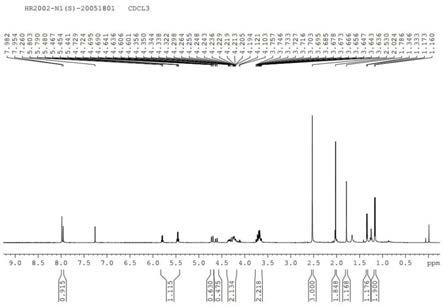
图1为化合物n1(s)的核磁氢谱图。
[0084]
图2为相关化合物在人血浆中降解图。
[0085]
图3为相关化合物在人血浆中代谢产生相应的活性代谢物水平图。
[0086]
图4本发明化合物n1(s)在吐温生理盐水溶液中40℃放置1天取样检测有关物质的液相色谱图。
[0087]
图5为左奥硝唑、左奥硝唑磷酸酯二钠液相色谱图(左奥硝唑相对左奥硝唑磷酸酯二钠的保留时间是1.1)。
[0088]
图6为左奥硝唑磷酸酯二钠在吐温生理盐水溶液中40℃放置1天取样检测有关物质的液相色谱图。
具体实施方式
[0089]
下面结合具体实施例和附图对本发明作进一步详述,以下实施例只是描述性的,不是限定性的,不能以此限定本发明的保护范围,如无特别说明,所用原料均可通过市售或自制获得。
[0090]
本上下文中所使用的缩写具有以下含义:dcm:二氯甲烷;py:吡啶;dmap:4-二甲氨基吡啶;dcc:二环己基碳二亚胺;tbab:4-丁基溴化铵。
[0091]
实施例1化合物n1(s)的合成:
[0092][0093]
首先合成化合物n1(s)中间体1:称取左奥硝唑(5.036g,22.93mmol)加入瓶中,加入dcm 20ml室温搅拌溶解,再称取py(3.609g,45.62mmol),dmap(2.811g,23.01mmol)依次加入反应瓶中,最后称取乙酸酐(3.514g,34.42mmol)缓慢滴入反应瓶中,保持搅拌1h,tlc监控至原料消失。后处理,加入50ml水和30ml dcm萃取分液取有机层,有机层再分别用50ml饱和nahco3与饱和食盐水洗,无水na2so4干燥,然后减压浓缩得白色固体(4.367g,16.69mmol),收率为72.8%。
[0094]
化合物n1(s)的合成:称取化合物1中间体1(1.056g,4.04mmol)加入瓶中,加入dcm6ml室温搅拌溶解,反应瓶用ar气置换3次,将反应瓶移置冷阱中-78℃搅拌,将(1.162g,8.17mmol)二异丁基氢化铝缓慢滴入反应瓶中,滴毕保持搅拌1h,称取py(0.965g,12.20mmol),dmap(1.004g,8.22mmol)分别用2mldcm稀释后缓慢滴入反应瓶中,滴毕再称取乙酸酐(2.496g,24.45mmol)滴入反应瓶中,保持搅拌20h,开始后处理,加入dcm 40ml、饱和nh4cl 50ml萃取分液取有机层,有机层再分别用50ml水与饱和食盐水洗,无水na2so4干燥,旋蒸得油状物,再硅胶柱层析分离,使用正己烷:乙酸乙酯4:1的混合溶剂冲柱,旋蒸浓缩,最终得产物(0.272g,0.89mmol)g,收率为22.0%。
[0095]
1h nmr(400mhz,cdcl3)δ7.97(d,1h,j=11.3hz),δ5.82-5.44(m,1h),δ4.73-4.60(m,1h),δ4.38-4.09(m,2h),δ3.76-3.64(m,2h),δ2.53(s,3h),δ1.90(d,3h,j=95.0hz),δ1.25(dd,3h,j=5.3hz,j=69.2hz);
[0096]
esi-ms m/z=306.0,[m+h]
+
[0097]
实施例2化合物n3(s)的合成:
[0098][0099]
首先合成化合物n3(s)中间体1:称取左奥硝唑(6.012g,27.37mmol)加入瓶中,加入dcm 20ml室温搅拌溶解,再称取py(4.319g,54.60mmol),dmap(3.313g,27.12mmol)依次加入反应瓶中,最后称取丙酸酐(5.310g,40.80mmol)缓慢滴入反应瓶中,保持搅拌1h,tlc监控至原料消失。后处理,加入50ml水和30mldcm萃取分液取有机层,有机层再分别用50ml饱和nahco3与饱和食盐水洗,无水na2so4干燥,然后减压浓缩得白色固体(5.571g,20.21mmol),收率为73.8%。
[0100]
化合物n3(s)的合成:称取化合物2中间体1(1.104g,4.00mmol)加入瓶中,加入dcm6ml室温搅拌溶解,反应瓶用ar气置换3次,将反应瓶移置冷阱中-78℃搅拌,将(1.145g,8.05mmol)二异丁基氢化铝缓慢滴入反应瓶中,滴毕保持搅拌1h,称取py(0.956g,12.09mmol),dmap(0.997g,8.16mmol)分别用2mldcm稀释后缓慢滴入反应瓶中,滴毕再称取乙酸酐(2.439g,23.89mmol)滴入反应瓶中,保持搅拌20h,开始后处理,加入dcm 40ml、饱和nh4cl 50ml萃取分液取有机层,有机层再分别用50ml水与饱和食盐水洗,无水na2so4干燥,
旋蒸得油状物,再硅胶柱层析分离,使用正己烷:乙酸乙酯4:1的混合溶剂冲柱,旋蒸浓缩,最终得产物(0.325g,1.02mmol)g,收率为25.5%。
[0101]
1h nmr(400mhz,cdcl3)δ7.97(d,1h,j=11.2hz),δ5.78-5.42(m,1h),δ4.71-4.58(m,1h),δ4.36-4.07(m,2h),δ3.74-3.62(m,2h),δ2.53(s,3h),δ1.90(d,3h,j=95.0hz),δ1.38-1.16(m,2h),δ0.95-0.89(m,3h);
[0102]
esi-ms m/z=320.0,[m+h]
+
[0103]
实施例3化合物n7(s)的合成:
[0104][0105]
首先合成化合物n7(s)中间体1:称取左奥硝唑(5.036g,22.93mmol)加入瓶中,加入dcm 20ml室温搅拌溶解,再称取py(3.609g,45.62mmol),dmap(2.811g,23.01mmol)依次加入反应瓶中,最后称取乙酸酐(3.514g,34.42mmol)缓慢滴入反应瓶中,保持搅拌1h,tlc监控至原料消失。后处理,加入50ml水和30mldcm萃取分液取有机层,有机层再分别用50ml饱和nahco3与饱和食盐水洗,无水na2so4干燥,然后减压浓缩得白色固体(4.367g,16.69mmol),收率为72.8%。
[0106]
化合物n7(s)的合成:称取化合物3中间体1(1.214g,4.64mmol)加入瓶中,加入dcm6ml室温搅拌溶解,反应瓶用ar气置换3次,将反应瓶移置冷阱中-78℃搅拌,将(1.324g,9.31mmol)二异丁基氢化铝缓慢滴入反应瓶中,滴毕保持搅拌1h,称取py(1.104g,13.96mmol),dmap(1.141g,9.34mmol)分别用2mldcm稀释后缓慢滴入反应瓶中,滴毕再称取丙酸酐(3.717g,28.56mmol)滴入反应瓶中,保持搅拌20h,开始后处理,加入dcm 40ml、饱和nh4cl 50ml萃取分液取有机层,有机层再分别用50ml水与饱和食盐水洗,无水na2so4干燥,旋蒸得油状物,再硅胶柱层析分离,使用正己烷:乙酸乙酯4:1的混合溶剂冲柱,旋蒸浓缩,最终得产物(0.356g,1.11mmol)g,收率为24.0%。
[0107]
1h nmr(400mhz,cdcl3)δ7.96(d,1h,j=11.1hz),δ5.82-5.43(m,1h),δ4.75-4.62(m,1h),δ4.38-4.09(m,2h),δ3.76-3.64(m,2h),δ2.55(s,3h),δ2.03-1.77(m,2h,j=95.0hz),δ1.27(dd,2h,j=5.4hz,j=69.8hz),δ1.12-1.06(m,3h);
[0108]
esi-ms m/z=320.0,[m+h]
+
[0109]
实施例4化合物n8(s)的合成:
[0110][0111]
首先合成化合物n8(s)中间体1:称取左奥硝唑(6.012g,27.37mmol)加入瓶中,加入dcm 20ml室温搅拌溶解,再称取py(4.319g,54.60mmol),dmap(3.313g,27.12mmol)依次加入反应瓶中,最后称取丙酸酐(5.310g,40.80mmol)缓慢滴入反应瓶中,保持搅拌1h,tlc监控至原料消失。后处理,加入50ml水和30mldcm萃取分液取有机层,有机层再分别用50ml饱和nahco3与饱和食盐水洗,无水na2so4干燥,然后减压浓缩得白色固体(5.571g,20.21mmol),收率为73.8%。
[0112]
化合物n8(s)的合成:称取化合物4中间体1(1.078g,3.91mmol)加入瓶中,加入dcm6ml室温搅拌溶解,反应瓶用ar气置换3次,将反应瓶移置冷阱中-78℃搅拌,将(1.119g,7.87mmol)二异丁基氢化铝缓慢滴入反应瓶中,滴毕保持搅拌1h,称取py(0.929g,11.75mmol),dmap(0.965g,7.90mmol)分别用2mldcm稀释后缓慢滴入反应瓶中,滴毕再称取丙酸酐(3.065g,23.55mmol)滴入反应瓶中,保持搅拌20h,开始后处理,加入dcm 40ml、饱和nh4cl 50ml萃取分液取有机层,有机层再分别用50ml水与饱和食盐水洗,无水na2so4干燥,旋蒸得油状物,再硅胶柱层析分离,使用正己烷:乙酸乙酯4:1的混合溶剂冲柱,旋蒸浓缩,最终得产物(0.404g,1.21mmol),收率为30.9%。
[0113]
1h nmr(400mhz,cdcl3)δ7.98(d,1h,j=11.1hz),δ5.84-5.45(m,1h),δ4.76-4.63(m,1h),δ4.39-4.11(m,2h),δ3.77-3.66(m,2h),δ2.56(s,3h),δ2.05-1.80(m,2h,j=96.1hz),δ1.40-1.18(m,2h),δ1.14-1.08(m,3h),δ0.99-0.92(m,3h);
[0114]
esi-ms m/z=334.1,[m+h]
+
[0115]
实施例5化合物n9(s)的合成:
[0116][0117]
1-碘乙基乙基碳酸酯的合成:称取1-氯乙基乙基碳酸酯(2.064g,13.53mmol)于干燥的100ml两颈反应瓶中,加入无水nai(1.704g,11.37mmol)、tbab(0.087g,0.27mmol)、无水cacl2(0.494g,4.45mmol)和乙酸乙酯10ml,加热至80℃回流反应3h。向反应瓶中加入水,振摇后分液,ea层再用饱和食盐水洗,无水硫酸钠干燥,减压浓缩,得棕色油状物,不经纯化直接用于下一步反应。
[0118]
化合物n9(s)的合成:称取左奥硝唑(1.627g,7.41mmol)加入瓶中,用丙酮10ml搅拌溶解,再加入1-碘乙基乙基碳酸酯(2.701g,11.07mmol),无水碳酸钾(0.820g,5.93mmol),tbab(0.048g,0.15mmol),加毕移至40℃水浴搅拌5h。后处理,加入水50ml、乙酸乙酯50ml,萃取取有机层,有机层再用5%nahco3、水与饱和食盐水洗,无水硫酸钠干燥,旋蒸得油状物,再硅胶柱层析分离,使用正己烷:乙酸乙酯4:1的混合溶剂冲柱,旋蒸浓缩,最终得产物(1.027g,3.06mmol),收率为41.3%。
[0119]
1h nmr(400mhz,cdcl3)δ7.96(s,1h),δ6.67-6.51(m,1h),δ5.67-5.56(m,1h),δ4.79-4.47(m,2h),δ4.15-4.09(m,2h),δ3.91-3.79(m,2h),δ2.53(s,3h),δ2.07-2.02(m,3h),δ1.36-1.32(m,3h);
[0120]
esi-ms m/z=336.1,[m+h]
+
[0121]
实施例6化合物n10(s)的合成:
[0122][0123]
1-碘乙基异丙基碳酸酯的合成:称取1-氯乙基异丙基碳酸酯(2.046g,12.28mmol)于干燥的100ml两颈反应瓶中,加入无水nai(1.706g,11.38mmol)、tbab(0.087g,0.27mmol)、无水cacl2(0.517g,4.66mmol)和乙酸乙酯10ml,加热至80℃回流反应3h。向反应瓶中加入水,振摇后分液,ea层再用饱和食盐水洗,无水硫酸钠干燥,减压浓缩,得棕色油
状物,不经纯化直接用于下一步反应。
[0124]
化合物n10(s)的合成:称取左奥硝唑(1.586g,7.22mmol)加入瓶中,用丙酮10ml搅拌溶解,再加入1-碘乙基异丙基碳酸酯(2.516g,9.75mmol),无水碳酸钾(0.815g,5.90mmol),tbab(0.058g,0.18mmol),加毕移至40℃水浴搅拌5h。后处理,加入水50ml、乙酸乙酯50ml,萃取取有机层,有机层再用5%nahco3、水与饱和食盐水洗,无水硫酸钠干燥,旋蒸得油状物,再硅胶柱层析分离,使用正己烷:乙酸乙酯4:1的混合溶剂冲柱,旋蒸浓缩,最终得产物(0.990g,2.83mmol),收率为39.2%。
[0125]
1h nmr(400mhz,cdcl3)δ7.95(s,1h),δ6.68-6.52(m,1h),δ5.67-5.56(m,1h),δ4.79-4.48(m,2h),δ4.23-4.16(m,1h),δ3.90-3.78(m,2h),δ2.54(s,3h),δ2.11-2.05(m,3h),δ1.43-1.38(m,6h);
[0126]
esi-ms m/z=350.1,[m+h]
+
[0127]
实施例7化合物n11(s)的合成:
[0128][0129]
首先合成1-氯丙基氯甲酸酯:称取三光气(10.030g,33.70mmol)与100ml三颈反应瓶中,加入15ml无水二氯甲烷,反应瓶用ar气置换3次,将反应瓶移至-20℃冷阱中不断搅拌。量取py(0.540g,6.83mmol)用5ml的二氯甲烷稀释后,加入到反应瓶中。然后称取正丙醛(4.602g,79.20mmol)缓缓滴加入反应瓶中,滴毕,将冷阱温度设置为-20℃,继续反应20h。用水泵接上含有koh水溶液的反应瓶进行抽气处理5min,然后将反应瓶从冷阱中移出,减压浓缩除去dcm,然后蒸馏得到无色至浅黄色油状物3.91g,收率为73.2%。
[0130]
再合成1-氯丙基乙基碳酸酯:称取1-氯丙基氯甲酸酯(0.868g,5.53mmol)于干燥的两颈反应瓶中,加入无水dcm 10ml不断搅拌,称取乙醇(0.310g,7.75mmol)加入到上述反应瓶中,将反应瓶移至冰水浴中不断搅拌,称取吡啶(0.522g,6.60mmol)缓缓加入到上述反应瓶中,滴加过程中出现白色固体,滴毕,将反应瓶移至室温进行反应1h。向反应瓶中加入10ml水,分液,dcm层用5%khso4洗至ph=3~4,然后再用水洗至接近中性,再用饱和食盐水洗,无水硫酸钠干燥。减压浓缩得到无色油状物0.727g,不经纯化直接进行下一步反应;
[0131]
1-碘丙基乙基碳酸酯的合成:称取1-氯丙基乙基碳酸酯(0.727g,4.36mmol)于干燥的100ml两颈反应瓶中,加入无水nai(0.579g,3.86mmol)、tbab(0.032g,0.10mmol)、无水cacl2(0.171g,1.54mmol)和乙酸乙酯5ml,加热至80℃回流反应3h。向反应瓶中加入水,振摇后分液,ea层再用饱和食盐水洗,无水硫酸钠干燥,减压浓缩,得棕色油状物,不经纯化直接用于下一步反应。
[0132]
化合物n11(s)的合成:称取左奥硝唑(0.602g,2.74mmol)加入瓶中,用丙酮5ml搅拌溶解,再加入1-碘丙基乙基碳酸酯(1.061g,4.11mmol),无水碳酸钾(0.303g,2.19mmol),tbab(0.026g,0.08mmol),加毕移至40℃水浴搅拌5h。后处理,加入水25ml、乙酸乙酯25ml,
萃取取有机层,有机层再用5%nahco3、水与饱和食盐水洗,无水硫酸钠干燥,旋蒸得油状物,再硅胶柱层析分离,使用正己烷:乙酸乙酯4:1的混合溶剂冲柱,旋蒸浓缩,最终得产物(0.392g,1.12mmol),收率为40.9%。
[0133]
1h nmr(400mhz,cdcl3)δ7.96(s,1h),δ6.67-6.51(m,1h),δ5.69-5.59(m,1h),δ4.77-4.44(m,2h),δ4.16-4.11(m,2h),δ3.91-3.79(m,2h),δ2.54(s,3h),δ2.18-2.12(m,2h),δ1.37-1.31(m,3h)δ0.99-0.93(m,3h);
[0134]
esi-ms m/z=350.1,[m+h]
+
[0135]
实施例8化合物n12(s)的合成:
[0136][0137]
首先合成1-氯丙基氯甲酸酯:称取三光气(10.030g,33.70mmol)与100ml三颈反应瓶中,加入15ml无水二氯甲烷,反应瓶用ar气置换3次,将反应瓶移至-20℃冷阱中不断搅拌。量取py(0.540g,6.83mmol)用5ml的二氯甲烷稀释后,加入到反应瓶中。然后称取正丙醛(4.602g,79.20mmol)缓缓滴加入反应瓶中,滴毕,将冷阱温度设置为-20℃,继续反应20h。用水泵接上含有koh水溶液的反应瓶进行抽气处理5min,然后将反应瓶从冷阱中移出,减压浓缩除去dcm,然后蒸馏得到无色至浅黄色油状物3.91g,收率为73.2%。
[0138]
再合成1-氯丙基异丙基碳酸酯:称取1-氯丙基氯甲酸酯(0.815g,5.19mmol)于干燥的两颈反应瓶中,加入无水dcm 10ml不断搅拌,称取异丙醇(0.453g,7.54mmol)加入到上述反应瓶中,将反应瓶移至冰水浴中不断搅拌,称取吡啶(0.522g,6.60mmol)缓缓加入到上述反应瓶中,滴加过程中出现白色固体,滴毕,将反应瓶移至室温进行反应1h。向反应瓶中加入10ml水,分液,dcm层用5%khso4洗至ph=3~4,然后再用水洗至接近中性,再用饱和食盐水洗,无水硫酸钠干燥。减压浓缩得到无色油状物0.746g,不经纯化直接进行下一步反应;
[0139]
1-碘丙基乙基碳酸酯的合成:称取1-氯丙基乙基碳酸酯(0.746g,4.13mmol)于干燥的100ml两颈反应瓶中,加入无水nai(0.564g,3.76mmol)、tbab(0.032g,0.10mmol)、无水cacl2(0.162g,1.46mmol)和乙酸乙酯5ml,加热至80℃回流反应3h。向反应瓶中加入水,振摇后分液,ea层再用饱和食盐水洗,无水硫酸钠干燥,减压浓缩,得棕色油状物,不经纯化直接用于下一步反应。
[0140]
化合物n12(s)的合成:称取左奥硝唑(0.560g,2.55mmol)加入瓶中,用丙酮5ml搅拌溶解,再加入1-碘丙基乙基碳酸酯(1.056g,3.88mmol),无水碳酸钾(0.290g,2.10mmol),tbab(0.032g,0.10mmol),加毕移至40℃水浴搅拌5h。后处理,加入水25ml、乙酸乙酯25ml,萃取取有机层,有机层再用5%nahco3、水与饱和食盐水洗,无水硫酸钠干燥,旋蒸得油状物,再硅胶柱层析分离,使用正己烷:乙酸乙酯4:1的混合溶剂冲柱,旋蒸浓缩,最终得产物(0.433g,1.22mmol),收率为47.8%。
[0141]
1h nmr(400mhz,cdcl3)δ7.95(s,1h),δ6.67-6.51(m,1h),δ5.69-5.59(m,1h),δ4.75-4.41(m,2h),δ4.14-4.07(m,2h),δ3.92-3.79(m,2h),δ2.55(s,3h),δ2.21-2.13(m,2h),δ1.54-1.48(m,2h)δ1.08-1.00(m,3h),δ0.89-0.83(m,3h);
[0142]
esi-ms m/z=364.1,[m+h]
+
[0143]
实施例9化合物n13(s)的合成:
[0144][0145]
1-氯-1-甲基-乙基酯异丙基碳酸酯的合成:氯甲酸-2-丙烯酯(2.514g,20.86mmol)溶于20ml的干燥dcm中,依次加入异丙醇(1.262g,21.01mmol)和吡啶(1.754g,22.01mmol),室温反应2小时。将体系倒入20ml冰水中,有机相经硫酸钠干燥,过滤,滤液蒸干得无色透明状液体。向该液体中加入l0ml乙醚,然后缓慢滴加4n盐酸/乙醚50ml,加完后室温搅拌过夜,蒸出得无色液体(1.203g,6.66mmol)。
[0146]
1-碘-1-甲基-乙基酯异丙基碳酸酯的合成:称取1-氯-1-甲基-乙基酯异丙基碳酸酯(1.203g,6.66mmol)于干燥的100ml两颈反应瓶中,加入无水nai(838g,5.59mmol)、tbab(0.043g,0.15mmol)、无水cacl2(0.250g,2.25mmol)和乙酸乙酯10ml,加热至80℃回流反应3h。向反应瓶中加入水,振摇后分液,ea层再用饱和食盐水洗,无水硫酸钠干燥,减压浓缩,得棕色油状物,不经纯化直接用于下一步反应。
[0147]
化合物n13(s)的合成:称取左奥硝唑(0.681g,3.10mmol)加入瓶中,用丙酮10ml搅拌溶解,再加入1-碘-1-甲基-乙基酯异丙基碳酸酯(1.268g,4.66mmol),无水碳酸钾(0.815g,5.90mmol),tbab(0.032g,0.10mmol),加毕移至40℃水浴搅拌5h。后处理,加入水50ml、乙酸乙酯50ml,萃取取有机层,有机层再用5%nahco3、水与饱和食盐水洗,无水硫酸钠干燥,旋蒸得油状物,再硅胶柱层析分离,使用正己烷:乙酸乙酯4:1的混合溶剂冲柱,旋蒸浓缩,最终得产物(0.320g,0.88mmol),收率为28.4%。
[0148]
1h nmr(400mhz,cdcl3)δ7.97(s,1h),δ6.82-6.61(m,1h),δ5.68-5.57(m,1h),δ4.80-4.48(m,2h),δ4.23-4.16(m,1h),δ3.90-3.78(m,2h),δ2.54(s,3h),δ2.22-2.14(m,6h),δ1.43-1.38(m,6h);
[0149]
esi-ms m/z=364.1,[m+h]
+
[0150]
对比例1
[0151]
专利gb1453417a公开了一类奥硝唑衍生物,其通式结构如下:
[0152][0153]
其中,r可选自烷基、烷氧基、苯氧基、苄氧基等。
[0154]
本发明选自r为异丙基氧基,即化合物n2’(s)作为本发明化合物的对照化合物1,结构式如下:
[0155][0156]
化合物n2’(s)的合成:称取左奥硝唑(2.010g,9.152mmol)加入瓶中,用二氯甲烷15ml搅拌溶解,使用氩气保护。移至冰水浴中,再加入三乙胺(1.843g,18.243mmol),逐步滴加氯甲酸异丙酯(1.606g,13.102mmol),加毕,移至室温搅拌反应1h。后处理,加入水50ml、二氯甲烷20ml,萃取有机层,有机层再用5%nahco3、水与饱和食盐水洗涤,无水硫酸钠干燥,旋蒸浓缩除去部分溶剂,此时为棕红色液体。使用正己烷:乙酸乙酯3:1的混合溶剂冲柱,旋蒸浓缩,得淡黄色结晶(2.187g,7.154mmol),收率为78.1%。
[0157]
1h nmr(400mhz,cdcl3)δ7.96(s,1h),δ5.27-5.33(m,1h),δ4.78-4.82(m,1h),δ4.70-4.76(m,1h),δ4.39-4.45(m,1h),δ3.83-3.88,1h),δ2.53(s,3h),δ1.18-1.26(m,6h)
[0158]
对比例2
[0159]
按照专利cn108409786a公开的方法制备磷酸左奥硝唑酯二钠水合物,作为本发明化合物的对照化合物2,结构式如下:
[0160][0161]
试验例1本发明化合物在人血浆中的代谢研究:
[0162]
1.1实验操作:将实施例中制备的化合物n1(s)、对比例1制备的对照化合物1为对照,进行人血浆中的酶解动力学实验,实验方法如下:
[0163]
(1)配制40mm的本发明的化合物nx(x代表不同的化合物编号)的纯乙腈贮备液,40mm的对照化合物1的纯乙腈贮备液;
[0164]
(2)取奥硝唑贮备液1ml的人血浆中混合,涡旋30s,取样200μl加入800μl乙腈沉降蛋白,涡旋1min终止反应,作为奥硝唑对照;40mm的本发明的化合物,40mm的对照化合物1贮备液稀释200倍作为前药对照;
[0165]
(4)取100μl本发明的化合物,对照化合物1纯乙腈贮备液加入4ml的人血浆中混合,涡旋30s,置于37℃恒温振荡水浴加热器中200rpm振荡;
[0166]
(5)在不同时间点(0,30,60,120min)取样200μl,每个时间点取样3次,加入800μl乙腈沉降蛋白,涡旋1min终止反应;并同法做空白血浆对照;
[0167]
(6)12000rpm,4℃离心10min,取上清液400ul,加入200ul纯净水,(过滤膜)进样30μl,记录峰面积变化;
[0168]
(7)观察并分析本发明的化合物nx与对照化合物1的水解速率,并根据数据筛选出合适的本发明的化合物。
[0169]
1.2实验结果:实验研究发现,从降解速率为n1(s)>n2’(s);对照化合物1在血浆中几乎不降解;从化合物代谢生成活性代谢物s-奥硝唑的水平来看,本发明化合物n1(s)经体外血浆试验表明24h内相比对照化合物能较快转化为活性成分左奥硝唑,证明其具有良好的药代动力学性质。
[0170]
试验例2本发明化合物n1(s)油溶液稳定性考察
[0171]
2.1试验方案:制备含化合物n1(s)的中链甘油三酸酯(mct)和大豆油溶液,所得样品置60℃条件下留样,分别于0天、6天、13天取样检测有关物质的生成情况。
[0172]
2.2试验方法:按表2制备样品,每份样品分别按照放样体积分装4瓶放样。
[0173]
表2油溶液稳定性考察样品处方
[0174][0175]
①
化合物n1(s)mct溶液的制备:称取处方量n1(s)化合物,加入处方量mct,磁力搅拌20分钟使其混合均匀。
[0176]
②
化合物n1(s)大豆油溶液的制备:称取处方量n1(s)化合物,加入处方量大豆油,磁力搅拌20分钟使其混合均匀。
[0177]
⑵
分装留样:
[0178]
①
将含化合物的mct溶液、大豆油溶液分别分装于4支西林瓶中(2.5g/瓶),盖胶塞轧盖、做好名称和批号标记。
[0179]
②
各批西林瓶样品存于遮光盒子中,于60℃电热恒温鼓风干燥箱中留样,并分别于0天、6天、13天取样检测有关物质的生成情况。
[0180]
2.3有关物质测定按照高效液相色谱法(中国药典2015年版通则0512)测定。
[0181]
⑴
色谱条件:色谱柱为welch xtimate c18柱,4.6mm
×
250mm,5μm,流动相:以水为流动相a,以乙腈为流动相b,按下表进行梯度洗脱;
[0182][0183]
检测波长为318nm;流速为每分钟1.0ml;柱温为35℃;
[0184]
⑵
测定法:取本品适量,精密称定,加稀释剂[无水乙醇]振摇使溶解并定量稀释制成每1ml中约含0.4mg的溶液,采用ptfe滤膜(0.22μm,津腾)过滤,取续滤液,作为供试品溶液。精密量取10μl注入液相色谱仪,记录色谱图;供试品溶液色谱图中,如有杂质峰,按峰面积归一化法计算,即得。
[0185]
测试结果如表3所示:
[0186]
表3
[0187][0188]
由试验结果可知,本发明化合物n1(s)在mct、大豆油中60℃放置13天,左奥硝唑依次为0.02%、0.04%;总杂依次为0.66%、0.52%,与起始相比,无明显变化较为稳定;空白大豆油、空白mct辅料峰较多,但不干扰样品主峰检测。
[0189]
试验例2本发明化合物n1(s)水溶液稳定性考察
[0190]
2.1试验方案:
[0191]
为比较本发明化合物n1(s)酯类化合物与左奥硝唑磷酸酯二钠在水溶液中的稳定性优劣,制备化合物n1(s)吐温80氯化钠溶液,分别在室温下放置0h、1h、4h、6h、8h、26h后取样检测有关物质的增长趋势。
[0192]
2.2试验方法:
[0193]
处方:
[0194]
化合物n1(s)吐温80生理盐水用量80mg6g34g
[0195]
2.3试验过程:
[0196]
1、称取上述处方量的化合物n1(s)、吐温80、生理盐水于50ml锥形瓶中,高速剪切3min,使其混合均匀。送样分析,检测0h有关物质的生成情况,测完样后于室温条件下留样分别于1h、4h、6h、8h、26h后取样检测有关物质的生成情况;
[0197]
2、称取1.5g吐温80、8.5g生理盐水于25ml锥形瓶中,磁力搅拌3min,目测完全溶解,作为空白对照检测有关物质;
[0198]
3、另将0~1h期间内,室温留样品转移至40℃药品稳定箱中留样,分别于1d、4d后取样检测有关物质的生成情况。
[0199]
测试结果如表4所示:
[0200]
表4
[0201]
时间左奥硝唑(%)总杂(%)纯度(%)0h0.090.5599.451h0.340.7899.222h0.470.8999.114h0.691.1098.90
5h0.801.2298.7826h3.614.0795.9324h/40℃15.0515.5184.494d/40℃43.5844.1155.89
[0202]
结论:空白吐温80生理盐水不干扰样品检测,化合物n1(s)吐温80生理盐水溶液在室温放置26h,左奥硝唑在含量在逐渐增长,从0.09%增长至3.61%。在40℃放置24h,与0h相比,左奥硝唑增长明显,从0.09%增长至15.05%。化合物n1(s)吐温80生理盐水溶液在室温及40℃放置过程中主要降解产生左奥硝唑。
[0203]
试验例3:对照化合物2左奥硝唑磷酸酯二钠溶液稳定性考察
[0204]
3.1试验方案:
[0205]
为比较本发明n1(s)酯类化合物与左奥硝唑磷酸酯二钠稳定性优劣,制备左奥硝唑磷酸酯二钠吐温80氯化钠溶液,分别在室温下放置0h、1h、4h、6h、8h、26h后取样检测有关物质的增长趋势。
[0206]
3.2试验方法:
[0207]
处方:
[0208]
化合物左奥硝唑磷酸酯二钠吐温80生理盐水用量40mg3g17g
[0209]
2.3试验过程:
[0210]
1、称取上述处方量的左奥硝唑磷酸酯二钠、吐温80、生理盐水于50ml锥形瓶中,高速剪切3min,使其混合均匀。送样分析,检测0h有关物质的生成情况,测完样后于室温条件下留样分别于1h、4h、6h、8h、26h后取样检测有关物质的生成情况;
[0211]
2、称取1.5g吐温80、8.5g生理盐水于25ml锥形瓶中,磁力搅拌3min,目测完全溶解,作为空白对照检测有关物质;
[0212]
3、另将0~1h期间内,室温留样品转移至40℃药品稳定箱中留样,分别于1d、4d后取样检测有关物质的生成情况。
[0213]
测试结果如表5所示:
[0214]
表5
[0215]
时间左奥硝唑(%)总杂(%)纯度(%)0h/2.0797.931h/2.2097.802h/2.3197.694h/2.5697.445h0.022.6997.3126h0.096.0793.9324h/40℃0.0333.3866.624h/40℃0.0472.9127.09
[0216]
结论:空白吐温80生理盐水不干扰样品检测,对照化合物2左奥硝唑磷酸酯二钠吐温80生理盐溶液在室温放置26h,左奥硝唑在含量在逐渐增长,从2.07%增长至6.07%。在40℃放置24h,与0h相比,总杂,从2.07%增长至33.38%。对照化合物2左奥硝唑磷酸酯二钠
吐温80生理盐溶液在室温及40℃放置过程中主要降解产生未知杂质,说明其水溶液稳定性较差,室温下即发生降解,影响用药安全。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1