一种基于鸭黄病毒E蛋白及其单抗的竞争ELISA方法与流程
一种基于鸭黄病毒e蛋白及其单抗的竞争elisa方法
技术领域
1.本发明涉及动物免疫学检测技术领域,尤其是一种基于鸭黄病毒e蛋白及其单抗的竞争elisa方法。
背景技术:
2.鸭黄病毒病是由鸭黄病毒引起的一种新的传染病,该病主要发生于鸭,可引起蛋鸭产蛋率下降,雏鸭生长迟缓和死亡。鸭群中的发病率可达到80%,蛋鸭产蛋率可由90%降到10%。感染后耐过的鸭需要长时间才能恢复生产性能,而且难以达到感染前的生产水平。2010年我国出现首例鸭黄病毒病后,国内大部分养鸭地区都相继出现鸭群感染dtmuv的报道,该病给我国养鸭业带来了重大的经济损失,而且严重影响到我国养鸭业的健康发展,也给我国的公共卫生带来一系列的潜在威胁。
3.目前,鸭黄病毒的病原检测种类很多,主要依赖病毒分离和分子生物学检测。病毒分离是鸭黄病毒的传统检测方法;分子生物学检测方法有rt-pcr、套式rt-pcr、荧光定量rt-pcr和环介导等温扩增技术等方法。抗体检测只有间接方法,相对来说,间接elisa特异不高,为了更好的进行流行病调查和免疫评估,因此利用单抗研制竞争elisa有利于提高检测的准确性。
技术实现要素:
4.针对现有技术的不足,本发明提供一种基于鸭黄病毒e蛋白及其单抗的竞争elisa方法,本发明涉及到鸭黄病毒病e蛋白单克隆抗体的制备,建立了单抗竞争elisa的方法来检测鸭黄病毒病抗体,形成鸭黄病毒病免疫监测技术平台。
5.本发明的技术方案为:一种鸭黄病毒e蛋白,所述的鸭黄病毒e蛋白包括两种不同表达方式得到的鸭黄病毒病e蛋白1和口蹄疫a型vp1蛋白2,以鸭黄病毒基因组为模板,利用一对克隆引物和一对表达引物进行pcr扩增得到dfv-e基因,将dfv-e基因分别与pet-32a、pgex-6p-1质粒连接构建得到表达质粒pet-32a-e1、pgex-6p-1-e1,再将表达质粒pet-32a-e1和pgex-6p-1-e1分别转入原核表达宿主大肠杆菌bl21中诱导表达得到分别融合蛋白1和融合蛋白2,融合蛋白1和融合蛋白2分别经纯化得到鸭黄病毒病e蛋白1和鸭黄病毒病e蛋白2。
6.优选的,所述的一对克隆引物包括引物c1:5
’‑
gcaggattgtgcagaag-3’,引物c2:5
’‑
ccatgcagtgtcaccca-3’。
7.优选的,所述一对表达引物包括引物e1:5
’‑
ccggaattcaccgctgagatggagga-3’,引物e2:5
’‑
ccgctcgagctggtacctgatctgtc-3’。
8.优选的,所述的鸭黄病毒病e蛋白1和鸭黄病毒病e蛋白2为不同表达方式得到的相同序列蛋白,两者蛋白序列均为seq id no:1所示。
9.优选的,作为本发明的进一步限定,所述的融合蛋白纯化为经过his和gst柱层析纯化。
10.为使本发明公开充分,本发明的中涉及到的构建重组基因表达载体、诱导表达重组基因、色谱纯化获得鸭黄病毒病e蛋白方法步骤,按照实验室常规现有方法即可实现,其中所述pcr扩增的具体步骤如下:
11.步骤a:以鸭黄病毒病e基因为模板,利用第一对克隆引物c1、c2扩增得到包含dfv-e基因的序列(900bp),然后用第二对表达引物e1、e2扩增此序列得到dfv-e1基因(660bp)。
12.步骤b:以步骤a扩增得到的dfv-e基因(900bp)进行纯化,连接pmd18-t载体,构建pmd18-t-e克隆载体。
13.步骤c:以步骤b构建pmd18-t-e为模板,利用表达引物e1、e2进行pcr扩增,纯化回收pcr产物,用ecorⅰ和xholⅰ内切酶对此pcr纯化产物和表达载体pet-32a、pgex-6p-1分别进行双酶切。
14.以上所述的pcr扩增的实现过程依靠现有的pcr技术,通过多次pcr扩增,以及基因工程双酶切技术,实现蛋白的原核表达。
15.本发明还提供一种制备以上所述鸭黄病毒病e蛋白及其单抗的方法,该制备方法包括以下步骤:
16.步骤a)、动物免疫:利用表达质粒pet-32a-e1诱导得到的鸭黄病毒病e蛋白1免疫5~7周龄的balb/c雌性小鼠,经过3次免疫后,筛选出免疫测定效价>1:12800的小鼠;
17.步骤b)、细胞融合:取步骤a)得到的免疫小鼠的脾细胞,与骨髓瘤细胞sp2/0进行细胞融合,利用表达质粒pgex-6p-1-e1诱导得到的鸭黄病毒病e蛋白2作为包被抗原,对融合后的细胞进行间接elisa筛选得到杂交瘤细胞。
18.步骤c)、单抗的大量克隆:将步骤b)得到的杂交瘤细胞注射到小鼠腹腔中,饲养注射后的小鼠1~3周,收集腹部膨大的小鼠腹水,对腹水进行纯化得到鸭黄病毒病e蛋白单抗。
19.作为本发明的进一步限定,所述的鸭黄病毒病e蛋白1、鸭黄病毒病e蛋白2为不同表达方式得到的相同序列蛋白,两者蛋白序列均为seq id no:1所示。
20.本发明还提供一种基于鸭黄病毒病e蛋白及其单抗的竞争elisa方法,该方法包括样品稀释、抗原包被、封闭、加样与加单抗、加酶标记抗体、显色与终止、测值、数据处理,该竞争elisa检测方法具体如下:
21.步骤1)样品稀释:血清样品的稀释为原体积的2倍,得到待测血清样品。
22.步骤2)抗原包被:所用到的包被抗原为表达质粒pgex-6p-1-e1诱导得到的鸭黄病毒病e蛋白2,包被抗原的包被浓度为0.5μg/ml。
23.步骤3)封闭:用封闭液封闭步骤2)包被的抗原,封闭时间为40~60min,得到封闭后的酶标板。
24.步骤4)加样与加单抗:将步骤1)得到的待测血清样品加入到步骤3)得到的封闭后的酶标板中,使血清抗体与包被抗原结合,再加入稀释度为1:400的鸭黄病毒病e蛋白单抗,使鸭黄病毒病e蛋白单抗结合未与血清抗体反应的剩余包被抗原,得到样品、单抗反应后的酶标板。
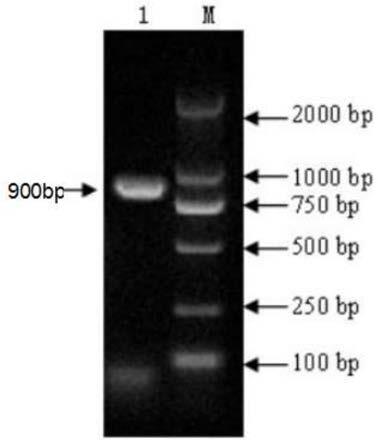
25.步骤5)加酶标记抗体:在步骤4)得到的样品、单抗反应后酶标板中加入酶标抗体,酶标记抗体的稀释浓度为1:2000,酶标记抗体与鸭黄病毒病e蛋白单抗结合,而不与血清抗体结合,得到加酶标记单抗后的酶标板。
26.步骤6)显色与终止:在步骤5)得到的加酶标记抗体后的酶标板中加入新鲜配制的底物溶液,振荡混合后室温避光孵育10~20min进行显色,再每孔加入终止液,混匀孵育5~10min终止反应,得到可进行测定的溶液。
27.步骤7)测值:测定步骤6)得到的可进行测定的溶液在od
450nm
处的吸光值a
450nm
;
28.步骤8)数据处理:利用步骤7)测定的吸光值a
450nm
计算出待测样品抑制率,所述待测样品抑制率pi%=(1-a
450
样品/a
450
阴性对照)
×
100。
29.优选的,作为本发明的进一步限定,所述封闭液为浓度为:1%bsa溶液、1%明胶溶液、5%胎牛血清溶液、5%脱脂奶粉溶液中任一种。
30.优选的,作为本发明的进一步限定,所述酶标记抗体的抗体为山羊抗小鼠igg-hrp;所述的a
450
阴性对照为用未感染鸭黄病毒的血清测定出来的吸光值a
450
。
31.本发明的有益效果为:
32.1、本发明利用rt-pcr和蛋白原核表达技术成功获得纯度较高且具有良好特异性和免疫原性的鸭黄病毒病e蛋白1和鸭黄病毒病e蛋白2;
33.2、采用杂交瘤技术,以鸭黄病毒病e蛋白1为免疫原,鸭黄病毒病e蛋白2为包被抗原建立了间接elisa筛选方法,筛选、制备得到了抗鸭黄病毒病e蛋白的杂交瘤细胞株,杂交瘤细胞株单抗均能被鸭黄病毒病阳性血清阻断,单抗生物特性的鉴定结果表明可选用该单抗作为竞争elisa的检测抗体,解决了竞争elisa检测方法的特异性识别的单抗获得难题;
34.3、本发明以鸭黄病毒病e蛋白1为包被抗原,鸭黄病毒病e蛋白的单抗为竞争抗体,建立优化了检测鸭黄病毒病血清抗体的单抗竞争elisa方法,得到一种特异性强、稳定性高、快速便捷的鸭黄病毒病的抗体检测方法。
35.4、本发明确定了竞争elisa阴阳判定抑制率临界值,抑制率(pi)≥30%为阳性,抑制率(pi)<30%为阴性。
36.5、本发明基于鸭黄病毒病e蛋白及其抗体建立的鸭黄病毒病抗体检测的竞争elisa方法,本发明的检测方法特异性强、稳定性好等优点,可用于鸭黄病毒病血清抗体的检测,这为鸭黄病毒病免疫效果评估、疫情监控及流行病学调查提供了技术平台。
附图说明
37.图1为本本发明dfv-e基因的序列(900bp)的扩增结果,图中左边箭头所指为dfv-e基因(900bp);
38.图2为本发明dfv-e1基因(660bp)的扩增结果,图中左边箭头所指为dfv-e1基因(660bp);
39.图3为本发明鸭黄病毒病e蛋白1的sds-pag电泳图,图中右边箭头所指为鸭黄病毒病e蛋白1条带;
40.图4为本发明鸭黄病毒病e蛋白2的sds-pag电泳图,图中右边箭头所指为鸭黄病毒病e蛋白2条带。
具体实施方式
41.以下结合说明书附图和实施例描述本发明一种基于鸭黄病毒病e蛋白单抗的竞争elisa方法及其应用,这些描述并不是对本发明内容作进一步的限定,以下实施例中所用到
的所有试剂均可通过商业手段购买,以下实施例中的操作步骤如无特别说明均可通过实验室常规操作方法实现。
42.实施例1
43.鸭黄病毒病e蛋白的获得
44.(1)引物设计
45.根据genbank已发表的鸭黄病毒病e基因序列,设计一对克隆引物(c1、c2)扩增包含dfv-e基因的序列,大小为900bp;根据原核表达载体及目的基因序列设计一对针对完整e基因(660bp)特异性表达引物(e1、e2),并插入ecorⅰ和xholⅰ两个酶切位点。引物序列送大连宝生物工程公司合成。
46.表1.扩增fmdv-a-vp1基因的引物核苷酸序列
[0047][0048]
(2)基因克隆
[0049]
以鸭黄病毒病病毒基因为模板,利用第一对克隆引物c1、c2扩增得到包含dfv-e基因的序列(900bp),然后用第二对表达引物e1、e2扩增此序列得到dfv-e1基因(660bp)。dfv-e基因的序列(900bp)克隆结果如图1所示,dfv-e1基因(660bp)克隆结果如图2所示。
[0050]
表2.聚合酶链式反应(pcr)体系
[0051][0052]
(3)表达载体构建、诱导表达、纯化
[0053]
将fmdv-a-vp1基因分别与pet-32a、pgex-6p-1质粒连接构建得到表达质粒pet-32a-e1、pgex-6p-1-e1,再将表达质粒pet-32a-e1和pgex-6p-1-e1分别转入原核表达宿主大肠杆菌bl21中诱导表达得到分别融合蛋白1和融合蛋白2,融合蛋白1和融合蛋白2分别经过his和gst柱层析纯化得到鸭黄病毒病e蛋白1和鸭黄病毒病e蛋白2。融合蛋白的电泳图如图3、图4所示。鸭黄病毒病e蛋白1、鸭黄病毒病e蛋白2为不同表达方式得到的相同序列蛋白,两者蛋白序列均为seq id no:1所示。
[0054]
实施例2
[0055]
鸭黄病毒病e蛋白单抗的获得
[0056]
步骤a)、动物免疫:利用表达质粒pet-32a-e1诱导得到的鸭黄病毒病e蛋白1免疫7周龄的balb/c雌性小鼠,经过3次免疫后,筛选出每次免疫测定效价大于1:12800的小鼠。
[0057]
步骤b)、细胞融合:取步骤a)得到的免疫小鼠的脾细胞,与骨髓瘤细胞sp2/0进行细胞融合,利用表达质粒pgex-6p-1-e1诱导得到的鸭黄病毒病e蛋白2作为包被抗原,对融合后的细胞进行间接elisa筛选得到杂交瘤细胞。
[0058]
步骤c)、杂交瘤细胞株稳定性鉴定:杂交瘤细胞连续传代及冻存后复苏后,分别收集培养上清测定od450值,见表3。结果显示:3株杂交瘤细胞株分泌抗体效价都保持在1个梯度之间变化,相对稳定。
[0059]
步骤d)单抗亚型的鉴定:按照sigma公司小鼠单抗检测试剂盒操作检测杂交瘤细胞株2b6、3d2、4e5的单抗培养上清的亚类,测定结果单抗均为igm亚型和κ轻链。
[0060]
表3杂交瘤细胞抗体分泌稳定性检测
[0061] 2b63d24e5第1代1:641:2561:1024第5代1:321:5121:1024第10代1:641:5121:512复苏后1:641:5121:1024
[0062]
实施例3
[0063]
单抗阻断elisa分析和大量克隆
[0064]
包被0.5μg/ml重组蛋白pgex-6p-1-e,加入倍比稀释的鸭黄病毒病阴、阳性血清,再加入纯化的单抗进行单抗阻断elisa。结果见表4,随着鸭黄病毒病e阴、阳性血清的稀释度增大,2b6、3d2、4e5单抗上清的p/n值均增大,表明鸭黄病毒病血清能够阻断3株单抗上清。
[0065]
表4.单抗阻断elisa
[0066][0067][0068]
单抗的大量克隆:根据抗体效价、稳定性及单抗阻断的鉴定结果,最终选择生物特性最好的4e5作为单抗竞争elisa的竞争抗体。将得到的杂交瘤细胞4e5株注射到小鼠腹腔中,饲养注射后的小鼠1周后,收集腹部膨大的小鼠腹水,对腹水进行纯化得到鸭黄病毒病e蛋白单抗。
[0069]
实施例4
[0070]
抗原包被浓度和待检血清稀释度确定
[0071]
方阵滴定确定pgex-6p-1-e1蛋白包被浓度和待检血清稀释度(见表5)。结果显示:
蛋白抗原包被浓度为0.5μg/ml,待检血清稀释倍数为1:2,抑制率(pi%)最大,且阴性od450值接近1.0。因此确定pgex-6p-1-e1蛋白包被浓度为0.5μg/ml,待检血清最适稀释倍数为1:2。
[0072]
表5.抗原包被浓度和待检血清稀释度的确定
[0073][0074][0075]
实施例5
[0076]
单抗稀释度确定
[0077]
将单抗4e5分别稀释至1
×
50、1
×
100、1
×
200、1
×
400、1
×
800、1
×
1600、1
×
3200、1
×
6400进行竞争elisa(结果见表6)。结果显示:单抗4e5在1
×
400时,抑制率(pi%)最大,且阴性od450值接近1.0。因此以1
×
400倍为单抗4e5最适稀释度。
[0078]
表6.单抗最适稀释度
[0079][0080]
实施例6
[0081]
阴阳临界值的确定
[0082]
选用45份鸭黄病毒阴性血清,运用已优化的条件进行竞争elisa,计算所有样品pi%平均值和标准方差值(sd)。结果见表7,平均抑制率为7.73%,标准差为7.46%,临界值以x+3sd,为判断标准,即cut-off值为30%。因此待检血清pi≥30%判为阳性,pi<30%则判为阴性。
[0083]
表7.竞争elisa阴阳临界值的确定
[0084][0085]
实施例7
[0086]
特异性试验结果
[0087]
用鸭黄病毒阴、阳血清,新城疫阴、阳性血清,鸭疫里氏杆菌阴、阳性血清,鸭瘟阴、阳性,禽流感h5和h9阴阳型血清为待检血清进行单抗竞争elisa(结果见表8)。结果显示:只有鸭黄病毒阳性血清能阻断单抗与抗原的反应,其余血清均为阴性,表明建立的单抗竞争elisa特异性强。
[0088]
表8.特异性试验结果
[0089][0090]
实施例8
[0091]
与鸭黄病毒中和试验比较结果
[0092]
利用建立的单抗竞争elisa与鸭黄病毒中和试验比对,结果见表9,结果显示鸭黄病毒中和试验和单抗竞争elisa检测100份血清,均阳性和阴性样品分别为51份和46份,因此,建立的单抗竞争elisa与中和试验的阳性检测符合率为96.23%,阴性符合率为97.87%。
[0093]
表9.两种方法检测的符合率
[0094][0095][0096]
实施例9
[0097]
鸭黄病毒病血清的竞争elisa检测
[0098]
采集4个鸭场的鸭血清各20份,对该血清进行阴阳性判定,该方法包括样品稀释、抗原包被、封闭、加样与加单抗、加酶标记抗体、显色与终止、测值、数据处理,该竞争elisa检测方法中:
[0099]
步骤1)抗原包被:所用到的包被抗原为表达质粒pgex-6p-1-e1诱导得到的鸭黄病毒病e蛋白2,包被抗原的包被浓度为0.5ug/ml。封闭:用1%bsa溶液封闭液封闭步骤2)包被的抗原,封闭时间为40min,得到封闭后的酶标板。
[0100]
步骤2)样品稀释:血清样品的稀释为原体积的2倍,得到待测血清样品。
[0101]
步骤3)加样:将步骤2)得到的待测血清样品加入到步骤1)得到的封闭后的酶标板中,第1列前2孔为阳性对照,3、4孔为阴性血清对照,从第5孔开始依次加入待检样品,每孔50μl。放入37℃恒温培养箱作用45min。冲洗3次,吸水纸上拍干。
[0102]
步骤4)加单抗:再加入稀释度为1:400的鸭黄病毒病e蛋白单抗,每孔50μl。放入37℃恒温培养箱作用30min。冲洗3次,吸水纸上拍干。
[0103]
步骤5)加酶标记抗体:在步骤4)的酶标板中加入酶标抗体,酶标记抗体的稀释浓度为1:2000,每孔50μl。放入37℃恒温培养箱作用30min。冲洗3次,吸水纸上拍干。所用到的酶标记抗体的抗体为山羊抗小鼠igg-hrp。
[0104]
步骤6)显色与终止:在步骤5)得到的加酶标记抗体后的酶标板中加入新鲜配制的底物溶液,每孔50μl,振荡混合后室温避光孵育20min进行显色,再加入终止液,每孔50μl,混匀孵育5min终止反应,得到可进行测定的溶液。
[0105]
步骤7)测值:测定步骤6)得到的可进行测定的溶液在od
450nm
处的吸光值a
450nm
;
[0106]
步骤8)试验成立的条件:a)阴性对照od值大于1.0;b)阳性对照的抑制率大于70%;c)阴性对照od值与阳性对照的差值大于0.3。
[0107]
步骤9)数据处理:利用步骤7)测定的吸光值a
450nm
计算出待测样品抑制率,所述待测样品抑制率pi%=(1-a
450
样品/a
450
阴性对照)
×
100。检测结果见10。试验结果表明:阳性血清的抑制率是72.39%,试验成立;样品od值小于0.8103就是阳性。
[0108]
表10.样品检测结果
[0109]
《》12345678a0.3121.1171.1270.6240.4120.6530.5610.562b0.321.0551.0540.5940.590.5630.5230.362c1.1881.1981.1060.5830.5830.4120.2980.453d1.1271.1941.0530.5360.5760.5220.3140.326e1.181.1761.0060.4930.4690.4710.3251.118f0.981.2431.0670.4320.5160.4360.4211.33g1.2331.0821.1040.560.5950.5100.4631.3h1.0231.0891.1950.4630.7460.5280.5411.149
[0110]
上述实施例和说明书中描述的只是说明本发明的原理和最佳实施例,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
[0111]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1