同时检测BK病毒和JC病毒的引物组和探针组及用途的制作方法
本发明涉及医学分子生物检测领域,具体涉及一种同时检测bk病毒和jc病毒的引物组和探针组及用途。
背景技术:
多瘤病毒(polyomaviruses,pv)属乳多孔病毒科病毒,主要包括bk病毒(bkv)、jc病毒(jcv)和猴空泡病毒40(sv40),其原发感染多发生于儿童和青少年时期,一般无明显临床症状,可潜伏于肾小管和尿道上皮细胞中。对健康人群并不致病,但当机体免疫能力低下时,潜伏体内的病毒便被激活,引起一系列的临床症状,如进行性多灶性白质脑(pml)、多瘤病毒相关性肾病(pvan)等。
肾移植是治疗肾脏终末期病变的重要手段。然而,患者在移植术后需要长期服用免疫抑制剂来避免排斥反应的发生,这就引起患者免疫力降低,病毒激活。其中,bkv和jcv是肾移植术后临床上常见致病病毒。在器官移植患者中,肾移植患者术后bkv再次被激活的发生率可达10%-68%,约1%-10%的肾移植患者会出现bkv相关肾病(bkvan),其中约50%会导致移植肾的功能丧失。jcv也是一种机会感染性病原,并可通过分娩、哺乳、呼吸道、消化道等方式传播。jcv具有明显的嗜神经性特点,严重免疫抑制患者感染jcv后可引起pml。此外,bkv和jcv非常相似(基因组相似度75%),难以区分。因此,通过早期检测患者bkv和jcv载量并有效区分,对预防bkv、jcv造成的临床症状具有重要意义。
对于bkv/jcv的检测方法较多,包括尿液decoy细胞检测、电镜的haufen检测、基于vp1mrna的分子检测和组织活检等,但存在分辨困难、阳性预测值低、成本较高、耗时长、有创等缺点,难以满足临床检测要求。荧光定量pcr(real-timepcr)是基于pcr扩增和数据采集为一体的核酸定量技术,并通过基因组上特异性变异位点,具有很高的特异性、灵敏度等特点,且检测时间短、检测效率高。目前,市场上同时检测bkv和jcv的诊断试剂较少(norgen,inc.),且价格昂贵,增加了患者的检测负担,而单独检测又耗时耗力。因此,本发明基于荧光定量pcr技术,基于不同荧光信号探针,同时对人体bkv和jcv进行检测,并根据制备的标准品进行病毒拷贝数定量,为辅助临床诊断提供支持。
技术实现要素:
因此,本发明要解决的技术问题在于提供一种同时检测人bk病毒和jc病毒的引物和探针及其用途。
为此,本发明提供了如下的技术方案:
本发明提供了一种同时检测bk病毒和jc病毒的引物组,所述的引物组是基于如seqidno.1和seqidno.2所示的核苷酸序列设计的。
可选的,所述引物组包括上游引物bj-f和下游引物bj-r,上游引物bj-f核苷酸序列如seqidno.3所示,下游引物bj-r核苷酸序列如seqidno.4所示。
本发明提供了一种同时检测bk病毒和jc病毒的探针组,所述的探针组是基于如seqidno.1和seqidno.2所示的核苷酸序列设计的。
可选的,所述探针组包括探针bk-p和探针jc-p,探针bk-p的核苷酸序列如seqidno.5所示,探针jc-p的核苷酸序列如seqidno.6所示。
可选的,所述探针bk-p和探针jc-p各自的5’端修饰有荧光报告基团,3’端修饰有荧光淬灭基团;
可选的,所述的荧光报告基团选自6-羧基荧光素、六氯-6-甲基荧光素、vic荧光染料、四氯-6-羧基荧光素、羧基-x-罗丹明、6-羧基四甲基罗丹明、2,7-二甲基-4,5-二氯-6-羧基荧光素、磺酰罗丹明、6-羧基-4’,5-二氯-2’,7’-二甲氧基荧光素琥珀酰亚胺酯、花菁3、花菁5或花菁5.5中的至少一种;
可选的,所述荧光淬灭基团为mgb。
本发明提供了所述的同时检测bk病毒和jc病毒的引物组和/或所述的同时检测bk病毒和jc病毒的探针组在制备检测bk病毒、jc病毒或同时检测bk病毒和jc病毒的产品中的用途;
可选的,所述的产品包括检测试剂和试剂盒。
本发明提供了一种同时检测bk病毒和jc病毒的荧光定量pcr试剂盒,包括所述的同时检测bk病毒和jc病毒的引物组和/或所述的同时检测bk病毒和jc病毒的探针组;
可选的,所述上游引物bj-f、下游引物bj-r、探针bk-p和探针jc-p的摩尔比为1:1:0.5:0.5。
可选的,所述同时检测bk病毒和jc病毒的荧光定量pcr试剂盒还包括pcrmastermix、阴性质控品、bkvdna标准品和jcvdna标准品中的至少一种;
可选的,所述阴性质控品为无菌水;
可选的,所述bkv标准品为克隆有如seqidno.1所示的核苷酸序列的重组质粒,设有6个浓度梯度,浓度依次为5×102copies/ul、5×103copies/ul、5×104copies/ul、5×105copies/ul、5×106copies/ul、5×107copies/ul;
可选的,所述jcv标准品为克隆有如seqidno.2所示的核苷酸序列的重组质粒,设有6个浓度梯度,浓度依次为5×102copies/ul、5×103copies/ul、5×104copies/ul、5×105copies/ul、5×106copies/ul、5×107copies/ul。
可选的,所述同时检测bk病毒和jc病毒的荧光定量pcr试剂盒,还包括pcr扩增反应体系,以25ul为计:
pcrmastermix,12.5ul;
上游引物bj-f,浓度为10um,1ul;
下游引物bj-r,浓度为10um,1ul;
探针bk-p,浓度为10um,0.5ul;
探针jc-p,浓度为10um,0.5ul;
dna模板,1ul;
无菌水补足至25ul。
本发明提供了一种同时检测bk病毒和jc病毒的荧光定量pcr方法,包括:
利用所述的同时检测bk病毒和jc病毒的引物组、所述的同时检测bk病毒和jc病毒的探针组和/或所述的同时检测bk病毒和jc病毒的荧光定量pcr试剂盒对待测样品进行荧光定量pcr扩增反应;
可选的,所述荧光定量pcr扩增反应条件为:95℃预变性5min;95℃变性10s,60℃退火延伸40s,40个循环;
可选的,每个循环中在60℃收集荧光信号;
可选的,所述荧光定量pcr扩增反应体系,以25ul为计:
pcrmastermix,12.5ul;
上游引物bj-f,浓度为10um,1ul;
下游引物bj-r,浓度为10um,1ul;
探针bk-p,浓度为10um,0.5ul;
探针jc-p,浓度为10um,0.5ul;
dna模板,1ul;
无菌水补足至25ul;
可选的,还包括荧光定量pcr标准曲线制定的步骤:将bkvdna标准品和jcvdna标准品分别利用利用所述的同时检测bk病毒和jc病毒的引物组、所述的同时检测bk病毒和jc病毒的探针组和/或所述的同时检测bk病毒和jc病毒的荧光定量pcr试剂盒对待测样品进行荧光定量pcr扩增反应,以各扩增产物的ct值为纵坐标,以各标准品的浓度为纵坐标,绘制荧光定量pcr标准曲线,通过所述标准曲线可以定量检测待测样品中的目标病毒的浓度。
本发明技术方案,具有如下优点:
1、本发明提供的一种同时检测bk病毒和jc病毒的引物组,所述的引物组是基于如seqidno.1和seqidno.2所示的核苷酸序列设计的,上述靶序列满足在100-200bp范围内,能够满足引物设计要求,同时基于上述靶序列设计的引物既能有效鉴别bk病毒,又能准确鉴别jc病毒,且设计合适引物的片段也具有较高难度。
2、本发明提供的一种同时检测bk病毒和jc病毒的引物组,所述引物组包括上游引物bj-f和下游引物bj-r,上游引物bj-f核苷酸序列如seqidno.3所示,下游引物bj-r核苷酸序列如seqidno.4所示,仅通过一对引物即可同时扩增出bk病毒和jc病毒各自的特异片段,两者扩增效率分别可达到94.4%和99.9%,能够满足检测要求,降低了反应成本,且特异性高,敏感性高,相比现有技术中通常鉴别一种病毒,反应体系包含一对引物和一条探针,鉴别两种病毒包含两对引物和两条探针。而在本发明中,同时检测bk和jc两种病毒,只设计了一对引物和2条探针,降低了检测成本,简化了实验操作。
3、本发明提供的一种同时检测bk病毒和jc病毒的探针组,所述的探针组是基于如seqidno.1和seqidno.2所示的核苷酸序列设计的,上述靶序列满足在100-200bp范围内,基于上述靶序列设计的两条探针能有效鉴别bk病毒和jc病毒,且特异性高。进一步的,所述探针组包括探针bk-p和探针jc-p,探针bk-p的核苷酸序列如seqidno.5所示,探针jc-p的核苷酸序列如seqidno.6所示,能有效鉴别bk病毒和jc病毒,且特异性高。
4、本发明提供的一种同时检测bk病毒和jc病毒的荧光定量pcr方法,敏感性高,最低检出可达到500copies/ul,且特异性高,不与其他病毒产生交叉反应,比如猴空泡病毒40(sv40)等。检测速度快,从样本采集到得出结果,仅需2~3个小时。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
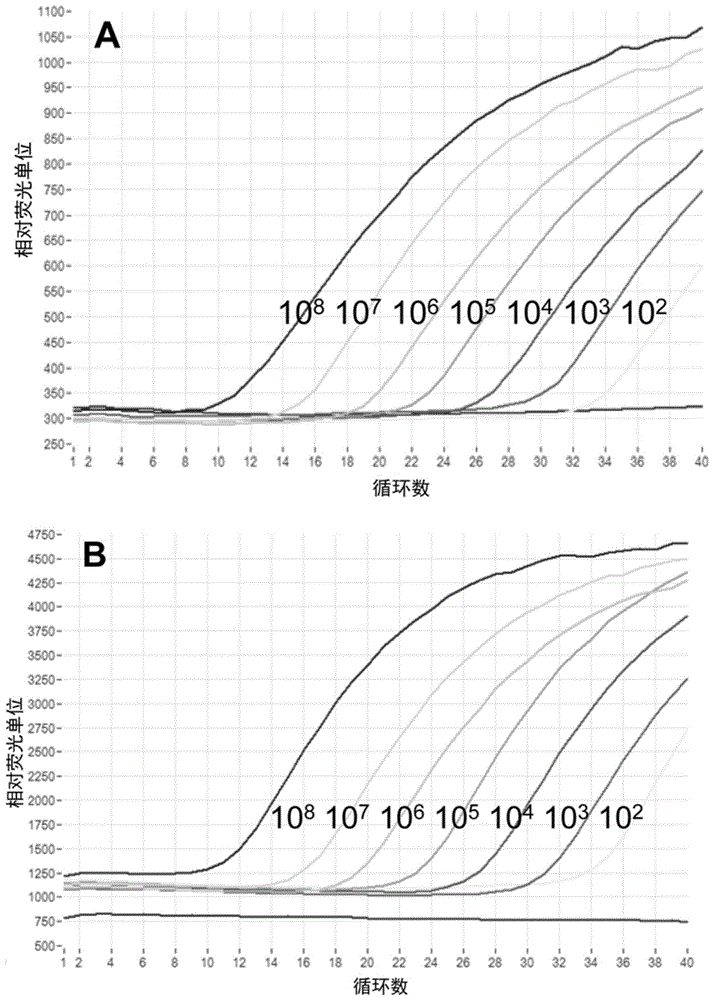
图1是本发明实施例3中bkv和jcv病毒荧光定量pcr扩增曲线;图中a图为bkv病毒,b图为jcv病毒;
图2是本发明实施例3中bkv和jcv病毒定量标准曲线;
图3是本发明对比例1中bkv病毒定量标准曲线;
图4是本发明对比例1中jcv病毒定量标准曲线;
图5是本发明实验例2中bkv模板荧光定量pcr扩增曲线;
图6是本发明实验例2中jcv模板荧光定量pcr扩增曲线;
图7是本发明实验例2中sv40模板荧光定量pcr扩增曲线。
具体实施方式
提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
下述实施例中pcrmastermix购自新海生物(nh9212),荧光定量pcr仪为罗氏lightcycler480。
实施例1一种同时检测bk病毒和jc病毒的引物组和探针组
本实施例从bkv和jcv基因组上的保守区中筛选出靶序列(如seqidno.1(bkv)和seqidno.2(jcv)所示),基于上述靶序列设计高特异性引物组和探针组,具体如下:
所述引物组包括上游引物bj-f和下游引物bj-r,上游引物bj-f核苷酸序列如seqidno.3所示,下游引物bj-r核苷酸序列如seqidno.4所示;
所述探针组包括探针bk-p和探针jc-p,探针bk-p的核苷酸序列如seqidno.5所示,探针jc-p的核苷酸序列如seqidno.6所示。
上述探针组中的各探针的5’端修饰有荧光报告基团,3’端修饰有荧光淬灭基团;所述荧光报告基团选自6-羧基荧光素(fam)、六氯-6-甲基荧光素(hex)、vic荧光染料(vic)、四氯-6-羧基荧光素(tet)、羧基-x-罗丹明(rox)、6-羧基四甲基罗丹明(tamra)、2,7-二甲基-4,5-二氯-6-羧基荧光素(joe)、磺酰罗丹明、6-羧基-4’,5-二氯-2’,7’-二甲氧基荧光素琥珀酰亚胺酯、花菁3、花菁5或花菁5.5。所述荧光淬灭基团为mgb(minorgroovebinder)。
在本实施例中的引物组和探针组如下表1所示:
表1.bk和jc病毒引物和探针
上述引物组和探针组的纯化方式可选自:hap、page和hplc纯化方式。上述的引物组和探针组委托通用生物系统(安徽)有限公司合成。
实施例2一种同时检测bk病毒和jc病毒的荧光定量pcr试剂盒
本实施例提供了一种同时检测bk病毒和jc病毒的荧光定量pcr试剂盒,包括实施例1中引物组和探针组。
进一步的,所述上游引物bj-f、下游引物bj-r、探针bk-p和探针jc-p的摩尔比为1:1:0.5:0.5。
进一步的,还包括pcrmastermix、阴性质控品、bkvdna标准品和jcvdna标准品中的至少一种;
所述阴性质控品为无菌水;
所述bkv标准品为克隆有bkv目的片段(为seqidno.1所示的核苷酸序列)的重组质粒,设有6个浓度梯度,浓度依次为5×102、5×103、5×104、5×105、5×106、5×107copies/ul;
所述jcv标准品为克隆有jcv目的片段(为如seqidno.2所示的核苷酸序列)的重组质粒,设有6个浓度梯度,浓度依次为5×102、5×103、5×104、5×105、5×106、5×107copies/ul。
进一步的,还包括pcr扩增反应体系,以25ul为计:
pcrmastermix,12.5ul;
上游引物bj-f,浓度为10um,1ul;
下游引物bj-r,浓度为10um,1ul;
探针bk-p,浓度为10um,0.5ul;
探针jc-p,浓度为10um,0.5ul;
dna模板,1ul;
无菌水补足至25ul。
上述试剂盒中的标准品的制备:将jcv目的片段(seqidno.2)和bkv目的片段(seqidno.1),基于基因合成技术合成两目的片段序列,并克隆至puc57载体(插入位置为ecori-hindiii之间)构建重组质粒,然后将重组质粒载体转化大肠杆菌,筛选阳性克隆后提取质粒。并通过引物组对提取所得的质粒dna进行扩增,sanger测序进行验证,证明所得到的重组质粒中具有目的序列(上述委托通用生物系统(安徽)有限公司合成)。利用紫外分光光度法(260nm)测量并计算质粒浓度,最后将重组质粒稀释成6个梯度(5×102~5×107copies/ul),分别作为试剂盒的bkv标准品i(5×102copies/ul)、bkv标准品ii(5×103copies/ul)、bkv标准品iii(5×104copies/ul)、bkv标准品iv(5×105copies/ul)、bkv标准品v(5×106copies/ul)、bkv标准品vi(5×107copies/ul)和jcv标准品i(5×102copies/ul)、jcv标准品ii(5×103copies/ul)、jcv标准品iii(5×104copies/ul)、jcv标准品iv(5×105copies/ul)、jcv标准品v(5×106copies/ul)、jcv标准品vi(5×107copies/ul)。
实施例3bkv和jcv荧光定量pcr标准曲线制定
利用实施例2中的试剂盒配制不同标准品的pcr扩增反应的体系为:
pcrmastermix,12.5ul;
上游引物bj-f,10um,1ul;
下游引物bj-r,10um,1ul;
探针bk-p,10um,0.5ul;
探针jc-p,10um,0.5ul;
dna模板(bkv或jcv各稀释浓度的标准品,还包括5×101copies/ul浓度的bkv或jcv标准品,或阴性质控品)1ul;
无菌水补足至25ul。
pcr扩增反应的条件为:95℃预变性5min;95℃变性10s,60℃退火延伸40s,40个循环。
在每个循环中60℃收集荧光信号;
bkv/jcv标准品的荧光定量pcr扩增曲线结果分别如图1中的a图和b图所示,在标准品5×102~5×107浓度梯度下,都有“s”型扩增曲线,而在5×101浓度以及阴性质控品下无“s”型曲线,表明bk和jc病毒的最低检测量均为5×102copies/ul。
以5×102~5×107copies/ul为模板按照上述pcr扩增反应的体系配制,根据上述pcr扩增反应的条件进行荧光定量pcr,以各浓度的标准品的ct值为纵坐标,以标准品的浓度为横坐标,得到两条标准曲线(图2),bkv的斜率(slope)、线性相关系数(r2)和扩增效率(e)分别为-3.463、0.9915、94.4%;jcv的slope、r2和e分别为-3.323、0.9996和99.9%,扩增产物ct值与浓度之间线性关系良好。
实施例4一种同时检测bk病毒和jc病毒的荧光定量pcr方法
本实施例提供了一种同时检测bk病毒和jc病毒的荧光定量pcr方法,包括如下步骤:
(1)获得待测样品;
(2)将所述待测样品作为dna模板,利用实施例1中的引物组和探针组配制得到如下的pcr扩增反应体系,以25ul为计:
pcrmastermix,12.5ul;
上游引物bj-f,浓度为10um,1ul;
下游引物bj-r,浓度为10um,1ul;
探针bk-p,浓度为10um,0.5ul;
探针jc-p,浓度为10um,0.5ul;
dna模板,1ul;
无菌水补足至25ul;
将上述pcr扩增反应体系按照如下的荧光定量pcr扩增反应条件进行扩增反应:95℃预变性5min;95℃变性10s,60℃退火延伸40s,40个循环;每个循环中在60℃收集荧光信号;
(3)将得到的ct值代入实施例3中的相应的标准曲线中,得到待测样品中相应病毒的浓度,实现bk病毒和jc病毒的定量检测。
实施例5重复性验证
将5×104、5×105、5×106copies/ul三个不同浓度的bkv标准品和jcv标准品分别作为dna模板,配制如下pcr扩增反应体系:
pcrmastermix,12.5ul;
上游引物bj-f,10um,1ul;
下游引物bj-r,10um,1ul;
探针bk-p,10um,0.5ul;
探针jc-p,10um,0.5ul;
dna模板(选定浓度的bkv或jcv标准品)1ul;
无菌水补足至25ul。
pcr扩增反应的条件为:95℃预变性5min;95℃变性10s,60℃退火延伸40s,40个循环。每个循环中在60℃收集荧光信号。
将得到的ct值代入实施例3中的相应的标准曲线中,得到待测样品中相应病毒的浓度。每个浓度的标准品分别进行3次批内和批间平行试验,计算变异系数(cv),结果如表2所示,批次内和批次间的变异系数均小于5%。
表2荧光定量pcr的批内和批间检测结果
对比例1
本对比例提供了一种同时检测bk病毒和jc病毒的引物组和探针组,具体见下表3所示,
表3.bk和jc病毒引物和探针
将上述引物组和探针组按照实施例3实施,绘制标准曲线,结果如图3-4所示,bkv病毒的扩增效率为89%,而jcv病毒扩增效率只有88%,难以满足检测要求。
实验例1
采用实施例4检测已知病理结果的肾移植患者血液样本,并与对比例1(对比例1按照实施例4实施,区别仅在于引物组和探针组采用对比例1的)比较,结果见下表4,
表4临床样本验证
注:“+”表示检测为阳性,“-”表示检测为阴性。
由以上结果可知,在本发明实施例4对9个肾移植患者的血液样本进行检测结果中,阳性率为100%,假阴性率为0,而对比例1的bk病毒假阴性率均为22.2%,jc病毒假阴性率33.3%,说明本发明的同时检测bk病毒和jc病毒的荧光定量pcr方法,具有准确度高的优势。
实验例2特异性
采用实施例4检测已知结果的肾移植患者血液样本(已知bkv、jcv、sv40病毒(猴空泡病毒40)各自序列的拷贝数大于5×102copies/ul),以病毒序列相似的bkv、jcv、sv40的阳性样本作为dna模板。结果如图5所示,在bkv模板中,只有bktaqman探针有扩增曲线(figurea);结果如图6所示,在jcv模板中,只有jctaqman探针有扩增曲线(figureb);结果如图7所示,在sv40模板中,无“s”型扩增曲线(figurec)。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
序列表
<110>苏州奥根诊断科技有限公司
<120>同时检测bk病毒和jc病毒的引物组和探针组及用途
<160>10
<170>siposequencelisting1.0
<210>1
<211>267
<212>dna
<213>bk病毒(bkv)
<400>1
ttgacagaaattattaattgcagaaactctatgtctatgtggagttaaaaagaatataat60
attatgcccagcacacatgtgtctactaataaaagttacagaatatttttccataagttt120
tttatacagaatttgagctttttctttagtagtatacacagcaaagcaggcaagggttct180
attactaaatacagcttgactaagaaactggtgtagatcagagggaaagtctttagggtc240
ttctacctttcttttttttttgggtgg267
<210>2
<211>267
<212>dna
<213>jc病毒(jcv)
<400>2
ttgacagtagttattaattgctgacactctatgtctatgtggtgttaagaaaaacaaaat60
attatgacccccaaaaccatgtctacttataaaagttacagaatatttttccataagttt120
cttatataaaatttgagctttttctttagtggtatacacagcaaaagaagcaacagttct180
attactaaacacagcttgactgaggaatgcatgcagatctacaggaaagtctttagggtc240
ttctaccttttttttctttttaggtgg267
<210>3
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>3
ttgcagaaactctatgtctatgt23
<210>4
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>4
aaggtagaagaccctaaagactt23
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
gcacacatgtgtctactaat20
<210>6
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>6
cagcttgactgaggaatgcatg22
<210>7
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>7
cagacactctatgctatgtg20
<210>8
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>8
gtagaagaccctaaggacttc21
<210>9
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>9
ccagcacacatgtgtcta18
<210>10
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>10
tgactgaggaatgcatgc18
- 还没有人留言评论。精彩留言会获得点赞!