柽柳多糖及其在制备补体抑制剂及防治病毒性肺炎药物中的用途
1.本发明属中药技术领域,涉及多糖,具体涉及从柽柳中分离制备的90醇沉粗多糖及6个均一多糖及其在制备补体抑制剂及防治病毒性肺炎药物中的用途。
背景技术:
2.补体系统是人体免疫系统的重要组成部分,然而该系统的过度激活会引起人体免疫系统的过度反应,造成人体自身正常组织的损伤。如类风湿性关节炎、老年性痴呆、系统性红斑狼疮(sle)以及缺血性再灌注、急性心肌梗死、急性呼吸窘迫综合征(ards)多器官功能衰竭综合症等急性疾病的发病过程中,补体的过度激活都起了重要作用。目前临床上使用的糖皮质激素等免疫抑制剂并非专一的补体抑制剂,且亦产生多种并发症和副作用,因此临床上急需高效低毒专一的新型补体抑制剂。
3.病毒性肺炎(viral pneumonia)是由多种病毒感染肺部引起的重大感染性疾病,起病急,病情发展快,病死率高。病毒性肺炎主要病理改变为肺泡水平的气体交换障碍,进一步引发急性肺损伤(acute lung injury,ali),导致患者出现呼吸窘迫和严重的低血氧症。补体过度激活是呼吸窘迫综合征的常见特征,c5a在外周血样本中显著升高,已被认为是与严重脓毒症、细胞因子风暴和多器官衰竭(mof)相关的呼吸窘迫综合征的标志(polycarpou a,howard m,farrar c a.embo molecular medicine,2020,12(8):1-15.)。据有关新冠尸检结果表明,患者血浆补体过度消耗导致肺泡毛细管壁损伤,通透性增加,炎性介质释放进一步增强,加重组织损伤;因此,补体抑制剂可作为治疗病毒性肺炎的潜在药物。
4.目前临床上治疗病毒性肺炎的常用药物中,抗病毒药物面临类病毒株变异迅速和疫苗周期长等问题,糖皮质激素类抗炎药物副作用明显。由于补体抑制为病毒性肺炎潜在的治疗靶点之一,因此,采用高效低毒的补体抑制剂作为病毒性肺炎药物的开发具有重要意义。我国中药资源丰富,许多中药对免疫系统有明显的调节作用,是寻找补体抑制剂和病毒性肺炎药物前体的宝贵资源。
5.柽柳,又称西河柳、观音柳、赤柽木,收载于《本草图经》《本草汇言》等,来源于柽柳科柽柳属植物tamarix chinensis lour.的枝叶,味甘,具有疏风、解表、透疹、止咳、清血热、利尿之功效,可用于治疗麻疹不透、风湿痹痛、风热感冒、咳嗽、关节风湿、慢性支气管炎、黄水病、鼻咽癌等。柽柳组方如麻杏石甘汤临床上治疗麻疹并发肺炎具有显著的疗效(张祖联.中西医结合临床杂志,1992,2(3):41-41;夏承义.时珍国医国药,2000,11(6):536-537.)。且有研究表明柽柳水提物具有抗炎和抗疱疹病毒活性(赵润洲,孙仕银,陈发奎.中草药,1995,26(2):85-85;周元,杨学志,郑民实.江西医学院学报,1988,24(28):1-7.);但尚未见对于柽柳多糖的结构、抗补体活性及对病毒性肺炎的防治作用的相关研究。
6.基于现有技术的现状,本技术的发明人拟提供柽柳多糖及其在制备补体抑制剂及防治病毒性肺炎药物中的用途。
技术实现要素:
7.本发明的目的是基于现有技术的现状,提供防治病毒性肺炎的抗补体活性成分,柽柳多糖及其在制备补体抑制剂及防治病毒性肺炎药物中的用途。具体涉及柽柳90醇沉多糖和6个柽柳均一多糖及其制备方法和在制备补体抑制药物、病毒性肺炎防治药物中的用途。本发明实验证实了柽柳多糖的抗补体活性及对甲型流感病毒诱导的急性肺损伤小鼠的保护作用。
8.具体的,本发明从植物柽柳tamarix chinensis lour.的枝叶中分离得到90醇沉多糖(mbap90)及6个均一多糖(mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap-6),并表征了所述多糖的结构特征,经体外实验证实所述多糖具有显著的补体抑制活性,可进一步用于制备抗补体药物。
9.本发明中,进行了整体动物模型试验,结果证实,90醇沉多糖(mbap90)及均一多糖(mbap-2、mbap-3和mbap-5)均能显著改善病毒性肺炎的病理状态,具有治疗病毒性肺炎的作用,可用于制备病毒性肺炎防治药物。
10.本发明所述的柽柳90醇沉多糖mbap90及均一多糖mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap-6的结构特征描述如下:
11.(1)mbap90由六种单糖组成,分子量范围为30.2-274.1kda;总糖含量为64.36%;蛋白含量为3.53%;糖醛酸含量为13.52%;黄酮含量为12.18%;不含硫酸基。单糖摩尔比d-葡萄糖:d-半乳糖:l-阿拉伯糖:d-甘露糖:d-葡萄糖醛酸:d-半乳糖醛酸=21.2:8.12:9.31:4.14:2.07:1.12。
12.(2)mbap-1是由五种单糖组成的多糖,分子量约为269.3kda;总糖含量为86.06%;蛋白含量为1.90%;糖醛酸含量为9.64%;黄酮含量为12.03%,不含硫酸基。单糖摩尔比d-葡萄糖:d-半乳糖:l-阿拉伯糖:d-葡萄糖醛酸:d-半乳糖醛酸=54.54:4.21:18.18:4.87:4.21。甲基化结果显示结构中含1,4-连接葡萄糖、1,3,4-连接葡萄糖、1,3,4,6-连接葡萄糖、1,2,3-连接的葡萄糖、末端连接葡萄糖醛酸、1,5-连接阿拉伯糖、末端连接阿拉伯糖、1,4-连接半乳糖和末端连接半乳糖醛酸组成,摩尔比为7.89:2.01:1:0.95:1.1:1.95:2.24:0.99:1.12。并且在1,3,4,6-连接葡萄糖的6位连有槲皮素。
13.(3)mbap-2是由葡萄糖组成,分子量约为46.5kda;总糖含量为82.03%;蛋白含量为2.06%;黄酮含量为15.96%,不含硫酸基。甲基化结果表明,该糖由1,4-连接葡萄糖,1,3,6-连接葡萄糖、末端连接葡萄糖、1,6-连接的葡萄糖、1,3,4-连接葡萄糖组成,摩尔比为0.44:0.35:1:0.9:0.63。并且在1,3,6-连接葡萄糖的6位与1,6-连接葡萄糖的1位同时连有槲皮素。
14.(4)mbap-3是由五种单糖组成的多糖,分子量约为80.1kda;总糖含量为89.01%;蛋白含量为1.55%;糖醛酸含量为10.51%;黄酮含量为9.43%,不含硫酸基。单糖摩尔比d-甘露糖:d-葡萄糖醛酸:d-葡萄糖:d-半乳糖:l-阿拉伯糖=11.87:10.51:63.21:5.04:10.21。甲基化糖链分析表明该糖由端基连接阿拉伯糖、端基连接葡萄糖醛酸、1,4-连接半乳糖、1,4-连接葡萄糖、1,3,4-连接葡萄糖、1,4,6-连接甘露糖、1,3,4,6-连接的葡萄糖组成,摩尔比为2.01:1.89:1:10.42:2.11:1.16:0.79。并且在1,4-连接半乳糖的4位连有杨梅素。
15.(5)mbap-4是由三种单糖组成的多糖,分子量约为56.4kda。总糖含量为88.66%;
蛋白含量为1.49%;糖醛酸含量为11.02%;黄酮含量为9.84%,不含硫酸基。单糖摩尔比d-葡萄糖醛酸:d-葡萄糖:d-半乳糖醛酸=6.35:87.86:5.79。甲基化糖链分析表明该糖由端基连接葡萄糖醛酸、端基连接半乳糖醛酸、1,4-连接葡萄糖、1,3,4-连接葡萄糖、1,4,6-连接葡萄糖组成,摩尔比为1:1.01:14.93:0.79:2.33。并且在1,4,6-连接葡萄糖的6位连接有杨梅素。
16.(6)mbap-5是由四种单糖组成的多糖,分子量约为153.6kda。总糖含量为83.98%;蛋白含量为1.07%;糖醛酸含量为24.86%;黄酮含量为14.94%,不含硫酸基。单糖摩尔比d-葡萄糖:d-葡萄糖醛酸:d-半乳糖:l-阿拉伯糖=50.14:24.86:15.42:9.58。甲基化糖链分析表明该糖由1,4-连接葡萄糖醛酸、1,6-连接葡萄糖、端基连接阿拉伯糖、1,4,6-连接葡萄糖、端基连接半乳糖、1,3,4-连接的葡萄糖和1,3,4,6-连接的葡萄糖组成,摩尔比为4.86:5.06:1.79:2.24:3.11:1.96:0.89。并且在1,3,4,6-连接葡萄糖的4位连接有槲皮素。
17.(7)mbap-6是由两种单糖组成的多糖,分子量约为34.4kda。总糖含量为88.69%;蛋白含量为0.91%;糖醛酸含量为9.51%;黄酮含量为10.42%,不含硫酸基。单糖摩尔比d-葡萄糖:d-葡萄糖醛酸=82.4:17.6。甲基化糖链分析表明该糖由1,4-连接葡萄糖醛酸、1,6-连接葡萄糖、1,3,4,6-连接的葡萄糖、1,4,6-连接葡萄糖、1,3,6-连接的葡萄糖和端基连接葡萄糖组成,摩尔比为4.15:3.67:0.92:3.13:2.15:5.93。并且在1,3,4,6-连接葡萄糖的3位上连接有槲皮素。
18.本发明所述的柽柳多糖(mbap90、mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap-6)通过下述方法制备:
19.柽柳以95%乙醇提取,滤过,残渣烘干后,用热水提取,提取液经滤过,浓缩,加入95%乙醇至乙醇浓度为80%,静置,离心取上清,上清液浓缩,加入无水乙醇至乙醇浓度为90%,静置,离心去上清,沉淀加水复溶,再以三氯醋酸去除蛋白,离心,上清液调至中性,浓缩,透析,冷冻干燥得90醇沉多糖(mbap90)。
20.90醇沉多糖加蒸馏水溶解,用deae-cellulose柱色谱初步分离。以蒸馏水、0.2、0.4、0.8和2.0mol/l的nacl溶液洗脱,收集各流份,浓缩,透析及冻干得5个次级组分:mbap90-1、mbap90-2、mbap90-3、mbap90-4及mbap90-5。
21.各个次级组分加入适量水溶解,离心,上清液用sephacryl tm s200凝胶色谱(截留分子量2kda-400kda)进行分离,收集各流份。隔管检测490nm(硫酸-苯酚法显色后)下的吸光度值,合并流份,浓缩及冷冻干燥得到均一多糖。
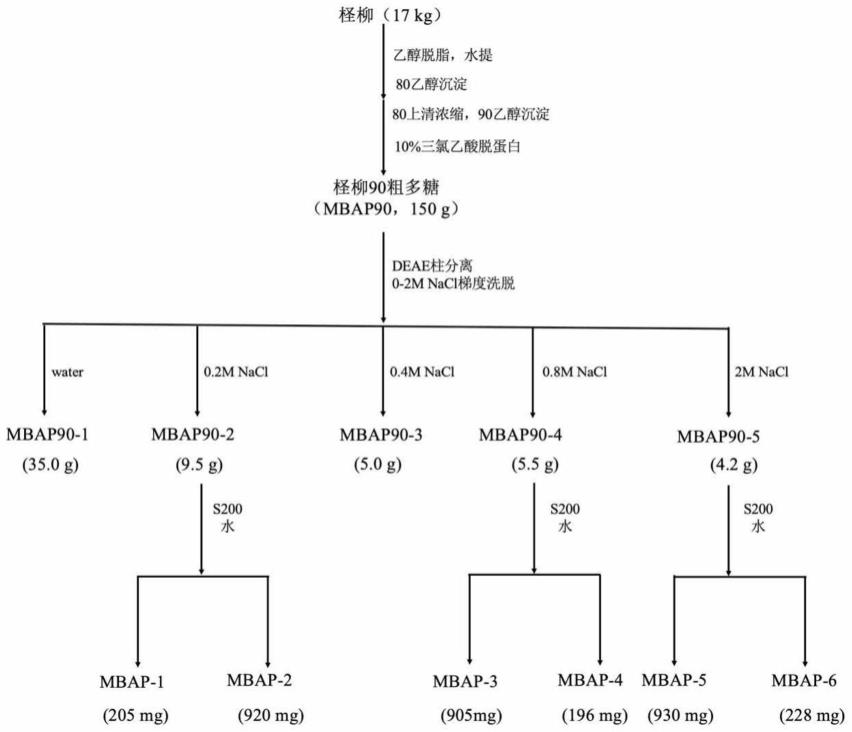
22.本发明进行了体外试验,结果证实,所述的柽柳多糖mbap90、mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap-6对补体经典途径激活所引发的细胞溶血均有明显的抑制,即有明显的抗补体作用,ch
50
值(经典途径50%抑制溶血所需供试品的浓度)分别为96
±
4μg/ml、33
±
4μg/ml、122
±
5μg/ml、72
±
3μg/ml、67
±
2μg/ml、56
±
2μg/ml和102
±
8μg/ml。
23.经体内动物试验证明,所述的柽柳多糖mbap90、mbap-2、mbap-3、mbap-5对h1n1诱导病毒性肺炎小鼠体重、肺部病理损伤、肺部炎症反应等均有显著的改善作用,对流感病毒引发的病毒性肺炎有显著的治疗效果。
24.本发明所述的柽柳多糖可用于制备补体抑制剂及防治病毒性肺炎的药物。
附图说明
25.图1,柽柳均一多糖分离流程图。
26.图2是mbap-1、mbap-2、mbap-3、mbap-4、mbap-5、和mbap-6的hpgpc的色谱图,其中tsk-gel gmpw
xl
凝胶柱(300
×
7.6mm);洗脱液:蒸馏水;流速:0.8ml/min)。
27.图3,柽柳多糖mbap90对h1n1病毒感染鼠体重的影响。
28.图4,柽柳多糖mbap90对h1n1病毒感染鼠肺指数的影响,其中,###p《0.001,normal control vs model control,*p《0.05,**p《0.01,***p《0.001,vs model control。
29.图5,柽柳多糖mbap90对h1n1病毒感染鼠血清tnf-α、il-18、c3c和il-1β的作用,其中,##p《0.01,###p《0.001,normal control vs model control,*p《0.05,**p《0.01,***p《0.001,vs model control。
30.图6,柽柳多糖mbap90对h1n1病毒感染鼠肺匀浆mcp-1、il-8、il-6、c3c的作用,其中,###p《0.001,normal control vs model control,*p《0.05,**p《0.01,***p《0.001,vs model control。
31.图7,柽柳多糖mbap90对h1n1病毒感染鼠肺部病理变化影响(200
×
)。
32.图8,柽柳均一多糖(mbap-2、mbap-3、mbap-5)对h1n1病毒感染鼠体重的影响。
33.图9,柽柳均一多糖(mbap-2、mbap-3、mbap-5)对h1n1病毒感染鼠肺指数的影响,其中,###p《0.001,normal control vs model control,*p《0.05,**p《0.01,***p《0.001,vs model control。
34.图10,柽柳均一多糖(mbap-2、mbap-3、mbap-5)对h1n1病毒感染鼠肺部匀浆il-8、il-6、il-18、il-1β、c3c和c5b-9的作用,其中,###p《0.001,normal control vs model control,*p《0.05,**p《0.01,***p《0.001,vs model control。
35.图11,柽柳均一多糖(mbap-2、mbap-3、mbap-5)对h1n1病毒感染鼠肺部病理变化影响(200
×
)。
具体实施方式
36.实施例1制备柽柳多糖mbap90、mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap-6
37.柽柳药材17kg粉碎,以95%乙醇提取,滤过,药渣用水溶液提取3次,浓缩,离心,上清液加入95%乙醇至乙醇浓度80%,静置,离心取上清,上清液浓缩,加入无水乙醇至乙醇浓度90%,静置,离心去上清,沉淀以水复溶,减压回收,除去乙醇;复溶再以三氯醋酸去除游离蛋白,离心,上清液调至中性,透析,浓缩,冷冻干燥即得粗多糖mbap90。粗多糖100g加蒸馏水溶解,离心,上清液用deae-cellulose柱色谱进行初步分离。以蒸馏水、0.2、0.4、0.8和2.0mol/l的nacl溶液洗脱,洗脱体积大于2倍柱体积(约10l),流速为25ml/min,收集各流份,隔管检测490nm(硫酸-苯酚法显色后)下的吸光度值。根据糖显色反应并结合紫外检测的结果,合并流份,浓缩,透析及冷冻干燥得5个次级组分:mbap90-1、mbap90-2、mbap90-3、mbap90-4及mbap90-5。
38.将mbap90-2(9.5g)加蒸馏水溶解,离心,上清液分次用sephacryl tm s200色谱(截留分子量2kda-400kda)分离。用蒸馏水溶液洗脱,流速为0.5ml/min,收集各流分。隔管检测490nm(硫酸-苯酚法显色后)下的吸光度值,根据检测结果合并相同流份,浓缩,透析及冷冻干燥得均一多糖mbap-1(205mg)和mbap-2(920mg)。
39.将mbap90-4(5.5g)加蒸馏水溶解,离心,上清液分次用sephacryl tm s200色谱分离。用蒸馏水溶液洗脱,流速为0.5ml/min,收集各流份。隔管检测490nm(硫酸-苯酚法显色后)下的吸光度值,根据检测结果合并相同流份,浓缩,透析及冷冻干燥得均一多糖mbap-3(905mg)和mbap-4(196mg)。
40.将mbap90-5(4.2g)加蒸馏水溶解,离心,上清液分次用sephacryl tm s200色谱分离。0.1mol/l nacl溶液洗脱,流速为0.8ml/min,收集各流份。隔管检测490nm(硫酸-苯酚法显色后)下的吸光度值,根据检测结果合并相同流份,浓缩,透析及冷冻干燥得均一多糖mbap-5(930mg)和mbap-6(228mg)。
41.经高效凝胶渗透色谱法(hpgpc)检测mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap-6均为均一组分。
42.实施例2柽柳多糖(mbap90、mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap-6)的结构表征
43.1)分子量的测定
44.采用高效凝胶渗透色谱法(hpgpc)进行多糖样品的相对分子量的测定,基本原理是均一多糖通过凝胶渗透色谱,形成对称的色谱峰,出峰时间与分子量大小相关,根据已知分子量得出的校正曲线进行计算。
45.色谱条件:用tsk gmpw
xl
凝胶柱进行分离,流速0.8mg/ml,进样量20μl,超纯水为流动相,柱温25℃,检测器为蒸发光散射检测器(elsd)。
46.实验方法:准确称取均一多糖和dextrans系列标准品各2.0mg,用超纯水水配置成2.0mg/ml的溶液,进样前用0.45μm的微孔滤膜过滤后检测,记录保留时间,以标准多糖分子量的对数值(lg)为纵坐标,保留时间为横坐标绘制标准曲线,得出相应的线性回归方程,计算均一多糖的相对分子量。mbap90、mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap-6的相对分子量分别为30.2-274.1kda、269.3kda、46.5kda、80.1kda、56.4kda、153.6kda、和34.4kda。
47.2)总糖、糖醛酸、蛋白、硫酸基及黄酮含量测定
48.硫酸-苯酚法测定mbap90总糖含量为64.36%;mbap-1总糖含量为86.06%;mbap-2总糖含量为82.03%;mbap-3总糖含量为89.01%;mbap-4总糖含量为88.66%;mbap-5总糖含量为83.98%和mbap-6总糖含量为88.69%。
49.间羟联苯法测定检测糖醛酸含量,mbap-1的糖醛酸含量为9.64%;mbap-3的糖醛酸含量为10.51%;mbap-4的糖醛酸含量为11.02%;mbap-5的糖醛酸含量为24.86%;mbap-6的糖醛酸含量为9.51%。
50.考马斯亮蓝法测定蛋白含量:mbap90的蛋白含量为3.53%;mbap-1的蛋白含量为1.90%;mbap-2的蛋白含量为2.06%;mbap-3的蛋白含量为1.55%;mbap-4的蛋白含量为1.49%;mbap-5的蛋白含量为1.07%;mbap-6的蛋白含量为0.91%。
51.bacl2比浊法测定mbap90、mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap90-6均不含硫酸基。
52.硝酸铝显色法测定黄酮含量:mbap90的总黄酮含量为12.18%;mbap-1的槲皮素含量为12.03%;mbap-2的槲皮素含量为15.96%;mbap-3的杨梅素含量为9.43%;mbap-4的杨梅素含量为9.84%;mbap-5的槲皮素含量为14.94%;mbap-6的槲皮素含量为10.42%。
53.3)单糖组成分析
54.mbap90、mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap-6分别经2mol/l tfa于110℃全水解得到的产物,再进行pmp衍生化后,进行液相分析。
55.mbap90是由六种单糖组成的多糖,d-葡萄糖:d-半乳糖:l-阿拉伯糖:d-甘露糖:d-葡萄糖醛酸:d-半乳糖醛酸=21.2:8.12:9.31:4.14:2.07:1.12。
56.mbap-1是由五种单糖组成的多糖,d-葡萄糖:d-半乳糖:l-阿拉伯糖:d-葡萄糖醛酸:d-半乳糖醛酸=54.54:4.21:18.18:4.87:4.21。
57.mbap-2是由d-葡萄糖组成的。
58.mbap-3是由五种单糖组成的多糖,d-甘露糖:d-葡萄糖醛酸:d-葡萄糖:d-半乳糖:l-阿拉伯糖=11.87:10.51:63.21:5.04:10.21。
59.mbap-4是由三种单糖组成的多糖,d-葡萄糖醛酸:d-葡萄糖:d-半乳糖醛酸=6.35:87.86:5.79。
60.mbap-5是由四种单糖组成的多糖,d-葡萄糖:d-葡萄糖醛酸:d-半乳糖:l-阿拉伯糖=50.14:24.86:15.42:9.58。
61.mbap-6是由两种单糖组成的多糖,d-葡萄糖:d-葡萄糖醛酸=82.4:17.6。
62.4)甲基化分析
63.采用改良hakomori法分别对多糖进行甲基化(mbap-1、mbap-3、mbap-4、mbap-5和mbap-6含有糖醛酸多糖的先用cmc-nabh4还原后再甲基化),甲基化后的产物用2mol/l tfa全水解,nabd4还原和醋酐乙酰化制成部分甲基化的阿尔迪醇乙酸酯衍生物,然后进行gc-ms分析。
64.mbap-1结构中含:1,4-连接葡萄糖、1,3,4-连接葡萄糖、1,3,4,6-连接葡萄糖、1,2,3-连接的葡萄糖、末端连接葡萄糖醛酸、1,5-连接阿拉伯糖、末端连接阿拉伯糖、1,4-连接半乳糖和末端连接半乳糖醛酸,摩尔比为7.89:2.01:1:0.95:1.1:1.95:2.24:0.99:1.12。
65.mbap-2结构中含:1,4-连接葡萄糖,1,3,6-连接葡萄糖、末端连接葡萄糖、1,6-连接的葡萄糖、1,3,4-连接葡萄糖,摩尔比为0.44:0.35:1:0.9:0.63。
66.mbap-3结构中含:端基连接阿拉伯糖、端基连接葡萄糖醛酸、1,4-连接半乳糖、1,4-连接葡萄糖、1,3,4-连接葡萄糖、1,4,6-连接甘露糖、1,3,4,6-连接的葡萄糖,摩尔比为2.01:1.89:1:10.42:2.11:1.16:0.79。
67.mbap-4结构中含:端基连接葡萄糖醛酸、端基连接半乳糖醛酸、1,4-连接葡萄糖、1,3,4-连接葡萄糖、1,4,6-连接葡萄糖,摩尔比为1:1.01:14.93:0.79:2.33。
68.mbap-5结构中含:1,4-连接葡萄糖醛酸、1,6-连接葡萄糖、端基连接阿拉伯糖、1,4,6-连接葡萄糖、端基连接半乳糖、1,3,4-连接的葡萄糖和1,3,4,6-连接的葡萄糖,摩尔比为4.86:5.06:1.79:2.24:3.11:1.96:0.89。
69.mbap-6结构中含:1,4-连接葡萄糖醛酸、1,6-连接葡萄糖、1,3,4,6-连接的葡萄糖、1,4,6-连接葡萄糖、1,3,6-连接的葡萄糖和端基连接葡萄糖,摩尔比为4.15:3.67:0.92:3.13:2.15:5.93。
70.5)均一多糖中黄酮结构与连接方式的确认
71.mbap-1、mbap-2、mbap-3、mbap-4、mbap-5和mbap-6分别经2mol/l tfa于110℃全水
解后,得到的产物旋干后加适量甲醇溶解,进行lc-ms分析。根据碎片进行初步分析后分别以杨梅素和槲皮素为对照进行lc-ms进一步确认。
72.lc-ms分析结果表明mbap-1、mbap-2、mbap-5、mbap-6结构中含槲皮素;mbap-3和mbap-4结构中含有杨梅素。
73.经核磁hmbc相关信号确认,mbap-1中槲皮素连接在1,3,4,6-连接葡萄糖的6位;mbap-2中槲皮素的4'位连接在1,3,6-连接葡萄糖的6位,槲皮素的5位链接在1,6-连接葡萄糖的1位;mbap-3中杨梅素连接在1,4-连接半乳糖的4位;mbap-4中杨梅素连接在1,4,6-连接葡萄糖的6位;mbap-5中槲皮素连接在1,3,4,6-连接葡萄糖的4位;mbap-6中槲皮素连接在1,3,4,6-连接葡萄糖的3位。
74.实施例3经典途径补体抑制试验
75.取3个月龄豚鼠的血清,以bbs缓冲液(巴比妥缓冲液,ph=7.4)稀释为1∶100,作为本次经典途径的补体来源。将兔抗羊红细胞的抗体以bbs缓冲液稀释为1∶1000作为溶血素;羊红细胞(srbc)配置成2%srbc。精密称量多糖3mg,加入bbs缓冲液溶解,对倍稀释成8个浓度。不同浓度的多糖溶液200μl与已经稀释到1∶100的补体200μl在37℃预孵育10min后,依次加入100μl溶血素(1∶1000)和100μl2%srbc,在37℃水浴30min后放入低温高速离心机,在5000rpm、4℃条件下离心10min。每管取200μl上清于96孔板中,在405nm测定吸光度。实验同时设置多糖对照组(200μl相应浓度的多糖加400μbbs缓冲液)、补体对照组(以200μlbbs缓冲液代替多糖)和全溶血组(100μl 2%srbc溶于500μl蒸馏水中)。将各浓度的多糖组吸光度值扣除相应多糖对照组吸光度值后计算溶血抑制率。以多糖浓度的对数作为x轴,溶血抑制率作为y轴作图,得到的拟合曲线计算50%抑制溶血所需供试品的浓度(ch
50
值)。以肝素作为阳性对照药,结果显示90醇沉多糖和六个均一多糖均对补体经典途径激活都有显著的抑制活性(如表1所示)。
76.表1柽柳多糖对补体激活的抑制作用
77.柽柳多糖mbap90mbap-1mbap-2mbap-3mbap-4mbap-5mbap-6ch
50
(μg/ml)96
±
433
±
4122
±
572
±
367
±
256
±
2102
±878.ch
50
值表达为:平均值
±
sd(n=3);阳性对照肝素ch
50
:34
±
2μg/ml。
79.实施例4柽柳多糖mbap90对h1n1诱导急性肺损伤小鼠肺指数的影响
80.balb/c小鼠36只(15-16g),按照体重随机分为6组(a、b、c、d、e、f):a组为正常对照组,b组为h1n1病毒模型组,c组为阳性对照利巴韦林组,d组为柽柳多糖mbap90低剂量组(mbap90-100,100mg/kg),e组为柽柳多糖mbap90中剂量组(mbap90-200,200mg/kg),f组为柽柳多糖mbap90高剂量组(mbap90-400,400mg/kg),每组6只。所有动物经戊巴比妥钠腹腔注射麻醉,滴鼻感染3ld
50
h1n1病毒液30μl,a组滴鼻感染1640培养液30μl作为对照;b-f组感染h1n1病毒稀释液,c-f组感染2小时后感胃给予相应剂量药物;同时a、b组给予0.5%cmc-na灌胃给药,作为正常组和病毒对照组。每天称量体重并给药一次,连续给药四天。h1n1病毒攻击96小时后,称量体重,摘眼球取血;按照常规取实验小鼠肺组织标本,称重记录;置于10%福尔马林溶液中,制成病理切片,进行病理评估;右肺置于-80℃冰箱保存,用于检测肺炎性因子指标。
81.(1)柽柳多糖mbap90对h1n1病毒感染鼠体重影响
82.体重变化是评价药物对病毒性肺炎小鼠有无保护作用的一个宏观指标。将小鼠每
天体重除以感染当天体重即得体重变化率,以小鼠每天体重变化率绘制体重变化曲线。结果显示,模型组小鼠体重下降幅度最大,各组给药体重下降幅度均显著小于模型组,其中柽柳多糖mbap90-400(400mg/kg)第四天略优于柽柳多糖mbap90-200(200mg/kg)和柽柳多糖mbap90-100(100mg/kg),结果如图3所示。
83.(2)柽柳多糖mbap90对h1n1病毒感染鼠肺指数影响
84.肺指数是小鼠肺重与体重的比值,其比值越大说明肺病变程度越严重,这也是病毒肺炎的重要指征。结果表明,与正常组相比,模型组小鼠肺指数明显升高(p《0.001);给予药物后,除mbap90低剂量组外,mbap90其他给药组(mbap90-200、mbap90-400)肺指数均显著低于模型组(p《0.05、p《0.01)。其中,柽柳多糖高剂量组略优于中剂量组(如图4所示)。
85.(3)柽柳多糖mbap90对h1n1病毒感染鼠血清tnf-α、il-18、c3c和il-1β的作用
86.小鼠全血离心获得血清,分装,冻存。应用elisa法,将上清按照tnf-α、il-18、c3c和il-1β试剂盒说明书测定。结果显示,与正常组相比,模型组血清中tnf-α、il-18、c3c和il-1β水平显著升高(p《0.001、p《0.001、p《0.001、p《0.01);给药后,除mbap90低剂量组外,其他多糖给药组(mbap90-200、mbap90-400)血清tnf-α、il-18、c3c和il-1β水平均显著低于模型组(tnf-α:p《0.05、p《0.01;il-18:p《0.001、p《0.001;il-1β:p《0.05、p《0.05;c3c:p《0.01、p《0.01),柽柳多糖mbap90高剂量组略低于中剂量组(如图5所示)。
87.(4)柽柳多糖mbap90对h1n1病毒感染鼠肺匀浆mcp-1、il-8、il-6、c3c的作用
88.应用elisa法,将匀浆上清按照mcp-1、il-8、il-6、c3c试剂盒说明书测定。与正常组相比,模型组小鼠肺匀浆mcp-1、il-8、il-6、c3c水平显著升高(p《0.001、p《0.001、p《0.001、p《0.01);给药后,各多糖给药组肺匀浆中mcp-1、il-6水平均显著低于模型组(mcp-1:p《0.001、p《0.001p《0.001;il-6:p《0.001、p《0.001p《0.001);同时,给药后,除mbap90低剂量组外,其他多糖给药组(mbap90-200、mbap90-400)il-8和c3c水平与模型组相比显著降低(il-8:p《0.001、p《0.001;c3c:p《0.01、p《0.01),结果如图6所示,
89.(5)柽柳多糖mbap90对h1n1病毒感染鼠肺部病理变化影响
90.病理检查结果表明,正常组肺泡轮廓清晰,结构完整,无渗血现象,基本无炎症;模型组病理切片显示肺泡壁明显增厚,肺泡萎缩变形,肺间质大量中性粒细胞及淋巴单核细胞浸润,炎症严重。各给药组均能显著改善肺部病理损伤,肺泡轮廓较清晰,结构相对完整,炎性细胞浸润状况明显减轻。其中,柽柳多糖mbap90高剂量组(400mg/kg)和中剂量组(200mg/kg)肺部损伤最小,基本跟正常组相近(如图7所示)。
91.实施例5柽柳均一多糖mbap-2、mbap-3和mbap-5对h1n1诱导急性肺损伤小鼠肺指数的影响
92.balb/c小鼠36只(15-16g),按照体重随机分为6组(a、b、c、d、e、f):a组为正常对照组,b组为h1n1病毒模型组,c组为阳性对照利巴韦林组,d组为均一多糖mbap-2组(mbap-2,400mg/kg),e组为均一多糖mbap-3组(mbap-3,400mg/kg),f组为均一多糖mbap-5组(mbap-5,400mg/kg),每组6只。所有动物经戊巴比妥钠腹腔注射麻醉,滴鼻感染3ld
50 h1n1病毒液30μl,a组滴鼻感染1640培养液30μl作为对照;b-f组感染h1n1病毒稀释液,c-f组感染2小时后感胃给予相应剂量药物;同时a、b组给予0.5%cmc-na灌胃给药,作为正常和病毒对照组。每天称量体重并给药一次,连续给药四天。h1n1病毒攻击96小时后,称量体重,摘眼球取血;按照常规取实验小鼠肺组织标本,称重记录;置于10%福尔马林溶液中,制成病理切片,进
行病理评估;右肺置于-80℃冰箱保存,用于检测肺炎性因子指标。
93.(1)柽柳均一多糖mbap-2、mbap90-3和mbap-5对h1n1病毒感染鼠体重影响
94.体重变化是评价药物对病毒性肺炎小鼠有无保护作用的一个宏观指标。将小鼠每天体重除以感染当天体重即得体重变化率,以小鼠每天体重变化率绘制体重变化曲线。结果显示,模型组小鼠体重下降幅度最大,各均一多糖给药组体重下降幅度均显著小于模型组(如图8所示)。
95.(2)柽柳均一多糖mbap-2、mbap-3和mbap-5对h1n1病毒感染鼠肺指数影响
96.肺指数是小鼠肺重与体重的比值,其比值越大说明肺病变程度越严重,这也是病毒肺炎的重要指征。结果表明,与正常组相比,模型组小鼠肺指数明显升高(p《0.001);给予药物后,均一多糖给药组(mbap-2、mbap-3、mbap-5)肺指数均显著低于模型组(p《0.05、p《0.01、p《0.01),结果如图9所示。
97.(3)柽柳均一多糖mbap-2、mbap-3和mbap-5对h1n1病毒感染鼠肺部匀浆il-8、il-6、il-18、il-1β、c3c和c5b-9的作用
98.应用elisa法,将肺匀浆上清按照il-8、il-6、il-18、il-1β、c3c和c5b-9试剂盒说明书测定。与正常组相比,模型组小鼠肺匀浆il-8、il-6、il-18、il-1β、c3c和c5b-9水平显著升高(p《0.001、p《0.001、p《0.001、p《0.001、p《0.001、p《0.001);给药后,各均一多糖给药组(mbap-2、mbap-3、mbap-5)肺匀浆中il-8、il-6、il-18、il-1β、c3c和c5b-9水平均显著低于模型组(il-8:p《0.001、p《0.001、p《0.001;il-6:p《0.001、p《0.001、p《0.001;il-18:p《0.001、p《0.001、p《0.001;il-1β:p《0.001、p《0.001、p《0.001;c3c:p《0.001、p《0.001、p《0.001;c5b-9:p《0.001、p《0.001、p《0.001);其中,mbap-5效果略优于mbap-3,而mbap-3效果略优于mbap-2,结果如图10所示。
99.(4)柽柳均一多糖mbap-2、mbap-3和mbap-5对h1n1病毒感染鼠肺部病理变化影响
100.病理检查结果表明,正常组肺泡轮廓清晰,结构完整,无渗血现象,基本无炎症;模型组病理切片显示肺泡壁明显增厚,肺泡萎缩变形,肺间质大量中性粒细胞及淋巴单核细胞浸润,炎症严重。各给药组均能显著改善肺部病理损伤,肺泡轮廓较清晰,结构相对完整,炎性细胞浸润状况明显减轻。其中,mbap-5(400mg/kg)和mbap-3(400mg/kg)肺部损伤最小,基本跟正常组相近(如图11所示)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1