本发明涉及dna重组及化学法制备融合蛋白技术领域,具体涉及一种glp-1类似物的半重组制备方法。
背景技术:
人胰高血糖素样肽-1(glp-1)是37个氨基酸残基的胃肠激素,参与血液葡萄糖代谢、胃肠分泌和代谢及食物摄取的调节。glp-1以葡萄糖依赖性方式刺激胰岛素分泌,刺激胰岛素生物合成,促进β细胞拯救,减少胰高血糖素分泌、胃排空和食物摄取,从而达到稳定的降糖效果,不易诱发低血糖。
由于glp-1及其类似物在治疗2型糖尿病的优良效果,使其近年来在糖尿病治疗药物市场中逐渐占据重要地位。人体内具有生物活性的glp-1主要是glp-1(7-36)和glp-1(7-37),天然的glp-1容易被血浆酶二肽基肽酶iv(dpp-iv)迅速水解失活,不具有临床使用价值。因此,对glp-1结构进行修饰,形成具有同样药理活性的glp-1类似物,并掩盖dpp-iv的结合位点,延长半衰期是该类药物研发的主要课题。现今已有多个glp-1类似物上市,如:利拉鲁肽、艾塞那肽、阿必鲁肽、杜拉鲁肽等,该类药物在未来10年内将会是抗糖尿病药物的重要增长点。
利拉鲁肽(liraglutide)是一种每日皮下注射一次的酰胺化长效glp-1类似物。利拉鲁肽是将glp-1(7-37)的lys34替换成arg,并且在lys26连接一条16碳棕榈脂肪酸(n-ε-(γ-glu(n-α-十六酰基)))而得到的衍生物,与天然glp-1有97%的同源性。注射利拉鲁肽后,其侧链上连接的16碳棕榈脂肪酸(n-ε-(γ-glu(n-α-十六酰基)))链可驱动利拉鲁肽分子自联形成稳定的七聚体,从而延缓吸收;并且还可以在体内通过非共价键作用与人体血清白蛋白连接形成生物大分子物质,达到有效延缓肾脏的清除、dpp-iv的代谢作用以及促进该药从注射部位缓慢释放等作用,它的血浆半衰期长达约13h。
索马鲁肽(semaglutide)是一种每周注射一次的长效glp-1类似物。索马鲁肽是将glp-1(7-37)的lys34替换成arg,第ala8位替换为α-氨基异丁酸,并且在lys26连接一条18碳脂肪二酸侧链,而得到的衍生物,与天然glp-1有94%的同源性。相比利拉鲁肽,索马鲁肽增长的碳链对白蛋白的亲和力增强5-6倍,与白蛋白结合,增大了分子量,避免快速被肾脏清除,并防止代谢性降解,延长了体内半衰期,其半衰期可长达一周。
目前对于glp-1类似物的生产制备工艺上,可以分为化学与生物两大途径。只含有蛋白氨基酸(即天然氨基酸)的多肽,例如天然glp-1,可以采用重组技术或通过化学合成法产生。然而,还含有非蛋白氨基酸的多肽,例如n端突出端的glp-1类似物,目前无法通过重组表达技术以实用的方式制备,而一般是通过化学合成法制备。
当采用化学法合成glp-1类似物、glp-1的截短类似物和glp-1的衍生物时,例如中国专利cn102875665b一种合成利拉鲁肽的方法、cn103275208b利拉鲁肽的制备方法等,以上化学合成方法需要用到大量的有机溶剂,对环境造成严重污染,并且化学合成副反应较多,产率低,所使用的氨基酸原料成本高,整体生产成本较高。
与化学合成法相比,生物法在环境友好型、工艺简单以及成本低廉等方面的优势而受到人们的重视。目前已有使用酵母表达系统表达利拉鲁肽和索马鲁肽的技术。但是,利用酵母系统表达外源蛋白时,酵母自身的蛋白酶可能会降解外源蛋白,特别是一些结构简单的小分子蛋白更容易被降解,导致产物表达量低,分离纯化困难。通过更换蛋白酶缺陷型的酵母菌株,改善发酵条件等,可部分减少外源蛋白的降解,但仍然不能满足产业化生产的要求。通过分子生物学手段敲除酵母菌株中的特定蛋白酶基因,可部分实现防止多肽的降解,如诺和诺德公司通过基因敲除获得的酿酒酵母菌株ye2085可高效表达,但该技术难度较大。
目前来说,大肠杆菌较多地被用于glp-1衍生物的发酵生产。这是因为利用大肠杆菌作为宿主表达glp-1衍生物片段,相较酵母具有更容易融合表达,产量高,无糖基化及酶干扰的优势。因而,大肠杆菌也逐渐成为glp-1衍生物的主要生物生产途径。目前在大肠杆菌生产利拉鲁肽方面,普遍是将arg34-glp-1(7-37)片段融合分子伴侣和连接肽进行表达,然后将分子伴侣及连接肽用特异性工具酶切除,得到arg34-glp-1(7-37)后再对其进行修饰得到利拉鲁肽。例如中国专利cn104745597a公开了一种高效表达重组利拉鲁肽蛋白的方法,该方法是将arg34-glp-1(7-37)通过肠激酶酶切位点连接his标签形成基因片段his-ek-(arg34-glp-1(7-37)),然后将基因片段载入大肠杆菌中进行该融合蛋白的表达。利用his标签亲和吸附得到融合蛋白后,再利用肠激酶特异性酶切肠激酶位点得到arg34-glp-1(7-37)。又例如中国专利cn106434717a公开了一种利用大肠杆菌表达带有glp-1片段的融合蛋白的制备方法。该蛋白含有可溶性分子伴侣、肠激酶识别位点及glp-1片段,其以可溶性蛋白形式表达后再被肠激酶特异性酶切得到相应的arg34-glp-1(7-37)片段。再例如文章《利拉鲁肽在大肠杆菌中的表达、制备工艺研究及活性分析》所披露的制备方法。其是采用大肠杆菌表达具有ksi分子伴侣、肠激酶识别位点及arg34-glp-1(7-37)片段的融合蛋白,通过收集包涵体进行变复性及纯化操作得到融合蛋白,再加入肠激酶进行特异性酶切并纯化得到arg34-glp-1(7-37)片段,最后加入脂肪酸活化物修饰得到利拉鲁肽。
上述披露的大肠杆菌生产工艺中存在两方面问题:一、上述工艺均采用了肠激酶作为工具酶,这是因为arg34-glp-1(7-37)片段中含有lys26、arg34和arg36等能够被常见消化酶(胰蛋白酶、糜蛋白酶、赖氨酰内切酶等)所识别的酶切位点,容易误切glp-1片段;虽然肠激酶能够特异性识别ddddk连接肽,不会误切glp-1片段,但其酶活低,商业化的肠激酶一般每一单位酶活仅可酶切50μg-500μg融合蛋白,且酶切时间长达12-24h,对于酶切温度(一般要求4℃-25℃)和缓冲液限制多(不能含高于200mm盐,或者2m以上的尿素、200mm咪唑),使用中还经常需要对酶切缓冲体系进行透析或置换;并且其价格高昂,使用量大,存在酶残留风险,并不利于工业化生产和成本的降低;二、上述工艺均需要通过各种纯化手段先获得融合蛋白前体,再进行酶切以获得arg34-glp-1(7-37)片段,然后再对arg34-glp-1(7-37)片段进行修饰得到利拉鲁肽分子,步骤繁琐。在方式上,要么是通过加入his标签亲和吸附融合蛋白,或者包涵体破碎溶解后再层析富集融合蛋白,又或者包涵体收集后变复性再层析富集融合蛋白。这样无形中增加了下游纯化步骤和成本,导致产品制备步骤复杂。
技术实现要素:
针对现有技术存在的不足,本发明要解决的技术问题是提供一种glp-1类似物的半重组制备方法,利用半重组法制备利拉鲁肽和索马鲁肽,即利用大肠杆菌重组表达技术制备glp-1(7-37)、glp-1(9-37)或glp-1(11-37),然后在特定的体外条件下定点化学修饰,获得经脂肪酸侧链修饰的融合蛋白分子,最后经特异性酶切获得利拉鲁肽和索马鲁肽分子。
为解决上述技术问题,本发明提供以下技术方案:
首先,本发明构建的融合蛋白(即glp-1类似物)拥有一个独立表达单元,即t7启动子-融合蛋白-t7终止子,该表达单元的核苷酸序列装载于质粒pgbc2中。为了便于理解,可以描述为融合蛋白具有以下结构通式:f-l-a。其中,f是伴侣蛋白,是一种不含有赖氨酸(lys)的酸性蛋白分子,优选为trxa,氨基酸序列如seqidno:9所示;l是连接肽,由10-30个氨基酸组成,氨基酸序列如seqidno:10或seqidno:11所示;a是目标多肽的部分序列,氨基酸序列分别如seqidno:12、seqidno:13或seqidno:14所示。具体地,本发明构建的四种融合蛋白的氨基酸序列如下所示。
融合蛋白1(seqidno:5):
msdriihltddsfdtdvlnadgailvdfwaewcgpcrmiapildeiadeyqgrltvarlnidqnpgtaprygirgiptlllfrngevaatvvgalsrgqlaefldanlahmasmtggqqmgrgsefggggsggseekhaegtftsdvssylegqaakefiawlvrgrg
融合蛋白2(seqidno:6):
msdriihltddsfdtdvlnadgailvdfwaewcgpcrmiapildeiadeyqgrltvarlnidqnpgtaprygirgiptlllfrngevaatvvgalsrgqlaefldanlahmasmtggqqmgrgsefggggsggsddddkhaegtftsdvssylegqaakefiawlvrgrg
融合蛋白3(seqidno:7):
msdriihltddsfdtdvlnadgailvdfwaewcgpcrmiapildeiadeyqgrltvarlnidqnpgtaprygirgiptlllfrngevaatvvgalsrgqlaefldanlahmasmtggqqmgrgsefggggsggseekegtftsdvssylegqaakefiawlvrgrg
融合蛋白4(seqidno:8):
msdriihltddsfdtdvlnadgailvdfwaewcgpcrmiapildeiadeyqgrltvarlnidqnpgtaprygirgiptlllfrngevaatvvgalsrgqlaefldanlahmasmtggqqmgrgsefggggsggseektftsdvssylegqaakefiawlvrgrg
因此,一方面,本发明提供一种融合基因,所述的融合基因具有以下结构通式:f-l-a;其中,f为伴侣蛋白的编码基因,l为连接肽的编码基因,a为glp-1类似物的编码基因;所述的伴侣蛋白为不含有赖氨酸的酸性蛋白;所述的连接肽的氨基酸序列如seqidno:10或seqidno:11所示;所述的glp-1类似物选自glp-1(7-37)、glp-1(9-37)或glp-1(11-37)多肽类似物。
优选地,所述的伴侣蛋白为trxa,其氨基酸序列如seqidno:9所示。
在第一种具体的实施方案中,所述的融合基因核苷酸序列为seqidno:1,其编码的融合蛋白的氨基酸序列为seqidno:5。
在第二种具体的实施方案中,所述的融合基因核苷酸序列为seqidno:2,其编码的融合蛋白的氨基酸序列为seqidno:6。
在第三种具体的实施方案中,所述的融合基因核苷酸序列为seqidno:3,其编码的融合蛋白的氨基酸序列为seqidno:7。
在第四种具体的实施方案中,所述的融合基因核苷酸序列为seqidno:4,其编码的融合蛋白的氨基酸序列为seqidno:8。
另一方面,本发明还提供了上述融合蛋白的制备方法,即一种glp-1类似物的半重组制备方法,包括如下步骤:
s1.构建上述任一所述的融合基因并连接到表达载体上,将顺式助溶蛋白因子dsba表达单元连接到表达载体的下游,将表达载体转化至大肠杆菌中,经筛选得到重组工程菌株;
s2.将步骤s1所得重组工程菌株进行发酵,经诱导表达得到融合蛋白,提取并纯化融合蛋白溶液;
s3.将步骤s2所得融合蛋白溶液与dmf充分混合均匀,用二异丙基乙胺将融合蛋白溶液的ph调节至11-12,并加入一定量的脂肪酸链活化物进行修饰反应;
s4.待步骤s3反应完后加入赖氨酰内切酶进行酶切反应,反应结束后经hplc纯化、冷冻干燥获得glp-1类似物。
优选地,步骤s1中所述的表达载体为pet-39b(+)。
具体地,步骤s1中所述的顺式助溶蛋白因子dsba表达单元为t7启动子-dsba-t7终止子的核苷酸序列。
优选地,步骤s1中所述的大肠杆菌为大肠杆菌top10。
优选地,步骤s2中所述的诱导表达为iptg诱导。
优选地,步骤s2中所述的提取并纯化融合蛋白溶液包括如下具体步骤:取大肠杆菌重组工程菌株的发酵表达菌体,用破菌缓冲液重悬,用700-800bar下高压均质两次;8000rpm离心20min收集上清液,加入终浓度0.4m的硫酸铵,再次离心收集上清液;用疏水层析纯化获得纯度大于90%的融合蛋白溶液。
优选地,步骤s3中所述的脂肪酸链活化物为n-棕榈酰基谷氨酸-γ-n-羟基琥珀酰亚胺酯或17-{(s)-1-叔丁氧基羰基-3-[2-(2-{[2-(2-羧基甲氧基乙氧基)乙基氨基甲酰基]甲氧基}乙氧基)乙基氨基甲酰基]丙基氨基甲酰基}十七烷酸叔丁酯。
优选地,步骤s3中所述的脂肪酸链活化物的用量为:1mol融合蛋白加入1.7-2.2mol脂肪酸链活化物。
优选地,步骤s4中所述的赖氨酰内切酶为重组赖氨酰内切酶,用量为:1g融合蛋白加入1-2au赖氨酰内切酶。
在一些具体的实施方案中,当构建的融合蛋白为融合蛋白1或融合蛋白2时,步骤s3的具体步骤为:向步骤s2所得的融合蛋白溶液中加入等体积的dmf,然后用二异丙基乙胺将融合蛋白溶液的ph调节至11-12,加入经dmf溶解的n-棕榈酰基谷氨酸-γ-n-羟基琥珀酰亚胺酯(1mol融合蛋白:2.1-2.2moln-棕榈酰基谷氨酸-γ-n-羟基琥珀酰亚胺酯),反应2h后加入等体积的纯化水稀释,用盐酸调节ph至4.5终止修饰反应。
步骤s4的具体步骤为:待步骤s3反应完后,8000rpm离心20分钟收集蛋白沉淀,用20mmtris缓冲液溶解,调ph至9-10之间,按融合蛋白:重组赖氨酰内切酶=1g:2au的比例加入重组赖氨酰内切酶进行酶切,反应20-30h调ph至7.0结束反应;然后用反向层析和c8高压柱层析、超滤、冷冻干燥得到利拉鲁肽冻干粉
在另一些具体的实施方案中,当构建的融合蛋白为融合蛋白3或融合蛋白4时,步骤s3的具体步骤为:向步骤s2所得的融合蛋白溶液中加入0.6倍体积的dmf,然后用二异丙基乙胺将融合蛋白溶液的ph调节至11-12,加入经dmf溶解的酰化试剂17-{(s)-1-叔丁氧基羰基-3-[2-(2-{[2-(2-羧基甲氧基乙氧基)乙基氨基甲酰基]甲氧基}乙氧基)乙基氨基甲酰基]丙基氨基甲酰基}十七烷酸叔丁酯(1mol融合蛋白:1.7-1.8mol酰化试剂),反应2h后加入等体积的纯化水稀释,用盐酸调节ph至4.5终止修饰反应。
步骤s4的具体步骤为:待步骤s3反应完后,8000rpm离心20分钟收集蛋白沉淀,用20mmtris缓冲液溶解,调ph至9-10之间,按融合蛋白:重组赖氨酰内切酶=1g:1-2au的比例加入赖氨酰内切酶进行酶切,反应20-30h调ph至4.5结束反应,然后8000rpm离心20min收集沉淀;将沉淀用水溶解后,用dipea调ph至8.3,加入boc-his(boc)-aib-osu,搅拌混合物14小时,调ph至4.5,8000rpm离心20min收集沉淀冷冻干燥,然后40℃进行旋蒸,加入tfa脱去保护基团,再经c8高压柱层析、冷冻干燥到索马鲁肽冻干粉。
相对于现有技术,本发明具有以下有益效果:
(1)本发明使用伴侣蛋白与目标多肽组成融合蛋白,并在表达质粒上添加顺式助溶蛋白因子dsba,实现了glp-1类似物融合蛋白在大肠杆菌的可溶性表达,且可溶蛋白比例达95%以上。
(2)本发明通过伴侣蛋白和连接肽的共同作用,实现了glp-1类似物融合蛋白在大肠杆菌中的高效表达,融合蛋白的表达量可达30g/l,具有产业化应用前景。
(3)采用本发明提供的融合蛋白序列,对融合蛋白进行脂肪酸侧链修饰时,绝大多数修饰位点发生在glp-1部分的第26位lys,其他错误修饰、多位点修饰杂质极少,后续纯化步骤简单。
(4)采用本发明提供的融合蛋白序列,依次经过修饰、酶切可去除伴侣蛋白和连接肽序列,获得无多余氨基酸的目标修饰多肽,酶切效率高,酶用量少,成本低,适合产业化生产。
附图说明
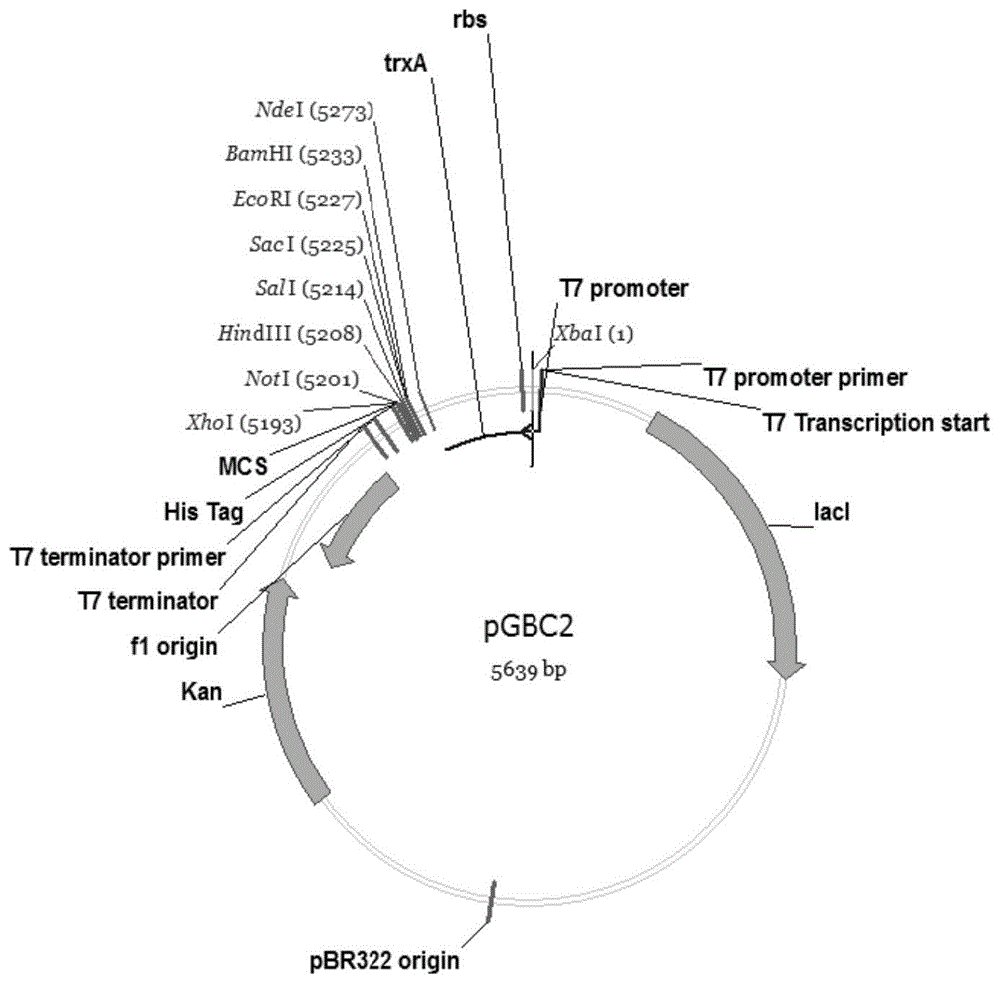
图1为质粒pgbc2的图谱。
图2为质粒pet-39b(+)的图谱。
图3为工程菌株bl21(de3)/pet39b-glp1、bl21(de3)/pet39b-glp2、bl21(de3)/pet39b-glp3、bl21(de3)/pet39b-glp4表达产物的sds-page电泳图谱。其中,泳道1为工程菌株bl21(de3)/pet39b-glp1诱导表达菌体的破碎上清液;泳道2为工程菌株bl21(de3)/pet39b-glp1诱导表达菌体的破碎沉淀溶解液;泳道3为工程菌株bl21(de3)/pet39b-glp2诱导表达菌体的破碎上清液;泳道4为工程菌株bl21(de3)/pet39b-glp2诱导表达菌体的破碎沉淀溶解液;泳道5为蛋白标准品,从下至上分子量分别为:6.5kd,9.5kd,14.4kd,20kd,27kd,35kd,45kd,66kd;泳道6为工程菌株bl21(de3)/pet39b-glp3诱导表达菌体的破碎上清液;泳道7为工程菌株bl21(de3)/pet39b-glp3诱导表达菌体的破碎沉淀溶解液;泳道8为工程菌株bl21(de3)/pet39b-glp4诱导表达菌体的破碎上清;泳道9为工程菌株bl21(de3)/pet39b-glp4诱导表达菌体的破碎沉淀溶解液。
图4为利拉鲁肽冻干粉的hplc检测。
图5为不同量赖氨酰内切酶酶切融合蛋白产物的sda-page检测结果。其中,泳道1为1g融合蛋白加入2au赖氨酰内切酶的酶切产物;泳道2为1g融合蛋白加入1au赖氨酰内切酶的酶切产物;泳道3为蛋白质标准品,从下至上分子量分别为:6.5kd,9.5kd,14.4kd,20kd,27kd,35kd,45kd,66kd;泳道4为未酶切的融合蛋白。
图6为索马鲁肽肽冻干粉的hplc检测。
图7为工程菌株bl21(de3)/pet39b-glp7、bl21(de3)/pet39b-glp8表达产物的sds-page电泳图谱。其中,泳道1为蛋白标准品,从下至上分子量分别为:6.5kd,9.5kd,14.4kd,20kd,27kd,35kd,45kd,66kd;泳道2为工程菌株bl21(de3)/pet39b-glp7诱导表达菌体的破碎上清液;泳道3为工程菌株bl21(de3)/pet39b-glp7诱导表达菌体的破碎沉淀溶解液;泳道4为工程菌株bl21(de3)/pet39b-glp8诱导表达菌体的破碎上清液;泳道5为工程菌株bl21(de3)/pet39b-glp8诱导表达菌体的破碎沉淀溶解液。
图8为不同浓度肠激酶酶切融合蛋白产物的sds-page检测图。其中,泳道1为未酶切的融合蛋白;泳道2为蛋白质标准品,从下至上分子量分别为:6.5kd,9.5kd,14.4kd,20kd,27kd,35kd,45kd,66kd;泳道3为空白;泳道4为1u/ml肠激酶酶切融合蛋白产物;泳道5为2u/ml肠激酶酶切融合蛋白产物;泳道6为5u/ml肠激酶酶切融合蛋白产物;泳道7为10u/ml肠激酶酶切融合蛋白产物。
图9为工程菌株bl21(de3)/pgbc2-glp1诱导培养产物的sds-page电泳图谱。其中,泳道1为蛋白质标准品,由上至下分子量依次为98kd,66.2kd,45kd,31kd,20kd,14.4kd;泳道2为菌株bl21(de3)/pgbc2-glp1诱导表达菌体的破碎上清液;泳道3为菌株bl21(de3)/pgbc2-glp1诱导表达菌体的破碎沉淀溶解液。
具体实施方式
下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明的融合基因和大肠杆菌重组工程菌株的构建方法可参考自本领域实验指南(j.萨姆布鲁克等,《分子克隆实验指南》第二版,科学出版社,1995年)。
实施例1构建融合蛋白1的工程菌株
根据融合蛋白1的氨基酸序列,根据密码子简并性和大肠杆菌密码子偏好性,设计编码基因序列,并在基因5’端添加限制酶ndei酶切位点catatg,在3’端添加双终止密码子taatga和限制酶xhoi酶切位点ctcgag,得到核苷酸序列(如seqidno:1所示),并委托人工合成核苷酸序列,然后连接至质粒puc57中得到重组质粒puc57-glp1,保存于top10中。用限制酶ndei和xhoi酶切质粒,回收目的基因,连接至同样经ndei和xhoi双酶切的质粒pgbc2(图1),转化至大肠杆菌top10,经测序鉴定获得正确的重组质粒pgbc2-glp1。以重组质粒pgbc2-glp1为模板,以primer-a和primer-b为引物扩增基因片段;以质粒pet-39b(+)(图2)为模板,以primer-c和primer-d为引物载体核苷酸片段;使用同源重组法将基因片段和载体核苷酸片段连接起来,并转化至大肠杆菌top10,经测序鉴定获得重组表达质粒pet39b-glp1。将重组质粒pet39b-glp1转化至大肠杆菌bl21(de3),获得可表达融合蛋白1的工程菌株bl21(de3)/pet39b-glp1。将工程菌株接种至含有lb培养基的三角瓶中,37℃培养至菌液od600=0.6-0.8时加入0.3mmiptg诱导表达,诱导6h收获菌体,用0.2m磷酸钠缓冲液重悬,在冰浴保护下超声波破碎20分钟,收集超声破碎上清液和超声破碎沉淀,超声破碎沉淀用与超声破碎上清液等体积的8m尿素溶解,用sds-page电泳检测(图3)。
其中,所用到的引物的核苷酸序列如下所示:
primer-a(seqidno:15):ctgaaaggaggaactatatcctaatacgactcactataggg;
primer-b(seqidno:16):cgcgtcccattcgccaatcccaaaaaacccctcaagaccc;
primer-c(seqidno:17):ggatatagttcctcctttcag;
primer-d(seqidno:18):ggattggcgaatgggacgcg。
实施例2构建融合蛋白2的工程菌株
融合蛋白2编码基因的核苷酸序列如seqidno:2所示,可表达融合蛋白2的工程菌株bl21(de3)/pet39b-glp2的构建方法与实施例1相同。
工程菌株bl21(de3)/pet39b-glp2表达产物的sds-page电泳见图3。
实施例3构建融合蛋白3的工程菌株
融合蛋白3编码基因的核苷酸序列如seqidno:3所示,可表达融合蛋白3的工程菌株bl21(de3)/pet39b-glp3的构建方法与实施例1相同。
工程菌株bl21(de3)/pet39b-glp3表达产物的sds-page电泳见图3。
实施例4构建融合蛋白4的工程菌株
融合蛋白4编码基因的核苷酸序列如seqidno:4所示,可表达融合蛋白4的工程菌株bl21(de3)/pet39b-glp4的构建方法与实施例1相同。
工程菌株bl21(de3)/pet39b-glp4表达产物的sds-page电泳见图3。
实施例5工程菌株的发酵培养
将实施例1-4的工程菌株bl21(de3)/pet39b-glp1、bl21(de3)/pet39b-glp2、bl21(de3)/pet39b-glp3、bl21(de3)/pet39b-glp4,接种至装有300mllb培养基的三角瓶,37℃,220rpm培养15-18小时,然后接种至装有3l无机盐发酵培养基的7.5l发酵罐。37℃培养,通过调节转速、通气量保存溶氧在20%以上,用氨水调节ph并保持为7.0;当菌液浓度od600达到60-80时,加入终浓度0.2mm的iptg,并将温度调为28℃,继续培养10小时后停止培养,收集发酵液,8000rpm离心20分钟,收集菌体备用。
实施例6融合蛋白的前处理、修饰、酶切及纯化
取实施例5中工程菌株bl21(de3)/pet39b-glp1、bl21(de3)/pet39b-glp2的发酵表达菌体,用破菌缓冲液重悬,用700-800bar下高压均质两次;8000rpm离心20min收集上清液,加入终浓度0.4m的硫酸铵,再次离心收集上清液。用疏水层析纯化获得纯度大于90%的融合蛋白溶液,加入等体积的dmf,然后用二异丙基乙胺将融合蛋白溶液的ph调节至11-12,加入经dmf溶解的n-棕榈酰基谷氨酸-γ-n-羟基琥珀酰亚胺酯(1mol融合蛋白:2.1-2.2moln-棕榈酰基谷氨酸-γ-n-羟基琥珀酰亚胺酯),反应2h后加入等体积的纯化水稀释,用盐酸调节ph至4.5终止修饰反应。8000rpm离心20分钟收集蛋白沉淀,用20mmtris缓冲液溶解,调ph至9-10之间,按融合蛋白:重组赖氨酰内切酶=1g:2au的比例加入重组赖氨酰内切酶进行酶切,反应20-30h调ph至7.0结束反应。然后用反向层析和c8高压柱层析、超滤、冷冻干燥得到利拉鲁肽冻干粉(hplc检测结果如图4所示)。
实施例7融合蛋白的前处理、修饰、酶切及纯化
取实施例5中工程菌株bl21(de3)/pet39b-glp3、bl21(de3)/pet39b-glp4的发酵表达菌体,用破菌缓冲液重悬,用700-800bar下高压均质两次;8000rpm离心20min收集上清液,加入终浓度0.4m的硫酸铵,再次离心收集上清液。用疏水层析纯化获得纯度大于90%的融合蛋白溶液,加入0.6倍的dmf,然后用二异丙基乙胺将融合蛋白溶液的ph调节至11-12,加入经dmf溶解的酰化试剂17-{(s)-1-叔丁氧基羰基-3-[2-(2-{[2-(2-羧基甲氧基乙氧基)乙基氨基甲酰基]甲氧基}乙氧基)乙基氨基甲酰基]丙基氨基甲酰基}十七烷酸叔丁酯(1mol融合蛋白:1.7-1.8mol酰化试剂),反应2h后加入等体积的纯化水稀释,用盐酸调节ph至4.5终止修饰反应。8000rpm离心20分钟收集蛋白沉淀,用20mmtris缓冲液溶解,调ph至9-10之间,按融合蛋白:重组赖氨酰内切酶=1g:1-2au的比例加入赖氨酰内切酶进行酶切(酶切产物的sds-page电泳结果如图5所示),反应20-30h调ph至4.5结束反应,然后8000rpm离心20min收集沉淀。将沉淀用水溶解后,用dipea调ph至8.3,加入boc-his(boc)-aib-osu,搅拌混合物14小时,调ph至4.5,8000rpm离心20min收集沉淀冷冻干燥,然后40℃进行旋蒸,加入tfa脱去保护基团,再经c8高压柱层析、冷冻干燥到索马鲁肽冻干粉(hplc检测结果如图6所示)。
对比例1
对比例1设计了融合蛋白的伴侣蛋白中含lys残基,并构建了表达融合蛋白的工程菌株。具体如下:
融合蛋白5(seqidno:19):
msdkiihltddsfdtdvlkadgailvdfwaewcgpckmiapildeiadeyqgkltvaklnidqnpgtapkygirgiptlllfkngevaatkvgalskgqlkefldanlahmasmtggqqmgrgsefggggsggseekhaegtftsdvssylegqaakefiawlvrgrg
融合蛋白6(seqidno:20):
msdkiihltddsfdtdvlkadgailvdfwaewcgpckmiapildeiadeyqgkltvaklnidqnpgtapkygirgiptlllfkngevaatkvgalskgqlkefldanlahmasmtggqqmgrgsefggggsggseekegtftsdvssylegqaakefiawlvrgrg
按照实施例1所述方法构建重组大肠杆菌菌株,并按照实施例6所述方法制备利拉鲁肽,按照实施例7所述方法制备索马鲁肽,发现脂肪酸链的用量增加了2.5-3.5倍(表1)。推测本对比例中lys残基与脂肪酸链发生了修饰反应,并生成了错误修饰杂质。
表1制备不同融合蛋白的脂肪酸链的用量
对比例2
对比例2设计了融合蛋白的伴侣蛋白中无lys残基,但伴侣蛋白的氨基酸序列与seqidno:9不同,并构建了表达融合蛋白的工程菌株。具体如下:
融合蛋白7(seqidno:21):
msdriihltddsfdtdvlradgailvdfwaewcgpcrmiapildeiadeyqgrltvarlnidqnpgtaprygirgiptlllfrngevaatrvgalsrgqlrefldanlahmasmtggqqmgrgsefggggsggseekegtftsdvssylegqaakefiawlvrgrg
融合蛋白8(seqidno:22):
msdriihltddsfdtdvlnadgailvdfwaewcgpcrmiapildeiadeyqgrltvarlnidqnpgtaprygirgiptlllfrngevaatdvgalsrgqlrefldanlahmasmtggqqmgrgsefggggsggseekegtftsdvssylegqaakefiawlvrgrg
使用实施例1相同方法构建重组大肠杆菌菌株bl21(de3)/pet39b-glp7和bl21(de3)/pet39b-glp7,并按实施例1所述方法进行摇瓶培养和sds-page电泳检测(图7),发现融合蛋白7-8的表达量比实施例1中融合蛋白1的表达量低。
对比例3
对比例3采用不同浓度肠激酶识别酶切融合蛋白,具体如下:
取实施例3中工程菌株bl21(de3)/pgbc2-glp3发酵表达获得含融合蛋白的大肠杆菌细胞。按实施例6的方法制备融合蛋白溶液,将融合蛋白浓度调整为10mg/ml,分别加入1u/ml、2u/ml、5u/ml、10u/ml肠激酶酶切(酶切产物的sds-page检测结果如图8所示)。发现1g融合蛋白需要1000u肠激酶(1000u肠激酶市售价约2000元)才能完全酶切(酶切效率≥95%视为完全酶切)。实施例6-7中,1g融合蛋白发生完全酶切需要2au赖氨酰内切酶(1000au重组赖氨酰内切酶市售价约18600元)。由此可见酶切融合蛋白时,使用肠激酶的生产成本远超赖氨酰内切酶。
对比例4
对比例4设计了不含顺式助溶蛋白dsba表达元件的融合蛋白,并构建了表达融合蛋白的工程菌株。具体如下:
将实施例1中的重组质粒pgbc2-glp1直接转化至大肠杆菌bl21(de3),经摇瓶表达验证,获得可表达融合蛋白1的工程菌株bl21(de3)/pgbc2-glp1。发酵表达发现,融合蛋白中可溶性蛋白比例仅占60%(sds-page检测结果如图9所示)。
最后应当说明的是,以上内容仅用以说明本发明的技术方案,而非对本发明保护范围的限制,本领域的普通技术人员对本发明的技术方案进行的简单修改或者等同替换,均不脱离本发明技术方案的实质和范围。
序列表
<110>珠海冀百康生物科技有限公司
<120>一种glp-1类似物的半重组制备方法
<160>22
<170>siposequencelisting1.0
<210>1
<211>518
<212>dna
<213>人(homosapiens)
<400>1
catatgtcagataggataattcacctaacagatgactcctttgataccgatgtgctgaac60
gctgatggtgccattctcgtcgatttctgggcggaatggtgtggtccgtgcaggatgatt120
gcgccaatcttggacgagatcgccgacgagtaccagggtcgtctgaccgttgcccgtctg180
aacattgatcagaacccgggtacggctccgcgctatggtattcgtggtatcccgaccctg240
ttgttatttcgtaatggtgaagttgcggctaccgttgtgggtgcgctgtctcgtggccaa300
ttggctgagttcctggatgcaaacctggcacacatggcgtccatgaccggcggtcaacaa360
atgggtcgcggctcggagttcggcggcggcggcagcggtggcagcgaggagaaacatgca420
gagggtacgtttacttcagacgttagcagctacctggaaggccaggcagcgaaagagttc480
atcgcgtggctggtgcgcggccgtggttaatgactcga518
<210>2
<211>525
<212>dna
<213>人(homosapiens)
<400>2
catatgtcagataggataattcacctaacagatgactcctttgataccgatgtgctgaac60
gctgatggtgccattctcgtcgatttctgggcggaatggtgtggtccgtgcaggatgatt120
gcgccaatcttggacgagatcgccgacgagtaccagggtcgtctgaccgttgcccgtctg180
aacattgatcagaacccgggtacggctccgcgctatggtattcgtggtatcccgaccctg240
ttgttatttcgtaatggtgaagttgcggctaccgttgtgggtgcgctgtctcgtggccaa300
ttggctgagttcctggatgcaaacctggcacacatggcgtccatgaccggcggtcaacaa360
atgggtcgcggctcggagttcggcggcggcggcagcggtggcagcgacgatgacgacaaa420
catgcagagggtacgtttacttcagacgttagcagctacctggaaggccaggcagcgaaa480
gagttcatcgcgtggctggtgcgcggccgtggttaatgactcgag525
<210>3
<211>513
<212>dna
<213>人(homosapiens)
<400>3
catatgtcagataggataattcacctaacagatgactcctttgataccgatgtgctgaac60
gctgatggtgccattctcgtcgatttctgggcggaatggtgtggtccgtgcaggatgatt120
gcgccaatcttggacgagatcgccgacgagtaccagggtcgtctgaccgttgcccgtctg180
aacattgatcagaacccgggtacggctccgcgctatggtattcgtggtatcccgaccctg240
ttgttatttcgtaatggtgaagttgcggctaccgttgtgggtgcgctgtctcgtggccaa300
ttggctgagttcctggatgcaaacctggcacacatggcgtccatgaccggcggtcaacaa360
atgggtcgcggctcggagttcggcggcggcggcagcggtggcagcgaggagaaagagggt420
acgtttacttcagacgttagcagctacctggaaggccaggcagcgaaagagttcatcgcg480
tggctggtgcgcggccgtggttaatgactcgag513
<210>4
<211>507
<212>dna
<213>人(homosapiens)
<400>4
catatgtcagataggataattcacctaacagatgactcctttgataccgatgtgctgaac60
gctgatggtgccattctcgtcgatttctgggcggaatggtgtggtccgtgcaggatgatt120
gcgccaatcttggacgagatcgccgacgagtaccagggtcgtctgaccgttgcccgtctg180
aacattgatcagaacccgggtacggctccgcgctatggtattcgtggtatcccgaccctg240
ttgttatttcgtaatggtgaagttgcggctaccgttgtgggtgcgctgtctcgtggccaa300
ttggctgagttcctggatgcaaacctggcacacatggcgtccatgaccggcggtcaacaa360
atgggtcgcggctcggagttcggcggcggcggcagcggtggcagcgaggagaaaacgttt420
acttcagacgttagcagctacctggaaggccaggcagcgaaagagttcatcgcgtggctg480
gtgcgcggccgtggttaatgactcgag507
<210>5
<211>168
<212>prt
<213>人(homosapiens)
<400>5
metseraspargileilehisleuthraspaspserpheaspthrasp
151015
valleuasnalaaspglyalaileleuvalaspphetrpalaglutrp
202530
cysglyprocysargmetilealaproileleuaspgluilealaasp
354045
glutyrglnglyargleuthrvalalaargleuasnileaspglnasn
505560
proglythralaproargtyrglyileargglyileprothrleuleu
65707580
leupheargasnglygluvalalaalathrvalvalglyalaleuser
859095
argglyglnleualaglupheleuaspalaasnleualahismetala
100105110
sermetthrglyglyglnglnmetglyargglyserglupheglygly
115120125
glyglyserglyglysergluglulyshisalagluglythrphethr
130135140
seraspvalsersertyrleugluglyglnalaalalysglupheile
145150155160
alatrpleuvalargglyarggly
165
<210>6
<211>170
<212>prt
<213>人(homosapiens)
<400>6
metseraspargileilehisleuthraspaspserpheaspthrasp
151015
valleuasnalaaspglyalaileleuvalaspphetrpalaglutrp
202530
cysglyprocysargmetilealaproileleuaspgluilealaasp
354045
glutyrglnglyargleuthrvalalaargleuasnileaspglnasn
505560
proglythralaproargtyrglyileargglyileprothrleuleu
65707580
leupheargasnglygluvalalaalathrvalvalglyalaleuser
859095
argglyglnleualaglupheleuaspalaasnleualahismetala
100105110
sermetthrglyglyglnglnmetglyargglyserglupheglygly
115120125
glyglyserglyglyseraspaspaspasplyshisalagluglythr
130135140
phethrseraspvalsersertyrleugluglyglnalaalalysglu
145150155160
pheilealatrpleuvalargglyarggly
165170
<210>7
<211>166
<212>prt
<213>人(homosapiens)
<400>7
metseraspargileilehisleuthraspaspserpheaspthrasp
151015
valleuasnalaaspglyalaileleuvalaspphetrpalaglutrp
202530
cysglyprocysargmetilealaproileleuaspgluilealaasp
354045
glutyrglnglyargleuthrvalalaargleuasnileaspglnasn
505560
proglythralaproargtyrglyileargglyileprothrleuleu
65707580
leupheargasnglygluvalalaalathrvalvalglyalaleuser
859095
argglyglnleualaglupheleuaspalaasnleualahismetala
100105110
sermetthrglyglyglnglnmetglyargglyserglupheglygly
115120125
glyglyserglyglysergluglulysgluglythrphethrserasp
130135140
valsersertyrleugluglyglnalaalalysglupheilealatrp
145150155160
leuvalargglyarggly
165
<210>8
<211>164
<212>prt
<213>人(homosapiens)
<400>8
metseraspargileilehisleuthraspaspserpheaspthrasp
151015
valleuasnalaaspglyalaileleuvalaspphetrpalaglutrp
202530
cysglyprocysargmetilealaproileleuaspgluilealaasp
354045
glutyrglnglyargleuthrvalalaargleuasnileaspglnasn
505560
proglythralaproargtyrglyileargglyileprothrleuleu
65707580
leupheargasnglygluvalalaalathrvalvalglyalaleuser
859095
argglyglnleualaglupheleuaspalaasnleualahismetala
100105110
sermetthrglyglyglnglnmetglyargglyserglupheglygly
115120125
glyglyserglyglysergluglulysthrphethrseraspvalser
130135140
sertyrleugluglyglnalaalalysglupheilealatrpleuval
145150155160
argglyarggly
<210>9
<211>109
<212>prt
<213>人工序列(artificialsequence)
<400>9
metseraspargileilehisleuthraspaspserpheaspthrasp
151015
valleuasnalaaspglyalaileleuvalaspphetrpalaglutrp
202530
cysglyprocysargmetilealaproileleuaspgluilealaasp
354045
glutyrglnglyargleuthrvalalaargleuasnileaspglnasn
505560
proglythralaproargtyrglyileargglyileprothrleuleu
65707580
leupheargasnglygluvalalaalathrvalvalglyalaleuser
859095
argglyglnleualaglupheleuaspalaasnleuala
100105
<210>10
<211>28
<212>prt
<213>人工序列(artificialsequence)
<400>10
hismetalasermetthrglyglyglnglnmetglyargglyserglu
151015
pheglyglyglyglyserglyglysergluglulys
2025
<210>11
<211>30
<212>prt
<213>人工序列(artificialsequence)
<400>11
hismetalasermetthrglyglyglnglnmetglyargglyserglu
151015
pheglyglyglyglyserglyglyseraspaspaspasplys
202530
<210>12
<211>31
<212>prt
<213>人(homosapiens)
<400>12
hisalagluglythrphethrseraspvalsersertyrleuglugly
151015
glnalaalalysglupheilealatrpleuvalargglyarggly
202530
<210>13
<211>29
<212>prt
<213>人(homosapiens)
<400>13
gluglythrphethrseraspvalsersertyrleugluglyglnala
151015
alalysglupheilealatrpleuvalargglyarggly
2025
<210>14
<211>27
<212>prt
<213>人(homosapiens)
<400>14
thrphethrseraspvalsersertyrleugluglyglnalaalalys
151015
glupheilealatrpleuvalargglyarggly
2025
<210>15
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>15
ctgaaaggaggaactatatcctaatacgactcactataggg41
<210>16
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>16
cgcgtcccattcgccaatcccaaaaaacccctcaagaccc40
<210>17
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>17
ggatatagttcctcctttcag21
<210>18
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>18
ggattggcgaatgggacgcg20
<210>19
<211>168
<212>prt
<213>人(homosapiens)
<400>19
metserasplysileilehisleuthraspaspserpheaspthrasp
151015
valleulysalaaspglyalaileleuvalaspphetrpalaglutrp
202530
cysglyprocyslysmetilealaproileleuaspgluilealaasp
354045
glutyrglnglylysleuthrvalalalysleuasnileaspglnasn
505560
proglythralaprolystyrglyileargglyileprothrleuleu
65707580
leuphelysasnglygluvalalaalathrlysvalglyalaleuser
859095
lysglyglnleulysglupheleuaspalaasnleualahismetala
100105110
sermetthrglyglyglnglnmetglyargglyserglupheglygly
115120125
glyglyserglyglysergluglulyshisalagluglythrphethr
130135140
seraspvalsersertyrleugluglyglnalaalalysglupheile
145150155160
alatrpleuvalargglyarggly
165
<210>20
<211>166
<212>prt
<213>人(homosapiens)
<400>20
metserasplysileilehisleuthraspaspserpheaspthrasp
151015
valleulysalaaspglyalaileleuvalaspphetrpalaglutrp
202530
cysglyprocyslysmetilealaproileleuaspgluilealaasp
354045
glutyrglnglylysleuthrvalalalysleuasnileaspglnasn
505560
proglythralaprolystyrglyileargglyileprothrleuleu
65707580
leuphelysasnglygluvalalaalathrlysvalglyalaleuser
859095
lysglyglnleulysglupheleuaspalaasnleualahismetala
100105110
sermetthrglyglyglnglnmetglyargglyserglupheglygly
115120125
glyglyserglyglysergluglulysgluglythrphethrserasp
130135140
valsersertyrleugluglyglnalaalalysglupheilealatrp
145150155160
leuvalargglyarggly
165
<210>21
<211>166
<212>prt
<213>人(homosapiens)
<400>21
metseraspargileilehisleuthraspaspserpheaspthrasp
151015
valleuargalaaspglyalaileleuvalaspphetrpalaglutrp
202530
cysglyprocysargmetilealaproileleuaspgluilealaasp
354045
glutyrglnglyargleuthrvalalaargleuasnileaspglnasn
505560
proglythralaproargtyrglyileargglyileprothrleuleu
65707580
leupheargasnglygluvalalaalathrargvalglyalaleuser
859095
argglyglnleuargglupheleuaspalaasnleualahismetala
100105110
sermetthrglyglyglnglnmetglyargglyserglupheglygly
115120125
glyglyserglyglysergluglulysgluglythrphethrserasp
130135140
valsersertyrleugluglyglnalaalalysglupheilealatrp
145150155160
leuvalargglyarggly
165
<210>22
<211>166
<212>prt
<213>人(homosapiens)
<400>22
metseraspargileilehisleuthraspaspserpheaspthrasp
151015
valleuasnalaaspglyalaileleuvalaspphetrpalaglutrp
202530
cysglyprocysargmetilealaproileleuaspgluilealaasp
354045
glutyrglnglyargleuthrvalalaargleuasnileaspglnasn
505560
proglythralaproargtyrglyileargglyileprothrleuleu
65707580
leupheargasnglygluvalalaalathraspvalglyalaleuser
859095
argglyglnleuargglupheleuaspalaasnleualahismetala
100105110
sermetthrglyglyglnglnmetglyargglyserglupheglygly
115120125
glyglyserglyglysergluglulysgluglythrphethrserasp
130135140
valsersertyrleugluglyglnalaalalysglupheilealatrp
145150155160
leuvalargglyarggly
165
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:赖红星;祝捷;马文柱;姚元锋;夏玉平;李正;蒋婷
- 技术所有人:珠海冀百康生物科技有限公司
- 我是此专利的发明人
- 上一篇:一种低温冷却循环泵的制作方法
- 上一篇:一种内分泌科如厕辅助装置的制作方法
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
- 还没有人留言评论。精彩留言会获得点赞!