外泌体液体活检样本的制备装置和制备方法以及由此制备的外泌体液体活检样本的分析方法与流程
1.本发明涉及一种技术,其中通过将群体样本分离成包含与特定疾病例如癌症疾病相关的外泌体的亚群、亚亚群或其子集来制备液体活检样本并且进行分析。
背景技术:
2.最近,为了最大程度地减少癌症、退行性疾病等特定疾病筛查过程中的痛苦,实现疾病的早期诊断,引入“液体活检”的概念。液体活检是指以相对简单的方式提取包括血液、唾液和尿液在内的体液并分析从体液中释放的特定疾病相关细胞或成分(例如肽、蛋白质、核酸、细胞器和特定物质)的一种无创方法。液体活检有助于在早期确定特定疾病的发生。因此,液体活检作为现有检测方法例如诊断成像、组织检查和血液检验的替代方法而备受关注。
3.通常,用于诊断特定疾病例如癌症疾病的液体活检优于组织活检。首先,使用体液的液体活检相对容易进行,并降低并发症的风险。相比之下,组织活检通常涉及昂贵的侵入性手术组织取样,这会带来潜在风险。其次,液体活检能够实时连续监测癌症疾病的进展。相比之下,组织活检仅在必要时提供单个疾病病变的快照,无法随时监测疾病的进展和治疗。第三,液体活检收集从肿瘤细胞产生的生物材料,允许在分子水平上更全面地分析相应肿瘤的组成。相比之下,组织活检收集的肿瘤种类繁多,因此很难完全了解目标肿瘤的组成。第四,液体活检能够根据需要从各种体液中进行多次采样。相比之下,组织活检样本的大小有限,因此无法将它们分开并用于多种诊断目的。第五,液体活检由于其相对较高的敏感度(阳性样本的测量精度)和特异性(阴性样本的测量精度)可以为临床决策提供可靠结果。相比之下,组织活检的有限准确性限制测试结果的临床实用性。
4.循环肿瘤细胞(ctc)、无细胞dna和外泌体因其作为癌症疾病诊断领域液体活检生物标志物的潜力而得到认可。尽管循环肿瘤细胞在分离核酸的富集性、选择性和稳定性方面是极好的靶点,但其极低的血液水平使其难以用于癌症疾病的早期诊断。尽管无细胞dna在血液中含量高,但其仍难以富集和选择且分离后稳定性低。此外,由于存在大量与目标疾病无关的非特异性dna,克服分析过程中的噪音问题成为主要问题。与这两种生物标志物相比,外泌体大量存在于血液中,易于富集和选择。此外,从外泌体中分离出的核酸状态是稳定的。然而,由于外泌体颗粒的大小和密度以及存在于外泌体颗粒中的蛋白质和核酸成分的组成极其异质,因此只有与疾病相关的外泌体需要被分离以用于液体活检。
5.外泌体作为液体活检的生物标志物已受到关注。外泌体以微泡(mve)的形式从人体细胞中释放出来,反映原始细胞的特性。外泌体大小为30nm至150nm,可以从血液、唾液和尿液等各种体液中提取。由于外泌体是由脂质双层组成的囊泡,因此在体内不仅稳定,而且不受蛋白酶、核糖核酸酶和脱氧核糖核酸酶的攻击。在这些情况下,越来越多的研究使用外泌体作为诊断特定疾病例如癌症和退行性疾病的新生物标志物。实践中,使用外泌体中存在的成分(例如,蛋白质和rna)作为标志物的产品已开发或目前正在开发用于癌症的早期
诊断和伴随诊断。
6.以下外泌体蛋白和rna生物标志物可用于在液体活检期间诊断特定疾病,特别是癌症疾病。首先,考虑到外泌体的生物合成和加工,较小的mve例如外泌体出芽到细胞中,形成含有胞质内蛋白质、mrna和microrna(mirna)的小细胞内囊泡。其次,当mve与细胞膜融合时,这种细胞内囊泡作为外泌体释放到外部。第三,释放的外泌体开始向其表面特定配体结合所决定的目的地移动。第四,到达靶细胞的外泌体通过内吞途径进入靶细胞或与靶细胞膜融合,将其成分直接释放到细胞质中。
7.第一阶段参与外泌体生物合成的蛋白质成分包括肝细胞生长因子调节的酪氨酸激酶底物(hrs)、信号转导适配器分子(stam1)、肿瘤易感基因(tsg101)和cd81。参与第二阶段外泌体释放的已知蛋白质的实例包括rab2b、rab5a、rab7和rab9a。这些蛋白质分子不仅是治疗药物开发的潜在靶标,而且可以用作外泌体检测和分离技术开发的主要靶标。
8.释放到体液中的外泌体含有多种细胞组成成分,例如双链dna、rna、蛋白质和脂质。根据最近研究,加载在外泌体中的dna分子代表整个基因组,可以反映释放外泌体的肿瘤细胞的突变状态。因此,外泌体中双链dna分子的分析对于癌症疾病或转移的早期检测会特别有用。外泌体中蛋白质的组成因释放外泌体的细胞或组织而异,但大多数外泌体包含进化上保守的蛋白质分子的一般组装。外泌体的蛋白质含量对于开发用于分离、检测和分析外泌体的技术和方法是重要的。此外,外泌体的蛋白质分子可作为其他病理状况的信息收集和诊断的生物标志物。由于报道细胞和外泌体来源的mrna和mirna的不同含量以及mirna在外泌体中的功能,多项关于mirna的研究结果已同时发表,并引发关于外泌体的爆炸性研究。实践中,mirna作为治疗剂和诊断剂开发中的特殊靶点已引起关注。许多基于新检测技术的研究报道,mirna几乎存在于所有体液中。因此,mirna已成为诊断分析的潜在生物标志物。实践中,对各种体液样本的分析表明,根据样本的来源,发现大量不同的mirna。
9.特别地,已知外泌体在肿瘤发生、癌症转移和耐药性等关键癌症相关问题中发挥作用。在肿瘤发生的微环境中,肿瘤细胞释放外泌体和其他mve,当血管生成受到刺激时,这些外泌体和其他mve有助于肿瘤细胞在肿瘤进展和转移过程中的迁移,就像其他细胞一样。肿瘤衍生的囊泡还含有参与免疫抑制的分子。这些分子可以灭活t淋巴细胞或自然杀伤细胞或促进调节性t淋巴细胞或骨髓细胞的分化以抑制免疫反应。也报道肿瘤细胞释放的外泌体导致肿瘤活性转移。
10.然而,由于来自所有细胞的外泌体以混合状态存在于体液中,因此从体液分离的大量外泌体样本中准确诊断癌症等特定疾病存在局限性。此外,体液中源自特定疾病相关细胞的外泌体在疾病发作的早期富集相对非常低,从体液中分离和富集目标外泌体是早期诊断的先决条件。许多外泌体分离技术是已知的。其中,基于密度差异的超速离心因其高重现性和相对稳定过程而被用作外泌体分离的金标准。然而,超速离心法的缺点在于需要使用昂贵系统并且分离需要很长时间。为了克服这些缺点,已开发通过沉淀分离外泌体的方法和通过尺寸排阻色谱法或使用微流体基于尺寸分离外泌体的方法。
11.然而,现有的外泌体分离技术在选择性检测源自特定细胞例如癌细胞的痕量外泌体方面受到限制,因为体液中存在的所有外泌体均以单一群体的形式提供。实践中,存在于细胞膜中或细胞释放的外泌体内部的各种生化成分(包括膜蛋白、内化蛋白和rna)在其组成上是非常异质的。特别地,据报道,源自癌细胞的特定外泌体含有mrna或mirna,这些mrna
或mirna在血管生成和癌症转移的初始阶段参与局部环境的创造。还已知特定的外泌体含有参与诱导免疫细胞的细胞毒性或在癌症转移过程中将正常细胞转化为癌细胞的生化成分。
12.在包含体液中存在的所有外泌体的大群体用作诊断特定疾病例如癌症的液体活检样本的情况下,由于样本基质效应(例如非特异性外泌体的非特异性结合)导致分析特异性和敏感度的负面结果,因此很难实现高的诊断准确度。在尝试解决这类分析问题时,可以同时测量已知在患有特定疾病的患者的体液中增加的多种生物标志物(例如,多种不同的mirna物种)以确定疾病是否发生,尽管其特异性低。然而,使用多种生物标志物的协同效应有限,因为大多数外泌体标志物与疾病非特异性相关,并且它们对疾病的特异性极低。
13.因此,迫切需要解决与癌症等特定疾病的发生相关的外泌体无法被选择性分离并用于诊断特定疾病的问题。
技术实现要素:
14.本发明所要解决的技术问题
15.为了解决现有技术存在的问题而作出本发明,本发明的一方面是提供在温和条件下进行顺序免疫亲和分离的技术,其中在诊断特定疾病如癌症、退行性疾病、心脏病或传染病时,包含与体液中的特定疾病相关的外泌体的亚群、亚亚群或其子集进行分离并以高产率完整回收,用作液体活检样本。
16.本发明的另一方面是提供用于分析含有亚群、亚亚群或其子集的液体活检样本的技术,所述液体活检样本含有目标外泌体,以发现存在于目标外泌体中的生物标志物,例如特定疾病相关的蛋白和核酸。
17.用于解决技术问题的手段
18.本发明的一个实施方案提供用于制备外泌体液体活检样本的装置,其包括固态固定元件,与第一目标外泌体的第一分离标志物特异性结合以捕获第一目标外泌体的第一捕获材料,以及第一可逆接头,其中所述第一目标外泌体与包含从细胞释放的外泌体的群体样本中的预定疾病相关,第一捕获材料通过第一可逆接头可分离地结合固定元件。
19.本发明的一个实施方案提供制备外泌体液体活检样本的方法,其包括(a)允许与与预定疾病相关的第一目标外泌体的第一分离标志物特异性结合的第一捕获材料通过第一可逆接头结合固态固定元件,(b)允许包含从细胞释放的外泌体的群体样本与结合到固定元件的第一捕获材料反应,使得第一捕获材料捕获第一目标外泌体以分离包含第一目标外泌体的亚群,和(c)解离第一可逆接头,使得捕获的第一目标外泌体与固定元件分离以回收外泌体亚群。
20.本发明的一个实施方案提供分析外泌体液体活检样本的方法,其包括(a)由含有正常组和患者组细胞释放的外泌体的外泌体群体样本制备含有与预定疾病相关的目标外泌体的外泌体液体活检样本,(b)测量来自存在于外泌体液体活检样本中的目标外泌体的多种生物标志物的定量信号,以及(c)基于测量的定量信号值,根据多种生物标志物之间的相关性分析来自正常组和患者组的外泌体液体活检样本。
21.发明效果
22.根据本发明,可以将具有外泌体特异性标志物(初级分离标志物)的外泌体亚群与
含有与目标疾病相关性相对较低的外泌体的群体分离,并且可以富集和回收与目标疾病高度相关的特定外泌体用于后续分离。在初级分离溶液中具有外泌体特异性标志物(二级分离标志物)的外泌体亚亚群可以从群体中分离出来,并且可以富集含有参与目标疾病进展的生物标志物的外泌体以提供液体活检样本。
23.此外,可以从含有从体内细胞释放的外泌体的群体样本中分离和回收含有与特定疾病相关的外泌体的亚群、亚亚群或其子集,以制备液体活检样本。液体活检样本可以通过生物标志物分析来分析,以发现特定于目标疾病的生物标志物(例如,蛋白质和核酸)。
24.此外,由于从外泌体亚群、亚亚群或其子集中分离和浓缩的液体活检样本用作分析物,因此去除非特异性外泌体,使得在分析过程中能够将噪声最小化,并使特异性外泌体信号最大化。使用这种外泌体作为特定疾病例如癌症的生物标志物,最大限度地减少由外泌体异质性导致的非特异性外泌体的干扰,这是当前的一个问题,能够准确识别来自液体活检样本的母体细胞的生理特性和谱系的信息。
25.此外,本发明可用于以非常高的准确度诊断特定疾病,例如癌症疾病、退行性疾病、心脏病或传染病,因此在疾病的早期临床诊断中是有效的。本发明能够根据疾病的治疗剂获取关于目标疾病的进展或衰退的信息。因此,本发明还可应用于个性化治疗的伴随诊断。
附图说明
26.图1是比较分析液体活检样本中生物标志物的常规方法(左)与分析本发明制备的液体活检样本中生物标志物的方法(右)的示意图。
27.图2示意性地说明根据本发明的一个实施方案的用于制备外泌体液体活检样本的装置的构造。
28.图3至图6示意性地说明图2所示的第一可逆接头和第二可逆接头的各种实施方案的结构。
29.图7至图13是说明根据本发明的示例性实施方案制备外泌体液体活检样本的方法的流程图。
30.图14是说明根据本发明的一个实施方案的用于分析外泌体液体活检样本的方法的流程图。
31.图15显示基于开关样结合的样本中cd63阳性(cd63+)外泌体的免疫亲和色谱结果。
32.图16显示重复图15的免疫亲和色谱时外泌体分离的重现性。
33.图17显示通过基于开关样结合的免疫磁分离对样本中cd63+外泌体的分离和富集。
34.图18显示重复图17的免疫磁分离时外泌体分离的重现性。
35.图19显示基于开关样结合分离的cd63+外泌体的物理表征结果。
36.图20显示基于开关样结合分离的cd63+外泌体样本的外泌体表面标志物的免疫化学表征结果。
37.图21显示基于cd9浓度的窖蛋白1(cav1)标志物的校正浓度,以补偿外泌体标准样本之间的浓度变化。
38.图22显示使用基于开关样结合分离的cd63+外泌体作为分析物对黑色素瘤癌症诊断的潜在影响。
39.图23显示基于开关样结合的亲和分离系统与目前可商购获得的外泌体分离系统根据分离样本的免疫测定确定的cav1/cd9浓度比来区分黑色素瘤癌症样本与正常样本的能力的比较结果。
40.图24至图27显示使用无标记传感器同时测量外泌体标准样本免疫亲和分离前后样本中的cd9和cav1标志物时所获得的实验结果,以验证外泌体亚群分离的效果。具体来说,图24显示分离前后正常外泌体样本中cd9的浓度,图25显示分离前后正常外泌体样本中cav1的浓度,图26显示分离前后癌细胞外泌体样本中cd9的浓度,图27显示分离前后癌细胞外泌体样本中cav1的浓度。
41.图28在对来自正常组和恶性黑色素瘤患者组的外泌体大群体样本中外泌体亚群的外泌体表面标志物进行分析后,基于肿瘤抑制标志物比较肿瘤进展、促进和转移标志物之间的相关性。
42.图29在对分离自作为样本的正常组和恶性黑色素瘤患者组的外泌体大群体的外泌体亚群的外泌体表面标志物进行分析后,基于肿瘤抑制标志物比较肿瘤进展、促进和转移标志物之间的相关性。
43.图30在对来自正常组和恶性黑色素瘤患者组的外泌体大群体样本中外泌体亚群的外泌体表面标志物进行分析后,比较肿瘤进展、促进和转移标志物之间的相关性。
44.图31在对分离自正常组和恶性黑色素瘤患者组的外泌体大群体的外泌体亚群样本中的外泌体亚亚群进行外泌体表面标志物分析后,比较肿瘤进展、促进和转移标志物之间的相关性。
45.图32显示当新定义的参数应用于生物标志物分析时,来自正常组和恶性黑色素瘤患者组的外泌体大群体样本中外泌体亚群的生物标志物分析结果。
46.图33显示当新定义的参数应用于生物标志物分析时,分离自正常组和恶性黑色素瘤患者组的外泌体大群体的外泌体亚群样本的生物标志物分析结果。
47.图34显示当新定义的参数应用于生物标志物分析时,对来自正常组和恶性黑色素瘤患者组的外泌体大群体样本(a)中的外泌体亚群以及分离自外泌体大群体的外泌体亚群样本(b)中的外泌体亚亚群的生物标志物分析结果的二维参数分析的总体结果。
48.图35显示当新定义的参数应用于生物标志物分析时,分离自正常组和恶性黑色素瘤患者组的外泌体亚群样本的亚亚群的生物标志物分析结果的二维参数分析的总体结果。
49.图36显示当新定义的参数应用于生物标志物分析时,来自正常组和前列腺癌患者组的外泌体亚群样本中外泌体亚亚群的生物标志物分析结果的二维参数分析的总体结果。
50.图37显示来自前列腺癌衍生细胞系培养物的外泌体群体、cd63+亚群和cd63+/cd81+亚亚群样本中存在的前列腺癌mirna生物标志物的分析结果。
具体实施方式
51.通过以下详细描述和优选实施方案,本发明的目的、具体优点和新颖特征将变得更明显,其实例在附图中示出。相同的附图标记和符号表示相同或相似的部件,即使它们在彼此不同的附图中示出。尽管本文使用术语“第一”、“第二”等来描述各种部件,但这些部件
不应受这些术语的限制。这些术语仅用于将一个组件与另一组件区分开。为了避免混淆本发明的主题,避免对众所周知的技术进行详细描述。
52.现将参考附图详细描述本发明的优选实施方案。
53.图1是比较分析液体活检样本中生物标志物的常规方法(左)与分析本发明制备的液体活检样本中生物标志物的方法(右)的示意图。
54.本发明涉及一种技术,其中通过将体液中的外泌体分离成亚群及其子集来制备液体活检样本,对外泌体亚群及其子集进行生物标志物分析以发现特定疾病相关的生物标志物,并且将特定疾病相关的生物标志物应用于临床早期诊断。
55.已知液体活检为通过提取血液、唾液或尿液等体液并分析从特定疾病相关细胞释放的外泌体来早期确定特定疾病发生的诊断方法。最近研究了使用从体液中提取的外泌体作为诸如癌症疾病、退行性疾病、传染病和心脏病等特定疾病的新诊断生物标志物的技术。然而,由于来自所有细胞的外泌体以混合状态存在于体液中,从分离自体液的外泌体大群体样本中准确诊断诸如癌症等特定疾病存在局限性,如图1左侧所示。很难从作为样本的体液中找到存在于目标外泌体中的特定生物标志物分子。外泌体纳米囊泡作为生物标志物的可用性依赖于外泌体分离过程中高度选择的标志物的富集。否则,目标外泌体仅占体液总蛋白质组/转录组的很小一部分。因此,由于有必要对存在于外泌体中的物质(例如生物标志物)进行分类,因此在外泌体来源例如体液中富集诊断标志物有助于发现通常不会被检测到的相对低表达的生物标志物。因此,需要开发用于分离和富集目标外泌体的技术。外泌体分离的常规技术基于超速离心、沉淀分离、尺寸排阻色谱或微流控。然而,这些技术在选择性检测源自特定细胞例如癌细胞的痕量目标外泌体方面受到限制,因为体液中存在的所有外泌体都是以单一群体的形式提供的。
56.因此,本发明提供了存在于外泌体表面与癌症高度相关的蛋白质标志物,例如,用于黑色素瘤的窖蛋白1(cav1)、用于胃癌的her-2/neu和用于卵巢癌的l1cam,如图1的右侧所示,本发明采用特异性标志物的免疫亲和分离来分离特定疾病相关的外泌体亚群及其进一步延伸出的群体(即,亚亚群)。也就是说,具有外泌体标志物(例如,用于黑色素瘤癌症的cd63)的外泌体亚群从含有与目标疾病相关性相对较低的外泌体的群体中进行初级分离,检测或分离初级分离溶液中具有外泌体特异性标志物(例如,用于黑色素瘤癌的cav1)的外泌体亚亚群以制备液体活检样本,其中富集含有涉及目标疾病进展的生物标志物(例如,特定mirna)的外泌体。
57.外泌体分析可以提供个体患者的个性化信息,对于准确预后或鉴别诊断至关重要。外泌体衍生的生物标志物的变化可代表对异常单一条件的反应。体液中的外泌体例如血浆外泌体,从各种细胞来源例如血细胞和周围组织中释放出来。
58.各种蛋白质异质分布在体液中的外泌体表面,用于液体活检。特别地,与癌症疾病相关的特定表面蛋白的表达水平不同,即使在来自健康对象的外泌体中也复杂地存在。据报道,表面蛋白的类型和表达水平例如细胞类型特异性分子如四次穿膜蛋白(例如cd9、cd63、cd81、cd82和cd151)和组织相容性复合物(mhc)i类和ii类、黏附分子hsp60和hsp70根据亲代细胞的特征而增加或减少。例如,cd63,四次穿膜蛋白家族的一种外泌体表面蛋白,是存在于源自b细胞的外泌体溶酶体膜中的蛋白质,据报道在患有多种癌症疾病(包括黑色素瘤癌症)患者的样本中增加。一些研究报道,cd63可用作疾病诊断的最佳外泌体标志物,
因为与相同家族的cd81和cd9相比,其表达水平因亲本细胞的类型而异。对于外泌体表面蛋白的准确定量分析,可以量化独立于亲本细胞特征的不变管家标志物以进行归一化。对于这种归一化,预计cd9比四次穿膜蛋白家族中的cd63更合适。
59.在这种情况下,基于外泌体表面蛋白的外泌体亚群的免疫亲和分离可以提供以下优势。首先,与基于密度、大小、沉淀等的分离方法不同,基于抗原-抗体结合的免疫亲和分离最大限度地减少分离后溶液中除目标外泌体以外的杂质的存在。如上所述,样本基质效应例如非特异性相互作用随着诊断样本中杂质含量的减少而降低,从而提高诊断的敏感度和特异性。其次,对含有与目标疾病相关性相对较低的外泌体的群体进行免疫亲和分离,可以增加后续亚群中特定疾病相关外泌体的浓度。当外泌体群体中疾病相关外泌体的初始浓度低到难以在体液中检测到时,这种方法是有用的。在这种情况下,使用亚群作为诊断特定疾病的样本可导致提高敏感度。
60.通过与特定疾病例如癌症相关的特定外泌体表面蛋白,外泌体亚群可以进一步分离为包含高浓度特定疾病标志物例如mrna和mirna的外泌体亚亚群。外泌体亚亚群可以作为诊断样本提供。特别地,已知从癌细胞释放的外泌体含有各种类型的rna,这些rna在癌症的转移前阶段创造局部环境,例如血管生成,并在转移阶段起主导作用。据报道,这种生物标志物装载在特定外泌体中。
61.实践中,越来越多的外泌体衍生蛋白被鉴定为各种疾病的潜在生物标志物,所述疾病例如肝炎、肝脏疾病、肾脏疾病、退行性疾病以及癌症疾病。据报道,外泌体蛋白与特定疾病有关,从而提供在未来产品开发中将其用作诊断或分离目标的可能性。例如,血浆中的cd81是与慢性丙型肝炎相关的外泌体蛋白标志物,血浆中的cd63、窖蛋白-1、tyrp2、vla-4、hsp70和hsp90是与黑色素瘤癌相关的标志物,血浆中的存活蛋白是与前列腺癌相关的标志物,血浆中的l1cam、cd24、adam10、emmprin,密封蛋白是与卵巢癌相关的标志物。尿液中的胎球蛋白a和atf 3是与急性肾损伤相关的外泌体蛋白标志物,尿液中的cd26、cd81、s1c3a1和cd10是与肝损伤相关的标志物,尿液中的egf、抵抗素和视黄酸诱导蛋白3是与膀胱癌相关的标志物,而尿液中的psa和pca3是与前列腺癌相关的标志物。脑组织中的淀粉样肽是与阿尔茨海默病相关的外泌体肽标志物,脑脊液中的tau磷酸化thr181是与阿尔茨海默病相关的标志物。
62.四次穿膜蛋白是广泛存在于外泌体中的骨骼膜蛋白家族。例如,与健康对照组相比,黑色素瘤癌症患者组的血浆cd63阳性(cd63+)外泌体显著增加。cd81是四次穿膜蛋白家族的另一个外泌体标志物,在丙型肝炎病毒结合和/或内吞作用中起关键作用。此外,慢性丙型肝炎患者血清外泌体中cd81的浓度升高,并且还与炎症和纤维化的加剧有关,表明外泌体中的cd81将成为丙型肝炎诊断和治疗反应的潜在标志物。此外,据报道外泌体中的许多蛋白质生物标志物潜在用于诊断中枢神经系统疾病。在胶质母细胞瘤患者的血清外泌体中发现的胶质母细胞瘤特异性表皮生长因子受体viii(egfrviii)可用于胶质母细胞瘤的诊断检测。也有报道称外泌体淀粉样肽在阿尔茨海默病患者的脑斑块中积聚。在thr-181磷酸化的tau蛋白是公认的阿尔茨海默病生物标志物,并且在从轻度阿尔茨海默病患者的脑脊液样本中分离的外泌体中浓度增加。基于这些发现,外泌体在阿尔茨海默病早期诊断中的潜在价值已经显现。目前没有用于识别早期阿尔茨海默病的诊断测试方法。
63.特别地,正在探索尿路疾病以确定通过非侵入性方法获得的尿外泌体中蛋白质的
潜在诊断用途。例如,与健康对象相比,重症监护病房中急性肾损伤患者的尿外泌体胎球蛋白a增加。atf3仅存在于从急性肾损伤患者中分离的外泌体中,在慢性肾病患者和健康个体中不存在。此外,正在研究尿液外泌体蛋白作为膀胱癌和前列腺癌的潜在生物标志物的用途。这些研究表明,从前列腺癌患者的尿液中分离出的外泌体中存在两种类型的前列腺癌生物标志物pca-3和psa。总体而言,在其他体液中鉴定的外泌体蛋白期望在未来诊断分析系统的开发中用作目标平台。
64.也报道与癌症高度相关的蛋白质标志物,例如对于黑色素瘤的窖蛋白1(cav1)、对于胃癌的her-2/neu和对于卵巢癌的l1cam存在于外泌体的表面上。然而,由于这些特定外泌体的含量、特别是在早期诊断样本中的含量非常低,因此,引入上述顺序重复分离过程对于外泌体的选择性分离是不可避免的。
65.图2示意性地说明根据本发明的一个实施方案的用于制备外泌体液体活检样本的装置的构造。
66.如图2所示,装置包括固态固定元件10、第一捕获材料20和第一可逆接头30,所述第一捕获材料与从细胞释放的外泌体1中与预定疾病相关的外泌体1a的第一分离标志物m1特异性结合以捕获疾病相关外泌体1a,第一捕获材料20通过所述第一可逆接头可分离地结合固定元件10。
67.装置还可以包括第二捕获材料40,其与第一捕获材料20未结合的固定元件10结合并且与作为疾病相关外泌体1a的群体的外泌体亚群s中的目标外泌体1b的第二分离标志物m2特异性结合,以捕获目标外泌体1b。
68.装置还可以包括第二可逆接头50,第二捕获材料40通过第二可逆接头结合固定元件10。
69.固定元件10是固态元件。第一可逆接头30、第二捕获材料40和第二可逆接头50可以选择性地结合并固定在固定元件10的表面上。第一可逆接头30结合并固定在一个固定元件10上后从固定元件10解除结合,第二捕获材料40或第二可逆接头50可以结合并固定在固定元件10上。或者,第一可逆接头30和第二捕获材料40或第二可逆接头50可以固定到不同的固定元件上。固定元件10可选自但不一定限于水凝胶、磁珠、乳胶珠、玻璃珠、纳米金属结构、多孔膜、无孔膜及其组合。然而,可以使用能够与第一可逆接头30、第二捕获材料40或第二可逆接头50结合的任何材料,而对固定元件10没有特别限制。
70.第一捕获材料20和第二捕获材料40是能够选择性捕获预定外泌体1的材料。第一捕获材料20和第二捕获材料40与外泌体1的分离标志物m特异性结合以捕获外泌体1。此处,分离标志物m是一种生物标志物,与健康对象的体液相比,在患有特定疾病的患者的体液中存在的量相对增加。分离标志物可以包括存在于外泌体1表面的蛋白质、核酸、脂质、糖、肽和其他生化成分。分离标志物m可以通过免疫化学相互作用例如抗原抗体反应与第一捕获材料20和第二捕获材料40特异性结合。例如,第一捕获材料20和第二捕获材料40可以是与外泌体1的表面蛋白反应的预定抗体。
71.与第一捕获材料20特异性结合的第一分离标志物m1存在于与预定疾病相关的外泌体1a的表面上。因此,具有被第一捕获材料20捕获的第一分离标志物m1的疾病相关外泌体1a可以从从细胞释放的外泌体1的大群体b中分离。此处,分离的疾病相关外泌体1a的群体成为亚群s。外泌体亚群s中疾病相关外泌体1a中目标外泌体1b的第二分离标志物m2与第
二捕获材料40特异性反应并被第二捕获材料40捕获,结果是外泌体亚亚群sa从外泌体亚群s中分离。当用于诊断特定疾病时,外泌体1上的第一分离标志物m1与第二分离标志物m2相比表现出相对较低的准确度。然而,第一分离标志物m1在体液中的浓度相对较高,可能具有更全面的特征,因为它们在基于外泌体群体中标志物数量的系统分类上位于更高水平。
72.本发明可以使用一种外泌体液体活检样本,其通过从包括在体液中浓度预计较低的疾病特异性标志物的外泌体群体中初级分离表面蛋白标志物(第一分离标志物)阳性外泌体的亚群s并且富集和回收外泌体来制备。或者,本发明可以使用通过从亚群s中二次分离和浓缩疾病特异性标志物(第二分离标志物)以回收外泌体亚亚群s制备的外泌体液体活检样本。本发明中,表面蛋白标志物(第一分离标志物)阳性外泌体的亚群s从包括疾病特异性标志物的外泌体群体中初级分离,其在体液中的浓度预计低,外泌体被富集和回收,疾病特异性标志物(第二分离标志物)从亚群s二次分离和浓缩以回收外泌体亚亚群s。此处,其他外泌体表面蛋白标志物的分离、浓缩和回收过程可以根据目的重复两次或多于两次。通过从外泌体亚亚群sa分离和浓缩回收的子集可用作外泌体液体活检样本。
73.通过简单地将体液浓缩成与疾病相关的外泌体样本,将大群体形式的外泌体样本从体液中选择性分离,可以提高液体活检的诊断准确性。窖蛋白1(cav1)是外泌体表面蛋白,在黑色素瘤患者的血液中显著增加,黑色素瘤是始于黑素细胞的皮肤癌,与健康对象的血液相比,结果是基于cav1-阳性(cav1+)外泌体的诊断敏感度为68%,高于基于作为另一种黑色素瘤癌症标志物的cd63的诊断敏感度(43%)。具有改善性能的液体活检的临床应用需要选择性分离和富集目标外泌体例如cav1+外泌体,但由于来自体液的所有外泌体中目标外泌体的比例非常低,因此难以通过本领域已知的一般方法来实现。
74.因此,本发明旨在提供使用从体液中选择性分离的包含cav1+外泌体的亚群或亚亚群作为测试样本来以高精度和敏感度诊断黑素瘤癌的方法。考虑到外泌体分离的产量和重现性,cav1+外泌体不用作分离目标,而是使用与致癌作用相关的外泌体群体作为主要分离目标。例如,由于cd63蛋白(在一般外泌体中大量发现的管家蛋白)当发生几种癌症(包括黑色素瘤癌)时与其他表面蛋白相比在外泌体表面上增加和表达,因此该表面蛋白可用作分离标志物m1以分离cd63+外泌体亚群s,cav1可用作第二个分离标志物m2以将cd63+/cav1+外泌体亚群sa与cd63+外泌体亚群s分离。
75.第一捕获材料20可以通过第一可逆接头30固定在固定元件10上并与固定元件10分离。第二捕获材料40可以直接结合并固定在固定元件10上,而不与固定元件10分离。或者,第二捕获材料40可以通过在固定元件10之间引入的第二可逆接头50固定在固定元件10上并与固定元件10分离。
76.第一捕获材料20通过第一可逆接头30可分离地结合到固定元件10,第二捕获材料40通过第二可逆接头50可分离地结合到固定元件10。此处,当第一捕获材料20不结合到在固定部件10上时,第二捕获材料40固定在固定部件10上。也就是说,当第一捕获材料20不与固定部件10结合时,第二捕获材料40通过第二可逆接头50固定在固定部件10上。第一可逆接头30和第二可逆接头50可以由相同或不同材料构成并且具有相同或不同结构。下面将详细描述第一可逆接头30和第二可逆接头50的材料和结构。
77.使用基于配体-结合剂结合的可逆接头可以在温和条件下进行外泌体免疫亲和分离。可逆接头最初用于将能够捕获特定外泌体1的捕获材料(抗体)固定到固定元件10上,并
在固定元件10上捕获外泌体1后通过不同反应条件解离,使得可以回收捕获的外泌体1。例如,可基于各种反应使用可逆接头,包括通过亲水和疏水结合的糖-糖受体结合、离子-离子或离子-离子受体结合、底物-酶反应、抗原-抗体反应、核酸杂交、激素-细胞受体反应和配体-纳米结构反应,特别是与多组氨酸标签、生物素-亲和素键和螯合剂的结合反应。通过在结合后改变结合剂的结构或控制接头的结合剂-配体亲和力,例如结合剂的竞争反应,可以解离可逆接头。因此,在免疫捕获样本中的外泌体1后,可逆接头的使用能够在温和条件下分离和回收目标外泌体1b,从而避免对酸性ph等苛刻条件的需要。
78.使用基于结合反应的可逆接头的免疫亲和分离可以是基于物理、生物和化学特性例如密度、大小、溶解度、膜渗透性、分子结构和磁性能够实现分离和回收的任何过程。特别地,使用专门设计的免疫亲和分离过程,例如色谱或磁分离,能够通过控制接头中的结合剂-配体亲和力,分离和回收体液中的微量外泌体。例如,使用识别材料的“开关样结合”识别在配体结合期间引起的接头中结合剂结构的变化,能够仅根据配体的存在与否通过免疫隔离来分离和回收外泌体。在免疫隔离过程中,在配体结合剂反应中使用类配体结构与配体来竞争结合剂的竞争性结合反应的引入,能够根据竞争性结合反应的存在与否来分离和回收外泌体。
79.该免疫隔离过程可以基于可逆化学交联-去交联以及可逆结合例如配体-结合剂结合来进行。特别地,交联通过聚合物之间的化学反应进行,去交联然后在某些条件下或通过光能裂解化学交联键来进行。
80.将详细描述第一可逆接头30和第二可逆接头50。可逆接头可根据以下第一至第四实施方案形成。具体地,第一可逆接头30和30a至30d以及第二可逆接头50和50a至50d可以根据第一至第四实施方案中的一个形成。图3至图6示意性地说明图2所示的第一可逆接头和第二可逆接头的各种实施方案的结构。
81.如图3所示,根据本发明第一实施方案的可逆接头30a和50a各自包括配体31a、结合剂33a和识别材料35a。
82.配体31a是能够与结合剂33a可分离地结合的材料并且可以选自糖分子、离子、底物、抗原、肽、维生素、生长因子、激素及其组合。
83.结合剂33a是当与配体31a结合时其构象发生改变的材料。结合剂33a可以选自糖结合蛋白、离子结合蛋白、酶、抗体、亲和素、适体、细胞受体、纳米结构及其组合。因此,结合剂33a和配体31a可以形成结合剂-配体对,例如糖结合蛋白-糖分子对、离子结合蛋白-离子对、生物素-亲和素对、酶-底物对、抗原-抗体对、适体-配体对、细胞受体-配体对或纳米结构-配体对。结合剂33a和配体31a的最具代表性的实例分别包括钙结合蛋白(cbp)和钙离子。然而,结合剂33a和配体31a不一定限于上述材料并且可以是能够彼此可分离地结合以引起它们的构象改变的任何材料。在可逆接头中,结合剂33a与第一捕获材料20和/或第二捕获材料40缀合以形成结合剂-捕获材料缀合物c。
84.识别材料35a是与结合剂33a特异性结合的材料,结合剂33a通过与配体31a结合而改变构象。识别材料35a可以选自抗体、蛋白质受体、细胞受体、适体、酶、纳米颗粒、纳米结构、重金属螯合剂及其组合。然而,这些材料仅是说明性的并且本发明的范围不一定限于此。例如,作为配体31a的钙离子主要与作为结合剂33a结合钙结合蛋白以引起钙结合蛋白的构象改变,并且构象发生改变的钙结合蛋白与作为识别材料35a的抗体反应并与其结合
(“抗原-抗体反应”)。在可逆接头中,识别材料35a固定在固定元件10的表面上。
85.在外泌体1被通过可逆接头30和/或50结合到固定元件10的第一捕获材料20和/或第二捕获材料40捕获后,可以通过改变反应条件以解离可逆接头来回收捕获的外泌体1a或1b。当其构象已改变的结合剂33a恢复到其原始构象时,可逆接头30a或50a可以解离。例如,抗体(识别材料)与通过与钙离子(配体)结合而改变构象的钙结合蛋白(结合剂)结合并捕获外泌体1后,加入不含钙离子的回收液,以使钙离子与钙结合蛋白分离,结果使钙结合蛋白的构象得以恢复,钙结合蛋白可与抗体分离。
86.参见图4,根据本发明第二实施方案的可逆接头30b和50b各自包括配体31b、结合剂33b和识别材料35b。
87.根据第二实施方案的可逆接头30b或50b的配体31b、结合剂33b和识别材料35b分别对应于根据第一实施方案的可逆接头30a或50a的配体31a、结合剂33a和识别材料35a,下面仅主要说明不同之处。
88.在根据第一实施方案的可逆接头30a或50a中,结合剂33a与捕获材料20或40缀合以形成聚合物c,并且识别材料35a固定在固定元件10的表面上。相比之下,在根据第二实施方案的可逆接头30b或50b中,结合剂33b固定在固定元件10的表面上并且识别材料35b与捕获材料20或40缀合以形成识别材料-捕获材料聚合物c。除此之外,可逆接头30b或50b与根据第一实施方案的可逆接头30a或50a相同。因此,省略可逆接头30b或50b的详细描述。
89.作为能够在温和条件下回收样本中的外泌体亚群或亚亚群的根据第一和第二实施方案的可逆接头30和50各自的实例,抗体可用作识别材料35a或35b,其特异性识别当作为结合剂33a或33b的钙结合蛋白与作为配体31a或31b的钙离子特异性结合和反应时引起的构象改变。结合剂-识别材料反应可以是抗原-抗体反应,其中结合剂根据配体31a或31b例如钙离子的存在或与否快速结合或脱离识别材料。这种结合或脱离描述为“开关样可逆结合”,因为其原理类似于通过开关打开/关闭灯的原理。
90.如图5所示,根据本发明第三实施方案的可逆接头30c和50c各自包括配体31c和结合剂33c。
91.根据第三实施方案的可逆接头30c或50c的配体31c与第一捕获材料20和/或第二捕获材料40缀合以形成捕获材料-配体缀合物c。
92.可逆接头30c或50c的结合剂33c固定在固定元件10的表面上,并与与外泌体1a或1b特异性结合的捕获材料-配体缀合物c结合,结果外泌体1a或1b通过固定元件10捕获。与配体31c结合的结合剂33c与与配体31c竞争的另一个配体32结合。结果,配体31c分离并且外泌体1a或1b可以从固定元件10分离和回收。此处,配体31c可以选自多组氨酸标签(his-tags)、维生素例如如生物素、糖分子、离子、底物、抗原、氨基酸、肽、核酸、生长因子、激素及其组合。结合剂33c可以选自二价金属离子、亲和素、糖结合蛋白、离子结合蛋白、酶、抗体、适体、蛋白质受体、细胞受体、纳米结构及其组合。竞争性配体32可选自咪唑、维生素例如生物素、糖分子、离子、底物、抗原、氨基酸、肽、核酸、生长因子、激素及其组合。
93.例如,his-标签、二价金属离子和咪唑可分别用作配体31c、结合剂33c和竞争配体32。his标签是蛋白质中的氨基酸基序,由至少六个组氨酸(his)残基组成,通常位于蛋白质的n-末端或c-末端。his-tag通常用于重组蛋白表达后的纯化。此处,基于与在琼脂糖凝胶/琼脂糖树脂上的螯合剂结合的二价镍或钴离子的亲和力,捕获用his-tag标记的蛋白质,然
后通过添加含咪唑的回收溶液进行回收。
94.参见图6,根据本发明第四实施方案的可逆接头30d和50d各自包括配体31d和结合剂33d。
95.可逆接头30d或50d的配体31d和结合剂33d分别对应于根据第三实施方案的可逆接头30c或50c的配体31c和结合剂33c,下面将仅主要描述不同之处。
96.在根据第三实施方案的可逆接头30c或50c中,配体31c与捕获材料20或40缀合,并且结合剂33c固定在固定元件10的表面上。相比之下,在可逆接头30d或50d中,配体31d固定在固定元件10的表面上,并且结合剂33d与捕获材料20或40缀合以形成捕获材料-结合剂缀合物c。如在根据第三实施方案的可逆接头30c或50c中,配体31d与结合剂33d结合并且结合剂33d与与配体31d竞争的另一个配体32结合。结果,配体31d与结合剂33d分离。
97.用于制备外泌体液体活检样本的装置还可包括反应器(未示出)。反应器可在其中容纳固定元件10。当外泌体样本1加入反应器中时,疾病相关外泌体1a通过反应器中的第一可逆接头30和第一捕获材料20被固定元件10捕获,并且分离外泌体亚群s。将第一可逆接头30解离以回收外泌体亚群s。回收的外泌体亚群s作为样本添加到反应器中。目标外泌体1b通过第二可逆接头50和第二捕获材料40被固定元件10捕获,并且分离外泌体亚亚群sa。解离第二可逆接头50以回收外泌体亚亚群sa。此处,固定元件10使用磁力、重力和/或离心力来集中以集中外泌体亚群s和/或外泌体亚亚群sa。例如,当磁珠用作固定元件10时,使用磁体来捕获与疾病相关外泌体1a和/或目标外泌体1b结合的固定元件10。然后,弃去上清液,并且可以从磁珠中回收和浓缩外泌体亚群s或外泌体亚亚群sa。
98.下文中,将描述使用装置制备液体活检样本的方法。上面已描述装置,并且省略或简化重复的解释。
99.图7至图13是说明根据本发明的示例性实施方案制备外泌体液体活检样本的方法的流程图。
100.参考图7,根据本发明第一实施方案的制备外泌体液体活检样本的方法包括(s110)允许与从细胞释放的外泌体中的与预定疾病相关的外泌体的第一分离标志物特异性结合的第一捕获材料通过第一可逆接头与固态固定元件结合,(s120)允许含有外泌体群体的样本溶液与结合到固定元件的第一捕获材料反应,使得第一捕获材料捕获疾病相关的外泌体以分离包含疾病相关的外泌体的亚群,和(s130)解离第一可逆接头,使得捕获的疾病相关外泌体与固定元件分离以回收外泌体亚群。
101.在根据本发明第一实施方案的方法中,从细胞或体液中释放的大群体外泌体用作样本溶液,并且主要从样本溶液中分离和回收的外泌体亚群可以作为液体活检样本提供。
102.如图8所示,方法还可以包括(s140)允许与外泌体亚群中目标外泌体的第二分离标志物特异性结合的第二捕获材料与固定元件结合和(s150)允许含有回收的外泌体亚群的外泌体亚群溶液与结合固定元件的第二捕获材料反应,使得第二捕获材料捕获目标外泌体以分离目标外泌体的亚亚群。此处,第二捕获材料可以通过第二可逆接头与固定元件结合。
103.首先,为了分离和回收外泌体亚群,允许第一捕获材料和第一可逆接头与固定元件反应(s110)。此处,第一捕获材料通过第一可逆接头与固定元件结合。
104.接着,使样本溶液与第一捕获材料反应(s120)。此处,第一捕获材料与样本溶液中
存在的疾病相关外泌体的第一分离标志物特异性结合。结果,包含疾病相关外泌体的亚群被固定元件捕获并与样本溶液分离。
105.在外泌体亚群分离后,第一可逆接头解离(s130)。此时,疾病相关的外泌体与固定元件分离,以回收外泌体亚群。
106.在疾病相关外泌体与固定元件分离后,固定元件可以重新用于与第二捕获材料结合或者可以允许第二捕获材料结合新的固定元件(s140)。此时,第二捕获材料可以直接结合到固定元件上。或者,第二捕获材料可以通过第二可逆接头与固定元件结合。
107.接着,使含有回收的外泌体亚群的外泌体亚群溶液与第二捕获材料反应(s150)。此时,由于第二捕获材料与外泌体亚群中目标外泌体的第二分离标志物特异性结合,目标外泌体固定在固定元件上,从而分离目标外泌体的亚亚群。代替回收分离的外泌体,保留未回收并固定在固定元件上的外泌体亚群可以作为液体活检样本提供。也就是说,可以直接分析特定疾病的诊断生物标志物,而无需在亚亚群分离后回收外泌体。或者,在外泌体溶解后,可以分析洗脱的生物标志物。在这种情况下,仅有生物标志物可以直接用作样本,而无需在顺序免疫亲和分离过程的最终分离步骤中从亚亚群中回收外泌体。
108.下文中,将参考第一可逆接头和第二可逆接头的具体实例更详细地描述本发明。
109.图9说明使用根据第一实施方案的第一可逆接头30a和第二可逆接头50a制备作为液体活检样本的外泌体亚群的方法。参考图9,首先,识别材料35a固定在固定元件10的表面上,并且使含有配体31a、结合剂33a和第一捕获材料20的溶液彼此反应。作为该反应的结果,结合剂33a和第一捕获材料20形成结合剂-第一捕获材料缀合物c并且识别材料35a与缀合物c结合。此处,配体溶液中存在的配体31a与结合剂33a结合引起结合剂33a的构象变化,识别材料35a特异性地识别构象发生变化的结合剂33a并与之结合。接着,添加含有大群体外泌体1的样本溶液。具有与第一捕获材料20特异性结合的第一分离标志物m1的疾病相关外泌体1a被固定元件10捕获,使得分离外泌体亚群s。在分离外泌体亚群s后,加入含有配体31a的回收溶液。与结合剂33a结合的配体31a脱离,结果,结合剂33a的改变的构象恢复到它们的原始状态,导致结合剂33a从识别材料35a上解离。因此,与外泌体亚群s的疾病相关外泌体1a结合的缀合物c与识别材料35a分离以回收外泌体亚群s。
110.接着,疾病相关外泌体1a分离并且固定有识别材料35a的固定元件10被重新使用以允许第二可逆接头50a与第二捕获材料40反应。此时,第二可逆接头50a共享使用具有第一可逆接头30a的识别材料35a并将第二捕获材料40而不是第一捕获材料20固定到固定元件10上。然后,加入回收的外泌体亚群s的溶液。结果,第二捕获材料40在外泌体亚群s的溶液中与目标外泌体1b的第二分离标志物m2特异性结合,使得分离外泌体亚亚群sa。由于外泌体亚群s包含第一可逆接头30a的结合剂33a,与固定元件10结合的识别材料35a可与第一可逆接头30a的结合剂33a反应。在第二可逆接头50a与第二捕获材料40之间的反应之后,可以通过用合适的反应组分(例如,结合剂33a)封闭结合到固定元件10的识别材料35a上的剩余结合位点来防止反应。
111.将描述根据本发明第一实施方案的使用第一可逆接头和第二可逆接头分离cd63+/cav1+外泌体亚亚群sa的方法。作为可逆识别材料的抗体固定在固体表面(珠表面)和钙结合蛋白(cbp)上,因为结合剂与特异性抗体缀合,作为cd63外泌体表面蛋白通过生物素-链霉亲和素键(cbp捕获抗体缀合物)结合的第一捕获材料。将cbp捕获抗体缀合物溶解在含
有钙离子(例如,》10mm ca
2+
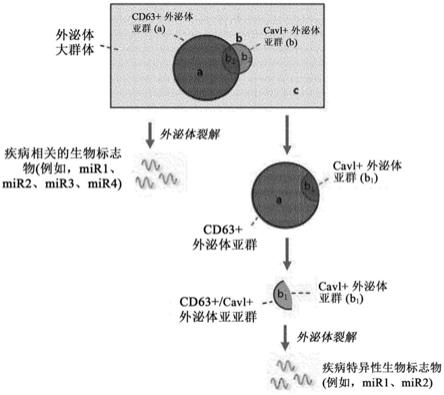
)的溶液中,并添加到固定的可逆识别材料中。缀合物通过“开启”识别反应固定在固体表面上。制备大量外泌体样本并将其添加到相同溶液中。具有cd63标志物的外泌体与固体表面上的捕获抗体反应并被该捕获抗体捕获。用相同的溶液洗涤后,加入不含钙的外泌体回收溶液。钙离子与cbp分离,导致“关闭”状态。因此,与捕获抗体结合的捕获外泌体可以回收到溶液中。因此,cd63+外泌体的亚群进行分离和回收。可以根据样本溶液和所用回收溶液之间的体积比富集外泌体。此外,固体表面可以再生并重新用于其他样本的分离。
112.对于外泌体亚亚群的顺序分离,可逆识别材料固定在再生的固体表面或新的固体表面上,与特定疾病高度相关的cav1外泌体表面蛋白的特异性抗体与cbp缀合,cbp捕获抗体缀合物通过上述“开启”识别反应固定在固体表面上。在保持相同状态的同时,将初次分离后回收的cd63+外泌体亚群作为二次分离样本加入。含有cd63和cav1标志物(cd63+/cav1+)的外泌体与固体表面上的捕获抗体发生反应并被该捕获抗体捕获。用相同溶液洗涤后,加入不含钙的外泌体回收溶液。这导致“关闭”状态,允许捕获的外泌体回收到溶液中。因此,cd63+/cav1+外泌体的亚亚群进行二次分离和回收。
113.当分离的外泌体亚亚群不需要回收时,可以通过将捕获抗体直接固定在固体表面上来分离亚亚群,而无需引入第二可逆接头。在这种情况下,免疫测定主要对捕获的外泌体进行。或者,直接裂解捕获的外泌体以提取核酸,其用于分子检测。
114.图10说明使用根据第三实施方案的第一可逆接头30c和第二可逆接头50c来制备作为液体活检样本的外泌体亚亚群的方法。参考图10,配体31c与第一捕获材料20缀合,与疾病相关外泌体1a的第一分离标志物m1特异性反应,基于与结合剂33c的亲和力固定配体捕获材料缀合物,结合剂33c与固定元件10结合,添加外泌体样本,捕获外泌体亚群s并将其分离,使用含有竞争性配体32的回收溶液回收外泌体亚群s。
115.接着,与目标外泌体1b的第二分离标志物m2特异性反应的第二捕获材料40与配体31c缀合,所得缀合物c固定到与固定元件10结合的结合剂33c上,并且添加外泌体亚群s的溶液用于捕获和分离外泌体亚亚群sa。由于外泌体亚群s包含第一可逆接头30c的配体31c,因此与固定元件10结合的结合剂33c可与第一可逆接头30c的配体31c反应。在第二可逆接头50c与第二捕获材料40之间的反应之后,可以通过用适当的反应组分(例如,配体31c)封闭结合到固定元件10的结合剂33c上的剩余结合位点来防止反应。
116.将描述使用根据本发明第三实施方案的第一可逆接头和第二可逆接头分离cd63+/cav1+外泌体亚亚群sa的方法。作为结合剂的镍离子固定在固体表面(珠表面)上,而作为配体的his标签与cd63外泌体表面蛋白的特异性抗体缀合,作为第一分离标志物m1。将his标签捕获抗体缀合物添加到固定的镍离子中。缀合物通过结合剂-配体反应固定在固体表面上。制备批量外泌体样本并将其添加到相同溶液中。cd63外泌体与固体表面上的捕获抗体反应并被捕获。用相同溶液洗涤后,加入含有高浓度竞争配体(咪唑)的外泌体回收溶液。与镍离子结合的his标签通过竞争反应分离。因此,捕获的外泌体可以回收到溶液中。因此,将cd63+外泌体亚群分离和回收,固体表面可以再生并重新用于下一次样本分离。
117.上述分离过程适用于从回收的cd63+外泌体亚群中分离cd63+/cav1+外泌体亚亚群。在这种情况下,作为配体的his标签与作为第二分离标志物的cav1外泌体表面蛋白特异性抗体缀合。通过结合剂-配体反应将缀合物固定在固体表面上后,将cd63+外泌体亚群作
为样本添加。cd63+/cav1+外泌体与固体表面上的捕获抗体反应并被捕获。洗涤后,加入含有高浓度竞争配体(咪唑)的外泌体回收溶液。与con a结合的cd63+/cav1+外泌体可以回收到溶液中。因此,将cd63+/cav1+外泌体的亚亚群分离并回收。
118.图11说明使用根据第一实施方案的第一可逆接头30a和根据第三实施方案的第二可逆接头50c制备作为液体活检样本的外泌体亚亚群的方法。参考图11,如上所述,可以使用根据第一实施方案的第一可逆接头30a分离和回收外泌体亚群s,并且可以使用根据第三实施方案的第二可逆接头50c分离外泌体亚亚群sa(图10)。外泌体亚群s包含第一可逆接头30a的结合剂33a,但是当外泌体亚亚群sa分离时,与根据第一实施方案的结合剂33a不反应的根据第三实施方案的结合剂33c与固定元件10结合。即,以不同于第一可逆接头30a的机制起作用的第二可逆接头50c的使用避免对上述封闭过程的需要。
119.图12说明使用根据第三实施方案的第一可逆接头30c和根据第一实施方案的第二可逆接头50a制备作为液体活检样本的外泌体亚亚群的方法。参考图12,可以使用根据第三实施方案的第一可逆接头30c分离和回收外泌体亚群s(图10),并且可以使用根据第一实施方案的第二可逆接头50a分离外泌体亚亚群sa(图9)。外泌体亚群s包含第一可逆接头30c的配体31c,但采用区别于第一可逆接头30c的第二可逆接头50a来分离外泌体亚亚群sa,避免上述封闭过程的需要。
120.图13是说明根据本发明的另一个实施方案的用于制备作为液体活检样本的外泌体亚亚群的方法的流程图。
121.参考图13,方法还可包括(s160)回收外泌体亚亚群。此处,第二捕获材料通过第二可逆接头与固定元件结合。第二可逆接头的解离使捕获的目标外泌体与固定元件分离并回收外泌体亚群。可以分析捕获的目标外泌体的生物标志物。或者,在捕获的目标外泌体溶解后,可以分析洗脱的生物标志物。
122.方法还可包括(s125)浓缩外泌体亚群。在加入样本溶液之后和加入回收溶液之前,外泌体亚群可以浓缩。具体而言,与外泌体亚群的疾病相关外泌体结合的固定元件使用磁力、重力和/或离心力进行浓缩。例如,当磁珠用作固定元件10时,使用磁力将固定元件捕获在配体溶液和样本溶液的混合溶液的预定空间中。然后,可以通过去除不存在固定元件的混合溶液的一部分(例如,上清液)来浓缩外泌体亚群。
123.以与外泌体亚群的浓缩相同的方式,可以通过使用磁力、重力和/或离心力浓缩与目标外泌体结合的固定元件来浓缩外泌体亚亚群(s155)。
124.将描述用于分析通过制备方法制备的外泌体液体活检样本的方法。
125.图14是说明根据本发明的一个实施方案的用于分析外泌体液体活检样本的方法的流程图。
126.如图14所示,方法包括(s100)从含有正常组和患者组细胞释放的外泌体的外泌体群体样本中捕获与预定疾病相关的目标外泌体,以制备含有目标外泌体群体的外泌体液体活检样本,(s200)测量来自存在于外泌体液体活检样本中的目标外泌体的多个生物标志物的定量信号,以及(s300)基于测量的定量信号值,根据多个生物标志物之间的相关性分析来自正常组和患者组的外泌体液体活检样本。
127.在s100中,将外泌体液体活检样本与正常组的外泌体大群体样本分离,外泌体液体活检样本与患者组的外泌体大群体样本分离。外泌体液体活检样本用作分析样本。来自
正常组和患者组的外泌体液体活检样本以相同的方式与各自的外泌体大群体样本分离。
128.每个外泌体液体活检样本包括从相应的外泌体大群体样本中捕获并与特定疾病相关的目标外泌体群体。具体而言,每个外泌体液体活检样本包括亚群、亚亚群和外泌体子集,该亚群包含属于外泌体大群体并且具有至少一种特定生物标志物作为共同靶分析物的外泌体,该亚亚群包含属于外泌体亚群并且具有至少另一种特定生物标志物作为共同的靶分析物的外泌体,该外泌体子集属于外泌体亚亚群并且具有至少另一种特定生物标志物作为共同靶分析物。
129.为了清楚理解本文使用的术语“外泌体群体”、“外泌体亚群”和“外泌体亚亚群”,参考cd63和cav1,它们是黑色素瘤癌症相关的生物标志物。外泌体群体是包含从体内细胞释放的外泌体的大群体。外泌体亚群是外泌体群体的一部分,包含目标生物标志物作为目标分析物。具有cd63标志物的外泌体群体,据报道其浓度在黑色素瘤癌症样本中增加,可用作外泌体亚群。由于具有cav1标志物的外泌体存在于具有cd63标志物的外泌体亚群中,因此具有cav1标志物的外泌体群体与外泌体亚群分离并可用作外泌体亚亚群。相反,具有cav1标志物的外泌体群体也可以用作外泌体亚群,属于外泌体亚群并具有cd63标志物的外泌体群体也可以用作外泌体亚亚群。
130.在s200中,测量来自外泌体液体活检样本中存在的目标外泌体的多个生物标志物的定量信号。生物标志物可以包括排列在外泌体表面的预定疾病相关生物标志物和/或从外泌体洗脱的预定疾病相关生物标志物。特定疾病患者体液中预定的疾病相关生物标志物的浓度高于健康对象体液中的浓度。预定的疾病相关生物标志物的实例包括蛋白质、mrna、trna、mirna、长链非编码rna、dna、脂质、糖、肽和其他参与细胞外泌体生物合成、细胞外泌体释放或由受体细胞容纳外泌体的生化成分。
131.来自生物标志物的定量信号可以通过本领域已知的任何合适的测量方法来测量,例如酶联免疫吸附测定(elisa)。用于定量信号测量的方法的其他实例包括但不限于光谱法、电化学法、电磁法、成像法、波测量法和其他基于传感器技术的信号测量方法。
132.在s300中,对外泌体液体活检样本进行生物标志物分析。可以基于测量的定量信号值根据多个生物标志物之间的相关性来执行该分析。可以根据来自一种生物标志物的定量信号与来自另一种生物标志物的定量信号之间的二维相关性来分析每个外泌体液体活检样本。例如,每个外泌体液体活检样本都可以基于xy坐标系中的测量信号值进行分析,该坐标系的x轴显示来自一种生物标志物的定量信号,而y轴显示来自另一种生物标志物的定量信号。来自正常组和患者组的外泌体液体活检样本之间分布模式的比较有助于发现可用于诊断患者组疾病的生物标志物。此外,可以通过识别生物标志物组成中增加的异质性来预测疾病例如癌症的阶段。
133.还可以通过基于定量信号新定义归一化参数来执行分析。此处,每个参数可以定义为作为参考信号的来自多个生物标志物之一的定量信号与来自另一生物标志物的定量信号之间的比率。参数的数量至少为两个,并且根据来自除参考信号之外的生物标志物的定量信号的数量设置。例如,在测量来自四个生物标志物的定量信号的情况下,参数1、2和3可以分别定义为来自第二生物标志物的信号、来自第三生物标志物的信号和来自第四生物标志物的信号与来自第一生物标志物的信号作为参考信号的比率。
134.此处,用于参数化的生物标志物可以选自其定量信号已测量的多个生物标志物。
例如,可以通过在x轴和y轴的一个或多于一个定量信号不同的多个xy坐标系中建立外泌体液体活检样本的坐标来设置参数,如在根据定量信号之间的二维相关性的分析中那样,计算来自正常组和患者组的外泌体液体活检样本的斜率,并选择构成其中斜率差异较大的xy坐标系的生物标志物。即,可以通过比较来自正常组和患者组的外泌体液体活检样本的定量信号之间的二维分析结果,使用显示显著差异的定量信号来设置参数。
135.当设置至少两个参数时,可以根据两个不同参数之间的相关性进行分析。例如,在第一xy坐标系中,其x轴显示第一参数,y轴显示第二参数,将测量值代入第一参数和第二参数以计算参数值,根据计算的参数值建立外泌体液体活检样本的坐标,可以比较分布模式。
136.此处,可以在第一xy坐标系中设置分布来自正常组的外泌体液体活检样本的阴性区域。在来自患者组的外泌体液体活检样本分布在阴性区域的情况下,为阴性区域中的外泌体液体活检样本配置第一参数和第二参数中的至少一个与另一个参数之间的xy坐标系以重新分析样本在阴性区域的分布。例如,通过单独或顺序地重新分析第一参数和第三参数之间的阴性区域的分布以及第三参数和第四参数之间的阴性区域的分布,可以最大化阳性准确度(即敏感度)。
137.同样,可以在第一xy坐标系中设置分布有来自患者组的外泌体液体活检样本的阳性区域。在来自正常组的外泌体液体活检样本分布在阳性区域的情况下,以与上述相同的方式重新分析阳性区域中的外泌体液体活检样本的分布。这种重新分析可以最大限度地提高阴性准确度(即特异性)。
138.在对外泌体表面蛋白进行免疫分离后回收外泌体时,在酸性ph等苛刻条件下进行的现有免疫分离技术难以实现外泌体亚群的生物标志物分析。因此,对于连续免疫分离两次或多于两次,难以不加修饰地使用现有技术,例如色谱、磁分离、荧光激活细胞分选(facs)和微流体分离。外泌体分离技术仍处于开发的早期阶段。事实上,外泌体目前通过如下方法分离:基于外泌体表面蛋白的简单一次性免疫分离和基于外泌体颗粒的大小、密度和溶解度的分级分离。目前还没有关于通过顺序免疫亲和分离和亚亚群生物标志物分析基于外泌体亚亚群分离诊断特定疾病的报道。
139.根据本发明,通过连续重复分离过程对样本中的特定外泌体亚群、亚亚群及其子集进行生物标志物分析,能够对特定疾病例如癌症疾病进行早期诊断。这是因为解决了使用苛刻条件(例如酸性ph和/或表面活性剂来回收被固定元件捕获的特定外泌体)引起的基本问题(例如,外泌体受损和产量低)。综上,本发明解决现有技术存在的例如外泌体在亚群中难以在回收时保持完整形式、回收率低等问题,从而能够通过基于生物标志物分析的特定疾病的顺序重复分离和诊断实现与特定疾病相关的目标外泌体亚亚群的分离。
140.此外,当外泌体亚群、外泌体亚亚群及其子集可以通过与特定疾病如癌症疾病相关的特定外泌体表面蛋白分离时,如上所述,在特定外泌体中以高浓度存在的特定疾病的核酸生物标志物(例如,mrna和mirna)可作为液体活检样本提供。特别地,已知防止rnase降解并在循环血浆或血清中稳定检测的存在于外泌体中的mirna,已成为临床诊断的理想生物标志物。在血浆外泌体中发现的mirna(mir)的实例包括卵巢癌相关mirna,例如mir-21、mir-141、mir-200a、mir-200c、mir-203、mir-205和mir-214,肺癌相关mirna,例如mir-17、mir-3p、mir-21、mir-20b、mir-223、mir-301和let-7f,前列腺癌相关mirna,例如mir-141和mir-375,乳腺癌相关mirna,例如mir-21,心血管疾病相关的mirna,例如mir-1和mir-133a,
以及酒精性肝病相关的mirna,例如mir-122和mir-155。在尿液外泌体中发现的mirna的实例包括与肾纤维化相关的mir-29c和cd2ap mrna。
141.大多数关于外泌体衍生的mirna的研究都集中在癌症诊断上。这些研究表明,在卵巢癌活检标本或从同一卵巢癌患者分离的血清外泌体中发现相似浓度的特定mirna。然而,在正常组中未发现这种外泌体mirna,表明它们可用作活检数据收集的潜在诊断标志物。前列腺癌可以使用前列腺特异性抗原(psa)进行早期检测和诊断。然而,基于psa的检测表现出低诊断特异性和高假阳性率,导致前列腺癌的过度诊断和过度治疗。因此,需要开发对前列腺癌表现出更高诊断准确性的新标志物。一些研究表明,作为mirna(mir)标志物的mir-141和mir-375浓度增加与前列腺癌的肿瘤进展有关。一些外泌体衍生的mirna,例如mir-141和mir-375,由于它们在血清或血浆样本中的rnase抗性,期望成为前列腺癌的有价值的诊断标志物。
142.存在于外泌体中的mirna是食管鳞状细胞癌(escc)的潜在诊断生物标志物。几项研究表明,与没有全身炎症的良性肿瘤患者的血清相比,escc患者血清中外泌体衍生的mir-21浓度升高,并且与肿瘤进展和侵袭性明显相关。此外,外泌体衍生的mirna是心血管疾病和肾纤维化的潜在诊断生物标志物。
143.除了mirna,外泌体mrna在临床诊断中具有作为生物标志物的潜在用途。来自前列腺癌患者的尿液外泌体样本确实含有pca3和tmprss2的mrna,这是一种由erg(v-ets禽类成红细胞增多症病毒e26癌基因同源物)融合染色体重排产生的产物。同样,在尿外泌体中,已发现肾缺血/再灌注损伤或抗利尿激素作用的诊断和预后标志物,例如水通道蛋白-1和水通道蛋白-2。
144.在上述温和条件下通过免疫亲和分离技术制备的外泌体亚群和亚亚群样本可含有外泌体衍生的蛋白质和核酸作为特定疾病的诊断标志物。这些潜在的蛋白质和核酸如下。
145.近年来,许多外泌体衍生的乳腺癌标志物例如cd24和epcam已进行临床鉴定。除了乳腺癌,外泌体蛋白为许多其他癌症的生物标志物提供有用来源。几项研究表明,在正常和前列腺癌患者两者的血浆来源的外泌体中均可检测到作为细胞凋亡抑制剂(iap)成员的存活蛋白,但前列腺癌患者血浆中外泌体存活蛋白的相对含量明显更高。尿液外泌体可通过非侵入性方式轻松获取,其已用于开发前列腺癌和膀胱癌的生物标志物。通过无标记液相色谱-串联质谱(lc-ms/ms)对来自健康和膀胱癌患者的尿液外泌体进行蛋白质分析,鉴定出尿液外泌体蛋白作为膀胱癌的潜在生物标志物。pca3和tmprss2-erg是两种已建立的前列腺癌标志物,它们也存在于前列腺癌患者的尿外泌体中。细胞表面蛋白多糖(蛋白结合多糖)显示存在于通过facs从早期和晚期胰腺患者血清中分离的外泌体中,但在良性胰腺疾病中不存在。通过超速离心从卵巢癌患者血浆中分离的外泌体携带tgf-β1和mage 3/6,但在良性肿瘤患者的外泌体中不携带。
146.对来自分离外泌体的核酸的初步分析确定microrna(mir)和mrna作为外泌体货物的主要成分。随后的研究表明,外泌体包含其他种类的rna,例如转移rna(trna)和长链非编码rna(lnc rna)。除了rna种类,外泌体中还鉴定单链和双链dna的片段。由于外泌体mirna对rnase依赖性降解的稳定性,外泌体mirna作为癌症诊断生物标志物在外泌体衍生的核酸中最受关注。在临床前和临床研究中发现的外泌体核酸生物标志物的实例包括:mir-21和
mir-1246作为血浆中的外泌体核酸应用于乳腺癌诊断;mir-21、mir-141、mir-200a、mir-200c、mir-200b、mir-203、mir-205和mir-214作为血清外泌体核酸应用于卵巢癌的诊断和筛查;let-7a、mir-1229、mir-1246、mir-150、mir-21、mir-223和mir-23a作为血清中的外泌体核酸应用于结直肠癌诊断;mir-141和mir-375作为血浆和血清中的外泌体核酸应用于前列腺癌的诊断;mir-17-5p和mir-21作为血清和尿液中的外泌体核酸应用于胰腺癌的诊断。
147.总之,癌症衍生的外泌体通过增强含有蛋白质、脂质和核酸的货物的细胞间转移,促进肿瘤微环境中的癌症进展。外泌体的货物反映原始癌症的改变状态,这使外泌体成为用于早期检测、诊断和预后的微创生物标志物。实践中,由于外泌体在生物体液中的稳定性,基于外泌体的诊断比传统的组织活检或其他基于生物标志物的液体活检具有更高的敏感度和特异性。
148.此外,外泌体标志物很容易从大多数生物流体中获得,而且外泌体分离方面的最新技术进步使基于外泌体的诊断成本和劳动力效率更高。在外泌体诊断领域要克服的主要障碍是开发分离纯外泌体群体的最佳方法。mve本身可以成为检测癌症的有用诊断工具,但只有使用分离技术才能进行比较研究,将mve分成两个主要的细胞外mve,纯外泌体与其他微泡群体。另一个挑战是了解调节癌症外泌体异质性的机制,这将影响癌症衍生的外泌体货物的含量,并且因此影响诊断结果的重现性。尽管存在这些担忧,未来将外泌体rna和dna的下一代测序、外泌体表面蛋白的蛋白质组学分析和免疫亲和捕获技术相结合的努力将使外泌体在癌症诊断中的利用达到新的水平。
149.本发明的实施方式
150.将参考以下实施例更具体地解释本发明,包括评价实施例。然而,提供这些实施例仅用于说明目的,并不旨在限制本发明的范围。
151.i.基于开关样结合反应的外泌体亲和分离
152.1.材料
153.本发明人已产生特异性识别与钙离子结合的改变的钙结合蛋白(cbp)的独特结构的单克隆抗体。选择突变的葡萄糖-半乳糖结合蛋白(ggbp)作为cbp。这些蛋白质是从大肠杆菌(e.coli)中产生并纯化的。氯化钠、三羟甲基氨基甲烷、酪蛋白(钠盐形式,牛乳提取物)、3,3',5,5'-四甲基联苯胺(tmb)、十二烷基硫酸钠(sds)、牛血清白蛋白(bsa)和cnbr活化琼脂糖凝胶4b(4%琼脂糖)购自sigma(st.louis,mo,usa)。氯化钙二水合物和氯化钾由daejung(siheung,korea)提供。磺基琥珀酰亚胺-6-[生物素酰胺]-6-己酸己胺酯(nhs-lc-lc-biotin)、琥珀酰亚胺4-(n-马来酰亚胺甲基)环已烷-1-羧酸酯(smcc)、n-琥珀酰亚胺3-(2-吡啶二巯基)-丙酸(spdp)、二硫苏糖醇(dtt)、马来酰亚胺、链霉亲和素(sa)和辣根过氧化物酶(hrp)购自thermo fisher scientific(rockford,il,usa)。抗cd63抗体(cat.no.353014)由biolegend(san diego,ca,usa)提供。cd9(cat.no.mab1880)、cd81(cat.no.mab4615)或窖蛋白-1(cav1;cat no.mab5736)的单克隆抗体由r&d systems(minneapolis,mn,usa)提供。来自健康对象的冻干外泌体标准试剂(人血浆来源)和黑色素瘤癌细胞培养物购自hansabiomed(tallinn,estonia)。磁珠(甲苯磺酰基活化的dynabeads m-280,2.8mm直径)和链霉亲和素-poly-hrp20分别由invitrogen(carlsbad,ca,usa)和fitzgerald(acton,ma,usa)提供。其他几种外泌体分离试剂盒,包括exoquick
tm
试剂盒(system biosciences;mountain view,ca,usa)、magcapture
tm
试剂盒(wako;osaka,japan)
和exoeasy maxi
tm
试剂盒(qiagen;hilden,germany),购自不同来源。使用的其他试剂均为分析纯。
[0154]
2.实施例1:用于外泌体分离和表征的组分的制备
[0155]
2.1sa和cbp之间的缀合
[0156]
将cbp(400μg)溶解在10mm磷酸盐缓冲液(ph 7.4;pb)中,并与20倍摩尔过量的smcc混合。使混合物在室温下反应1小时以激活cbp。溶解在pb中的sa(2mg)与5倍摩尔过量的spdp反应1小时,用含有5mm乙二胺四乙酸(edta)的10mm dtt溶液在37℃下化学还原1小时以暴露巯基。在sephadex g-15凝胶过滤柱(10ml体积)上分离活化组分以除去过量试剂。两种活化的蛋白质(即马来酰亚胺-cbp和硫醇化-sa)以1:5的摩尔比混合。使混合物在室温下反应4小时。此后,将含有cbp-sa聚合物的最终溶液在使用前储存在4℃的密闭容器中。
[0157]
2.2抗cd63抗体的生物素化
[0158]
nhs-lc-lc-生物素的琥珀酰亚胺酯部分与抗体分子上的胺基反应,使抗体生物素化。简而言之,将溶解在含有140mm nacl(pbs)的pb溶液中的抗cd63抗体与溶解在20倍摩尔过量二甲基亚砜(dmso)中的nhs-lc-lc-生物素混合。使混合物在室温下反应2小时。使用用pbs平衡的sephadex g-15柱通过尺寸排阻色谱法除去反应混合物中未反应的试剂。纯化的缀合物用pbs透析两次,用vivaspin 500浓缩至1mg/ml,并在使用前储存在4℃下。
[0159]
2.3用hrp标记抗cd63抗体
[0160]
根据一般程序用hrp标记抗cd63抗体。简而言之,首先,抗体在37℃下用10mm dtt还原1小时,并用凝胶过滤柱去除过量试剂。hrp用30倍摩尔过量的smcc激活,未反应的试剂如以前所述通过尺寸排阻色谱去除。在还原的抗体与10倍摩尔过量的活化hrp混合后,在4℃下进行缀合持续≥24小时。将所得缀合物与等体积的甘油混合并储存在-20℃下。
[0161]
3.实施例2:免疫亲和色谱
[0162]
3.1免疫亲和凝胶的制备
[0163]
对于免疫亲和色谱,将cbp构象特异性单克隆抗体固定在cnbr活化的sepharose 4b凝胶表面上。根据制造商的说明,抗体分子上的赖氨酸残基在碱性条件下与凝胶上的官能团反应,以将抗体(每毫升水合凝胶2毫克)化学结合到琼脂糖凝胶上。抗体结合后,凝胶上剩余的反应基团用tris-hcl缓冲液水解。
[0164]
将所得免疫亲和凝胶装入塑料柱中以制作免疫亲和色谱柱,然后在交替的酸性和碱性条件下洗涤以去除非特异性吸附到固体(凝胶)表面的抗体。
[0165]
3.2免疫亲和色谱柱的制作及通过柱分离cd63阳性(cd63+)外泌体
[0166]
免疫亲和凝胶用于制作免疫亲和色谱柱。对cd63阳性(cd63+)外泌体具有特异性的免疫亲和色谱柱通过以下程序制造。首先,用免疫亲和凝胶填充塑料柱。通过使用含有ca
2+
(10mm)的转运溶液(“ca
2+
开启”条件)与cbp构象特异性单克隆抗体反应,将免疫亲和凝胶用cbp-sa缀合物(5μg/ml)固定。此后,通过生物素-sa结合将生物素化的抗cd63抗体(3μg/ml)固定在cbp-sa缀合物层上。
[0167]
制作的免疫亲和柱(9mm
×
3.2mm;1.5ml床体积)用于外泌体分离。具体而言,将来自健康对象的标准外泌体样本(25μg/ml;1ml)加载到cd63免疫亲和柱上。注入含ca
2+
的转运溶液以洗掉未结合的组分。此后,注射不含ca
2+
的溶液(“ca
2+
关闭”条件)以回收与免疫亲和凝胶结合的cbp-抗体-外泌体复合物(包含cd63
+
的外泌体)的级分。此处,使免疫亲和柱再
生并重新用于其他样本的分析。
[0168]
更具体地,在将外泌体样本添加到免疫亲和柱之前,凝胶最初用含有140mm nacl、10mm ca
2+
和2%bsa(ph 7.4;结合溶液)的20mm tris-hcl平衡。实施例1中制备的cbp-sa(5μg/ml,1ml)和生物素化抗cd63抗体(3μg/ml,1ml)和外泌体标准样本(1ml;正常外泌体标准试剂或黑色素瘤癌细胞培养物)各自用结合溶液稀释。将hrp酶(0.1μg/ml)添加到每个稀释液中以标记每种试剂的添加位置。将所得溶液依次加入凝胶柱,使得它们以预定的洗脱体积进行洗脱。使用蠕动泵以120μl/min的洗脱速率将来自柱的洗脱液转移至级分收集器(级分体积:1ml)。通过用不含bsa的结合溶液洗涤,从凝胶柱中除去未反应的蛋白质。最后,将含有500mm nacl的20mm tris-hcl缓冲溶液(ph 7.4)进给到柱中,以洗脱和回收与柱结合的外泌体。此后,将含有500mm nacl、5%(v/v)tween-20和0.02%(w/v)硫柳汞的100mm醋酸钠缓冲液(ph 4.5)进给到凝胶柱中进行再生,然后将柱置于彻底洗涤直至观察不到蛋白质洗脱。
[0169]
4.实施例3.免疫磁分离
[0170]
4.1cd63+外泌体的免疫磁富集
[0171]
通常,磁富集是在磁场下使用抗体结合的免疫磁珠通过抗原-抗体反应分离和浓缩目标物质的方法。基于该方法的cd63+外泌体的分离与实施例2中进行的免疫亲和色谱基本上相同。磁珠与单克隆抗体结合,通过ca
2+
结合识别cbp的构象变化,然后在“ca
2+
开启”条件下与cbp-sa缀合物和生物素化抗cd63抗体顺序反应。使所得免疫磁珠与外泌体样本(正常外泌体标准样本(25μg/ml;1ml))反应。用磁铁捕获磁珠,除去上清液,洗涤磁珠。然后,在“ca
2+
关闭”条件下添加缓冲溶液以回收和浓缩cd63+外泌体。所用缓冲溶液的体积为其初始体积的十分之一。
[0172]
更具体地,对于磁富集,cd63特异性抗体上的胺基团化学结合并固定在磁珠固体表面上的活化甲苯磺酰基部分上。用tris-hcl缓冲液洗涤3次后,剩余表面用酪蛋白-pbs封闭。在从溶液中磁分离珠(总共1mg)后,添加用结合溶液稀释的cbp-sa缀合物(5μg/ml;1ml)并在振荡器上孵育1小时。用不含bsa的结合溶液洗涤珠后,将生物素化抗cd63抗体(3μg/ml;1ml)在相同条件下孵育。再次洗涤后,添加用结合溶液稀释的外泌体样本(25μg/ml;1ml)并使其反应3小时。最后,回收cd63+外泌体,并根据与免疫亲和色谱相同的方案使珠再生。
[0173]
5.评估实施例1:分析实施例2中回收的洗脱液分数
[0174]
图15显示基于开关样结合的样本中cd63阳性(cd63+)外泌体的免疫亲和色谱结果。
[0175]
首先,进行辣根过氧化物酶(hrp)的显色酶测定,以确定实施例2中添加的试剂在色谱图上的洗脱位置。对实施例2中洗脱时从柱上收集的洗脱液级分进行分析,确认各组分的添加位置和各级分中cd63+外泌体的分布。当将每种成分(即cbp-sa缀合物、生物素化抗cd63抗体和外泌体样本)注射到预处理的凝胶柱中时,每种溶液允许含有总共0.1μg的hrp,使得确定洗脱后的添加位置。为此,对每个级分的各部分取样并铺覆在微孔中并向其中添加hrp底物溶液。根据结果,获得有关组分进样位置信息的色谱图。峰(a)、(b)和(c)在图15中用虚线表示。更具体地,对于酶测定,将预定量(5μl)的各个级分铺覆在微量滴定板中,然后加入酶底物溶液(200μl)以产生来自酶的信号。通过混合3%(v/v)过氧化氢水溶液(10μ
l)、溶解在二甲亚砜(dmso)中的10mg/ml tmb(100μl)和0.05m醋酸盐缓冲液(ph 5.1;10毫升)来制备酶底物溶液。在酶信号饱和前通过加入2m硫酸溶液(50μl)终止反应。使用酶标仪(synergy h4,biotek inc.;winooski,vt,u.s.a.)在450nm的最大吸光度下测量光密度。
[0176]
此外,对每个级分中的外泌体进行酶联免疫吸附测定(elisa),以确定通过免疫亲和色谱分离和回收的外泌体的洗脱位置。为此,对每个级分的部分进行取样并铺覆在固定有抗cd63抗体的微孔中,然后进行孵育。此后,使sa-poly hrp 20缀合物与预测与柱中的外泌体反应的生物素化抗体分子上的剩余生物素反应。更具体地,将5μg/ml抗体(100μl)添加到每个孔中,并在37℃下孵育1小时以固定抗体。洗涤后,剩余表面用含有0.5%酪蛋白(酪蛋白-tris)的tris-hcl缓冲液封闭。然后,将每个级分的等分试样(100μl)加入每个孔中,并在保持在37℃和100%湿度的容器中孵育12小时。洗涤孔,向其加入实施例1中制备的生物素化抗cd63抗体(1μg/ml;100μl),然后在37℃下孵育1小时。再次洗涤后,加入用酪蛋白-tris稀释的sa-poly hrp20(66ng/ml;100μl/孔)并在37℃下孵育1小时。最后,加入hrp底物溶液(200μl),并在显色饱和前通过加入2m硫酸溶液(50μl)终止反应。如上所述测量光密度。通过加入hrp底物溶液得到的外泌体特异性色谱结果如图15中实线所示。“ca
2+
关闭”条件下的显著信号由图15中的峰(d)表示。由于免疫分析仅检测到在cd63+外泌体周围形成的抗cd63抗体夹心复合物(参见图15中的插图),因此确定从柱中洗脱的峰(d)含有通过免疫分离法分离和回收的cd63+外泌体。此外,预测即使在外泌体样本的注射位置(图15中的峰(c))也会产生微弱信号,这是由于洗脱的一些外泌体复合物或非特异性反应的过量外泌体对柱不具有亲和性。然而,从进一步分析排除峰(c),因为峰(c)的大小小于峰(d)大小的10%。
[0177]
6.评估实施例2:实施例2的免疫亲和色谱的重现性评价
[0178]
图16显示重复图15的免疫亲和色谱时外泌体分离的重现性。
[0179]
为了确认使用实施例2的免疫亲和柱进行外泌体分离的重现性,重复相同的免疫分离程序3次。如上所述,从每个实验中获得的洗脱液级分对cd63+外泌体进行免疫测定以获得它们的色谱图(参见图16a)。在用洗脱的不含ca
2+
的转运溶液进行交换后(在第35个级分之后),尽管重复实验,cd63+外泌体仍分离并形成单个独立峰。此外,发现形成cd63+外泌体峰的级分数量和来自外泌体的特定信号的强度非常相似。特别地,色谱图上回收的外泌体峰中第37、38和39号级分中存在的cd63+外泌体的免疫测定信号显示平均变异系数(cv)≤9.4%,表明具有较高的重现性(图16b)。
[0180]
更具体地,首先,如上获得免疫亲和色谱图,并根据相同的分离方案回收和分析存在于每个洗脱液级分中的外泌体。这个过程重复3次。获得构成分离的外泌体的每个峰的主要级分中存在的cd63+外泌体的免疫测定结果。测量信号之间的变异系数(cv)用作评估分离测试重现性的指标。用于分离的凝胶柱填充有tris-hcl缓冲液,不使用时储存在4℃下。
[0181]
7.评估实施例3:实施例3的富集性能评价
[0182]
图17显示基于开关样结合的免疫磁分离对样本中cd63+外泌体的分离和富集。
[0183]
为了测试实施例3的富集性能,对其他标准外泌体标准样本(1、3或5μg/ml)重复施加磁分离,然后对cd63+外泌体进行夹心酶联免疫吸附试验,如上所述。结果如图17a中的黑条所示。磁富集前原始标准样本cd63+外泌体免疫分析结果如图17a中的白条所示。比较磁分离前后的样本结果,磁富集产生的信号强度平均增加约3.7倍。免疫测定对原始标准样本
的剂量反应通过log-logit转换线性化,以确定分离的外泌体的富集率,并由此确定富集的cd63+外泌体的浓度(图17b)。特别地,基于cd63+外泌体,3μg/ml外泌体样本富集到22μg/ml,其对应于约7.9倍的富集效率。
[0184]
通过与免疫测定标准试剂获得的结果进行比较,确定分离前后外泌体样本的浓度。首先,将正常外泌体标准试剂用酪蛋白-tris稀释,制备外泌体标准样本(1-100μg/ml)。将抗cd63抗体(5μg/ml;100μl)铺覆在微孔中进行免疫测定,在37℃下孵育1小时,并用捕获结合剂固定在孔的内表面上。洗涤后,剩余表面在与上述相同的条件下用酪蛋白-tris封闭。将外泌体样本(每100μl)铺覆在不同的孔中,并在37℃下孵育12小时。根据上述elisa方案进行随后的程序。
[0185]
8.评估实施例4:实施例3的免疫磁分离的重现性评价
[0186]
图18显示重复图17免疫磁分离时外泌体分离的重现性。
[0187]
实施例3中基于开关识别材料的磁富集技术能够在“ca
2+
开启”条件下捕获目标外泌体,在“ca
2+
关闭”条件下顺序回收外泌体,预处理磁珠的再生,以及重新使用预处理的珠来分离和富集新样本。为了评估预处理珠粒实际重复使用的富集性能的重现性,不同浓度的外泌体标准样本(1、3和5μg/ml;从正常人血浆中收集)进行磁分离和富集,并使用重新使用的预处理珠重复相同的程序两次。通过cd63+外泌体的夹心酶联免疫吸附测定分析分离的外泌体样本的浓度。结果显示在图18a中。参考图18a,当使用预处理的珠分离和富集样本时,cd63+外泌体的浓度响应模式非常相似。实践中,根据来自免疫测定的信号值,发现取决于外泌体浓度的分离样本中cd63+外泌体的富集具有很高的重现性,平均cv为8.3%(参见图18b)。
[0188]
此处,标准样本(1、3和5μg/ml)是通过用结合溶液稀释来自健康对象的外泌体标准试剂制备的。不使用时,将磁珠浸入酪蛋白-tris中并在4℃下储存。
[0189]
9.评估实施例5:实施例2和实施例3中分离的cd63+外泌体的表征
[0190]
图19显示基于开关样结合反应分离的cd63+外泌体的物理表征结果。图20显示基于开关样结合反应分离的cd63+外泌体样本的外泌体表面标志物的免疫化学表征结果。
[0191]
外泌体的两个特征(包括微泡的形态和不同类型表面蛋白的分布)实际上是通过实施例2和实施例3中分离的cd63+外泌体亚群的形态学表征和表面蛋白的免疫测定来确定的。对于形态学表征,测量通过本发明方法分离的外泌体的形态学。为此,使用扫描电子显微镜(sem)观察图像并通过动态光散射(dls)测量尺寸分布。通过蛋白质印迹确定外泌体蛋白的分布。通过酶联免疫吸附测定(elisa)测量分离后的回收率。
[0192]
9.1扫描电子显微镜(sem)成像
[0193]
通过sem成像观察在实施例2和实施例3中分离的cd63+外泌体样本的形态。为了获得高放大倍率的图像,根据标准方案从通过免疫亲和色谱或免疫磁分离法分离的外泌体样本中制备样本。为了测量固态微观结构和形貌,将每个原始样本转移到显微镜载玻片上并盖上盖玻片,将物体浸入液氮中并通过快速冷冻固定。取下盖玻片后,通过加入2.5%戊二醛溶液固定冷冻标本,用tris-hcl缓冲液和去离子水洗涤(各一次),用丙酮脱水。然后,使用液态二氧化碳进行临界点干燥来除去丙酮。使用临时固定粘合剂将样本固定在铝制短柱上,并将其表面与胶体银接触。在将铂溅射涂覆至3-5nm的厚度后,使用hitachi s-4700sem(hitachi;tokyo,japan)观察样本。在每个样本的图像中,观察到直径约100nm的球形颗粒
(参见图19a)。实际上,外泌体是从各种类型的细胞中释放的膜微泡,已知直径为约30-200nm。
[0194]
9.2动态光散射(dls)分析
[0195]
为了更准确地测量每个分离的cd63+样本的粒径分布,在室温下使用粒径分析仪(elsz-1000,otsuka electronics;osaka,japan)对外泌体进行dls分析。将外泌体样本(0.5ml)转移到一次性比色皿(bi-scp,brookhaven instruments corporation;ny,usa)并根据制造商的指南进行分析。根据stokes-einstein方程确定外泌体的大小后,表征细胞外囊泡的粒径分布。结果,发现每个样本中的平均粒径处于约186.2nm或约193.8nm的水平(参见图19b)。从测得的粒径和粒径分布来看,认为通过免疫亲和色谱和免疫磁分离法分离的样本中存在的颗粒是外泌体。
[0196]
9.3蛋白质印迹
[0197]
为了确定不同类型表面蛋白的分布,这是外泌体的一般特征之一,对实施例2和实施例3中分离的cd63+外泌体样本中的四次穿膜蛋白标志物进行蛋白质印迹。在优化条件下对外泌体样本进行sds-page后,分离的蛋白质转移到硝酸纤维素膜上,并允许对cd9、cd63和cd81特异的抗体-hrp缀合物(通常大量分布在外泌体表面上)与相应的靶蛋白反应。更具体地,首先,每个外泌体样本用含有150mm nacl、1%triton x-100、0.5%脱氧胆酸钠和0.1%十二烷基硫酸钠(sds)的50mm tris缓冲液(ph 8.0)处理。变性蛋白质使用8%sds-聚丙烯酰胺凝胶电泳(sds-page)分离并通过电泳转移到硝酸纤维素膜上。剩余表面用酪蛋白-pbs封闭后,使用抗cd63、cd9和cd81抗体进行印迹,这些抗体先前已与hrp化学缀合。最后,加入含有3,3'-二氨基联苯胺(dab)作为显色试剂的hrp底物溶液以在膜上产生比色信号。通过将0.05%dab(10μl)和3%h2o2(1μl)添加到50mm醋酸钠缓冲液(ph 5.0;1ml)来制备底物溶液。
[0198]
染色的比色信号表明外泌体的所有四次穿膜蛋白标志物都在实施例2和实施例3中分离的cd63+外泌体样本中表达(参见图20a)。作为参考,与cd9和cd81条带的比色信号相比,来自cd63的条带信号并不清晰。这受到相对较宽的条带分布(30-60kda)的影响,因为cd63标志物是糖基化蛋白,但更根本的原因是该评估实验中使用的外泌体标准样本(图20a:对照)中cd63标志物表达的条带信号低(参见图20a)。综合以上结果,免疫亲和色谱和免疫磁分离法分离的样本表现出外泌体的所有一般特征,表明本发明方法成功分离cd63+外泌体亚群。
[0199]
9.4分离后cd63+外泌体的回收率
[0200]
为了确定外泌体分离系统的回收率,在分离前后对样本中的cd63+外泌体进行定量分析,并使用通过对外泌体标准样本的cd63标志物的免疫测定获得的标准曲线间接测量cd63+外泌体亚群的浓度。标准曲线通过酶联免疫吸附试验(elisa),使用对cd63(一种外泌体表面标志物)具有特异性的抗体作为免疫分析过程中的捕获和检测结合剂(图20b;左)获得。在分离前后在相同条件下对样本进行免疫测定。将所得信号代入标准曲线以计算外泌体的浓度。在校准体积稀释因子后,计算免疫亲和色谱和免疫磁分离前后外泌体样本中外泌体的总量,以确定分离过程的回收率(图20b;右)。发现免疫亲和色谱和免疫磁分离的产率分别为约78.3%和约68.5%,与在严苛条件例如酸性ph下回收分离产物的常规分离工艺的产率(例如,《50%)相比,这非常高。这是因为在使用开关识别材料的分离过程中从溶液
中去除钙离子时,识别材料对cbp的亲和力降低到背景水平,导致分离的外泌体的回收率相对较高,并且外泌体的结构变形最小。
[0201]
10.评估实施例6:cd63+外泌体亚群用作诊断样本时的分析性能评估
[0202]
图21显示基于cd9浓度的cav1标志物的校正浓度,以补偿外泌体标准样本之间的浓度变化。图22显示使用通过本发明的基于开关样结合反应的亲和分离系统和方法分离的cd63+外泌体作为分析样本对黑色素瘤癌症诊断的潜在影响。
[0203]
10.1目标标志物的浓度归一化
[0204]
当分离的cd63+外泌体亚群用作诊断样本时,由于cav1+外泌体作为黑色素瘤癌症相关标志物的富集效应,预测高敏感度诊断。然而,当简单测量cav1蛋白的表达水平时,由于样本中的外泌体浓度不同,在准确确定分离效果方面存在局限性。因此,引入通过基于通常存在于外泌体表面上的cd9的校准来归一化标志物的方法,以最大限度地减少性能比较过程中的不确定性。为此,将cav1蛋白特异性抗体和cd9蛋白特异性抗体固定在微量滴定板的不同孔中,将相同样本铺覆在孔中,然后孵育。使用cd63抗体作为检测抗体进行elisa。结果,获得与癌症标志物和正常标志物的浓度成比例的信号(参见图21中的条)并计算信号的比率(即cav1/cd9信号比)(参见图21中的线)。当对健康对象的血浆样本进行稀释和分析时(图21a),cav1/cd9信号比平均为0.147,在不同稀释因子下几乎保持不变。对于黑色素瘤癌细胞样本(图21b),检测到的标志物信号相对较高,cav1/cd9比平均为0.206,表明cav1的表达水平比标准样本的表达水平高约40%。因此,总外泌体浓度的变化可以通过使用cd9+外泌体作为正常标志物校准cd63+外泌体亚群中的cav1+外泌体来归一化。
[0205]
为了详细说明评估实验程序,通过用酪蛋白-tris稀释从正常血浆或黑色素瘤癌细胞系获得的外泌体制备外泌体标准样本(5-100μg/ml)。如下测量样本中标志物的浓度。首先,将标志物特异性的捕获抗体(5μg/ml;100μl)铺覆在微孔中,并在37℃下孵育1小时以进行固定。随后的程序以与上述cd63 elisa程序相同的方式进行。测量分析cd9和cav1后产生的信号,并计算样本的cav1/cd9信号比。
[0206]
10.2分离外泌体亚群作为诊断样本的潜力
[0207]
使用免疫测定法测量cav1/cd9信号比的方法测试cd63+外泌体亚群作为基于开关识别材料分离的诊断样本对黑色素瘤癌症诊断的潜在影响。分离健康外泌体和黑色素瘤癌症外泌体标准品(各25μg/ml)以获得cd63+外泌体亚群,并与分离前比较cav1蛋白的表达水平。与分离前批量健康外泌体样本相比,分离前批量癌症外泌体样本的cav1/cd9信号比增加约40%(图22a;左)。与通过免疫色谱分离的健康cd63+外泌体亚群样本相比,通过免疫色谱分离的癌症cd63+外泌体亚群样本的信号比增加约4倍(即400%)(图22a;右)。也就是说,使用分离的cd63+外泌体亚群样本导致黑色素瘤癌细胞筛查的潜在敏感性增加约10倍。还发现使用通过免疫磁分离法分离的亚群样本对黑色素瘤癌细胞筛查的潜在敏感性增加(图22b)。预计这种效果是由于使用cd63+外泌体亚群作为筛查样本,这不仅导致cav1+外泌体浓度增加,而且导致cd9+外泌体浓度降低。确实有报道称,癌症样本中cd9+外泌体的浓度降低。
[0208]
11.评估实施例7:与传统外泌体分离系统的性能比较
[0209]
图23比较基于开关样结合反应的亲和分离系统根据分离样本的免疫测定确定的cav1/cd9浓度比区分黑色素瘤癌症样本和正常样本的能力,以及目前商购可得外泌体分离
系统的能力。
[0210]
通过与使用目前商购可得外泌体分离试剂盒获得的样本进行比较,客观评估使用实施例2和实施例3中基于开关识别材料的分离系统获得的cd63+外泌体亚群样本对黑色素瘤癌细胞筛查的影响。商购可得外泌体分离试剂盒以商品名exoquick
tm
、magcapture
tm
和exoeasy maxi
tm
市售。根据每个系统的既定方案,分离出25μg/ml正常外泌体和黑色素瘤癌症外泌体标准品(各1ml)。如上所述,通过elisa测量分离的外泌体样本中cav1和cd9蛋白的表达水平作为信号。计算并比较作为校准参数的cav1/cd9信号比。结果如图23所示。参考图23,通过本发明的免疫色谱和免疫磁分离系统获得的癌症cd63+外泌体亚群样本的cav1/cd9信号比在癌症样本中分别比正常样本增加5.5倍和4.1倍,如上述提到的。相比之下,无论使用何种试剂盒,使用商购可得分离试剂盒获得的样本与分离前的样本之间的cav1/cd9信号比没有显著差异。相反,与正常样本相比,癌症样本的cav1/cd9信号比降低。
[0211]
认为这些结果是因为商业外泌体分离试剂盒的分离原理与本发明的分离系统的原理不同。商业试剂盒基于使用聚乙二醇(exoquick
tm
,sbi)等聚合物进行外泌体分离的沉淀方法,这是使用蛋白质在金属离子存在下与外泌体表面上的磷脂酰丝氨酸(ps)反应进行外泌体分离的亲和方法(magcaprue
tm
,wako),以及使用旋转柱进行外泌体分离以缩短分离所需时间的方法(exoeasy maxi
tm
,qiagen)。
[0212]
大多数商业试剂盒仅用于分离或浓缩批量外泌体群体,并且在显著提高诊断敏感度方面受到限制,因此难以应用于癌细胞筛查。此外,可以应用靶向特定外泌体表面标记的常规免疫分离来提高诊断敏感度,但在不引入如本发明中使用开关识别材料的创新方法的情况下在外泌体回收率和完整形式的维持方面没有竞争力。
[0213]
下文中,将简要描述使用本评估实验中使用的商业试剂盒进行外泌体分离的过程。
[0214]
使用exoquick试剂盒分离外泌体:
[0215]
根据制造商的指南分离外泌体标准样本。简而言之,将商业外泌体样本(各25μg/ml;1ml)分别转移到微孔中,并向其中加入预定量的exoquick外泌体沉淀溶液。混合后,将混合物在4℃下冷藏。将混合物离心并弃去上清液。收集以颗粒形式沉淀的外泌体,重新溶解在缓冲液(500μl)中,并进行免疫测定以确定cav1/cd9比,如前所述。
[0216]
使用magcapture试剂盒进行外泌体分离:
[0217]
根据制造商的方案分离相同的外泌体标准样本。简而言之,将包被有磷脂酰丝氨酸(ps)结合蛋白(外泌体的特异性捕获因子)的磁珠(60μl)添加到含有金属离子作为结合促进剂的样本(1ml)中。使混合物在搅拌下反应3小时。此后,将珠用洗涤溶液(2mm cacl2,含有150mm nacl、0.05%tween20和20mm tris-hcl(ph 7.4;1ml))洗涤3次,并用洗脱液(20mm tris-hcl,含有150mm nacl和2mm edta(ph 7.4))洗脱。进行免疫测定以确定回收的外泌体样本的cav1/cd9比。
[0218]
使用exoeasy maxi试剂盒进行外泌体分离:
[0219]
使用另一种商业试剂盒分离外泌体样本。简而言之,将随试剂盒提供的xbp缓冲液(1ml)添加到等体积的样本中。轻轻混合后,将混合物在室温下静置并预热至室温。将混合物转移到exoeasy旋转柱中,然后离心1分钟。将xwp缓冲溶液(10ml)加载到柱上后,进行离心另外5分钟以除去加载的缓冲溶液。将旋转柱转移到新的回收管中,然后将xe缓冲液(500
μl)加载到柱上,然后孵育1分钟。离心另外5分钟后,洗脱外泌体并在管中回收。最后,将洗脱液再次加载到旋转柱上,孵育1分钟,离心5分钟。回收洗脱液并进行免疫测定以确定cav1/cd9比,如上所述。
[0220]
ii.评估cd63+亚群分离对癌症诊断的有用性
[0221]
1.材料
[0222]
传感器和传感器系统购自fortebio(san francisco,usa)并用于以下实施例。其他材料与
“ⅰ
.基于开关样结合反应的外泌体亲和分离”部分中使用的材料相同。
[0223]
2.使用无标记传感器进行生物标志物分析
[0224]
为了支持cd63+亚群分离对癌症诊断的有用性,使用无标记传感器(octet传感器;fortebio)分别同时测量批量外泌体标准样本和分离后获得的外泌体亚群样本的cd9和cav1标志物。结果如图24至图27所示。
[0225]
图24至图27显示使用无标记传感器同时测量外泌体标准样本免疫亲和分离前后样本中的cd9和cav1标志物时获得以便验证外泌体亚群分离效果的实验结果。具体来说,图24显示分离前后正常外泌体样本中cd9的浓度,图25显示分离前后正常外泌体样本中cav1的浓度,图26显示分离前后癌细胞外泌体样本中cd9的浓度,图27显示分离前后癌细胞外泌体样本中cav1的浓度。
[0226]
首先,在分离前后测量正常样本中含有cd9的外泌体。为此,将固定有针对cd9的特异性捕获抗体的传感器浸入外泌体样本中,并实时测量信号1200秒(参见图24)。测量与来自分离前原始样本的cd9相关的信号。结果,平均结合信号增加到0.74nm,当转换为结合厚度时(图24顶部的灰色实线)。相比之下,测量分离后样本的信号仅为约0.03nm(图24底部的黑色实线)。对分离前后获得的黑色素瘤癌症样本重复相同的实验(参见图25)。测得的信号在分离前为0.04nm(图25顶部的黑色实线),分离后为《0.01nm(图25底部的灰色实线)。比较这些结果,分离前正常和黑色素瘤癌症标准样本中含有cd9的外泌体的信号强度根据样本来源显示出很大差异,然而cd63亲和分离后的信号强度几乎降低至背景信号的水平。
[0227]
使用固定有cav1特异性捕获抗体的传感器,将相同的无标记传感技术应用于相同样本的分析。对于正常样本,来自含有cav1的外泌体的结合信号仅从分离前的0.04nm略微增加到分离后的0.06nm(参见图26)。对于黑色素瘤癌症样本,来自含有cav1的外泌体的结合信号从分离前的《0.01nm增加到分离后的0.1nm(图27)超过10倍。认为这些结果是由于与cd63亲和分离相关的特定效应导致的。
[0228]
总之,无论外泌体样本的来源如何,使用基于免疫亲和分离的本发明方法导致含cd9的外泌体浓度显著降低。相比之下,本发明的分离方法增加含有cav1的外泌体的浓度,特别是显著增加了黑色素瘤癌症样本中含有cav1的外泌体的浓度。本发明的分离方法对外泌体标志物浓度变化的这种相反影响提供潜在分离机制方面的清晰解释。
[0229]
上述结果实际上可能因诊断时黑色素瘤癌症疾病的进展阶段而异。根据已发表的文献,据报道在癌症发展过程中增加的cav1+外泌体的浓度在癌症的转移阶段而不是在癌症发展的早期阶段显著增加。因此,在癌症转移阶段收集的样本中cav1+外泌体的浓度容易测量,无需外泌体分离和富集。然而,在癌症发展的早期阶段,体液例如血液中cav1+外泌体的浓度会非常低,因此即使使用灵敏的分析方法例如免疫分析也很难直接测量。总之,本发明中提出的cd63+/cav1+外泌体亚亚群的分离和富集将允许通过分析存在于外泌体中的生
物标志物(例如,特定的mirna,如黑色素瘤癌症的mir222)进行早期和准确的癌症诊断。
[0230]
iii.临床样本中外泌体的分析
[0231]
1.材料
[0232]
抗cd63抗体(cat.no.353014)、抗cd81抗体(cat.no.349501)和抗cd151抗体(cat.no.350404)购自biolegend(san diego,ca,usa),抗存活蛋白抗体(cat.no.nb500-201)购自novus biologicals(centennial,co,usa)。对cd9(cat.no.mab1880)或窖蛋白-1(cav1;cat.no.mab5736)特异的单克隆抗体由r&d systems(minneapolis,mn,usa)提供。来自恶性黑色素瘤和前列腺癌阳性患者的样本(血清或血浆)购自discovery life sciences(huntsville,al,usa)和promeddx(norton,ma,usa)。其他材料与
“ⅰ
.基于开关样结合反应的外泌体亲和分离”部分中使用的材料相同。
[0233]
2.实施例1:cd63+外泌体亚群样本的制备
[0234]
2.1sa和cbp之间的缀合
[0235]
重复
“ⅰ
.基于开关样结合反应的外泌体亲和分离”部分中描述的程序。
[0236]
2.2抗cd63抗体的生物素化
[0237]
重复
“ⅰ
.基于开关样结合反应的外泌体亲和分离”部分中描述的程序。
[0238]
2.3临床样本的预处理
[0239]
临床样本(血清或血浆;200μl)在4℃下低速(1200g)离心20分钟以去除沉淀物,并在相同温度下高速(10000g)离心30分钟以去除沉淀。上清液通过hm注射器过滤器(cat.no.sc13p020sl;0.2μm)过滤以预处理临床样本。预处理的临床样本用作大群体样本。
[0240]
2.4免疫磁珠的制备
[0241]
对于磁富集,cbp特异性抗体上的胺基团化学结合并固定在磁珠固体表面上的活化甲苯磺酰基部分上。用tris-hcl缓冲液洗涤3次后,剩余表面用酪蛋白-pbs封闭。从溶液中磁分离珠(共1mg)后,cbp-sa缀合物(5μg/ml;1ml)用含有ca
2+
(10mm)的bsa-tris结合溶液稀释(“ca
2+
开启”条件),并在振荡器上孵育1小时。用不含bsa的结合溶液洗涤珠后,将用bsa-tris结合溶液稀释的生物素化抗cd63抗体(3μg/ml;1ml)在相同条件下孵育,然后进行磁分离。
[0242]
2.5cd63阳性(cd63+)外泌体的分离
[0243]
使用免疫磁珠分离和回收cd63阳性(cd63
+
)外泌体,并再生珠。为了分离cd63+的外泌体亚群(一种外泌体标志物),预处理的临床样本(血清或血浆;200μl)用含有ca
2+
(10mm)的结合溶液稀释5倍(“ca
2+
开启”条件)并添加到免疫磁珠中。在振荡器上孵育1小时后,进行磁分离。再次转移含ca
2+
的结合溶液以洗掉未结合的组分,然后通过磁分离进行洗涤。此后,转移仅包含500mm nacl(“ca
2+
关闭”条件)的20mm tris-hcl(ph 7.4)缓冲溶液,并将结合到磁珠的cbp-抗体-外泌体复合物(包含cd63+外泌体亚群)通过磁分离回收。此后,将含有500mm nacl、5%(v/v)tween-20和0.02%(w/v)硫柳汞的100mm醋酸钠缓冲液(ph 4.5)进给至磁珠进行再生,磁珠彻底洗涤,直到没有观察到蛋白质洗脱。
[0244]
3.实施例2:外泌体表面生物标志物的分析
[0245]
3.1酶联免疫吸附测定
[0246]
为了表征通过磁分离分离的cd63+外泌体亚群,对外泌体表面存在的生物标志物进行分析。为此,将对生物标志物特异的抗体固定在微量滴定板的孔上,并对目标生物标志
物(cd9、cd81、cav1和存活蛋白)进行夹心酶联免疫吸附测定(elisa)。根据癌症疾病的类型,cd81、cav1和存活蛋白是已知参与肿瘤进展、促进或转移的外泌体生物标志物,以及称为肿瘤抑制因子的cd9选择为目标生物标志物。首先,将生物标志物特异性抗体(5μg/ml;100μl)在37℃下固定在孔上持续1小时,然后用去离子水洗涤。在与上述相同的条件下,用含有0.5%酪蛋白的20mm tris-hcl(ph 7.4)缓冲液处理剩余表面。将通过磁分离法分离的cd63+外泌体亚群样本或分离前的作为对照的种群样本铺覆在固定有生物标志物特异性抗体的孔中,然后在37℃下孵育10小时,如上所述。洗涤后,加入链霉亲和素-poly-hrp20(66ng/ml;100μl),在室温下孵育1小时。再次洗涤后,加入hrp底物溶液(0.05m醋酸盐缓冲溶液,含有0.003%过氧化氢和100μg/ml tmb,ph 5.1;200μl),然后孵育15分钟。通过加入硫酸溶液(2m;50μl)终止反应。使用elisa读数器(synergy h4,biotek inc.;winooski,vt,usa)通过450nm处的吸光度对每个孔中的显色进行量化。
[0247]
3.2分析生物标志物之间的相关性
[0248]
如上所述,使用通过对恶性黑色素瘤阳性临床样本(血清或血浆)和正常样本(血清)进行预处理获得的外泌体大群体对cd81、cav1、存活蛋白和cd9进行免疫测定。此处,由于测量每个外泌体大群体样本与对生物标志物特异的固相捕获抗体反应并分离后与剩余免疫复合物成比例的信号,因此能够对包含生物标志物的亚群进行定量分析。图28在对来自正常组和恶性黑色素瘤患者组的外泌体大群体样本中的外泌体表面标志物进行分析后,比较肿瘤进展、促进或转移标志物与肿瘤抑制标志物之间的相关性。图28中,对样本的分布进行二维作图,从通过elisa获得的定量信号中获得来自cd81、cav1或存活蛋白作为肿瘤进展、促进或转移标志物的信号与来自cd9作为肿瘤抑制标志物的信号之间的相关性。参考图28,当使用外泌体大群体作为样本时,癌症阳性样本的数据和正常样本的数据在分布上是混合的,它们之间没有明显的相关性。作为参考,当使用外泌体大群体样本时,难以确保相关性分析的可靠性,因为大多数样本中来自cav1和存活蛋白的信号值非常低。
[0249]
对恶性黑色素瘤阳性样本组和正常样本组进行预处理后,如前所述,使用基于“开关样结合反应”的可逆免疫分离系统分离和回收cd63+外泌体,制备外泌体亚群作为分析样本,然后对四种生物标志物进行免疫分析。这种免疫测定的一个特殊优势是,在与固定在固态固定元件上的特定抗体反应后,分离出包含存在于外泌体亚群中的生物标志物的外泌体,并从剩余的免疫复合物产生与其成比例的信号,从而能够对特定亚亚群进行分析。图29使用从正常阻和恶性黑色素瘤患者的外泌体大群体中分离出的外泌体亚群作为样本,对外泌体亚亚群中的外泌体表面标志物进行分析后,基于肿瘤抑制标志物比较肿瘤进展、促进和转移标志物之间的相关性。图29中,对样本的分布进行二维作图,以获得通过elisa获得的来自cd81、cav1和存活蛋白作为肿瘤进展、促进或转移标志物的信号与来自cd9作为肿瘤抑制标志物的信号之间的相关性。在来自cd9(肿瘤抑制标志物)的信号相对于来自cd81(肿瘤进展标志物)的信号进行作图的第一张图中,正常样本显示两种标志物之间的线性比例关系,表明样本中两种标志物的组成比保持恒定。相比之下,恶性黑色素瘤阳性样本的两种标志物显示逆相关,表明癌症阳性样本中cd81与cd9的组成比不同。
[0250]
比较来自不同样本组的两个结果,当出现恶性黑色素瘤时,预测外泌体表面标志物之间的组成比的异质性增加。特别地,随着癌症阶段从第1阶段发展到第4阶段,cd81信号增加但cd9信号降低,这表明cd81/cd9信号比增加。因此,预测标志物之间组成比的异质性
增加与癌症阶段有关。
[0251]
此外,在来自cd9的信号相对于来自cav1的信号作图的第二张图中以及在来自cd9的信号相对于来自存活蛋白的信号作图的第三张图中,看来癌症样本的分布偏离正常样本中两种标志物之间显示的线性比例关系。然而,与第一张图中观察到的不同,没有观察到异质性的明显增加。
[0252]
图30在对来自正常和恶性黑色素瘤患者组的外泌体大群体样本中外泌体亚群的外泌体表面标志物进行分析后,比较肿瘤进展、促进和转移标志物之间的相关性。如上所述,使用通过对恶性黑色素瘤阳性临床样本(血清或血浆)和正常样本(血清)进行预处理获得的外泌体大群体对生物标志物进行免疫测定。根据结果,分析cd81、cav1和存活蛋白作为肿瘤进展、促进或转移标志物之间的相关性。分析结果表明,当外泌体大群体作为样本时,关于癌阳性样本的数据和关于正常样本的数据混合分布,两者之间没有明显的相关性,并且难以确保相关性分析的可靠性,因为大多数样本中来自cav1和存活蛋白的信号值非常低,如图28中所示。
[0253]
图31在从正常和恶性黑色素瘤患者组的外泌体大群体中分离出的外泌体亚群样本中,对外泌体亚亚群中的外泌体表面标志物进行分析后,比较肿瘤进展、促进和转移的标志物之间的相关性。在对恶性黑色素瘤阳性和正常样本组进行预处理后,使用可逆免疫分离系统分离并回收cd63+外泌体亚群。在以与上述相同的方式对外泌体亚亚群的生物标志物进行免疫测定后,分析三种类型生物标志物的肿瘤进展、促进和转移之间的相关性。从免疫测定结果可以看出,在来自cd81的信号相对于来自cav1的信号作图的第一张图中,正常样本显示两种标志物之间出基本上线性的比例关系。相比之下,恶性黑色素瘤阳性样本显示两种标志物之间的逆相关,其中cav1信号在癌症疾病早期高于cd81信号,并在晚期逆转。
[0254]
在来自cd81的信号相对于来自存活蛋白的信号作图的第二张图中以及在来自cav1的信号与来自存活蛋白的信号作图的第三张图中,未观察到这种现象。然而,在第三张图中,看来癌症样本的分布偏离正常样本中两个标志物之间的线性比例关系。
[0255]
4.实施例3:基于生物标志物分析结果和使用参数的分析设置用于疾病早期诊断的参数
[0256]
4.1诊断参数的设置
[0257]
由于样本中外泌体的浓度不同并且因稀释因子而异,因此难以直接比较根据免疫测定结果计算出的样本中生物标志物的信号差异。为了解决该问题,根据来自一种生物标志物的信号与来自其他生物标志物的信号之间的比率,新定义待诊断的目标疾病的两种或多于两种类型的归一化参数。具体而言,归一化参数1、2和3是根据来自cd81、cav1和存活蛋白(肿瘤进展、促进或转移的标志物)的信号与来自cd9(肿瘤抑制标志物)的信号的比率设置的。此处,参数1、2和3分别设置为“来自cd81的信号/来自cd9的信号”、“来自cav1的信号/来自cd9的信号”和“来自存活蛋白的信号/来自cd9的信号”。
[0258]
4.2二维参数分析
[0259]
在将样本中外泌体生物标志物的分析结果转换为如上定义的参数后,选择两个参数的最佳对进行二维分析。根据分析结果,设置两个参数值的边界,使得正常和目标疾病样本可以相互区分,以及目标疾病区分阴性和阳性样本的能力,即阳性准确度(敏感性)和阴性准确度(特异性)。作为参考,相互区分正常和目标疾病样本的边界线的参数值可因分析
条件而异。
[0260]
图32显示当新定义的参数应用于生物标志物分析时,来自正常和恶性黑色素瘤患者组的外泌体大群体样本中外泌体亚群的生物标志物分析结果。图33显示当新定义的参数应用于生物标志物分析时,从正常组和恶性黑色素瘤患者组的外泌体大群体中分离出的外泌体亚群样本的生物标志物分析结果。
[0261]
难以从免疫分离前外泌体大群体样本中外泌体亚群的生物标志物分析结果中阐明正常和癌症样本之间的分析差异(参见图32),因为无论是正常样本还是癌症样本,参数3的值都太小。这是因为在所有总体样本中,存活蛋白的免疫测定结果测得过小,如图28和图30所示。
[0262]
接着,在免疫分离和回收后获得的外泌体亚群样本的生物标志物分析结果中(参见图33),三个参数的值都高得足以比较样本。特别地,所有参数的值都显著增加,这使得当合适的外泌体亚群进行分离、回收并用作分析样本时,能够对选定的外泌体生物标志物进行分析。
[0263]
由于使用分离和回收的目标外泌体作为样本,减少的分析观察窗口和集中目标的协同作用使这种效果成为可能。由于从许多不同细胞释放的外泌体物种混合在体液中,使用包含从体液中分离和回收的目标外泌体作为样本的外泌体亚群可以从与疾病相关的外泌体物种中排除不相关的外泌体物种。因此,当比较观察窗的大小时,在期望的方向上减少观察窗将是有效的。在这种情况下,可以最大限度地减少疾病诊断过程中无关生物标志物的非特异性反应引起的干扰。此外,分离富集成亚群导致目标外泌体浓度增加,实现高回收率。因此,根据本发明,使用外泌体亚群作为免疫测定样本进行诊断,最大限度地减少非特异性外泌体造成的干扰,并导致目标外泌体浓度增加,实现对分析准确度的积极协同作用。
[0264]
图34显示当新定义的参数应用于生物标志物分析时,对来自正常组和恶性黑色素瘤患者组的外泌体大群体样本(a)中的外泌体亚群以及与外泌体总体样本分离的外泌体亚群样本(b)中的外泌体亚亚群的生物标志物分析结果的二维参数分析的总体结果。
[0265]
为了阐明使用免疫分离后回收的外泌体亚群作为诊断样本的效果,首先,将分离前外泌体大群体样本中含有生物标志物的亚群的分析结果(参见图28至图31)转换为图32和图33中定义的参数。首先,对参数1和2进行二维分析(参见图34a)。结果发现,正常样本和癌症样本在二维图中混合分布,样本组之间没有差异。
[0266]
接着,对免疫分离后回收获得的亚群样本中的亚亚群进行分析,并将结果以与上述相同的方式转换为参数。此后,对参数1和2进行二维分析(参见图34b)。因此,正常样本分布在由两个参数值(参数1《约3.2;参数2《约0.9)定义的有限区域内(参见图中虚线定义的边界),恶性黑色素瘤样本分布在边界上或边界外。仅有一个(n52)正常样本位于边界外,这认为是由分析错误或分析时未知样本引起的。因此,根据本发明,通过连续免疫分离观察到归一化效应,使得能够使用亚亚群中的疾病相关外泌体生物标志物根据样本来源进行区分分析。因此,癌症阴性的样本可以与癌症阳性的样本区分开。作为参考,用于相互区分癌症样本和正常样本的边界线的参数值是示例性的,并且可以根据分析条件而变化。
[0267]
还发现可以通过参数1和2的二维分析预测恶性黑色素瘤疾病的分期。特别是对i、ii、iv期恶性黑色素瘤患者样本的分析结果表明,参数1的值随病情发展成比例增加。值得注意的是,i期和ii期黑色素瘤癌症样本的参数1值分布在正常样本的值范围内,但癌症样
本的参数2值高于正常样本的值范围。认为这些结果是因为调节参数2值的cav1标志物在癌症发展的早期阶段参与肿瘤抑制并高度表达。因此,认为参数1和2的二维分析允许预测恶性黑色素瘤的阶段并能够早期诊断早期癌症。总之,外泌体亚群中与特定癌症疾病相关的多种标志物的选择和分析有助于解决在晚期或转移阶段诊断癌症的问题。
[0268]
图35显示当新定义的参数应用于生物标志物分析时,从正常和恶性黑色素瘤患者组的外泌体亚群样本中分离出的亚亚群的生物标志物分析结果的二维参数分析的总体结果。对于外泌体亚亚群的分析结果,除了参数1和2的二维分析(参见图35左侧)之外,还进行参数1和3(参见图35中间)和参数2和3(参见图35的右侧)的二维分析。参数1和3的二维分析(参见图35中间)揭示正常样本和恶性黑色素瘤样本分布在图中,没有相互区分。因此,认为参数1和3的分析无法区分正常样本和恶性黑色素瘤样本。相比之下,参数2和3的分析(参见图35的右侧)表明可以区分正常样本和恶性黑色素瘤样本。正常样本分布在由两个参数值(参数2《约0.7;参数3《约2.5)定义的有限区域内(参见图中虚线定义的边界),恶性黑色素瘤样本分布在边界上或边界外。总之,通过外泌体亚亚群分析对参数2和3进行二维分析使其可以区分恶性黑色素瘤样本和正常样本。
[0269]
4.3参数面板结构
[0270]
为了最大限度地提高对目标疾病的诊断敏感性和特异性,由两个或更多个参数组成的面板用于疾病的早期诊断。具体地,以与上述相同的方式对参数对进行二维分析。选择一对参数,以提供最大能力区分目标疾病的阴性和阳性样本。所选参数对用于构建参数面板。如有必要,将一个或多个参数依次应用于初步构建的参数面板,以确定能够以最大准确度区分阴性和阳性样本的最终参数面板。还确定使用最终参数面板的诊断算法。
[0271]
图36显示当新定义的参数应用于生物标志物分析时,来自正常和前列腺癌患者组的外泌体亚群样本中外泌体亚亚群的生物标志物分析结果的二维参数分析的总体结果。对于前列腺癌,cd151用作另外的外泌体表面标志物。以与上述相同的方式使用总共五种生物标志物(cd9、cd81、cav1、存活蛋白和cd151)对cd63+外泌体亚群样本进行分析。与上述类似,归一化参数4、5、6和7是通过采用来自实现最大临床性能的任何两种生物标志物的信号之间的比率新定义的(样本总数=28;阳性=20,阴性=8)。此处,参数4至7分别设置为“来自cd9的信号/来自cav1的信号”、“来自cd151的信号/来自cd9的信号”、“来自存活蛋白的信号/来自cd9的信号”和“来自cav1的信号/来自cd81的信号”。
[0272]
首先,对前列腺癌和正常样本亚群免疫分离和回收后外泌体亚亚群的分析结果进行参数4和5的二维分析。作为参数4和5的二维分析结果(参见图36的顶部),发现大部分正常样本分布在由测试条件下的这两个参数值(参数4《约3.3;参数5《约1.5)定义的有限区域内(参见图中虚线定义的边界),并且发现大多数前列腺癌样本分布在边界外。当使用这两个参数时,在分析条件下,阳性准确度(即敏感度)为80%,阴性准确度(即特异性)为100%。
[0273]
对位于上述边界内的前列腺癌阳性样本(p7、p10、p13和p18),即假阴性样本,进行精确重新分析(参见图36的底部)。当使用两个参数(即参数4和5)时,临床敏感度限制为80%(参见图36的底部左侧)。当对参数4和另外的参数6(共三个参数)进行二维分析时,阴性样本保留在阴性区域内,但有一个(p13)阳性样本转移至阳性区域(参见图36的底部中间)。结果,敏感度提高至85%。当对参数6和另外的参数7(共4个参数)进行二维分析时,阴性样本保留在阴性区域内,但阳性样本的p7和p18转移至阳性区域(参见图36的底部右侧)。
结果,临床敏感度增加至95%。前列腺癌样本的最终临床性能得到改善(敏感度为95%,特异性为100%)。
[0274]
此外,参数4和5的二维分析已显示能预测前列腺癌的分期。特别地,从根据临床判断标准设定的前列腺癌分期编号(样本编号旁边括号中的罗马数字)对患者样本的分析结果可以看出(参见图36顶部),9份前列腺癌-阳性样本分布在由边界线定义的右下角。其中,9份样本中有8份呈ⅰ、ⅱ期阳性,其余1份呈ⅳ期阳性。另一组的7份前列腺癌阳性样本分布在由边界线定义的左上角。其中,7份样本中有5份呈ⅲ、ⅳ期阳性,其余2份呈ⅰ、ⅱ期阳性。随着阶段的推进,每个样本与参数4的值成反比减少,与参数5的值成正比增加(参见图36中的箭头)。值得注意的是,早期前列腺癌样本(i期和ii期样本)分布在右下角,即参数4值特别高而参数5值低的区域内。因此,认为两种或更多种归一化生物标志物的连续二维分析不仅有助于预测前列腺癌的分期,而且还能够对早期癌症进行早期诊断。
[0275]
5.实施例4:外泌体mirna生物标志物的分析
[0276]
5.1细胞系培养和外泌体样本制备
[0277]
选择并培养du145、lncap和pc3细胞系,它们是通常已知的源自前列腺癌的细胞系。收获每种培养物以制备外泌体总体样本,如在上述临床样本制备中那样。如上所述,基于“开关样可逆结合反应”从外泌体群体制备cd63+亚群外泌体样本。使用固定有抗cd81抗体的磁珠,通过磁性免疫分离从cd63+亚群外泌体依次制备cd63+/cd81+亚亚群样本。选择hek293(源自肾细胞的细胞系)作为对照,并以与上述相同的方式制备群体、亚群和亚亚群外泌体样本。
[0278]
更具体地,人胚胎肾衍生细胞系hek293和前列腺癌衍生细胞系lncap、du145和pc3购自korea cell line bank(seoul,korea)。将每个细胞系在补充有10%胎牛血清(fbs)和抗生素的最佳培养基中在co2培养箱中培养34-39小时。培养基是补充有用于hek293的hepes的dmem或用于前列腺癌衍生细胞系的rpmi 1640培养基。此后,将培养基更换为补充有5%无外泌体fbs的培养基,并在相同条件下进行培养。通过离心将细胞与培养物分离并收集上清液。对上清液进行低速离心以去除沉淀物,随后进行高速离心以去除沉淀物,如在上述临床样本的预处理中那样。所得上清液通过hm注射器过滤器(0.2μm孔径)过滤以制备外泌体群体样本。
[0279]
cd63+亚群外泌体样本以与实施例1相同方式通过免疫磁分离从外泌体群体中制备的。按照磁珠制造商提供的方案,将抗cd81抗体化学固定在磁珠上。cd63+/cd81+亚群样本通过免疫磁分离使用化学固定有抗cd81抗体的磁珠从cd63+外泌体亚群制备。
[0280]
5.2外泌体mirna提取、cdna合成和实时pcr
[0281]
选择四种类型的前列腺癌相关mirna,即mir-17、mir-21、mir-221和mir-375作为靶核酸生物标志物。从每个外泌体样本中提取mirna标志物后,通过逆转录合成cdna。通过聚合酶链反应扩增产物。对于每个样本,循环阈值(ct)值灵敏地测量为信号。整个程序使用商购可得试剂盒进行。对于归一化,计算来自两个mirna标志物的信号的比率,即“来自mir-21的信号/来自mir-17的信号”、“来自mir-221的信号/来自mir-17的信号”和“来自mir-375的信号/来自mir-17'的信号”的比率。
[0282]
具体而言,为每个细胞系制备三种类型的外泌体样本(即群体、亚群体和亚亚群样本),并使用mirneasy micro kit(qiagen,217084)从样本中提取mirna。每个步骤都根据制
造商的说明进行。使用分光光度计(nd-2000;nanodrop technologies,wilmington,de,usa)对提取的mirna进行定量。接着,根据制造商的说明,使用taqman advanced mirna cdna合成试剂盒(applied biosystems,grand island,ny,usa)在15μl反应体积规模上对从外泌体样本中提取的mirna(2ng)进行逆转录。此后,进行mirna扩增并定量进行实时pcr。使用taqman microrna检测试剂盒(applied biosystems)对目标mirna(mir-17、mir-21、mir-221和mir-375)进行定量pcr。使用cfx 384(bio-rad laboratories,ca,usa)进行定量。重复测量每个样本中的mirna。将每个ct值归一化为mir-17,并根据作为对照的hek293细胞系的外泌体群体中的信号比进行缩放,基于此计算倍数变化。
[0283]
5.3样本中外泌体mirna生物标志物的分析
[0284]
对于从每个细胞系制备的外泌体群体、亚群和亚亚群样本,监测上述三种类型mirna之间信号比的变化。图37显示前列腺癌衍生细胞系培养物的外泌体群体、cd63+亚群和cd63+/cd81+亚亚群样本中存在的前列腺癌mirna生物标志物的分析结果。为了便于比较,所有信号比都相对于作为对照的hek293细胞系外泌体群体中的每个信号比进行缩放,基于此计算倍数变化并作图。
[0285]
首先,基于来自对照细胞系hek293的那些样本,来自所有三种前列腺癌细胞系的外泌体群体和亚群样本显示出显著增加的mir-21/mir-17信号比,即倍数变化(参见图37的顶部)。然而,在亚亚群样本中未增加或检测到mir-21/mir-17信号比。特别地,在来自du145细胞系的样本中倍数增加明显,表明与mir-21生物标志物的特定关联。作为另一个特定特征,未在来自所有选定细胞系的cd63+/cd81+亚亚群外泌体中测量mir-21。因此,预测用于免疫分离的外泌体亚亚群表面标志物与外泌体中存在的mirna之间存在负相关。
[0286]
接着,du145细胞系样本中的mir-221/mir-17信号比与对照细胞系群体中的那些信号比相似,而与外泌体群体无关(参见图37的中间)。lncap和pc3细胞系的群体和亚群体中的信号比没有显示出显著的倍数增加。然而,在来自lncap和pc3细胞系的亚亚群外泌体中倍数增加明显。这些结果与mir-21/mir-17信号比的结果相反,表明外泌体亚亚群表面标志物与外泌体中存在的mirna之间成比例关联。
[0287]
最后,对于mir-375/mir-17信号比(参见图37的底部),在来自du145和lncap的所有外泌体样本中没有观察到倍数增加,就如在来自对照的样本中那样。相比之下,在来自pc3细胞系的样本中观察到倍数增加。特别地,在亚亚群样本中观察到显著的倍数增加。由于pc3细胞系来源于恶性程度相对较高的前列腺癌,因此预测存在于cd63+/cd81+亚群外泌体中的mir-375可用作与癌症进展相关的标志物。因此,使用外泌体亚亚群作为特定mirna的分析样本期望帮助根据细胞类型选择特定的生物标志物。
[0288]
总而言之,根据本发明,当与诸如恶性黑色素瘤和前列腺癌等癌症疾病相关的外泌体亚亚群中存在的蛋白质和mirna选择为生物标志物并转化为归一化参数用于分析时,可以区分对于癌症疾病呈阴性和阳性的样本,可早期诊断癌症疾病。根据本发明,预测用于诊断或其组合的有效参数根据癌症疾病的类型而变化。作为参考,由于图35和图26中用于区分癌症疾病呈阴性和阳性的样本的参数值可能因分析条件而异,因此它们没有绝对意义。通过参数的二维(在某些情况下,一维)分析获得的图中癌症样本相对于正常样本的分布是有意义的。
[0289]
虽然本文结合具体实施方案对本发明进行描述,但这些实施方案并不用于限制本
发明,仅为说明目的而提出。对本领域技术人员来说将明显的是,可以在不脱离本发明的精神和范围的情况下进行修改和改进。
[0290]
对本发明的这种简单的修改和改进,均属于本发明的范围,本发明的具体范围将由所附权利要求明确定义。
[0291]
工业实用性
[0292]
根据本发明,体液中含有与特定疾病相关的外泌体的亚群、亚亚群或其子集可以高产率地分离和完整回收以制备液体活检样本,并且可以分析液体活检样本。因此,本发明可应用于各种工业领域,包括体外诊断、治疗开发和美容行业。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1