杯芳烃化合物及其用途
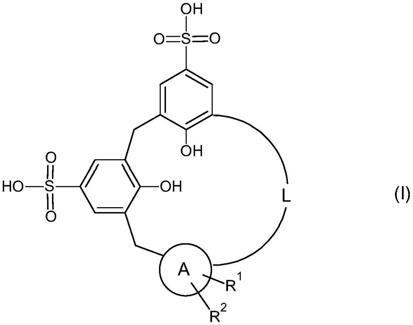
1.本发明涉及通式(i)的新型化合物
[0002][0003]
其中,元件a、l、r1和r2具有在说明书和权利要求书、制备这些化合物的方法及其作为药物的用途或其他用途中给出的含义。
背景技术:
[0004]
炎症过程具有病因多样化的特点,针对炎症过程的治疗已有几种成熟策略,例如类固醇(皮质类固醇或糖皮质激素疗法是其中最有效和最广泛使用的方法之一)。这些治疗策略已在多个疾病领域取得了巨大成功(例如,治疗炎症和自身免疫疾病,例如类风湿性关节炎、哮喘、溃疡性结肠炎、克罗恩病(chron’s disease)等)。目前,通过类固醇疗法治疗的大多数疾病尚无法治愈,因此通常需要长期、慢性的治疗。尽管糖皮质激素疗法在临床上取得了巨大成功,但尚还无法满足替代干预策略的医疗需求,主要是由于糖皮质激素疗法会出现不同严重程度的副作用,从而阻碍了长期治疗。长期使用最佳疗效剂量的皮质类固醇的副作用包括高血糖、肌肉萎缩、高血压、骨质疏松和神经症状。
[0005]
糖皮质激素的作用模式是通过激活受体,使得核易位和基因转录调节,从而刺激或抑制靶基因的表达。糖皮质激素的抗炎作用机制是通过一种被称为反式抑制的机制抑制主要的促炎性基因产物,如通过nf-kb转录因子抑制tnfα和il-6。糖皮质激素也会影响参与不良反应的基因的表达。迄今为止,以糖皮质激素受体激动剂为基础分离基因表达的有益和有害调控的新药研发活动尚未取得成功。
[0006]
satish balasaheb nimse和taison kim(chem.soc.rev.2013(42):366-386)描述了功能化杯芳烃在抗病毒、抗菌、抗真菌、抗结核和抗癌活性中的生物学应用。
[0007]
yousaf等人(drug des devel ther.2015(9):2831-8)公开了杯芳烃的抗癌潜力及其载药特性。
[0008]
us 5,489,612公开了杯芳烃衍生物、其合成物及其作为氯通道阻滞剂的用途。更
准确地说,us 5,489,612中公开了几种化合物在治疗呼吸系统疾病、骨骼肌疾病和心血管疾病中的用途。
[0009]
wo 00/07585公开了杯芳烃在治疗纤维化疾病中的用途。
[0010]
wo 2017093363公开了一种用于治疗神经退行性疾病的4-磺酰杯[4]芳烃钠盐的用途。
[0011]
wo 9403165a1公开了杯[n]芳烃衍生化合物的抗血栓治疗。
[0012]
hall等人(metal-based drugs 1998,5(2):67-75)公开了具有防止lps诱导的休克、调节性细胞因子(tnfα和il-1)的释放、炎症靶细胞与受体结合,以及阻断弹性蛋白酶和环氧合酶活性及细胞粘附作用的f-多酚磺化化合物。
[0013]
pinhal等人(thrombosis research 2001,103(1):35-45)描述了一种环八酚-八磺酸及其甲基化衍生物和乙酰化衍生物及其对内皮细胞分泌的硫酸乙酰肝素蛋白多糖的合成的影响。
[0014]
tyrrell等人(trends in pharmacological scien,elsevier,haywarth,gb,1995,16(6):198-204)公开了肝素除作为抗凝剂作用之外的治疗用途。
[0015]
rodik等人(current medicinal chemistry 2009,16:1630-1655)公开了杯[n]芳烃衍生化合物,这些衍生化合物为酶模拟物、受体、酶、抗体和酶抑制剂的模拟物、膜活性杯芳烃和具有生物活性的化合物及其在dna转染和磁共振成像中的用途。
[0016]
需要新的抗炎化合物和新的鉴别此类化合物的方法。本发明的另一个目的是提供新化合物,这些新化合物具有在体外和体内模拟糖皮质激素或硫酸乙酰肝素的作用,并且具有适用的药理学和/或药代动力学性质,以使其能够用作药物。
技术实现要素:
[0017]
本发明的目的是提供具有抗炎特性的新化合物,以及抗炎制剂。该目的通过本权利要求书的主题解决,本文中将做进一步描述。
[0018]
令人惊奇地发现,在通式(i)的化合物中,元件a、l、r1和r2作为特定抗炎化合物具有以下含义。更令人惊奇的是,此类化合物可用于抗炎、抗氧化、抗衰老或脂质代谢调控的治疗或预防。这一系列化合物(包括先前描述用于治疗神经退行性疾病的4-磺酰杯[4]芳烃)的作用模式出乎意料地使其可应用于新的医疗、化妆品或营养用途。
[0019]
通过以下对本发明实施方案的详细描述,本发明的各种目的、特征、方面和优点将变得更加明显。
[0020]
实施方案的描述
[0021]
本发明涉及包含通式(i)化合物的制剂:
[0022][0023]
其中
[0024]
a选自芳基、5-12元杂芳基、c
3-10
环烷基、3-8元杂环烷基,和
[0025]
l为选自于任选取代的c
1-6-烷基和
–
(ch2)
n-o-(ch2)
m-,或式(ii)化合物的键或连接基(linker),
[0026][0027]
其中
[0028]
b选自芳基、5-12元杂芳基、c
3-10
环烷基、3-8元杂环烷基,和
[0029]
r1和r3彼此独立地选自由氢、卤素、-ora和-nrara组成的组,
[0030]
r2和r4彼此独立地选自由氢、卤素、-so3ra、-ora和-coora组成的组,以及
[0031]
每个ra是氢或c
1-3
烷基,
[0032]
n和m彼此独立地表示0、1或2;
[0033]
任选地呈药学上可接受的盐、对映异构体、外消旋体及其混合物的形式。
[0034]
本文中所描述的化合物可以以其药学上可接受的盐、对映异构体、外消旋体及其混合物的形式提供。因此,本文中进一步描述的术语“化合物”或“本发明的化合物”应指由结构式确定的任何形式、药学上可接受的盐、对映异构体、外消旋体及其混合物。
[0035]
令人惊奇的是,此类化合物具有抗炎、抗氧化、抗衰老或脂质代谢调控的特性。
[0036]
令人惊奇地发现,在通式(i)的化合物中,元件a、l、r1和r2具有本文中进一步描述的含义,条件是该化合物不是5,11,17,23-磺酸基-25,26,27,28-四羟基杯[4]芳烃(4-磺酰杯[4]芳烃,本文中也称为sca-744),可将其作为具有本文中进一步描述的性质的新化合物(或其医药上可接受的盐)进行提供。
[0037]
本发明的一个实施方案涉及如本文中所描述的化合物,其中,l为式(ii)的化合物。
[0038]
本发明的一个实施方案涉及如本文中所描述的化合物,其中,l为由(-ch2-)n组成的连接基,其中n=1、2、3、4、5;或(-cf2-)n,其中n=1、2、3、4、5;或(-ch
2-o-ch
2-)n,其中n=
1、2、3、4。
[0039]
在一个具体方面,杂芳基为n-杂环或o-杂环,任选地,五元或六元n-杂环,或者五元或六元o-杂环。
[0040]
在一个具体方面,卤素为f、cl或br中的任意一个。
[0041]
本发明的一个实施方案涉及如本文中所描述的化合物,其中,a和b彼此独立地表示苯基。
[0042]
本发明的一个实施方案涉及如本文中所描述的化合物,其中,ra表示h。
[0043]
本发明的一个实施方案涉及如本文中所描述的化合物,其中,每个ch2基团氘化(cd2)。
[0044]
本发明的一个实施方案涉及如本文中所描述的化合物,其中,l为式(ii)的化合物,并且a和b彼此独立地选自5-6-元n-杂环或6元苯环,且r2和r4中的每一个都是-cooh。
[0045]
本发明的一个实施方案涉及具有不同(-ch2-)连接区段的3-磺酰杯[3]芳烃的化合物,例如,如本文中所描述的化合物,其中,l为由(-ch2-)n组成的连接基,其中n=1、2、3、4、5;a表示苯,r1和r3中的每一个都是-ora;r2和r4中的每一个都是-so3ra,具体地,其中ra为氢。
[0046]
一个实施方案涉及化合物,其特征在于具有以下一个或多个特征:
[0047]
a)a为苯基(任选地被取代);
[0048]
b)b为苯基(任选地被取代)、吡嗪、吡啶或吡咯;
[0049]
c)r1和/或r3是-h或-oh;
[0050]
d)r2和/或r4是-so3h。
[0051]
杯芳烃(calixarene)通常定义为基于苯酚和甲醛的羟烷基化反应产物的大环或环状低聚物。杯芳烃的特点在于呈三维篮状、杯状或桶状。杯[4]芳烃的苯酚环单元数为4,而杯[3]芳烃的苯酚环单元数为3。杯芳烃环在本文中也称为“主链(backbone)”。
[0052]
所述环可由相同或不同的重复单元和任选的连接元件组成,例如,如本文中的进一步描述,其中,连接基为l,具体为线性连接基。除式(ii)化合物外,本文中的任何连接基l也称为“线性连接基”或“线性l”。在具体实施方案中,l为线性连接基,如(-ch2-)连接区段,例如,其中的l是由(-ch2-)n组成的线性连接基,其中n=1、2、3、4、5,具体地,其中的l为ch2(“亚甲基桥”)。
[0053]
在具体实施方案中,杯芳烃环包括四个通过线性l连接的相同重复单元或由四个通过线性l连接的相同重复单元组成,具体地,其中l为ch2。
[0054]
在具体实施方案中,杯芳烃环包括通过线性l连接的三个相同的重复单元和第四个单元或由通过线性l连接的三个相同的重复单元和第四个单元组成,具体地,其中l为ch2,并且其中第四单元不同于重复单元且由式(ii)组成。
[0055]
在杯[4]芳烃中,内体积约为10立方埃。杯芳烃的特点为上边缘宽、下边缘窄且具有中心环。其以苯酚为起始原料,下缘的4个羟基在环内。
[0056]
具体实施方案涉及如本文中所描述的化合物(或其对映异构体或药学上可接受的盐),其包含由两个相同元素组成的杯芳烃主链,每个元素均为连接有磺酸基团的苯基(如式(i)中所示),以及两个其他元素,每个元素均为如本文中进一步描述的五元和/或六元环元素,从而获得由四个环元素组成的杯芳烃主链。或者,杯芳烃主链可由三个环元素组成,
每个环元素均为五元和/或六元环系统,其中它们中的至少两个为相同的元素,每个元素均为连接有磺酸基团的苯基(如式(i)所示),其通过特定的线性连接基连接,如本文中的进一步描述。
[0057]
具体实施方案涉及不对称的杯芳烃,其由不同的元素组成,例如,取代的苯酚重复单元和至少一个不同于重复单元的取代的苯酚单元。在根据一个具体实施方案,不对称杯芳烃化合物包含或由两个或三个通过亚甲基桥连接的对位磺化苯酚单元和一个或两个各自独立地不同于对位磺化苯酚单元的对位取代苯酚单元组成。不对称杯芳烃是由通过连接(例如亚甲基桥或其他连接基)彼此连接形成环状结构的元素组成的大环化合物,其具体特征在于至少一种元素不同于任何一个或多个其他元素。
[0058]
具体实施方案涉及通过2+1片段缩合获得的3-磺酰杯[3]芳烃(例如,包含由三个亚甲基桥接环元素和线性连接基组成的杯芳烃主链),或者通过3+1片段缩合获得的4-磺酰杯[4]芳烃(例如,包含由四个亚甲基桥接环元素组成的杯芳烃主链)。
[0059]
具体实施方案涉及3-磺酰杯[3]芳烃,具体涉及通过2+1片段缩合获得的3-磺酰杯[3]芳烃。
[0060]
具体实施方案涉及4-磺酰杯[4]芳烃,具体涉及通过2+2或3+1片段缩合获得的4-磺酰杯[4]芳烃。
[0061]
具体实施方案涉及式(iii)的4-磺酰杯[4]芳烃及其药学上可接受的盐(例如钠盐)以及4-磺酰杯[4]芳烃的对映异构体或衍生物的新型用途。
[0062]
式(iii):
[0063][0064]
具体实施方案涉及选自下表的化合物(或任何此类化合物的药学上可接受的盐)。式(iv)和式(v)显示了所用的命名规范。
[0065]
式(iv):
[0066][0067]
式(v):
[0068][0069]
表:优选的化合物
[0070]
[0071]
[0072]
[0073]
[0074][0075]
本文中所描述的化合物应理解为包含杯芳烃环。
[0076]
在疾病中的作用
[0077]
本文中所描述的化合物(或其药学上可接受的盐)具有作为治疗(治疗或预防)抗炎性疾病、抗氧化疾病、抗衰老疾病、神经退行性疾病或脂质代谢疾病的新药的潜力。这包括目前使用糖皮质激素治疗的疾病(例如类风湿性关节炎、炎症性肠病、骨关节炎、哮喘、自身免疫性疾病)。所述化合物或其药学上可接受的盐具有替代或辅助现有糖皮质激素治疗的潜力。尤其是,研究已表明sca-744和sca-745会影响与参与糖皮质激素(皮质醇)抗炎作用的通路重叠的抗炎通路,但不会影响糖皮质激素副作用相关的某些代谢通路。
[0078]
此外,研究表明sca-744能够抑制促炎性基因产物,例如il-1β、tnfα和il-6,与皮质醇类似,即使在非败血症模型中也是如此。大多数受皮质醇和所述化合物影响的代谢通路都是共享的。然而,受皮质醇影响并与其副作用相关的几种代谢通路不受所述化合物的调控(例如糖代谢通路和神经递质失活通路)。此外,所述化合物可激发多种有益效果,例如有效的抗氧化及细胞保护反应,而这些有益效果并非由皮质醇诱发。因此,sca-744是一种潜在的新型抗炎药候选产品,在抗氧化应激反应、脂质代谢的有利变化和激活抗衰老基因方面具有额外活性。
[0079]
硫酸乙酰肝素模拟
[0080]
sca-744的一种潜在机制是通过模拟硫酸乙酰肝素(hs)并与hs相互作用的分子结合。硫酸乙酰肝素模拟物包括能够执行硫酸乙酰肝素的至少一种生物功能的任何分子。先前的数据表明,硫酸乙酰肝素模拟物要求结构具有高度特异性,以维持细胞活力和内环境
稳定(ziolkowski et al.;journal of clinical investigation 2012,122(1),pp.132
–
141)。可以确定的是,除当前临床应用的肝素(一种硫酸乙酰肝素模拟物)外,作为hs活性模拟物的化合物也可用于临床应用。
[0081]
硫酸乙酰肝素是一种与蛋白质共价结合并在大多数细胞表面形成硫酸乙酰肝素蛋白聚糖(hspg)的糖胺聚糖。硫酸乙酰肝素是细胞外基质(ecm)的重要组成部分,其中,hs与多种分子结合,包括生长因子、细胞因子和趋化因子、酶和酶抑制剂,并可促进或抑制其活性。人们还发现hs有助于受体复合物的形成。硫酸乙酰肝素结合蛋白(hsbp)是在正常生理条件下与细胞外蛋白聚糖的硫酸乙酰肝素链相互作用的蛋白质。hsbp包括血浆蛋白、细胞外基质成分、细胞表面蛋白,以及主要生长因子和信号蛋白家族的成员,包括wnt、刺猬蛋白(hedgehog)、骨桥蛋白、成纤维细胞生长因子和血管内皮生长因子家族(billings and pacifici,connect tissue res.2015,56(4),pp.272
–
280)。
[0082]
ecm是由胶原蛋白、蛋白聚糖/糖胺聚糖(gag)、弹性蛋白、纤连蛋白、层粘蛋白及其他几种具有感官和机械特性的糖蛋白组成的大分子和聚合物的多维网络。ecm组分相互结合,形成微环境,并与细胞粘附受体结合,形成一个复杂的网络,其中,细胞存在于细胞和大分子的多维系统中的所有组织和器官中。这种环境是细胞行为和组织稳态的基础,在维持和控制细胞结构和功能(例如生存、生长、激活、迁移和分化)方面起着至关重要的作用。ecm可以直接结合不同类型的细胞表面受体或共受体,从而介导细胞的锚定并调控参与细胞内信号传导和机械传导的多个通路。蛋白聚糖是ecm中重要的结构和功能性生物大分子。ecm组分和结构的失调与多种病理状况的发展和进展有关,其中一些机制与hs和hspg在ecm中的作用有关(theocharis et al.advanced drug delivery reviews 2016,97:4-27)。
[0083]
hs在炎症中的作用
[0084]
hs在炎症中的作用已得到充分研究(collins and troeberg;journal of leukocyte biology 2018,105(1),pp.81-92)。一方面,hs与各种趋化因子结合,从而使其集中在细胞表面,形成一个梯度,以将白细胞吸引到炎症部位。另一方面,细胞因子与ecm hs结合被认为是一种将细胞因子集中在其作用部位附近,保护其免受蛋白水解降解并形成特定细胞因子储存库的机制。除通过与趋化因子和细胞因子相互作用在炎症中发挥作用外,研究表明hs的可溶性片段还可通过固有模式识别受体tlr4直接发出信号。ecm hs的另一个拟定机制是通过乙酰肝素酶的活性在炎症和疾病中发挥作用。乙酰肝素酶是一种b-d-葡萄糖醛酸内切酶,可裂解hs,促进ecm降解并释放hs结合的生物分子,例如,包括某些细胞因子。
[0085]
hs还通过其与hsbp和骨桥蛋白(opn)的相互作用参与炎症。opn是一种分泌的、富含唾液酸的趋化因子样蛋白,是sibling(小整合素结合配体n端联结糖蛋白)家族的成员。我们组之前的工作通过溶液核磁共振(nmr)显示了hs与opn的结合位点。这项工作表明肝素结合位点映射到了包含rgd基序的opn的中心整合素结合域。骨桥蛋白被证明可介导多种功能,通过与整合素的相互作用及其作为th1细胞因子的作用参与慢性炎。此外,骨桥蛋白也是生物矿化调节器。
[0086]
因此,hs模拟物在通过改变hs/hspg与其结合蛋白之间的相互作用来调控炎症过程方面具有很大的潜力。
[0087]
如果通过以下标准检测法测定化合物能够在lps刺激后减少人thp-1巨噬细胞中
il-1β、il-6和tnfα中的一种的产生,则可证明所述化合物具有特异性抗炎作用或活性:用100nm佛波醇12-十四酸酯13-乙酸酯(pma)处理thp-1人单核细胞48h,以诱导成熟的巨噬细胞样状态。然后在不存在和存在500μm化合物的情况下,用100ng/ml lps刺激细胞。6h后,收集处理和未处理细胞的上清液,并使用人类炎症面板legendplex人体促炎趋化因子面板(货号:740118)测定细胞因子水平。如果所述化合物能够减少或阻断lps刺激后人thp-1巨噬细胞中il-1β、il-6和tnfα的产生,则认为结果为阳性。
[0088]
hs在神经退行性疾病中的作用
[0089]
蛋白质积聚导致许多神经退行性疾病。虽然蛋白质的积聚因疾病而有所不同,但其均表现出相似的结构,包括富含β-折叠结构,形成淀粉样原纤维。这些原纤维通过自动催化(称为“加种”)和疾病传播触发单体蛋白质进一步掺入到原纤维中。hs已被证明在神经退行性疾病的发病机制中起着多方面的作用,包括但不限于tau蛋白病(taupathies)(阿尔茨海默病(ad)、进行性核上性麻痹(progressive supranuclear palsy)(psp)和匹克氏病(pick’s disease))(naini and soussi-yanicostas.front cell dev biol.2018;6:163)、帕金森病、路易体痴呆(lewy body dementia)、肌萎缩侧索硬化症(als)和朊病毒疾病(maiza et al,febs letters 2018;592:3806-3818)。在神经退行性疾病(例如唐氏综合征相关的痴呆和阿尔茨海默病)的早期阶段,通常会观察到hspg异常积聚,所有研究的细胞外淀粉样蛋白均显示含有hs(如阿尔茨海默病中的β淀粉样蛋白斑(aβ)和神经原纤维缠结(nft))(snow et al.lab invest.1987;56:120-3)。这种相互作用可能是由hs中带负电荷的基团与淀粉样蛋白中带正电荷的氨基酸引发,从而导致纤维的形成和聚集体的稳定。
[0090]
在tau蛋白病中,肝素也显示出可通过不同的蛋白激酶增强tau蛋白的磷酸化,从而导致tau蛋白过度磷酸化(可能通过诱导构象变化,从而暴露先前被掩盖的tau蛋白的磷酸化位点)。重要的是,细胞表面的hs还充当β淀粉样蛋白斑(aβ)和tau蛋白积聚的受体并增强细胞内化。总之,hs可能在tau蛋白病的发生和传播中发挥作用,也可能在限制痴呆易感区域的再生潜力方面发挥作用,因此,通过hs类似物靶向hs和hspg并阻断其在tau蛋白病中的功能具有预防、治疗或逆转疾病的潜力。
[0091]
在帕金森病发病机制中,研究表明α-突触核蛋白(呈淀粉样原纤维的形式)的内化依赖于于hspg,而hs在少突胶质细胞的接种过程中起着重要作用(ihse et al.scientific reports;2017,7:9008;doi:10.1038/s41598-017-08720-5)。因此,通过hs类似物干扰hspg与α-突触核蛋白的相互作用对该疾病具有潜在的有益作用。
[0092]
虽然参与als发病的确切机制尚未完全清楚,但研究已表明hspg参与将分泌的i型nrg1集中到某些区域(由于nrg1上的特定hs结合位点),并可能导致信号异常转导(song et al.journal of neuropathol exp neurol.2012;71:104
–
115)。
[0093]
hs在脂质代谢中的作用
[0094]
已证明与hs和hspg的相互作用可调节刺猬(hh)蛋白在靶细胞和组织上的分布与作用。hh信号对发育、增殖和干细胞维持至关重要。hh蛋白是一种分泌型配体,可在发育中的细胞和成体组织的细胞之间进行远距离通信。脂质代谢对刺猬信号转导(transduction)和配体本身的性质都有深远的影响,从而导致hh信号转导强度和细胞功能改变。脂质代谢与hh信号之间的联系与ldl受体(ldlr)和insig1表达有关(ali et al.arthritis rheumatol.2016jan;68(1):127
–
137)。与hh信号转导相关的hspg通常具有由多配体蛋白聚
糖3或磷脂酰肌醇蛋白聚糖组成的蛋白核心。这些大分子通常通过跨膜结构域或gpi锚定蛋白附着在细胞质膜上。hh通过在其n端发现的高度保守的cardin weintraub序列与hspg相互作用,在hspg的带负电荷的硫酸盐和hh的之间产生静电相互作用。已发现hspg还会与其他细胞外基质因子相互作用,这些因子介导与hh的相互作用,例如,显热因子(shf)和大点状结构中携带的脂质修饰的hh(farzan et al.american journal of physiology-gastrointestinal and liver physiology 2008,294(4),pp.g844
–
g849)。通过调节hh信号,hs也可在改变脂质代谢方面发挥作用。因此,hs模拟物有可能通过改变参与胆固醇代谢的hh调节蛋白来降低血脂水平。
[0095]
此外,hs通过与脂蛋白脂肪酶以及成纤维细胞生长因子(fgf-2)和血小板衍生生长因子(pdgf)等生长因子相互作用在动脉粥样硬化发展中起着多种作用。
[0096]
如果通过以下标准检测法测定化合物能够增加哺乳动物细胞中ldlr蛋白的表达,则证明所述化合物具有特定的脂质代谢调节作用或活性:
[0097]
如果在经50、100和500μm受试化合物处理后,所述化合物能够增加哺乳动物细胞提取物中ldlr蛋白的表达,则证明所述化合物具有特定的脂质代谢调节作用或活性。ldlr的表达水平通过共聚焦激光扫描显微镜和免疫印迹分析法测定。通过ldl-r配对抗体(c7:sc-18823,圣克鲁斯生物技术公司)及alexafuor plus 488(a3273,英杰生命技术公司)的荧光信号估计全细胞成像和荧光强度。如果所述化合物能够在哺乳动物细胞提取物中诱导ldlr表达并通过共聚焦显微镜成像增加ldrr信号,则认为结果为阳性。
[0098]
hs在衰老性疾病中的作用
[0099]
研究表明,hs存在与年龄相关的改变与hsbp相互作用的结构变化(feyzi et al.,journal of biological chemistry 1998,273(22),pp.13395-13398)。这些变化可能与衰老的复杂发病机制有关。
[0100]
抗氧化和抗衰老的相关机制
[0101]
参与氧化应激反应的酶主要有三种:1、chac1(基因id:79094):谷胱甘肽特异性γ-谷氨酰环转移酶1),其与氧化应激和凋亡有关;2、nqo1(基因id:1728):nad(p)h脱氢酶[醌]1),其参与解毒通路;3、slc7a11(基因id:23657):半胱氨酸/谷氨酸转运体(xct/ccbr1),其产生还原形式的细胞外胱氨酸氧化还原电位(cyss)(半胱氨酸氧化的结果),独立于谷胱甘肽(gsh)系统。
[0102]
nqo1保护细胞免受氧化应激和有毒醌类物质的侵害。nqo1是哺乳动物系统中两种主要的醌氧化还原酶之一,可高度诱导,并可在细胞对压力的适应中发挥多种作用。nqo1存在于细胞质、高尔基复合体、细胞核、线粒体、细胞膜和内质网中。众所周知,线粒体是细胞凋亡的调控中心。线粒体膜电位的丧失对细胞来说是灾难性的,并且还会导致细胞色素c释放到细胞质中(weinberg&chandel,nature chemical biology 2015,11(1),pp.9
–
15)。
[0103]
nrf2可介导nqo1的强诱导。nrf2是一种碱性亮氨酸拉链(bzip)转录因子,可在细胞核内形成异二聚体,识别被称为抗氧化反应元件(are)的增强子序列。数项研究表明,nrf2通过are及其与nf-kβ通路之间的相互作用参与抗炎过程(ahmed et al.molecular basis of disease 2017,1863(2),pp.585
–
597)。通过增加mrna和蛋白表达和抑制nf-kβ信号通路及促炎性细胞因子激活nrf2,以诱导ho-1基因。此外,炎症与局部和全身活性氧(ros)病理水平的增加有关,ros可能会损害氧化还原信号,增加氧化应激反应。这种情况会
影响线粒体,使nadph氧化酶不受控制地激活,而nadph氧化酶正是炎症细胞中ros生成增多的主要因素。线粒体ros会导致线粒体dna(mtdna)受损并释放,从而形成一个恶性循环,进一步导致ros的产生和炎性小体的激活,最终致使器官衰弱(kovac et al.biochimica et biophysica acta.bba 2015,1850(4),pp.794
–
801)。nrf2会影响中间代谢,增加底物的可用性,减少线粒体呼吸链的当量,并维持线粒体dna的完整性(holmstrom,k.m.,baird,l.,zhang,y.,hargreaves,i.,chalasani,a.,land,j.m.,et al.(2013)..biology open,2(8),761
–
770)。增强nrf2和nqo1表达的药物和候选药物可发挥抗氧化作用并保护细胞免受氧化应激。
[0104]
chac1:谷胱甘肽特异性γ-谷氨酰环转移酶1在未折叠蛋白反应中发挥作用,调控谷胱甘肽水平和氧化平衡,并促进神经元分化。
[0105]
半胱氨酸/谷氨酸转运体独立于谷胱甘肽(gsh)系统,可导致细胞外胱氨酸氧化还原电位(cyss)(以半胱氨酸的氧化形式)减少。下调基因会促进铁死亡和衰老(zhang et al.nature cell biology 2018,pp.1
–
19)。
[0106]
此外,3β-羟基胆固醇-δ24还原酶(dhcr24)(基因id:1718)也称为seladin1(选择性阿尔茨海默病指示因子1),其通过在氧化应激和淀粉样蛋白β诱导的细胞凋亡过程中降低半胱天冬酶3的活性来保护细胞免受氧化应激。dhcr24还在胆固醇合成的最后一步中起催化作用,因此也参与了脂质代谢。
[0107]
据发现,ldlr(基因id:3949)、insig1(基因id:3638)和dhcr24/seladin-1(基因id:1718)的基因还可由本文中所描述的化合物,特别是sca-744所调控。
[0108]
如果通过以下标准检测法使用500μm(优选地,约3倍)化合物时可诱导哺乳动物细胞中nqo1的表达水平高于赋形剂处理的细胞,则可证明所述化合物具有特异性抗氧化作用或活性:半定量免疫印迹分析法。用赋形剂及50μm、100μm和500μm化合物处理hela细胞48小时,然后在triton x-100提取缓冲液(50mm hepes[ph值7.4]、140mm nacl、1%triton x-100、1mm edta、0.3mmdtt和complete
tm
蛋白酶抑制剂混合物)中溶解。转移至pvdf膜(bio-rad)后,在10%sds-page上分离25μg全细胞提取物,以标准的免疫印迹程序检测蛋白质。将膜与nqo1一级抗体(a-5:sc-271116,圣克鲁斯生物技术公司)的稀释液(1:200)和1:3000的羊抗小鼠抗体(igg hrp:sc-2005)一起孵育。内参对照采用gapdh抗体(0411:sc-47724)。nqo1的蛋白质信号强度相对于gapdh进行估算,当使用500μm化合物时,显示nqo1的信号增加量至少是赋形剂处理细胞信号的3倍。对于蛋白质水平的分析和定量,使用imagej的凝胶分析仪(美国国家卫生研究院:http://imagej.nih.gov/ij)。
[0109]
抗衰老过程
[0110]
慢性炎症、氧化应激和脂质代谢的不利变化是衰老的重要因素。上述机制均有助于该过程,并且改变这些过程组合的药物和候选药物可能具有成为抗衰老药物的潜力。
[0111]
nrf2(基因id:4780)是最具代表性的抗衰老基因之一,它是证明炎症与氧化应激和衰老之间关系的一个实例。nrf2是一种转录因子,可调节亲电反应元件和抗氧化剂的表达,以响应外部产生的或者在代谢或炎症过程中产生的活性氧水平的增加。激活剂(例如萝卜硫素(膳食化合物))和更有效的合成类似物正处于临床开发中。例如,雷帕霉素可延长所有受试生物体的寿命,抑制mtor并表现出可增加nrf2的转录。激活通常通过其在细胞质中的结合伙伴keap1进行。nrf2的激活涉及半衰期的增加并易位至细胞核,nrf2在此与目标基
因的启动子结合。
[0112]
如果通过以下标准检测法测定化合物可同时诱导以下基因nqo1、ldlr的表达并抑制促炎性趋化因子il-1β、il-6和tnfα,则可证明所述化合物具有特异性抗衰老作用或活性:半定量免疫印迹分析法。对于蛋白质水平的分析和定量,使用imagej的凝胶分析仪(美国国家卫生研究院:http://imagej.nih.gov/ij)。
[0113]
对于nqo1和ldlr的检测,用赋形剂及50μm、100μm和500μm化合物处理hela细胞48小时,然后在triton x-100提取缓冲液(50mm hepes[ph值7.4]、140mm nacl、1%triton x-100、1mm edta、0.3mmdtt和complete
tm
蛋白酶抑制剂混合物)中溶解。转移至pvdf膜(bio-rad)后,在10%sds-page上分离25μg全细胞提取物,以标准的免疫印迹程序检测蛋白质。将膜与nqo1(nqo1一级抗体(a-5:sc-271116,圣克鲁斯生物技术公司)或ldlr抗体(c7:sc-18823,圣克鲁斯生物技术公司)的稀释液(1:200)一起孵育,然后再与1:3000的羊抗小鼠抗体(igg hrp:sc-2005)一起孵育。内参对照采用gapdh抗体(0411:sc-47724)。相对于gapdh的估计表明,nqo1蛋白信号强度比内参对照增加至少3倍。同时,所述化合物须通过减少人thp-1巨噬细胞中的il-1β、il-6和tnfα才具有抗炎活性。用100nm佛波醇12-十四酸酯13-乙酸酯(pma)处理人单核细胞(thp-1)48h,以诱导成熟的巨噬细胞样状态。然后在不存在和存在500μm sca-744的情况下,用100ng/ml lps刺激细胞。6h后,收集处理和未处理细胞的上清液,并使用人类炎症面板legendplex人类促炎性趋化因子面板(货号:740118)测定细胞因子水平。
[0114]
医疗用途
[0115]
本发明设想了治疗(例如预防性治疗或治疗)人类或非人动物受试者的的一系列适应症,这些适应症可通过皮质类固醇、硫酸乙酰肝素或硫酸肝素中的任何一种或多种的特定模拟物进行治疗。具体地,选择一种化合物作为皮质类固醇、硫酸肝素或硫酸肝素中任何一种或多种的模拟物。
[0116]
本文中所用的关于治疗受试者的术语“治疗”是指以治愈、改善、稳定、降低发病率或预防疾病、病理状况或病症为目的对受试者进行医学管理,其单独或共同理解为“疾病症状”。该术语包括专门针对改善疾病症状的积极治疗、专门针对疾病症状预防的预防性治疗,并且还包括专门针对消除相关病症病因的病因治疗。此外,该术语包括旨在缓解症状而非治愈疾病症状的姑息治疗,以及旨在最小化或部分或完全抑制相关疾病症状发展从而对疾病症状所做的进一步治疗和用于补充另一种旨在改善相关疾病症状的特定疗法的支持性治疗。
[0117]
具体地,使用一种化合物,所述化合物
[0118]
a)降低一种或多种促炎性细胞因子的表达,所述促炎性细胞因子优选选自由il-1β、il-6、tnfα组成的组;或降低选自由ikzf1、gdf10、spock3、mmp1、il-1β、kcnma1、ccl7、aqp1、itih5、abi3bp和bmp5组成的组中的一个或多个促炎性基因的表达;
[0119]
b)增加一种或多种抗氧化基因的表达,所述抗氧化基因优选选自由chac1、slc7a11、nqo1、egr1、sgk1、slc6a9和dhcr24组成的组,优选nqo1;
[0120]
c)增加ldlr、id3、nqo1、slcga2或dhcr24中任何一种或多种的表达;或者
[0121]
d)调节参与胆固醇代谢的酶的表达,优选ldlr或dhcr24。
[0122]
具体地,本文中所描述的治疗包括向受试者施用有效量的化合物或其药学上可接
dystrophy)和湿疹。
[0140]
其他抗氧化应激疾病包括心肌梗死、中风、肝/肠缺血和动脉粥样硬化。
[0141]
其他衰老性疾病包括hutchinson-gilford早衰综合症和werner早衰综合征。
[0142]
其他适应症包括奥尔波特综合征(alport syndrome)、常染色体显性多囊肾病、iga肾病、1型糖尿病ckd、局灶节段性肾小球硬化、弗里德里希共济失调(friedreich’s ataxia)。
[0143]
本文使用的术语“受试者”是指任何动物,本文中优选包括任何哺乳动物,尤其是预期会对其进行诊断、筛查、监测或治疗的人类。受试者可能处于某种病状风险中,例如,患有病状的患者或者需要确定病状或病状风险的患者。本文使用的术语“患者”始终包括健康受试者。
[0144]
术语处于某种病状的“风险”中是指可能发展为此种病状的受试者,例如,具有某种倾向或已在不同阶段患有此种病状,包括先天性或后天性状态,包括暂时性疾病,特别是与其他致病病状或因免疫球蛋白缺乏导致的其他疾病或并发症相关的疾病。对于尚未诊断出疾病的受试者,风险确定尤其重要。因此,这种风险确定包括早期诊断,使得可进行预防性治疗。风险评估可通过单个风险参数进行,优选通过多个风险参数进行,例如遗传背景、压力水平、某些药物的摄入等。具体地,本发明的制剂用于具有高风险(例如,患病率高)的患者。
[0145]
具体地,本文中所描述的制剂提供用于医疗用途和相应的治疗,包括口服、局部、粘膜或肠胃外施用有效量的所述制剂以表现出所述抗炎、抗氧化、抗衰老或脂质代谢调节活性。
[0146]
具体地,本文中所描述的制剂提供用于医疗用途和相应的治疗,其中的治疗方案包括替换或联合施用皮质类固醇、抗tnf-α抑制剂、il-17抑制剂、il-23/il-12抑制剂、pde4抑制剂、富马酸、jak激酶抑制剂、甲氨蝶呤、来氟米特、氢氯喹啉、柳氮磺胺吡啶、环孢菌素或解离性类固醇化合物中的任何一种。
[0147]
在具体实施方案中,所述制剂是配制用于口服、局部、粘膜或肠胃外给药的药物组合物。
[0148]
本文中使用的术语“制剂”是指用于以特定方式治疗受试者的即用型制剂。具体地,药物组合物包含本文中进一步描述的化合物或其药学上可接受的盐以及药学上可接受的稀释剂、载体或赋形剂。
[0149]
在一个具体方面,提供了含本文中所描述的化合物或其药学上可接受的盐或相应制剂的药物制剂,其包含在用于口服、局部、粘膜或肠胃外给药的药学上可接受的赋形剂中。此外,本发明还包括已冻干并且可通过静脉注射、肌肉注射或皮下注射等方式重新组合以形成药学上可接受的给药制剂的化合物或其盐。也可通过皮内或经皮给药。
[0150]
具体实施方案是指可作为固体通过口服给药或吸入给药的剂型,或者可作为溶液剂、混悬剂或乳剂通过肌内或静脉内给药的剂型。或者,也可作为脂质体混悬剂通过吸入、静脉内或肌内给药的剂型。
[0151]
为了通过除肠胃外给药以外的任何途径施用本文中所描述的化合物或其药学上可接受的盐或相应的制剂,可能需要用材料包覆活性剂或与活性剂共同给药以防止其失活。例如,可使用适当的载体,例如脂质体或稀释剂。
[0152]
药学上可接受的稀释剂包括盐水和水缓冲溶液。
[0153]
本文中所描述的化合物或其药学上可接受的盐或相应的制剂可口服给药,例如,与惰性稀释剂、可吸收或可食用的载体一起口服给药。例如,可将制剂封装在硬壳或软壳明胶胶囊中,压缩成片剂,或直接加入受试者的饮食中。对于口服治疗性给药,本文中所描述的化合物或其药学上可接受的盐可与赋形剂混合,并以可摄入的片剂、口含片、锭剂、胶囊、酏剂、悬浮剂、糖浆剂、威化剂(wafer)等形式使用。当然,组合物和制剂中化合物或其药学上可接受的盐的百分比可变化。本文中所描述的化合物或其药学上可接受的盐在这种有疗效的组合物中的量即为获得的适合剂量。
[0154]
与治疗受试者的制剂或相应剂型的给药或施药或其他粘膜用途相关的术语“粘膜”是指经由粘膜途径给药,包括全身或局部给药,其中活性成分通过与粘膜表面接触吸收。这包括口服、经口、鼻、阴道和直肠给药,且剂型例如有液体、糖浆、锭剂、片剂、喷雾剂、散剂、速溶粉剂、颗粒剂、胶囊剂、乳膏剂、凝胶剂、滴剂、混悬剂、乳剂或食品。
[0155]
口服剂型可包括液体溶液剂、乳剂、混悬剂等。适用于制备此类组合物的药学上可接受的赋形剂在本领域是众所周知的。糖浆、酏剂、乳剂和混悬剂载体的典型成分包括乙醇、甘油、丙二醇、聚乙二醇、液体蔗糖、山梨醇和水。对于混悬剂,典型的助悬剂(suspending agent)包括甲基纤维素、羧甲基纤维素钠、西黄蓍胶和海藻酸钠;典型的润湿剂包括卵磷脂和聚山梨酯80;典型的防腐剂包括对羟基苯甲酸甲酯和苯甲酸钠。口服液体组合物还可包含一种或多种组分,例如上文公开的甜味剂、调味剂和着色剂。
[0156]
药物组合物也可通过常规方法包衣,通常使用ph或时间依赖性包衣,以使受试制剂在所需局部施用附近的胃肠道中释放,或在不同时间释放以延长所需作用。此类剂型通常包括但不限于邻苯二甲酸醋酸纤维素、聚醋酸乙烯邻苯二甲酸酯、邻苯二甲酸羟丙基甲基纤维素、乙基纤维素、蜡和虫胶中的一种或多种。
[0157]
用于实现对本文中所描述的化合物或其药学上可接受的盐或相应制剂全身性给药的其他组合物包括舌下、口腔和鼻腔剂型。此类组合物通常包含一种或多种可溶性填料物质,例如蔗糖、山梨醇、甘露醇,以及黏合剂,例如阿拉伯胶、微晶纤维素、羧甲基纤维素和羟丙基甲基纤维素,或助流剂、润滑剂、甜味剂、着色剂、抗氧化剂和调味剂。
[0158]
本文中所描述的化合物或其药学上可接受的盐或相应的制剂也可局部给药给受试者,例如,通过将包含其的组合物直接铺放或铺展在受试者的表皮或上皮组织上,或通过“贴片”经皮给药。例如,此类组合物包括洗剂、乳膏剂、溶液剂、凝胶剂和固体剂。这些局部组合物可包含有效量的本文中所描述的化合物或其药学上可接受的盐,通常至少约0.1wt%,或甚至约1wt%至约5wt%。用于局部给药的合适载体通常以连续膜的形式保留在皮肤的适当位置,以免因出汗或浸水而脱离。通常,载体本质上为有机载体并且能够使治疗剂分散或溶解其中。载体可包括药学上可接受的润肤剂、乳化剂、增稠剂、溶剂等。
[0159]
适用于注射用途的药物组合物包括无菌水溶液(特别是在化合物或药学上可接受的盐为水溶性的情况下)或分散剂和用于临时制备无菌注射溶液或分散剂和无菌粉。具体地,所述组合物是特定无菌的且流动性需达到易注射的程度;其在制造和储存条件下是稳定的,并可防止细菌和真菌等微生物的污染作用。
[0160]
药学上可接受的适合赋形剂包括但不限于任何适用于口服、肠胃外、经鼻、经粘膜、经皮、静脉注射(iv)、动脉注射(ia)、肌内注射(im)和皮下注射(sc)给药途径的非免疫
原性药物佐剂,例如磷酸盐缓冲生理盐水(pbs)。
[0161]
在一个具体方面,式(i)化合物或其药学上可接受的盐可用作食品或饲料产品、膳食补充剂或化妆品制剂,例如,营养品或药妆品。
[0162]
具体实施方案是指含式(i)化合物或其药学上可接受的盐的食物、饲料或化妆品组合物。
[0163]
本文中所描述的术语“食物”或“食品”是指适合或旨在供动物(包括人类和非人类动物)摄入的任何化合物、制剂、混合物或组合物。这包括任何作为营养补充剂、营养品补充剂或食品补充剂、膳食食品、完全或不完全平衡的膳食或补充剂或医疗食品的化合物,其被视为可能用作饮食的食物产品的营养或功能性补充剂。特定的功能性食品通常选自包括谷物棒、酸奶等乳制品、烘焙产品、果汁和饮料的组。通常,功能性食品有助于预防或预防性治疗和/或治疗与病原体有关的病状,包括毒素或治疗身体的生理失衡。该术语还应包括可能用作喂养非人类动物的饮食的饲料或饲料产品。食物来源可以是有机或合成的,以天然或类似天然的成分配制,包括乳制品或基于人造物质混合物合成的组合物,这些物质在混合前已经过适当纯化。本发明的食物通常以食品级质量提供。等级质量具有动物可接受的食物质量特征。这包括外观(大小、形状、颜色、光泽和稠度)、质地和味道等外部因素。质量标准还规定了可接受的最大污染物质量。除成分质量外,还有灭活或消除病原体的卫生要求。重要的是要确保食物加工环境尽可能清洁,以便为消费者生产尽可能安全的食物。
[0164]
本文中使用的术语“营养品(nutraceutical)”是指包含在特定饮食或加工食品中的任何营养素、膳食补充剂及产品,例如,植物油/动物油、维生素、胆固醇、肌酸、氨基酸、矿物盐、β-胡萝卜素、类黄酮、植物或酵母提取物、透明质酸、肌醇、草药和所有其他适用成分。
[0165]
本文中使用的术语“药妆品”是指对身体具有类似药物益处的任何化妆品,例如,维生素、α-和β-羟基酸、硫辛酸、二甲基氨基乙醇、乙醇酸、水杨酸、透明质酸。
[0166]
具体地,适用制剂可提供为液体、糖浆、锭剂、片剂、口香糖、喷雾剂、散剂、速溶粉剂、颗粒剂、胶囊剂、乳膏剂、凝胶剂、滴剂、混悬剂、乳剂或食物产品,例如,包括用于提供相应剂型的特定赋形剂或辅助手段。
[0167]
在一个具体方面,提供了用于局部施用的适用化妆品配方制剂,其包含本文中所描述的化合物或其药学上可接受的盐或相应的制剂以及美容学上可接受的赋形剂。特定的化妆品配方具有保湿和防腐性能,并且能够处理角蛋白基质、老化迹象和暴露于环境因素而造成的皮肤损伤,从而改善皮肤外观。
[0168]
处理角蛋白基质旨在保护或恢复皮肤和/或头发和/或指甲的健康功能,或提供保护或改善其外观和/或结构的任何治疗方法。这类治疗示例包括强化皮肤、减少皱纹、保湿、防止任何类型的侵害,特别是防止太阳辐射和老化迹象。
[0169]
治疗老化迹象是指治疗由于老化和光老化导致的所有皮肤外观变化。这些变化示例包括皱纹和细纹、牙线皮肤、皮肤变薄、皮肤弹性和/或色调丧失、皮肤不透明。其还包括不会直接影响外观变化的内部皮肤改变。这些内部改变的一个示例是因反复暴露于紫外线辐射而皮肤内部发生降解。
[0170]
用于改善皮肤外观的治疗是指可能导致皮肤外观视觉改善的所有现象。这些现象的示例使得皮肤更加美丽、紧致和光滑。
附图说明
[0171]
图1示出了根据报告(皮质醇)或实验验证(sca-744)的基因表达变化测定的皮质醇和sca-744调节细胞通路的比较。粗体:通过rna序列分析进行实验认证。
[0172]
图2示出了lps刺激thp-1巨噬细胞对il-1β、tnf-α、il-6和il-10生成量的影响。通过sca-744对lps诱导的tnf-α,il-β和il-6的剂量依赖性进行抑制。然后,在不存在和存在10μm、100μm和500μm sca-744的情况下,用[10ng/ml]lps处理细胞。通过biolegend公司的legendplex
tm
人类炎症面板检测法测定细胞因子水平。条形高度代表与lps一式三份的3个独立实验单独比较的平均浓度。
[0173]
图3示出了lps刺激thp-1巨噬细胞对il-1β、tnf-α、il-6和il-10生成量的影响。通过sca-754对lps诱导的tnf-α,il-β和il-6的剂量依赖性进行抑制。然后,在不存在和存在30μm和150μm sca-754的情况下,用[10ng/ml]lps处理细胞。通过biolegend公司的legendplex
tm
人类炎症面板测定细胞因子水平。条形高度代表与lps一式三份的3个独立实验单独比较的平均浓度。
[0174]
图4示出了sca-744使hela细胞中抗氧化酶nqo1的表达显著增加。
[0175]
图5示出了sca-744可防止细胞死亡并从mpp+诱导的损伤中恢复线粒体完整性。箭头指示为中下部方形面板中放大的功能失调的线粒体。
[0176]
图6示出了sca-744通过免疫印迹(a)和免疫荧光显微镜(b)诱导hela细胞中ldlr的表达。
[0177]
图7示出了sca-744与包含在与肝素(b,c)相互作用的类似蛋白质区域的硫酸乙酰肝素结合蛋白骨桥蛋白(a)结合。
[0178]
图8描绘了sca-744和硫酸乙酰肝素(hs)的化学结构。
[0179]
图9描绘了sca-744作为通路修饰剂通过硫酸乙酰肝素相互作用的分子从细胞外空间起作用的作用模式。
[0180]
图10:表1、表2、表3和表4。
[0181]
表1示出了在sca-744处理的人体细胞中上调差异且与细胞炎症和氧化反应及脂质代谢有关的基因。
[0182]
表2示出了在sca-744处理的人体细胞中下调差异且与细胞炎症和氧化反应及脂质代谢有关的基因。
[0183]
表3示出了p值《0.05且对数倍数变化(logfc)》1的所有标记代谢物,其中,这些代谢物在sca-744处理的人体细胞中上调差异并与细胞炎症和氧化反应及脂质代谢有关。代谢物按logfc值排序。
[0184]
表4示出了在sca-744处理的人体细胞中下调差异的p值《0.05且logfc《-1的关于葡萄糖代谢的选定代谢物。代谢物按logfc值排序。
[0185]
图11示出了通过接触内毒素(lps)损害并通过基于体积描记法测量的sca-744治疗显著改善的呼吸肺功能的参数示图。a:功能残气量(frc);b:呼气时间(te);c:呼气峰流速(rpef);d:呼吸频率(fbpm);e:吸气时间(ti)。使用的统计分析方法为单向方差分析(anova),其次是dunnett的多重比较检验。#p值《0.05,##p值《0.005与对照组相比(未处理),n=5-7/组。
[0186]
图12示出了苏木精和伊红染色小鼠肺组织的显微照片。a:对照组(未经处理);b:
lps+赋形剂;c:lps+sca-744;d:lps+dexa。po:血管周水肿,pl:血管周围白细胞/支气管周围白细胞。
[0187]
图13示出了显微镜载玻片0-3分的半定量评估。0:与未经治疗的对照组相比无变化;1、2和3对应的病理学严重程度增加。a:血管周水肿评分;b:粒细胞评分;c:巨噬细胞评分;d:综合得分(三个参数的全部总和)。使用的统计分析法为克鲁斯卡尔-沃利斯检验(kruskal wallis),其次是dunn多重比较检验。与对照组(未处理)相比,#p值《0.05,##p值《0.005,n=5-7/组。
[0188]
图14示出了a:阴性对照组(假手术/赋形剂)和阳性对照组(经cfa处理)的苏木精和伊红染色的小鼠踝关节组织的显微照片,箭头表示滑膜增生;以及b:滑膜增生评分的数据图表,其中,0表示相对于阴性对照组无变化,3表示阳性对照组出现严重病理变化。使用的统计分析为克鲁斯卡尔-沃利斯检验+dunnett的多重比较检验。与相应的完整足爪相比,#p值《0.05,##p值《0.01,n=5-6只小鼠/组。
[0189]
图15示出了合成磺酰杯芳烃变体的合成方案。
[0190]
图16示出了鉴定与sca-744细胞反应相关的关键代谢物。受sca-744影响的对数倍数变化绝对值》1的上调和(选定)下调代谢物在火山图中标出。
[0191]
图17示出了上调和下调代谢物富集图。261个标记代谢物(fdr《0.05)通过化学相似性富集分析法进行了化学组分类。每个节点表示显著改变的代谢物簇。仅示出了p值《0.05时表现出显著差异的富集簇。富集p值由柯尔莫诺夫-斯米尔诺夫(kolmogorov
–
smirnov)检验给出。图中y轴表示顶部变化最明显的簇。x轴按tanimoto相似性树上的聚类顺序排序。节点色标表示与对照人体细胞相比,sca-744中增加(黑色)或减少(白色)化合物的比例。灰结节既具有增加的代谢物又具有减少的代谢物。
[0192]
图18示出了与分子功能相关的基因本体分析。差异表达基因(deg)通过运用deseq和edger包的统计检测进行鉴定。基因本体是使用大猩猩、基因本体富集分析和可视化工具生成的。
[0193]
图19示出了sca-744(a)和sca-754(b)细胞毒性的体外评估。使用hek 293神经母细胞瘤细胞系进行实验。在处理72小时后,使用标准atp、celltiter 发光细胞活力检测法评估sca-744和sca-754对细胞活性的影响。sca-744(c)和sca-754(d)可保护哺乳动物细胞免受mpp+诱导的氧化应激损伤。
[0194]
图20示出了sca-744保护哺乳动物细胞免受h2o2诱导的氧化应激损伤。
具体实施方式
[0195]
除非另有说明,否则本文中使用的定义如下:
[0196]
当单独使用或与其他基团或原子组合使用时,术语“烷基”是指仅由多个氢取代碳原子组成的饱和直链或支链,并且包括如甲基、乙基、丙基、异丙基、正丁基、1-甲基丙基、异丁基、叔丁基、2,2-二甲基丁基、2,2-二甲基丙基、正戊基、2-甲基戊基、3-甲基戊基、4-甲基戊基、正己基,等等。
[0197]
术语“芳基”是指含有5个或6至14个碳原子,优选6至10个碳原子的单环或双环芳族基团,其可任选地与完全或部分饱和或不饱和的碳环融合,并可任选地由一个或多个相同或不同的取代基取代,适宜地,1至3个取代基。芳基示例包括苯基、萘基、吲哚基,等等。
[0198]
当单独使用或与其他基团或原子结合使用时,术语“环烷基”是指单环烃环、双环烃环或螺环烃环,其各自可以是饱和的或不饱和的(环烯基)。术语“不饱和”是指在所讨论的环系中至少有一个双键,但未形成芳香系。在双环烃环中,两个环相连,使其至少有两个共同的碳原子。在螺环烃环中,两个环共用一个碳原子(螺原子)。如果取代环烷基,则在每种情况下的取代都可以是在所有相互独立的携带碳原子的氢上的单取代或多取代。环烷基本身可作为取代基通过环系的任何适当位置连接至分子。
[0199]
术语“杂芳基”是指含有5个或6至14个碳原子,优选5个或6至12个碳原子的单环或双环芳族基团,其中,1至5个由选自n、s和o的杂原子取代,该杂原子可任选地还原为非芳族杂环,并可任选地由一个或多个相同或不同的取代基取代。杂芳基的示例包括吡咯基、二氢吡咯基、吡咯烷基、氧代吡咯烷基、吲哚基、异吲哚基、吲嗪基、咪唑基、吡唑基、苯并咪唑基、咪唑并(1,2-a)吡啶、吲唑基、嘌呤基、吡咯(2,3-c)吡啶基、吡咯并(3,2-c)吡啶、吡咯并(2,3-b)吡啶、吡唑并(1,5-a)吡啶、1,2,3-三唑基、1,2,4-三唑基、四唑基、恶唑基、1,2恶唑基、异恶唑基、1,3,4-恶二唑基、1,2,5-恶二唑基、1,2,4-恶二唑基、1,2,3-恶二唑基、噻唑基、异噻唑基、1,3,4-噻二唑基、1,2,5-噻二唑基、1,2,4-噻二唑基、1,2,3-噻二唑基、呋喃基、二氢呋喃基、四氢呋喃基、苯并呋喃基、异苯并呋喃基、噻吩基(thiophenyl)、二氢噻吩基、四氢噻吩基、苯并噻吩基、苯并异噻吩基、吡啶基、哌啶基、喹啉基、异喹啉基、四氢异喹啉基、喹嗪基(quinolizinyl)、吡嗪基、哒嗪基、嘧啶基、吡喃基、四氢吡喃基、1,2,3-三嗪基、1,2,4-三嗪基、1,3,5-三嗪基、色烯基(chromenyl)、吗啉基、二氮二乙烯基(diazepinyl)、苯并二氮二乙烯基(benzodiazepinyl)等等。
[0200]
如果在烃环中一个或多个基团-ch
2-彼此独立地由基团-o-、-s-或-nh-取代,或者一个或多个基团=ch-由基团=n-取代,则术语“杂环烷基”是指衍生自上文中所定义的环烷基的基团,虽然可能总共存在不超过五个杂原子,但两个氧原子和两个硫原子之间或一个氧原子和一个硫原子之间必须至少有一个碳原子,并且该基团作为一个整体必须是化学稳定的。杂原子可能同时存在于所有可能的氧化阶段(硫-》亚砜-so-,砜-so
2-;氮-》氮氧化物)。从环烷基的间接定义/衍生物中可立即看出,杂环烷基由单环杂环、双环杂环和螺杂环等子基团组成,而每个子基团还可进一步细分为饱和和不饱和(杂环烯基)。术语“不饱和”是指在所讨论的环系中至少有一个双键,但未形成芳香系。在双环杂环中,两个环相连,使其至少有两个共同的原子。在螺杂环中,两个环共用一个碳原子(螺原子)。如果取代杂环烷基,则在每种情况下的取代都可以是在所有相互独立的携带碳原子和/或氮原子的氢上的单取代或多取代。杂环烷基本身可作为取代基通过环系的任何适当位置联接至分子。
[0201]
本文所使用的术语“杂环基”是指任选地可熔合到芳香族芳基或杂芳基基团的杂环烷基。
[0202]
下面列出了各子基团的典型示例:单环杂环(饱和与不饱和):氧戊环、吡咯烷基、吡咯啉基、咪唑烷基、噻唑烷基、咪唑啉基、吡唑烷基、吡唑啉基、哌啶基、哌嗪基、环氧乙烷基、氮丙啶基、氮杂环丁基、1,4-二氧杂环己基、氮杂环庚烷基(azepanyl)、二氮杂环庚烷基(diazepanyl)、吗啉基、硫代吗啉基、高吗啉基(homomorpholinyl)、高哌啶基、高哌嗪基、高硫代吗啉基、硫代吗啉基-s-氧化物、硫代吗啉基-s、s-二氧化物、1,3-二氧戊烯基、恶烷、四氢硫吡喃基、1,4-恶氮杂环戊烯基、四氢噻吩基、高硫代吗啉基-s、s-二氧化物、恶唑烷基、二氢吡唑基、二氢吡咯基、二氢吡嗪基、二氢吡啶基、二氢嘧啶基、二氢呋喃基、二氢吡喃基、
四氢噻吩基-s-氧化物、四氢噻吩基-s、s-二氧化物、高硫代吗啉基-s-氧化物、2,3-二氢氮杂环、2h-吡咯基、4h-吡喃基、1,4-二氢吡啶基等;双环杂环(饱和与不饱和):8-氮杂双环[3.2.1]辛基、8-氮杂双环[5.1.0]辛基、2-氧杂-5-氮杂双环[2.2.1]庚基、8-氧杂-3-氮杂-双环[3.2.1]辛基、3,8-二氮杂-双环[3.2.1]辛基、2,5-二氮杂-双环-[2.2.1]庚基、1-氮杂-双环[2.2.2]辛基、3,8-二氮杂-双环[3.2.1]辛基、3,9-二氮杂-双环[4.2.1]壬基、2,6-二氮杂-双环[3.2.2]壬基、六氢呋喃[3,2-b]呋喃基等;螺杂环(饱和与不饱和):1,4-二氧杂-螺[4.5]癸基、1-氧杂-3,8-二氮杂-螺[4.5]癸基;2-氧杂螺[3.3]庚基、5-氮杂螺[2.4]庚基、2,6-二氮杂-螺[3.3]庚基、2,7-二氮杂-螺[4.4]壬基、2,6-二氮杂-螺[3.4]辛基、3,9-二氮杂-螺[5.5]十一烷基、2,8-二氮杂-螺[4.5]癸基等等。
[0203]
术语“合适的取代基”一方面是指化合价适用的取代基,另一方面是指可使系统具有化学稳定性的取代基。
[0204]
分子中特定位置的任何取代基或变量的定义应独立于在该分子中其他位置的定义。应当理解,本领域普通技术人员中的一个可选择本发明化合物的取代基和取代模式,以提供化学稳定的且易于通过本领域已知技术及本文中所描述的方法合成的化合物。
[0205]
本文中给出的任何化学式或结构,包括具有定义化学式的化合物,也旨在表示化合物的未标记形式以及同位素标记形式。同位素标记化合物具有由本文中给出的化学式所描述的结构,但一个或多个原子由具有选定原子质量或质量数的原子所取代。可加入本发明化合物中的同位素示例包括氢、碳、氮、氧、磷、氟和氯的同位素,例如但不限于2h(氘,d)、3h(氚)、11c、13c、14c、15n、18f、31p、32p、35s、36cl和125j。
[0206]
术语“药学上可接受的”也被称为“药理学上可接受的”,是指可与动物,特别是人类的治疗相兼容。术语药理学上可接受的盐包括药理学上可接受的酸加成盐和药理学上可接受的碱加成盐。
[0207]
本文中使用的术语“药理学上可接受的酸加成盐”是指本发明任何碱化合物的任何无毒有机或无机盐,或其任何中间体。例如,本发明的可形成酸加成盐的碱性化合物包括含有碱性氮原子的化合物。可形成适用盐的说明性无机酸包括盐酸、氢溴酸、硫酸和磷酸,以及金属盐,例如正磷酸一氢钠和硫酸氢钾。可形成适用盐的说明性有机酸包括一元羧酸、二元羧酸和三元羧酸,例如乙醇酸、乳酸、丙酮酸、丙二酸、琥珀酸、戊二酸、富马酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、马来酸、苯甲酸、苯乙酸、肉桂酸和水杨酸,以及磺酸,例如对甲苯磺酸和甲烷磺酸。可形成一元酸盐、二元酸盐或三元酸盐,并且这些盐可以以水合、溶剂化或基本上无水的形式存在。通常,本发明化合物的酸加成盐更易溶于水和各种亲水性有机溶剂,并且与其游离碱形式相比通常表现出更高的熔点。本领域技术人员会知道选择适当的盐。例如,其他非药理学上可接受的酸加成盐(例如草酸盐)可用于分离本发明化合物、供实验室使用或随后转化为药理学上可接受的酸加成盐。
[0208]
本文中使用的术语“药理学上可接受的碱性盐”是指本发明任何酸性化合物的任何无毒有机或无机碱加成盐或其任何中间体,其适用于或兼容动物,尤其是人类的治疗。例如,可形成碱加成盐的本发明酸性化合物包括含有羧酸、磺酸、亚磺酸、磺酰胺、n-未取代四唑、磷酸酯或硫酸酯的化合物。可形成适用盐的说明性无机碱包括氢氧化锂、氢氧化钠、氢氧化钾、氢氧化钙、氢氧化镁或氢氧化钡。可形成适用盐的说明性有机碱包括脂肪族、脂环族或芳香族的有机胺,例如甲胺、三甲胺和吡啶或氨。本领域技术人员会知道选择适用的
crl-2266)治疗后基因表达的整体变化。sh-sy5y是用视黄酸和佛波醇-12-肉豆蔻酸酯-13-乙酸酯分化的细胞(presgraves et al.experimental neurology 2004,190(1),pp.157
–
170)。细胞培养物用500μm sca-744或赋形剂(dpbs)处理24小时。使用lexogen sense mrna试剂盒分离总rna以制备文库,并使用hiseq2500(illumina)测序,hiseq2500使用测序化学版本4以50bp单读模式运行。差异表达基因(deg)通过运用deseq统计检验功能(anders&huber,genome biology 2010,11(10),p.r106)和edger包(robinson et al.bioinformatics 2009,26(1),pp.139
–
140)进行鉴定。比较通过智人标识符进行。
[0220]
值得注意的是,参与炎症、抗氧化、抗衰老反应和脂质代谢的几个基因在sca-744中受到差异调节(表1、表2、图10)。
[0221]
在对sca-744诱导的基因表达变化的进一步扩展分析中,将基因组导入cytoscape,然后使用cluego插件进行基因本体、疾病区域和通路分析(bindea et al.bioinformatics 2009,25(8),pp.1091
–
1093)。此外,还运用了一种新型通路比较计算方法来比较sca-744的实验测定曲线与抗炎化合物皮质醇(氢化可的松,美国密苏里州圣路易市西格玛奥德里奇公司)。这种方法利用蛋白质一级结构信息和小分子化学信息来鉴别药物可能的蛋白靶标,并揭示(隐藏的)药物间的相似性。
[0222]
当预计受sca-744影响的通路(其中大部分数也是使用rnaseq分析法通过实验确定)与报告受皮质醇调控的通路进行比较时(wan et al.scientific reports 2016,pp.1
–
14),通路出现了明显重叠(图1)。然而,一些受皮质醇影响并参与其副作用的代谢通路不受sca-744调控,例如糖代谢和神经递质失活通路。
[0223]
现有技术尚无其他抗炎药描述过这种情况。根据这些研究结果发现,sca-744和本文中所描述的化合物具有成为新型抗炎化合物的潜力。
[0224]
实施例2:sca-744可减少体内和体外促炎性细胞因子的产生
[0225]
根据mrna表达分析,sca-744下调了参与促炎性反应的关键基因(表1,图10)。为了验证这些数据,采用了一种表征良好且应用广泛的体外促炎信号模型,即lps刺激的thp-1人单核细胞系(bosshart&heinzelmann,annals of translational medicine 2016,4(21),pp.438
–
438)。用100nm佛波醇12-十四酸酯13-乙酸酯(pma)处理细胞,以诱导成熟的巨噬细胞样状态。然后在不存在和存在500μm sca-744的情况下,用100ng/ml脂多糖(lps)刺激细胞。6小时后,收集处理和未处理细胞的上清液,并使用人类炎症分析面板legendplex多分析物流动检测试剂盒测定三种主要促炎性细胞因子tnf-α、il-6和il-1β的水平。与未经治疗的细胞相比,在经sca-744治疗的thp-1细胞的培养上清液中测得的促炎性细胞因子水平显著降低(图2)。
[0226]
这些由直接测量细胞因子(测量蛋白质表达水平)获得的数据证明,细胞通过减少炎症信号对sca-744作出反应,这与其在不同人类细胞类型(神经母细胞瘤)中检测到的mrna水平(rnaseq)下的基因表达变化的预测相同。因此,可以得出结论,sca-744的抗炎作用是普遍的,并不局限于免疫细胞。
[0227]
在第二组实验中,在衰老动物模型体内对sca-744的抗炎作用进行了测试。众所周知,衰老过程与低度炎症有关。18个月以上的小鼠表现出许多老年人的特征,则被视为是人类衰老的相关模型。在年轻和老龄老动物的肺裂解物中测定了超过20种细胞因子和趋化因子的浓度;发现与年轻动物相比,大多数细胞因子和趋化因子在老龄动物中的含量明显更
高(janesch et al.cytokine 2018,111,pp.389
–
397)。在用sca-744治疗老龄小鼠(5只/组)2周后(以30mg/kg剂量间隔2天或3天,腹腔注射),采集小鼠的肺并制备裂解物。通过biolegend公司的legendplex
tm
鼠类炎症面板检测法测定细胞因子水平。检测发现促炎性细胞因子il-6和tnf-α以及炎症标记物脂钙蛋白2(lcn2)的数量明显减少(图3)。重要的是,抗炎细胞因子il-10并未受到sca-744的影响。
[0228]
根据这些数据,sca-744可下调促炎性细胞因子信号并发挥抗炎作用。
[0229]
实施例3:sca-744在人类培养细胞中诱导抗氧化细胞反应
[0230]
mrna表达分析(rnaseq)表明参与不同氧化应激反应通路的三个主要抗氧化基因显著上调:1、chac1(谷胱甘肽特异性γ-谷氨酰环转移酶1),其与氧化应激和凋亡有关;2、nqo1(nad(p)h脱氢酶[醌]1),其参与解毒通路;3、slc7a11(半胱氨酸/谷氨酸转运体,xct/ccbr1),其产生还原形式的细胞外胱氨酸氧化还原电位(cyss)(半胱氨酸氧化的结果),独立于谷胱甘肽(gsh)系统。
[0231]
为了通过实验验证sca-744的抗氧化作用,研究了这三个基因中的一个
‑‑
nqo1(一种主要的抗氧化酶)的诱导作用。用sca-744(50μm、100μm和500μm)处理hela(人宫颈上皮细胞,atcc ccl-2)48小时,并采集制备细胞裂解物,以利用抗人nqo1抗体(a-5:sc-271116,圣克鲁斯生物技术公司)进行免疫印迹分析。通过经sca-744处理的细胞获得的信号强度证明,nqo1以sca-744浓度依赖性方式显著上调(图4)。事实上,在所采用的实验条件下,在对照细胞中未检测到nqo1,而即使在50μm(受测sca-744的最低浓度)下也可诱导出明显的信号,该信号随着sca-744浓度的增加而增加(500μm时,信号高出约3.5倍)。实验有效性通过内参对照(一种预计不会被sca-744改变的蛋白质;gapdh)得到了验证。
[0232]
人们普遍认为线粒体的电子传递链(etc)产生了大部分(80-90%)的细胞活性氧簇(ros)。jarrett s.g.等人;《视网膜与眼科研究进展》2008年;27(6),第596页至第607页(jarrett,s.g.et al.progress in retinal and eye research 2008,27(6),pp.596
–
607)。越来越多的证据表明,线粒体功能障碍介导的氧化应激在数种疾病病理中起着主要作用。因此,抗氧化酶响应于氧化应激增加而激活生理活性被认为具有细胞保护作用。
[0233]
为了测试sca-744是否能够在由线粒体功能障碍引起的氧化损伤中挽救细胞,用1-甲基-4-苯基吡啶(mpp+)(0.5mm,48小时)处理sh-sy5y神经母细胞瘤细胞以诱导线粒体断裂。mpp+主要通过促进神经细胞线粒体中自由基活性氧簇的形成而显示其毒性,从而导致更广泛的细胞损伤(przedborski et al.journal of bioenergetics and biomembranes 2004,36(4),pp.375
–
379)。为了观察线粒体,将细胞与包含标记线粒体的弱巯基反应性氯甲基的线粒体红色荧光探针(mitotracker red cmxros,#9082;cell signaling)一起孵育、固定并安装。线粒体形态用zeiss lsm710激光扫描共聚焦显微镜成像。在存在sca-744(500μm)的情况下,细胞保持了线粒体的完整性,这表明ros的形成被大大减少或阻止(图5)。
[0234]
这些来自两个独立体外实验模型的数据表明,sca-744增加了细胞的抗氧化能力,充当了抗氧化剂。
[0235]
实施例4:sca-744调控脂质代谢
[0236]
如表1(图10)所示,sca-744影响了几个参与脂质代谢的基因的表达,例如低密度脂蛋白受体(ldlr),ldlr是决定血浆中胆固醇水平的主要因素。有趣的是,据报道,其中一
些基因的表达受wnt和刺猬信号通路的调控(bandari et al.current protein and peptide science 2015,16(1),pp.66
–
76;ali et al.arthritis&rheumatology 2015,68(1),pp.127
–
137)。为了直接评估sca-744对ldl-r表达水平的影响,用浓度为50μm或500μm的sca-744处理hela细胞24小时或48小时。收集细胞,制备细胞裂解物,然后使用抗人ldl-r抗体(c7:sc-18823,圣克鲁斯生物技术公司)进行免疫印迹分析。
[0237]
在对照细胞(未处理)中未观察到ldl-r信号,而在sca-744两种浓度下在细胞裂解物中检测到ldl-r,且ldl-r水平在sca-744浓度较高和暴露时间更长(48小时与24小时)时有升高的趋势(图6a)。
[0238]
在另一组实验中,以相同的方式处理hela细胞(50μm和500μm sca-744处理48小时)。在室温(rt)下用4%的多聚甲醛溶液固定细胞10分钟,在室温下用0.1%的triton x-100透化15分钟,并使用与免疫印迹分析相同的抗人ldlr抗体通过免疫荧光显微镜进行分析。这种检测方法更灵敏,即使在对照细胞中也能检测到ldl-r。根据半定量分析(比较几个不同视野下的荧光点数目)发现,sca-744以浓度依赖性方式使得ldl-r水平显著增加(图6b)。
[0239]
这些数据证实,ldl-r基因表达在基于rnaseq的分析中在蛋白质水平上增加。根据这些数据可得出结论,暴露于sca-744的细胞会随着ldl-r生成增加而应答。ldl-r与脂质代谢密切相关,并且参与胆固醇合成的其他几个基因在sca-744存在的情况下在mrna水平上有差异表达(表1,图10)。
[0240]
实施例5:sca-744与硫酸乙酰肝素结合蛋白及骨桥蛋白结合并与hs拮抗
[0241]
根据sca-744与硫酸乙酰肝素(hs)的化学相似性(两者均为带负电荷的硫酸化碳水化合物)(如图8所示)以及sca-744对由刺猬信号调节的或参与促炎信号的脂质代谢基因的调控作用(表1、图10、实例2和实例4)(两者均涉及硫酸乙酰肝素结合蛋白)(xu&esko,annual review of biochemistry 2014,83(1),pp.129
–
157)提出了sca-744通过hs模拟对细胞代谢发挥多效性作用的假设。
[0242]
为了验证sca-744对硫酸乙酰肝素模拟物活性的预测,用典型的hs结合蛋白骨桥蛋白(opn)(细胞外基质(ecm)的组成成分)对其物理相互作用进行探测。为此,使用核磁共振波(nmr)谱法直接探测其相互作用,并沿蛋白质主键映射其相互作用位点的位置。实验策略如下:首先,采用成熟的分子生物学技术制备
15
n标记的opn。通过被称为
15
n-1
h异核单量子相干(hsqc)的光谱直接监测各残基的位置,其中二维(2d)频谱中的各交叉峰对应于蛋白质的各残基位置(氨基酸)。配体结合改变了位于结合位点的残基的化学环境,从而导致hsqc光谱发生变化。由于可进行信号归属,通过比较蛋白质的载脂蛋白(无配体)和配体结合状态的hsqc光谱可以很容易地识别出受配体结合影响的残基位置(图7a)。检查无配体和有配体结合的hsqc光谱为sca-744与opn结合提供了明确的证据。而分析作为残基位置函数的化学位移变化(由配体结合引起)非常方便(图7b和图7c)。出现最大化学位移变化的残基通常是结合界面的一部分。可以清楚地看到,hs和sca-744均显示结合位点重合(相同的残基片段受结合过程的影响)。因此,可以得出结论,sca-744和hs共享相同的配体相互作用位点,因而出现配体竞争结合。
[0243]
根据这些数据和基因表达模式发现,sca-744基于化学相似性模拟硫酸乙酰肝素,并通过硫酸乙酰肝素相互作用分子从细胞外空间起通路修饰剂的作用(图9)。根据该模式,
sca-744在成纤维细胞生长因子(fgf)和成纤维细胞生长因子细胞外受体(fgfr)的相互作用下,通过细胞因子和趋化因子信号传导靶向多种ecm蛋白质(例如刺猬信号通路的成员),从而使得促炎反应降低。
[0244]
实施例6:使用标准检测法的作用模式和化合物选择
[0245]
sca-744作为硫酸乙酰肝素(hs)模拟物
[0246]
与hs结合蛋白的拮抗作用:如上所述,sca-744与骨桥蛋白(一种hs结合蛋白)相互作用,并且hs与sca-744共享结合位点。基于nmr的测量证明存在竞争性拮抗作用。对其他几种参与细胞信号传导的hs结合蛋白(例如,参与刺猬信号传导的蛋白)进行了测试。
[0247]
hs对sca-744介导效应的干扰:
[0248]
体外实验表明,sca-744可显著降低lps诱导的细胞因子产生,并可诱导抗氧化酶的产生。sca-744与hs共孵育,以测试hs是否会降低sca-744的效应。hs是一种市售聚合物糖,而不同制剂中的聚合物长度差异较大。纯化hs亚种(短、中、长)并单独测试其效应。据报道,小分子量肝素(另一种硫酸化碳水化合物聚合物)具有抗炎作用,但并非高分子量形式。这也是并行测试的。
[0249]
对促炎信号传导的影响
[0250]
nf-κb报告基因细胞系用于测量sca-744阻断促炎反应的效用与选择性(thp1-lucia
tm
细胞,专为监测nf-κb信号传导通路而设计)。sca-744对nf-κb活性的调控受机械监测。nf-κb的激活依赖于两种主要的信号传导通路,即经典(或典型)及选择性nf-κb信号传导通路。为了了解sca-744与细胞表面受体结合时参与抗炎激酶信号网络的信号传导通路,进行了kinomescan检测。该筛选平台采用了一种新型活性位点定向竞争结合测定法来定量测量化合物与450多种激酶之间的相互作用。
[0251]
抗氧化反应
[0252]
sca-744通过诱导参与清除活性氧簇(ros)的集中基因表达,在细胞培养物中显示出抗氧化特性。nqo1是一种受核因子(红细胞衍生2)-样2(nrf2)调控的主要下游抗氧化基因之一。nrf2是一种泛表达且必不可少的亮氨酸拉链转录因子。nrf2可调控多种编码蛋白质的基因表达,这些蛋白质在细胞保护中起着关键作用,并在与抗氧化反应元件(are)结合后解毒和清除有害的内源性和外源性物质。人类nrf2报告基因细胞是一种稳定的细胞系,其包括荧光素酶报告基因,该基因与含有串联抗氧化反应元件(are)的启动子功能性连接。因此,量化经处理的报告基因细胞中荧光素酶表达的变化为测量nrf2活性变化提供了灵敏的读数。将已知的nrf2激动剂用作阳性对照。
[0253]
刺猬信号传导
[0254]
细胞培养物中的rnaseq转录组药物谱显示,参与刺猬(hh)信号传导通路的基因上调,而该通路是调控脂质或胆固醇代谢的主要通路。为了研究sca-744对hh信号传导的影响,使用已知的hh激动剂和拮抗剂测量主要负性调节因子insg1和转录调节因子srebf2的活性或表达,以及参与胆固醇内稳态的基因的活性或表达,例如羟甲基戊二酰辅酶a还原酶(hmgcr)、7-脱氢胆固醇还原酶(dhcr7)、低密度脂蛋白受体(ldlr)和atp结合盒转运蛋白(abca1)。
[0255]
sca-744和皮质醇诱导基因表达的比较
[0256]
rnaseq转录组药物谱是一种适用于研究药物刺激下基因调控的工具。基于上述硅
片分析法预测的sca-744和皮质醇之间的相似性和差异性,生成皮质醇rnaseq药物转录组,以基于差异基因表达在通路水平上分析相似性和差异性。
[0257]
用biomaptm discoveryx对sca-744进行表型分析(th1炎性细胞促使巨噬细胞活化;参与慢性炎症的b细胞依赖于t细胞活化),以监测sca-744存在时促炎蛋白生物标记物的变化,并将其与皮质醇的变化进行比较。
[0258]
葡萄糖代谢:抗炎性皮质类固醇的主要局限之一是其致糖尿病的副作用。上述发现表明,sca-744和皮质醇在一个转录水平下在葡萄糖浓度和胰岛素代谢水平方面存在明显差异。这些差异在更高分辨率下得到了证实,
[0259]
i、在存在sca-744的情况下,通过免疫印迹法与皮质醇对比,研究胰岛素和细胞因子对akt1和irs1的磷酸化作用;以及
[0260]
ii、使用2-nbdg(一种专为高通量分析中的灵敏检测而设计的荧光葡萄糖类似物)进行功能分析,以监测细胞对葡萄糖的摄取情况。在存在sca-744和皮质醇的情况下,使用facs和高内涵显微镜对2-nbdg响应于胰岛素的摄取进行量化。
[0261]
实施例7:在人类疾病相关模型中测试sca-744
[0262]
银屑病
[0263]
mattek公司开发了一种用于银屑病的人体皮肤等效物(hse)3d组织模型。该模型使用来自银屑病患者的成纤维细胞和专有的细胞因子混合物来诱导银屑病。该模型可用于评估杯芳烃在不同剂量下降低炎性细胞因子反应的疗效。该模型有可能可用于补充免疫细胞。
[0264]
虽然银屑病是一种严格意义上的人类疾病,但咪喹莫特(imq)诱导的银屑病模型已成功地用于测试针对该疾病的候选药物(horv
á
th et al.;scientific reports 2019,9,article number:3685])。imq是一种固有的tlr7/8配体,可在类似斑块型银屑病的小鼠中快速诱导炎症性皮肤病变,并通过il-23/il-17细胞因子轴发挥作用(van der fits et al.;journal of immunology2009,182,pp.5836-584)。该模型可用于评估杯芳烃全身给药对病变引起的临床体征和组织病理学变化的疗效,以及监测皮肤细胞因子反应的变化。主要候选药物在不同剂量下通过全身和局部给药进行测试。
[0265]
关节炎:
[0266]
弗氏完全佐剂(cfa)诱导的慢性关节炎小鼠模型可用于测试杯芳烃在减轻关节炎症方面的疗效(horv
á
th,et al.;arthritis research and therapy,2016;18:6)。在该模型中,通过足底注射和反复皮下注射cfa诱发关节炎。杯芳烃可每天全身或口服给药。可监测临床体征(例如脚踝水肿)和局部炎症体征(例如血浆渗漏)3周,并对关节及关节内细胞因子水平进行组织病理学分析。
[0267]
可在胶原诱导性类风湿关节炎大鼠模型中进一步测试先导候选分子。与cfa关节炎不同,在这个模型中,关节普遍发炎,而非仅限于脚踝。关节炎是由随后两次皮内注射牛胶原蛋白诱发的。先导化合物可在治疗环境下(即关节炎发展后)全身或口服给药。作为阳性对照,甲氨蝶呤(临床上用于ra的免疫抑制剂)可用于比较疗效。可对治疗组和安慰剂对照组动物的临床症状(关节肿胀和非特异性临床症状)和炎症生化参数进行评估。此外,可保存四肢进行组织病理学检查,组织病理学检查只有在其他读数显示治疗组动物与对照组动物之间无显著差异时才可进行。
[0268]
哮喘:
[0269]
研究表明,与健康人相比,哮喘患者的基底上皮细胞因子水平发生了改变(freishtat et al.;american journal of respiratory cell and molecular biology 2011,44,pp.863-869)。使用哮喘患者细胞建立的3d上皮肺组织模型可以测试抗哮喘化合物在恢复正常细胞因子水平方面的功效。试验结果通过临床使用的抗炎药(皮质类固醇和类固醇类似物)进行验证(damsker et al.;plos one 2013,8(5):e63871),并可在测试杯芳烃时用作阳性对照。卵清蛋白(ova)诱导的小鼠肺部炎症模型可用于评估杯芳烃抗哮喘的疗效(elekes et al.;european journal of pharmacology 2008,578,pp.313-322)。在该模型中,在腹腔注射ova后,通过鼻内注射ova诱导动物气道高反应性。在鼻内施用ova前一天及整个给药过程中,可向小鼠全身施用杯芳烃、强的松或赋形剂。通过全身体积描记器评估气道反应性,并通过组织病理学检查检测肺部炎症变化。可在不同的给药途径(例如口服)、给药方案(预防性和治疗性)及剂量下对选定的抗哮喘的先导候选药物进行测试。
[0270]
类固醇副作用研究:
[0271]
皮质类固醇的长期使用与严重副作用之间存在关联,这通常不仅会限制其疗效,甚至还会限制其使用。这些副作用包括急性和慢性胰岛素抵抗增加(最终导致糖尿病)、骨转换减少(导致儿童骨脱矿和骨缺损或生长迟缓)、抑郁和免疫抑制。如果幼年小鼠长期服用类固醇(15周模型),则可检测到免疫毒性和生长相关的副作用。可在这种慢性给药模型中对杯芳烃进行测试,并可将与生长(身长和胫骨长度)和免疫毒性(脾脏大小)相关的副作用与地塞米松进行比较。
[0272]
硫酸乙酰肝素模拟活性
[0273]
1、核磁共振(nmr):使用核磁共振波谱测量与hs结合蛋白
‑‑
骨桥蛋白(opn)的物理相互作用以直接探测其相互作用,并映射蛋白质中相互作用位点的位置。使用
15
n标记的opn,其中,通过被称为
15
n-1
h异核单量子相干(hsqc)的光谱直接监测各残基的位置,其中二维(2d)频谱中的各交叉峰对应于蛋白质的各残基位置(氨基酸)。配体结合改变了位于结合位点的残基的化学环境,从而导致hsqc光谱发生变化。比较无配体和有配体结合的hsqc光谱为sca-744与opn结合提供了明确的证据。出现最大化学位移变化的残基通常是结合界面的一部分。结合位点重合表明出现竞争结合。
[0274]
2、biacore或生物膜层干涉(bli)技术,例如:将骨桥蛋白或其他hs结合蛋白包被到传感器芯片上(例如,在链霉亲和素包被芯片上使用生物素标记的重组蛋白)可以很容易地检测hs是否结合,而添加sca-744则有望减少或消除结合信号。
[0275]
3、亲和层析,例如:将骨桥蛋白或其他hs结合蛋白固定在层析基质上(例如,链霉亲和素包被的层析珠的生物素标记蛋白),添加hs,在洗涤色谱柱后,检测到sca-744从色谱柱上洗脱的hs。
[0276]
实施例8:sca-744在小鼠急性肺部炎症模型中具有显著的抗炎作用
[0277]
方法:
[0278]
在这些实验中,将8-12周龄雌性c57bl/6j小鼠分为4组(5-7只/组):1)pbs阴性对照组,2)仅ls,3)lps+sca-744和4)lps+地塞米松。
[0279]
内毒素(脂多糖:lps)诱导的急性肺部炎症模型
[0280]
在氯胺酮(120mg/kg腹腔注射,氯胺酮(calypsol),匈牙利布达佩斯吉瑞医药)和
甲苯噻嗪(6mg/kg腹腔注射,甲苯噻嗪(sedaxylan),荷兰北布拉班特优诺威动物保健公司)的麻醉作用下,经气管内给予溶解于60μl无菌磷酸盐缓冲盐水(pbs)中的100μg lps(大肠埃希菌(escherichia coli)o111:b4;美国密苏里州圣路易市西格玛奥德里奇公司),以诱导急性肺部炎症。给药后24小时,评估呼吸功能参数并采集肺样本进行组织病理学评估。
[0281]
治疗与实验设计
[0282]
经气管注射lps前24小时、12小时、20分钟和经气管注射lps 12小时后,腹腔注射sca-744(60mg/kg)及其赋形剂。在lps治疗前24小时和20分钟,腹腔注射长效类固醇地塞米松(5mg/kg;消除半衰期t1/2:36-54小时)。在lps给药后24小时进行呼吸功能测定。
[0283]
呼吸功能测定
[0284]
buxco finepoint无创气道机制检测系统(nam)双腔式体积描记器(dsi哈佛生物科学有限公司)用于在不使用麻醉的情况下监测清醒、受限动物的通气和支气管收缩参数。容积描记器可独立测量鼻腔和胸腔的流量。在第2天(-42小时)和第1天(-18小时)让动物适应2
×
20分钟后,在lps给药后24小时将动物置于体积描记室内。在10分钟的适应期后,评估基础肺功能,例如频率、潮气量、每分钟通气量、呼气时间、吸气时间、呼气流量峰值、吸气流量峰值,以及比气道阻力(支气管收缩的衡量标准)。
[0285]
结束与组织采集
[0286]
在评估呼吸功能后,麻醉动物并采集其肺部进行组织病理学评估。
[0287]
组织病理学评估
[0288]
切除的肺组织样本用福尔马林固定(6%)并包埋在石蜡中,切割5μm切片并用苏木精-伊红染色以进行组织学分析。在0-3分半定量评分标准下,在每只动物的3个肺组织深度的2个视野范围内,对气道炎症进行盲法评估,以评估血管周围和支气管周围水肿、中性粒细胞、巨噬细胞和淋巴细胞炎症细胞浸润以及杯状细胞化生。
[0289]
结果:
[0290]
使用lps治疗的小鼠呼吸功能明显改变,例如呼吸频率增加(每分钟呼吸次数,(f)bpm);功能残气量(frc)增加;呼气时间(te)缩短,呼气流量峰值(pef)相对于te(rpef)增加;鼻呼吸和胸呼吸之间的时间增加)(从kata中可添加更更加准确的描述)。与从对照组动物(未经lps治疗)中测得的参数相比,在接受sca-744治疗的动物中,lps治疗并未引起这些参数在统计学上的明显变化(图11)。地塞米松治疗有一些积极作用,但与对照组相比,参数仍有明显变化。
[0291]
组织学检查显示,sca-744治疗可预防或大大减少血管周围水肿的病理变化,以及中性粒细胞和巨噬细胞对血管周围和支气管周围的浸润(图12)。染色组织的半定量分析显示,经sca-744治疗的肺样本在三个参数和综合病理评分方面与未经治疗的对照组没有统计学上的显著差异,而经lps+赋形剂治疗的样本有统计学上的显著差异,这表明sca-744可防止炎症相关的病变(图13)。地塞米松治疗组中的这些炎症参数有减少趋势,但除粒细胞数量减少外,并未达到统计学意义。
[0292]
实施例9:sca-744在慢性关节炎小鼠模型中的有益作用
[0293]
方法:
[0294]
弗氏完全佐剂(cfa)诱导的慢性关节炎模型
[0295]
通过右后掌足底注射(i.pl.)20μl弗氏完全佐剂(cfa,悬浮在石蜡油中的热灭活
分枝杆菌,1mg/ml;美国密苏里州圣路易市西格玛奥德里奇公司)并皮下注射(s.c.)20μl至尾根以诱发慢性关节炎。次日(第1天),额外再向尾根皮下注射(20μl),以增强模拟人体状况的全身效应。
[0296]
治疗与实验设计
[0297]
从cfa给药前第0天开始并在整个21天的实验期内每天腹腔注射sca-744(60mg/kg)或参照化合物地塞米松(60mg/kg)以及sca-744赋形剂。
[0298]
后足机械痛阈值的测定
[0299]
使用动态足底触觉仪(dpa,ugo basile 37400,意大利科米里奥公司)评估后足足底表面的机械敏感度。将小鼠放入带金属网格底板的有机玻璃盒中,适应后,用直线式金属丝接触足底表面,逐渐向上用力(4秒内达到最大10g),直至小鼠缩回足爪。机械性超敏反应显示初始(cfa给药前)缩足阈值百分比下降。
[0300]
足爪体积测量
[0301]
通过器官充满度测量法(ugo-basile 7140肢体肿胀测量仪,意大利科米里奥公司)测定足爪体积,并以立方厘米(cm3)表示,然后以初始值百分比的增加表示水肿程度。
[0302]
中性粒细胞髓过氧化物酶活性的体内生物发光成像
[0303]
用鲁米诺生物发光法评估中性粒细胞髓过氧化物酶(mpo)衍生的细胞活性氧簇(ros)的产生以及酶活性。将溶于无菌磷酸盐缓冲盐水(pbs,30mg/ml)中的鲁米诺(5-氨基-2,3-二氢-1,4-邻苯二甲嗪二酮)钠盐(150mg/kg,美国密苏里州奥利维特市gold生物技术公司)腹腔注射到麻醉的小鼠体内。使用氯胺酮(120mg/kg腹腔注射;氯胺酮(calypsol),匈牙利布达佩斯吉瑞医药)和甲苯噻嗪(6mg/kg腹腔注射,甲苯噻嗪(sedaxylan),荷兰北布拉班特优诺威动物保健公司)对其进行麻醉。使用ivis lumina iii成像系统(美国沃尔瑟姆珀金埃尔默公司;120秒采集,像素组合=8,光圈级数=1)在注射后10分钟进行生物发光成像。在脚踝周围提取相同的感兴趣区域(roi),发光效率以总辐射亮度(总光子通量/秒)表示。
[0304]
组织学
[0305]
将切除的胫骨关节固定在4%的缓冲甲醛中,脱钙并石蜡包埋,切片(5μm)并用苏木精和伊红染色。根据是否存在1)单核细胞浸润蜂窝组织、2)滑膜增生、3)软骨破坏和4)骨侵蚀,采用0-3分的评分标准由盲测者对关节炎变化进行评分。
[0306]
结果:
[0307]
可在踝关节检测到cfa诱导的炎症对足爪区域的影响,其表现为骨侵蚀、软骨破坏、滑膜增生和单核细胞浸润(图14a)。在关节炎症过程的早期出现滑膜增生是一个重要的发现。在同时使用sca-744治疗的小鼠中,因注射cfa而增加的滑膜增生评分显著降低,并且疗效与使用地塞米松治疗后观察到的疗效相当(图14b)。
[0308]
这些数据表明,sca-744类似于关节炎治疗中常用的药物地塞米松,其对预防滑膜组织病变具有有益作用。
[0309]
实施例10:示例性化合物的合成途径
[0310]
杯芳烃的化学合成应基于3+1片段缩合策略,并遵循完善的化学合成程序(gutsche,cd calixarenes revisited in“monographs in supramolecular chemistry”,stoddard,fj,ed.,royal society of chemistry(pg-38-47)。含3个环系的片段携带-oh及
叔丁基取代基,取代基通过亚甲基(-ch2-)连接基连接。末端(侧翼)芳香环包含一个反应性基团,用于与单片段进行偶联反应。该单片段包含式中所示的各种取代或未取代的芳基(还包括杂芳基)体系,以及用于偶联到三环片段的两个反应性官能团。例如,-ch
2 br被称为偶联反应(ticl4,二氧六环,回流80-120小时)的有效官能团,以25-30%的产率生成杯[4]芳烃(gutsche,cd calixarenes revisited in“monographs in supramolecular chemistry”,stoddard,fj,ed.,royal society of chemistry(pg-38-47)。
[0311]
杯芳烃化合物的合成(图15)
[0312]
2,6-双(羟甲基)-4-叔丁基苯酚21[0313]
将naoh水溶液(27ml h2o中加2.7g)加入到4-叔丁基苯酚1(10g)中。加入甲醛水溶液(33%;10ml)后,在40℃氩气环境下搅拌混合物3天。加入盐水(100ml)后沉淀出钠盐,滤出并用盐水(30ml)洗涤。然后将该固体重新溶解在35ml水中,并使用稀释的hcl(1m)将所得溶液酸化至ph=1。然后使用ch2cl2(3
×
30ml)萃取混合物,随后用水(50ml)冲洗混合有机相并用mgso4干燥。蒸发溶剂得到含油残余物,使用庚烷和乙酸乙酯的混合物(4:3)通过硅胶柱层析纯化法纯化含油残余物。在紫外灯下在tlc板上鉴别含油馏分的产物。混合油馏分产物并蒸发溶剂,得到3.4g白色固体形式的化合物2。1h-nmr(400mhz;cdcl3):7,89(s,1h);7,08(s,2h);4,80(d,4,6hz,4h);2,54(bs,2h);1,28(s,9h);
13
c-nmr(150mhz);cdcl3):152,37;142,65;125,45;124,87;63,96;34,03;31,48。
[0314]
2,6-双(2-羟基-5-叔丁基苄基)-4-叔丁基苯酚32[0315]
在对甲苯磺酸一水合物(12mg)存在的情况下,在140℃油浴温度下,将4-叔丁基苯酚1(2.8g)和2,6-双(羟甲基)-4-叔丁基苯酚2(0.5g)的混合物在干燥的甲苯(10ml)中搅拌过夜。将反应混合物移至室温条件下,并减压去除甲苯。在少量丙酮中重新溶解残余油,并加入庚烷直至溶液变浑浊。将该混合物储存在冰箱,同时沉淀出产物。过滤分离,用丙烷洗涤并真空干燥获得415mg化合物3。1h-nmr(400mhz;cdcl3):8,82(s,1h);7,90(s,2h);7,29(d,2,4hz,2h);7,19(s,2h);7,07(dd,8,4hz,2,4hz,2h);6,74(d,8,4hz,2h);3,91(s,4h);1,29(s,9h);1,26(s,18h)。
[0316]
2,6-双(溴甲基)-4-甲基苯酚53[0317]
将多聚甲醛(1,69g)溶解在hbr/乙酸(33%,15ml)中。在冰浴中冷却该混合物,然后使用滴液漏斗逐滴加入甲酚4(2.7g)。在0℃下继续搅拌1小时,然后在室温下继续搅拌1.5小时。将混合物倒入冰水混合物中,并用ch2cl2(3
×
30ml)萃取。用水(2
×
20ml)冲洗混合有机相并用mgso4干燥。减压蒸发溶剂得到含油残留物,将其再次溶解于少量ch2cl2中。通过加入庚烷诱导该产物并将混合物储存在4℃下完成沉淀。过滤并真空干燥该固体产物,制得1.11g化合物5。1h-nmr(400mhz;cdcl3):7,08(s,2h);5,41(s,1h);4,54(s,4h);2,26(s,3h)。
[0318]
环-(2-羟基-5-甲基-1,3-亚苯基)亚甲基-三[(2-羟基-5-叔丁基-1,3-亚苯基)亚甲基]63[0319]
将2,6-双(溴甲基)-4-甲基苯酚5(1.5g)和2,6-双(2-羟基-5-叔丁基苄基)-4-叔丁基苯酚3(2.37g)溶解在乙酸(300ml)中,并用滴液漏斗在118℃下6小时内缓慢滴加至乙酸(300ml)中。在减压去除溶剂之前,在相同温度下将混合物再搅拌48小时。使用两个连续硅胶色谱柱(洗脱液:庚烷/乙酸乙酯(4:6)和庚烷/甲苯(3:1))纯化残余物。使用kmno4染色鉴定含油馏分的产物,并真空蒸发制得400mg产物6。1h-nmr(400mhz;cdcl3):10,26(s,2h);
7,02-7,08(m,4h);7,02(s,2h);6,84(s,2h);4,23(bs,4h);3,47(bs,4h);2,13(s,3h);1,23(s,18h);1.19(s,9h)。ms(负离子模式):m/z=605,33([m-h]-);计算:605,36。
[0320]
环-(2-羟基-5-甲基-1,3-亚苯基)亚甲基-三[(亚苯基)亚甲基]7
[0321]
将化合物6(248mg)、苯酚(220mg)和alcl3(400mg)的混合物溶解在干燥的甲苯(6ml)中,并在氩气环境中在60℃下搅拌5小时。将反应移至室温条件下,并在加入3%hcl(5ml)后继续搅拌30分钟。用甲苯(3
×
30ml)萃取溶液,并用mgso4干燥混合甲苯相。真空蒸发溶剂,并将甲醇(2ml)加入含油残余物中沉淀产物。过滤所得固体,并用ch2cl2和甲醇的混合物重结晶。反应生成80mg白色固体化合物7。1h-nmr(400mhz;cdcl3):10,17(s,4h);7,05(d,7,6hz,4h);7,04(d,7,5hz,2h);6,84(s,2h);6,73(t,7,5hz,2h);6,71(t,7,5hz,1h);4,24(bs,4h);3,50(bs,4h);2,13(s,3h)。ms(负离子模式):m/z=437,1762([m-h]-);计算:437,1758。
[0322]
环-(2-羟基-5-甲基-1,3-亚苯基)亚甲基-三[(2-羟基-5-磺酸基-1,3-亚苯基)亚甲基]8
[0323]
将化合物7(80mg)溶解于浓硫酸(0.7ml)中,并在80℃下搅拌4小时。在冰浴中,将热溶液逐滴加入到2.5ml水中。然后,加入盐水(2,5ml),并将混合物加热回流10分钟。减压去除溶剂,并将甲醇(10ml)加入残余固体中。将该不均匀混合物在超声波浴中辐照3分钟,然后在2500rpm下离心3分钟,并分离出上清液。再重复相同的甲醇加入、超声波辐照和离心分离程序两次。从混合上清液中蒸发溶剂,得到100mg白色固体化合物8。1h-nmr(400mhz;cd3od):7,63(s,4h);7,62(s,4h);4,02(bs,4h);3,93(bs,4h);2,12(s,3h)。ms(负离子模式):m/z=225,0110([m-3na]
3-);计算:225,0106。
[0324]
参考资料:
[0325]
1、修改自tetrahedron lett.2012,53,7,804-807。
[0326]
2、修改自synlett,2006,8,1221-1224。
[0327]
3、修改自makromol.chem.1979,180,2503-2506。
[0328]
分析技术
[0329]
化学合成结果的成功与否通过nmr和质谱分析所得到的磺酸基杯芳烃衍生物进行了验证。核磁共振波普分析依赖于1h和
13
c核磁共振波谱。文中列出了单个质子的化学位移。质谱实验在负离子和正离子两种模式下进行。根据预测分子式c
29h26o13
s3预计精确分子量为6780536道尔顿。
[0330]
获得了磺酸基杯芳烃变体sca-754的质谱结果,结果中显示了负离子和正离子模谱以及计算出的质荷比峰值。在负离子模式下,仅观察到单个钠加合物,而在正离子模式下,可分解出四个加合物片段。质谱实验数据清楚反映出了化合物的化学特性,并明确证明已成功完成了所需分子的变体。
[0331]
质谱:
[0332][0333]
化学式:c
29h26o13
s3[0334]
精确质量:6780536
[0335]
负离子模式
[0336]
计算:m-3h
+
/3=225,018
[0337]
m-3h
+
+na
+
/2=349,02
[0338]
正离子模式
[0339]
m+na=701,05
[0340]
m+2
×
na=723,05
[0341]
m+3
×
na=745,05
[0342]
m+4
×
na=767,05
[0343]
实施例11:sca-744的代谢分析
[0344]
人神经母细胞瘤细胞的代谢谱
[0345]
分化人神经母细胞瘤sh-sy5y细胞,并用500μm sca-744处理24小时。用meoh:acn:h2o(2:2:1,v/v)溶剂混合物提取细胞颗粒。采用高分辨率质谱法在vbcf代谢组学单元(www.vbcf.ac.at)进行非目标代谢谱分析。
[0346]
关键代谢物的鉴定
[0347]
使用compound discover软件(3.1版)分析非靶标代谢组学数据。第一组代谢物通过维也纳生物中心(vbcf)的内部据库进行分析。将测得的化合物保留时间与先前测得的标准保留时间进行比较。鉴定时需考虑是否有可用的ms2光谱。第二组代谢物用mzcloud进行标记(匹配度至少为75%)。鉴定基于mzcloud数据库通过对比测得的分子量(容差:5ppm)和ms2光谱进行。第三组代谢物通过分子量匹配(最大质量容差:5ppm)利用chemspider id(csid)进行标记。p值由compound discover软件根据生物重复和技术重复(t1-t2,ms)计算得出。使用了kegg、hmdb、biocyc、metabolika和pubchem数据库做进一步标记。
[0348]
化学族分类与富集分析
[0349]
提取错误发现率(fdr)《0.05的代谢物及其p值和相应的倍数变化,并进行化学和代谢网络富集分析。使用chemrich进行基于化学相似性的富集分析,chemrich独立于生化途径分配,利用tanimoto子结构相似系数和医学主题词表本体来生成不同化学类别的非重叠代谢物簇。统计实验结果通过柯尔莫诺夫-斯米尔诺夫检验测定,fdr校正后的p值《0.05则被认为具有显著性差异。
[0350]
代谢分析表明,sca-744具有可量化的药理反应,特别是改变脂质代谢、下调糖酵解和减少nadh、atp。这对脂肪细胞炎症轴受sca-744影响做出了联合解释。分析表明还发生了其他反应,如核苷酸和氨基酸生物合成减少。
[0351]
通过非配对单变量分析确定对照组细胞和治疗组细胞之间代谢物相对丰度的比较结果。根据fdr值(0.05)校正计算出的p值,并通过分析对数倍变化(logfc)进行筛选(表3)。在生成的火山图上以logfc》1和logfc《-2标注代谢物,以供说明之用。共发现261种标记代谢物,其中,fdr《0.05。在sca-744治疗组中,logfc绝对值》1的代谢物总数为74,差异显著;其表现为11种代谢物增加(表3),63种代谢物减少(选定代谢物如表4所示)。
[0352]
上调:
[0353]
表3中仅包括变化大于logfc》1且经fdr校正的p值《0.05的代谢物(图10)。上调代谢物最多是溶血磷脂酰(lpi)。一些出版物中指出,lpi(包括其受体gpr55)具有抗炎作用,其受体在治疗炎症和神经病理性疼痛方面具有治疗潜力
2,3
。lpi可影响多种细胞的生长、分化和运动等功能。lpi可诱导人肺动脉舒张机制。其在不同的生理和病理环境中起着重要作用,包括代谢和葡萄糖稳态。富集分析支持其他脂质代谢和肌醇上调(表3)。il-6(由sca-744下调)是肌醇的主要靶点。肌醇具有抗炎作用。
[0354]
前11个上调的代谢物还包括次黄嘌呤和肌苷,其上调程度非常显著。研究表明,肌苷和次黄嘌呤具有抗氧化和抗炎作用。例如,肌苷具有防止过度生成促炎性细胞因子的能力,同时还可增加保护性il-104的生成。
[0355]
表3示出了与细胞抗炎和抗氧化反应以及脂质代谢相关的进一步显著上调的代谢物和参照物。
[0356]
下调:
[0357]
表4(图10)仅显示了选定的代谢物,因为有63种代谢物在logfc《-1时下调极显著。
[0358]
富集分析支持其他脂质代谢及糖酸和糖磷酸盐的下调。在这一方面,图17主要显示了参与糖酵解的代谢物。在炎症代谢调控中,糖酵解起着重要作用。免疫细胞已发育出不同的代谢程序来为其提供细胞能量和生物分子,使其能够应对不断变化和具有挑战性的代谢条件。自上向下调控的代谢物包括磷酸二羟丙酮(dhap)。dhap是脂质生物合成和糖酵解的重要中间体。
[0359]
磷酸戊糖途径(ppp)中还包括其他代谢物,其在炎症、葡萄糖和血管细胞损伤中起着关键性作用研究表明,il-β(在sca-744中下调)可激活ppp5。这又反过来导致nadph氧化酶过度激活。ppp的过度激活是血管损伤和氧化应激的重要发生机制。sca-744使得糖酵解和nadh以及atp显著下调。
[0360]
135种代谢物的富集分析为脂质代谢改变提供了支持,包括甘油磷脂和溶血磷脂(fdr《0.05,logfc绝对值》0.5)的脂质代谢改变。涵盖261种代谢物(fdr《0.05,图2)的富集分析显示,磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺和缩醛磷脂等其他类的代谢物发生了
改变,其中大部分均上调。在该分析中,不饱和溶血磷脂和不饱和脂肪酸(fa)下调。这一点特别有趣,因为不饱和fa是炎症信号分子(如白三烯)的前体6。脂肪酸不饱和度低也会导致脂质过氧化降低。在炎症,尤其是动脉粥样硬化的发病机制中,脂蛋白过氧化起着至关重要的作用7。
[0361]
富集分析进一步发现氨基酸代谢减少。氨基酸代谢受mtor调控,而mtor又与甘油脂代谢和自噬作用以及蛋白质稳态有关。
[0362]
自噬作用在应激条件下被激活,而营养缺乏、蛋白质内稳态和病原体感染以及各种病理条件(包括癌症和神经退行性疾病)又会使得调控解除。人们普遍认为,ros可诱导自噬作用,而自噬作用又反过来有助于减少氧化损伤
18
。
[0363]
根据这一思路,则多种应激形式均可激活自噬作用。蛋白质、脂类、碳水化合物和核酸的降解将氨基酸、脂肪酸等代谢物释放到细胞质中为其再利用提供了内部营养物质。最近,自噬作用在神经退行性疾病和肿瘤抑制中的可能作用以及在炎症和抗氧化应激中的作用受到越来越多人的研究。
[0364]
代谢组分析
[0365]
上调和下调代谢物支持sca-744影响脂肪细胞炎症轴,并具有抗炎和抗氧化作用,且可改变脂质代谢。此外,胸腺嘧啶核苷、腺嘌呤核苷、二肽及氨基酸均下调。sca-744可影响核苷酸和氨基酸的生物合成。
[0366]
与分子功能相关的基因本体分析
[0367]
与分子功能相关的基因本体分析显示钙、细胞外基质、谷氨多糖、硫化合物和肝素结合蛋白的功能显著(图18)。
[0368]
实施例12:sca-744和sca-754在哺乳动物细胞中的细胞毒性
[0369]
体外评估sca-744和sca-754在哺乳动物细胞中的细胞毒性。在sca-744和sca-754治疗72小时后,使用标准atp方法——celltiter发光法细胞活力检测法评估细胞活力。根据浓度效应曲线得出50%有效浓度ec50。sca-744的ec50为2mm,sca-754的ec50为1mm(图19)。
[0370]
实施例13:sca-744及其变体(sca-754,也称为cal-x)的氧化应激保护
[0371]
一些体内和体外研究发现mpp+对细胞
22
施加氧化应激。mpp+毒性基于其对多巴胺能神经元的摄取力。mpp+积聚在线粒体内抑制复合物-i活性,导致atp耗竭、活性氧簇(ros)生成增多以及细胞凋亡
23
。mpp+处理以及sca-744和cal-x孵育12小时后,使用标准atp方法——celltiter发光法细胞活力检测法评估细胞活力。用0.1μm-1000μm sca-744和cal-x治疗可保护神经母细胞瘤细胞避免受mpp+诱导而凋亡(图19c)。有趣的是,与sca-744[1μm]相比,cal-x[0.2μm]对mpp+诱导细胞凋亡的保护有效性提高了4倍。综上所述,这些结果表明sca-744和cal-x对氧化应激诱导的线粒体功能障碍有保护作用(图19d)。
[0372]
实施例14:sca-744对过氧化氢h2o2透导的哺乳动物细胞应激的保护作用
[0373]
用24小时孵育时间就足以确定sca-744在hela细胞中的毒性和挽救效应。根据浓度效应曲线得出50%有效浓度ec50。sca-744对50mm h2o2有毒浓度的ec50为200nm(图20)。
[0374]
参考文献:
[0375]
1.shah,a.,mehta,n.&reilly,m.p.adipose inflammation,insulin resistance,and cardiovascular disease.jpen-parenter enter32,638-644(2008).
[0376]
2.kallendrusch,s.et al.the g protein-coupled receptor 55ligand i-α-lysophosphatidylinositol exerts microglia-dependent neuroprotection after excitotoxic lesion.gila 61,1822-1831(2013).
[0377]
3.o.et al.mechanisms of i-alpha-lysophosphatidylinositol-induced relaxation in human pulmonary arteries.life sci 192,38-45(2018).
[0378]
4.hask
ó
,g.et al.inosine inhibits inflammatory cytokine production by a posttranscriptional mechanism and protects against endotoxin-induced shock.j immunol 164,1013-1019(2000).
[0379]
5.peir
ó
,c.et al.inflammation,glucose,and vascular cell damage:the role of the pentose phosphate pathway.cardiovasc diabetol 15,82(2016).
[0380]
6.dennis,e.a.&norris,p.c.eicosanoid storm in infection and inflammation.nat rev immunol 15,511-523(2015).
[0381]
7.steinbrecher,p.role of lipoprotein peroxidation in the pathogenesis of atherosclerosis.clin cardiol 14,865-867(1991).
[0382]
8.scherz-shouval,r.&elazar,z.regulation of autophagy by ros:physiology and pathology.trends biochem sci 36,30-38(2011).
[0383]
参考文献(表3和表4):
[0384]
1.kallendrusch,s.et al.the g protein-coupled receptor 55ligand i-α-lysophosphatidylinositol exerts microglia-dependent neuroprotection after excitotoxic lesion.glia 61,1822-1831(2013).
[0385]
2.o.et al.mechanisms of i-alpha-lysophosphatidylinositol-induced relaxation in human pulmonary arteries.life sci 192,38-45(2018).
[0386]
3.bizzarri,m.,lagan
à
,a.s.,aragona,d.&unfer,v.inositol and pulmonary function.could myo-inositol treatment downregulate inflammation and cytokine release syndrome in sars-cov-2?eur rev med pharmaco 24,3426-3432(2020).
[0387]
4.lee,j.s.et al.hypoxanthine is a checkpoint stress metabolite in colonic epithelial energy modulation and barrier function.j biol chem 293,6039-6051(2018).
[0388]
5.schulte,e.c.et al.alterations in lipid and inositol metabolisms in two dopaminergic disorders.plos one 11,e0147129(2016).
[0389]
6.vimal,a.&kumar,a.i-asparaginase:a feasible therapeutic molecule for multiple diseases.3biotech 8,278(2018).
[0390]
7.hask
ó
,g.,sitkovsky,m.v.&szab
ó
,c.immunomodulatory and neuroprotective effects of inosine.trends pharmacol sci 25,152-157(2004).
[0391]
8.haines,r.j.,pendleton,l.c.&eichler,d.c.argininosuccinate synthase:at the center of arginine metabolism.int j biochem molbiology 2,8-23(2011).
[0392]
9.veen,j.n.van der et al.the critical role of phosphatidylcholine and phosphatidylethanolamine metabolism in health and disease.biochimica et biophysica acta bba-biornembr1859,1558-1572(2017).
[0393]
10.abuduli,m.et al.effects of dietary phosphate on glucose and lipid metabolism.am j physiol-endoc m 310,e526-e538(2016).
[0394]
11.marat,a.l.&haucke,v.phosphatidylinositol 3-phosphates-at the interface between cell signalling and membrane traffic.embo j 35,561-579(2016).
[0395]
12.evaldsson,c.,ryd
é
n,i.&uppugunduri,s.anti-inflammatory effects of exogenous uridine in an animal model of lung inflammation.int immunopharmacol 7,1025-1032(2007).
[0396]
13.jeengar,m.k.,thummuri,d.,magnusson,m.,naidu,v.g.m.&uppugunduri,s.uridine ameliorates dextran sulfate sodium(dss)-induced colitis in mice.sci rep-uk 7,3924(2017).
[0397]
14.rozova,e.v.,mankovskaya,i.n.,belosludtseva,n.v.,khmil,n.v.&mironova,g.d.uridine as a protector against hypoxia-induced lung injury.sci rep-uk 9,9418(2019).
[0398]
15.gaber,t.,strehl,c.&buttgereit,f.metabolic regulation of inflammation.nat rev rheumatol 13,267-279(2017).
[0399]
16.peir
ó
,c.et al.inflammation,glucose,and vascular cell damage:the role of the pentose phosphate pathway.cardiovasc diabetol 15,82(2016).
[0400]
17.o’neill,l.a.j.,kishton,r.j.&rathmell,j.a guide to immunometabolism for immunologists.nat rev immunol 16,553-565(2016).
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1