PD-1激动剂和其使用方法与流程
pd-1激动剂和其使用方法
1.相关申请的交叉引用
2.本专利申请要求2019年6月5日提交的美国临时专利申请62/857,699;2019年6月18日提交的美国临时专利申请62/863,193;以及2020年2月28日提交的美国临时专利申请62/983,512的优先权,所述申请的全部公开内容特此以引用的方式并入本文中。
背景技术:
3.程序性死亡1(pd-1)(也称为程序性细胞死亡1)是一种268个氨基酸的i型跨膜蛋白,最初通过经历细胞凋亡的小鼠t细胞系的消减杂交(subtractive hybridization)鉴别(ishida等人,《欧洲分子生物学杂志(embo j.)》,11:3887-95(1992))。pd-1是cd28/ctla-4家族t细胞调节子的成员,且据报道在激活的t细胞、b细胞和髓系细胞上表达(greenwald等人,《免疫学年鉴(annu.rev.immunol.)》,23:515-548(2005);和sharpe等人,《自然
·
免疫学(nat.immunol.)》,8:239-245(2007))。
4.已鉴别出pd-1的两种配体,pd配体1(pd-l1)和pd配体2(pd-l2),其均属于b7蛋白质超家族(greenwald等人,前述)。pd-l1在多种细胞类型中表达,包括肺、心脏、胸腺、脾和肾细胞(参见例如freeman等人,《实验医学杂志(j.exp.med.)》,192(7):1027-1034(2000);和yamazaki等人,《免疫学杂志(j.immunol.)》,169(10):5538-5545(2002))。pd-l1表达响应于脂多糖(lps)和gm-csf处理在巨噬细胞和树突状细胞(dc)上上调,并且在通过t细胞和b细胞受体信号传导后在t细胞和b细胞上上调。pd-l1还在多种鼠类和人肿瘤细胞系中表达(参见例如iwai等人,《美国国家科学院院刊(proc.natl.acad.sci.usa)》,99(19):12293-12297(2002);和blank等人,《癌症研究(cancer res.)》,64(3):1140-1145(2004))。相比之下,pd-l2展现更受限的表达模式,并且主要由抗原呈递细胞(例如树突状细胞和巨噬细胞)和一些肿瘤细胞系表达(参见例如latchman等人,《自然
·
免疫学》,2(3):261-238(2001))。
5.pd-1负调节t细胞激活,并且此抑制性功能与细胞质结构域中的基于免疫受体酪氨酸的转换基序(immunoreceptor tyrosine-based switch motif,itsm)有关(参见例如greenwald等人,前述;和parry等人,《分子与细胞生物学(mol.cell.biol.)》,25:9543-9553(2005))。已发现pd-l1诱导的pd-1簇聚诱导shp2磷酸酶的募集,所述磷酸酶优先使cd28去磷酸化,抑制t细胞功能(hui等人,《科学(science)》,355:1428-1433(2017))。pd-1缺乏可导致自身免疫。举例来说,已显示c57bl/6pd-1基因敲除小鼠罹患狼疮样综合征(nishimura等人,《免疫(immunity)》,11:141-1151(1999))。在人类中,pd-1基因中的单核苷酸多态性与系统性红斑狼疮、1型糖尿病、类风湿性关节炎和多发性硬化症进展的较高发生率相关(参见例如nielsen等人,《组织抗原(tissue antigens)》,62(6):492-497(2003);bertsias等人,《关节炎与风湿病(arthritis rheum.)》,60(1):207-218(2009);ni等人,《人类遗传学(hum.genet.)》,121(2):223-232(2007);tahoori等人,《临床和实验风湿病学(clin.exp.rheumatol.)》,29(5):763-767(2011);和kroner等人,《神经病学年鉴(ann.neurol.)》,58(1):50-57(2005))。
6.尽管最近在抑制pd-1活性以治疗各种类型的癌症以及用于免疫增强(例如以治疗
感染性疾病)方面取得了进展,但需要以高亲和力结合pd-1的pd-1结合剂(例如抗体),其促进负信号传导并且充当pd-1激动剂。
技术实现要素:
7.本发明提供了激动性pd-1结合剂。在一个实施例中,pd-1结合剂包含免疫球蛋白重链可变区和免疫球蛋白轻链可变区,其中免疫球蛋白重链可变区包含:包含seq id no:1的cdr1;包含seq id no:2的cdr2;以及包含seq id no:3的cdr3;并且免疫球蛋白轻链可变区包含有包含seq id no:4的cdr1;包含seq id no:5的cdr2;以及包含seq id no:6的cdr3。
8.还提供了抗pd-1结合剂,其包含与seq id no:24-33中的任一者具有至少80%、85%或90%序列同一性的免疫球蛋白重链可变区,或包含seq id no:24-33的至少cdr区的重链可变区,和/或与seq id no:34或35具有至少80%、85%或90%序列同一性的免疫球蛋白轻链可变区,或包含seq id no:34或35的至少cdr区的轻链可变区。
9.另一方面,pd-1结合剂包含免疫球蛋白重链可变区和免疫球蛋白轻链可变区,其中免疫球蛋白重链可变区包含:包含seq id no:7的cdr1;包含seq id no:8的cdr2;以及包含seq id no:9的cdr3;并且免疫球蛋白轻链可变区包含有包含seq id no:10的cdr1;包含seq id no:11的cdr2;以及包含seq id no:12的cdr3。
10.还提供了抗pd-1结合剂,其包含与seq id no:43-47或61-63中的任一者具有至少80%、85%或90%序列同一性的免疫球蛋白重链可变区,或包含至少其cdr区的重链可变区,和/或与seq id no:48-50具有至少80%、85%或90%序列同一性的免疫球蛋白轻链可变区,或包含至少其cdr区的轻链可变区。
11.另外,本发明提供编码前述免疫球蛋白多肽的分离或纯化的核酸序列,包含此类核酸序列的载体,包含前述免疫球蛋白多肽的分离的pd-1结合剂,编码此类pd-1结合剂的核酸序列,包含此类核酸序列的载体,包含此类载体的分离的细胞,包含此类pd-1结合剂或此类载体以及药学上可接受的载剂的组合物,以及通过向哺乳动物施用有效量的此类组合物来抑制哺乳动物的免疫反应和治疗哺乳动物的炎性或自身免疫病症的方法。
附图说明
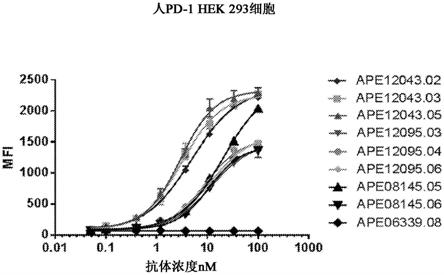
12.图1为描绘抗pd-1抗体与用人pd-1稳定转染的hek 293细胞结合的结果的图。
13.图2为描绘抗pd-1抗体与用食蟹猴pd-1稳定转染的hek 293细胞结合的结果的图。
14.图3为描绘抗pd-1抗体与2天抗cd3/抗cd28激活的人外周血cd4
+
t细胞结合的结果的图。
15.图4-7为显示抗pd-1抗体与pd-l1-fc或pd-l2-fc竞争与pd-1cho-k1细胞结合的测试结果的图。
16.图4为描绘竞争分析的结果的图,其说明抗pd-1抗体与pd-l1-fc竞争与用人pd-1稳定转染的cho-k1细胞结合的能力。
17.图5为描绘竞争分析的结果的图,其说明抗pd-1抗体与pd-l1-fc竞争与用人pd-1稳定转染的cho-k1细胞结合的能力。
18.图6为描绘竞争分析的结果的图,其说明抗pd-1抗体与pd-l2-fc竞争与用人pd-1
稳定转染的cho-k1细胞结合的能力。
19.图7为描绘竞争分析的结果的图,其说明抗pd-1抗体与pd-l2-fc竞争与用人pd-1稳定转染的cho-k1细胞结合的能力。
20.图8a为描绘使用2:1小珠与细胞比的基于小珠的cd4
+
t细胞激动剂分析中抗pd-1抗体的激动剂活性性能的图。
21.图8b为描绘使用1:1小珠与细胞比的基于小珠的cd4
+
t细胞激动剂分析中抗pd-1抗体的激动剂活性性能的图。
22.图9a为描绘使用4:1小珠与细胞比的基于小珠的cd4
+
t细胞激动剂分析中抗pd-1抗体的激动剂活性性能的图。
23.图9b为描绘使用2:1小珠与细胞比的基于小珠的cd4
+
t细胞激动剂分析中抗pd-1抗体的激动剂活性性能的图。
24.图9c为描绘使用1:1小珠与细胞比的基于小珠的cd4
+
t细胞激动剂分析中抗pd-1抗体的激动剂活性性能的图。
25.图10a为描绘针对抗pd-1抗体,基于小珠的cd4
+
t细胞激动剂分析中跨多个供体的ifnγ产生的平均抑制%的图。
26.图10b为提供抗pd-1抗体的描述、ifnγ的抑制%和图10a中所包括的供体数量的图表。
27.图11a为描绘针对抗pd-1抗体,基于小珠的cd4
+
t细胞激动剂分析中跨多个供体的ifnγ产生的平均抑制%的图。
28.图11b为描绘针对参考pd-1激动剂pd-l1-fc,基于小珠的cd4
+
t细胞激动剂分析中跨相同供体的ifnγ产生的平均抑制%的图。
29.图11c为提供候选抗体、抗体的描述、ifnγ的抑制%以及图11a和11b中所包括的供体数量的图表。
30.图12a为描绘基于板的人pbmc激动剂分析(供体#747)中抗pd-1抗体在抑制il-2产生方面的激动剂效力的图。
31.图12b为描绘基于板的人pbmc激动剂分析(供体#500)中抗pd-1抗体和pd-l1-fc在抑制il-2产生方面的激动剂效力的图。
32.图13a为描绘基于板的人pbmc激动剂分析(冷冻供体#500)中抗pd-1抗体和pd-l1-fc在抑制il-2产生方面的激动剂效力的图。
33.图13b为描绘基于板的人pbmc激动剂分析(冷冻供体#500)中抗pd-1抗体和pd-l1-fc在抑制il-2产生方面的激动剂效力的图。
34.图14a为描绘基于板的人pbmc激动剂分析(冷冻供体#1202)中抗pd-1抗体和pd-l1-fc在抑制il-2产生方面的激动剂效力的图。
35.图14b为描绘基于板的人pbmc激动剂分析(冷冻供体#1202)中抗pd-1抗体和pd-l1-fc在抑制il-2产生方面的激动剂效力的图。
36.图15a为描绘在阻断性抗pd-l1/抗pd-l2存在下,全人血破伤风回忆分析中观察到的pd-l1-fc四聚体的激动剂活性和纳武单抗(nivolumab)缺乏激动剂活性的图。
37.图15b为描绘在阻断性抗pd-l1/抗pd-l2存在下,全人血破伤风回忆分析中观察到的pd-1激动剂抗体的激动剂活性的图。
38.图15c为描绘全人血破伤风回忆分析中wt igg1抗pd-1激动剂抗体(实心三角形数据点)对ifnγ的影响的图。
39.图15d为描绘全人血破伤风回忆分析中igg2同种型抗pd-1抗体(空心三角形数据点)对ifnγ的影响的图。
40.图16a为根据本发明的实施方式,用于实施例8中所描述的移植物抗宿主病研究的异种nsg/hu-pbmc小鼠模型的示意图。
41.图16b为显示根据本发明的实施方式,实施例8中所描述的nsg/hu-pbmc移植物抗宿主病研究的时间线、给药日程和模型组的示意图。
42.图16c为描绘针对抗pd-1抗体,实施例8中的nsg/hu-pbmc移植物抗宿主病研究到达体重减轻≥10%的时间的结果的图。
43.图16d为描绘针对抗pd-1抗体,实施例8中的nsg/hu-pbmc移植物抗宿主病研究到达体重减轻≥10%的时间的结果的图。
44.图17a为描绘10mg/kg静脉内或皮下注射单次剂量的抗pd-1抗体后食蟹猴中药代动力学特性的图。
45.图17b为描绘10mg/kg静脉内或皮下注射单次剂量的抗pd-1抗体后食蟹猴中药代动力学特性的图。
46.图18a为描绘10mg/kg静脉内或皮下注射单次剂量的抗pd-1抗体后食蟹猴中cd3
+
t细胞pd-1受体占有率的图。
47.图18b为描绘10mg/kg静脉内或皮下注射单次剂量的抗pd-1抗体后食蟹猴中cd3
+
t细胞pd-1受体占有率的图。
48.图19a为显示pd-1免疫沉淀物与抗pd-1(顶部)、抗shp2(中间)或抗shp1(底部)的免疫印迹结果的sds-page凝胶。
49.图19b为描绘图19a中所示的免疫印迹的光密度测定法定量的图。
50.图20a为与人pd-l1细胞外结合结构域(灰色)的晶体结构的空间填充模型对接的人pd-1细胞外结构域(黑色)的晶体结构的带状模型图示。分子定向为pd-1的近膜区位于左下。
51.图20b为与人pd-l1细胞外结合结构域(灰色)的晶体结构的空间填充模型对接的人pd-1细胞外结构域(黑色)的晶体结构的带状模型图示。与图20a中所示的分子的视图相比,分子旋转90
°
,在底部中心处显示pd-1的近膜区。
52.图21a为描绘与igg1同种型相比,igg1 3.7c6抗pd-1抗体对来自用角质形成细胞抗原刺激的斑秃供体的pbmc中分泌的ifnγ的影响的图。
53.图21b为描绘与igg1同种型四聚体相比,pd-l1-igg1 fc四聚体对来自用角质形成细胞抗原刺激的斑秃供体的pbmc中分泌的ifnγ的影响的图。
54.图21c为描绘igg1 3.7c6抗pd-1抗体对从用角质形成细胞抗原刺激的斑秃供体分离的pbmc中ifnγ斑点形成细胞(sfc)的数量的影响的图。
55.图21d为描绘pd-l1 igg1-fc四聚体对从用角质形成细胞抗原刺激的斑秃供体分离的pbmc中ifnγ斑点形成细胞(sfc)的数量的影响的图。
56.图22a为描绘与igg1同种型相比,igg1 3.7c6抗pd-1抗体在破伤风类毒素特异性抗原回忆分析中对分泌的infγ的影响的图。
57.图22b为描绘与igg1同种型相比,igg1 3.7c6抗pd-1抗体在破伤风类毒素特异性抗原回忆分析中对分泌的il-17a的影响的图。
58.图23a为描绘与igg1同种型相比,igg1 3.7c6抗pd-1抗体对来自用黑色素细胞抗原刺激的斑秃供体的pbmc中分泌的ifnγ的影响的图。
59.图23b为描绘与igg1同种型四聚体相比,pd-l1-igg1-fc四聚体对来自用黑色素细胞抗原刺激的斑秃供体的pbmc中分泌的ifnγ的影响的图。
60.图23c为描绘igg1 3.7c6抗pd-1抗体对从用黑色素细胞抗原刺激的斑秃供体分离的pbmc中ifnγsfc的数量的影响的图。
61.图23d为描绘pd-l1 igg1-fc四聚体对从用黑色素细胞抗原刺激的斑秃供体分离的pbmc中ifnγsfc的数量的影响的图。
62.图24a为根据本发明的实施方式,用于实施例15中所描述的移植物抗宿主病研究的异种nsg/hu-pbmc小鼠模型的示意图。
63.图24b为显示根据本发明的实施方式,实施例15中所描述的nsg/hu-pbmc移植物抗宿主病研究的时间线、给药日程和模型组的示意图。
64.图24c为描绘针对抗pd-1激动剂igg1抗体3.7c6,实施例15中的nsg/hu-pbmc移植物抗宿主病研究的到达死亡的时间结果的图。
65.图24d为描绘在研究期间针对同种型对照,个别动物从研究开始起的体重变化百分比结果的图。
66.图24e为描绘在研究期间针对30mg/kg剂量下的抗pd-1激动剂igg1抗体3.7c6,个别动物从研究开始起的体重变化百分比结果的图。
67.图24f为描绘在研究期间针对10mg/kg剂量下的抗pd-1激动剂igg1抗体3.7c6,个别动物从研究开始起的体重变化百分比结果的图。
68.图24g为描绘在研究期间针对3mg/kg剂量下的抗pd-1激动剂igg1抗体3.7c6,个别动物从研究开始起的体重变化百分比结果的图。
69.图24h为描绘在研究期间针对阳性对照ctla-4-ig,个别动物从研究开始起的体重变化百分比结果的图。
具体实施方式
70.本发明提供了pd-1结合剂。如上文所论述,程序性死亡1(pd-1)(也称为程序性细胞死亡1)是一种268个氨基酸的i型跨膜蛋白(ishida等人,前述)。pd-1是cd28/ctla-4家族t细胞调节子的成员,且据报道在激活的t细胞、b细胞和髓系细胞上表达(greenwald等人,前述;和sharpe等人,前述)。pd-1包括细胞外igv结构域,接着是短细胞外茎、跨膜区和细胞内尾。pd-1细胞内尾含有位于免疫受体酪氨酸抑制基序和免疫受体酪氨酸转换基序中的两个磷酸化位点,其在磷酸化时通过募集酪氨酸磷酸酶起作用来负调节t细胞受体信号传导(参见例如ishida等人,前述;和blank等人,前述)。
71.在一些实施方式中,本文所提供的pd-1结合剂为激动性的,意味着pd-1结合剂与pd-1结合但不显著抑制pd-1与pd-1配体的结合,从而维持pd-1负调节t细胞受体信号传导的能力。根据某些实施方式,本文所提供的pd-1结合剂可诱导或刺激pd-1负调节t细胞受体信号传导和抑制免疫反应的能力。在一个特定实施方式中,提供了pd-1结合剂,其在包含以
下、基本上由以下组成或由以下组成的表位处结合pd-1:人pd1的残基33-41(序列:npptfspal)和/或人pd-1的残基96-110(序列:rvtqlpngrdfhmsv)。
72.pd-1结合剂包含免疫球蛋白重链可变区和免疫球蛋白轻链可变区,其中的每一者包含三个互补决定区(cdr),通常称为cdr1、cdr2或cdr3。cdr区还可在命名中使用“h”或“l”提及以分别表示重链或轻链,即,cdrh1、cdrh2、cdrh3、cdrl1、cdrl2或cdrl3。给定ig序列的cdr可通过若干常规编号方案中的任一者来确定,如kabat、chothia、martin(增强型chothia)、igmt或aho(参见例如kabat等人,《免疫学关注的蛋白质的序列(sequences of proteins of immunological interest)》,美国卫生与公众服务部(u.s.department of health and human services),美国国立卫生研究院(nih)(1991);chothia等人,《免疫球蛋白高变区的典型结构(canonical structures for the hypervariable regions of immunoglobulins)》,《分子生物学杂志(j.mol.biol.)》,196:901-917(1987);al-lazikani等人,《免疫球蛋白的典型结构的标准构象(standard conformations for the canonical structures of immunoglobulins)》,《分子生物学杂志》,273:927-948(1997);abhinandan等人,《kabat的分析和改良以及抗体可变结构域的结构正确编号(analysis and improvements to kabat and structurally correct numbering of antibody variable domains)》,《分子免疫学(mol.immunol.)》,45:3832-3839(2008);lefranc等人,《免疫球蛋白、t细胞受体和ig样结构域的imgt唯一编号(the imgt unique numbering for immunoglobulins,t cell receptors and ig-like domains)》,《免疫学家(the immunologist)》,7:132-136(1999);lefranc等人,《免疫球蛋白和t细胞受体可变结构域和i超家族v样结构域的imgt唯一编号(imgt unique numbering for immunoglobulin and t cell receptor variable domains and i superfamily v-like domains)》,《发育与比较免疫学(dev.comp.immunol.)》,27:55-77(2003);以及honegger等人,《另一种免疫球蛋白可变结构域的编号方案:一种自动建模和分析工具(yet another numbering scheme for immunoglobulin variable domains:an automatic modeling and analysis tool)》,《分子生物学杂志》309:657-670(2001)。
73.根据本发明的一个方面,pd-1结合剂的免疫球蛋白重链可变区包含有包含seq id no:1的cdr1;包含seq id no:2的cdr2;以及包含seq id no:3的cdr3;并且免疫球蛋白轻链可变区包含有包含seq id no:4的cdr1;包含seq id no:5的cdr2;以及包含seq id no:6的cdr3。在一些实施方式中,重链cdr1包含seq id no:13-18中的任一者。另外,或替代地,重链cdr3的一些实施方式包含seq id no:19-21中的任一者。此外,轻链cdr1可包含seq id no:22或23。
74.在特定实施方式中,pd-1结合剂可包含如seq id no:24-33中的任一者的免疫球蛋白重链可变区,或与seq id no:24-33中的任一者具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列。在其它实施方式中,pd-1结合剂包含免疫球蛋白重链可变区,其包含seq id no:24-33中的任一者的cdr,其中cdr如上文所提供或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。任选地,包含seq id no:24-33中的任一者
的cdr的免疫球蛋白重链可变区还具有与seq id no:24-33中的任一者具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列。
75.除上文所描述的ig重链可变区之外,或替代地,抗pd-1结合剂可包含如seq id no:34或35的免疫球蛋白轻链可变区,或与seq id no:34或35具有至少80%、85%或90%序列同一性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列。在其它实施方式中,pd-1结合剂包含免疫球蛋白轻链可变区,其包含seq id no:34或35的cdr,其中cdr如上文所提供或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。任选地,包含seq id no:34或35的cdr的免疫球蛋白轻链可变区还具有与seq id no:34或35具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列。
76.根据一个实施方式,pd-1结合剂可包含如seq id no:29的免疫球蛋白重链可变区或与其具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列;或包含seq id no:29的至少cdr的免疫球蛋白重链可变区,其中cdr区如上文所提供(例如cdr1-seq id no:15,cdr2-seq id no:2,以及cdr3-seq id no:20)或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定;以及如seq id no:35的免疫球蛋白轻链可变区或与其具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列,或包含seq id no:35的至少cdr的免疫球蛋白轻链可变区;其中cdr区如上文所提供(例如cdr1-seq id no:23,cdr2-seq id no:5,以及cdr3-seq id no:6)或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。在一些实施方式中,抗体包含seq id no:29的重链可变区和seq id no:35的轻链可变区,或至少其如通过kabat所确定的cdr。在一些实施方式中,抗体包含seq id no:29的重链可变区和seq id no:35的轻链可变区,或至少其如通过chothia所确定的cdr。在一些实施方式中,抗体包含seq id no:29的重链可变区和seq id no:35的轻链可变区,或至少其如通过martin所确定的cdr。在一些实施方式中,抗体包含seq id no:29的重链可变区和seq id no:35的轻链可变区,或至少其如通过igmt所确定的cdr。在一些实施方式中,抗体包含seq id no:29的重链可变区和seq id no:35的轻链可变区,或至少其如通过aho所确定的cdr。进一步举例来说,抗pd-1结合剂可包含有包含seq id no:36的免疫球蛋白重链和包含seq id no:37的免疫球蛋白轻链,或分别与seq id no:
36和37具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列,任选地其中序列分别保留seq id no:36和37的重链和轻链cdr,其中cdr如上文所提供或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。
77.根据另一实施方式,pd-1结合剂可包含如seq id no:24的免疫球蛋白重链可变区或与其具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列;或包含seq id no:24的至少cdr的免疫球蛋白重链可变区,其中cdr区如上文所提供(例如cdr1-seq id no:13,cdr2-seq id no:2,以及cdr3-seq id no:19)或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定;以及如seq id no:34的免疫球蛋白轻链可变区或与其具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列,或包含seq id no:34的至少cdr的免疫球蛋白轻链可变区;其中cdr区如上文所提供(例如cdr1-seq id no:22,cdr2-seq id no:5,以及cdr3-seq id no:6)或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。在一些实施方式中,抗体包含seq id no:24的重链可变区和seq id no:34的轻链可变区,或至少其如通过kabat所确定的cdr。在一些实施方式中,抗体包含seq id no:24的重链可变区和seq id no:34的轻链可变区,或至少其如通过chothia所确定的cdr。在一些实施方式中,抗体包含seq id no:24的重链可变区和seq id no:34的轻链可变区,或至少其如通过martin所确定的cdr。在一些实施方式中,抗体包含seq id no:24的重链可变区和seq id no:34的轻链可变区,或至少其如通过igmt所确定的cdr。在一些实施方式中,抗体包含seq id no:24的重链可变区和seq id no:34的轻链可变区,或至少其如通过aho所确定的cdr。
78.根据一个实施方式,pd-1结合剂可包含如seq id no:30的免疫球蛋白重链可变区或与其具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列;或包含seq id no:30的至少cdr的免疫球蛋白重链可变区,其中cdr区如上文所提供(例如cdr1-seq id no:15,cdr2-seq id no:2,以及cdr3-seq id no:21)或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定;以及如seq id no:35的免疫球蛋白轻链可变区或与其具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或
100%序列同一性)的氨基酸序列,或包含seq id no:35的至少cdr的免疫球蛋白轻链可变区;其中cdr区如上文所提供(例如cdr1-seq id no:23,cdr2-seq id no:5,以及cdr3-seq id no:6)或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。在一些实施方式中,抗体包含seq id no:30的重链可变区和seq id no:35的轻链可变区,或至少其如通过kabat所确定的cdr。在一些实施方式中,抗体包含seq id no:30的重链可变区和seq id no:35的轻链可变区,或至少其如通过chothia所确定的cdr。在一些实施方式中,抗体包含seq id no:30的重链可变区和seq id no:35的轻链可变区,或至少其如通过martin所确定的cdr。在一些实施方式中,抗体包含seq id no:30的重链可变区和seq id no:35的轻链可变区,或至少其如通过igmt所确定的cdr。在一些实施方式中,抗体包含seq id no:30的重链可变区和seq id no:35的轻链可变区,或至少其如通过aho所确定的cdr。
79.根据另一方面,抗pd-1结合剂包含免疫球蛋白重链可变区,其包含:包含seq id no:7的cdr1;包含seq id no:8的cdr2;和包含seq id no:9的cdr3;以及免疫球蛋白轻链可变区,其包含有包含seq id no:10的cdr1;包含seq id no:11的cdr2;和包含seq id no:12的cdr3。在一些实施方式中,重链cdr1包含seq id no:57-60中的任一者。在一些实施方式中,重链cdr2包含seq id no:38-42中的任一者。
80.在一些实施方式中,pd-1结合剂包含如seq id no:43-47或61-63中的任一者的免疫球蛋白重链可变区,或与seq id no:43-47或61-63中的任一者具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列。在一些实施方式中,pd-1结合剂包含免疫球蛋白重链可变区,其包含seq id no:43-47或61-63中的任一者的cdr,其中cdr如上文所提供或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。任选地,包含seq id no:43-47或61-63中的任一者的cdr的免疫球蛋白重链可变区还具有与seq id no:43-47或61-63中的任一者具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列。
81.除上文所描述的ig重链可变区(例如seq id no:43-47或61-63)之外,或替代地,抗pd-1结合剂可包含如seq id no:48-50中的任一者的免疫球蛋白轻链可变区,或与seq id no:48-50中的任一者具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列。在其它实施方式中,pd-1结合剂包含免疫球蛋白轻链可变区,其包含seq id no:48-50中的任一者的cdr,其中cdr如上文所提供或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。任选地,包含seq id no:48-50中的任一者的cdr的免疫球蛋白轻链可变区还具有与seq id no:48-50中的任一者具有至少80%、85%或90%序列同一性(例如
至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列。
82.在一个特定实施方式中,抗pd-1结合剂包含如seq id no:47的免疫球蛋白重链可变区或与seq id no:47具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列;或包含seq id no:47的至少cdr的免疫球蛋白重链可变区,其中cdr区如上文所提供(例如cdr1-seq id no:57,cdr2-seq id no:42,以及cdr3-seq id no:9)或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定;以及如seq id no:49的免疫球蛋白轻链可变区或与seq id no:49具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列,或包含seq id no:49的至少cdr的免疫球蛋白重链可变区;其中cdr区如上文所提供(例如cdr1-seq id no:10,cdr2-seq id no:11,以及cdr3-seq id no:12)或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。在一些实施方式中,抗体包含seq id no:47的重链可变区和seq id no:49的轻链可变区,或至少其如通过kabat所确定的cdr。在一些实施方式中,抗体包含seq id no:47的重链可变区和seq id no:49的轻链可变区,或至少其如通过chothia所确定的cdr。在一些实施方式中,抗体包含seq id no:47的重链可变区和seq id no:49的轻链可变区,或至少其如通过martin所确定的cdr。在一些实施方式中,抗体包含seq id no:47的重链可变区和seq id no:49的轻链可变区,或至少其如通过igmt所确定的cdr。在一些实施方式中,抗体包含seq id no:47的重链可变区和seq id no:49的轻链可变区,或至少其如通过aho所确定的cdr。进一步举例来说,抗pd-1结合剂可包含有包含seq id no:51的免疫球蛋白重链和包含seq id no:52的免疫球蛋白轻链,或与seq id no:51和52具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列,任选地其中序列保留seq id no:51和52的重链和轻链cdr,其如上文所提供或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。
83.在另一实施方式中,抗pd-1结合剂包含如seq id no:46的免疫球蛋白重链可变区或与seq id no:46具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列;或包含seq id no:46的至少cdr的免疫球蛋白重链可变区,其中cdr区如上文所提供(例如cdr1-seq id no:57,cdr2-seq id no:41,以及cdr3-seq id no:9)或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin
(增强型chothia)、igmt或aho)中的任一者确定;以及如seq id no:50的免疫球蛋白轻链可变区或与seq id no:50具有至少80%、85%或90%序列同一性(例如至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性)的氨基酸序列,或包含seq id no:50的至少cdr的免疫球蛋白重链可变区;其中cdr区如上文所提供(例如cdr1-seq id no:10,cdr2-seq id no:11,以及cdr3-seq id no:12)或如根据各种已知免疫球蛋白编号方案(例如kabat、chothia、martin(增强型chothia)、igmt或aho)中的任一者确定。在一些实施方式中,抗体包含seq id no:46的重链可变区和seq id no:50的轻链可变区,或至少其如通过kabat所确定的cdr。在一些实施方式中,抗体包含seq id no:46的重链可变区和seq id no:50的轻链可变区,或至少其如通过chothia所确定的cdr。在一些实施方式中,抗体包含seq id no:46的重链可变区和seq id no:50的轻链可变区,或至少其如通过martin所确定的cdr。在一些实施方式中,抗体包含seq id no:46的重链可变区和seq id no:50的轻链可变区,或至少其如通过igmt所确定的cdr。在一些实施方式中,抗体包含seq id no:46的重链可变区和seq id no:50的轻链可变区,或至少其如通过aho所确定的cdr。
84.如本文所描述,序列“同一性”可通过将所关注的核酸或氨基酸序列与参考核酸或氨基酸序列进行比较来确定。同一性百分比是所关注的序列与参考序列之间相同(即,同一)的核苷酸或氨基酸残基的数量除以最长序列的长度(即,所关注的序列或参考序列的长度,以较长者为准)。用于获得最优比对和计算两个或更多个序列之间的同一性的多种数学算法是已知的,并且被并入到多个可用的软件程序中。此类程序的实例包括clustal-w、t-coffee和align(用于核酸和氨基酸序列比对)、blast程序(例如blast 2.1、bl2seq和其后续版本)以及fasta程序(例如fasta3x、fastm和ssearch)(用于序列比对和序列相似性搜索)。序列比对算法还公开于例如altschul等人,《分子生物学杂志》,215(3):403-410(1990),beigert等人,《美国国家科学院院刊》,106(10):3770-3775(2009),durbin等人编,《生物序列分析:蛋白质和核酸的概率模型(biological sequence analysis:probalistic models of proteins and nucleic acids)》,剑桥大学出版社(cambridge university press),英国剑桥(cambridge,uk)(2009),soding,《生物信息学(bioinformatics)》,21(7):951-960(2005),altschul等人,《核酸研究(nucleic acids res.)》,25(17):3389-3402(1997),以及gusfield,《字符串、树和序列算法(algorithms on strings,trees and sequences)》,剑桥大学出版社,英国剑桥(1997)中。
85.序列同一性的变化可通过添加、取代或缺失一个或多个氨基酸残基来实现。氨基酸“替换”或“取代”是指多肽序列内给定位置或残基处的一个氨基酸由相同位置或残基处的另一氨基酸替换。氨基酸替换或取代可为保守、半保守或非保守的,取决于取代是否由与所替换的残基具有相似特性的氨基酸残基进行。用于定义个别氨基酸之间的共同特性的功能方法是分析同源生物体的对应蛋白质之间氨基酸变化的归一化频率(schulz和schirmer,《蛋白质结构原理(principles of protein structure)》,施普林格出版社(springer-verlag),纽约(new york)(1979))。根据此类分析,可以定义氨基酸组,其中一个组内的氨基酸优先彼此交换,并且因此在其对整体蛋白质结构的影响方面彼此最相似(schulz和schirmer,前述)。
86.氨基酸可大致分组为“芳香族”或“脂肪族”。芳香族氨基酸包括芳香环。“芳香族”氨基酸的实例包括组氨酸(h或his)、苯丙氨酸(f或phe)、酪氨酸(y或tyr)以及色氨酸(w或trp)。非芳香族氨基酸大致分组为“脂肪族”。“脂肪族”氨基酸的实例包括甘氨酸(g或gly)、丙氨酸(a或ala)、缬氨酸(v或val)、亮氨酸(l或leu)、异亮氨酸(i或ile)、甲硫氨酸(m或met)、丝氨酸(s或ser)、苏氨酸(t或thr)、半胱氨酸(c或cys)、脯氨酸(p或pro)、谷氨酸(e或glu)、天冬氨酸(a或asp)、天冬酰胺(n或asn)、谷氨酰胺(q或gln)、赖氨酸(k或lys)以及精氨酸(r或arg)。
87.脂肪族氨基酸可细分成四个亚组。“大脂肪族非极性亚组”由缬氨酸、亮氨酸和异亮氨酸组成。“脂肪族微极性亚组”由甲硫氨酸、丝氨酸、苏氨酸和半胱氨酸组成。“脂肪族极性/带电亚组”由谷氨酸、天冬氨酸、天冬酰胺、谷氨酰胺、赖氨酸和精氨酸组成。“小残基亚组”由甘氨酸和丙氨酸组成。带电/极性氨基酸组可细分成三个亚组:由赖氨酸和精氨酸组成的“带正电亚组”、由谷氨酸和天冬氨酸组成的“带负电亚组”以及由天冬酰胺和谷氨酰胺组成的“极性亚组”。
88.芳香族氨基酸可细分成两个亚组:由组氨酸和色氨酸组成的“氮环亚组”以及由苯丙氨酸和酪氨酸组成的“苯基亚组”。
89.保守氨基酸取代的实例包括上文所描述的亚组内的氨基酸取代,例如赖氨酸取代精氨酸,且反之亦然,使得可维持正电荷;谷氨酸取代天冬氨酸,且反之亦然,使得可维持负电荷;丝氨酸取代苏氨酸,使得可维持游离-oh;以及谷氨酰胺取代天冬酰胺,使得可维持游离-nh2。“半保守突变”包括本文所列的相同组内,但并非相同亚组内的氨基酸的氨基酸取代。举例来说,天冬氨酸取代天冬酰胺,或天冬酰胺取代赖氨酸,涉及相同组内,但不同亚组内的氨基酸。“非保守突变”涉及不同组之间的氨基酸取代,例如赖氨酸取代色氨酸,或苯丙氨酸取代丝氨酸等。
90.在一些实施方式中,pd-1结合剂可包含本文所提供的免疫球蛋白重链和轻链可变区或完整重链和轻链多肽、基本上由其组成或由其组成。分离的pd-1结合剂可以是包含至少指定免疫球蛋白重链和轻链可变区的任何类型的分子或构建体。因此,pd-1结合剂可为例如如本文所描述的整个免疫球蛋白或抗体,或抗原结合(pd-1结合)免疫球蛋白或抗体“片段”。关于抗体或免疫球蛋白使用的术语“片段”意指包含免疫球蛋白或抗体的某一部分并且结合靶抗原的任何分子或构建体。此种片段一般将包含至少重链和轻链可变区的部分,包括cdr,并且还可包括恒定区的部分,任选地连同通常并非免疫球蛋白或抗体的部分的其它元件(例如接头等)。此类“片段”的实例包括但不限于(i)fab片段,其为由v
l
、vh、c
l
和ch1结构域组成的单价片段,(ii)f(ab')2片段,其为包含在铰链区由二硫桥键连接的两个fab片段的二价片段,(iii)由抗体的单臂的v
l
和vh结构域组成的fv片段,(iv)fab'片段,其由使用温和还原条件断裂f(ab')2片段的二硫桥键产生;(v)双功能抗体;(vi)单链可变区(scfv),以及(vii)二硫键稳定的fv片段(dsfv)。
91.在一些实施方式中,pd-1结合剂包含免疫球蛋白重链恒定区,如可结晶片段(fc)区或其部分。fc区可为任何ig类别/子类(iga(iga1、iga2))、igd、ige、igg(igg1、igg2、igg3和igg4)、igm,包括其变异体。在一个特定实施方式中,pd-1结合剂包含结合抗原呈递细胞(例如树突状细胞、巨噬细胞、朗格汉斯细胞(langerhans cell)或b细胞)的fc受体的fc区。fc受体可为fcγ受体(fcγr),如fcγri(cd64)、fcγriia(cd32)、fcγriib(cd32)、fcγ
riiia(cd16a)、fcγriiib(cd16b)。在一个实施方式中,pd-1结合剂包含结合fcγr的fc区,如igg1。因此,在一些实施方式中,pd-1结合剂为“整个”或“完整”ig(即,抗体)。在其它实施方式中,pd-1结合剂为igg抗体,尤其igg1抗体。
92.分离的pd-1结合剂还可为抗体缀合物。在这方面,分离的pd-1结合剂可为包含pd-1结合剂(例如抗pd-1抗体或抗体片段)和另一生物活性部分的缀合物。举例来说,pd-1结合剂可与肽、荧光分子或化疗剂,尤其适用于抑制免疫反应的药剂缀合。
93.分离的pd-1结合剂可为或可获自人抗体、非人抗体或嵌合抗体。“嵌合”意指包含人和非人区两者的抗体或其片段。优选地,分离的pd-1结合剂为人源化抗体。“人源化”抗体为包含人抗体支架和至少一个获自或衍生自非人抗体的cdr的单克隆抗体。非人抗体包括从任何非人动物,例如啮齿动物(例如小鼠或大鼠)分离的抗体。人源化抗体可包含获自或衍生自非人抗体的一个、两个或三个cdr。在本发明的一个优选实施方式中,本发明pd-1结合剂的cdrh3获自或衍生自小鼠单克隆抗体,而本发明pd-1结合剂的其余可变区和恒定区获自或衍生自人单克隆抗体。
94.人抗体、非人抗体、嵌合抗体或人源化抗体可通过任何手段获得,包括通过体外来源(例如杂交瘤或重组产生抗体的细胞系)和体内来源(例如啮齿动物)。用于产生抗体的方法是所属领域中已知的并且描述于例如和milstein,《欧洲免疫学杂志(eur.j.immunol.)》,5:511-519(1976);harlow和lane(编),《抗体:实验室手册(antibodies:a laboratory manual)》,csh出版社(csh press)(1988);以及janeway等人(编),《免疫生物学(immunobiology)》,第5版,garland publishing,纽约州纽约(new york,ny)(2001);starkie等人,《公共科学图书馆
·
综合(plos one)》,11(3):e0152282(2016))中。在某些实施方式中,人抗体或嵌合抗体可使用转基因动物(例如小鼠)产生,其中一个或多个内源性免疫球蛋白基因被一个或多个人免疫球蛋白基因替换。其中内源性抗体基因被人抗体基因有效替换的转基因小鼠的实例包括但不限于medarex humab-mouse
tm
、麒麟(kirin)tc mouse
tm
和协和麒麟(kyowa kirin)km-mouse
tm
(参见例如lonberg,《自然
·
生物技术(nat.biotechnol.)》,23(9):1117-25(2005),和lonberg,《实验药理学手册(handb.exp.pharmacol.)》,181:69-97(2008))。人源化抗体可使用所属领域中已知的任何合适方法产生(参见例如an,z.(编),《治疗性单克隆抗体:从实验台到临床(therapeutic monoclonal antibodies:from bench to clinic)》,约翰
·
威利父子公司(john wiley&sons,inc.),新泽西州霍博肯(hoboken,new jersey)(2009)),包括例如将非人cdr移植到人抗体支架上(参见例如kashmiri等人,《方法(methods)》,36(1):25-34(2005);和hou等人,《生物化学杂志(j.biochem.)》,144(1):115-120(2008))。在一个实施方式中,人源化抗体可使用例如美国专利申请公开2011/0287485a1中所描述的方法产生。
95.pd-1结合剂可对人pd-1具有任何合适的亲和力。术语“亲和力”是指两种试剂的可逆结合的平衡常数,并且表示为解离常数(kd)。结合剂对配体的亲和力,如抗体对表位的亲和力可为例如约1皮摩尔(pm)至约100微摩尔(μm)(例如约1皮摩尔(pm)至约1纳摩尔(nm)、约1nm至约1微摩尔(μm)或约1μm至约100μm)。在一个实施方式中,pd-1结合剂可以小于或等于1nm(例如0.9nm、0.8nm、0.7nm、0.6nm、0.5nm、0.4nm、0.3nm、0.2nm、0.1nm、0.05nm、0.025nm、0.01nm、0.001nm,或由前述值中的任何两个限定的范围)的kd与pd-1蛋白结合。在另一实施方式中,pd-1结合剂可以小于或等于200pm(例如190pm、175pm、150pm、125pm、
110pm、100pm、90pm、80pm、75pm、60pm、50pm、40pm、30pm、25pm、20pm、15pm、10pm、5pm、1pm,或由前述值中的任何两个限定的范围)的kd与pd-1结合。在一些实施方式中,pd-1结合剂与食蟹猴pd-1具有交叉反应性,其中亲和力在关于人pd-1论述的任何前述范围内。免疫球蛋白对所关注的抗原或表位的亲和力可使用任何所属领域公认的分析来测量。此类方法包括例如荧光激活细胞分选(facs)、可分离小珠(例如磁珠)、表面等离子体共振(spr)、溶液相竞争抗原淘选和/或elisa(参见例如janeway等人(编),《免疫生物学》,第5版,garland publishing,纽约州纽约,2001)。
96.pd-1结合剂结合pd-1,但优选不完全抑制pd-1负调节免疫反应的能力,或在一些情况下,基本上不抑制pd-1负调节免疫反应的能力或甚至增强pd-1负调节免疫反应的能力。在一些实施方式中,pd-1结合剂不完全阻断pd-1与pd-l1之间的结合,或优选基本上不降低pd-1与pd-l1之间的结合。pd-1结合剂抑制pd-1对免疫反应的调节或pd-1与pd-l1的结合的程度的评定可使用如实例中所阐述的分析或所属领域中已知的其它分析进行。在一些实施方式中,pd-1结合剂抑制pd-1与pd-l1的结合不超过约80%、不超过约75%、不超过约70%、不超过约65%、不超过约60%、不超过约55%、不超过约50%、不超过约45%、不超过约40%、不超过约35%、不超过约30%、不超过约25%、不超过约20%、不超过约15%、不超过约10%。
97.使用/治疗方法
98.本发明提供一种通过向哺乳动物施用本文所描述的pd-1结合剂来抑制哺乳动物的免疫反应,尤其t细胞介导的免疫反应的方法。本发明进一步提供一种治疗其中pd-1活性降低(例如通过降低pd-l1结合而降低pd-1信号传导,如免疫系统的负调节降低)造成或促成疾病的病理效应的疾病或病症,或其中pd-1活性提高(例如通过pd-l1结合提高pd-1信号传导,如免疫系统的负调节提高)将具有治疗益处的任何疾病或病症的方法,所述方法包括向哺乳动物施用本文所描述的pd-1结合剂以减少或消除病症的任何症状,或预防或抑制此类症状的发作。如本文所用,免疫系统的负调节与免疫抑制同义。应了解,在一些情况下,可在症状发作之前(例如在暴露于触发免疫反应的抗原之前)施用pd-1结合剂,以便预防、抑制引入抗原后的免疫反应或降低其严重程度。
99.疾病或病症可为炎性或自身免疫病症。炎性或自身免疫病症的实例包括例如感染(病毒、细菌、真菌和寄生虫)、与感染相关的内毒素休克、关节炎、类风湿性关节炎、哮喘、慢性阻塞性肺病(copd)、盆腔炎性疾病、白塞病(behcet disease)、阿尔茨海默病(alzheimer's disease)、炎性肠病包括克罗恩病(crohn's disease)和溃疡性结肠炎、佩罗尼病(peyronie's disease)、乳糜泻、胆囊疾病、藏毛疾病、腹膜炎、银屑病、银屑病关节炎、血管炎、抗中性粒细胞细胞质抗体相关(anca)血管炎、手术粘连、中风、i型糖尿病、莱姆病(lyme disease)、关节炎、脑膜脑炎、自身免疫葡萄膜炎、免疫介导的中枢和外周神经系统炎性病症如多发性硬化症、狼疮(如系统性红斑狼疮和慢性盘状红斑狼疮)和吉兰-巴雷综合征(guillain-barr syndrome)、特应性皮炎、多发性肌炎、皮肌炎、自身免疫性肝炎、纤维性肺泡炎、格雷夫斯病(grave's disease)、iga肾病、特发性血小板减少性紫癜、梅尼埃病(meniere's disease)、天疱疮、类天疱疮、原发性胆汁性胆管炎、肝炎、结节病、硬皮病(局限性硬皮病、系统性硬皮病和进行性系统性硬皮病)、肉芽肿病伴多血管炎、其它自身免疫病症、胆管炎、胰腺炎、外伤(手术)、移植物抗宿主病、移植排斥反应、心脏病包括缺血性
疾病如心肌梗死以及动脉粥样硬化、结节性动脉周围炎(结节性多动脉炎和显微镜下多血管炎)、过敏性肉芽肿性血管炎、超敏性血管炎、主动脉炎综合征(高安动脉炎(takayasu arteritis))、颞动脉炎、血管内凝血、骨质再吸收、骨质疏松症、骨关节炎、牙周炎和胃酸过少、斯蒂尔病(still's disease)、柯根综合征(cogan's syndrome)、rs3pe、风湿性多肌痛、纤维肌痛综合征、抗磷脂抗体综合征、嗜酸性筋膜炎、吉兰-巴雷综合征、重症肌无力、慢性萎缩性胃炎、古德帕斯丘综合征(goodpasture's syndrome)、急进性肾小球肾炎、巨幼红细胞性贫血、溶血性贫血、自身免疫性中性粒细胞减少症、桥本甲状腺炎(hashimoto's thyroiditis)、自身免疫性肾上腺功能不全、原发性甲状腺功能减退、特发性阿狄森病(addison's disease)(慢性肾上腺功能不全)、妊娠疱疹、线状iga大疱皮肤病、获得性大疱性表皮松解、斑秃、白斑病、原田病(harada disease)、自身免疫性视神经病变、特发性无精子症、复发性胎儿丢失或与缺乏胎母耐受相关的不育症。
100.在一些实施方式中,疾病或病症为巨细胞动脉炎、风湿性多肌痛、原发性舍格伦综合症(syndrome)、tnf难治性类风湿性关节炎、斑秃、原发性胆汁性胆管炎(pbc)、移植物抗宿主病(gvhd)、白斑病、anca血管炎、1型糖尿病或非感染性葡萄膜炎。
[0101]“免疫反应”可需要例如抗体产生和/或免疫效应细胞(例如t细胞)的激活、炎性细胞因子的产生或本文所描述或所属领域中另外已知的任何适应症或病症。如本文所用,术语“治疗(treatment/treating)”等是指获得所需药理学和/或生理学效果。优选地,所述效果是治疗性的,即,所述效果部分或完全治愈疾病和/或可归因于疾病的不良症状。为此目的,本发明方法包括施用“治疗有效量”的pd-1结合剂。“治疗有效量”是指在必要剂量下且在必要时间段内有效实现所需治疗结果的量。治疗有效量可根据如个体的疾病状态、年龄、性别和体重以及pd-1结合剂在个体中引发所需反应的能力等因素而变化。
[0102]
替代地,药理学和/或生理学效果可为预防性的,即,所述效果完全或部分预防疾病或其症状。在这方面,本发明方法包括施用“预防有效量”的pd-1结合剂。“预防有效量”是指在必要剂量下且在必要时间段内有效实现所需预防结果(例如预防疾病发病)的量。
[0103]
pd-1结合剂可为适合于向哺乳动物施用的组合物的一部分。优选地,组合物为药学上可接受的(例如生理学上可接受的)组合物,其包含载剂,优选药学上可接受的(例如生理学上可接受的)载剂,以及本发明氨基酸序列、抗原结合剂或载体。在本发明的上下文内可使用任何合适的载剂,并且此类载剂在所属领域中众所周知。载剂的选择将部分地通过可施用组合物的特定部位和用于施用组合物的特定方法来确定。组合物还可包含用于治疗性分子(例如蛋白质或抗体)配制物,尤其肠胃外配制物的任何其它赋形剂,包括例如缓冲剂、张力调节剂、稳定剂、表面活性剂等。组合物任选地可为无菌的。组合物可冷冻或冻干储存并且在使用前在合适的无菌载剂中复原。组合物可根据例如《雷明顿:药学科学与实践(remington:the science and practice of pharmacy)》,第21版,利平科特威廉姆斯和维尔金斯出版社(lippincott williams&wilkins),宾夕法尼亚州费城(philadelphia,pa)(2001)中所描述的常规技术产生。
[0104]
pd-1结合剂的典型剂量可例如在1pg/kg至20mg/kg动物或人体重的范围内;然而,低于或高于此示例性范围的剂量在本发明的范围内。每日肠胃外剂量可为每天约0.00001μg/kg至约20mg/kg总体重(例如约0.001μg/kg、约0.1μg/kg、约1μg/kg、约5μg/kg、约10μg/kg、约100μg/kg、约500μg/kg、约1mg/kg、约5mg/kg、约10mg/kg,或由前述值中的任何两个限
定的范围),优选约0.1μg/kg至约10mg/kg总体重(例如约0.5μg/kg、约1μg/kg、约50μg/kg、约150μg/kg、约300μg/kg、约750μg/kg、约1.5mg/kg、约5mg/kg,或由前述值中的任何两个限定的范围),更优选约1μg/kg至5mg/kg总体重(例如约3μg/kg、约15μg/kg、约75μg/kg、约300μg/kg、约900μg/kg、约2mg/kg、约4mg/kg,或由前述值中的任何两个限定的范围),并且甚至更优选约0.5至15mg/kg体重(例如约1mg/kg、约2.5mg/kg、约3mg/kg、约6mg/kg、约9mg/kg、约11mg/kg、约13mg/kg,或由前述值中的任何两个限定的范围)。治疗或预防功效可通过定期评定所治疗的患者来监测。对于在数天或更长时间内重复施用,取决于病况,可重复治疗直至出现所需的疾病症状抑制。然而,其它剂量方案可能是有用的并且在本发明的范围内。所需剂量可通过单次推注施用组合物、通过多次推注施用组合物或通过连续输注施用组合物进行递送。
[0105]
pd-1结合剂可使用标准施用技术向哺乳动物施用,包括口服、静脉内、腹膜内、皮下、经肺、经皮、肌内、鼻内、经颊、舌下或栓剂施用。组合物优选适合于肠胃外施用。如本文所用,术语“肠胃外”包括静脉内、肌内、皮下、经直肠、经阴道和腹膜内施用。更优选地,组合物通过静脉内、腹膜内或皮下注射使用外周全身递送向哺乳动物施用。
[0106]
一旦向哺乳动物(例如人)施用,则本发明pd-1结合剂的生物活性可通过所属领域中已知的任何合适方法测量。举例来说,可通过确定特定pd-1结合剂的稳定性来评定生物活性。在本发明的一个实施方式中,pd-1结合剂(例如抗体)的体内半衰期在约30分钟与45天之间(例如约30分钟、约45分钟、约1小时、约2小时、约4小时、约6小时、约10小时、约12小时、约1天、约5天、约10天、约15天、约25天、约35天、约40天、约45天,或由前述值中的任何两个限定的范围)。在另一实施方式中,pd-1结合剂的体内半衰期在约2小时与20天之间(例如约5小时、约10小时、约15小时、约20小时、约2天、约3天、约7天、约12天、约14天、约17天、约19天,或由前述值中的任何两个限定的范围)。在另一实施方式中,pd-1结合剂的体内半衰期在约10天与约40天之间(例如约10天、约13天、约16天、约18天、约20天、约23天、约26天、约29天、约30天、约33天、约37天、约38天、约39天、约40天,或由前述值中的任何两个限定的范围)。
[0107]
本发明的pd-1结合剂可单独或与其它活性剂或药物组合施用。举例来说,pd-1结合剂可与用于治疗或预防本文所公开的疾病的其它药剂组合施用。在这方面,pd-1结合剂可与至少一种其它炎性或自身免疫病症抑制剂,包括例如其它单克隆抗体、疾病杀伤病毒、基因疗法和过继性t细胞转移和/或手术组合使用。本文所描述的本发明pd-1结合剂还可与至少一种其它免疫抑制剂,包括例如甲氨蝶呤、皮质类固醇和用于治疗自身免疫和炎性疾病的其它小分子药剂组合使用。当本发明方法治疗感染性疾病时,pd-1结合剂可与至少一种抗菌剂或至少一种抗病毒剂组合施用。在这方面,抗菌剂可为所属领域中已知的任何合适抗生素。抗病毒剂可为特异性靶向特定病毒的任何合适类型的任何疫苗(例如减毒活疫苗、亚单位疫苗、重组载体疫苗)和小分子抗病毒疗法(例如病毒复制抑制剂和核苷类似物)。
[0108]
除治疗用途之外,本文所描述的pd-1结合剂还可用于诊断或研究应用。在这方面,pd-1结合剂可用于诊断癌症或感染性疾病的方法。以类似方式,pd-1结合剂可用于监测针对与异常pd-1表达相关的疾病或病症所测试的受试者的pd-1蛋白水平的分析。研究应用包括例如利用pd-1结合剂和标记来检测样品中,例如人体体液或细胞或组织提取物中的pd-1
蛋白的方法。pd-1结合剂可在具有或不具有修饰的情况下使用,修饰如用可检测部分共价或非共价标记。举例来说,可检测部分可为放射性同位素(例如3h、
14
c、
32
p、
35
s或
125
i)、荧光或化学发光化合物(例如异硫氰酸荧光素(fluorescein isothiocyanate)、罗丹明(rhodamine)或虫荧光素(luciferin))、酶(例如碱性磷酸酶、β-半乳糖苷酶或辣根过氧化物酶)或辅基。在本发明的上下文中可采用所属领域中已知的用于将抗原结合剂(例如抗体)单独缀合到可检测部分的任何方法(参见例如hunter等人,《自然(nature)》,194:495-496(1962);david等人,《生物化学(biochemistry)》,13:1014-1021(1974);pain等人,《免疫学方法杂志(j.immunol.meth.)》,40:219-230(1981);以及nygren,《组织化学与细胞化学杂志(j.histochem.cytochem.)》,30:407-412(1982))。
[0109]
pd-1蛋白水平可通过所属领域中已知的任何合适方法使用本发明pd-1结合剂测量。此类方法包括例如放射免疫分析(ria)和facs。pd-1蛋白的正常或标准表达值可使用任何合适的技术建立,例如通过将包含或疑似包含pd-1多肽的样品与pd-1特异性抗体在适于形成抗原-抗体复合物的条件下组合。抗体用可检测物质直接或间接标记以便于结合或未结合抗体的检测。合适的可检测物质包括各种酶、辅基、荧光材料、发光材料和放射性材料(参见例如zola,《单克隆抗体:技术手册(monoclonal antibodies:a manual of techniques)》,crc出版公司(crc press,inc.)(1987))。随后将样品中表达的pd-1多肽量与标准值进行比较。
[0110]
pd-1结合剂可提供于试剂盒,即,预定量的试剂与用于进行诊断分析的说明书的包装组合中。如果用酶标记pd-1结合剂,则试剂盒宜包括酶所需的底物和辅因子(例如提供可检测发色团或荧光团的底物前体)。另外,试剂盒中可包括其它添加剂,如稳定剂、缓冲液(例如阻断缓冲液或裂解缓冲液)等。各种试剂的相对量可变化,以提供显著优化分析灵敏度的试剂的溶液中的浓度。试剂可以干粉(典型地冻干)形式提供,包括溶解时将提供具有适当浓度的试剂溶液的赋形剂。
[0111]
核酸、细胞、产生方法
[0112]
本发明还提供一种或多种编码pd-1结合剂或其个别重链或轻链免疫球蛋白多肽的分离或纯化的核酸序列。因此,在一个实施方式中,核酸编码如本文所提供的免疫球蛋白轻链可变区或完整免疫球蛋白轻链。在另一实施方式中,核酸编码如本文所提供的免疫球蛋白重链可变区或完整免疫球蛋白轻链。在又一实施方式中,核酸编码如本文所提供的免疫球蛋白轻链可变区或完整免疫球蛋白轻链以及免疫球蛋白重链可变区或完整免疫球蛋白重链两者。编码免疫球蛋白重链的核酸序列的实例由seq id no:53和55提供,其分别编码seq id no:29和47的重链可变区,并且分别编码seq id no:36和51的完整重链和轻链。编码免疫球蛋白轻链的核酸序列的实例由seq id no:54和56提供,其分别编码seq id no:35和49的轻链可变区,并且分别编码seq id no:37和52的完整重链和轻链。
[0113]
术语“核酸”和“核酸序列”旨在涵盖dna或rna的聚合物,即,多核苷酸,其可为单链或双链的并且可含有非天然或改变的核苷酸。如本文所用,术语“核酸”和“多核苷酸”是指任何长度的聚合形式的核苷酸,即核糖核苷酸(rna)或脱氧核糖核苷酸(dna)。这些术语是指分子的一级结构,并且因此包括双链和单链dna,以及双链和单链rna。作为等效物,术语包括由核苷酸类似物制成的rna或dna的类似物和修饰的多核苷酸,如但不限于甲基化和/或加帽多核苷酸。核酸典型地通过磷酸酯键连接以形成核酸序列或多核苷酸,不过所属领
域中已知许多其它键(例如硫代磷酸酯、硼烷磷酸酯等)。
[0114]
核酸可以是载体的一部分。载体可为例如质粒、附加体、粘粒、病毒载体(例如逆转录病毒或腺病毒)或噬菌体。合适的载体和载体制备方法是所属领域中众所周知的(参见例如sambrook等人,《分子克隆实验指南(molecular cloning,a laboratory manual)》,第3版,冷泉港出版社(cold spring harbor press),纽约州冷泉港(cold spring harbor,n.y.)(2001),以及ausubel等人,《现代分子生物学实验技术(current protocols in molecular biology)》,格林出版公司(greene publishing associates)和约翰
·
威利父子公司,纽约州纽约(1994))。
[0115]
除编码免疫球蛋白重链和/或轻链的核酸序列之外,载体还可包含表达控制序列,如启动子、增强子、聚腺苷酸化信号、转录终止子、内部核糖体进入位点(ires)等,其提供编码序列在宿主细胞中的表达。示例性表达控制序列是所属领域中已知的并且描述于例如goeddel,《基因表达技术:酶学方法(gene expression technology:methods in enzymology)》,第185卷,学术出版社(academic press),加利福尼亚州圣地亚哥(san diego,calif.)(1990)中。
[0116]
来自多种不同来源的大量启动子,包括组成型、诱导型和阻抑型启动子是所属领域中所众所周知的。启动子的代表性来源包括例如病毒、哺乳动物、昆虫、植物、酵母和细菌,并且来自这些来源的合适的启动子是容易获得的,或可以基于可公开获得的序列合成制备,例如获自保藏机构(如atcc)以及其它商业或个人来源。启动子可以是单向的(即,在一个方向上起始转录)或双向的(即,在3'或5'方向上起始转录)。启动子的非限制性实例包括例如t7细菌表达系统、pbad(araa)细菌表达系统、巨细胞病毒(cmv)启动子、sv40启动子、rsv启动子。诱导型启动子包括例如tet系统(美国专利5,464,758和5,814,618)、蜕皮激素诱导型系统(no等人,《美国国家科学院院刊》,93:3346-3351(1996))、t-rex
tm
系统(英杰(invitrogen),加利福尼亚州卡尔斯巴德(carlsbad,ca))、lacswitch
tm
系统(stratagene,加利福尼亚州圣地亚哥)以及cre-ert他莫昔芬(tamoxifen)诱导型重组酶系统(indra等人,《核酸研究》,27:4324-4327(1999);《核酸研究》,28:e99(2000);美国专利7,112,715;以及kramer和fussenegger,《分子生物学方法(methods mol.biol.)》,308:123-144(2005))。
[0117]
如本文所用,术语“增强子”是指增加例如与其可操作地连接的核酸序列的转录的dna序列。增强子可位于距核酸序列的编码区许多千碱基处,并且可介导调节因子的结合、dna甲基化的模式或dna结构的变化。来自多种不同来源的大量增强子是所属领域中所众所周知的并且可作为克隆的多核苷酸或在克隆的多核苷酸内获得(来自例如保藏机构(如atcc)以及其它商业或个人来源)。许多包含启动子(如常用的cmv启动子)的多核苷酸还包含增强子序列。增强子可位于编码序列的上游、内部或下游。
[0118]
载体还可包含选择标记基因。如本文所用,术语“选择标记基因”是指一种核酸序列,其在对应选择剂存在下允许表达所述核酸序列的细胞被特异性选择或排除。合适的选择标记基因是所属领域中已知的并且描述于例如国际专利申请公开wo 1992/008796和wo 1994/028143;wigler等人,《美国国家科学院院刊》,77:3567-3570(1980);o'hare等人,《美国国家科学院院刊》,78:1527-1531(1981);mulligan和berg,《美国国家科学院院刊》,78:2072-2076(1981);colberre-garapin等人,《分子生物学杂志》,150:1-14(1981);santerre等人,《基因(gene)》,30:147-156(1984);kent等人,《科学》,237:901-903(1987);wigler等
人,《细胞(cell)》,11:223-232(1977);szybalska和szybalski,《美国国家科学院院刊》,48:2026-2034(1962);lowy等人,《细胞》,22:817-823(1980);以及美国专利5,122,464和5,770,359中。
[0119]
在一些实施方式中,载体为“附加型表达载体”或“附加体”,其能够在宿主细胞中复制,并且在适当选择压力存在下保持为宿主细胞内的染色体外dna区段(参见例如conese等人,《基因疗法(gene therapy)》,11:1735-1742(2004))。代表性市售附加型表达载体包括但不限于利用爱泼斯坦-巴尔(epstein barr)核抗原1(ebna1)和爱泼斯坦-巴尔病毒(ebv)复制起点(orip)的附加型质粒。来自英杰(加利福尼亚州卡尔斯巴德)的载体prep4、pcep4、prep7和pcdna3.1以及来自stratagene(加利福尼亚州拉荷亚(la jolla,ca))的载体pbk-cmv代表使用t抗原和sv40复制起点代替ebna1和orip的附加型载体的非限制性实例。
[0120]
其它合适的载体包括整合表达载体,其可随机整合到宿主细胞的dna中,或可包括重组位点以使得能够在表达载体与宿主细胞的染色体之间进行特异性重组。此类整合表达载体可利用宿主细胞的染色体的内源性表达控制序列来实现所需蛋白质的表达。以位点特异性方式整合的载体的实例包括例如来自英杰(加利福尼亚州卡尔斯巴德)的flp-in系统的组件(例如pcdna
tm
5/frt)或cre-lox的组件,如可见于来自stratagene(加利福尼亚州拉荷亚)的pexchange-6核心载体。随机整合到宿主细胞染色体中的载体的实例包括例如来自赛默飞世尔(thermofisher)(加利福尼亚州卡尔斯巴德)的pcdna3.3(当在不存在t抗原的情况下引入时)、来自密理博(millipore)(马萨诸塞州比尔里卡(billerica,ma))的ucoe以及来自普洛麦格(promega)(威斯康星州麦迪逊(madison,wi))的pci或pfn10a(act)flexi
tm
。
[0121]
还可使用病毒载体。代表性市售病毒表达载体包括但不限于可获自crucell,inc.(荷兰莱顿(leiden,the netherlands))的基于腺病毒的per.c6系统、来自赛默飞世尔(加利福尼亚州卡尔斯巴德)的基于慢病毒的plp1以及来自安捷伦(agilent)(stratagene,加利福尼亚州拉荷亚)的逆转录病毒载体pfb-erv加pcfb-egsh。
[0122]
编码本发明氨基酸序列的核酸序列可在同一载体上(即,顺式)提供给细胞。单向启动子可用于控制每个核酸序列的表达。在另一实施方式中,双向启动子与单向启动子的组合可用于控制多个核酸序列的表达。替代地,编码本发明氨基酸序列的核酸序列可在单独载体上(即,反式)提供给细胞群。每个单独载体中的每个核酸序列可包含相同或不同表达控制序列。单独载体可同时提供给细胞。
[0123]
可将包含编码本发明氨基酸序列的核酸的载体引入到能够表达由此编码的多肽的宿主细胞中,包括任何合适的原核或真核细胞。因此,本发明提供包含本发明载体的体外细胞或细胞系。本发明还提供表达免疫球蛋白重链和/或轻链多肽,或表达pd-1结合剂的体外细胞或细胞系。优选的宿主细胞是可容易且可靠地生长、具有相当快的生长速率、具有良好表征的表达系统并且可容易且有效地转化或转染的宿主细胞。
[0124]
合适的原核细胞的实例包括但不限于来自芽孢杆菌属(bacillus)(如枯草芽孢杆菌(bacillus subtilis)和短芽孢杆菌(bacillus brevis))、埃希氏菌属(escherichia)(如大肠杆菌(e.coli))、假单胞菌属(pseudomonas)、链霉菌属(streptomyces)、沙门氏菌属(salmonella)以及欧文氏菌属(erwinia)的细胞。尤其适用的原核细胞包括大肠杆菌的
各种菌株(例如k12、hb101(atcc编号33694)、dh5α、dh10、mc1061(atcc编号53338)以及cc102)。
[0125]
在一些实施方式中,将载体引入到真核细胞中。合适的真核细胞是所属领域中已知的并且包括例如酵母细胞、昆虫细胞和哺乳动物细胞。合适的酵母细胞的实例包括来自克鲁维酵母属(kluyveromyces)、毕赤酵母属(pichia)、鼻孢子菌属(rhino-sporidium)、酵母菌属(saccharomyces)和裂殖酵母属(schizosaccharomyces)的酵母细胞。优选的酵母细胞包括例如酿酒酵母(saccharomyces cerivisae)和巴斯德毕赤酵母(pichia pastoris)。
[0126]
合适的昆虫细胞描述于例如kitts等人,《生物技术(biotechniques)》,14:810-817(1993);lucklow,《现代生物技术观点(curr.opin.biotechnol.)》,4:564-572(1993);和lucklow等人,《病毒学杂志(j.virol.)》,67:4566-4579(1993)中。优选的昆虫细胞包括sf-9和hi5(英杰,加利福尼亚州卡尔斯巴德)。
[0127]
在一些实施方式中,哺乳动物细胞用于本发明。许多合适的哺乳动物宿主细胞是所属领域中已知的,并且许多可获自美国典型培养物保藏中心(american type culture collection;atcc,弗吉尼亚州马纳萨斯(manassas,va))。合适的哺乳动物细胞的实例包括但不限于中国仓鼠卵巢细胞(cho)(例如atcc编号ccl61)、cho dhfr细胞(例如urlaub等人,《美国国家科学院院刊》,97:4216-4220(1980))、人胚肾(hek)293或293t细胞(例如atcc编号crl1573)以及3t3细胞(例如atcc编号ccl92)。其它合适的哺乳动物细胞系为猴cos-1(例如atcc编号crl1650)和cos-7细胞系(例如atcc编号crl1651),以及cv-1细胞系(例如atcc编号ccl70)。其它示例性哺乳动物宿主细胞包括灵长类动物细胞系和啮齿动物细胞系,包括小鼠细胞系ns0,一种小鼠骨髓瘤细胞系mopc21的衍生物(例如tysabri),以及转化细胞系。正常二倍体细胞、衍生自原代组织的体外培养的细胞株以及原代外植体也是合适的。其它合适的哺乳动物细胞系包括但不限于小鼠成神经细胞瘤n2a细胞、海拉(hela)、小鼠l-929细胞以及bhk或hak仓鼠细胞系,其均可获自atcc。选择合适的哺乳动物宿主细胞的方法以及细胞转化、培养、扩增、筛选和纯化的方法是所属领域中已知的。
[0128]
在一些实施方式中,哺乳动物细胞为人细胞。举例来说,哺乳动物细胞可为人淋巴样或淋巴样衍生细胞系,如前b淋巴细胞来源的细胞系。人淋巴样细胞系的实例包括但不限于ramos(例如crl-1596)、daudi(例如ccl-213)、eb-3(例如ccl-85)、raji细胞(例如ccl-86)以及其衍生物。
[0129]
编码本发明氨基酸序列的核酸序列可通过任何合适的技术,如通过“转染”、“转化”或“转导”引入到细胞中。如本文所用,“转染”、“转化”或“转导”是指通过使用物理或化学方法将一种或多种外源性多核苷酸引入到宿主细胞中。许多转染技术是所属领域中已知的,并且包括例如磷酸钙dna共沉淀(参见例如murray e.j.(编),《分子生物学方法》,第7卷,《基因转移和表达方案(gene transfer and expression protocols)》,胡马纳出版社(humana press)(1991));deae-葡聚糖;电穿孔;阳离子脂质体介导的转染;钨粒子促进的微粒轰击(johnston,《自然》,346:776-777(1990));以及磷酸锶dna共沉淀(brash等人,《分子与细胞生物学》,7:2031-2034(1987))。在感染性粒子在合适的包装细胞(其中许多是市售的)中生长后,可将噬菌体或病毒载体引入到宿主细胞中。
[0130]
核酸和细胞可用于任何目的,如用于制造本文所描述的pd-1结合剂。在这方面,本发明提供一种制备pd-1结合剂的方法,其包括培养包含编码pd-1结合剂的重和/或轻免疫
球蛋白多肽的核酸的细胞。换句话说,所述方法包括在细胞中表达编码pd-1结合剂的免疫球蛋白重链和/或轻链的核酸。应了解,免疫球蛋白重链和轻链可由给定细胞中的单一核酸表达,或免疫球蛋白重链和轻链可由相同细胞中的单独核酸表达。所述方法可进一步包括使用已知技术从细胞或细胞培养基中收集和/或纯化pd-1结合剂。
[0131]
以下实施例进一步说明本发明,但当然,不应将其理解为以任何方式限制本发明范围。
[0132]
实施例
[0133]
以下实施例描述根据本发明的实施例的特定抗pd-1抗体重链多肽和轻链多肽序列。这些实施例中所用的抗体如下文所阐述。
[0134]
437m5-112抗体衍生自对来自经免疫小鼠脾的分选pd-1结合igg转换b细胞进行的单细胞pcr。3.7c6抗体衍生自通过标准融合技术从经免疫小鼠的脾细胞产生的小鼠杂交瘤。抗体使用本文中所描述的标准技术进行人源化。最终优化抗体在cho细胞中表达。抗体序列概述于表1a、1b和1c中,其中“h”和“l”分别是指重链和轻链,并且根据kabat和imgt定义两者(表1b),或对于某些抗体根据kabat或imgt(表1c)确定cdr包括氨基酸。
[0135]
表1a
[0136][0137][0138]
表1b
[0139][0140]
表1c
[0141][0142][0143]
实施例1
[0144]
本实施例证明本文所公开的抗体展现与稳定转染的hek 293细胞中表达的人和食蟹猴pd-1的饱和结合。
[0145]
将hek 293细胞稳定转染以表达人pd-1或食蟹猴pd-1。通过accutase
tm
处理(innovative cell technologies,加利福尼亚州圣地亚哥)收集细胞,将表达食蟹猴pd-1的细胞用亲脂性荧光染料did(赛默飞世尔科技(thermofisher scientific),加利福尼亚州卡尔斯巴德)处理,且随后与相同数量的表达人pd-1的未标记hek 293细胞混合。将细胞(每个样品总共2
×
105个)在4℃下伴随轻轻摇动用指定浓度的每种抗体染色40分钟,离心并且洗涤一次。将细胞在室温下在含2%多聚甲醛的磷酸盐缓冲盐水(pbs)中固定10分钟,洗涤,并且在4℃下伴随轻轻摇动用藻红蛋白(pe)缀合山羊抗人κ(southern biotechnology,阿拉巴马州伯明翰(birmingham,al))检测抗体15分钟。将细胞洗涤,再悬浮,并且在bd facsarray
tm
(bd生物科学(bd biosciences),加利福尼亚州圣何塞(san jose,ca))上对结合的抗体荧光进行定量。使用分析软件(flowjo,llc)分析数据的中值荧光强度(mfi)。在graphpad prism 5.0(graphpad software)中使用log(激动剂)对反应-可变斜率(4参数)曲线拟合确定ec
50
值。结果如图1和2所示,并且ec
50
如表2(人)和表3(食蟹猴)所示。ape06339为对鸡卵溶菌酶具有特异性的人igg1同种型对照抗体。ape08145为参考抗pd-1抗体。
[0146]
表2.
[0147]
抗体类型ec
50
(nm)ape12043.02437m5-1124.88ape12043.03437m5-1123.13ape12043.05437m5-1122.95ape12095.033.7c611.92ape12095.043.7c69.04ape12095.063.7c611.82ape08145.05参考抗pd120.80ape08145.06参考抗pd110.91ape06339.08igg1同种型对照无结合
[0148]
表3.
[0149]
抗体类型ec
50
(nm)ape12043.02437m5-1123.69ape12043.03437m5-1122.69ape12043.05437m5-1122.59ape12095.033.7c67.99ape12095.043.7c66.17ape12095.063.7c67.47ape08145.05参考抗pd191.14ape08145.06参考抗pd165.68ape06339.08igg1同种型对照无结合
[0150]
实施例2
[0151]
此实施例证明本文所公开的抗体与2天抗cd3/抗cd28激活的人外周血cd4
+
t细胞结合。
[0152]
原代人外周血cd4
+
t细胞使用磁珠分离(cd4
+
t细胞分离试剂盒,美天旎生物技术公司(miltenyi biotec),加利福尼亚州奥本(auburn,ca))外周血单核细胞(pbmc)制备,并且在6孔板中用塑料涂布的抗cd3和抗cd28激活48小时。将细胞(每个样品1
×
105个)洗涤并在v型底96孔板中在4℃下伴随轻轻摇动用指定浓度的每种抗体染色30分钟,离心并且洗涤一次。将细胞在室温下在含4%多聚甲醛的pbs中固定10分钟,洗涤,并且在4℃下用alexa fluor 647缀合f(ab')2山羊抗人igg fc(jackson immunoresearch,宾夕法尼亚州西格罗夫(west grove,pa))检测抗体10分钟。将细胞洗涤,再悬浮,并且在bd facsarray
tm
(bd生物科学,加利福尼亚州圣何塞)上对结合的抗体荧光进行定量。使用分析软件(flowjo,llc)分析数据的几何平均荧光强度(mfi)。在graphpad prism7.02(graphpad software)中使用log(激动剂)对反应-可变斜率(4参数)曲线拟合确定ec
50
值。结果如图3所示,并且ec
50
值如表4所示。ape10787为对pd-1具有特异性的人igg1阳性对照抗体,并且ape06339为对鸡卵溶菌酶具有特异性的人igg1同种型对照抗体。
[0153]
表4.
[0154][0155][0156]
实施例3
[0157]
此实施例记录了本文所公开的抗体与pd-l1和pd-l2竞争与人pd-1转染的cho-k1细胞的结合的程度。
[0158]
进行竞争分析以测试抗pd-1抗体与pd-l1-fc或pd-l2-fc构建体之间对pd-1结合的竞争。如图4-7中所示,测试抗体显示与pd-l1的中度竞争(约70%最大抑制)和与pd-l2的强竞争;另一测试抗体显示与pd-l1的弱/最小竞争(约15%最大抑制)和与pd-l2的中度竞争(约70%最大抑制)。
[0159]
cho-k1细胞经稳定转染以表达人pd-1,并且选择高水平表达克隆。通过accutase
tm
处理(innovative cell technologies,加利福尼亚州圣地亚哥)收集细胞,并且将其置于u型底96孔板中(2
×
105个细胞/孔)。为了测试pd-l1竞争,将抗体连续稀释并且与dylight650(dyl650)标记的人pd-l1-小鼠igg1 fc融合蛋白(艾博抗(abcam),马萨诸塞州剑桥(cambridge,ma))预混合(10nm最终浓度dyl650-pd-l1-fc并且抗体浓度如图4和5中所指示)。在冰上培育10分钟后,将抗体/dyl650-pd-l1-fc混合物在4℃下伴随轻轻摇动添加到细胞中,持续30分钟。将细胞离心,洗涤一次,再悬浮于含有碘化丙啶的缓冲液中,并且在bd facsarray
tm
(bd生物科学,加利福尼亚州圣何塞)上对结合的pd-l1-fc荧光进行定量。使用分析软件(flowjo,llc)分析数据的pd-l1几何中值荧光强度(mfi)。在graphpad prism 7.02(graphpad software)中使用log(激动剂)对反应-可变斜率(4参数)曲线拟合确定ic
50
值。结果如图4和5所示,并且所得ic
50
值如表4-5所示。ape10787(“10787”)为对pd-1具有特异性的人igg1阳性对照拮抗剂抗体,并且ape06339(“06339.08”)为对鸡卵溶菌酶具有特异性的人igg1同种型对照抗体。ape08145(“08145.05”和“08145.06”)为参考抗体。ape12043(“12043.02”和“12043.03”)为实施例1中所描述的437m5-112抗pd-1抗体。ape12095(“12095.03”和“12095.04”)为实施例中所描述的3.7c6抗pd-1抗体。
[0160]
通过accutase
tm
处理(innovative cell technologies,加利福尼亚州圣地亚哥)收集稳定表达高水平人pd-1的cho-k1细胞克隆,并且将其置于u型底96孔板中(2
×
105个细胞/孔)。为了测试pd-l2竞争,将抗体连续稀释并且与dyl650标记的人pd-l2-小鼠igg1fc融合蛋白(艾博抗,马萨诸塞州剑桥)预混合(10nm最终浓度dyl650-pd-l2-fc并且抗体浓度如图6和7中所示)。在冰上培育10分钟后,将抗体/dyl650-pd-l2-fc混合物在4℃下伴随轻轻摇动添加到细胞中,持续30分钟。将细胞离心,洗涤一次,再悬浮于含有碘化丙啶的缓冲液中,并且在bd facsarray
tm
(bd生物科学,加利福尼亚州圣何塞)上对结合的pd-l2-fc荧光进行定量。使用分析软件(flowjo,llc)分析数据的pd-l2几何中值荧光强度(mfi)。在graphpad prism 7.02(graphpad software)中使用log(激动剂)对反应-可变斜率(4参数)曲线拟合确定ic
50
值。结果如图6和7所示,并且所得ic
50
值如表6-7所示。ape10787
(“10787”)为对pd-1具有特异性的人igg1阳性对照拮抗剂抗体,并且ape06339(“06339.08”)为对鸡卵溶菌酶具有特异性的人igg1同种型对照抗体。ape08145(“08145.05”和“08145.06”)为参考抗体。ape12043(“12043.02”和“12043.03”)为实施例1中所描述的437m5-112抗pd-1抗体。ape12095(“12095.03”和“12095.04”)为实施例1中所描述的3.7c6抗pd-1抗体。
[0161]
表4.pd-l1-fc竞争
[0162]
抗体类型ic
50
(nm)ape10787抗pd-1阳性对照1.89ape06339.08igg1同种型对照无竞争ape08145.05参考抗pd-175.2ape08145.06参考抗pd-1119.1ape12043.02437m5-1111.6ape12043.03437m5-1112.2
[0163]
表5.pd-l1-fc竞争
[0164]
抗体类型ic
50
(nm)ape10787抗pd-1阳性对照1.59ape06339.08igg1同种型对照无竞争ape12095.033.7c6495.1ape12095.043.7c6632.1
[0165]
表6.pd-l2-fc竞争
[0166]
抗体类型ic
50
(nm)ape10787抗pd-1阳性对照2.53ape06339.08igg1同种型对照无竞争ape08145.05参考抗pd-1无竞争ape08145.06参考抗pd-1无竞争ape12043.02m5-115.8ape12043.03m5-115.5
[0167]
表7.pd-l2-fc竞争
[0168]
抗体类型ic
50
(nm)ape10787抗pd-1阳性对照1.78ape06339.08igg1同种型对照无竞争ape12095.033.7c630.4ape12095.043.7c620.0
[0169]
实施例4
[0170]
此实施例证明本文所公开的抗体在基于小珠和基于板的激动剂分析中显示一致的激动剂活性。
[0171]
对于基于小珠的激动剂分析,将m-280对甲苯磺酰基激活(m-280tosylactivated)(英杰-生命技术(life technologies),加利福尼亚州
卡尔斯巴德)根据制造商的说明书与抗cd3(10μg)、抗pd-1或pd-l1-fc(40μg)和结合鸡卵溶菌酶的阴性对照抗体(50μg)偶联,总共偶联100μg蛋白质。通过流式细胞术定量小珠偶联的程度。使用磁珠分离(cd4
+
t细胞分离试剂盒,美天旎生物技术公司,加利福尼亚州奥本)pbmc制备原代人外周血cd4
+
t细胞。在可溶性抗cd28(ebioscience;250ng/ml、100ng/ml或50ng/ml,如所示)存在下,将纯化的cd4
+
t细胞(1
×
105个细胞/孔)与如所示的不同数量的小珠(4:1、2:1或1:1的小珠:t细胞比)一起孵育72小时。通过elisa(安迪生物公司(r&d systems),明尼苏达州明尼阿波利斯(minneapolis,mn))定量培养上清液中分泌的ifnγ。如图8a和8b中所示以及表8中所概述,本文所公开的抗pd-1抗体(437m5-112和3.7c6)在小珠分析中展现与pd-l1-fc相当的一致抑制(激动剂)活性。
[0172]
如图9a-9c中所示,3.7c6变异体ape12093和ape12095为基于小珠的分析中的最好激动剂,与pd-l1-fc相比抑制更强。与亲本抗体ape11844相比,437m5-112变异体ape12043和ape12044具有提高的激动剂活性。
[0173]
表8.
[0174]
候选抗体测试的供体数量ifnγ抑制%(平均值
±
sem)437m5-112(ape12043)783
±
63.7c6(ape12095)677
±
7pd-l1-fc1083
±3[0175]
基于小珠的激动剂分析中测试的本文所公开的抗pd-1抗体跨供体对ifnγ产生的抑制如图10a-10b和图11a-11c所示。
[0176]
对于基于板的激动剂分析,将96孔板依序在4℃下用抗cd3(0.3μg/ml)涂布过夜,将孔抽吸且用pbs洗涤,并且随后经历在4℃下用各种浓度的抗pd-1抗体或pd-l1-fc(如图12-14中所示)进行的第二涂布过夜。将新鲜或冷冻的人pbmc在植物血凝素(pha;2μg/ml)存在下培养48小时,收集,洗涤以去除pha,并且在il-2存在下培养过夜。将细胞收集,洗涤并且在抗cd3/抗pd-1涂布的孔(1
×
105个细胞/孔)中在人γ球蛋白(100μg/ml)存在下孵育48小时。通过elisa(安迪生物公司,明尼苏达州明尼阿波利斯)定量培养上清液中分泌的il-2。pd-1抗体跨三个pbmc供体对il-2产生的抑制如图12a-12b、13a-13b和14a-14b所示。本文所公开的抗pd-1抗体对il-2产生的抑制与由pd-l1-fc诱导的抑制相当。
[0177]
实施例5
[0178]
此实施例证明本文所公开的抗pd-1抗体在阻断性抗pd-l1/抗pd-l2存在下在溶液中显示激动剂抗体活性。
[0179]
将来自破伤风类毒素免疫供体的全血1:3稀释,并且在u型底96孔板中在破伤风类毒素(astarte biologics,华盛顿州波塞尔(bothell,wa);5μg/ml)、抗pd-l1+抗pd-l2(biolegend,加利福尼亚州圣地亚哥;各2μg/ml)以及指定浓度的四聚体pd-l1-fc、本文所描述的抗pd-1igg1抗体(3.7c6 ape12095;437m5-112 ape12043)或对照人igg1存在下培养4天。通过elisa(安迪生物公司,明尼苏达州明尼阿波利斯)定量培养上清液中分泌的ifnγ。在此破伤风类毒素回忆反应全血分析中,在阻断性抗pd-l1/抗pd-l2存在下观察到本文所描述的抗pd-1抗体的强效激动剂抗体活性,如图15a(阳性和阴性对照)和15b(抗pd-1抗体)中所示。
[0180]
将igg1 3.7c6抗pd-1抗体与制备为人igg2的相同抗体进行比较(图15c和15d)。抗
体的抗pd-1igg2形式具有与抗pd-1igg1相同的激活的t细胞结合,但不显示激动剂活性。抗体的igg2、igg4或igg1(l234a、l235a)同种型也缺乏激动剂活性,这证明功能性激动剂活性需要fcγr接合/抗体簇聚。
[0181]
实施例6
[0182]
此实施例证明本文所提供的抗pd-1抗体以浓度依赖性方式降低全血中的免疫反应。
[0183]
当供体先前经历暴露于所关注抗原时,用适当抗原体外刺激的人全血将引发特异性t细胞回忆免疫反应。免疫反应可通过ifn-γ和il-17a水平来衡量。
[0184]
预筛选健康人供体(n=6)对抗原破伤风类毒素的体外回忆反应性,所述供体可能先前在普通破伤风疫苗接种过程期间暴露于所述抗原。将来自供体的全血在破伤风类毒素和抗pd-1 3.7c6抗体(ape12890)或不相关人igg1同种型对照存在下培养96小时。96小时培养后,使用细胞因子检测试剂盒(meso scale diagnostics,马里兰州罗克维尔(rockville,md))分析上清液是否存在细胞因子ifn-γ和il-17a。结果如图22a和22b所示。
[0185]
所有供体通过产生大量ifn-γ和il-17a对破伤风类毒素特异性刺激起反应,但一些供体反应比其它供体更强烈。相对于igg1同种型对照抗体,3.7c6抗体以浓度依赖性方式减少ifn-γ和il-17a两者的分泌,如图22a和22b中所示。人全血破伤风类毒素回忆分析中3.7c6的中值ic
50
和平均ic
50
±
sd对于ifn-γ抑制分别确定为0.053nm和0.091
±
0.115nm,并且对于il-17a抑制分别确定为0.097nm和0.119
±
0.098nm。
[0186]
实施例7
[0187]
此实施例证明本文所公开的抗体的结合动力学(亲和力)和热稳定性。
[0188]
3.7c6(ape12095.06和ape12537.01)显示通过表面等离子体共振(spr)测量的与人和食蟹猴pd-1的结合动力学相当。紧密结合动力学接近仪器的极限。spr数据与通过动力学排除分析确定的对ape12095的平衡结合亲和力相当一致。最终亲和力测量值为:对人pd-1的kd:75pm;以及对食蟹猴pd-1的kd:450pm。
[0189]
437m5-112(ape12043.05和ape12538.01)也显示通过spr测量的与人和食蟹猴pd-1的结合动力学非常相当。紧密结合动力学接近仪器的极限。spr数据与通过确定的对ape12043的平衡结合亲和力相当一致。最终亲和力测量值为:对人pd-1的kd:51pm;以及对食蟹猴pd-1的kd:210pm。通过表面等离子体共振和对本文所公开的抗pd-1抗体的kd测量的概述如表9所示。
[0190]
表9.
[0191][0192][0193]
将ape12537抗体结合亲和力和热稳定性与命名为“030-13263/030-13264”的类似抗体进行比较。ape12537与030-13263/030-13264的不同之处在于重链中的两个突变:
a52ai和d62q,按kabat编号(使用序列表中的位置为a53i和d63q)。表10中所提供的结果显示这些突变提高结合亲和力和热稳定性。
[0194]
表10
[0195][0196]
在biacore t200(ge医疗生命科学(ge healthcare life sciences),宾夕法尼亚州匹兹堡(pittsburgh,pa))上进行通过表面等离子体共振(spr)筛选的kd测量,并且动力学常数使用1:1结合模型全局拟合。利用预固定有链霉亲和素的羧基甲基化葡聚糖表面,将生物素化人或食蟹猴pd-1细胞外结构域单体以1nm浓度捕获于biacore传感器芯片sa(ge医疗生命科学,宾夕法尼亚州匹兹堡)上。捕获抗原水平被靶向以产生低反应,以防止亲合力对解离速率的影响。tm测量值通过基于荧光的热漂移和差示扫描量热法来确定。
[0197]
实施例8
[0198]
此实施例证明本文所公开的抗pd-1抗体在异种nsg/hu-pbmc移植物抗宿主病(gvhd)模型中显示体内功效。
[0199]
测试本文所公开的抗pd-1抗体的功效的异种nsg/hu-pbmc gvhd模型在杰克逊实验室体内药理学服务(the jackson laboratoryin vivo pharmacology services)(加利福尼亚州萨克拉门托(sacramento,ca))进行。如图16a所示,nod-scid il2rγ
null
(nsg)小鼠用1gy辐照,接着在每只小鼠中静脉内注射3
×
106个人pbmc。在pbmc注射后一天开始,抗体以10mg/kg腹膜内给药,每周两次持续4周,并且贝拉西普(belatacept)生物类似药以75μg/小鼠腹膜内给药,每周三次持续4周。研究中的给药方案和剂量组如图16b所示。每周通过体重减轻、死亡和gvhd评分监测疾病三次,gvhd评分测量:体重减轻、活动、皮毛质地、苍白和体态。显示体重减轻大于10%的动物每天进行疾病监测,并且显示与起始体重相比体重减轻大于20%的动物进行安乐死。
[0200]
与同种型对照相比,本文所公开的3.7c6 pd-1激动剂抗体(ape12095)在到达10%体重减轻的时间方面显示统计显著功效(图16c)。与同种型对照相比,本文所公开的437m5-112抗pd-1激动剂抗体也在到达10%体重减轻的时间方面显示统计显著功效(图16d)。对两种抗pd-1抗体的反应是双峰的,每个组中一定比例的动物在研究中完全存活(图16c和16d)。
[0201]
实施例9
[0202]
此实施例展现食蟹猴单次剂量药代动力学和耐受性研究的研究设计。
[0203]
食蟹猴单次剂量药代动力学和耐受性研究的研究设计如表11所示。研究期间的评定如下:
[0204]
·
临床病理学,给药前(两次),第2、6、22和35天(查尔斯河实验室(charles river laboratories;crl))
[0205]
·
血液facs组-主要白细胞群体和20个t细胞亚群,给药前(两次),第2、6、22和35天(crl)
[0206]-b、t、nk、单核细胞
[0207]-cd4、cd8、t中央记忆、t效应记忆、pd-1
+
、激活的cd4
+
和cd8
+
、treg
[0208]
·
受体占有率,第4、14、28、35天
[0209]
·
pk样品分析,抗药物抗体分析,给药前和第35天
[0210]
·
血清细胞因子分析(17重:il-1β、il-1ra、il-2、il-4、il-5、il-6、il-8、il-10、il-12p40、il-13、il-17a、g-csf、gm-csf、ifnγ、mip1β、mip1α、tnf-α),给药前,4小时和24小时,第7天和第35天
[0211]
·
使用(certara,美国)的pk参数分析。
[0212]
两种pd-1抗体显示表现良好的药代动力学特性,在第28天在所有动物中具有可检测的药物水平(图17a和17b)。研究在第35天完成。剂量耐受良好,未观察到不良临床征象或临床病理学变化。研究结果如表11和12所示。
[0213]
表11.食蟹猴单次剂量药代动力学和耐受性研究的研究设计。
[0214][0215]
表12.药代动力学参数、细胞因子和抗药物抗体反应的分析。
[0216][0217]
*平均值(
±
sd),3只动物/组。tmax,到达cmax的时间;cmax,最大浓度;c0,初始浓度;aucall,到最后一次观察的曲线下面积;aucinf_obs,基于最后一次观察到无穷大的auc;cavg,平均浓度;clss,稳态清除率;vz,末期分布容积;vss obs,基于最后一次观察的稳态分布容积;f,生物利用度%。
[0218]
表13.抗药物抗体(ada)反应和细胞因子的分析
[0219][0220][0221]
如所显示,用抗体ape12538.01给药的所有6只动物在第36天具有可测量/低滴度抗药物抗体。用抗体ape12537.01给药的6只动物中的两只在第36天具有可测量/低滴度抗药物抗体。评估的任何细胞因子都不存在有意义的变化。进一步如图18a和18b所示,除#1001(用437m5-112 iv给药)外,在所有动物中观察到维持的受体占有率直到第14天;在大部分动物中发现一定的占有率直到第28天。
[0222]
实施例10
[0223]
此实施例证明本文所公开的抗pd-1抗体诱导磷酸酶shp2募集到pd-1转染的jurkat细胞中的pd-1细胞质结构域。
[0224]
将抗体3.7c6(ape12890)或识别鸡卵溶菌酶的人igg1同种型对照抗体和恒定量的抗cd3(ucht1克隆;biolegend,加利福尼亚州圣地亚哥)与磁珠(dynabeads
tm
m-280对甲苯磺酸化;invitrogen
tm
/赛默飞世尔科技)偶联。小珠上的抗pd-1抗体模拟抗原呈递细胞上的抗体的fcγr接合。用指定小珠刺激稳定人pd-1转染的jurkat细胞2分钟或10分钟,裂解细胞,并且通过添加3.7c6偶联小珠来进行pd-1免疫沉淀。免疫沉淀物通过sds-page分析,接着用抗pd-1(图19a,顶部)、抗shp2(图19a,中间)或抗shp1(图19a,底部)进行免疫印迹。在此信号传导分析中,用抗cd3进行pd-1jurkat细胞激活后,本文所描述的3.7c6抗体而非同种型对照抗体诱导磷酸酶shp2而非shp1募集到pd-1细胞质结构域,如图19a(免疫印迹)和19b(免疫印迹的光密度测定法定量)中所示。在抗cd3涂布的小珠存在下,pd-1拮抗剂抗体纳武单抗(在溶液中以100nm使用)不诱导shp2或shp1募集到pd-1,如图19a-b中所示。在可溶性纳武单抗的情况下未发现shp募集。与t细胞激活和cd28共刺激组合,抗体3.7c6还降低zap70和lat磷酸化(数据未显示)。在不存在t细胞激活的情况下,抗体3.7c6对信号传导路径没有影响。
[0225]
实施例11
[0226]
此实施例证明本文所公开的3.7c6抗体所结合的人pd-1上的表位在pd-1与pd-l1结合位点相反的面上。
[0227]
在biomotif ab(瑞典丹德吕德(danderyd,sweden))使用重组人pd-1单体对本文所公开的3.7c6抗体(ape12537)所结合的pd-1上的肽进行氢-氘交换作图。pd-1的结构可通过美国国家生物技术信息中心(national center for biotechnology information)(马
里兰州贝塞斯达(bethesda,md))运营的蛋白质数据库(protein data bank;pdb)公开获得,登录号为4zqk(还参见zak,k.m.等人,2015,《结构(structure)》23:2341-2348;以及pdb登录号5ggr(还参见lee,j.y.等人,2016,《自然
·
通讯(nat commun.)》,7:13354)。图20a和20b中的一种主要肽,标记为“hdx作图的β-发夹”,受3.7c6抗体保护免于氢-氘交换。“hdx作图的β-发夹”由pd-1的氨基酸96-110构成,所述氨基酸具有序列rvtqlpngrdfhmsv。另一主要肽由pd-1的氨基酸33-41构成,所述氨基酸具有序列npptfspal。图20a和20b显示与人pd-l1细胞外结合结构域(浅灰色)的晶体结构的空间填充模型对接的人pd-1细胞外结构域(黑色)的晶体结构的带状模型(pd-1和pd-l1结构来自ncbi pdb)。分子定向为pd-1的近膜区位于左下(图20a),以及旋转90
°
,在底部中心处显示pd-1的近膜区(图20b)。在确定的表面区中表达含有不同组突变的人pd-1单体,并且通过表面等离子体共振评估本文所公开的3.7c6抗体(ape12095)的结合。图20a和20b中标记为“pd-1三点突变体”的区中的突变完全消除本文所公开的3.7c6抗体的结合。图20a和20b中标记为“hdx作图的β-发夹”的环顶部的突变不影响本文所公开的3.7c6抗体的结合。氢-氘交换和pd-1突变作图的组合证明本文所公开的3.7c6 pd-1激动剂抗体显示与图20b中由虚线圆划定的区结合,所述区在pd-1与pd-l1结合位点相反的面上。
[0228]
实施例12
[0229]
此实施例证明本文所公开的抗pd-1抗体抑制来自用角质形成细胞肽抗原刺激的斑秃供体的外周血单核细胞(pbmc)中的ifnγ产生。
[0230]
斑秃是由免疫系统介导的脱发。当毛囊的免疫赦免被产生ifnγ的角质形成细胞和黑色素细胞抗原特异性t细胞破坏时,导致脱发。t细胞浸润毛囊根鞘。激活的t细胞产生过量ifnγ。主要组织相容性复合体i类和ii类分子异常表达,导致随后毛囊细胞破坏和脱发。
[0231]
从斑秃供体的血液中分离pbmc,并且将其在板中在角质形成细胞肽抗原(肽抗原池如wang等人,《皮肤病学研究杂志(j invest dermatol.)》2016年8月;136(8):1617-1626所描述)和指定浓度的四聚体pd-l1-igg1 fc、igg1 3.7c6抗pd-1抗体(ape12890)或对照igg1同种型四聚体或对照igg1同种型存在下培养(2
×
105个细胞/孔)。五天后,将细胞洗涤并且在elispot板中再孵育20小时以检测ifnγ分泌细胞的数量。将来自每个供体和处理组的结果相对于未处理的孔归一化,以允许对来自12个供体的处理和阴性对照的数据进行统计比较。
[0232]
如图21a中所示,与对照igg1同种型相比,igg1 3.7c6抗pd-1抗体以浓度依赖性方式抑制ifnγ产生。如图21b中所示,与对照igg1同种型四聚体相比,相比于igg1同种型四聚体的阳性对照pd-l1-igg1 fc四聚体以浓度依赖性方式抑制ifnγ产生。如图21c和21d中所示,在等于或高于1nm的浓度下,本文所描述的抗pd-1抗体和pd-l1-igg1 fc四聚体均显著抑制ifnγ分泌细胞的数量(p《0.001)。
[0233]
实施例13
[0234]
此实施例证明本文所公开的抗pd-1抗体抑制来自用黑色素细胞肽抗原刺激的斑秃供体的外周血单核细胞(pbmc)中的ifnγ产生。
[0235]
斑秃是由免疫系统介导的脱发。当毛囊的免疫赦免被产生ifnγ的角质形成细胞和黑色素细胞抗原特异性t细胞破坏时,导致脱发和/或毛发色素沉着丧失。t细胞浸润毛囊
根鞘。激活的t细胞产生过量ifnγ。主要组织相容性复合体i类和ii类分子异常表达,导致随后毛囊细胞破坏和脱发。皮肤中类似的黑色素细胞特异性t细胞反应导致白斑病中黑色素细胞的破坏。
[0236]
从斑秃供体的血液中分离pbmc,并且将其在板中在黑色素细胞肽抗原(肽抗原池如wang等人,《皮肤病学研究杂志》2016年8月136(8):1617-1626所描述)和指定浓度的四聚体pd-l1-igg1 fc、igg1 3.7c6抗pd-1抗体(ape12890)或对照igg1同种型四聚体或对照igg1同种型存在下培养(2
×
105个细胞/孔)。五天后,通过meso scale discovery(meso scale diagnostics,马里兰州罗克维尔)定量培养上清液中分泌的ifnγ。将来自每个供体和处理的结果相对于未处理的孔归一化,以允许对来自12个供体的处理和阴性对照的数据进行统计比较。另外,5天后,将细胞洗涤并且在elispot分析中再孵育20小时以检测ifnγ分泌细胞的数量。将来自每个供体和处理的结果相对于未处理的孔归一化,以允许对来自12个供体的处理和阴性对照的数据进行统计比较。结果如图23a-23d所示。
[0237]
如图23a中所示,与对照igg1同种型相比,igg1 3.7c6抗pd-1抗体以浓度依赖性方式抑制ifnγ产生。如图23b中所示,与对照igg1同种型四聚体相比,相比于igg1同种型四聚体的阳性对照pd-l1-igg1 fc四聚体以浓度依赖性方式抑制ifnγ产生。在等于或高于100nm的浓度下,本文所描述的抗pd-1抗体和pd-l1-igg1 fc四聚体均显著抑制ifnγ产生(p《0.001)。如图23c和23d中所示,在等于或高于10nm的浓度下,本文所描述的抗pd-1抗体和pd-l1-igg1 fc四聚体均显著减少ifnγ分泌细胞的数量(p《0.001)。
[0238]
实施例14
[0239]
此实施例证明本文所公开的抗pd-1抗体以3mg/kg的剂量在异种nsg/hu-pbmc移植物抗宿主病(gvhd)模型中显示体内功效。
[0240]
测试本文所公开的抗pd01抗体的功效的异种nsg/hu-pbmc gvhd模型在杰克逊实验室(加利福尼亚州萨克拉门托)进行。如图24a所示,nod-scid il2rγ
null
(nsg)小鼠用1gy辐照,接着在每只小鼠中静脉内注射0.9
×
107个人pbmc。在pbmc注射后一天开始,抗体以30mg/kg、10mg/kg或3mg/kg腹膜内给药,每周两次持续4周。第四组用不相关同种型对照抗体以30mg/kg给药,每周两次,并且第五组用ctla-4-igg(模型中已知的功效阳性对照)以75μg/小鼠给药,一周三次。研究中的给药方案和剂量组如图24b所示。每周针对体重减轻、死亡和gvhd评分监测疾病三次,gvhd评分测量:体重减轻、活动、皮毛质地、苍白和体态。显示体重减轻大于10%的动物的每天进行疾病监测,并且显示与起始体重相比体重减轻大于20%的动物进行安乐死。
[0241]
与同种型对照相比,本文所公开的3.7c6 pd-1激动剂抗体(ape12890)在存活方面显示统计显著功效,延长中值存活时间(图24c)。当分别用30mg/kg下的同种型对照igg1、30mg/kg下的抗pd-1激动剂igg1(3.7c6)、10mg/kg下的抗pd-1激动剂igg1(3.7c6)、3mg/kg下的抗pd-1激动剂igg1(3.7c6)以及75μg/剂量下的ctla-4-ig(阳性对照)给药时,研究过程中个别动物的起始体重的%如图24d、24e、24f、24g和24h所示。
[0242]
抗pd-1激动剂igg1(3.7c6)30mg/kg与抗pd-1激动剂igg1(3.7c6)3mg/kg剂量组之间不存在存活方面的显著差异。这表明可在小于3mg/kg的剂量下获得gvhd模型中的功效。
[0243]
本文引用的所有参考文献,包括出版物、专利申请和专利由此以引用的方式并入,其程度与每篇参考文献被单独并且具体地指明以通过引用并入并且在本文中整体阐述一
样。
[0244]
除非本文另外指出或明显与上下文相矛盾,否则在描述本发明的上下文中(尤其是在随附权利要求书的上下文中),使用的术语“一个(种)”和“所述”和“至少一个(种)”以及类似指示物应理解为涵盖单数与复数两者。除非本文另外指出或明显与上下文相矛盾,否则在一或多个条目的列表后使用的术语“至少一个”(例如“a和b中的至少一个”)应理解为意指选自所列条目的一个条目(a或b)或者两个或超过两个所列条目的任何组合(a和b)。除非另外指出,否则术语“包含”、“具有”、“包括”和“含有”应理解为开放式术语(即,意指“包括但不限于”)。除非本文另外指出,否则本文中对值范围的叙述仅仅意图用作个别提及落入所述范围内的每个单独值的简写方法,并且每个单独值并入本说明书中,如同在本文中个别地叙述一般。除非本文另外指出或另外明显与上下文相矛盾,否则本文所描述的所有方法可以按任何合适的顺序进行。除非另外要求,否则本文提供的任何和所有实例或示例性语言(例如,“如”)的使用仅旨在更好地说明本发明并且不对本发明的范围构成限制。本说明书中的任何语言均不应理解为指示实践本发明所必需的任何未要求要素。
[0245]
本文中描述了本发明的优选实施例,包括发明人已知进行本发明的最佳模式。在阅读前述描述后,那些优选实施例的变化对于所属领域的普通技术人员来说可以变得显而易见。诸位发明人期望熟练的技术人员视需要采用这类变化,并且诸位发明人希望本发明以不同于本文所具体描述的方式来实践。因此,本发明包括适用法律允许的所附权利要求书中所叙述主题的所有修改和等同物。此外,除非本文另外指出或另外明显与上下文相矛盾,否则本发明涵盖上述要素的所有可能的变化形式的任何组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1