短链脂肪酸戊酸作为细胞疗法和抗肿瘤疗法的增强剂的制作方法
1.本发明涉及短链脂肪酸戊酸及其作为细胞免疫疗法和抗肿瘤疗法增强剂的应用。valerate(戊酸)是pentanoate(戊酸)的同义词。本发明涉及通过将从外周血白细胞中分离的t细胞与短链脂肪酸(short-chain fatty acid,scfa)戊酸孵育来改进其培养。将这些孵育的外周血白细胞再注射入同一患者体内。效果是这些细胞活化并且患者体内效应分子的产生增加。这增加了肿瘤疗法成功的机会。来自小鼠的t细胞在手术后被转移到患有皮下胰腺肿瘤的小鼠说明了这点。这种类型的细胞处理可以转用于人t细胞,并改善胰腺癌、肺癌、膀胱癌、卵巢癌、结肠癌、皮肤癌、肝癌、脑癌和血癌以及感染性和自身免疫性疾病的治疗。
2.本发明还涉及短链脂肪酸丁酸及其作为增强剂在细胞免疫疗法和抗肿瘤疗法中的应用。还涉及包含戊酸和/或丁酸的短链脂肪酸组合物及其作为增强剂在细胞免疫疗法和抗肿瘤疗法中的应用。
3.本发明涉及通过细胞免疫疗法(过继免疫疗法)对癌症、感染性疾病和免疫细胞介导的疾病的治疗的改进。具体地,涉及短链脂肪酸的药学上可接受的制剂的应用。本发明还涉及短链脂肪酸丁酸及其作为增强剂在细胞免疫疗法和抗肿瘤疗法中的应用。
4.细胞免疫疗法(过继免疫疗法)是向患者进行过继细胞转移(adoptive cell transfer,act)。这些细胞可能源自该患者或另一个体。这些细胞最常来源于免疫系统,目的是改善免疫功能和特性。在自体细胞免疫疗法中,从该患者体内提取t细胞,对其进行基因修饰和体外培养,然后回到同一患者体内。相比之下,同种异体细胞免疫疗法涉及从与接受细胞的患者分开的供体中分离和扩增的细胞。细胞免疫疗法用于治疗患有癌症、感染性和免疫细胞介导疾病的患者。
背景技术:
5.一些共生细菌如嗜黏蛋白阿克曼菌(akkermansia muciniphila)和双歧杆菌属(bifidobacterium)的种能够增强抗肿瘤免疫力。然而,潜在的分子机制以及多样的细菌代谢物对所述的这些抗肿瘤作用的贡献仍然不清楚。我们在此展示了短链脂肪酸(scfa)戊酸增强了cd8+细胞毒性t淋巴细胞(ctl)的功能。戊酸作为一种选择性i类组蛋白去乙酰化酶(histone deacetylase,hdac)抑制剂,在tbx21、ifnγ和eomes的启动子区域触发组蛋白h4乙酰化增加,从而使人和鼠ctl中的效应分子如颗粒酶b(granzyme b)和tnf-α的产生增加。同时,戊酸促进肿瘤浸润性ctl的长期维持和扩增。广泛的筛选方法显示,在测试的共生菌株中,只有少数细菌物种表现出很强的hdac抑制能力。具体是三种共生细菌:马赛巨球型菌(megasphaera massiliensis)(已知可合成高水平戊酸的少数人肠道细菌之一)以及两种强丁酸生产者普拉梭菌(faecalibacterium prausnitzii)和哈氏厌氧棒杆菌(anaerostipes hadrus),其具有有效的i类hdac抑制活性。值得注意的是,马赛巨球型菌(m.massiliensis)显著增强了cd8+t细胞的效应子功能并促进了抗肿瘤免疫。
6.肠道微生物群已被证明直接影响特定癌症免疫疗法的功效(matson,v.,fessler,j.,bao,r.,chongsuwat,t.,zha,y.,alegre,m.l.,luke,j.j.,和gajewski,t.f.(2018),
the commensal microbiome is associated with anti-pd-1efficacy in metastatic melanoma patients.science 359,104-108)。具体地,免疫检查点抑制(immune checkpoint inhibitory,ici)疗法和使用肿瘤特异性cd8+细胞毒性t淋巴细胞(ctl)的过继细胞疗法可能会受到肠道微生物群组成的影响(wang,y.,ma,r.,liu,f.,lee,s.a.和zhang,l.(2018).modulation of gut microbiota:a novel paradigm of enhancing the efficacy of programmed death-1and programmed death ligand-1 blockade therapy..frontiers in immunology 9,374.和zitvogel,l.,ma,y.,raoult,d.,kroemer,g.和gajewski,t.f.(2018).the microbiome in cancer immunotherapy:diagnostic tools and therapeutic strategies.science 359,1366-1370.)。最近,几项研究表明,肠道微生物群的成员能够增强pd-1和ctla4阻断疗法的抗肿瘤功效(tanoue,t.,morita,s.,plichta,d.r.,skelly,a.n.,suda,w.,sugiura,y.,narushima,s.,vlamakis,h.,motoo,i.,sugita,k.,et al.(2019).a defined commensal consortiums elicits cd8tcells and anti-cancer immuno.nature 565,600-605.和vetizou,m.,pitt,j.m.,daillere,r.,lepage,p.,waldschmitt,n.,flament,c.,rusakiewicz,s.,routy,b.,roberti,m.p.,duong,c.p.,et al.(2015).anticancer immunotherapy by ctla-4blockade relies on the gut microbiota.science 350,1079-1084.)。
7.嗜黏蛋白阿克曼菌(akkermansia muciniphila)和一些双歧杆菌菌株已被证明可调节抗肿瘤免疫应答并改善ici(routy,b.,le chatelier,e.,derosa,l.,duong,c.p.m.,alou,m.t.,daillere,r.,fluckiger,a.,messaoudene,m.,rauber,c.,roberti,m.p.,et al.(2018).gut microbiome influences efficacy of pd-1-based immunotherapy against epithelial tumors.science 359,91-97和sivan,a.,corrales,l.,hubert,n.,williams,j.b.,aquino-michaels,k.,earley,z.m.,benyamin,f.w.,lei,y.m.,jabri,b.,alegre,m.l.,et al.(2015).commensal bifidobacterium promotes antitumor immunity and facilitates anti-pd-l1 efficacy.science 350,1084-1089.)。此外,在实验性皮下肿瘤模型中,由11种人细菌菌株组成的确定的共生菌群(即细菌群)引发了强烈的cd8+t细胞介导的抗肿瘤免疫。该研究表明,人低丰度共生体的混合物能够大大提高小鼠中ici疗法的功效(tanoue,t.,morita,s.,plichta,d.r.,skelly,a.n.,suda,w.,sugiura,y.,narushima,s.,vlamakis,h.,motoo,i.,sugita,k.,et al.(2019).a defined commensal consortium elicits cd8tcells and anti-cancer immuno.nature 565,600-605.和skelly,a.n.,sato,y.,kearney,s.,and honda,k.(2019).mining the microbiota for microbial and metabolite-based immunotherapy.nature review.immunology 19,305-323.)。到目前为止,尚未有导致共生微生物群或微生物群衍生代谢物对抗肿瘤免疫具有有益作用的确切潜在机制。
8.关于可溶性微生物代谢物在促进抗肿瘤免疫应答中的作用知之甚少。主要的肠道细菌衍生代谢物,短链脂肪酸(scfa)乙酸、丙酸和丁酸,已被证明不仅促进treg的扩增,还改善了效应t细胞的功能(arpaia,n.,campbell,c.,fan,x.,dikiy,s.,van der veeken,j.,d eroos,p.、liu,h.、cross,j.r.、pfeffer,k.、coffer,p.j.和rudensky,a.y.(2013).metabolites produced by commensal bacteria promote peripheral regulatory t-cell generation.nature 504、451-455.furusawa,y.,obata,y.,fukuda,s.,endo,t.a.,
genomic sciences 8,525-538.and yuille,s.,reichardt,n.,panda,s.,dunbar,h.和mulder,i.e.(2018).human gut bacteria as potent classihistone deacetylase inhibitors in vitro through production of butyric acid and valeric acid.plos one 13,e0201073.)诱导效应分子的产生以及ctl的寿命,这使其能够消除小鼠体内已形成的肿瘤。
9.通过基因转移活化免疫细胞以用于细胞免疫疗法的方法是技术人员熟知的。基因转移可以在体内或体外进行。详细信息在出版物querques,i.,mades,a.,zuliani,c.,miskey,c.,alb,m.,grueso,e.,machwirth,m.,rausch,t.,einsele,h.,et al.(2019).a highly soluble sleeping beauty transposase improves control of gene insertion,nature biotechnology 37,1502-1512(2019),agarwal,s.,hanauer,j.d.s.,frank,a.m.,reichert,v.,thalheimer,f.b.和buchholz,c.j.(2020).in vivo generation of car tcells selectively in human cd4
+
lymphocytes.molecular therapy 8,p1741-1932和agarwal,s.,weidner,t.,thalheimer f.b.和buchholz c.j.(2019).in vivo generated human car tcells eradicate tumor cells.oncoimmunology 8,e1671761和smith,t.t.,stephan,s.b,moffett,h.f.,mcknight,l.e.,ji,w.,reiman,d.,bonagofski,e.,wohlfahrt,m.e.,pillai,s.p.s.和stephan,m.t.(2017).insitu programming of leukaemia-specific t cells using synthetic dna nanocarries.nature nanotechnology 12,813-820(2017)和hudecek m,schmitt tm,baskar s,lupo-stanghellini mt,nishida t,yamamoto tn,bleakley m,turtle cj,chang wc,greisman ha,wood b,maloney dg,et al.(2010).the b-cell tumor-associated antigen ror1 can be targeted with tcells modified to express a ror1-specific chimeric antigen receptor.blood 25,116(22):4532-4541和monjezi r,miskey c,gogishvili t,schleef m,schmeer m,einsele h,ivics z,hudecek m.(2016).enhancedcart-cell engineering using non-viral sleeping beauty transposition fromminicircle vectors.leukemia 31(1):186,194中进行了描述。
10.用于细胞免疫疗法的体外活化的免疫细胞的给药途径是技术人员熟知的。体内活化的用于细胞免疫疗法的免疫细胞不得施用于患者,因为其已经存在于该患者体内。详细信息在出版物agarwal,s.、hanauer,j.d.s.,frank,a.m.,reichert,v.,thalheimer,f.b.和buchholz,c.j.(2020).in vivo generation ofcar tcells selectively in human cd4+lymphocytes.molecular therapy 8,p1741-1932和agarwal,s.,weidner,t.,thalheimer f.b.和buchholz c.j.(2019).in vivo generated humancar tcells eradicate tumor cells.oncoimmunology 8,e1671761和smith,t.t.,stephan,s.b,moffett,h.f.,mcknight,l.e.,ji,w.,reiman,d.,bonagofski,e.,wohlfahrt,m.e.,pillai,s.p.s.和stephan,m.t.(2017).in situ programming of leukaemia-specifictcells using synthetic dna nanocarries.nature nanotechnology 12,813-820(2017)中进行了描述。
技术实现要素:
11.本发明的任务是改善患有癌症(血液肿瘤和肿瘤学肿瘤)或感染性疾病或免疫介
导的疾病(如自身免疫疾病和退行性疾病)的患者的外周血白细胞效应分子的产生。这将改善患有癌症(血液肿瘤和肿瘤学肿瘤)或感染性疾病或免疫介导的疾病(如自身免疫疾病和退行性疾病)的患者的细胞免疫疗法的结果。
12.解决方案
13.权利要求1解决了本发明的任务。本发明描述了一种培养t细胞的方法,该方法通过将t细胞与短链脂肪酸(scfa)如戊酸、丁酸或包含戊酸和/或丁酸的短链脂肪酸组合物一起孵育,从而活化t细胞并且增加效应分子的产生。本发明涉及通过将从外周血白细胞中分离的t细胞与短链脂肪酸(scfa)戊酸一起孵育来改进t细胞的培养。将这些孵育的外周血白细胞再注射入同一患者体内。效果是这些细胞活化并且患者体内效应分子的产生增加。这增加了肿瘤疗法成功的机会。
14.总的来说,我们请求保护低丰度的共生细菌物种(如m.massiliensis)及其选择性代谢物(如戊酸),而不是广泛分布和丰富的共生体,用于靶向人肿瘤的特定微生物疗法。
15.我们请求保护一种用于哺乳动物,特别是患有癌症(血液肿瘤和肿瘤学肿瘤)或感染性疾病或免疫介导的疾病(如自身免疫性疾病和退行性疾病)的人的药物制剂,所述药物制剂包含至少一种短链脂肪酸(scfa),如戊酸、丁酸,其特征在于所述至少一种短链脂肪酸(scfa)活化免疫细胞并增强效应分子的产生。
16.所述短链脂肪酸如戊酸和/或丁酸可用作盐,例如钠盐(na
+-盐)或另一种可接受的药物制剂。
17.在一优选的实施方案中,与短链脂肪酸戊酸一起孵育的t细胞是cd8
+
细胞毒性t淋巴细胞(ctl)和嵌合抗原受体(car)t细胞。通过这些细胞的综合代谢和表观遗传重编程来介导scfa处理的ctl和car t细胞增强的消除肿瘤生长的能力。scfa通过增加中央细胞代谢传感器mtor的功能和抑制i类组蛋白去乙酰化酶(hdac)的活性来作用于ctl和car t细胞。这导致ctl和car t细胞中cd25、ifn-γ和tnf-α等效应分子的产生增加。因此,该特定的微生物分子用于增强t细胞癌症免疫疗法的功效。
18.在一优选的实施方案中,将与短链脂肪酸戊酸一起孵育的t细胞与短链脂肪酸丁酸共同孵育。戊酸和丁酸诱导ctl效应分子的产生和寿命,这使ctl能够消除已形成的肿瘤。因此,戊酸和丁酸是增强抗肿瘤免疫的有效生物治疗物。
19.在一优选的实施方案中,细菌马赛巨型球菌(megasphaera massiliensis)用作戊酸和丁酸的生产供应者。因此,由于这种细菌会产生戊酸和丁酸,与短链脂肪酸戊酸和/或丁酸一起孵育的t细胞也可以与细菌马赛巨型球菌(megasphaera massiliensis)一起孵育。
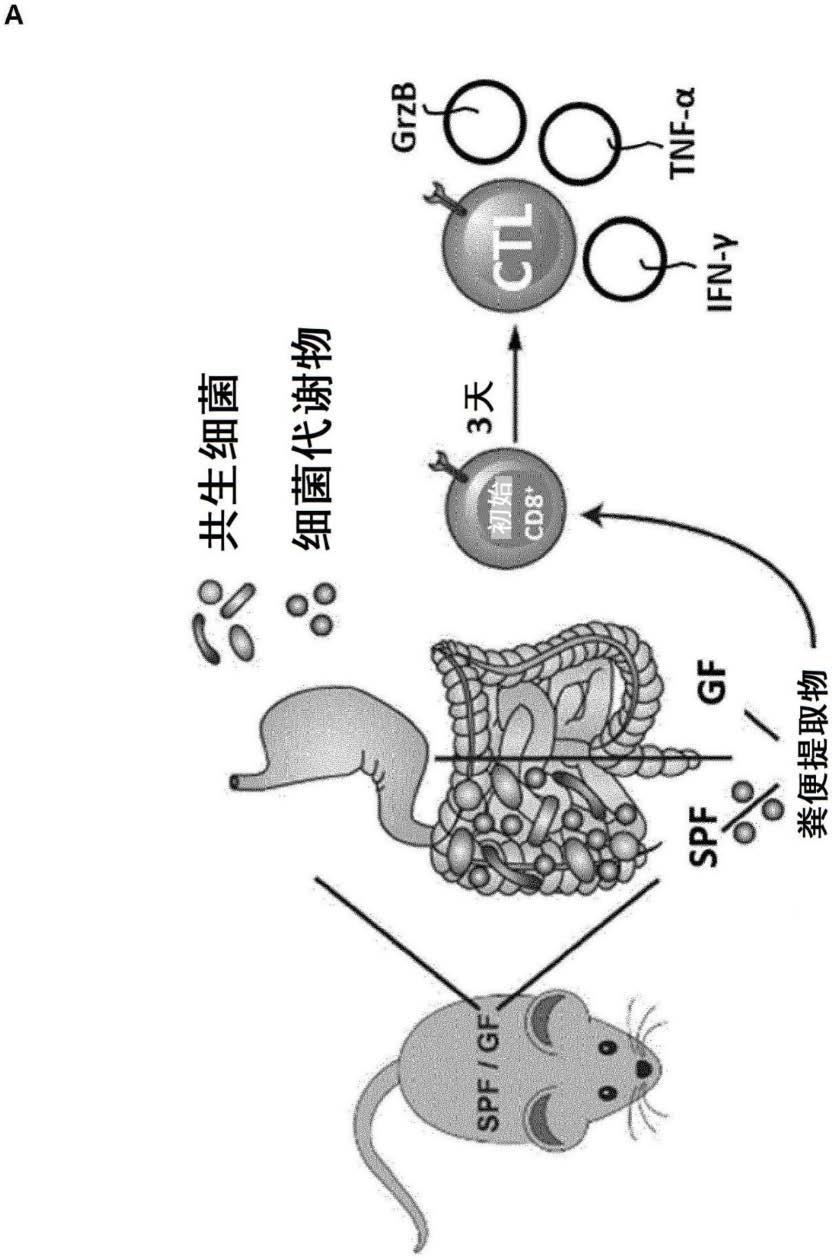
20.所述短链脂肪酸戊酸用作治疗肿瘤的药物活性化合物。
21.在一优选的实施方案中,所述短链脂肪酸戊酸和/或丁酸用作治疗肿瘤的药物活性化合物。
22.在一优选的实施方案中,所述短链脂肪酸戊酸和/或丁酸用作治疗胰腺癌的药物活性化合物。
23.为了改善患有癌症(血液肿瘤和肿瘤学肿瘤)或感染性疾病或免疫介导的疾病(如自身免疫性疾病和退行性疾病)的患者的细胞免疫疗法结果,将免疫细胞与活化所述免疫细胞的短链脂肪酸一起孵育。短链脂肪酸对免疫细胞的活化可以在体内或体外进行。
24.体内是指将所述短链脂肪酸以适当的方式施用于患者体内的免疫细胞,例如但不限于经口、静脉内、腹膜内,从而活化患者体内的所述免疫细胞。
25.体外是指将所述短链脂肪酸施用于患者体外的免疫细胞,从而活化患者体外的免疫细胞。所述活化的免疫细胞以适当的方式施用于该患者,例如但不限于经口、静脉内、腹膜内。
26.本发明包括一种活化免疫细胞的方法,所述方法通过将免疫细胞与至少一种短链脂肪酸孵育以使免疫细胞活化从而免疫细胞可以增加效应分子的产生。该方法的特征在于所述免疫细胞是t细胞。该方法的特征还在于所述免疫细胞为nk细胞、γδt细胞、b淋巴细胞、nk t细胞。该方法的特征还在于所述免疫细胞是cd8
+
细胞毒性t淋巴细胞(ctl)或嵌合抗原受体(car)t细胞。该方法的特征还在于,所述短链脂肪酸包括戊酸或其药学上可接受的衍生物。所述方法还在于所述短链脂肪酸包括戊酸和丁酸或其药学上可接受的组合物。该方法的特征还在于所述至少一种短链脂肪酸由至少一种细菌物种产生。该方法的特征还在于,所述至少一种短链脂肪酸由细菌马赛巨型球菌(megasphaera massiliensis)产生。该方法的特征还在于,所述至少一种短链脂肪酸由至少包括细菌马赛巨球型菌(megasphaera massiliensis)、埃氏巨球型菌(megasphaeraelsdenii)、普拉梭菌(faecalibacterium prausnitzii)和哈氏厌氧棒杆菌(anaerostipes hadrus)的细菌群产生。
27.本发明包括所述活化的免疫细胞在用于治疗肿瘤、免疫介导的疾病、退行性疾病和感染性疾病中的应用,其特征在于所述至少一种短链脂肪酸增强细胞免疫疗法。本发明包括所述活化的免疫细胞在治疗肿瘤、免疫介导的疾病、退行性疾病和感染性疾病中的应用,其特征在于所述肿瘤为胰腺肿瘤。
28.本发明还包括一种培养t细胞的方法,通过将t细胞与短链脂肪酸戊酸孵育,从而活化t细胞并增加效应分子的产生。
附图说明
29.图1为戊酸促进小鼠cd8+ctl的核心分子特征。
30.(a)用来自spf或gf小鼠的肠道内容物的水溶性部分处理ctl的实验设计。
31.(b和c)用来自指定器官的管腔内容物提取物处理的产生ifn-γ和tnf-α的ctl的频率。显示了两个实验的代表性结果(n=3)。
32.(d)进行elisa以测定如(a)所示处理的clt分泌的tnf-α。
33.(e)spf和gf小鼠粪便样本中总scfa量的定量测定(n=5)。
34.(f和g)用指定的scfa处理三天的ifn-γ
+
tnf-α
+
ctl的百分比(n=3,显示了三个独立实验之一)。
35.(h)通过elisa测定用scfa处理的ctl分泌的tnf-α(n=3,显示了两个独立实验之一)。
36.(i)采用荧光hdac分析测定scfa对ctl的hdac抑制活性。未受刺激的ctl的值被任意设置为1.0。进行了四次独立实验。
37.(j和k)代表性等高线图(j)和条形图(k)显示戊酸(2mm)或vpa(0.5mm)给药后ifn-γ
+
和tnf-α
+
细胞的频率。进行了三个相似的实验。
38.(l和m)通过流式细胞术(n=4)分析用戊酸(2mm)或vpa(0.5mm)处理三天的表达eomes和t-bet的ctl的频率。
39.(n)chip分析显示在用戊酸处理ctl 24小时后,组蛋白h4在ifnγ和eomes基因的启动子区域的乙酰化。数据来自三只小鼠的池化染色质。
40.图2为戊酸增强抗原特异性ctl的抗肿瘤活性。
41.(a)scfa在促进抗肿瘤免疫中的作用的实验设计。
42.(b-d)在用戊酸预处理三天后,腹膜内(i.p.)转移cd45.1
+
ova特异性ctl至携带5天龄b16ova肿瘤的cd45.2
+
小鼠中。分析了肿瘤体积和肿瘤质量(每组n=3只小鼠,显示了三个独立实验之一)。
43.(e-g)肿瘤、肿瘤引流ln和脾脏中产生tnf-α和ifn-γ的cd45.1
+
肿瘤特异性ctl的频率以及细胞过继转移后第10天的肿瘤浸润cd45.1
+
cd8
+
t细胞的绝对细胞数。
44.(h和i)用戊酸预处理的ova特异性cd45.1
+
ctl被过继转移到携带5天龄的pancova肿瘤的cd45.2
+
小鼠中。
45.在肿瘤接种后第23天测定肿瘤重量。显示了来自两个实验之一的代表性数据(每组n=3只小鼠)。
46.(j)肿瘤接种后第23天,在引流ln和肿瘤中转移的产生ifn-γ的cd8
+
t细胞的频率。
47.图3为细菌衍生的scfa表现出特定的i类hdac抑制活性。
48.(a)通过gc-ms测定了16种人共生体产生的scfa、支链脂肪酸(bcfa)和中链脂肪酸(mcfa)。在测定上清液中的脂肪酸之前,所有细菌都在体外生长直到稳定生长期。
49.(b和c)来自人共生群落的16个成员的无细胞上清液对重组i类和ii类hdac同种型的hdac抑制作用。针对ycfa培养基检验显著性。
50.(d)细菌scfa、bcfa和mscfa对i类和ii类hdac酶活性的影响。tsa用作泛-hdac(pan-hdac)抑制剂对照。
51.图4为产戊酸细菌增强cd8
+
t细胞介导的抗肿瘤免疫应答。
52.(a)在次优ctl条件下培养表达ifn-γ和tnf-α的cd8
+
t细胞并用来自马赛巨型球菌(m.massiliensis)的上清液刺激的的频率(上清液与细胞培养基的比例为1:40或1:20)。进行了三个独立的实验。
53.(b-f)用来自马赛巨型球菌(m.massiliensis)的上清液(上清液与细胞培养基的比例为1:20)处理三天后,将cd45.1
+
ot-i ctl经腹膜内(i.p.)转移到携带5天龄b16ova肿瘤的cd45.2
+
动物(每组n=3只小鼠,显示了两个相似实验之一)。在指定的时间点(b)分析肿瘤体积。
54.(c和d)肿瘤接种后第14天转移的cd45.1
+
ot-ictl的百分比和t-sne图中的图示显示在(c和d)中。戊酸处理的ot-i细胞作为对照。
55.(e和f)显示了在肿瘤引流ln中接种b16ova肿瘤后第14天转移的抗原特异性ifn-γ
+
tnf-α
+
ctl的频率和总细胞数(e和f)。
56.图5为戊酸通过hdac抑制活性诱导t-bet介导的ifn-γ产生
57.(a和b)脾cd8
+
t细胞在次优ctl诱导条件下,在1mm戊酸或丁酸存在下极化3天。代表性直方图(a)和条形图(b)显示了annexin v+细胞的频率。进行了三个相似的实验。
58.(c)在次优ctl诱导条件下极化的cd8
+
t细胞的代表性效应分子染色,在2-dg(1mm,sigma-aldrich)或雷帕霉素(100nm,sigma-aldrich)存在下用戊酸或tsa(10nm sigma-aldrich)处理3天。进行了三个独立的实验。
59.(d)用scfa处理3天的cd8
+
t细胞中h3ac和h4ac的western blot分析。
60.(e)戊酸处理的ctl中tbx21启动子的可及性的pan-h4ac chip qpcr分析。数据来自三只小鼠的池化染色质。
61.(f和g)从wt和tbx21-/-小鼠分离的cd8
+
t细胞在戊酸浓度增加的次优ctl诱导条件下极化。代表性等高线图(f)和条形图(g)显示了ifn-γ
+
和il-17a
+
细胞的频率。进行了两个相似的实验。
62.图6为戊酸在tc17和tc9细胞中诱导ctl表型
63.(a和b)从脾脏和ln中分离的cd8
+
t细胞在tc17诱导条件下极化,并用戊酸处理3天。代表性等高线图(a)和条形图(b)表示il-17
+
和ifn-γ
+
细胞的频率。进行了三个相似的实验。
64.(c和d)从脾脏和ln中分离的cd8
+
t细胞在tc9诱导条件下极化,并用戊酸处理3天。代表性等高线图(c)和条形图(d)显示了il-9
+
和ifn-γ
+
细胞的频率。进行了三个相似的实验。
65.(e和f)通过流式细胞术分析戊酸处理的人ctl中颗粒酶b、ifn-γ和eomes的表达。进行了五个独立实验(e)。对于eomes,显示了平均荧光强度(mean fluorescence intensity,mfi)值(f,n=3)。
66.图7为戊酸在cd4+t细胞亚群中诱导ctl表型
67.(a和b)从脾脏和ln中分离的cd4
+
t细胞在th极化条件下用戊酸(2mm)处理3天并染色,以产生其特征细胞因子。进行了三个相似的实验。
68.(c)对在th1极化条件下经戊酸处理的cd4
+
t细胞染色以显示ctl效应分子。显示了三个独立实验的代表性等高线图。
69.(d和e)通过流式细胞术分析戊酸处理的人ctl中颗粒酶b、ifn-γ和eomes的表达。进行了五个实验(d)。对于eomes,显示了平均荧光强度(mean fluorescence intensity,mfi)值(e,n=3)。
70.(f)在戊酸存在下对cd4
+
th17细胞进行rna-seq分析。显示了具有差异调节基因的火山图。
71.(g)戊酸处理的th17细胞中ctl相关基因的表达。指定基因的rna-seq分析结果显示为每千碱基每百万映射读数(reads per kilobase per million mapped reads,rpkm)的读数。
72.图8为各种人共生体的无细胞上清液对hdac酶的影响。
73.(a)筛选源自16个细菌菌株的无细胞上清液对来自人ht-29细胞的细胞裂解物的总hdac抑制作用(b)。针对ycfa培养基检验了显著性。
74.(b)在用指定细菌的上清液刺激三天后,通过elisa测定ctl的tnf-α分泌(n=4,所有细菌的上清液与细胞培养基的比例为1:20)。
75.图9为戊酸促进cd25和il-2的表达以及ctl的增殖扩增和持久性。
76.(a)显示了用于研究体内ctl持久性的实验设置。
77.(b-d)显示过继转移后第15天在rag1缺陷小鼠中转移的t细胞(wt cd45.1
+
ctl、wt cd45.2
+
戊酸处理的ctl和来自fir
×
tiger小鼠的foxp3
+
cd45.2
+
treg)的频率(b,c)和总细胞数(d)。共转移的foxp3-cd4
+
细胞被排除在门外(b,c)。在d中,n=3只小鼠/组/实验,显示了来自2个池化的独立实验的数据。
78.(e)显示过继转移后第4天rag1缺陷小鼠中转移的t细胞(wt cd45.1
+
ctl、wt cd45.2
+
戊酸处理的ctl和cd45.2
+
cd4
+
t细胞)的cfse标签(n=3只小鼠/组/实验,显示了来自2个独立实验的池化数据)。
79.(f)用指定的hdac抑制剂处理三天的cd25
+
ifn-+
ctl的百分比(n=3,在3个独立实验中进行)。
80.(g和h)在将对照ctl(cd45.1
+
)和戊酸处理的ctl(cd45.2
+
)转移到rag1缺陷小鼠后第15天,通过流式细胞术分析cd25
+
cd8
+
t细胞的频率和细胞数(n=3只小鼠/组/实验,数据来自2个独立实验)。
81.(i)ctl在戊酸存在或不存在的情况下生产3天,然后洗涤并静置4小时。随后,在指定的时间点用il-2(50u/ml)处理细胞。通过流式细胞术分析磷酸化(p)-stat5水平(n=5,在3个独立实验中进行)。
82.(j)通过elisa(n=4,从2个独立实验中池化)测定在指定时间点培养的戊酸处理的ctl中il-2的分泌。
83.图10为戊酸在ctl中诱导mtor通路。
84.(a和b)ctl在含有1.0%fcs的培养基中培养,并用戊酸(2.5mm)处理三天。代表性直方图和条形图分别显示mtor(a)和s6核糖体蛋白(b)的磷酸化水平(n=3,来自三个独立实验池化)。
85.(c和d)人ctl在含有1.0%血清的培养基中培养,并用指定的hdaci处理三天。代表性的直方图和条形图分别显示mtor(c)和s6核糖体蛋白(d)的磷酸化水平(数据点代表四个单个健康供体)。
86.(e)测定用或不用2.5mm戊酸培养三天的体外产生的小鼠ctl的胞外酸化率(extracellular acidification rate,ecar)。ecar在基础条件下测定并响应葡萄糖(10mm)、寡霉素(2μm)和2-脱氧-葡萄糖(2-dg,100mm)。显示了三个独立实验之一。
87.图11为戊酸处理增强了小鼠car t细胞的抗肿瘤活性。
88.(a)分析hdaci处理的ror1特异性cd8
+
cart细胞(car
ror1
+hdaci)的实验设计。
89.(b和c)用指定的hdaci刺激三天后,通过elisa和流式细胞术分析测定car t细胞产生的tnf-α和ifn-γ。
90.(d)用指定的hdaci刺激三天后,通过流式细胞术分析测定car t细胞上cd25的表面表达(n=3,来自3个独立实验)。
91.(e和f)用戊酸预处理三天后,将cd19t
+
ror1特异性car t细胞腹膜内(i.p.)转移到携带5天龄pancror1肿瘤的小鼠体内。在e中,分析了肿瘤体积和肿瘤质量(n=3只小鼠/组/实验,结合了2个独立实验)。
92.(f)显示了肿瘤接种后第14天肿瘤组织中转移的tnf-α和ifn-γcd19t
+
ror1特异性cart细胞的百分比和总细胞数。
93.图12为戊酸增强人car t细胞的功能状态。
94.(a)从健康供体的外周血中分离的cd8
+
t细胞在存在或不存在指定的hdaci的情况下分化为ctl。代表性等高线图和点图表示tnf-α
+
和ifn-γ
+
细胞的频率。图中的数据点代表单个供体(n=4,在4个独立实验中进行)
95.(b-g)戊酸处理的ror1特异性cd8
+
car t细胞(car
ror1 t细胞)的表型分析。
96.(b)显示了功能分析的实验设置。
97.(c)通过elisa在戊酸处理的car
ror1 t细胞的上清液中分析细胞因子分泌(ifn-γ和tnf-α)。
98.(d)通过流式细胞术测定cd25的表面表达。
99.(e)通过elisa检测car
ror1 t细胞上清液中il-2的分泌。
100.(f)car
ror1 t细胞的增殖由cfse标记确定。用戊酸预处理的car
ror1 t细胞用cfse染色,随后在不存在戊酸的情况下与k652
ror1
细胞共培养。没有car构建体的cd8
+
t细胞用作模拟对照细胞。
101.(g)通过在遇到表达荧光素酶的k652
ror1
细胞后分析特异性裂解来检验car
ror1
t细胞的溶细胞活性。以1小时的间隔测定裂解的靶细胞的百分比(效应物与靶细胞(e:t)的比率=2.5:1)。图表(c-g)中显示的数据点代表来自三个不同供体的car
ror1 t细胞。在戊酸预处理后,在没有戊酸的情况下,通过共培养cd8
+
car
ror1 t细胞与表达ror1的k652(k652
ror1
)细胞来介导刺激。
具体实施方式
102.本发明描述了通过增强免疫细胞的活化从而通过增加患者体内效应分子的产生来改进细胞免疫疗法。这导向更好的抗癌药物或调节免疫系统的药物。在一优选的实施方案中,短链脂肪酸戊酸和/或丁酸活化t细胞。在另一实施方案中,短链脂肪酸戊酸和/或丁酸活化nk细胞、γδt细胞、b淋巴细胞和nk-t细胞。在一优选的实施方案中,短链脂肪酸戊酸和/或丁酸活化cd8 t细胞和细胞毒性t细胞(ctl)。
103.在一个实施方案中,所述短链脂肪酸戊酸和/或丁酸活化具有内源性t细胞受体的人cd8 t细胞。在另一个实施方案中,所述短链脂肪酸戊酸和/或丁酸活化具有转基因t细胞受体的人cd8 t细胞。在另一个实施方案中,所述短链脂肪酸戊酸和/或丁酸通过合成受体活化人cd8 t细胞。所述合成受体可以是具有可变胞内信号结构域的嵌合抗原受体(car)。在一个优选实施方案中,使用了ror1特异性car。
104.本发明描述了短链脂肪酸处理免疫细胞的应用。本发明使用戊酸作为短链脂肪酸。本发明还使用丁酸作为短链脂肪酸。在一优选的实施方案中,本发明使用戊酸与丁酸的组合作为短链脂肪酸。戊酸也可以与其他短链脂肪酸(scfa)组合,包括但不限于乙酸、丙酸、丙戊酸。
105.用短链脂肪酸处理免疫细胞。在一优选的实施方案中,所述短链脂肪酸是戊酸或其盐。在另一优选的实施方案中,所述短链脂肪酸是戊酸或其盐与一种或多种其他短链脂肪酸或其盐的组合。在另一优选的实施方案中,所述短链脂肪酸是戊酸或其盐与丁酸或其盐的组合。
106.短链脂肪酸可以通过培养细菌获得。在一优选的实施方案中,马赛巨型球菌(megasphaera massiliensis)的培养物产生短链脂肪酸。这些短链脂肪酸可从上清液中获
得。马赛巨型球菌(megasphaera massiliensis)的培养物产生短链脂肪酸的组合,包括戊酸和丁酸。短链脂肪酸也可以通过提取缬草(valeriana officinalis)获得。短链脂肪酸也可以通过化学合成获得。
107.在一实施方案中,用于细胞免疫疗法的免疫细胞的活化如下:将马赛巨型球菌(megasphaera massiliensis)的培养物施用于患者,例如经口。在该实施方案中,在向患者施用了马赛巨型球菌(megasphaera massiliensis)培养物后,该患者自身的免疫细胞在患者体内活化,该培养物在患者体内产生一种或多种短链脂肪酸。
108.本发明可用于改善各种癌症的抗癌治疗,包括血液癌症(包括但不限于白血病、淋巴瘤、骨髓瘤)和肿瘤癌症(包括但不限于胰腺癌、皮肤癌、肺癌、膀胱癌、结肠癌、脑癌、睾丸癌、卵巢癌和乳腺癌)。本发明还可用于治疗免疫介导的疾病,如自身免疫性疾病(包括但不限于银屑病、红斑狼疮、重症肌无力、类风湿性关节炎)或退行性疾病(包括但不限于多发性硬化症)。本发明还可用于治疗感染性疾病(包括但不限于病毒感染)。
109.优选地,本发明适用于治疗涉及靶向选自包括但不限于:cd19、cd20、cd22、cd33、bcma、cd123、slamf7、cd138、cd38、cd70、cd44v6、cd56、egfr、erbb2、间皮素、psma、fap、5t4、flt-3、magea、megab、gage1、ssx、ny-eso-1、magec1、magec2、ctp11/spanx、xage1/gaged、sage1、page5、na88、il13ra1、csage、cage、hom-tes-85、e2f样/hca661、ny-sar-35、fthl17、nxf2、taf7l、fate1、ror-1、ror-2、整合素、siglecs、癌症睾丸抗原、新抗原组成的组中一种或多种抗原的免疫细胞的疾病。
110.用于细胞免疫疗法的体外活化免疫细胞的给药途径是技术人员熟知的。
111.在一优选的实施方案中,在向患者施用一种或多种短链脂肪酸后,患者自身的免疫细胞在患者体内活化。
112.在一优选的实施方案中,所述免疫细胞在通过与一种或多种短链脂肪酸体外孵育而活化后转移至同一患者中。
113.在另一实施方案中,健康人的免疫细胞在通过与一种或多种短链脂肪酸体外孵育而活化后被转移至患者中。
114.在另一实施方案中,在向健康人施用一种或多种短链脂肪酸后,其免疫细胞在该人体内活化。活化后,收集该人的活化的免疫细胞并转移至患者中。
115.在一实施方案中,受体构建体的所述基因转移是离体进行的。在另一实施方案中,受体构建体的所述基因转移在体内进行。在这种情况下,基因转移可以通过纳米粒子转座子技术或病毒基因转移技术进行。这些技术对于技术人员来说是公知的。详细信息在出版物agarwal,s.,hanauer,j.d.s.,frank,a.m.,reichert,v.,thalheimer,f.b.和buchholz,c.j.(2020).in vivo generation of car t cells selectively in human cd4
+
lymphocytes.molecular therapy 8,p1741-1932和agarwal,s.,weidner,t.,thalheimer f.b.和buchholz c.j.(2019).in vivo generated human car t cells eradicate tumor cells.oncoimmunology 8,e1671761和smith,t.t.,stephan,s.b,moffett,h.f.,mcknight,l.e.,ji,w.,reiman,d.,bonagofski,e.,wohlfahrt,m.e.,pillai,s.p.s.和stephan,m.t.(2017).in situ programming of leukaemia-specific t cells using synthetic dna nanocarries.nature nanotechnology 12,813-820(2017)中进行了描述。
116.在一实施方案中,在所述免疫细胞的制备过程中,即在将所述免疫细胞施用于患
者之前,使用一种或多种短链脂肪酸。在另一实施方案中,在将所述免疫细胞施用于患者之后使用一种或多种短链脂肪酸。在另一实施方案中,在所述免疫细胞的制备过程中,即在将所述免疫细胞施用于患者之前和将免疫细胞施用于患者之后,使用一种或多种短链脂肪酸。
117.在一实施方案中,一种或多种所述短链脂肪酸活化自体免疫细胞,即所述患者的免疫细胞活化。在另一实施方案中,一种或多种短链脂肪酸活化同种异体免疫细胞,即另一个人的免疫细胞活并施用于患者。
118.在一实施方案中,将一种或多种短链脂肪酸直接添加到细胞培养基中。在这种情况下,一种或多种短链脂肪酸在制备免疫细胞期间或在制备免疫细胞之后添加。在另一实施方案中,将一种或多种短链脂肪酸以可接受的药物组合物全身性地添加至患者。可接受的药物组合物包括例如可以口服或全身给药的溶液、丸剂、盐、饮料。在另一实施方案中,将一种或多种短链脂肪酸以可接受的药物组合物直接添加至细胞培养基并全身性地添加至患者。在另一实施方案中,通过向患者施用产生短链脂肪酸的细菌来添加一种或多种短链脂肪酸。在这种情况下,这些细菌会在患者体内产生一种或多种短链脂肪酸,因此免疫细胞在患者体内活化。在另一实施方案中,通过使用细菌培养基的上清液添加一种或多种短链脂肪酸。优选地,这些细菌是马赛巨型球菌(megasphaera massiliensis)。
119.免疫细胞的活化可以通过添加一种或多种短链脂肪酸或通过添加含有一种或多种短链脂肪酸的细菌培养上清液来进行。
120.在一个实施方案中,免疫细胞的活化。可以通过在用细胞产品治疗期间向患者注射含有一种或多种短链脂肪酸的细菌培养上清液来进行。在另一个实施方案中,免疫细胞的活化可以通过在用细胞产品治疗期间向患者注射一种或多种短链脂肪酸来进行。
121.在一个实施方案中,马赛巨型球菌(megasphaera massiliensis)产生的一种或多种短链脂肪酸用于活化免疫细胞。在另一个实施方案中,马赛巨型球菌(megasphaera massiliensis)和其他细菌产生的一种或多种短链脂肪酸用于活化免疫细胞。在这种情况下,一组细菌(consortium,联合体)用于生产一种或多种短链脂肪酸,例如将马赛巨型球菌(megasphaera elsdenii)、普拉梭菌(faecalibacterium prausnitzii)和哈氏厌氧棒杆菌(anaerostipes hadrus)联合施用。该联合体也可以从患者的微生物组或从其他人的微生物组中获得。这个人可以是一个健康的人,一个患有相同或不同疾病的人。例如,联合体可以从粪便样本中获得。在一个实施方案中,该粪便样品获自患者。在另一个实施方案中,该粪便样品获自对相同疾病进行相同治疗并具有所需治疗结果的良好应答者。
122.通过添加一种或多种短链脂肪酸活化免疫细胞可以在car t细胞疗法之前、同时和/或之后一次或顺序进行。也可以进行一次car t细胞疗法,并反复向患者施用一种或多种短链脂肪酸。在另一个实施方案中,进行一次或反复进行car t细胞疗法,并且一次或反复施用含有短链脂肪酸的细菌上清液或产生短链脂肪酸的细菌联合体。
123.在一个优选实施方案中,免疫细胞处理用于自体和/或同种异体造血干细胞移植。
124.在一个实施方案中,短链脂肪酸治疗与car t细胞疗法同时进行,并且短链脂肪酸重复施用(每日、每周、每月、每季度)。在一个更优选的实施方案中,每周进行一次施用。
125.在另一个实施方案中,进行短链脂肪酸处理以调节肿瘤细胞和肿瘤微环境。施用短链脂肪酸用于调节肿瘤特征,包括但不限于生长、信号传导、逃逸机制和抗原呈递。
126.通过肠道微生物群衍生的短链脂肪酸调节cd8
+
t淋巴细胞。
127.最近的一项研究表明,分泌ifn-γ的cd8+t细胞以高百分比存在于无特定病原体(specific pathogen-free,spf)的肠道中,但不存在于gf小鼠的肠道中。我们假设不仅细菌本身,而且可溶性、可扩散的微生物介质都可能直接影响cd8
+
t细胞。事实上,来自spf小鼠结肠,特别是盲肠的管腔内容物的水溶性提取物,对ctl中ifn-γ和tnf-α的产生表现出强烈影响。相比之下,来自gf动物的肠腔内容物的可溶性部分对ctl产生效应分子没有任何影响(图1,a-d)。总而言之,该分析表明,spf衍生的盲肠和结肠的管腔内容物含有影响ctl相关细胞因子表达的细菌代谢物。有趣的是,微生物scfa的分布和粪便特征与观察到的表型对应。醋酸、丙酸和丁酸等scfa是水溶性和可扩散的代谢物,在盲肠中达到峰值浓度,并在结肠中从近端到远端降低。无论划分如何,它们都不存在于gf小鼠的肠腔中,并且在spf小鼠的小肠中几乎检测不到(图1e)。为了阐明scfa介导的对cd8
+
t细胞的作用的角色,我们在醋酸、丙酸、丁酸或戊酸存在的次优条件下培养ctl。我们发现戊酸和丁酸引发tnf-α
+
ifn-γ
+
细胞的频率和ctl分泌的tnf-α显著增加(图1,f-h)。由于低浓度的丁酸,而不是戊酸,诱导ctl细胞凋亡(图5,a和b),我们决定用后者scfa进行进一步的功能分析。总之,这些数据表明,scfa等共生衍生分子能够增强cd8
+
t细胞中ifn-γ和tnf-α的产生。已知糖酵解代谢途径促进ifn-γ表达和t细胞效应子功能。与这些发现一致,通过葡萄糖类似物2-脱氧葡萄糖(2-dg)抑制糖酵解或通过雷帕霉素抑制mtor复合物(促进效应t细胞中的糖酵解代谢)导致ctl中ifn-γ产生减少(图5,c)。尽管t细胞可以利用微生物scfa来满足其代谢需求以增加mtor途径的活性并增强糖酵解和氧化磷酸化,但我们的数据表明scfa对组蛋白去乙酰化酶(hdac)的抑制活性而不是其代谢输入促进了效应分子如ifn-γ、tnf-α和颗粒酶b的稳定表达。与戊酸类似,与对照ctl相比,泛hdac抑制剂曲古抑菌素a(trichostatin a,tsa)显著增加了颗粒酶b
+
ifn-γ
+
cd8
+
t细胞的百分比。值得注意的是,tsa和戊酸的这种强烈作用无法通过雷帕霉素处理细胞来逆转(图5c)。蛋白质印迹(western blot)分析显示用丙酸、丁酸和戊酸处理t淋巴细胞后组蛋白h3和h4的乙酰化增加(图5d)。此外,暴露于丙酸、丁酸和戊酸,而不是乙酸和己酸的ctl衍生的细胞裂解物显示出hdac活性的剧烈降低(图1i)。丙戊酸(valproate,即2-propylpentanoate,2-戊酸丙酯)是一种合成的支链scfa,来源于戊酸,并具有很强的hdac抑制活性(图1i)。我们观察到,与戊酸类似,丙戊酸可有效增强ctl中tnf-α和ifn-γ的表达(图1j和1k)。此外,戊酸和丙戊酸都强烈诱导cd8
+
t细胞中的ctl相关转录因子t-bet和eomes(图1,l和m)。我们接下来研究了在用戊酸处理ctl后,h4的乙酰化是否在ctl特征基因座(ifnγ、tbx21和eomes)处增加。事实上,戊酸能够增强ifnγ、tbx21和eomes的启动子区域的h4乙酰化(图1n和图5e)。此外,t-bet缺陷型ctl在用戊酸处理后表现出ifn-γ生产的部分缺陷(图5,f和g)。这些结果表明戊酸的hdac抑制活性调节ctl中几种效应分子的产生。由于t淋巴细胞内的高度异质性和可塑性,我们接下来研究了戊酸对其他cd8
+
t细胞亚型的可能影响。我们观察到,戊酸处理诱导了最近描述的亚群tc9和tc17细胞向产生ifn-γ的ctl的表型转变(图6,a-d)。为了进一步了解可能的治疗策略,我们接下来研究了戊酸对人cd8
+
t淋巴细胞的影响。
128.我们从人t细胞获得的数据表明,戊酸可能具有治疗潜力,尤其是对于car疗法,因为该微生物scfa能够通过增强颗粒酶b、ifn-γ和eomes的表达来诱导人cd8
+
t淋巴细胞中的ctl表型(图6,e和f)。
129.戊酸处理的ctl的过继转移增强抗癌免疫。
130.我们接下来试图确定戊酸处理的ctl在对抗已形成的肿瘤方面是否优于对照。我们在两种不同的皮下(s.c.)肿瘤模型中检验了这一假设。我们向cd45.2
+
小鼠体内皮下注入了b16ova黑色素瘤细胞,并在肿瘤注射后第5天将对照或戊酸处理的cd45.1
+
ot-ictl转移到受体动物中。经戊酸预处理后,抗原特异性ctl介导的抗肿瘤免疫显著改善,如所示的肿瘤体积和重量减少(图2,a-d)。在ctl过继转移后的第10天,我们检测到更多数量的戊酸处理的细胞,这些细胞与肿瘤中的对照ot-i ctl、引流ln(draining ln)和脾脏相比,表达更多效应细胞因子tnf-α和ifn-γ(图2,e-g)。此外,在表达ova蛋白的侵袭性胰腺肿瘤(表达ova的panc02细胞,pancova)中测试了由用戊酸处理ctl介导的抗肿瘤作用。为此,向cd45.2
+
小鼠体内皮下注射1.5
×
106pancova细胞。值得注意的是,少量(7.5
×
105)经戊酸处理的cd45.1
+
ot-i cd8
+
t淋巴细胞(而非对照ctl)的转移足以完全清除受体动物中pancova细胞的生长(图2,h-i)。虽然在肿瘤接种后第23天几乎没有发现对照ctl,但我们观察到,即使在清除肿瘤细胞10天后,在受体小鼠的引流ln和脾脏中仍存在高ifn-γ产生的戊酸处理的ctl(图2j)。这些数据表明,戊酸盐可用于靶向人肿瘤治疗性过继细胞疗法。一个应用领域是car疗法。
131.产戊酸的细菌megasphaera massiliensis增强了cd8
+
ctl的抗肿瘤活性。
132.我们最近表明,人肠道分离的细菌菌株马赛巨型球菌(megasphaera massiliensis)能够产生高水平的戊酸。通过广泛筛选一组人共生体的scfa产量情况,我们无法在任何待测菌株中检测到任何显著的戊酸生产,这表明主要是肠道中低丰度的菌株可能能够产生这种特定的scfa。与14种丰富的细菌物种(代表了人肠道中最常见的门的比例分布(厚壁菌门(firmicutes):粪肠球菌(enterococcus faecalis)、普拉梭菌(faecalibacterium prausnitzii)、哈氏厌氧棒杆菌(anaerostipes hadrus)、类球布劳特氏菌(blautia coccoides)、长链多尔氏菌(dorea longicatena)、扭曲真杆菌(faecalicatena contorta)和活泼瘤胃球菌(ruminococcus gnavus);拟杆菌门(bacteroidetes):脆弱拟杆菌(bacteroides fragilis)、迪氏副拟杆菌(parabacteroides distasonis)、普通拟杆菌(bacteroides vulgatus)和卵形拟杆菌(bacteroides ovatus);放线菌门(actinobacteria):长双歧杆菌(bifidobacterium longum)和短双歧杆菌(bifidobacterium breve);和变形杆菌门(proteobacteria):大肠杆菌(escherichia coli)))相比,我们观察到马赛巨型球菌(m.massiliensis)是唯一合成大量戊酸的细菌(图3a)。有趣的是,气相色谱-质谱(gc-ms)分析表明,除了两种不同的马赛巨型球菌(m.massiliensis)菌株(dsm 26228和ncimb 42787)外,与马赛巨型球菌(m.massiliensis)最接近的系统发育近邻(phylogenetic neighbor)埃氏巨型球菌(megasphaera elsdenii)也产生戊酸,虽然产生水平没有马赛巨型球菌(m.massiliensis)高。虽然大多数共生体产生大量的乙酸和甲酸,但普拉梭菌(faecalibacterium prausnitzii)和哈氏厌氧棒杆菌(anaerostipes hadrus)合成了高水平的丁酸。我们还发现,两个马赛巨型球菌(m.massiliensis)菌株是中链脂肪酸(medium-chain fatty acid,mcfa)己酸和支链脂肪酸(branched-chain fatty acid,bcfa)2-甲基丙酸(异丁酸)和3-甲基丁酸(isovalerate,isopentanoate,异戊酸)仅有的生产者,所述脂肪酸已知依赖于膳食蛋白质的细菌发酵(图3a)。我们假设产生高水平丁酸的细菌,如普拉梭菌(f.prausnitzii)和哈氏厌氧棒杆菌
(a.hadrus),或埃氏巨型球菌(m.elsdenii)和马赛巨型球菌(m.massiliensis),它们能够合成丁酸和戊酸,可能发挥hdac抑制活性并且可能是用于过继性cd8
+
t细胞疗法的共生细菌中的最佳候选者。事实上,这4种细菌而不是不能产生戊酸和丁酸的其他待测细菌的上清液,强烈抑制i类hdac同种型的活性。
133.这种效应对i类酶具有特异性,因为ii类hdac(hdac4、hdac5、hdac6和hdac9)不受任何细菌上清液处理的影响。具体地,hdac2同种型受到马赛巨型球菌(m.massiliensis)的上清液以及不同浓度的丁酸和戊酸的强烈抑制(图3,b-d)。泛hdac(pan-hdac)抑制剂tsa抑制i类和ii类hdac。当我们比较来自16种人共生体的上清液的总hdac抑制活性时,我们观察到最强的抑制作用是由产生戊酸的马赛巨型球菌(m.massiliensis)和埃氏巨型球菌(m.elsdenii)以及强丁酸生产者普拉梭菌(f.prausnitzii)和哈氏厌氧棒杆菌(a.hadrus)介导的(图7a)。这些数据表明戊酸和丁酸介导的对cd8
+
t细胞的影响可能主要是通过抑制i类hdac来介导的。我们进一步研究了产生戊酸的细菌马赛巨型球菌(m.massiliensis)是否对cd8
+
t细胞的功能有影响。事实上,在用来自马赛巨型球菌(massiliensis)衍生的上清液处理t淋巴细胞后,ifn-γ
+
tnf-α
+
cd8
+
细胞的频率和ctl分泌的tnf-α显著增加(图4a)。通过比较来自无法合成戊酸或丁酸的几种肠道共生细菌(例如大肠杆菌、粪肠球菌和脆弱拟杆菌)的上清液与马赛巨型球菌(m.massiliensis)的上清液,我们观察到产戊酸细菌对nf-α分泌的特异性影响(图7b)。值得注意的是,与对照ctl相比,用马赛巨型球菌(m.massiliensis)的上清液预处理并过继转移到ly5.2
+
宿主的ly5.1
+
ot-i ctl被赋予了更高的浸润肿瘤、产生效应细胞因子和消除b16ova细胞的能力(图4,b-f)。总之,广泛的筛选表明,只有少数待测的共生细菌能够强烈抑制hdac活性,并且强hdac抑制剂如马赛巨型球菌(m.massiliensis)可用于调节ctl功能。我们认为,已鉴定的scfa是支持抗癌功效的新的有希望的候选者。戊酸似乎通过抑制i类hdac酶来促进抗肿瘤免疫,从而增强特定ctl相关位点的组蛋白乙酰化状态。值得注意的是,显示cd4
+
t细胞中i类hdac同种型hdac1和hdac2的t细胞特异性缺失诱导cd8谱系特征基因如gzmb、prf1和eomes的强表达。之前,双歧杆菌被证明可以增强小鼠的抗肿瘤免疫。有趣的是,消除已形成的肿瘤在cd8
+
t细胞耗竭的动物中被清除,表明潜在机制是通过宿主抗癌ctl应答介导的。同样,嗜黏蛋白阿克曼菌(akkermansia muciniphila)增加了向肿瘤中的cd4
+
t细胞的招募,并恢复了ici疗法对无应答癌症患者的功效。由于双歧杆菌菌株和嗜黏蛋白阿克曼菌(a.muciniphila)是广泛存在于人的共生细菌,我们认为罕见肠道细菌物种,如马赛巨型球菌(m.massiliensis)及其特定代谢物(如戊酸)可能是更适合癌症患者的生物治疗物。
134.戊酸促进cd25和il-2的表达以及ctl的增殖扩增和持久性。
135.为了研究scfa对cd8
+
t细胞存活和持久性的影响,我们将戊酸处理的ctl(cd45.2
+
)与对照ctl(cd45.1
+
)以1:1的比例混合,并将它们共转移到rag1缺陷小鼠中。为了更好地模拟体内肿瘤微环境,我们还过继共转移了实体瘤中常见的treg(cd45.2
+
,来自fir
×
tiger报告小鼠)。此外,foxp3-cd4
+
t细胞作为il-2的细胞来源共转移(图9,a和b)。令人惊讶的是,与对照ctl相反,在转移后第15天,发现即使没有遇到同源抗原,戊酸处理的cd8
+
t淋巴细胞的细胞数量和频率很高(图9,c和d)。利用cfse标记增殖细胞的能力在用戊酸预处理后,体内监测rag1缺陷小鼠的cd8
+
t细胞增殖。我们发现戊酸处理和cfse标记的cd8
+
t细胞与对照ctl相比具有更强的增殖能力(图9,e)。鉴于cd25在支持有效的il-2r信号传导以及淋巴细
胞的增殖和存活中的重要性,我们接下来考虑戊酸是否能够调节ctl中的cd25表达。有趣的是,不仅戊酸,丙戊酸也强烈提高体外产生的ctl中cd25
+
ifn-γ
+
细胞的百分比(图9,f),表明戊酸的hdac抑制活性可能调节cd25的表达。值得注意的是,我们观察到在所有三个检验的器官iln、mln和脾脏中,与对照ctl相比,戊酸预处理增加了cd25
+
cd8
+
t细胞的频率和数量(图9,g和h)。
136.il-2是介导t细胞增殖扩增的关键因素之一,并且在各个受体亚基中,cd25对il-2的亲和力最高。通过分析戊酸对il-2诱导的stat5磷酸化动力学的影响,我们发现与对照细胞相比,戊酸处理的ctl中响应il-2的stat5活性更强(图9,i)。最重要的是,与对照cd8
+
t细胞相比,戊酸处理的ctl以持续的方式稳定产生il-2(图9,j),因此能够维持这种自分泌循环更长的时间。
137.戊酸通过增强mtor的活性来调节ctl的细胞代谢。
138.已知糖酵解代谢途径促进ifn-γ表达和t细胞效应子功能。由于t细胞可以利用微生物代谢物来满足代谢需求以增强糖酵解和氧化磷酸化,因此我们测试了戊酸是否能够增加mtor复合物的活性,mtor复合物是一种细胞生长和免疫代谢的关键调节剂。事实上,戊酸提高了小鼠和人ctl和car t细胞中mtor及其下游靶标s6核糖体蛋白的磷酸化水平(图10,a-d)。有趣的是,mocetinostat(i类hdac抑制剂mgcd0103)和tmp-195(ii类hdac抑制剂)均对s6的磷酸化没有显著影响,表明戊酸和丁酸对cd8
+
t细胞代谢状态的影响与hdac无关(图10,c和d)。此外,作为糖酵解代谢指标的胞外酸化率(extracellular acidification rate,ecar)在戊酸处理ctl后增加(图10,e)。因此,与之前发表的戊酸对b细胞和cd4
+
t淋巴细胞代谢活性的影响相似,这种scfa还增强了cd8
+
t细胞的糖酵解代谢。
139.戊酸改善小鼠car t细胞的功效。
140.为了进一步了解可能的治疗策略,我们进一步检验了scfa对基因工程嵌合抗原受体(car)t细胞的影响。为此,我们使用了识别受体酪氨酸激酶样孤儿受体1(ror1)的car t细胞,ror1是一种经常在各种上皮肿瘤和一些b细胞恶性肿瘤中表达的分子。之前,我们可以证明配有这种ror1-car的人cd8
+
t淋巴细胞能够发挥有效的抗肿瘤作用。另外,用丁酸或戊酸处理的识别ror1的小鼠car t淋巴细胞增强其tnf-α和ifn-γ的产生和cd25的表达。观察到mocetinostat对car t细胞的类似影响,但tmp-195没有(图11,a-d)。为了评估戊酸对小鼠car t细胞体内功能的影响,我们生成了表达ror1的panc02胰腺肿瘤细胞(pancror1)并将其皮下注射入wt小鼠。在肿瘤细胞注射后的第5天,我们将经戊酸处理的ror1特异性car t细胞转移到荷瘤动物中并监测肿瘤生长。在car t细胞施用后第10天,与用对照car t淋巴细胞处理的动物相比,接受戊酸处理的car t细胞的小鼠的肿瘤体积和重量显著减少(图11,e)此外,与对照car t淋巴细胞相比,我们发现和肿瘤中ifn-γ
+
tnf-α
+
戊酸预处理的car t细胞的频率和数量升高(图11,f)。
141.戊酸提高人car t细胞的功效。
142.我们接下来研究了scfa对人cd8+t淋巴细胞和car t细胞的影响。我们的数据表明戊酸和丁酸可能具有治疗潜力,因为两种scfa都能够通过增强tnf-α和ifn-γ的表达来诱导人cd8
+
t淋巴细胞中的ctl表型。同样,mocetinostat而非tmp-195促进了对人ctl的类似作用(图12,a)。基于从小鼠car t细胞中收集的发现,我们采用一种互补的方法,用戊酸预处理人car t细胞4天,随后研究了未经处理和经戊酸处理的car t细胞的细胞因子产生、增
殖、活化标志物的表达和细胞毒性能力,如图12,b所示。当我们将ror1特异性car t细胞与表达ror1的k562人癌细胞一起孵育时,我们发现戊酸预处理的细胞提高了ctl相关细胞因子ifn-γ和tnf-α的产生(图12,c)。根据小鼠ctl产生的结果,人car t细胞在戊酸预处理后也上调了cd25的表达和il-2的分泌,而未经处理的细胞没有显示出如此强的效果(图12,d和e)。此外,我们发现用戊酸预处理的car t细胞比对照car t细胞增殖更强,并且在遇到它们的同源抗原后表现出优异的溶细胞活性(图12,f和g)。这些结果有力地表明,戊酸和丁酸等微生物代谢物可用于治疗,以提高人car t细胞的功效。
143.统计数据:
144.对于所有实验,使用未配对的student t检验(graphpad prism 8)比较两组的平均值。p《0.05的p值被认为是显著的。使用以下p值:*,p=0.01-0.05;**,p=0.001-0.01;***,p《0.001。在适当的情况下,数据表示为平均值
±
sem。为了比较多个实验组,使用单方差分析(one-way analysis of variance,anova)分析数据。
145.本发明涉及通过将从外周血中分离后的t细胞与短链脂肪酸(scfa)戊酸孵育来改进t细胞的培养。效果是细胞活并且效应分子的产生增加。这增加了肿瘤疗法成功的机会。来自小鼠的t细胞在手术后被转移到患有皮下胰腺肿瘤的小鼠说明了这点。这种类型的细胞处理可以转用于人并改善胰腺癌的治疗。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1