细交链格孢菌酮酸及其衍生物的制备方法
本发明涉及化学领域,具体地说,涉及细交链格孢菌酮酸及其衍生物的制备方法。
背景技术:
随着作物对病虫草害防治药剂品种抗药性加剧与替代传统农药短缺,基于活性天然产物开发高效低风险小分子新农药品种越来越受到广泛的关注和应用。细交链格孢菌酮酸(tenuazonicacid,tea)是链格孢菌等在特定条件下产生的次生代谢产物,具有抗肿瘤、除草、杀菌等广泛的农用与医药生物活性。因此,细交链格孢菌酮酸及衍生物高效、简易合成方法对研究其结构与活性关系具有重要意义。
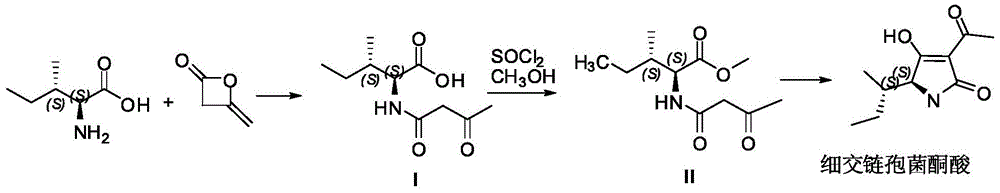
目前报道的细交链格孢菌酮酸(特窗酸)及其衍生物的合成路线主要以l-异亮氨酸为原料,与双乙烯酮乙酰乙酰化得到中间体(i)酯化得到中间体(ii),进一步在碱性条件下狄克曼关环得到特窗酸骨架(图1)。该路线涉及到重要的乙酰乙酰化试剂--双乙烯酮,双乙烯酮不仅价格昂贵,而且具有较强的毒性,刺激眼睛,且合成得到的3位只能为取代的乙酰基,不易进行衍生化研究取代基对特窗酸骨架活性的影响。由于中间体(ii)羧基邻位手性中心在碱性条件下容易消旋,合成得到的特窗酸多为消旋体或差向异构体。
技术实现要素:
本发明的目的是提供细交链格孢菌酮酸及其衍生物(3位和5位含不同修饰基团的tea衍生物)的制备方法。
为了实现本发明目的,本发明提供细交链格孢菌酮酸及其衍生物的制备方法,包括以下步骤:
a、丙二酸环亚异丙酯与酰氯反应得到酰基乙酰化试剂;
反应式如下:
其中,r为-ch3、-c3h5或-c6h11;
b、氨基酸甲酯或氨基酸甲酯盐酸盐与酰基乙酰化试剂反应得到酰基乙酰化氨基酸甲酯;
c、酰基乙酰化氨基酸甲酯与甲醇钠反应得到细交链格孢菌酮酸及其衍生物;
i)对于细交链格孢菌酮酸的制备,步骤b的反应式如下:
步骤c的反应式如下:
ii)对于细交链格孢菌酮酸衍生物的制备,步骤b的反应式如下:
步骤c的反应式如下:
其中,r1为-ch2c6h4cl、-ch2c6h4f、-ch2ch3、-ch2ch2ch3、-ch2ch2ch2ch3、-ch2ch2ch2ch2ch2ch2ch3、-ch2c6h5、-ch2ch2sch3、-ch2c6h11、-ch3、-c(ch3)3、-ch2ch2c6h5、-ch2c6h4oh、-ch2c8h6n或h。
前述的方法,步骤a中,在冰水浴条件下,丙二酸环亚异丙酯与酰氯在吡啶和二氯甲烷存在的条件下发生亲核反应得到酰基乙酰化试剂。
前述的方法,步骤b中,在加热回流条件下,氨基酸甲酯或氨基酸甲酯盐酸盐与酰基乙酰化试剂在对二氧六环和三乙胺存在的条件下发生酰胺化反应得到酰基乙酰化氨基酸甲酯。
前述的方法,步骤c中,在加热回流条件下,酰基乙酰化氨基酸甲酯与甲醇钠在甲醇存在的条件下发生狄克曼缩合反应得到细交链格孢菌酮酸及其衍生物。
进一步地,步骤a包括:
a1、冰水浴条件下,将1.44-14.4g丙二酸环亚异丙酯和1.58-15.8g吡啶加入到20-200ml二氯甲烷(分析纯)中,得到溶液①;
a2、将11.0-110.0mmol酰氯溶于2-20ml二氯甲烷中,得到溶液②;
a3、在氮气保护下,将溶液②于1h内逐滴滴加到溶液①中,于5~10℃反应2h;然后在室温条件下,搅拌反应过夜;
a4、用20-200ml二氯甲烷淬灭反应,并依次用10%盐酸和纯水洗涤有机相,然后将有机相用无水硫酸钠干燥,抽滤,旋转蒸发除去二氯甲烷,得到酰基乙酰化试剂。
进一步地,步骤b包括:将10.0-100.0mmol氨基酸甲酯盐酸盐和11.0-110.0mmol酰基乙酰化试剂溶于40-400ml对二氧六环中,并向上述体系中逐滴滴加1.01-10.1g三乙胺在加热回流的条件下反应4h旋转蒸发除去对二氧六环,将残留物溶解在200ml乙酸乙酯中,并依次用2mol/l盐酸、饱和食盐水洗涤有机相,将有机相用无水硫酸钠干燥,过滤并蒸发有机相,得到酰基乙酰化氨基酸甲酯。
优选地,氨基酸甲酯盐酸盐和酰基乙酰化试剂的摩尔比为1∶1.1,加热回流的温度为110℃,反应时间为4h。
进一步地,步骤c包括:将10.0-100.0mmol酰基乙酰化氨基酸甲酯溶解在20ml甲醇(分析纯)中,加入30%甲醇钠溶液2.22-22.2ml,在75℃加热回流的条件下反应4h,旋转蒸发除去甲醇,并将残留物溶解于12ml纯水中,用盐酸调ph至2-3,用乙醚萃取,并将有机相用无水硫酸钠干燥,过滤并蒸发有机相,得到细交链格孢菌酮酸及其衍生物。
在本发明的一个具体实施方式中,细交链格孢菌酮酸的制备方法如下:
1)5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮的合成
冰水浴条件下,将5.8g丙二酸环亚异丙酯和6.5g吡啶加入到75ml二氯甲烷中,得到溶液i;将4.4ml乙酰氯溶解于25ml二氯甲烷中,得到溶液ii;在氮气的保护下,于1h内将溶液ii缓慢滴加至溶液i中,并在0℃以下保持搅拌1h,然后撤去冰水浴,恢复至室温,并保持搅拌过夜;反应结束后,向棕色溶液中加入50ml二氯甲烷淬灭反应,有机相用10%盐酸洗涤3次,每次75ml,然后用100ml纯水洗涤,收集有机相,并用无水硫酸钠干燥,过滤除去硫酸钠,旋转蒸发有机相,得到粗产物,再用热乙醚对粗产物进行重结晶,抽滤,最终得到棕色固体,即为5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮;
2)(3-氧代丁酰基)-l-异亮氨酸甲酯的合成
将1.8g异亮氨酸甲酯盐酸盐和2.09g5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮溶解于40ml对二氧六环中,向上述体系中逐滴滴加1.01g三乙胺,在110℃加热回流的条件下反应4h,旋转蒸发除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用100ml2mol/l盐酸和100ml饱和食盐水洗涤一次,并将有机相用无水硫酸钠干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为(3-氧代丁酰基)-l-异亮氨酸甲酯;
3)细交链格孢菌酮酸的合成
将2.29g(3-氧代丁酰基)-l-异亮氨酸甲酯溶解在20ml甲醇中,加入30%甲醇钠溶液2.22ml,在75℃加热回流的条件下反应4h,旋转蒸发除去甲醇,并将残留物溶解于12ml纯水中,用1mol/l盐酸调ph至2-3,用乙醚萃取,并将有机相用无水硫酸钠干燥,过滤并蒸发有机相,得到细交链格孢菌酮酸。
本发明提供的细交链格孢菌酮酸衍生物的制备方法,主要步骤包括:丙二酸环亚异丙酯与酰氯反应得到酰基乙酰化试剂,氨基酸甲酯盐酸盐和酰基乙酰化试剂分别加入到对二氧六环(40ml)溶液中,并向上述溶液中逐滴滴加三乙胺,在加热回流的条件下反应4小时得到酰基乙酰化氨基酸甲酯。将酰基乙酰化氨基酸甲酯溶解在甲醇溶液中,加入甲醇钠,在加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到细交链孢菌酮酸衍生物。
具体步骤如下:
1)冰水浴条件下,将丙二酸环亚异丙酯和吡啶分别加入到二氯甲烷(200ml)溶液中,并将乙酰氯溶于二氯甲烷(20ml)中,在氮气的保护下,于1h内逐滴滴加,并维持反应体系的温度在5~10℃,反应2h后,撤去冰水浴,逐渐恢复室温,并在室温条件下,搅拌反应过夜。用50ml二氯甲烷猝灭反应,并用10%盐酸和100ml纯水洗涤有机相,并将有机相置于无水硫酸钠上干燥,抽滤,旋转蒸发除去二氯甲烷,得到酰基乙酰化试剂i。
2)氨基酸甲酯盐酸盐和酰基乙酰化试剂i分别加入到对二氧六环(40ml)溶液中,并向上述溶液中逐滴滴加三乙胺,在加热回流的条件下反应4小时,旋转蒸发除去对二氧六环,,将残留物溶解在200ml乙酸乙酯中,并用2mol/l盐酸、饱和食盐水分别洗涤有机相,将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到酰基乙酰化氨基酸甲酯ii。
3)酰基乙酰化氨基酸甲酯ii溶解在甲醇(20ml)溶液中,加入甲醇钠,在加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mo1/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到细交链格孢菌酮酸及其衍生物iii。
第二方面,本发明提供上述制备的细交链格孢菌酮酸及其衍生物在农药、生物医药等领域中的应用。
与现有技术相比,本发明至少具有以下优点:
(一)本发明以丙二酸环亚异丙酯代替双乙烯酮,对天然产物可进行修饰的位点更多。
(二)合成产率高。
(三)制备过程中使用的化学试剂毒性小,操作更加安全。
(四)所用原料低廉易得,反应条件温和,操作简单,社会效益和经济效益显著,适合工业化生产。
附图说明
图1为现有细交链格孢菌酮酸(特窗酸)及其衍生物的合成路线。
图2为本发明细交链格孢菌酮酸及其衍生物的合成路线。
图3为本发明较佳实施例中制备的细交链格孢菌酮酸核磁共振1hnmr图。
图4为本发明较佳实施例中制备的细交链格孢菌酮酸核磁共振13cnmr图。
图5为本发明较佳实施例中制备的细交链格孢菌酮酸高分辨质谱图。
具体实施方式
本发明提供一种基于天然活性物质细交链格孢菌酮酸及其在3位和5位不同修饰衍生物的合成方法。具体合成过程见图2。
1、冰水浴条件下,将丙二酸环亚异丙酯和吡啶分别加入到二氯甲烷(200ml)溶液中,并将酰氯溶于二氯甲烷(20ml)中,在氮气的保护下,于1h内逐滴滴加,并维持反应体系的温度在5~10℃,反应2h后,撤去冰水浴,逐渐恢复室温,并在室温条件下,搅拌反应过夜。用50ml二氯甲烷淬灭反应,并用10%盐酸和100ml纯水洗涤有机相,并将有机相置于无水硫酸钠上干燥,抽滤,旋转蒸发除去二氯甲烷,得到红棕色固体1a-1c,即为乙酰基乙酰化试剂i。
2、氨基酸甲酯盐酸盐和乙酰基乙酰化试剂i分别加入到对二氧六环(40ml)溶液中,并向上述溶液中逐滴滴加三乙胺,在加热回流的条件下反应4h,反应结束后,旋转蒸发除去对二氧六环,将残留物溶解在200ml乙酸乙酯中,并用2mol/l盐酸、饱和食盐水分别洗涤有机相,将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到粗产物,通过柱层析法提纯。将提纯得到的产物溶解在甲醇(20ml)溶液中,加入甲醇钠,在加热回流的条件下反应4h,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到3-位取代细交链孢菌酮酸。
3、氨基酸甲酯盐酸盐和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮分别加入到对二氧六环(40ml)溶液中,并向上述溶液中逐滴滴加三乙胺,在加热回流的条件下反应4小时,反应完成后,旋转蒸发除去对二氧六环,将残留物溶解在200ml乙酸乙酯中,并用2mol/l盐酸、饱和食盐水分别洗涤有机相,将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到粗产物,通过柱层析法提纯。将提纯得到的产物溶解在甲醇(20ml)溶液中,加入甲醇钠,在加热回流的条件下反应4h,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mo1/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到5-位取代细交链孢菌酮酸。
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
以下实施例中柱层析法使用的柱层析硅胶为200-300目,购自青岛鼎康硅胶有限公司。
实施例15-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(1a)的合成
冰水浴条件下,将丙二酸环亚异丙酯(5.8g,40mmol)和吡啶(6.5g,82mmol)加入到二氯甲烷(75ml)溶液中,并将乙酰氯(4.4ml,48mmol)溶解于二氯甲烷(25ml)溶液中,在氮气的保护下,于1h内缓慢滴加至上述溶液中。并且在0℃以下保持搅拌1h,随后撤去冰水浴,逐渐恢复至室温,并保持搅拌过夜。反应结束后,像棕色溶液中加入50ml二氯甲烷淬灭反应,有机相分别用10%盐酸(盐酸洗3次,每次75ml)和100ml纯水洗涤,收集有机相,并置于无水硫酸钠上干燥,过滤除去硫酸钠,旋转蒸发有机相,得到粗产物,再用热乙醚对粗产物进行重结晶,抽滤,最终得到棕色固体,即为化合物1a。产率83%。化合物1a表征如下:1hnmr(600mhz,cdcl3)δ1.75(s,6h),2.69(s,3h),15.13(s,1h).hrms[esi-]forc8h10o5[(m-h)-],m/zcalcd:185.0450;found:185.0451.
实施例25-(环丙烷羰基)-2,2-二甲基-1,3-二恶烷-4,6-二酮(1b)的合成
冰水浴条件下,将丙二酸环亚异丙酯(5.8g,40mmol)和吡啶(6.5g,82mmol)加入到二氯甲烷(75ml)溶液中,并将环丙基甲酰氯(3.4ml,48mmol)溶解于二氯甲烷(25ml)溶液中,在氮气的保护下,于1h内缓慢滴加至上述溶液中。并且在0℃以下保持搅拌1h,随后撤去冰水浴,逐渐恢复至室温,并保持搅拌过夜。反应结束后,向棕色溶液中加入50ml二氯甲烷淬灭反应,有机相分别用10%盐酸(盐酸洗3次,每次75ml)和100ml纯水洗涤,收集有机相,并置于无水硫酸钠上干燥,过滤除去硫酸钠,旋转蒸发有机相,得到粗产物,再用热乙醚对粗产物进行重结晶,抽滤,最终得到淡黄色固体,即为化合物1b。产率82%。化合物1b表征如下:1hnmr(600mhz,cdcl3)δ1.25(d,1h,j=6.9hz),1.74(s,6h),4.10(t,6h,j=6.9hz),15.50(s,1h).hrms[esi-]forc10h12o5[(m-h)-],m/zcalcd:211.0606;found:211.0609.
实施例35-(环己烷羰基)-2,2-二甲基-1,3-二恶烷-4,6-二酮(1c)的合成
冰水浴条件下,将丙二酸环亚异丙酯(5.8g,40mmol)和吡啶(6.5g,82mmol)加入到二氯甲烷(75ml)溶液中,并将环己基甲酰氯(7.04g,48mmol)溶解于二氯甲烷(25ml)溶液中,在氮气的保护下,于1h内缓慢滴加至上述溶液中。并且在0℃以下保持搅拌1h,随后撤去冰水浴,逐渐恢复至室温,并保持搅拌过夜。反应结束后,向棕色溶液中加入50ml二氯甲烷淬灭反应,有机相分别用10%盐酸(盐酸洗3次,每次75ml)和100ml纯水洗涤,收集有机相,并置于无水硫酸钠上干燥,过滤除去硫酸钠,旋转蒸发有机相,得到粗产物,再用热乙醚对粗产物进行重结晶,抽滤,最终得到黄棕色固体,即为化合物1c。产率85%。化合物1c表征如下:1hnmr(600mhz,cdcl3)δ1.20-1.90(m,10h),1.74(s,6h),3.74-3.85(m,1h),15.51(s,1h).hrms[esi-]forc13h18o5[(m-h)-],m/zcalcd:235.1076;found:235.1077.
实施例4(3-氧代丁酰基)-l-异亮氨酸甲酯(2a)的合成
将异亮氨酸甲酯盐酸盐(1.8g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物2a,产率90%。化合物2a表征如下:1hnmr(600mhz,cdcl3)δ0.93(q,j=7.1hz,3h),0.98(d,j=6.9hz,3h),1.26-1.31(m,1h),1.49-1.57(m,1h),1.95-2.04(m,1h),2.28(s,3h),2.77(s,2h),3.73(s,3h),4.63-4.54(m,1h).hrms[esi-]forc11h19n04[(m-h)-],m/zcalcd:228.1236;found:228.1234.
实施例5tea的合成
将(3-氧代丁酰基)-l-异亮氨酸甲酯(2.29g,10mmol)溶解在甲醇(20ml)溶液中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调节其ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物tea,产率90%。化合物表征如下:1hnmr(600mhz,dmso)δ0.78(t,j=7.4hz,3h),0.88(d,j=7.0hz,3h),1.01-1.13(m,1h),1.19-1.25(m,1h),1.71-1.84(m,1h),2.32(s,3h),3.77(s,1h),6.80(s,3h),8.85(s,1h).hrms[esi-]forc10h15no3[(m-h)-],m/zcalcd:196.0974;found:196.0970.
合成的细交链格孢菌酮酸的核磁共振氢谱、碳谱以及高分辨质谱分别见图3-图5。
实施例63-(4-氧苯基)-2-(3-氧代丁酰胺)丙酸甲酯(4a)的合成
将2-氨基-3-(4-氯苯基)丙酸甲酯盐酸盐(2.14g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4a,yeild,85%。化合物4a表征如下:1hnmr(600mhz,cdcl3)δ2.22(s,3h),3.03(dd,j=14.0,6.7hz,1h),3.13(dd,j=14.0,5.6hz,1h),3.38(s,2h),3.72(d,j=6.1hz,3h),4.84(dd,j=13.5,6.8hz,1h),7.07(d,j=8.2hz,2h),7.25(d,j=8.2hz,2h).hrms[esi-]forc14h16clno4[(m-h)-],m/zcalcd:296.0690;found:296.0692.
实施例73-(4-氟苯基)-2-(3-氧代丁酰胺)丙酸甲酯(4b)的合成
将2-氨基-3-(4-氟苯基)丙酸甲酯盐酸盐(2.34g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4b,yeild,80%。化合物4b表征如下:1hnmr(600mhz,cdcl3)δ2.19(s,3h),3.01(dd,j=14.0,6.7hz,1h),3.11(dd,j=14.0,5.6hz,3.36(s,2h),1h),3.69(d,j=5.1hz,3h),4.81(dd,j=13.4,6.8hz,1h),6.95(t,j=8.6hz,2h),7.08(dd,j=8.4,5.4hz,2h).hrms[esi-]forc14h16fno4[(m-h)-],m/zcalcd:280.0985;found:280.0987.
实施例82-(3-氧代丁酰胺)丁酸甲酯(4c)的合成
将(2s)-2-氨基丁酸甲酯盐酸盐(1.54g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4c,yeild,83%。化合物4c表征如下:1hnmr(600mhz,cdcl3)δ0.92(t,j=7.5hz,3h),1.74(dq,j=21.5,7.2hz,2h),1.89(tt,j=14.6,7.4hz,1h),2.26(s,3h),3.40-3.48{m,2h),3.73(s,3h),4.55(dd,j=12.8,7.1hz,1h).hrms[esi-]forc9h15no4[(m-h)-],m/zcalcd:200.0923;found:200.0924.
实施例92-(3-氧代丁酰胺)戊酸甲酯(4d)的合成
将l-正缬氨酸甲酯盐酸盐(1.68g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,选抓蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4d,yeild,86%。化合物4d表征如下:1hnmr(600mhz,cdcl3)δ0.92(t,j=7.3hz,3h),1.35(pd,j=13.6,6.6hz,2h),1.68(dt,j=13.9,8.7hz,1h),1.78-1.84(m,1h),2.27(s,3h),3.40-3.48(m,2h),3.73(s,3h),4.58(dd,j=13.0,7.5hz,1h).hrms[esi-]forc10h17no4[(m-h)-],m/zcalcd:214.1079;found:214.1077.
实施例102-(3-氧代丁酰胺)己酸甲酯(4e)的合成
将l-正亮氨酸甲酯盐酸盐(1.82g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在加热回流110℃的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4e,yeild,89%。化合物4e表征如下:1hnmr(600mhz,cdcl3)δ0.87(t,j=6.9hz,3h),1.30(dt,j=12.7,6.4hz,4h),1.63-1.72(m,1h),1.77-1.85(m,1h),2.25(s,3h),3.43(s,2h),3.72(d,j=5.9hz,3h),4.56(d,j=5.5hz,1h).hrms[esi-]forc11h19no4[(m-h)-],m/zcalcd:228.1236;found:228.1233.
实施例112-(3-氧代丁酰胺)辛酸甲酯(4f)的合成
将(s)-2-氨基辛酸甲酯盐酸盐(1.73g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在加热回流110℃的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,选抓蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4f,yeild,85%。化合物4f表征如下:1hnmr(600mhz,cdcl3)δ0.87(t,j=6.9hz,3h),1.24-1.33(m,8h),1.64-1.72(m,1h),1.79-1.87(m,1h),2.27(s,3h),3.43(d,j=17.5hz,2h),3.74(d,j=6.3hz,3h),4.53-4.61(m,1h).hrms[esi-]forc13h23no4[(m-h)-],m/zcalcd:256.1549;found:256.1552.
实施例12(3-氧代丁酰基)苯基丙氨酸甲酯(4g)的合成
将l-苯丙氨酸甲酯盐酸盐(2.15g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在加热回流110℃的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4g,yeild,78%。化合物4g表征如下:1hnmr(600mhz,cdcl3)δ2.19(s,3h),2.99-3.10(m,1h),3.10-3.18(m,1h),3.35(s,2h),3.69(d,j=10.5hz,3h),4.79-4.89(m,1h),7.11(t,j=10.8hz,2h),7.23(t,j=7.1hz,2h),7.24-7.30(m,2h).hrms[esi-]forc14h17no4[(m-h)-],m/zcalcd:262.1079;found:262.1077.
实施例13(3-氧代丁酰基)甲硫氨酸甲酯(4h)的合成
将l-甲硫氨酸甲酯盐酸盐(1.99g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,出去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4h,yeild,80%。化合物4h表征如下:1hnmr(600mhz,cdcl3)δ2.00(dd,j=14.4,7.0hz,1h),2.08(s,3h),2.12-2.20(m,1h),2.26(s,3h),2.51(t,j=7.5hz,2h),3.45(s,2h),3.74(s,3h),4.71(dt,j=12.8,6.4hz,1h),7.45(d,j=6.5hz,1h).hrms[esi-]forc10h16no4s[(m-h)-],m/zcalcd:246.0800;found:246.0802.
实施例143-环己基-2-(3-氧代丁酰胺)丙酸甲酯(4i)的合成
将(s)-(-)环己基丙氨酸甲酯盐酸盐(2.21g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,出去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4i,yeild,82%。化合物4i表征如下:1hnmr(600mhz,cdcl3)δ0.82-0.98(m,3h),1.06-1.26(m,5h),1.26-1.36(m,1h),1.52-1.59(m,1h),1.62(d,j=12.2hz,1h),1.67(dd,j=9.5,3.5hz,5h),1.74(t,j=16.9hz,2h),2.26(s,3h),3.44(s,2h),3.71(s,3h),4.61(td,j=8.8,5.3hz,1h).hrms[esi-]forc14h23no4[(m-h)-],m/zcalcd:268.1549;found:268.1546.
实施例15(3-氧代丁酰基)丙氨酸甲酯(4j)的合成
将l-丙氨酸甲酯盐酸盐(1.39g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,出去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4j,yeild,84%。化合物4j表征如下:1hnmr(600mhz,cdcl3)δ1.41(d,j=7.2hz,3h),2.26(s,3h),3.43(s,2h),3.73(s,3h),4.51-4.62(m,1h),7.38(s,1h).hrms[esi-]forc8h13no4[(m-h)-],m/zcalcd:186.0766;found:186.0768.
实施例163,3-二甲基-2-(3-氧代丁酰胺)丁酸甲酯(4k)的合成
将l-叔亮氨酸甲酯盐酸盐(1.82g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,出去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4k,yeild,88%。化合物4k表征如下:1hnmr(600mhz,cdcl3)δ0.98(s,9h),2.26(s,3h),3.45(q,j=17.4hz,2h),3.70(s,3h),4.40(d,j=8.9hz,1h),7.52(d,j=6.3hz,1h).hrms[esi-]forchh19no4[(m-h)-],m/zcalcd:228.1236;found:228.1238.
实施例172-(3-氧代丁酰胺)-4-苯基丁酸甲酯(4l)的合成
将l-高苯丙氨酸乙酯盐酸盐(2.44g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,出去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4l,yeild,86%。化合物41表征如下:1hnmr(600mhz,cdcl3)δ1.23-1.30(m,3h),1.97-2.07(m,1h),2.17-2.25(m,1h),2.27(s,2h),2.60-2.72(m,2h),4.17(q,j=7.1hz,2h),4.63(td,j=7.5,5.4hz,1h),7.18(dd,j=12.6,7.3hz,3h),7.23-7.31(m,2h).hrms[esi-]forc15h19no4[(m-h)-],m/zcalcd:276.1236;found:276.1238.
实施例18(3-氧代丁酰基)酪氨酸甲酯(4m)的合成
将l-酪氨酸甲酯盐酸盐(2.32g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,出去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4m,yeild,81%。化合物4m表征如下:1hnmr(600mhz,cdcl3)δ2.20(s,3h),2.97(dd,j=14.0,7.0hz,1h),3.09(dd,j=14.1,5.2hz,1h),3.73(s,3h),3.38(s,2h),4.84(dd,j=13.0,7.3hz,1h),6.71(d,j=8.3hz,2h),6.98(d,j=8.3hz,2h),7.35(d,j=7.5hz,1h).hrms[esi-]forc14h17no5[(m-h)-],m/zcalcd:278.1028;found:278.1027.
实施例19(3-氧代丁酰基)色氨酸甲酯(4n)的合成
将l-色氨酸甲酯盐酸盐(2.55g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,出去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4n,yeild,84%。化合物4n表征如下:1hnmr(600mhz,cdcl3)δ2.12(s,3h),3.25-3.35(m,4h),3.67(s,3h),4.90(dd,j=13.1,5.8hz,1h),7.02(s,1h),7.08(t,j=7.5hz,1h),7.16(t,j=7.5hz,1h),7.30(t,j=9.7hz,2h),7.51(d,j=7.9hz,1h),8.37(s,1h).hrms[esi-]forc16h18n2o4[(m-h)-],m/zcalcd:301.1188;found:301.1187.
实施例20(3-氧代丁酰基)甘氨酸甲酯(4o)的合成
将l-甘氨酸甲酯盐酸盐(1.26g,10mmol)和5-乙酰基-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.09g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,出去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4o,yeild,86%。化合物4o表征如下:1hnmr(600mhz,cdcl3)δ2.24(s,3h),3.44(s,2h),3.71(d,j=0.7hz,3h),4.02(d,j=3.9hz,2h).hrms[esi-]forc7h12no4[(m-h)-],m/zcalcd:172.0610;found:172.0609.
实施例213-乙酰基-4-羟基-5-(4-氧苄基)-2,5-二氢吡咯-2-酮(5a)的合成
将3-(4-氯苯基)-2-(3-氧杂多酰胺基)丙酸甲酯(2.98g,10mmo1)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5a,yeild,85%。化合物5a表征如下:1hnmr(600mhz,cdcl3)δ2.22(s,3h),3.03(dd,j=14.0,6.7hz,1h),3.13(dd,j=14.0,5.6hz,1h),3.38(s,2h),3.72(d,j=6.1hz,3h),4.84(dd,j=13.5,6.8hz,1h),7.07(d,j=8.2hz,2h),7.25(d,j=8.2hz,2h).hrms[esi-]forc13h12clno3[(m-h)-],m/zcalcd:264.0427;found:264.0428.
实施例223-乙酰基-4-羟基-5-(4-氟苄基)-2,5-二氢吡咯-2-酮(5b)的合成
将3-(4-氟苯基)-2-(3-氧杂多酰胺基)丙酸甲酯(2.81g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5b,yeild,83%。化合物5b表征如下:1hnmr(600mhz,cdcl3)δ2.46(d,j=8.1hz,3h),2.69(dd,j=14.0,9.8hz,1h),3.23(dt,j=12.1,6.0hz,1h),4.00(dd,j=9.5,3.2hz,1h),6.32(s,1h),6.94-7.05(m,2h),7.19-7.12(m,2h).hrms[esi-]forc13h12fno3[(m-h)-],m/zcalcd:248.0723;found:248.0722.
实施例233-乙酰基4-羟基-5-乙基--2,5-二氢吡咯-2-酮(5c)的合成
将2-(3-氧杂戊酰胺基)丁酸甲酯(2.01g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5c,yeild,88%。化合物5c表征如下:1hnmr(600mhz,dmso)δ0.82(t,j=7.4hz,3h),1.43-1.52(m,1h),1.61-1.71(m,1h),2.47(s,3h),3.78(s,1h),8.93(s,1h).hrms[esi-]forc8h11no3[(m-h)-],m/zcalcd:168.0661;found:168.0660.
实施例243-乙酰基-4-羟基-5-丙基-2,5-二氢吡咯-2-酮(5d)的合成
将2-(3-氧杂戊酰胺基)戊酸甲酯(2.15g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5d,yeild,81%。化合物5d表征如下:1hnmr(600mhz,cdcl3)δ0.92-0.97(m,3h),1.41(dt,j=10.0,7.6hz,2h),1.58(dd,j=13.8,5.6hz,1h),1.78-1.85(m,1h),2.47(d,j=33.4hz,3h),3.82(dd,j=7.8,4.1hz,1h),6.64(d,j=17.6hz,1h).hrms[esi-]forc9h13no3[(m-h)-],m/zcalcd:182.0817;found:182.0818.
实施例253-乙酰基-4-羟基-5-丁基-2,5-二氢吡咯-2-酮(5e)的合成
将2-(3-氧杂戊酰胺基)己酸甲酯(2.29g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5e,yeild,83%。化合物5e表征如下:1hnmr(600mhz,cdcl3)δ0.90(t,j=7.0hz,3h),1.28-1.42(m,4h),1.55-1.66(m,1h),1.79-1.88(m,1h),2.48(d,j=32.7hz,3h),3.82(dd,j=7.9,4.3hz,1h).hrms[esi-]forc10h15no3[(m-h)-],m/zcalcd:196.0974;found:196.0972.
实施例263-乙酰基-4-羟基-5-己基-2,5-二氢吡咯-2-酮(5f)的合成
将2-(3-氧杂戊酰胺基)辛酸甲酯(2.57g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5f,yeild,78%。化合物5f表征如下:1hnmr(600mhz,cdcl3)δ0.85(t,j=6.2hz,3h),1.31(ddd,j=24.2,14.9,8.5hz,8h),1.58(dd,j=11.9,7.1hz,1h),1.82(dd,j=11.1,7.2hz,1h),2.39-2.51(m,3h),3.80(dd,j=7.8,4.2hz,1h),6.81(s,1h).hrms[esi-]forc12h19no3[(m-h)-],m/zcalcd:224.1287;found:224.1286.
实施例273-乙酰基-4-羟基-5-苄基-2,5-二氢-吡咯-2-酮(5g)的合成
将(3-氧代丁酰基)苯基丙氨酸甲酯(2.63g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5g,yeild,80%。化合物5g表征如下:1hnmr(600mhz,cd3od)δ2.09(s,2h),2.97(dt,j=17.9,8.9hz,1h),3.16(dd,j=14.0,5.5hz,1h),3.68(d,j=10.4hz,3h),4.70(dd,j=16.1,10.0hz,1h),7.16-7.25(m,3h),7.27(t,j=7.1hz,2h).hrms[esi-]forc13h13no3[(m-h)-],m/zcalcd:230.0817;found:230.0818.
实施例283-乙酰基-4-羟基-5-(2-(甲硫基)乙基)-2,5-二氢吡咯-2-酮(5h)的合成
将(3-氧代丁酰基)甲硫氨酸甲酯(2.47g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5h,yeild,81%。化合物5h表征如下:1hnmr(600mhz,cdcl3)δ1.89-1.80(m,1h),2.10(s,3h),2.14-2.23(m,1h),2.48(d,j=33.3hz,3h),2.58-2.69(m,2h),3.95(dd,j=8.4,3.8hz,1h),6.88(s,1h).hrms[esi-]forc9h13no3s[(m-h)-],m/zcalcd:214.0538;found:214.0537.
实施例293-乙酰基-4-羟基-5-(环己基甲基)-2,5-二氢吡咯-2-酮(5i)的合成
将3-环己基-2-(3-氧杂戊酰胺基)丙酸甲酯(2.69g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5i,yeild,89%。化合物5i表征如下:1hnmr(600mhz,cdcl3)δ0.84-1.04(m,2h),1.28-1.09(m,3h),1.35-1.49(m,2h),1.62-1.79(m,6h),2.47(d,j=34.5hz,3h),3.88(dd,j=9.8,3.8hz,1h),6.80(s,1h).hrms[esi-]forc13h19no3[(m-h)-],m/zcalcd:236.1287;found:236.1288.
实施例303-乙酰基-4-羟基-5-甲基-2,5-二氢-吡咯-2-酮(5j)的合成
将(3-氧代丁酰基)丙氨酸甲酯(2.01g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5j,yeild,81%。化合物5j表征如下:1hnmr(600mhz,cdcl3)δ1.37(dd,j=16.9,6.9hz,3h),2.47(d,j=34.9hz,3h),3.94(dt,j=20.7,6.9hz,1h),6.43(s,1h).hrms[esi-]forc7h9no3[(m-h)-],m/zcalcd:154.0504;found:154.0503.
实施例313-乙酰基-5-(叔丁基)-4-羟基-2,5-二氢吡咯-2-酮(5k)的合成
将3,3-二甲基-2-(3-氧杂烟酰胺基)丁酸甲酯(2.29g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5k,yeild,88%。化合物5k表征如下:1hnmr(600mhz,cd3od)δ1.02(d,j=11.4hz,9h),2.21(s,2h),4.28(d,j=17.0hz,1h).hrms[esi-]forc10h15no3[(m-h)-],m/zcalcd:196.0974;found:196.0975.
实施例323-乙酰基-4-羟基-5-苯乙基-2,5-二氢吡咯-2-酮(5l)的合成
将2-(3-氧杂戊酰胺基)-4-苯基丁酸甲酯(2.77g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5l,yeild,81%。化合物51表征如下:1hnmr(600mhz,cdcl3)δ1.92(dt,j=14.9,8.0hz,1h),2.19(dd,j=19.7,13.8hz,1h),2.38-2.52(m,3h),2.72(dt,j=14.0,7.3hz,2h),3.81(dd,j=7.5,4.3hz,1h),7.19(dd,j=14.5,7.2hz,4h),7.27(dd,j=16.1,8.7hz,2h).hrms[esi-]forc14h15no3[(m-h)-],m/zcalcd:244.0974;found:244.0975.
实施例333-乙酰基-4-羟基-5-(4-羟基苄基)-2,5-二氢吡咯-2-酮(5m)的合成
将(3-氧代丁酰基)酪氨酸甲酯(2.77g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5m,yeild,85%。化合物5m表征如下:1hnmr(600mhz,cd3od)δ2.33(s,3h),2.86(dd,j=14.1,6.0hz,1h),2.98(dd,j=14.2,4.2hz,1h),4.08(s,1h),6.67(dd,j=19.1,8.4hz,2h),6.97(d,j=8.4hz,2h).hrms[esi-]forc13h13no4[(m-h)-],m/zcalcd:246.0766;found:246.0767.
实施例345-((1h-吲哚-3-基)甲基)-3-乙酰基-4-羟基-2,5-二氢-吡咯-2-酮(5n)的合成
将(3-氧代丁酰基)色氨酸甲酯(3.02g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5n,yeild,84%。化合物5n表征如下:1hnmr(600mhz,dmso)δ2.25(s,3h),2.96-3.04(m,1h),3.08(dt,j=21.4,10.7hz,1h),4.15(s,1h),6.94(t,j=7.4hz,1h),7.02(t,j=7.5hz,1h),7.46(dd,j=47.2,8.2hz,1h),7.30(t,j=10.2hz,1h),8.87(s,1h),10.71-10.94(m,1h).hrms[esi-]forc15h14n2o3[(m-h)-],m/zcalcd:269.0926;found:269.0927.
实施例353-乙酰基-4-羟基-2,5-二氢吡略-2-酮(5o)的合成
将(3-氧代丁酰基)甘氨酸甲酯(1.73g,10mmol)溶解在甲醇(20ml)中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5o,yeild,89%。化合物5o表征如下:1hnmr(600mhz,cdcl3)δ2.48(d,j=30.2hz,3h),3.80(brs,1h),3.93(brs,1h),6.47(s,1h).hrms[esi-]forc6h7no3[(m-h)-],m/zcalcd:140.0348;found:140.0349.
实施例362-(3-环丙基-3-氧代丙酰胺基)戊酸甲酯(4p)的合成
将正缬氨酸甲酯盐酸盐(1.68g,10mmol)和5-(环丙烷羰基)-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.33g,11mmol)溶解于1,4-二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4p,产率86%。化合物4p表征如下:1hnmr(600mhz,cdcl3)δ0.89(t,j=7.4hz,3h),0.97(dd,j=7.8,3.3hz,2h),1.11(td,j=4.5,2.1hz,2h),1.27-1.39(m,2h),1.65(d,j=9.3hz,1h),1.78(s,1h),1.99(t,j=4.4hz,1h),3.55(s,2h),3.70(s,3h),4.56(dd,j=7.5,2.1hz,1h),7.55(t,j=22.2hz,1h).hrms[esi-]forc12h19no4[(m-h)-],m/zcalcd:240.1236;found:240.1237.
实施例372-(3-环丙基-3-氧代丙酰胺基)丁酸甲酯(4q)的合成
将(2s)-2-氨基丁酸甲酯盐酸盐(1.54g,10mmol)和5-(环丙烷羰基)-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.33g,11mmol)溶解于1,4-二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4q,产率90%。化合物4q表征如下:1hnmr(600mhz,cdcl3)δ0.90(t,j=7.5hz,3h),0.94-1.00(m,2h),1.08-1.14(m,2h),1.72(dt,j=21.5,7.3hz,1h),1.82-1.92(m,1h),1.96-2.03(m,1h),3.55(t,j=9.0hz,2h),3.71(s,3h),4.54(dt,j=13.0,6.4hz,1h),7.61(d,j=5.8hz,1h).hrms[esi-]forc11h17no4[(m-h)-],m/zcalcd:226.1079;found:226.1078.
实施例382-(3-环己基-3-氧代丙酰胺基)戊酸甲酯(4r)的合成
将正缬氨酸甲酯盐酸盐(1.68g,10mmol)和5-(环己烷羰基)-2,2-二甲基-1,3-二恶烷-4,6-二酮(2.80g,11mmol)溶解于对二氧六环(40ml)中,向上述溶液中逐滴滴加三乙胺(1.01g,10mmol),在110℃加热回流的条件下,反应4小时,旋转蒸发,除去溶剂,将残留物溶解在200ml乙酸乙酯中,有机相分别用2mol/l盐酸(100ml)和饱和食盐水(100ml)分别洗涤一次,并将有机相置于无水硫酸钠上干燥,过滤,旋转蒸发有机相,得到粗产物,将粗产物通过柱层析法提纯,得到淡黄色油状液体,即为化合物4r,产率83%。化合物4r表征如下:1hnmr(600mhz,cdcl3)δ0.90(t,j=7.3hz,3h),1.13-1.38(m,8h),1.67(ddd,j=15.2,10.9,7.0hz,2h),1.79(ddd,j=12.8,9.8,4.4hz,3h),1.85(d,j=12.8hz,2h),2.37-2.44(m,1h),3.38-3.48(m,2h),3.68-3.75(m,3h),4.56(dd,j=13.2,7.5hz,1h),7.45(d,j=6.8hz,1h).hrms[esi-]forc15h24no4[(m-h)-],m/zcalcd:282.1705;found:282.1704.
实施例393-(环丙烷羰基)-4-羟基-5-丙基-2,5-二氢-吡咯-2-酮(5p)的合成
将2-(3-环丙基-3-氧代丙酰胺基)戊酸甲酯(2.41g,10mmol)溶解在甲醇(20ml)溶液中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5p,产率85%。化合物5p表征如下:1hnmr(600mhz,cdcl3)δ0.97(td,j=7.4,4.0hz,3h),1.13-1.22(m,2h),1.31-1.38(m,2h),1.67(dt,j=14.4,7.3hz,1h),1.82-1.92(m,1h),2.95-3.03(m,1h),3.78(dd,j=7.3,4.4hz,1h),6.91(s,1h).hrms[esi-]forc11h13no3[(m-h)-],m/zcalcd:208.0974;found:208.0973.
实施例403-(环丙烷羰基)-4-羟基-5-乙基-2,5-二氢-吡咯-2-酮(5q)的合成
将2-(3-环丙基-3-氧代丙酰胺基)丁酸甲酯(2.27g,10mmol)溶解在甲醇(20ml)溶液中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5q,产率88%。化合物5q表征如下:1hnmr(600mhz,dmso)δ0.85(t,j=7.4hz,3h),1.13(q,j=4.1hz,4h),1.44(tt,j=14.7,7.0hz,1h),1.38-1.28(m,2h),1.64(tdd,j=9.6,7.6,4.4hz,1h),2.84(s,1h),3.82(s,1h).hrms[esi-]forc10h13no3[(m-h)-],m/zcalcd:194.0817;found:194.0818.
实施例413-(环己烷羰基)-4-羟基-5-丙基-2,5-二氢-吡咯-2-酮(5r)的合成
将2-(3-环己基-3-氧代丙酰胺基)戊酸甲酯(2.83g,10mmol)溶解在甲醇(20ml)溶液中,加入30%甲醇钠(2.22ml,12mmol),在75℃加热回流的条件下反应4小时,旋转蒸发除去甲醇,并将残留物溶解于纯水(12ml)中,用1mol/l盐酸调ph至2~3左右,用乙醚萃取水相,并将有机相置于无水硫酸钠上干燥,过滤并蒸发有机相,得到化合物5r,产率92%。化合物5r表征如下:1hnmr(600mhz,cdcl3)δ0.90-0.97(m,3h),1.16-1.27(m,1h),1.32-1.45(m,4h),1.45-1.53(m,2h),1.53-1.65(m,1h),1.71(d,j=12.8hz,1h),1.73-1.86(m,5h),3.35-3.49(m,1h),3.79(dd,j=7.9,4.3hz,1h),6.79(s,1h).hrms[esi-]forc14h21no3[(m-h)-],m/zcalcd:250.1443;found:250.1444.
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!