一种解脲脲原体的微滴数字PCR检测方法及其试剂盒与流程
一种解脲脲原体的微滴数字pcr检测方法及其试剂盒
技术领域
1.本发明属生物技术领域,涉及一种体外核酸诊断方法,具体涉及微滴数字pcr绝对定 量检测解脲脲原体方法以及试剂盒。
背景技术:
2.现有技术公开了解脲脲原体(urealyticum spp.)根据分子生物学特征分为两个生物群 和14种血清型。其中基因组较大的血清型2、4、5、8~13属于解脲脲原体(ureaplasmaurealyticum,uu),占脲原体感染的8%~10%;其余血清型1、3、6、14属于微小脲原体 (ureaplasma parvum,up),占脲原体感染的90%~92%。
3.研究表明,解脲脲原体(urealyticum spp.)可能与非淋球菌尿道炎、阴道炎、宫颈炎、 多种不良妊娠结局(流产、早产、绒毛膜羊膜炎、胎膜早破等)密切相关。但由于不同实验室 采用的检测方法不同,研究人群各异,目前,对于解脲脲原体的致病性业界仍然存在很大争 议,而且其致病性是否与不同生物型或细菌负荷相关也不明确。
4.目前,国内不同的实验室建立并公布了基于实时荧光定量pcr(qpcr)检测解脲脲原体 检测方法,如专利cn103045721a公布了解脲脲原体和微小脲原体qpcr检测方法,专利 cn201410113941.6公布解脲脲原体14种血清型qpcr检测方法。qpcr分为相对定量和绝对 定量。其中,绝对定量是将已知拷贝数的标准品梯度稀释至不同浓度作为模板进行实时pcr 反应。通过标准曲线来推算未知样品的拷贝数。但是,不同实验室间建立的标准曲线并不相 同,因此同一标本不同实验室qpcr法检测会推算出不同的拷贝数。
5.微滴式数字pcr(digital pcr),是在传统的pcr扩增前对样本进行微滴化处理,即 将含有核酸分子的反应体系分配到2万个微滴中,其中每个微滴中含有0个、1个或多个待 检核酸靶分子。扩增结束后,对每个微滴的荧光信号进行逐一分析,有荧光信号的微滴判读 为1,没有荧光信号的微滴判读为0,根据泊松分布原理及阳性微滴的个数与比例即可得到 靶分子的起始拷贝数或浓度。由于把样本稀释成多个微滴,实现了“单分子pcr扩增”。因此, 本发明具有特异性高、灵敏度高、无需标准曲线进行绝对定量的特点。
技术实现要素:
6.本发明的目的是克服实时荧光pcr法的定量不准的缺陷,提供一种解脲脲原体微滴式 数字pcr检测方法及其试剂盒。具体设计一种特异性的引物利用微滴数字pcr绝对定量检 测解脲脲原体的方法;本发明的另一目的在于提供一种用于上述方法的试剂盒。
7.本发明采用专门的dna提取试剂盒提取解脲脲原体的dna,在对解脲脲原体10个亚型 序列分析的基础上,设计通用引物能同时扩增解脲脲原体10个亚型而不扩增微小脲原体。此 外,与其他宫颈炎相关的病原微生物均无交叉扩增,因此具有良好的特异性。
8.更具体的,本发明的一种解脲脲原体的微滴数字pcr检测方法及其试剂盒包括:1.引物和探针的制备;
根据解脲脲原体parc序列,设计并合成如下序列的引物:uu-f:5’attatcaaaacgtgcaatga 3’(nt2187-nt2206);uu-r:5’accaactaaaaatgctgctaaa 3’(nt2250-nt2271);uu-p:5’accatcaccactttatt 3’(nt2208-nt2224)。2.微滴式数字pcr:微滴数字pcr反应包括制备体系、制备微滴、扩增循环和信号读取4个步骤。1)制备含核酸样品的ddpcr反应液;将bio-rad ddpcr预混液,解脲脲原体特异性引物、探针, 内参特异性引物、探针,核酸样品混合均匀。2)制备微滴:将dd pcr反应混合液转入dg8微滴发生卡相应的孔内。3)使用水解探针进行pcr扩增:将经过微滴化处理的样本转移到96孔pcr反应板中,并封膜。 运行pcr程序。4)读取并分析结果:pcr结束后,将pcr反应板置于qx200微滴分析仪内,对微滴荧光信号 逐个检测、分析,并使用quantasoft软件进行浓度计算。通过阳性微滴数来判断待测样品中是否含有解脲脲原体,并确定其相应含量。
附图说明
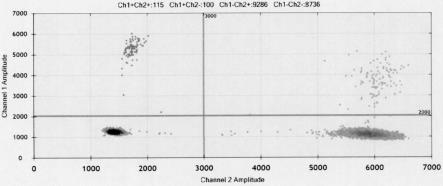
9.图1.双重微滴式数字pcr检测临床样本解脲脲原体阳性的2-d荧光强度图。(ddpcr 双重反应精确定量检测解脲脲原体(uu)和甘油醛-3-磷酸脱氢酶(gapdh)如图1所示,ch1为 fam荧光信号,ch2为vic荧光信号。黑色簇为阴性液滴,蓝色簇为uu阳性微滴,绿色簇 为gapdh阳性微滴,橙色簇为uu和gapdh均为阳性的微滴)。
10.图2.双重微滴式数字pcr检测临床样本解脲脲原体阴性的2-d荧光强度图。(ddpcr 双重反应精确定量检测解脲脲原体(uu)和甘油醛-3-磷酸脱氢酶(gapdh)如图2所示,ch1为 fam荧光信号,ch2为vic荧光信号。蓝色簇液滴为uu,液滴数为0,绿色簇为gapdh, 液滴数为17531)。
11.图3.双重微滴式数字pcr检测解脲脲原体特异性实验。(解脲脲原体特异性引物和探 针扩增的宫颈炎相关的病原微生物的2-d图,如图3所示,ch1为fam荧光信号,ch2为 vic荧光信号。从左至右,共7孔,分别是:a01为人型支原体,b01为生殖支原体,c01 为沙眼衣原体,d01为人乳头状瘤病毒,e01为单纯疱疹病毒,f01为淋病奈瑟菌,g01为 无乳链球菌)。
12.图4.特异性引物的融解曲线图。(解脲脲原体特异性引物融解曲线,如图4所示,解脲 脲原体特异性引物的融解温度为tm=76.8℃)。
13.图5.特异性引物和探针扩增国家参考品解脲脲原体10种血清型的实时荧光定量pcr 图。(解脲脲原体特异性引物和探针与国家参考品uu亚型实时荧光定量pcr扩增,如图5所 示,解脲脲原体特异性引物、探针与国家参考品解脲脲原体10个亚型(uu2,uu4-5,uu7-13) 在qpcr均能扩增出s形曲线)。
14.图6.双重微滴式数字pcr扩增解脲脲原体的可报告范围的2-d荧光强度图。(双重微 滴式数字pcr扩增解脲原体,如图6所示)。
具体实施方式
15.引物和探针的设计与合成
引物与探针用软件设计后合成,hplc级纯化。其中解脲脲原体探针的5
′
端标记报告基团 fam,3
′
端标记淬灭基团mgb;gapdh探针的5
′
端标记报告基团vic,3
′
端标记淬灭基团 mgb。
16.所涉及的引物探针如下:uu-f:5’attatcaaaacgtgcaatga 3’(nt2187-nt2206);uu-r:5’accaactaaaaatgctgctaaa 3’(nt2250-nt2271);uu-p:5’accatcaccactttatt 3’(nt2208-nt2224)。
17.融解曲线分析:配制20μl反应体系:sybr green mix 10μl,10μm引物uu-f 0.2μl,10 μm引物uu-r 0.2μl,模板2μl,rnase-free h2o 7.6μl,复孔2个。此外,不加模板作为阴性 对照。
18.实际检测样本的采集及脲原体dna基因组的提取将无菌拭子伸入女性宫颈口上1-2cm,旋转一周,停留约10秒后取出(应带有黏膜),并置于无 菌采样管,密闭送检。样本应立即进行处理检测,或保存于-20℃但不超过6个月。
19.检测样本包括但不限于女性的白带、宫颈拭子、尿液以及男性的尿液等。样本处理:标本管置于振荡器上振荡2-3分钟,自管壁挤干棉拭子,吸取全部液体转至1.5ml离心管中, 12000rpm/min离心10分钟,弃上清留沉淀。然后按照takara公司的试剂盒提取待测标本 的核酸(也可选用其他公司同类型的产品)。具体操作骤如下:
①
于沉淀中加入适量的buffer gl、proteinase k和的rnase a混匀,56℃ 水浴裂解10min。
②
加入200μl的buffer gb和200μl的无水乙醇,混匀后将溶液转移至spin column,12000rpm离心2分钟,弃滤液。
③
加入500μl的buffer wa,12000rpm离心1min。
ꢀ④
加入700μl的buffer wb,12000rpm离心3min。
⑤
最后加入40~200μl的elution buffer,12000 rpm离心2min将dna模板洗脱。阴性质控品:人上皮细胞标本,取100μl,与标本同样处理。阳性质控品:阳性质控品为解脲脲原体血清型8(atcc 27816),液体培养后灭菌分装,取 50μl与标本同样处理。
20.实施微滴数字pcr微滴数字pcr反应包括配制体系、生成微滴、扩增循环和信号读取4个步骤。采用ddpcrkit for probes试剂盒推荐的20μl体系,如表2所示。每次试验均需包括阴性对照、阳性对照。表2数字pcr扩增解脲脲原体反应体系 试剂名称加入体积终浓度2
×
pcr缓冲液10μl1
×
20
×
uu/gapdh引物/探针1μl900nm/250nmdna模板1~9μl-rnase-/dnase-free h2o可变-总体积20-将20μl反应体系加入dg8 cartridge中间一排8个孔,dg8 cartridge最底下一排
加入70μldroplet generation oil,盖上胶垫后放置微滴生成仪,生成微滴后转移至96孔板,并用预热 好的px1热封仪进行封膜。封膜后将微滴按照表3所示进行dpcr扩增。表3数字pcr扩增解脲脲原体反应程序pcr扩增结束后于qx200 droplet reader采集荧光信号并用quanta soft软件计算拷贝数。
21.方法学评价进行特异性、重复性、可报告范围、最低检测限试验等,以评价该方法的可靠性。
22.特异性:分别提取人型支原体(atcc 14027)、生殖支原体(atcc 33530)、沙眼衣原 体(atcc vr-880)、hpv52型(atcc vrmc-29)、hsvii型(atcc vr-540)、淋病奈瑟菌 (atcc 49226)、无乳链球菌(cmcc(b)32116的dna,数字pcr扩增后作特异性分析。 微滴数字pcr检测上述病原微生物的阳性微滴均为0,说明本发明微滴数字pcr检测解脲 脲原体与人型支原体、生殖支原体、沙眼衣原体、人乳头状瘤病毒(hpv)、人类疱疹病毒 (hsv)、淋病奈瑟菌、无乳链球菌均无非特异扩增,特异性为100%。
23.重复性:分别取高值国家参考品解脲脲原体血清型7(uu7)和低值解脲脲原体血清型13 (uu13),每日重复实验3次,连续重复5天,计算cv值。本发明微滴数字pcr检测解脲脲原体的uu7批内cv值为1.14%~4.83%,总cv值为0.98%; uu13批内cv值为0.39%~4.38%,总cv值为4.59%
24.将解脲脲原体血清型8(atcc27618)纯培养物提取的dna,原液,原液稀释2倍、10 倍、100倍、1000倍、10000倍、50000倍,数字pcr检测并重复实验3次。原液由于靶核酸拷贝数太多,2-d荧光强度图显示全部为阳性液滴,无阴性液滴;原液稀释 2倍、10倍、100倍、1000倍、10,000倍、50,000倍的拷贝数分别为7330、4670、135、 14.1、1.16、0.30copies/μl。[可报告范围]:本发明微滴式数字pcr检测解脲脲原体的可报告范围为0.30~7330 copies/μl。
[0025]
最低检测限:将国家家参考品解脲脲原体血清型8(uu8)倍比稀释,要求连续检测10 次均能检测其拷贝数,将平均值+2标准差定义为最低检测限。本发明微滴数字pcr检测解脲脲原体的最低检测限为1.31 copies/μl。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1