小鼠耳蜗螺旋器的分离和体外培养方法与流程
1.本发明涉及细胞培养领域,具体涉及一种小鼠耳蜗毛细胞分离和体外培养方法。
背景技术:
2.人类听力功能的基础是存在于颞骨耳蜗内的听觉感受器官,即螺旋器,又称柯蒂氏器、柯替氏器(organ of corti)。螺旋器内含有特殊的感觉上皮细胞,又称为毛细胞,可以将通过外耳和中耳传入内耳基底膜的声能转化为神经冲动传入大脑。
3.内耳深嵌在颞骨岩部坚硬的骨质中,不可以直接进行活体观察与照相,也不易将其完整取出而不受周围骨质的影响,这些都给内耳的研究带来许多困难。然而通过体外组织培养法建立起的体外培养内耳的模型系统,则可进行许多受体内条件限制或不能在体内进行的实验研究。此外,由于多数内耳损害(如耳毒性药物、声损伤等)发生于出生后,且内耳组织在胚胎期和出生后个体间有很大差异,故对于发育成熟的内耳器官进行培养并用于内耳疾病研究更具有实际意义。基于内耳自身的解剖特点,螺旋器组织的培养方法在内耳的研究中具有其独特的优越性,是一种理想的耳科实验造模方法。
4.在进行体外培养试验时,一般采用小鼠作为实验对象,为了获得稳定的实验材料,需要对小鼠包含耳蜗毛细胞的螺旋器进行体外培养,因此快速获得体外培养细胞,并且可以在体外条件下保证螺旋器的生物活性非常重要。但小鼠耳蜗较小,进行细胞分离及培养难度较大,因此提供一种分离简单,培养成功率高,细胞存活率高的方法非常必要。
5.耳蜗螺旋器附着在基底膜上,两者难以分离,体外组织培养也不将两者分离,耳蜗螺旋器的体外培养即为包含耳蜗螺旋器的基底膜的培养。现有的耳蜗螺旋器体外培养方法包含立体培养法,其相对贴壁培养法更接近体内环境。然而现有的立体培养法仍存在诸多不足之处,其培养获得的耳蜗螺旋器细胞存在形态不佳、活性较差、存活时间短等问题。传统的培养方法离体培养的耳蜗螺旋器,其内耳毛细胞形态维持时间仅为3
‑
5天,且随着培养时间的延长毛细胞数量逐渐降低、毛细胞纤毛束的形态逐渐消失。因此,本领域存在改进耳蜗螺旋器立体培养法的需求。
6.对现有技术检索发现,间隙连接蛋白30(cx30,又称间隙连接蛋白beta
‑
6,序列信息见uniprotkb
‑
095452)大量表达于耳蜗侧壁及螺旋器,人类螺旋神经节细胞(sg)同样表达cx30,cx30在人类螺旋器支持细胞中高表达(参见:张红蕾等,人类耳蜗连接蛋白的特定表达,公开日期20151231)。但现有技术仅公开了该基因的在螺旋器中的表达情况,并没有公开或暗示cx30基因表达的间隙连接蛋白30可用于螺旋器的体外培养。本发明通过实验发现,将间隙连接蛋白30作为培养基补料成分,在体外培养小鼠耳蜗螺旋器时使用,对细胞存活时间具有延长作用。
7.此外,现有技术表明(参见:王爱梅等,α
‑
硫辛酸对卡那霉素致离体小鼠耳蜗毛细胞损伤的防护作用,公开日期2013),抗氧化剂α
‑
硫辛酸对离体小鼠耳蜗毛细胞损伤具有防护作用。本发明进一步对其他功能类似的抗氧化剂进行筛选,发现抗氧化剂植酸(肌醇六磷酸)对小鼠耳蜗螺旋器的体外培养同样具有益处。将植酸与鼠尾胶进行组合使用,制备胶原
凝胶,将包含螺旋器的耳蜗基底膜固定在其中,进行体外培养,培养获得的细胞形态良好、活性佳、存活时间长。
技术实现要素:
8.针对如上所述现有技术中耳蜗螺旋器体外分离及培养方法的不足,本发明的目的是提供一种新生小鼠耳蜗螺旋器的分离和体外培养方法,可有效地分离得到完整的包含螺旋器的耳蜗基底膜,通过在培养过程中使用间隙连接蛋白30和植酸,培养获得的细胞形态良好、活性佳、存活时间长。
9.本发明的一方面提供一种小鼠耳蜗螺旋器的分离和体外培养方法,其特征在于,包含如下步骤:(1)将断头后的小鼠剪开头部皮肤,用手术刀片沿颅骨矢状线将头部切开,转移至装有无菌pbs的培养皿中,去除脑组织;(2)用精细镊剔除耳蜗与颞骨的链接,切断耳蜗与前庭组织的连接,将耳蜗取出,并转移至装有dmem/f12培养液的培养皿中;(3)从耳蜗底转向顶转剥离骨迷路,得到绕蜗轴的螺旋韧带和螺旋器,用精细镊夹住螺旋韧带和螺旋器的底部,将其从蜗轴上解旋下来,从底部将螺旋韧带和包含耳蜗螺旋器的基底膜分离,获得包含耳蜗螺旋器的基底膜; (4)耳蜗螺旋器的培养:取适量胶原凝胶滴到培养皿中央,将所述基底膜浸入胶原凝胶,将培养皿移入co2培养箱温育20
‑
30分钟后取出,见胶原凝胶凝固成胶块,基底膜被固定在其中,向培养皿中加入适量无血清培养液以淹没胶块为度,最后放回co2培养箱中培养,培养液隔日更换为补料培养基,培养7
‑
10天,其中所述胶原凝胶包含鼠尾胶和终浓度为50mm的植酸,所述补料培养基在所述无血清培养液的基础上添加终浓度为20mm的间隙连接蛋白30。
10.在一个优选实施方案中,其特征在于,所述胶原凝胶通过如下方法制备:鼠尾胶、10
×
bme以及2% na2co3比例为9:1:1,添加终浓度50mm的植酸,混合均匀,置于冰上,防止凝固。
11.在一个优选实施方案中,其特征在于,所述无血清培养液的各组分体积百分百为,1
×
dmem 96.4%,20%葡萄糖 2.4%,青霉素g 0.2%,谷氨酰胺 1%。
12.在一个优选实施方案中,其特征在于,所述小鼠是出生后3
‑
5天的小鼠。
13.在一个优选实施方案中,其特征在于,所述步骤(2)中dmem/f12培养液还进一步包含体积百分比为1%的n2补料,体积百分比为2%的b27补料,以及终浓度为50μg/ml的氨苄青霉素;步骤(3)在解剖显微镜下进行。
14.在一个优选实施方案中,其特征在于,所述步骤(4)耳蜗螺旋器的培养天数是10天。
15.在一个优选实施方案中,其特征在于,所述步骤(4)中co2培养箱的培养条件是37℃、5% co2。
16.在一个优选实施方案中,其特征在于,所述步骤(4)中所述温育时间是20分钟。
17.在一个优选实施方案中,其特征在于,所述方法在耳蜗螺旋器的培养阶段,采用免疫染色标记myo7a方法观察耳蜗基底膜螺旋器组织以及毛细胞活性。
18.在一个优选实施方案中,其特征在于,所述免疫染色标记myo7a方法包括:1)将培养的耳蜗螺旋器移除培养液,加入2ml 4% 的福尔马林固定液,室温放置15分钟后用pbs洗去;2)加入2ml 0.1%的pbs配制的triton x
‑
100溶液,室温放置15分钟后用pbs洗去;3)加入2ml 2.5%的pbs配制的bsa溶液,室温放置30分钟后用pbs洗去;4)一抗孵育,其为rabbit anti
‑
myo7a 1:200,2.5% bsa于pbs中,4
°
c过夜;5)用pbs洗去一抗,加入二抗,其为alexa fluor 546 goat
‑
anti rabbit igg 1:1000, 2.5% bsa于pbs中,室温放置2小时;6)用pbs洗去二抗,后用荧光显微镜进行观察、拍照。
19.本发明取得了如下的有益效果:(1)应用本发明的方法,分离小鼠耳蜗螺旋器简单易行,便于操作。
20.(2)本发明创新性地将间隙连接蛋白30、抗氧化剂植酸用于耳蜗螺旋器的体外培养。将植酸与鼠尾胶进行组合使用,制备固定基底膜的胶原凝胶,以及将间隙连接蛋白30作为培养基补料成分,在体外进行小鼠耳蜗螺旋器培养,培养获得的螺旋器毛细胞形态良好、活性佳、存活时间长。
21.(3)本发明小鼠耳蜗螺旋器的分离和体外培养方法,采用免疫染色标记myo7a方法,染色效果佳,可清晰观察毛细胞的生长状态。
附图说明
22.图1 小鼠耳蜗。
23.图2a 去除外周骨质耳蜗膜迷路。
24.图2b 带螺旋韧带的耳蜗螺旋器。
25.图3 实验1组培养24小时后形态学显微镜图。
26.图4 实验1组培养48小时后myo7a染色的耳蜗毛细胞显微镜图(scale bar: 20μm)。
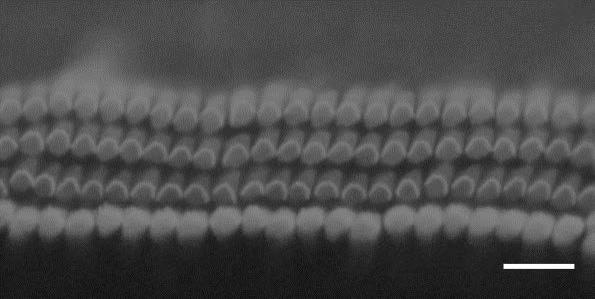
27.图5 实验4组培养第5天myo7a染色的显微镜图(scale bar: 20μm)。
28.图6 实验1组培养第5天myo7a染色的显微镜图(scale bar: 20μm)。
29.图7 实验1组培养第10天myo7a染色的显微镜图(scale bar: 20μm)。
具体实施方式
30.以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、
设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
31.实施例1 小鼠耳蜗螺旋器的分离选择出生后3
‑
5天的c57bl/6j小鼠作为实验材料。将新生小鼠冰浴麻醉,并用70%的酒精消毒。用解剖剪刀快速断头,剪开头部皮肤,用手术刀片沿颅骨矢状线将头部切开。转移至装有无菌pbs的培养皿中,去除脑组织。用精细镊剔除耳蜗与颞骨的链接,切断耳蜗与前庭组织的连接,将耳蜗取出,获得的耳蜗如图1所示。将分离出的耳蜗转移至装有培养液(所述的培养液为:dmem/f12 (gibco/invitrogen cat# 11320
‑
033); + 1%n2 supplement (gibco/invitrogen, cat # 17502
‑
048) + 2%b27 supplement (gibco/invitrogen, cat # 12587
‑
010) +50μg/ml ampicillin (sigma, cat # a5354
‑
10ml))的培养皿中。从耳蜗底转向顶转小心地剥离骨迷路,得到绕蜗轴的螺旋韧带和螺旋器,即得去除外周骨质耳蜗膜迷路,其如图2a所示。用精细镊夹住螺旋韧带和螺旋器的底部,将其从蜗轴上解旋下来,得到带螺旋韧带的耳蜗螺旋器,如图2b。从底部将螺旋韧带和包含耳蜗螺旋器的基底膜分离,获得包含耳蜗螺旋器的基底膜。
32.实施例2 小鼠耳蜗螺旋器的培养(1)试剂配制无血清培养液的配置:各组分体积百分百为,1
×
dmem 96.4%,20%葡萄糖 2.4%,青霉素g 0.2%,谷氨酰胺 1%。
33.补料培养基的配置:在上述无血清培养液的基础上添加间隙连接蛋白30,使得其终浓度为20mm。
34.补料对照培养基:即不添加间隙连接蛋白30的上述无血清培养液。
35.胶原凝胶的制备:鼠尾胶(购买于bd)、10
×
bme(购买于biowest,商品编号l0046
‑
500)以及2% na2co3比例为9:1:1,添加终浓度50mm的植酸,混合均匀,置于冰上,防止凝固。
36.胶原凝胶对照1的制备:除不添加植酸以外,其他均与上述胶原凝胶相同。
37.(2)培养实验1:取适量胶原凝胶滴到培养皿中央,将基底膜浸入胶原凝胶,将培养皿移入co2培养箱温育20分钟后取出,见胶原凝胶凝固成胶块,基底膜被固定在其中。向培养皿中加入适量无血清培养液以淹没胶块为度,最后放回37℃、5%co2培养箱中培养,培养液隔日更换为补料培养基,共培养10天。
38.实验2:培养过程与实验1一致,差别仅在于使用补料对照培养基替换补料培养基,即使用不添加间隙连接蛋白30的无血清培养液进行更换补料。
39.实验3:培养过程与实验1一致,差别仅在于使用胶原凝胶对照1替换胶原凝胶,即采用不包含植酸的胶原凝胶用于固定基底膜。
40.实验4:培养过程与实验1一致,差别在于使用补料对照培养基替换补料培养基、使用胶原凝胶对照1替换胶原凝胶,即使用不添加间隙连接蛋白30的无血清培养液进行更换补料,以及不包含植酸的胶原凝胶用于固定基底膜,实验4的培养过程即现有技术的常规立体培养方法。
41.实施例3螺旋器组织及毛细胞的形态学观察获取基底膜后,用上述实验1、实验2、实验3、实验4方法培养24 小时后于倒置显微镜下,观察各实验组下,轮廓形状,以及细胞生长状况。
42.结果表明:如图3所示,实验1效果最好,螺旋器基底膜组织轮廓形状清晰,高倍镜下可见耳蜗内、外毛细胞及支持细胞等结构耳蜗内、外毛细胞及支持细胞。
43.实施例4 螺旋器组织及毛细胞的活性鉴定采用免疫染色标记myo7a方法观察耳蜗基底膜螺旋器组织以及毛细胞活性。
44.免疫染色试剂如下:福尔马林固定液: sigma, #ht501128
‑
4l;pbs:corning, #21
‑
040
‑
cv;tritonx
‑
100:sigma, #x100
‑
100ml;edta:sigma, #e5134
‑
250g;bsa:sigma, #a1933
‑
25g;rabbit anti
‑
myo7a: proteus bioscience, #25
‑
6790;alexa fluor 546 goat anti
‑
rabbit igg: invitrogen, #a11035。
45.免疫染色步骤:1)耳蜗螺旋器培养48小时后,移除培养液,加入2ml 4% 的福尔马林固定液,室温放置15分钟后用pbs洗去;2)加入2ml 0.1%的triton x
‑
100( pbs配制)溶液,室温放置15分钟后用pbs洗去;3)加入2ml 2.5%的bsa(pbs配制)溶液,室温放置30分钟后用pbs洗去;4)一抗孵育(rabbit anti
‑
myo7a 1:200 2.5% bsa in pbs),4
°
c过夜;5)用pbs洗去一抗,加入二抗(alexa fluor 546 goat
‑
anti rabbit igg 1:1000, 2.5% bsa in pbs)室温放置2小时;6)用pbs洗去二抗,后用荧光显微镜进行观察、拍照。
46.结果:实验1组如图4所示,实验1的基底膜上外毛细胞、内毛细胞清晰可见,无缺损。
47.实施例5 螺旋器组织及毛细胞存活时间培养的过程中在倒置显微镜下进行镜检观察耳蜗螺旋器组织以及毛细胞的排列情况。按照实验1
‑
实验4的培养方法分别培养,在培养的3天、5天、8天以及10天记录螺旋器组织及毛细胞存活状态,结果如表1所示。
48.表1螺旋器组织及毛细胞存活状态(+++代表细胞存活且形态良好,+代表细胞存活但形态不佳,
‑
代表细胞死亡)培养天数实验1实验2实验3实验43天++++++++++++5天++++++8天+++
‑
10天+
‑‑‑
采用免疫染色标记myo7a方法染色以及显微镜观察,实验4的培养方法在培养第5天,图5显示毛细胞已经出现缺失,而图6显示同样培养5天的实验1组,毛细胞生长良好,无缺失。实验4组培养至第8天细胞均已死亡。采用本发明实验1的方法培养过程中,基底膜边缘上皮细胞生长抑制明显,可以维持内耳毛细胞较好形态至少一周,图7可见培养至10天仍然存活。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1