新型冠状病毒的人源单克隆抗体及其应用
1.本发明属于医药技术领域,具体涉及一种高中和活性的新型冠状病毒 (2019
‑
ncov,又称为sars
‑
cov
‑
2)的人源单克隆抗体及其应用。
背景技术:
2.对于新型冠状病毒2019
‑
ncov,目前还没有特效药物。
3.治疗性抗体药物不但在肿瘤和自身免疫疾病方面占有重要地位,在传染性疾病的治疗中也同样有效。目前已经上市的治疗和预防病毒感染的药物有预防小儿呼吸道合胞病毒(rsv)感染的帕利珠单抗(synagis),治疗 hiv感染的艾巴利珠单抗(trogarzo),以及用于狂犬病毒暴露后预防的 rabishield。同时还有针对众多病毒的单克隆抗体处于临床研究的不同阶段 (https://clinicaltrials.gov/)。
4.2019
‑
ncov属于冠状病毒。同属冠状病毒的重症急性呼吸综合征冠状病毒(sars
‑
cov)以及中东呼吸综合征冠状病毒(mers
‑
cov)也曾在分别在2002
‑
2003年和2012年引发疫情。据世界卫生组织(who)统计 sars
‑
cov共引发8000人感染,794人死亡(https://www.who.int/)。自 2012年至今,mers
‑
cov感染病毒病例在持续增加,截至2019年底,全球确诊2499例感染病例,861例死亡病例。2020年1月12日,世界卫生组织正式将该新型冠状病毒命名为“2019新型冠状病毒(2019
‑
ncov)”,其后在2020年2月11
‑
12日国际病毒分类委员会(international committeeon taxonomy of viruses,ictv)宣布,新型冠状病毒(2019
‑
ncov)的正式分类名为严重急性呼吸综合征冠状病毒2(severe acute respiratorysyndrome coronavirus 2,sars
‑
cov
‑
2),世界卫生组织(who)同日在日内瓦举办全球研究和创新论坛上宣布,由这一病毒导致的疾病的正式名称为“covid
‑
19”。
5.病毒要感染细胞,首先需要通过囊膜蛋白结合宿主的受体。抗体,尤其是中和活性抗体,通过结合到囊膜蛋白上,阻断病毒与细胞受体的结合,从而阻断病毒感染。同时,抗体结合到囊膜蛋白上,从而对游离的病毒或是被感染的细胞进行标记,通过抗体的fc区募集巨噬细胞或是补体等免疫细胞和免疫分子,从而清除游离的病毒以及被感染的细胞。因此,靶向受体结合区(receptor binding domain,rbd)的抗体,不但具有中和病毒感染的活性,还可以通过fc区发挥作用,促进病毒以及被感染细胞的清除。
6.基于对其它冠状病毒,尤其是sars
‑
cov和mers
‑
cov的研究,与受体结合的重要囊膜蛋白是刺突蛋白(s)。s可进一步分为s1和s2两部分。s2的作用是介导膜融合。s1的n端(ntd)和c端(ctd)都可能是rbd。通过对2019
‑
ncov的研究,团队发现ctd是此冠状病毒的rbd,结合受体ace2。因此靶向rbd的抗体,并且是阻断s与ace2结合的抗体,可能成为抑制病毒感染的中和抗体。本发明的目的是针对2019
‑
ncov,鉴定特异的具有保护效果的人源中和抗体。
技术实现要素:
7.为了获得具有保护效果的人源中和抗体,本发明首先以昆虫细胞表达的2019
‑
no:3所示的hcdr1、hcdr2和hcdr3;和轻链可变区,其包含氨基酸序列分别如seq id no:4、seq id no:5和seq id no:6 所示的lcdr1、lcdr2和lcdr3;或
26.(ⅱ)重链可变区,其具有氨基酸序列分别如seq id no:25、seq idno:26和seq id no:27所示的hcdr1、hcdr2和hcdr3;和轻链可变区,其包含氨基酸序列分别如seq id no:28、seq id no:29和seq idno:30所示的lcdr1、lcdr2和lcdr3。
27.在一些实施方式中,所述人源单克隆抗体或其抗原结合片段,其包含重链可变区和轻链可变区:
28.(ⅰ)所述重链可变区包含如seq id no:7所示的氨基酸序列,或与 seq id no:7所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如seq id no:8所示的氨基酸序列,或与seq id no:8所示的氨基酸序列具有至少95%,96%, 97%,98%或99%序列同一性的氨基酸序列;或
29.(ⅱ)所述重链可变区包含如seq id no:31所示的氨基酸序列,或与 seq id no:31所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如seq id no:32所示的氨基酸序列,或与seq id no:32所示的氨基酸序列具有至少95%,96%, 97%,98%或99%序列同一性的氨基酸序列。
30.在一些实施方式中,所述人源单克隆抗体或其抗原结合片段,其包含:
31.(ⅰ)氨基酸序列如seq id no:7所示的重链可变区和氨基酸序列如 seq id no:8所示的轻链可变区;
32.(ⅱ)氨基酸序列如seq id no:31所示的重链可变区和氨基酸序列如 seq id no:32所示的轻链可变区。
33.在一些实施方式中,所述人源单克隆抗体或其抗原结合片段,其中所述抗体包含重链和轻链:
34.(ⅰ)所述重链包含如seq id no:22所示的氨基酸序列,或与seq idno:22所示的氨基酸序列具有至少90%、92%、94%、95%、96%、97%、 98%或99%序列同一性的氨基酸序列;和所述轻链包含如seq id no:23 所示的氨基酸序列,或与seq id no:23所示的氨基酸序列具有至少90%、 92%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列;或 (ⅱ)所述重链包含如seq id no:33所示的氨基酸序列,或与seq idno:33所示的氨基酸序列具有至少90%、92%、94%、95%、96%、97%、 98%或99%序列同一性的氨基酸序列;和所述轻链包含如seq id no:34 所示的氨基酸序列,或与seq id no:34所示的氨基酸序列具有至少90%、 92%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列。
35.在一些实施方式中,所述人源单克隆抗体或其抗原结合片段,其中所述抗体包含:
36.(ⅰ)氨基酸序列如seq id no:22所示的重链,和氨基酸序列如seq id no:23所示的轻链;或
37.(ⅱ)氨基酸序列如seq id no:33所示的重链,和氨基酸序列如seqid no:34所示的轻链。
38.在一些实施方式中,所述人源单克隆抗体或其抗原结合片段,其中所述抗原结合片段选自fab、fab'、fab'
‑
sh、fv、scfv、f(ab')2、双抗体。
39.在一些实施方式中,本发明提供了多肽,其含有选自seq id no:7、 8、22或23所示的氨基酸序列。
40.在一些实施方式中,本发明提供了多肽,其含有选自seq id no:31、 32、33或34所示的氨基酸序列。
41.在一些实施方式中,本发明提供了多肽,其含有选自seq id no:31、 32、33或34所示的序列,其中所述多肽是特异性结合2019
‑
ncov rbd的人源单克隆抗体一部分,并且
42.当所述多肽含有seq id no:31时,所述人源单克隆抗体还包含seq id no:32所示的多肽;
43.当所述多肽含有seq id no:32时,所述人源单克隆抗体还包含seq id no:31所示的多肽;
44.当所述多肽含有seq id no:33时,所述人源单克隆抗体还包含seq id no:34所示的多肽;或
45.当所述多肽含有seq id no:34时,所述人源单克隆抗体还包含seqid no:33所示的多肽。
46.在又一个方面,本发明提供了多核苷酸,其编码权利要求本文所述的人源单克隆抗体或其抗原结合片段或本文所述的多肽。
47.在又一个方面,本发明提供了表达载体,其包含本文所述的多核苷酸,优选地,所述载体为真核表达载体。
48.在又一个方面,本发明提供了宿主细胞,其包含本文所述的多核苷酸或表达载体,优选地,所述宿主细胞是真核细胞,更优选哺乳动物细胞。
49.在又一个方面,本发明提供了一种制备本文所述的人源单克隆抗体或其抗原结合片段或所述多肽的方法,所述方法包括在适合于所述抗体或其抗原结合片段表达的条件下在本文所述的宿主细胞中表达所述抗体或其抗原结合片段或所述多肽,并从所述宿主细胞回收所表达的抗体或其抗原结合片段。
50.在又一个方面,本发明提供了药物组合物,其含有本文所述的人源单克隆抗体或其抗原结合片段、或所述的多肽、所述多核苷酸、所述表达载体和/或所述宿主细胞,以及药用载体。
51.在又一个方面,本发明提供了如本文所述的人源单克隆抗体或其抗原结合片段、所述多肽或所述药物组合物在制备治疗和/或预防2019
‑
ncov 感染的药物中的用途。
52.在又一个方面,本发明提供了一种治疗和/或预防2019
‑
ncov感染的方法,其包括向有需要的受试者施用本文所述的人源单克隆抗体或其抗原结合片段、所述多肽、所述多核苷酸、所述表达载体、所述宿主细胞和/ 或所述药物组合物。
53.在又一个方面,本发明提供了一种试剂盒,其包括本文所述的抗体或其抗原结合片段、所述多肽、所述多核苷酸、所述表达载体、所述宿主细胞和/或所述药物组合物。
54.在一些实施方式中,本发明提供了所述的试剂盒在制备诊断 2019
‑
ncov感染的药物中的用途。
55.在又一个方面,本发明提供了一种使用本文所述的抗体或其抗原结合片段或所述多肽检测2019
‑
ncov在样品中的存在的方法。
56.(ⅱ)
57.在一个方面,本发明提供人源单克隆抗体或其抗原结合片段,其特异性结合2019
‑
ncov rbd,
58.其vh链的互补决定区的cdr具有选自下组的氨基酸序列:
59.如seq id no:1所示的cdr1,
60.如seq id no:2所示的cdr2,和
61.如seq id no:3所示的cdr3;
62.其vl链的互补决定区的cdr具有选自下组的氨基酸序列:
63.如seq id no:4所示的cdr1,
64.如seq id no:5所示的cdr2,和
65.如seq id no:6所示的cdr3。
66.在一个方面,本发明提供人源单克隆抗体或其抗原结合片段,其特异性结合2019
‑
ncov rbd,
67.其vh链的互补决定区的cdr具有选自下组的氨基酸序列:
68.如seq id no:25所示的cdr1,
69.如seq id no:26所示的cdr2,和
70.如seq id no:27所示的cdr3;
71.其vl链的互补决定区的cdr具有选自下组的氨基酸序列:
72.如seq id no:28所示的cdr1,
73.如seq id no:29所示的cdr2,和
74.如seq id no:30所示的cdr3。
75.在一个实施方案中,所述人源单克隆抗体或其抗原结合片段含有:
76.如seq id no:7所示的重链可变区,和
77.如seq id no:8所示的轻链可变区。
78.在一个实施方案中,所述人源单克隆抗体或其抗原结合片段含有:
79.如seq id no:31所示的重链可变区,和
80.如seq id no:32所示的轻链可变区。
81.在一个实施方案中,人源单克隆抗体或其抗原结合片段含有:
82.如seq id no:22所示的重链,和
83.如seq id no:23所示的轻链。
84.在一个实施方案中,人源单克隆抗体或其抗原结合片段含有:
85.如seq id no:33所示的重链,和
86.如seq id no:34所示的轻链。
87.在一个实施方案中,其中所述抗原结合片段选自fab、fab'、fab'
‑
sh、 fv、scfv、f(ab')2、双抗体。
88.在另一个方面,本发明提供一种多肽,其含有选自seq id no:7、8、 22或23所示的序列。
89.在另一个方面,本发明提供一种多肽,其含有选自seq id no:31、 32、33或34所示的序列,其中所述多肽是特异性结合covid
‑
19rbd的人源单克隆抗体一部分,并且
90.当所述多肽含有seq id no:31时,所述人源单克隆抗体还包含seq id no:32所示的多肽;
91.当所述多肽含有seq id no:32时,所述人源单克隆抗体还包含seq id no:31所示
的多肽;
92.当所述多肽含有seq id no:33时,所述人源单克隆抗体还包含seq id no:34所示的多肽;或
93.当所述多肽含有seq id no:34时,所述人源单克隆抗体还包含seqid no:33所示的多肽。
94.在另一个方面,本发明提供一种多核苷酸,其编码前述任一项人源单克隆抗体或其抗原结合片段或前述任一项多肽。
95.在另一个方面,本发明提供一种表达载体,其包含上述多核苷酸。
96.在另一个方面,本发明提供一种宿主细胞,其包含上述表达载体。
97.在另一个方面,本发明提供一种药物组合物,其含有前述任一项人源单克隆抗体或其抗原结合片段和药用载体。
98.在另一个方面,本发明提供上述任一项人源单克隆抗体或其抗原结合片段在制备治疗2019
‑
ncov感染的药物中的用途。
99.本文公开的人源单克隆抗体或其抗原结合片段还特异性结合冠状病毒如sars
‑
cov rbd或mers
‑
cov rbd。
100.本说明书中提及的所有文献均通过引用以其整体并入本文。
101.定义
102.除非另有说明,本发明的实施将采用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术,这些都在本领域的技术范围内。
103.为了可以更容易地理解本发明,某些科技术语具体定义如下。除非本文其它部分另有明确定义,否则本文所用的科技术语都具有本发明所属领域普通技术人员通常理解的含义。关于本领域的定义及术语,专业人员具体可参考current protocols in molecular biology(ausubel)。氨基酸残基的缩写是本领域中所用的指代20个常用l
‑
氨基酸之一的标准3字母和/或1 字母代码。本文(包括权利要求书)所用单数形式包括其相应的复数形式,除非文中另有明确规定。
104.术语“约”在与数字数值联合使用时意为涵盖具有比指定数字数值小 5%的下限和比指定数字数值大5%的上限的范围内的数字数值,包括但不限于
±
5%、
±
2%、
±
1%和
±
0.1%,因为这些变化适于进行所公开的方法。
105.术语“和/或”应理解为意指可选项中的任一项或可选项中的任意两项或更多项的组合。
106.如本文所用,术语“或”应被理解为与如上定义的“和/或”具有相同的含义。例如,当分离列表中的项目时,“或”或“和/或”应被解释为包容性的,即,包括数量或元素列表中的至少一个,但也包括多于一个,以及任选地,额外的未列出的项目。只有明确指出相反的术语下,例如“只有一个”或“的确一个”或者在权利要求中使用“由...组成”时,将指的是仅列出的一个数字或列表的一个元素。
107.术语“百分比(%)氨基酸序列同一性”或简称“同一性”定义为在将氨基酸序列进行比对(并在必要时导入空位)以获取最大百分比序列同一性,且不将任何保守取代视为序列同一性的部分之后,候选氨基酸序列中的氨基酸残基与参比氨基酸序列中的相同氨基酸残基的百分比。可使用本领域各种方法进行序列比对以便测定百分比氨基酸序列同一性,
例如,使用公众可得到的计算机软件如blast、blast
‑
2、align或 megalign(dnastar)软件。本领域技术人员可以决定测量比对的适宜参数,包括对所比较的序列全长获得最大比对所需的任何算法。
108.术语“抗体”是指具有所需生物活性的任何形式的抗体。因此,其以最广义使用,具体包括但不限于单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如双特异性抗体)、人源化抗体、全人抗体、嵌合抗体和骆驼源化单结构域抗体。
109.术语“单克隆抗体”是指获自基本均质抗体群的抗体,即组成该群的各个抗体除可少量存在的可能天然存在的突变之外是相同的。单克隆抗体是高度特异性的,针对单一抗原表位。相比之下,常规(多克隆)抗体制备物通常包括大量针对不同表位(或对不同表位有特异性)的抗体。修饰语“单克隆”表明获自基本均质抗体群的抗体的特征,且不得解释为需要通过任何特定方法产生抗体。
[0110]“抗原结合片段”是指抗体的抗原结合片段及抗体类似物,其通常包括至少部分母体抗体的抗原结合区或可变区,例如一个或多个cdr。抗体的片段保留母体抗体的至少某些结合特异性。抗原结合片段包括选自fab、 fab
′
、fab
′‑
sh、fv、scfv、f(ab
′
)2、双抗体、包含cdr的肽等。
[0111]“fab片段”由一条轻链和一条重链的ch1及可变区组成。
[0112]“fc”区含有包含抗体的ch2和ch3结构域的两个重链片段。两个重链片段由两个或多个二硫键并通过ch3结构域的疏水作用保持在一起。
[0113]“fab
′
片段”含有一条轻链和一条包含vh结构域、ch1结构域以及ch1和ch2结构域之间的恒定区的部分的重链的部分,两个fab
′
片段的两条重链之间形成链间二硫键以形成f(ab
′
)2分子。
[0114]“f(ab
′
)2片段”含有两条轻链和两条包含vh结构域、ch1结构域以及ch1和ch2结构域之间的恒定区的部分的重链的部分,由此在两条重链间形成链间二硫键。因此,f(ab
′
)2片段由通过两条重链间的二硫键保持在一起的两个fab
′
片段组成。
[0115]“fv区”包含来自重链和轻链二者的可变区,但缺少恒定区。
[0116]“单链fv抗体(scfv抗体)”是指包含抗体的vh和vl结构域的抗原结合片段,这些结构域包含于单个多肽链中。一般而言,scfv多肽在vh 和vl结构域之间包含多肽接头,该接头使得scfv能形成用于抗原结合的所需结构。
[0117]“双抗体”为具有两个抗原结合位点的小抗原结合片段。所述片段包含在相同的多肽链中与轻链可变结构域(vl)连接的重链可变结构域 (vh)(vh
‑
vl或vl
‑
vh)。通过使用短至不能在同一链的两个结构域之间配对的接头,使得所述结构域和另一条链的互补结构域配对并形成两个抗原结合位点。
[0118]
当提及配体/受体、抗体/抗原或其它结合对时,“特异性”结合是指在蛋白和/或其它生物试剂的异质群体中确定是否存在所述蛋白例如本发明的单克隆抗体与2019
‑
ncov rbd蛋白的结合反应。因此,在所指定的条件下,特定的配体/抗原与特定的受体/抗体结合,并且并不以显著量与样品中存在的其它蛋白结合。
[0119]“亲和力”或“结合亲和力”指反映结合对子的成员之间相互作用的固有结合亲和力。分子x对其配偶物y的亲和力可以通常由平衡解离常数(kd)代表,平衡解离常数是解离速率常数和结合速率常数(分别是kdis 和kon)的比值。亲和力可以由本领域已知的常见方
法测量。用于测量亲和力的一个具体方法是本文中的fortebio动力学结合测定法。术语“不结合”蛋白或细胞是指,不与蛋白或细胞结合,或者不以高亲和力与其结合,即结合蛋白或细胞的k
d
为1.0
×
10
‑6m或更高,更优选1.0
×
10
‑5m或更高,更优选1.0
×
10
‑4m或更高、1.0
×
10
‑3m或更高,更优选1.0
×
10
‑2m 或更高。
[0120]
术语“高亲和性”对于igg抗体而言,是指对于抗原的k
d
为1.0
×
10
‑
6 m或更低,优选5.0
×
10
‑8m或更低,更优选1.0
×
10
‑8m或更低、5.0
×
10
‑
9 m或更低,更优选1.0
×
10
‑9m或更低。对于其他抗体亚型,“高亲和性”结合可能会变化。例如,igm亚型的“高亲和性”结合是指k
d
为10
‑6m 或更低,优选10
‑7m或更低,更优选10
‑8m或更低。
[0121]
术语“核酸”或“多核苷酸”是指脱氧核糖核酸(dna)或核糖核酸 (rna)及其呈单链或双链形式的聚合物。除非明确地限制,否则术语包括具有与参照核酸相似的结合性质并且以与天然存在的核苷酸相似的方式被代谢的含有已知的天然核苷酸的类似物的核酸(参见,属于kariko等人的美国专利no.8,278,036,其公开了尿苷被假尿苷替代的mrna分子,合成所述mrna分子的方法以及用于在体内递送治疗性蛋白的方法)。除非另有所指,否则特定核酸序列还隐含地包括其保守修饰的变体(例如,简并密码子取代)、等位基因、直系同源物、snp和互补序列以及明确指出的序列。具体地,简并密码子取代可通过生成其中一个或多个选择的(或全部)密码子的第三位被混合碱基和/或脱氧肌苷残基取代的序列来实现 (batzer等人,nucleic acid res.19:5081(1991);ohtsuka等人,j.biol. chem.260:2605
‑
2608(1985);和rossolini等人,mol.cell.probes8:91
‑
98(1994))。
[0122]“构建体”是指任何重组多核苷酸分子(诸如质粒、粘粒、病毒、自主复制多核苷酸分子、噬菌体或线性或环状单链或双链dna或rna多核苷酸分子),衍生自任何来源,能够与基因组整合或自主复制,构成如下多核苷酸分子,其中已经以功能操作的方式连接(即,可操作地连接)一或多个多核苷酸分子。重组构建体通常会包含可操作地连接至转录起始调节序列的本发明的多核苷酸,这些序列会导引多核苷酸在宿主细胞中的转录。可使用异源及非异源(即,内源)启动子两者导引本发明的核酸的表达。
[0123]“载体”是指任何重组多核苷酸构建体,该构建体可用于转化的目的 (即将异源dna引入到宿主细胞中)。一种类型的载体为“质粒”,是指环状双链dna环,可将额外dna区段连接至该环中。另一类型的载体为病毒载体,其中可将额外dna区段连接至病毒基因组中。某些载体能够在被引入到的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体及游离型哺乳动物载体)。在引入到宿主细胞中后,其他载体(例如,非游离型哺乳动物载体)整合至宿主细胞的基因组中,且因此与宿主基因组一起复制。此外,某些载体能够导引被操作性连接的基因的表达。本文将此类载体称为“表达载体”。
[0124]
本文所用术语“表达载体”是指能够在转化、转染或转导至宿主细胞中时复制及表达目的基因的核酸分子。表达载体包含一或多个表型选择标记及复制起点,以确保维护载体及以在需要的情况下于宿主内提供扩增。
[0125]
本发明还提供含有本发明特异性结合2019
‑
ncov rbd的人源高中和活性的单克隆抗体或其抗原结合片段的药物组合物。为了制备药物组合物,可以通过使抗体或其抗原结合片段与药用载体或赋形剂混合,制备成各种所需的剂型。作为本发明的医药组合物的剂型的种类,例如可以列举作为口服剂的片剂、粉末剂、丸剂、散剂、颗粒剂、细粒剂、软/硬胶囊剂、薄膜包衣剂、小丸剂、舌下片、膏剂等,作为非口服剂,可以列举注射剂、栓剂、经皮剂、
软膏剂、硬膏剂、外用液剂等,本领域的技术人员能够根据给药途径和给药对象等选择适当的剂型。
[0126]
本发明的药物组合物的有效成分的给药量,根据给药对象、对象脏器、症状、给药方法等不同而存在差异,可以考虑剂型的种类、给药方法、患者的年龄和体重、患者的症状等,根据医生的判断来确定。
[0127]
本发明的有益效果:
[0128]
本发明获得了人源高中和活性的抗体:cb6和gh12。上述抗体是具有中和2019
‑
ncov感染的人源抗体。cb6抗体与2019
‑
ncov的结合常数为8.15e
‑
10m,gh12抗体与2019
‑
ncov rbd的亲和力为5.87e
‑
09m。人源高中和活性的抗体cb6和gh12均能有效阻断2019
‑
ncov rbd与hace2结合,抑制2019
‑
ncov假病毒感染的中和活性好。本发明的cb6 和gh12有着临床治疗和预防2019
‑
ncov感染的应用价值。
附图说明
[0129]
图1:2019
‑
ncov rbd凝胶过滤层析和sds
‑
page鉴定。
[0130]
图2:2a:cb6抗体的分子筛层析和sds
‑
page鉴定;2b gh12抗体的分子筛层析和sds
‑
page鉴定。
[0131]
图3:3a:cb6抗体结合2019
‑
ncov rbd的动力学曲线;3b:gh12 抗体结合2019
‑
ncov rbd的动力学曲线。
[0132]
图4:4a:cb6抗体阻断2019
‑
ncov rbd与hek293t
‑
hace2结合; 4b:gh12抗体阻断2019
‑
ncov rbd与hek293t
‑
hace2结合。
[0133]
图5:5a:cb6抗体中和vsv
‑
2019
‑
ncov感染的效果;5b:gh12抗体中和vsv
‑
2019
‑
ncov感染的效果。
[0134]
图6:cb6抗体对sars
‑
cov
‑
2活病毒的中和作用。
[0135]
图7:实验动物的体温体重变化:7a:实验动物的温度变化;7b:实验动物的体重变化。
[0136]
图8:实验动物的咽拭子、鼻拭子和肛拭子病毒载量变化:8a:咽拭子病毒载量:咽拭子病毒载量反应了病毒可以在动物体内有效扩增,但是给与抗体处理以后,病毒载量大幅下降或者基本检不出;8b:鼻拭子病毒载量:鼻拭子中的病毒载量较低,均在检测限附近或之下;8c:肛拭子病毒载量:病毒载量较低,均在检测限附近或之下。
[0137]
l.o.d(检测限):200拷贝/ml。
[0138]
图9:实验动物的影像学分析:9a:对照组动物影像学观察,(上): c1,(中):c2,(下):c3;9b:预防组动物的影像学观察(上):pa1, (中):pa2,(下):pa3;9c:治疗组动物的影像学观察(上):ac1,(中): ac2,(下)ac3。
[0139]
图10:实验动物气管、支气管和肺部病毒载量分析:10a:攻毒后第5 天;10b:攻毒后第6天;10c:攻毒后第7天。
[0140]
l.o.d(limit of detection):检测限,1000拷贝/g。
具体实施方式
[0141]
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照
附图,对本发明作进一步的详细说明。
[0142]
实施例1:2019
‑
ncov rbd的表达与纯化
[0143]
在2019
‑
ncov rbd蛋白(氨基酸序列如seq id no:9所示)编码区的3’端连上6个组氨酸标签(hexa
‑
his
‑
tag)的编码序列及翻译终止密码子,通过连接ecori和xhoi构建入pfastbac1载体(购自invitrogen)中。再将连接产物转化到dh10bac感受态细胞(购自tiangen)中,进行杆状病毒重组。提取重组的杆状病毒,转染至sf9细胞(购自invitrogen)中进行杆状病毒的包装,再经过病毒的扩增,加入到hi5细胞(购自invitrogen)中,进行 2019
‑
ncov rbd蛋白的表达。
[0144]
含有目的蛋白的细胞培养液经镍离子亲和层析(histrap tmhp(ge)) 和凝胶过滤层析(superosetm 6increase 10/300gl(ge))纯化后,可以获得较纯的目的蛋白。sds
‑
page鉴定大小为30kd,结果如图1。
[0145]
实施例2:2019
‑
ncov rbd蛋白特异性记忆b细胞的分离
[0146]
在2019
‑
ncov感染后痊愈出院人员的知情同意下,采集15ml的血液,分离pbmcs。将分离的pbmcs以107/ml的密度与终浓度是400nm的 2019
‑
ncov rbd蛋白冰上孵育结合半小时,然后用pbs洗2次,再与下列抗体(均购自bd)孵育:抗人cd3/pe
‑
cy5(anti
‑
human cd3/pe
‑
cy5),抗人cd16/pe
‑
cy5(anti
‑
human cd16/pe
‑
cy5),抗人cd235a/pe
‑
cy5 (anti
‑
human cd235a/pe
‑
cy5),抗人cd19/apc
‑
cy7(anti
‑
humancd19/apc
‑
cy7),抗人cd27/太平洋蓝(anti
‑
human cd27/pacific blue),抗人cd38/apc(anti
‑
human cd38/apc),抗人igg/fitc(anti
‑
humanigg/fitc),以及抗his/pe(anti
‑
his/pe)。抗体冰上孵育半小时后,用pbs 洗pbmcs 2次。
[0147]
pbs洗后的pbmcs经facsaria iii分选,收集 pe
‑
cy5
‑
apc
‑
apc
‑
cy7+pacific blue+fitc+pe+的细胞(即b细胞),直接将其收集到96孔板内,1细胞/孔。
[0148]
实施例3:单一b细胞pcr、序列分析及人源抗体设计
[0149]
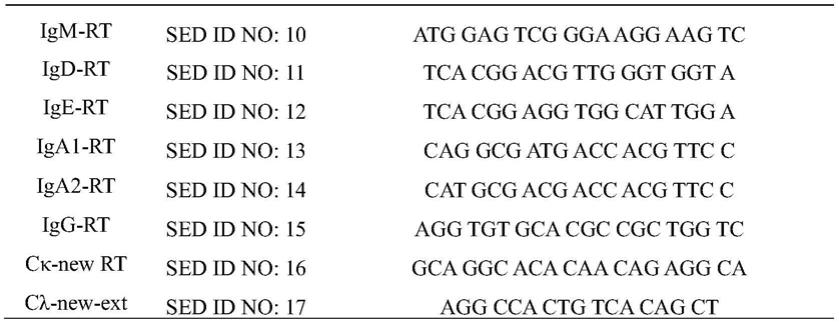
按照qihui wang等人于2016年12月在science translational medicine,第8卷,第369期发表的molecular determinants of human neutralizingantibodies isolated from a patient infected with zika virus中描述的方法,将实施例2获得的b细胞通过superscript iii reverse transcriptase(invitrogen) 逆转录,逆转录引物如表1,55℃反应60min。
[0150]
表1.逆转录反应引物
[0151]
[0152][0153]
3.1人源抗体cb6
[0154]
将上述逆转录产物作为模板,用hotstar tap plus酶(qiagen)进行 pcr(pcra),扩增抗体可变区序列。设计相应的引物,反应条件如下: 95℃,5min;95℃30s,55℃(重链/κ链)30s,72℃90s,35个循环; 72℃,7min。将此产物作为模板再进行1轮pcr(pcrb),条件如下:95℃, 5min;95℃30s,58℃(重链)/60℃(κ链)30s,72℃90s,35个循环; 72℃,7min,得到pcr产物。
[0155]
用1.2%的琼脂糖凝胶电泳分离pcr产物。条带大小在400
‑
500bp的切胶回收后送测序公司测序。测序结果用imgt在线软件进行分析。
[0156]
将分析得到的正确的可变区序列与相应的重链/κ链的恒定区通过搭桥pcr连接,克隆至表达载体pcaggs(购自addgene)中。其中重链以 ecori和xhoi连接,κ链以saci与xhoi连接。b细胞测序及表达质粒构建如下:
[0157]
人源抗体设计策略如下:
[0158]
重链:cmv启动子
‑
ecor i
‑
前导序列
‑
重链可变区
‑
ch
‑
xho i;
[0159]
轻链(κ):cmv启动子
‑
sac i
‑
前导序列
‑
轻链可变区
‑
cl
(κ)
‑
xho i;
[0160]
其中,前导序列(leader sequence)的氨基酸序列如sed id no:18 所示,ch的氨基酸序列如sed id no:19所示,cl的氨基酸序列如sedid no:20所示,通过序列测定,获得一株抗体的序列,这株抗体命名为 cb6。
[0161]
其中cb6的重链可变区序列如seq id no:7所示,轻链可变区序列如seq id no:8所示,重链序列如seq id no:22所示,轻链序列如seqid no:23所示。
[0162]
cb6的重链可变区具有分别如seq id no:1、seq id no:2和seq id no:3所示的hcdr1、hcdr2和hcdr3,和轻链可变区具有氨基酸序列分别如seq id no:4、seq id no:5和seq id no:6所示的lcdr1、 lcdr2和lcdr3。其中cb6抗体与胚系基因的序列一致性比较如下:
[0163]
表2.cb6抗体重链与胚系基因比较
[0164] v
‑
h等位基因d
‑
h等位基因j
‑
h等位基因一致性(v
‑
h)cb6ighv3
‑
66*01ighd3
‑
10*02ighj4*0299.00%
[0165]
表3.cb6抗体轻链与胚系基因比较
[0166] v
‑
l等位基因j
‑
l等位基因一致性(v
‑
l)cb6igkv1
‑
39*01igkj2*0199.60%
[0167]
3.2人源抗体gh12
[0168]
将上述逆转录产物作为模板,用hotstar tap plus酶(qiagen)进行 pcr(pcra),扩增抗体可变区序列。设计相应的引物,反应条件如下: 95℃,5min;95℃30s,55℃(重链)/50℃(λ链)30s,72℃90s,35 个循环;72℃,7min。将此产物作为模板再进行1轮pcr(pcrb),条件如下:95℃,5min;95℃30s,58℃(重链)/64℃(λ链)30s,72℃90s, 35个循环;72℃,7min,得到pcr产物。
[0169]
用1.2%的琼脂糖凝胶电泳分离pcr产物。条带大小在400
‑
500bp的切胶回收后送测序公司测序。测序结果用imgt在线软件进行分析。
[0170]
将分析得到的正确的可变区序列与相应的重链/λ链的恒定区通过搭桥pcr连接,克隆至表达载体pcaggs(购自addgene)中。其中重链与λ链以ecori和xhoi连接。b细胞测序及表达质粒构建如下:
[0171]
人源抗体设计策略如下:
[0172]
重链:cmv启动子
‑
ecor i
‑
前导序列
‑
重链可变区
‑
ch
‑
xho i;
[0173]
轻链(λ):cmv启动子
‑
ecor i
‑
前导序列
‑
轻链可变区
‑
cl
(λ)
‑
xho i;
[0174]
其中,前导序列的氨基酸序列如sed id no:18所示,ch的氨基酸序列如sed id no:19所示,cl的氨基酸序列如sed id no:24所示,通过序列测定,获得一株抗体的序列,将这株抗体命名为gh12。
[0175]
其中gh12的重链可变区序列如seq id no:31所示,轻链可变区序列如seq id no:32所示,重链序列如seq id no:33所示,轻链序列如 seq id no:34所示。
[0176]
gh12的重链可变区具有分别如seq id no:25、seq id no:26和 seq id no:27所示的hcdr1、hcdr2和hcdr3,和轻链可变区具有氨基酸序列分别如seq id no:28、seq id no:29和seq id no:30所示的 lcdr1、lcdr2和lcdr3。
[0177]
其中gh12抗体与胚系基因的序列一致性比较如下:
[0178]
表4.gh12抗体重链与胚系基因比较
[0179] v
‑
h等位基因d
‑
h等位基因j
‑
h等位基因一致性(v
‑
h)gh12ighv3
‑
7*01ighd3
‑
10*01ighj3*0299.70%
[0180]
表5.gh12抗体轻链与胚系基因比较
[0181] v
‑
l等位基因j
‑
l等位基因一致性(v
‑
l)gh12iglv6
‑
57*02iglj3*02100.00%
[0182]
实施例4:抗体的表达
[0183]
以含10%fbs的dmem培养293t细胞。用含有实施例3得到的特定抗体轻、重链编码基因的质粒共转染293t。转染4
‑
6小时后将细胞培养液更换成无血清的dmem,并且继续培养3天,收集上清后,再补加dmem,继续培养4天,收集上清。
[0184]
收集的上清经过5000rpm离心30min后,与含有20mm磷酸钠(ph 8.0) 的缓冲液等体积混合,经过0.22μm滤膜过滤后,与protein a预装柱结合 (5ml,ge healthcare)。以10mm甘氨酸(ph 3.0)洗脱结合的蛋白。收集此蛋白浓缩后进行分子筛层析。目的峰通过sds
‑
page(还原性和非还原性) 确定,结果如图2a(cb6抗体)和2b(gh12抗体)。得到纯化的cb6和 gh12抗体。
[0185]
实施例5:表面等离子共振技术检测抗体与2019
‑
ncov rbd的结合能力
[0186]
表面等离子共振分析利用biacore 8k(biacore inc.)进行。具体步骤如下:
[0187]
选用protein a芯片(购自ge healthcare),通过protein a与抗体fc 的亲和力将实施例4得到的纯化的抗体固定在芯片上,抗体固定量约为 5000ru,用10mm hepes,150mmnacl,ph 7.4溶液倍比稀释2019
‑
ncovrbd蛋白,从低浓度到高浓度逐一上样。抗体结合2019
‑
ncov rbd的动力学曲线如图3a(cb6抗体)和3b(gh12抗体)所示。抗体结合2019
‑
ncovrbd的动力学常数如表6所示。结合动力学常数的计算是利用 biaevaluation software 8k(biacore,inc.)软件进行。可见cb6和gh12抗体能够和2019
‑
ncov rbd以较高的亲和力结合。
[0188]
表6.抗体与2019
‑
ncov rbd蛋白结合的动力学常数
[0189] ka(1/ms)kd(1/s)kd(m)cb68.95e+057.29e
‑
048.15e
‑
10gh122.95e+061.73e
‑
025.87e
‑
09
[0190]
实施例6:本发明抗体阻断2019
‑
ncov rbd与ace2结合的检测
[0191]
将hace2(氨基酸序列如seq id no:21所示)的编码基因通过xhoi 和bamhi构建入pegfp
‑
n1载体(购自addgene)中,并且与gfp融合表达,形成pegfp
‑
hace2质粒。将质粒pegfp
‑
hace2转染hek293t细胞,24h 可在荧光显微镜下观察到gfp表达。收集hek293t
‑
hace2细胞,2
×
105为一个反应,与2019
‑
ncov rbd(200ng/ml)在室温条件下孵育30min。 500
×
g离心5min后,去掉上清,加入pbs洗2次。与抗his/apc (anti
‑
his/apc)在室温下孵育30min,再经过pbs洗2次后,用bdfacscanto检测细胞表面的荧光情况。
[0192]
为了检测cb6和gh12的阻断效果,将实施例4得到的纯化的抗体 (cb6和gh12)分别与200ng/ml的2019
‑
ncov rbd按摩尔比10:1的条件下在室温下孵育1h,再与hek293t
‑
hace2细胞孵育。其余步骤与上面相同,用抗his/apc(anti
‑
his/apc)检测蛋白与细胞的结合情况。抗体阻断2019
‑
ncov rbd与hek293t
‑
hace2细胞的结合情况如图4a(cb6 抗体)和4b(gh12抗体)所示。可见,cb6和gh12抗体均能阻断2019
‑
ncovrbd与hek293t
‑
hace2细胞的结合。
[0193]
实施例7:本发明抗体中和2019
‑
ncov假病毒感染的检测
[0194]
将实施例4得到的纯化的抗体(cb6和gh12)分别从50μg/ml开始 3倍倍比稀释至第10个梯度(2.5ng/ml)与1.6
×
104tcid
50 vsv
‑
2019
‑
ncov 假病毒混合在37℃混合孵育1h,然后加入到预先接种huh7细胞(购自协和医科大学基础医学细胞中心)的96孔板中。孵育4小时后,弃掉培养液与病毒液,加入含有10%fbs的dmem培养液中,继续培养48小时。弃掉培养液,pbs洗一次后,加入1
×
裂解液(promega,luciferase assaysystem)裂解细胞后,取10μl裂解液加入50μl反应底物,通过 promegaluminometers检测。根据不同浓度下荧光素酶的活性,计算抗体对vsv
‑
2019
‑
ncov假病毒的中和能力,结果如图5a(cb6抗体)和5b(gh12 抗体)所示,结果统计如表7。
[0195]
表7抗体对不同来源病毒中和效果
[0196]
mabsnd
50
(μg/ml)
a
cb60.00027gh123.27
[0197] a
半抑制浓度
[0198]
可见cb6和gh12抗体能以高中和活性中和2019
‑
ncov假病毒。
[0199]
综上,cb6和gh12抗体能够作为高中和活性的新型冠状病毒 (2019
‑
ncov)人源单克隆抗体。
[0200]
实施例8:本发明抗体中和2019
‑
ncov活病毒的检测
[0201]
本研究通过体外中和实验评估cb6抗体对2019
‑
ncov(sars
‑
cov
‑
2) 活病毒的中和作用。
[0202]
8.1试剂
[0203][0204]
8.2实验方法
[0205]
将vero e6细胞以每孔1
×
105的密度接种于96孔培养板,37℃培养24 小时后使用。在dmem培养基的96孔组织培养板中,加入连续2倍稀释的50μl cb6抗体(从48.8ng/ml到100μg/ml)。然后加入等体积的包含200 tcid
50 sars
‑
cov
‑
2的sars
‑
cov
‑
2工作储备液,最终病毒载量为100 tcid50。将抗体
‑
病毒混合物在37℃孵育1h,然后转移到包含八联体融合vero e6细胞的96孔微量滴定板中,37℃下于co2培养箱中培养3天。将100tcid50的sars
‑
cov
‑
2感染的细胞或对照培养基(dmem+10%fbs) 培养的细胞分别用作阳性对照或阴性未感染对照。在感染之前和之后观察并记录每个孔中的细胞病变效应(cpe)。进行病毒反滴定以评估实验中使用的正确病毒滴定。使用prism软件计算50%中和剂量(nd
50
)。所有实验均按照标准操作程序在批准的生物安全3级设施中进行。
[0206]
8.3结果和结论
[0207]
通过在不同浓度的cb6存在下,将细胞与sars
‑
cov
‑
2活病毒共培养来评估cb6的中和功能。如图6所示,cb6以剂量依赖的方式降低了sars
‑
cov
‑
2病毒对vero e6细胞的细胞病变效应。半数中和剂量(nd
50
) 为5.56nm。
[0208]
cb6能中和sars
‑
cov
‑
2活病毒并减轻病毒对细胞的病理损害。
[0209]
实施例9:本发明抗体对动物保护性效果评价
[0210]
9.1实验设计
[0211]
1)非人灵长类实验动物约为7岁的恒河猴(湖北天勤生物技术公司),雌性3只,雄性6只,体重为5.7
‑
10.9公斤,日龄为2512
‑
2545天,按实验动物质量管理要求完成动物常规病原体检测和冠状病毒类病毒的检测;符合要求的实验动物在实验室进行3天适应性饲养;
[0212]
2)设置对照组和新冠抗体治疗组、预防组,对照组恒河猴3只(c1、 c2和c3),预防组恒河猴为3只(pa1、pa2和pa3),治疗组恒河猴3 只(ac1、ac2和ac3)。其中,对照组攻毒前24小时单次注射pbs,预防组在攻毒前24小时注射cb6,给药剂量为50mg/kg;治疗组在攻毒后 24小时和72小时注射cb6,给药剂量为50mg/kg。
[0213]
3)采用气管插管接种方式进行动物感染,接种1ml的病毒液,病毒接种量为1
×
105tcid
50
;
[0214]
4)参数收集:
[0215]
a.每天观察记录实验动物每天的病程变化,健康打分;
[0216]
b.不同时间麻醉动物后,测定体重、体温,收集肛拭子、咽拭子、肺泡灌洗液、血液样品等;
[0217]
c.感染后第3和6天,采集实验动物胸部x
‑
射线影像,时间与观测采样同步;
[0218]
d.感染后第5、6和7天,分别随机选择一只动物解剖,采集不同组织器官样品。样品采用常规方法在室内灭活处理后,进行组织病理、病毒载量和免疫组化分析。
[0219]
5)完成不同样品(鼻拭子、咽拭子、肛拭子、血液、组织、器官)的病毒载量分析及血常规、血生化分析、中和抗体滴度分析,完成感染动物的影像学和主要器官组织的病理学分析;
[0220]
6)按照实验室标准操作程序和生物安全管理要求,所有采集的动物组织器官样品在室内灭活处理后,进行组织病理、病毒载量和免疫组化分析;按照实验室的废弃物管理规定对实验过程中产生的所有废弃物进行处理。
[0221]
9.2实验方法
[0222]
1)新型冠状病毒毒株
[0223]
新型冠状病毒毒株2019
‑
ncov
‑
wiv04(gisaid接受号: epi_isi_402124)是从一例病毒性肺炎患者的支气管肺泡灌洗液样品分离得到的。分离病毒毒株经纯化、培养、增殖、浓缩后,测定病毒的50%组织细胞感染量(tcid
50
),病毒滴度单位为tcid
50
/ml。
[0224]
2)动物行为观察
[0225]
在实验动物免疫和病毒攻毒阶段,每天或按标记时间观察动物的皮肤和毛发、分泌物、呼吸、粪便和尿、采食量和运动行为,测定体重和温度等,按照“新型冠状病毒攻毒后恒河猴临床评分标准”对每一只动物的进行健康评分。
[0226]
3)病毒滴度测定
[0227]
新型冠状病毒样品接种在含dmem的vero e6细胞中,37℃和5%co2条件下培养3天后收集培养液,保存在dmem备用。分离获得的病毒毒株,经纯化、培养、增殖、浓缩后,测定病毒的50%组织细胞感染量(tcid
50
)。经过用终点滴定法对vero e6细胞进行病毒滴定分析。接种10倍稀释的病毒稀释液到细胞,孵育1小时后,吸出病毒稀释液,加入100μl dmem (添加2%胎牛血清、1mml
‑
谷氨酰胺、青霉素(100iu/ml)和链霉素(100 μg/ml))。培养3天后进行细胞病变评分,计算出病毒滴度(tcid
50
/ml)。
[0228]
4)实时定量荧光pcr(qrt
‑
pcr)
[0229]
采用一步法实时定量rt
‑
pcr技术对样品中的病毒rna进行定量分析。根据供应商的说明,对拭子和血样样本,使用qiaamp viral rna minikit(qiagen)提取样品中病毒rna。样本在dmem(1:10,w/v)中均匀化,在4℃下4500g低速离心30分钟,然后立即用上清液提取rna。rna 在50μl洗脱液中洗脱,作为rt
‑
pcr模板。根据先前的研究结果,使用了针对s基因的引物:rbd
‑
qf1:5'
‑
caatggttaaggcagg
‑
3';rbd
‑
qr1: 5'
‑
ctcaaggtctggatcacg
‑
3'。
[0230]
根据说明,采用ii one step qrt
‑
pcrgreen kit (vazyme biotech co.,ltd)试剂盒,测定样品中rna的拷贝数。在abi 7700 机上进行50℃,3min,95℃,30s,40个循环,包括95℃,10s,60℃, 30s终止,并根据标准曲线,换算为病毒拷贝数
(copies/ml)。
[0231]
5)中和抗体测定
[0232]
通过利用新型冠状病毒活病毒与血清抗体的中和反应测定血清样品中的中和抗体滴度。获得的动物血清样品在56℃热灭活30min,稀释至1:50、1:150、1:450、1:1350、1:4050和1:12150,加入等量的活病毒,在 37℃,5%co2培养箱中孵育。培养1小时后,将100微升混合物接种于 12孔板中的单层vero细胞上,每隔15分钟摇动一次,孵育1小时。移除剩余的接种液后,加入含0.9%甲基纤维素和2%fbs的dmem的培养基后,在37℃,5%co2条件下培养三天。3天后,用4%甲醛固定细胞30min,去除固定溶液,用自来水冲洗,然后用结晶紫染色。计数噬斑数量,确定中和抗体效价(ec
50
)。
[0233]
6)实验动物操作
[0234]
所有攻毒实验是在四级生物安全实验室完成。恒河猴麻醉后,采用气管插管方式接种1毫升病毒液。每天观察并记录动物的临床症状、包括所有严重或可见变化的性质、发病、严重程度和持续时间。不同时间用 hf100ha(日本mikasa)进行动肺部x光检查,获取肺部影像,采集口咽、鼻甲、肛区的拭子样本和血液样品。收集的拭子样品放入1ml的 dulbecco’s modified eagle’s medium(dmem)中,含青霉素(100iu/ml)和链霉素(100μg/ml)。全血保存到k2 edta管中,进行病毒rna提取和血常规分析。为研究呼吸道的发病和病理损伤,分别于攻毒后第5、6、7 天随机安乐死一只动物,收集气管、右支气管、左支气管、六个肺叶及其他组织器官,进行病理、病毒学和免疫学分析。
[0235]
7)动物解剖和病理分析
[0236]
按照实验动物标准操作进行实验动物解剖。采集的器官、组织样品在 10%中性福尔马林缓冲液固定后移出实验室,进行石蜡包埋和切片,切片用苏木精和伊红染色后在光镜下观察。为检测新型冠状病毒的分布,将石蜡脱水组织切片置于抗原缓冲液中,在室温下用5%牛血清白蛋白封闭组织1小时,然后在1:500时用自制的一抗(兔抗rp3
‑
rp3
‑
cov n蛋白多克隆抗体)封闭组织。经pbs洗涤后,切片稍干,1:200稀释,覆盖cy3结合山羊抗兔igg(abcam)二抗。玻片经pbs洗涤后1:100稀释dapi染色。图像由pannoramic midi系统(3dhistech,布达佩斯,匈牙利)采集。
[0237]
根据实验动物肺部的病理变化特征,确定器官和组织的损伤等级,其中:“+++”表示重度病变;“++”为中度病变;“+”为轻度病变;
“‑”
为无病变,“+/
‑”
为介入轻度和无病变之间。
[0238]
8)其他操作
[0239]
按照生物安全四级实验室的管理体系文件要求,采用实验室的标准操作程序完成。
[0240]
9.3实验结果
[0241]
1)实验动物的选择和适应性饲养
[0242]
实验动物满足湖北省实验动物质量管理要求。实验动物完成实验室三天适应性饲养后,行为、健康、进食未有异常。
[0243]
2)接种病毒后实验动物的临床症状观察
[0244]
对照组、治疗组和预防组实验动物转移到p4实验室,在实验室内进行3天的适应性饲养后,分别进行以下操作。
[0245]
对照组和预防组:按计划在室内静脉注射pbs和单克隆抗体(达到 50mg/kg),24h后采用气管插管方式攻毒,并按实验计划进行常规的观察和体温及体重检测。
[0246]
治疗组:按计划在气管插管方式攻毒24h后,在d1和d3进行给药,并按实验计划进行常规的观察、体温和体重检测。
[0247]
结果表明,对照组、新冠抗体治疗组及预防组的实验动物在整个实验阶段未见明显的行为差异,没有明显的体温(参见图7a)和体重变化(参见图7b)。
[0248]
3)咽拭子、鼻拭子和肛拭子病毒载量变化
[0249]
每天采集咽拭子、鼻拭子和肛拭子样品,检测不同样品中病毒载量变化。结果表明,对照组咽拭子病毒载量随感染时间而变化,实验动物(c1、 c2和c3)接种病毒后,在第2
‑
4天达到高峰后,持续下降。到第7天,样品中的病毒载量降到一个较低的水平。但不同的动物个体的咽拭子病毒载量存在差异,其中c1、c2和c3的病毒复制高峰期分别在攻毒后第2、 3和4天。但总体来看,咽拭子样品中病毒载量变化规律显示病毒在体内的增殖过程(参见图8a)。与对照组动物的咽拭子中病毒载量检测结果相比,整个实验周期,预防组pa1和pa2动物仅在攻毒后第2
‑
3天可以检测到低水平的病毒核酸,其余检测点均未能检测到。pa3动物在整个实验周期未检测到病毒核酸。
[0250]
新冠抗体治疗组,个体差异明显;但均在攻毒后d2达到病毒载量峰值,后持续降低,病毒载量远低于对照组;ac1个体在d3其病毒载量低于检测下限;鼻拭子样品,所有组别的病毒载量均较低;鼻拭子样品中仅能在攻毒早期检测低水平的病毒核酸拷贝数,至7天,所有鼻拭子样品检测不到病毒核酸(参见图8b)。
[0251]
肛拭子样品,所有组别的病毒载量均较低;仅个别动物在攻毒早期检测低水平的病毒核酸拷贝数,至7天,所有肛拭子样品检测不到病毒核酸 (参见图8c)。
[0252]
4)感染动物的影像学分析
[0253]
对照组3只实验动物在攻毒第0天的x
‑
射线肺部影像清晰,未观察到任何肺部阴影。在病毒攻毒当天,未见对照组实验动物肺部有明显的阴影;攻毒第三天,一只动物(c3)可见肺部纹理略显模糊/紊乱,另外两只动物(c1和c2)可见明显的肺部阴影,至第6天,看不到明显肺部阴影(参见图9a)。
[0254]
而无论是预防组3只动物还是治疗组3只动物,x
‑
射线影像显示所有感染动物未出现肺部阴影,仅在攻毒后第3天,可观察到肺部纹理略显模糊/紊乱,但观察不到明显的肺部阴影(参见图9b和9c)。
[0255]
5)感染动物的病理变化
[0256]
分别于感染后第5、6和7天随机选取对照组、预防组和治疗组各一只动物进行解剖,分别采集肺、气管、支气管、心、肝、脾、肾、胃肠、生殖器官、淋巴结等器官和组织。根据实验要求,观察各器官形状、色泽和组织病变部位。
[0257]
攻毒后第5天,对照组动物(c2)大体肺表面大体肺表面色泽浅灰白色,质中,双下肺病变稍重,肺叶边缘呈气肿状,气管及支气管大体未见明显异常。攻毒后第6和第7天,对照组动物(d6:c3;d7:c1)大体肺表面暗红色,质中,双下肺病变稍重,肺叶边缘片状气肿与肺实变区域混杂,气管及支气管大体未见明显异常。
[0258]
攻毒后第5天,预防组动物(pa2)和治疗组动物(ac2)大体肺表面暗红色,质中,双下肺病变稍重,肺叶边缘肺气肿明显,气管及支气管大体未见明显异常。攻毒后第6、7天,实
验动物(预防组:d6:pa3,d7:pa1;治疗组:d6:ac3,d7:ac1)大体肺表面色泽浅灰白色,质中,肺部、气管及支气管大体未见明显异常。
[0259]
肺部的组织病理变化观察表明,感染第5天后,可观察到对照组动物肺弥漫性间质性肺炎改变,肺泡壁增厚,成纤维细胞增生、纤维化,并见大量单核细胞和淋巴细胞浸润;部分肺泡水肿及纤维蛋白渗出,可见透明膜形成及肺出血。部分肺毛细血管腔内透明血栓形成,细小支气管上皮细胞坏死、脱落。感染第6、7天的动物肺水肿及纤维蛋白渗出加重,肺泡腔巨噬细胞增多,肺泡壁和肺泡腔纤维化和机化明显。与对照组相比,无论是治疗组还是预防组,新冠病毒造成的实验动物的肺部损伤较小。感染后第5天,两只动物(ac2和pa2)的肺泡结构基本完整,可见灶性或小片状肺组织纤维化,并见单核细胞和淋巴细胞浸润,但数量均较对照组明显减少,肺泡腔巨噬细胞较多,水肿较轻,未见透明膜形成,未见严重的细小支气管和肺毛细血管病变。感染后第6、7天,动物肺部病理变化明显改善,肺组织渗出性病变基本消失,可见灶性或小片状组织纤维化。
[0260]
6)不同器官组织中的病毒载量
[0261]
为了进一步了解病毒在上呼吸道和肺部不同组织中的分布,分别于攻毒后第5、6和7天采集了对照组和两个抗体组动物气管、支气管、肺部不同部位的组织,测定了不同器官和组织中的病毒载量,结果表明在攻毒后第5天,仅在一只预防组动物(ac2)的气管和左支气管中检测到4
‑8×
105病毒拷贝/克,而在其它组织样品中均未能检测到病毒颗粒,所有治疗组动物样品中均未检测到病毒核酸(参见图10a)。
[0262]
如图10b所示,感染后第6天,在对照组动物(c3)的气管、左右支气管、左肺上叶中都检测到4
×
105‑1×
106病毒拷贝/克,其它组织样品中均未检测到病毒颗粒。同时,在一只预防组动物(ac3)的气管组织中也检测到3
×
105病毒拷贝/克,其它组织样品中均检测不到病毒颗粒。治疗组动物样品中未检测到病毒核酸。
[0263]
如图10c所示,感染后第7天,在对照组动物(c1)的左支气管、左肺下叶检测到5
×
104病毒拷贝/克,其它组织样品中均检测不到病毒颗粒。同时,预防组和治疗组动物组织样品中均检测不到病毒颗粒。
[0264]
7)免疫组化分析
[0265]
肺组织进行了病毒的免疫组化分析结果表明,在对照组第5、6和7 天的肺部病变组织中,可在肺部检测到病毒蛋白,而在不同时间的抗体治疗组和预防组的动物肺部检测不到病毒蛋白。
[0266]
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1