一种胺叠氮手性化合物、双叠氮手性化合物以及相关制备方法
1.本技术涉及一种胺叠氮手性化合物、双叠氮手性化合物以及相关制备方法,属于有机合成技术领域。
背景技术:
2.烯烃的胺-叠氮化反应,自二十一世纪以来已经被广泛而深入的研究。但是,用烯烃制备胺叠氮对应选择性产物的研究尚未有报道。烯烃不对称胺-叠氮化反应之所以尚未有报道,究其原因是因为该类反应过程中会经历一个自由基机理,而自由基机理被广泛的认为对立体选择的控制机并不容易。受限于这些原因,烯烃不对称胺-叠氮化反应的研究报道目前没有。
技术实现要素:
3.根据本技术的一个方面,提供了一种胺叠氮手性化合物,本技术描述了铁催化不对称胺叠氮化反应。该反应是二苯并呋喃恶唑啉类配体为手性催化中心,通过自由基机理实现铁催化不对称叠胺氮化反应。该方法首次将nfsi和叠氮基三甲基硅烷作为高效、可控的反应物引入到不对称胺-氮化反应中,具有原料和催化剂廉价、反应条件温和、操作简单、反应高效、对应选择性高等优点,并且可以大规模制备的特点。
4.一种胺叠氮手性化合物,所述胺叠氮手性化合物选自具有式ⅰ所示结构式的物质中的任一种:
[0005][0006]
在式ⅰ中,r1选自c6~c
10
芳基ⅰ、c6~c
10
取代芳基ⅰ、c8~c
12
杂芳基ⅰ中任一种。
[0007]
可选地,所述c6~c
10
取代芳基ⅰ选自具有式ⅱ所示结构式的基团中的任一种;
[0008][0009]
在式ⅱ中,r2选自h、卤素、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷基、c2~c5烯基、
c2~c5炔基中的任一种;
[0010]
r3选自h、卤素、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷基、c2~c5烯基、c2~c5炔基中的任一种;
[0011]
r4选自h、c1~c4烷基中的任一种;
[0012]
且,r2、r3、r4中至多有两个为h。
[0013]
可选地,在式ⅱ中,r4为氢。
[0014]
具体地,所述c6~c
10
取代芳基ⅰ选自具有式
ⅱ‑
1所示结构式的基团中的任一种;
[0015][0016]
在式
ⅱ‑
1中,r
21
选自h、卤素、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷基、c2~c5烯基、c2~c5炔基中的任一种;
[0017]r31
选自h、卤素、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷基、c2~c5烯基、c2~c5炔基中的任一种;
[0018]
且,r
21
和r
31
中至多有一个为h。
[0019]
可选地,在式ⅱ中,r3为氢,r2选自c1~c4烷基中的任一种,r4选自c1~c4烷基中的任一种。
[0020]
具体地,所述c6~c
10
取代芳基ⅰ选自具有式
ⅱ‑
2所示结构式的基团中的任一种;
[0021][0022]
在式
ⅱ‑
2中,r
22
选自c1~c4烷基,r
42
选自c1~c4烷基。
[0023]
可选地,所述c8~c
12
杂芳基ⅰ中的杂原子包括s。
[0024]
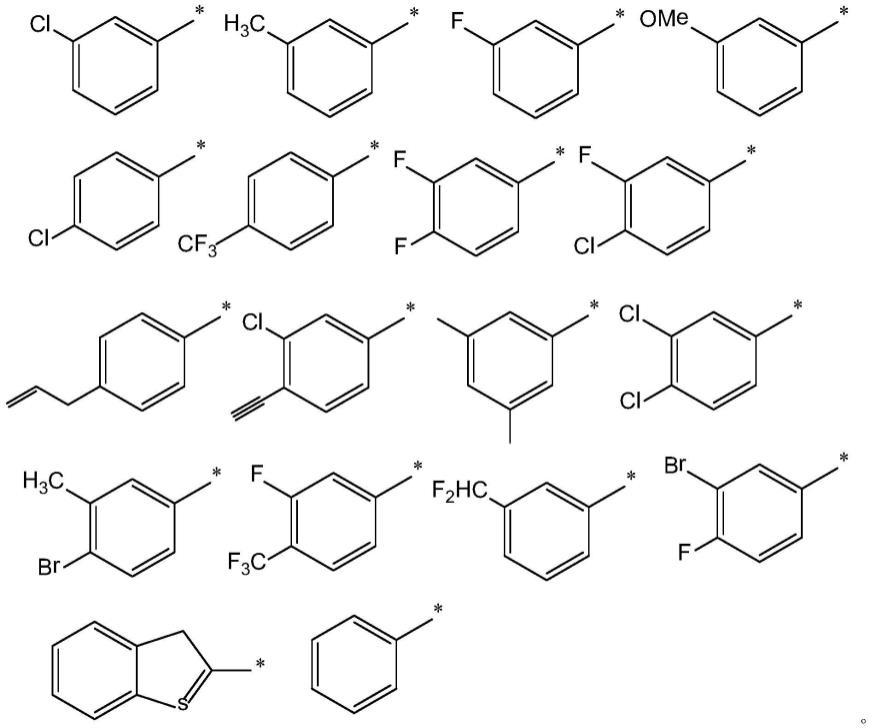
可选地,所述r1选自具有下列结构式的基团中的任一种;
[0025][0026]
根据本技术的第二方面,还提供了上述任一项所述胺叠氮手性化合物的制备方法,所述制备方法包括:将含有n-氟代双苯磺酰基亚胺、含有碳碳双键的化合物ⅱ、叠氮基三甲基硅烷的混合物,在催化剂存在的条件下,反应,即可得到所述胺叠氮手性化合物;
[0027]
所述催化剂包括铁源和二苯并呋喃恶唑啉类配体;
[0028]
所述含有碳碳双键的化合物ⅱ选自具有式ⅲ所示结构式的物质中的任一种;
[0029][0030]
式ⅲ中的r1与式ⅰ中的r1相同。
[0031]
具体地,在式ⅲ中,r1选自c6~c
10
芳基ⅰ、c6~c
10
取代芳基ⅰ、c8~c
12
杂芳基ⅰ中任一种。
[0032]
可选地,所述含有碳碳双键的化合物ⅱ选自具有式
ⅲ‑
1所示结构式的物质中的任一种;
[0033]
[0034]
在式
ⅲ‑
1中,r2选自h、卤素、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷基、c2~c5烯基、c2~c5炔基中的任一种;
[0035]
r3选自h、卤素、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷基、c2~c5烯基、c2~c5炔基中的任一种;
[0036]
r4选自h、c1~c4烷基中的任一种;
[0037]
且,r2、r3、r4中至多有两个为h。
[0038]
可选地,所述含有碳碳双键的化合物ⅱ选自具有式
ⅲ‑
11所示结构式的物质中的任一种;
[0039][0040]
在式
ⅲ‑
11中,r
21
选自h、卤素、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷基、c2~c5烯基、c2~c5炔基中的任一种;
[0041]r31
选自h、卤素、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷基、c2~c5烯基、c2~c5炔基中的任一种;
[0042]
且,r
21
和r
31
中至多有一个为h。
[0043]
可选地,所述含有碳碳双键的化合物ⅱ选自具有式
ⅲ‑
12所示结构式的物质中的任一种;
[0044][0045]
在式
ⅲ‑
12中,r
22
选自c1~c4烷基,r
42
选自c1~c4烷基。
[0046]
可选地,所述c8~c
12
杂芳基ⅰ中的杂原子包括s。
[0047]
可选地,所述含有碳碳双键的化合物ⅱ选自具有下列结构式的物质中的任一种;
[0048][0049]
可选地,所述铁源包括fe
3+
源或者fe
2+
源;
[0050]
所述fe
3+
源包括醋酸铁、氯化铁、氟化铁中的任一种;
[0051]
所述fe
2+
源包括三氟甲磺酸亚铁、醋酸亚铁、氯化亚铁、氟化亚铁中的任一种。
[0052]
可选地,所述二苯并呋喃恶唑啉类配体选自式
ⅴ
所示结构式的物质中任一种;
[0053][0054]
在式
ⅴ
中,r5和r8各自独立地选自氢、c1~c
12
烷基、c6~c
24
芳基、c6~c
24
杂芳基、c6~c
24
取代芳基中的一种;r6和r7各自独立地选自氢、c1~c
12
烷基、c6~c
24
芳基、c6~c
24
杂芳基、c6~c
24
取代芳基中的一种。
[0055]
可选地,所述二苯并呋喃恶唑啉类配体选自式
ⅴ‑
1所示结构式的物质中任一种;
[0056][0057]
在式
ⅴ‑
1中,r
51
、r
61
、r
71
、r
81
为相同的基团;
[0058]r51
、r
61
、r
71
、r
81
选自c8~c
16
取代芳基中的任一种。
[0059]
可选地,所述c8~c
16
取代芳基选自具有式ⅵ所示结构式的基团中的任一种;
[0060][0061]
在式ⅵ中,r9选自c4~c7烷基中的任一种。
[0062]
可选地,所述铁源与二苯并呋喃恶唑啉类配体的摩尔比为1:1~1.5。
[0063]
优选地,所述反应体系中,铁源与配体的摩尔比=1:1.2~1:1.5。
[0064]
可选地,所述n-氟代双苯磺酰基亚胺、叠氮基三甲基硅烷与含有碳碳双键的化合物ⅱ的摩尔比为1~10:1~10:1。
[0065]
优选地,n-氟代双苯磺酰基亚胺、叠氮基三甲基硅烷与含有碳碳双键的化合物ⅱ的摩尔比为1.25~2.5:1.25~2.5:1。
[0066]
反应体系中nfsi与碳碳双键的化合物ii的摩尔比=1:1~10:1。
[0067]
进一步优选地,所述反应体系中,反应体系中nfsi与碳碳双键的化合物iii的摩尔比=1:1~3:1。
[0068]
反应体系中叠氮基三甲基硅烷与碳碳双键的化合物ii的摩尔比=1:1~10:1。
[0069]
进一步优选地,所述反应体系中,反应体系中叠氮基三甲基硅烷与碳碳双键的化合物iii的摩尔比=1:1~3:1。
[0070]
可选地,所述铁源与含有碳碳双键的化合物ⅱ的摩尔比0.5~10:100。
[0071]
具体地,铁源与含有碳碳双键的化合物ⅱ的摩尔比的上限选自1:100、5:100、7:100、10:100;铁源与含有碳碳双键的化合物ⅱ的摩尔比的下限选自0.5:100、1:100、3:100、5:100、7:100。
[0072]
可选地,所述反应的条件为:反应温度不超过50℃,反应时间不小于6分钟。
[0073]
可选地,所述反应的条件为:反应温度20~50℃,反应时间48~72h。
[0074]
可选地,所述混合物中还含有有机溶剂;
[0075]
所述有机溶剂包括氯仿、二氯甲烷、四氯化碳、乙醚中的至少一种。
[0076]
可选地,所述有机溶剂的体积与含有碳碳双键的化合物ⅱ的摩尔数之比为1.0~2.0ml/mmol。
[0077]
下面介绍可能的制备方法:
[0078]
s100、将铁源和二苯并呋喃恶唑啉类配体与有机溶剂混合,在惰性条件下搅拌,抽走有机溶剂a,得到物料a;
[0079]
s200、在惰性条件下,向物料a中加入有机溶剂b、n-氟代双苯磺酰基亚胺、含有碳碳双键的化合物ⅱ和叠氮基三甲基硅烷,反应,得到所述胺叠氮手性化合物。
[0080]
根据本技术的第三方面,还提供了一种双叠氮手性有机物,所述双叠氮手性有机物选自具有式
ⅰ
(a)或者式
ⅰ
(b)所示结构式的物质中的任一种;
[0081][0082]
式
ⅰ
(a)中,r’、r”独立地选自h、c1~c4烷基、c1~c4取代烷基、c6~c
10
芳基、c6~c
10
取代芳基中的任一种;
[0083]
所述c1~c4取代烷基中的取代基为金刚烷基;
[0084]
r1与式ⅰ中的相同;
[0085][0086]
在式
ⅰ
(b)中,n为0或者1;r1与式ⅰ中的相同。
[0087]
根据本技术的第四方面,还提供了上述所述的双叠氮手性有机物的制备方法,所述制备方法包括:
[0088]
将含有过氧化(2-乙基己酸)叔丁酯、叠氮基三甲基硅烷、含有碳碳双键的物质a的混合物,在催化剂存在的条件下,反应,即可得到所述双叠氮手性有机物;
[0089]
所述催化剂包括铁源和二苯并呋喃恶唑啉类配体;
[0090]
所述含有碳碳双键的物质a选自具有式
ⅰ‑
1或者式
ⅰ‑
2所示物质中的任一种;
[0091][0092]
其中,r1与式ⅰ中的相同;r’、r”与式
ⅰ
(a)相同;n与式
ⅰ
(b)相同。
[0093]
可选地,所述含有碳碳双键的物质a选自以下物质中的任一种;
[0094][0095]
可选地,所述铁源包括fe
3+
源或者fe
2+
源;所述fe
3+
源包括三氟甲磺酸铁;所述fe
2+
源包括三氟甲磺酸亚铁。
[0096]
可选地,所述二苯并呋喃恶唑啉类配体选自式
ⅴ
所示结构式的物质中任一种;
[0097][0098]
在式
ⅴ
中,r5和r8各自独立地选自氢、c1~c
12
烷基、c6~c
24
芳基、c6~c
24
杂芳基、c6~c
24
取代芳基中的一种;r6和r7各自独立地选自氢、c1~c
12
烷基、c6~c
24
芳基、c6~c
24
杂芳基、c6~c
24
取代芳基中的一种。
[0099]
可选地,所述二苯并呋喃恶唑啉类配体选自式
ⅴ‑
1所示结构式的物质中任一种;
[0100][0101]
在式
ⅴ‑
1中,r
51
、r
61
、r
71
、r
81
为相同的基团;r
51
、r
61
、r
71
、r
81
选自c8~c
16
取代芳基中的任一种。
[0102]
可选地,所述c8~c
16
取代芳基选自具有式ⅵ所示结构式的基团中的任一种;
[0103][0104]
在式ⅵ中,r9选自c4~c7烷基中的任一种。
[0105]
可选地,所述铁源与二苯并呋喃恶唑啉类配体的摩尔比为1:1~1.5。
[0106]
可选地,所述过氧化(2-乙基己酸)叔丁酯、叠氮基三甲基硅烷与含有碳碳双键的化合物a的摩尔比为0.5~1.0:0.5~1.0:0.1~0.3。
[0107]
可选地,所述铁源与含有碳碳双键的化合物a的摩尔比1~10:100。
[0108]
可选地,所述反应的条件为:反应温度不超过50℃,反应时间不小于6分钟。
[0109]
可选地,所述反应的条件为:反应温度20~50℃,反应时间48~72h。
[0110]
可选地,所述混合物中还含有有机溶剂;所述有机溶剂包括氯仿、二氯甲烷、四氯化碳、乙醚中的至少一种。
[0111]
可选地,所述有机溶剂的体积与含有碳碳双键的化合物a的摩尔数之比为1.0~2.0ml/mmol。
[0112]
可选地,所述制备方法包括:
[0113]
s100、将铁源和二苯并呋喃恶唑啉类配体与有机溶剂a混合,在惰性条件下搅拌,抽走所述有机溶剂a,得到物料a;
[0114]
s200、在惰性条件下,向所述物料a中加入有机溶剂b、过氧化(2-乙基己酸)叔丁酯、含有碳碳双键的化合物a和叠氮基三甲基硅烷,反应,即可得到所述双叠氮手性有机物。
[0115]
可选地,所述反应的条件为:反应温度20~50℃,反应时间48~72h。
[0116]
可选地,所述有机溶剂的体积与含有碳碳双键的化合物a的摩尔数之比为1.0~
2.0ml/mmol。
[0117]
本技术利用铁催化不对称胺叠氮化反应。该反应是二苯并呋喃恶唑啉类配体为手性催化中心,通过自由基机理实现铁催化不对称叠胺氮化反应。该方法首次将nfsi和叠氮基三甲基硅烷作为高效、可控的反应物引入到不对称胺-氮化反应中,具有原料和催化剂廉价、反应条件温和、操作简单、反应高效、对应选择性高等优点,并且可以大规模制备的特点。申请利用铁催化不对称双叠氮化反应。该反应是二苯并呋喃恶唑啉类配体为手性催化中心,通过自由基机理实现铁催化不对称叠胺氮化反应。该方法首次将叠氮基三甲基硅烷作为高效、可控的反应物引入到不对称双氮化反应中,具有原料和催化剂廉价、反应条件温和、操作简单、反应高效、对应选择性高等优点。
[0118]
本技术中,c6~c
10
、c8~c
12
等均指基团中所包含的碳原子数;
[0119]
在本技术中,术语“芳基”是指芳香族化合物分子上失去芳环上的一个氢原子所形成的基团。
[0120]
在本技术中,术语“取代芳烃基”是指芳基上的至少一个氢原子被取代基取代所形成的基团。
[0121]
在本技术中,术语“杂芳基”是指杂环芳香环的芳香族化合物分子中,芳香环上失去任意一个氢原子后形成的基团。
[0122]
术语“烷基”是由烷烃化合物分子上失去任意一个氢原子所形成的基团,所述烷烃化合物包括直链烷烃、支链烷烃、环烷烃、带有支链的环烷烃。
[0123]
本技术中,-t-bu为叔丁基。
[0124]-ph为苯基;
[0125]-meo为甲氧基;
[0126]
nfsi为n-氟代双苯磺酰基亚胺;
[0127]
tmsn3为叠氮基三甲基硅烷。
[0128]
本技术能产生的有益效果包括:
[0129]
(1)本技术所提供的烯烃不对称的胺-叠氮化反应方法,首次将nfsi和叠氮基三甲基硅烷作为高效、可控的反应物引入到不对称胺-氮化反应中。
[0130]
(2)本技术所提供的烯烃不对称的胺-叠氮化反应方法,具有原料和催化剂廉价、反应条件温和、操作简单、反应高效等优点。
[0131]
(3)本技术所提供的烯烃不对称的胺-叠氮化反应方法,与现有技术相比,首次实现了不对称的叠氮化反应。
具体实施方式
[0132]
下面结合实施例详述本技术,但本技术并不局限于这些实施例。
[0133]
如无特别说明,本技术的实施例中的原料和催化剂均通过商业途径购买。
[0134]
实施例中,核磁共振氢谱1h-nmr在布鲁克公司(bruker)的400avanceⅲ型分光仪(spectrometer)上测定,400mhz,cdcl3;碳谱
13
c-nmr,400mhz,cdcl3。
[0135]
产物分离采用teledyne isco的rf+uv-vis型全自动快速制备色谱系统。
[0136]
高分质谱仪采用hrms(esi)采用中科院福建物质结构研究所购买的布鲁克公司(bruker)的impact ii uhr-tof上测定。
[0137]
含有非端基双键的化合物的产率通过以下公式计算得到:
[0138]
产率%=(目标产物实际得到的质量
÷
目标产物理论上应得到的质量)
×
100%
[0139]
本技术实施例中用到的二苯并呋喃恶唑啉类配体的制备方法如下:
[0140]
配体l1的制备方法:
[0141][0142]
1)在反应管中加入二苯并呋喃84mg(0.5mmol),正丁基锂(n-buli)2ml(2.5mmol)在-78℃下反应1小时后拿到室温下反应24小时。24小时后放入-78℃,并通入二氧化碳(co2)1小时。盐酸(hcl)酸化后抽干得到二酸产物。
[0143]
2)将二酸装入反应管中,加入二氯亚砜(socl2)91μl(1.25mmol)在70℃反应3小时,得到酰氯产物。
[0144]
3)将酰氯缓慢滴加到装有氨基醇((1r,2s)-2-amino-1,2-bis(4-(2,3,3-trimethylbutan-2-yl)phenyl)ethan-1-ol)613mg(1.5mmol)和三乙胺(tea)207μl(1.5mmol)的反应管中,室温反应10小时。将反应液用二氯甲烷和饱和碳酸钠萃取三次,干燥,收集有机相。旋干,得到酰胺产物。
[0145]
4)将酰胺产物装入反应瓶中,并加入四氢呋喃(thf)。缓慢滴加二氯亚砜(socl2)91μl(1.25mmol),室温反应1小时,反应结束后将反应液稀释,并加入饱和碳酸钠淬灭反应。萃取反应液,干燥,收集有机相。旋干,得到氯化产物。
[0146]
5)将氯化产物加入到反应瓶中,加入氢氧化钠(naoh)50mg(1.25mmol)和甲醇(meoh),在70℃下反应4小时,反应用饱和食盐水和二氯甲烷萃取3次,干燥,收集有机相。旋干,粗产品经柱色谱分离,得产物样品,共301mg,产率为60%。
[0147]
配体l2的制备方法:
[0148][0149]
1)在反应管中加入二苯并呋喃84mg(0.5mmol),正丁基锂(n-buli)2ml(2.5mmol)在-78℃下反应1小时后拿到室温下反应24小时。24小时后放入-78℃,并通入二氧化碳(co2)1小时。盐酸(hcl)酸化后抽干得到二酸产物。
[0150]
2)将二酸装入反应管中,加入二氯亚砜(socl2)91μl(1.25mmol)在70℃反应3小时,得到酰氯产物。
[0151]
3)将酰氯缓慢滴加到装有氨基醇((1r,2s)-2-amino-1,2-bis(4-(tert-butyl)phenyl)ethan-1-ol)488mg(1.5mmol)和三乙胺(tea)207μl(1.5mmol)的反应管中,室温反应10小时。将反应液用二氯甲烷和饱和碳酸钠萃取三次,干燥,收集有机相。旋干,得到酰胺产物。
[0152]
4)将酰胺产物装入反应瓶中,并加入四氢呋喃(thf)。缓慢滴加二氯亚砜(socl2)91μl(1.25mmol),室温反应1小时,反应结束后将反应液稀释,并加入饱和碳酸钠淬灭反应。萃取反应液,干燥,收集有机相。旋干,得到氯化产物。
[0153]
5)将氯化产物加入到反应瓶中,加入氢氧化钠(naoh)50mg(1.25mmol)和甲醇(meoh),在70℃下反应4小时,反应用饱和食盐水和二氯甲烷萃取3次,干燥,收集有机相。旋干,粗产品经柱色谱分离,得产物样品,共284mg,产率为65%。
[0154]
实施例1
[0155][0156]
在反应管中加入1.8mg(相当于苯乙烯的1.0mol%)三氟甲磺酸亚铁,6.0mg(相当于苯乙烯的1.2mol%)配体l1和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),苯乙烯(1-1)52mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(25℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为1-4,共221mg,产率为100%,对映选择性:93:7。
[0157]
产物样品1-4的检测数据如下:
[0158]1h nmr(400mhz,cdcl3)δ8.07(d,j=8.3hz,4h),7.66(t,j=7.4hz,2h),7.56(t,j=7.8hz,4h),7.44-7.36(m,5h),5.03(dd,j=9.4,4.0hz,1h),4.08(dd,j=15.5,9.7hz,1h),3.73(dd,j=15.6,4.0hz,1h).
[0159]
13
c nmr(100mhz,cdcl3)δ139.2,136.5,134.1,129.1(two signals overlapped),129.0,128.6,127.2,65.6,53.2.
[0160]
hrms(esi)calcd for[c
20h18
n4o4s2na]
+
([m+na]
+
):465.0662,found:465.0662.
[0161]
hplc(od-h,0.46*25cm,5μm,正己烷/异丙醇92/8,流速0.5ml/min,检测波长214nm),保留时间=17.561min(主要)和19.169min(少量)。
[0162]
实施例2
[0163][0164]
在反应管中加入1.8mg(相当于间氯苯乙烯的1.0mol%)三氟甲磺酸亚铁,4.8mg
(相当于间氯苯乙烯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),间氯苯乙烯(1-1)69mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(20℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为2-4,共234mg,产率为98%,对映选择性:94:6。
[0165]
产物样品2-4的检测数据如下:
[0166]1h nmr(400mhz,cdcl3)δ8.06(d,j=7.9hz,4h),7.66(t,j=7.4hz,2h),7.56(t,j=7.8hz,4h),7.35-7.30(m,3h),7.27-7.23(m,1h),4.98(dd,j=9.4,4.2hz,1h),4.02(dd,j=15.6,9.5hz,1h),3.69(dd,j=15.6,4.3hz,1h).
[0167]
13
c nmr(100mhz,cdcl3)δ139.1,138.5,135.0,134.1,130.4,129.2,129.0,128.5,127.3,125.3,65.0,53.2.
[0168]
hrms(esi)calcd for[c
20h17
cln4o4s2na]
+
([m+na]
+
):499.0272,found:499.0264.
[0169]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长240nm)保留时间=46.830min(主要)和34.421min(少量)。
[0170]
实施例3
[0171][0172]
在反应管中加入1.8mg(相当于间甲基苯乙烯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于间甲基苯乙烯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),间甲基苯乙烯(1-1)59mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(30℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为3-4,共171mg,产率为75%,对映选择性:90:10。
[0173]
产物样品3-4的检测数据如下:
[0174]1h nmr(400mhz,cdcl3)δ8.07(d,j=8.0hz,4h),7.66(t,j=7.3hz,2h),7.55(t,j=7.7hz,4h),7.30(t,j=7.5hz,1h),7.17(t,j=8.4hz,2h),7.15(s,1h),4.97(dd,j=9.6,4.1hz,1h),4.06(dd,j=15.6,9.7hz,1h),3.71(dd,j=15.6,4.1hz,1h),2.37(s,3h).
[0175]
13
c nmr(100mhz,cdcl3)δ139.2,138.9,136.3,134.0,129.8,129.0(two signals overlapped),128.6,127.8,124.2,65.6,53.2,21.4.
[0176]
hrms(esi)calcd for[c
21h20
n4o4s2na]
+
([m+na]
+
):479.0818,found:479.0820.
[0177]
hplc(od-h,0.46*25cm,5μm,正己烷/异丙醇=97/3,流速0.5ml/min,检测波长214nm)保留时间=22.767min(主要)和25.450min(少量)。
[0178]
实施例4
[0179][0180]
在反应管中加入1.8mg(相当于间氟苯乙烯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于间氟苯乙烯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),间氟苯乙烯(1-1)61mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(20℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为4-4,共205mg,产率为90%,对映选择性:93:7。
[0181]
产物样品4-4的检测数据如下:
[0182]1h nmr(400mhz,cdcl3)δ8.09-8.07(m,4h),7.67(t,j=7.4hz,2h),7.56(t,j=7.8hz,4h),7.40-7.34(m,1h),7.15(d,j=7.8hz,1h),7.08-7.04(m,2h),5.02(dd,j=9.5,4.1hz,1h),4.04(dd,j=15.6,9.6hz,1h),3.70(dd,j=15.6,4.1hz,1h).
[0183]
13
c nmr(100mhz,cdcl3)δ163.0(d,1jc-f=246.6hz),139.1,139.0(d,3jc-f=6.9hz),134.1,130.8(d,3jc-f=8.2hz),129.0,128.5,122.8(d,4jc-f=3.0hz),116.0(d,2jc-f=20.9hz),114.2(d,2jc-f=22.2hz),65.1(d,4jc-f=1.6hz),53.2.
[0184]
19
f nmr(376mhz,cdcl3)δ-111.1.
[0185]
hrms(esi)calcd for[c
20h17
fn4o4s2na]
+
([m+na]
+
):483.0567,found:483.0567.
[0186]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长254nm)保留时间=47.270min(主要)和35.267min(少量)。
[0187]
实施例5
[0188][0189]
在反应管中加入1.8mg(相当于间甲氧基苯乙烯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于间甲氧基苯乙烯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),间甲氧基苯乙烯(5-1)61mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(30℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为5-4,共145mg,产率为62%,对映选择性:91:9。
[0190]
产物样品5-4的检测数据如下:
[0191]1h nmr(400mhz,cdcl3)δ8.07(d,j=7.8hz,4h),7.66(t,j=7.4hz,2h),7.55(t,j=7.7hz,4h),7.32(t,j=7.8hz,1h),6.95(d,j=7.6hz,1h),6.92-6.89(m,2h),4.99(dd,j
=9.6,4.1hz,1h),4.05(dd,j=15.6,9.6hz,1h),3.82(s,3h),3.72(dd,j=15.6,4.1hz,1h).
[0192]
13
c nmr(100mhz,cdcl3)δ160.1,139.2,138.0,134.0,130.2,129.0,128.6,119.3,114.6,112.6,65.5,55.3,53.2.
[0193]
hrms(esi)calcd for[c
21h20
n4o5s2na]
+
([m+na]
+
):495.0767,found:495.0768.
[0194]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长254nm)保留时间=62.008min(主要)和47.912min(少量)。
[0195]
实施例6
[0196][0197]
在反应管中加入1.8mg(相当于对氯苯乙烯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于对氯苯乙烯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),对氯苯乙烯(6-1)59mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(15℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为6-4,共203mg,产率为85%,对映选择性:92:8。
[0198]
产品6-4的检测数据如下:
[0199]1h nmr(400mhz,cdcl3)δ8.03(d,j=8.1hz,4h),7.67(t,j=7.4hz,2h),7.56(t,j=8.0hz,4h),7.36(d,j=8.4hz,2h),7.29(d,j=8.4hz,2h),5.01(dd,j=9.1,4.7hz,1h),3.99(dd,j=15.6,9.1hz,1h),3.72(dd,j=15.6,4.7hz,1h).
[0200]
13
c nmr(100mhz,cdcl3)δ139.0,135.0(two signals overlapped),134.1,129.4,129.0,128.6(two signals overlapped),64.9,53.0.
[0201]
hrms(esi)calcd for[c
20h17
cln4o4s2na]
+
([m+na]
+
):499.0272,found:499.0271.
[0202]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长230nm)保留时间=46.184min(主要)和41.438min(少量)。
[0203]
实施例7
[0204][0205]
在反应管中加入1.8mg(相当于对三氟甲基苯乙烯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于对三氟甲基苯乙烯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),对三氟甲基苯乙烯(7-1)86mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl
(1.25mmol),然后投入室温(25℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为7-4,共177mg,产率为70%,对映选择性:89:11。
[0206]
产品7-4的检测数据如下:
[0207]1h nmr(400mhz,cdcl3)δ8.04(d,j=8.1hz,4h),7.69-7.65(m,4h),7.56(t,j=7.8hz,4h),7.50(d,j=8.0hz,2h),5.11(dd,j=9.1,4.5hz,1h),4.02(dd,j=15.6,9.2hz,1h),3.75(dd,j=15.6,4.3hz,1h).
[0208]
13
c nmr(100mhz,cdcl3)δ140.5,139.0,134.2,131.2(q,2jc-f=32.5hz),129.1,128.5,127.7,126.1(q,3jc-f=3.7hz),123.8(q,1jc-f=270.7hz),65.1,53.1.
[0209]
19
f nmr(376mhz,cdcl3)δ-62.7.
[0210]
hrms(esi)calcd for[c
21h17
f3n4o4s2na]
+
([m+na]
+
):533.0536,found:533.0534.
[0211]
hplc(od-h,0.46*25cm,5μm,正己烷/异丙醇=98/2,流速0.5ml/min,检测波长230nm)保留时间=34.898min(主要)和37.772min(少量)。
[0212]
实施例8
[0213][0214]
在反应管中加入1.8mg(相当于3,4-二氟苯乙烯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于3,4-二氟苯乙烯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),对3,4-二氟苯乙烯(8-1)86mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(20℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为8-4,共172mg,产率为72%,对映选择性:92:8。
[0215]
产品8-4的检测数据如下:
[0216]1h nmr(400mhz,chloroform-d)δ7.56(d,j=8.4hz,2h),7.22(d,j=8.4hz,2h),4.83(dd,j=8.1,4.4hz,1h),2.62
–
2.49(m,1h),2.48
–
2.34(m,1h).
[0217]1h nmr(400mhz,cdcl3)δ8.06(d,j=8.0hz,4h),7.68(t,j=7.3hz,2h),7.56(t,j=7.7hz,4h),7.20-7.14(m,2h),7.11-7.07(m,1h),4.99(dd,j=9.1,4.5hz,1h),3.99(dd,j=15.6,9.2hz,1h),3.69(dd,j=15.6,4.5hz,1h).
[0218]
13
c nmr(100mhz,cdcl3)δ150.6(dd,1jc-f=249.1hz,2jc-f=1.3hz),150.5(dd,1jc-f=248.9hz,2jc-f=1.9hz),139.0,134.2,133.5(dd,3jc-f=4.6hz,4jc-f=4.3hz),129.1,128.5,123.4(dd,3jc-f=6.4hz,4jc-f=3.7hz),118.0(d,2jc-f=17.5hz),116.3(d,2jc-f=17.hz),64.6,53.2.
[0219]
19
f nmr(376mhz,cdcl3)δ
–
135.4(d,3jf-f=21.1hz),-136.5(d,3jf-f=21.1hz).
[0220]
hrms(esi)calcd for[c
20h16
f2n4o4s2na]
+
([m+na]
+
):501.0473,found:501.0473.
[0221]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长
230nm)保留时间=41.152min(主要)和35.878min(少量)。
[0222]
实施例9
[0223][0224]
在反应管中加入1.8mg(相当于3-氯-4-氟苯乙烯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于3-氯-4-氟苯乙烯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),3-氯-4-氟苯乙烯(9-1)86mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(38℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为9-4,共205mg,产率为85%,对映选择性:97:3。
[0225]
产品9-4的检测数据如下:
[0226]1h nmr(400mhz,cdcl3)δ8.05(d,j=7.7hz,4h),7.67(t,j=7.4hz,2h),7.56(t,j=7.8hz,4h),7.37(dd,j=6.8,2.0hz,1h),7.26-7.22(m,1h),7.14(t,j=8.5hz,1h),4.99(dd,j=9.1,4.7hz,1h),3.99(dd,j=15.6,9.1hz,1h),3.71(dd,j=15.6,4.7hz,1h).
[0227]
13
c nmr(100mhz,cdcl3)δ158.2(d,1jc-f=249.5hz),139.0,134.2,133.6(d,3jc-f=3.9hz),129.5,129.1,128.5,127.0(d,3jc-f=7.4hz),121.8(d,2jc-f=17.9hz),117.3(d,2jc-f=21.3hz),64.5,53.2.
[0228]
19
f nmr(376mhz,cdcl3)δ-114.3.
[0229]
hrms(esi)calcd for[c
20h16
clfn4o4s2na]
+
([m+na]
+
):517.0178,found:517.0179.
[0230]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长214nm)保留时间=32.334min(主要)和28.365min(少量)。
[0231]
实施例10
[0232][0233]
在反应管中加入1.8mg(相当于1-烯丙基-2-氟-4-乙烯基苯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于1-烯丙基-2-氟-4-乙烯基苯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),1-烯丙基-2-氟-4-乙烯基苯(10-1)86mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(25℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为10-4,共170mg,产率为68%,对映选择性:89:11。
[0234]
产品10-4的检测数据如下:
[0235]1h nmr(400mhz,cdcl3)δ8.08(d,j=7.8hz,4h),7.67(t,j=7.4hz,2h),7.56(t,j=7.8hz,4h),7.23(t,j=7.7hz,1h),7.08(d,j=7.9hz,1h),7.03(d,j=10.4hz,1h),6.00-5.90(m,1h),5.13(s,1h),5.10(d,j=6.6hz,1h),4.98(dd,j=9.5,4.0hz,1h),4.03(dd,j=15.6,9.6hz,1h),3.68(dd,j=15.6,4.1hz,1h),3.41(d,j=6.6hz,2h).
[0236]
13
c nmr(100mhz,cdcl3)δ161.0(d,1jc-f=246.1hz),139.1,136.7(d,3jc-f=7.0hz),135.2,134.1,131.3(d,3jc-f=5.2hz),129.0,128.6,127.9(d,2jc-f=16.0hz),122.7(d,4jc-f=3.5hz),116.7,114.1(d,2jc-f=23.2hz),65.0(d,4jc-f=1.6hz),53.2,32.8(d,3jc-f=2.7hz).
[0237]
19
f nmr(376mhz,cdcl3)δ-116.5.
[0238]
hrms(esi)calcd for[c
23h21
fn4o4s2na]
+
([m+na]
+
):523.0880,found:523.0876.
[0239]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=94/6,流速0.5ml/min,检测波长230nm)保留时间=22.578min(主要)和19.405min(少量)。
[0240]
实施例11
[0241][0242]
在反应管中加入1.8mg(相当于2-氯-1-乙炔基-4-乙烯基苯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于2-氯-1-乙炔基-4-乙烯基苯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),2-氯-1-乙炔基-4-乙烯基苯(11-1)81mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(25℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为11-4,共200mg,产率为80%,对映选择性:90:10。
[0243]
产品11-4的检测数据如下:
[0244]1h nmr(400mhz,cdcl3)δ8.04(d,j=7.7hz,4h),7.68(t,j=7.4hz,2h),7.56(t,j=7.8hz,4h),7.53(d,j=8.2hz,1h),7.38(d,j=1.1hz,1h),7.23(dd,j=8.0,1.3hz,1h),5.01(dd,j=9.0,4.7hz,1h),3.98(dd,j=15.6,9.0hz,1h),3.72(dd,j=15.6,4.8hz,1h),3.43(s,1h).
[0245]
13
c nmr(100mhz,cdcl3)δ138.9,138.7,137.0,134.5,134.2,129.1,128.5,128.0,125.3,122.8,83.5,79.5,64.8,53.0.
[0246]
hrms(esi)calcd for[c
22h17
cln4o4s2na]
+
([m+na]
+
):523.0271,found:523.0272.
[0247]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长254nm)保留时间=43.849min(主要)和30.092min(少量).
[0248]
实施例12
[0249][0250]
在反应管中加入1.8mg(相当于1,3-二甲基-5-乙烯基苯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于1,3-二甲基-5-乙烯基苯的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 2ml,nfsi(1-3)394mg(1.25mmol),1,3-二甲基-5-乙烯基苯(12-1)76mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(20℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为12-4,共165mg,产率为70%,对映选择性:92:8。
[0251]
产品12-4的检测数据如下:
[0252]1h nmr(400mhz,cdcl3)δ8.09(d,j=7.8hz,4h),7.66(t,j=7.4hz,2h),7.56(t,j=7.7hz,4h),7.01(s,1h),6.96(s,2h),4.94(dd,j=9.7,4.0hz,1h),4.08(dd,j=15.5,9.8hz,1h),3.71(dd,j=15.6,4.1hz,1h),2.33(s,6h).
[0253]
13
c nmr(100mhz,cdcl3)δ139.3,138.8,136.2,134.0,130.7,128.9,128.5,124.9,65.6,53.2,21.3.
[0254]
hrms(esi)calcd for[c
22h22
n4o4s2na]
+
([m+na]
+
):493.0975,found:493.0975.
[0255]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长240nm)保留时间=26.074min(主要)和21.231min(少量)。
[0256]
实施例13
[0257][0258]
在反应管中加入1.8mg(相当于2-乙烯基苯并噻吩的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于2-乙烯基苯并噻吩的1.2mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 2ml,nfsi(1-3)394mg(1.25mmol),2-乙烯基苯并噻吩(13-1)80mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入室温(30℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为13-4,共245mg,产率为90%,对映选择性:88:12。
[0259]
产品13-4的检测数据如下:
[0260]1h nmr(400mhz,cdcl3)δ8.07(d,j=7.8hz,4h),7.85-7.82(m,1h),7.75-7.73(m,1h),7.63(t,j=7.4hz,2h),7.50(t,j=7.8hz,4h),7.41-7.36(m,2h),7.30(s,1h),5.38(dd,j=9.0,4.7hz,1h),4.18(dd,j=15.6,9.0hz,1h),3.90(dd,j=15.7,4.6hz,1h).
[0261]
13
c nmr(100mhz,cdcl3)δ139.6,139.5,139.0,138.9,134.1,129.0,128.6,125.1,124.7,124.0,123.5,122.5,61.8,53.0.
[0262]
hrms(esi)calcd for[c
22h18
n4o4s3na]
+
([m+na]
+
):521.0382,found:521.0382.
[0263]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长214nm)保留时间=32.490min(主要)和43.726min(少量).
[0264]
实施例14
[0265][0266]
在反应管中加入1.8mg(相当于3,4-二氯苯乙烯的2.0mol%)三氟甲磺酸亚铁,9.6mg(相当于3,4-二氯苯乙烯的1.2mol%)配体l2和二氯甲烷(dcm)4ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 8ml,nfsi(1-3)788.4mg(2.5mmol),3,4-二氯苯乙烯(14-1)80mg(1mmol),叠氮基三甲基硅烷(1-2)346μl(2.5mmol),然后投入室温(25℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为13-4,共409mg,产率为80%,对映选择性:93:7。
[0267]
产品14-4的检测数据如下:
[0268]1h nmr(400mhz,cdcl3)δ8.04(d,j=8.0hz,4h),7.68(t,j=7.4hz,2h),7.56(t,j=7.8hz,4h),7.44(d,j=8.2hz,1h),7.41(d,j=1.7hz,1h),7.20(dd,j=8.3,1.8hz,1h),4.99(dd,j=8.9,4.9hz,1h),3.97(dd,j=15.6,8.9hz,1h),3.72(dd,j=15.6,5.0hz,1h).
[0269]
13
c nmr(100mhz,cdcl3)δ139.0,136.7,134.2,133.3(two signals overlapped),131.1,129.2,129.1,128.5,126.5,64.5,53.1.
[0270]
hrms(esi)calcd for[c
20h16cl2
n4o4s2na]
+
([m+na]
+
):532.9882,found:532.9879.
[0271]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长254nm)保留时间=42.526min(主要)和34.532min(少量).
[0272]
实施例15
[0273][0274]
在反应管中加入9mg(相当于1-溴-2-甲基-4-乙烯基苯的1.0mol%)三氟甲磺酸亚铁,24mg(相当于1-溴-2-甲基-4-乙烯基苯的1.2mol%)配体l2和二氯甲烷(dcm)6ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 15ml,nfsi(1-3)1576.7mg(5mmol),1-溴-2-甲基-4-乙烯基苯(14-1)392mg(2mmol),叠氮基三甲基硅烷(1-2)553μl(4mmol),然后投入室温(25℃)反应72小时。反应结束后,用乙酸乙酯稀释、硅
藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为13-4,共818mg,产率为80%,对映选择性:93:7。
[0275]
产品15-4的检测数据如下:
[0276]1h nmr(400mhz,cdcl3)δ8.04(d,j=8.0hz,4h),7.68(t,j=7.4hz,2h),7.56(t,j=7.8hz,4h),7.44(d,j=8.2hz,1h),7.41(d,j=1.7hz,1h),7.20(dd,j=8.3,1.8hz,1h),4.99(dd,j=8.9,4.9hz,1h),3.97(dd,j=15.6,8.9hz,1h),3.72(dd,j=15.6,5.0hz,1h).
[0277]
13
c nmr(100mhz,cdcl3)δ139.0,136.7,134.2,133.3(two signals overlapped),131.1,129.2,129.1,128.5,126.5,64.5,53.1.
[0278]
hrms(esi)calcd for[c
20h16cl2
n4o4s2na]
+
([m+na]
+
):532.9882,found:532.9879.
[0279]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长254nm)保留时间=42.526min(主要)和34.532min(少量)。
[0280]
实施例16
[0281][0282]
在反应管中加入18mg(相当于1-氟-2-三氟甲基-4-乙烯基苯的1.0mol%)三氟甲磺酸亚铁,48mg(相当于1-氟-2-三氟甲基-4-乙烯基苯的1.2mol%)配体l2和二氯甲烷(dcm)8ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 30ml,nfsi(1-3)3.94g(12.5mmol),1-氟-2-三氟甲基-4-乙烯基苯(16-1)1.9g(10mmol),叠氮基三甲基硅烷(1-2)1730μl(12.5mmol),然后投入室温(20℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为15-4,共3.81g,产率为72%,对映选择性:92:8。
[0283]
产品16-4的检测数据如下:
[0284]1h nmr(400mhz,cdcl3)δ8.05(d,j=8.1hz,4h),7.67(t,j=7.4hz,2h),7.58-7.54(m,6h),7.21(t,j=9.1hz,1h),5.07(dd,j=9.1,4.7hz,1h),4.02(dd,j=15.6,9.0hz,1h),3.73(dd,j=15.6,4.8hz,1h).
[0285]
13
c nmr(100mhz,cdcl3)δ159.8(dq,1jc-f=257.0hz,3jc-f=2.3hz),138.9,134.2,133.0(d,4jc-f=3.9hz),132.8(d,3jc-f=8.8hz),129.1,128.4,126.0(qd,3jc-f=4.4hz,3jc-f=1.8hz),122.1(q,1jc-f=270.9hz),119.0(qd,2jc-f=33.0hz,2jc-f=12.7hz),117.8(d,2jc-f=20.9hz),64.5,53.2.19f nmr(376mhz,cdcl3)δ-61.4(d,4jf-f=12.7hz),-113.3(q,4jf-f=12.5hz).
[0286]
hrms(esi)calcd for[c
21h16
f4n4o4s2na]
+
([m+na]
+
):551.0441,found:551.0442.
[0287]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长214nm)保留时间=35.352min(主要)和28.555min(少量).
[0288]
实施例17
[0289][0290]
在反应管中加入7.2mg(相当于1-(氯甲基)-4-乙烯基苯的1.0mol%)三氟甲磺酸亚铁,24mg(相当于1-(氯甲基)-4-乙烯基苯的1.5mol%)配体l2和二氯甲烷(dcm)3ml,在惰气条件下搅拌60分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 9ml,nfsi(1-3)1576mg(5mmol),1-(氯甲基)-4-乙烯基苯(17-1)305mg(2mmol),叠氮基三甲基硅烷(1-2)692μl(5mmol),然后投入室温(25℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为17-4,共806mg,产率为82%,对映选择性:92:8。
[0291]
产物样品17-4的检测数据如下:
[0292]1h nmr(400mhz,cdcl3)δ8.05(d,j=8.0hz,4h),7.66(t,j=7.2hz,2h),7.56(t,j=7.8hz,4h),7.43(d,j=8.0hz,2h),7.37(d,j=8.1hz,2h),5.03(dd,j=9.4,4.3hz,1h),4.60(s,2h),4.03(dd,j=15.6,9.4hz,1h),3.72(dd,j=15.6,4.3hz,1h).
[0293]
13
c nmr(100mhz,cdcl3)δ139.1,138.4,136.7,134.1,129.3,129.0,128.6,127.7,65.3,53.0,45.5.
[0294]
hrms(esi)calcd for[c
21h19
cln4o4s2na]
+
([m+na]
+
):513.0428,found:513.0429.[α]d25.8=-43.18(c 0.4,chcl3).
[0295]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=92/8,流速0.5ml/min,检测波长254nm)保留时间=55.386min(主要)和45.011min(少量).
[0296]
实施例18
[0297][0298]
在反应管中加入3.6mg(相当于1-(二氟甲基)-3-乙烯基苯的1.0mol%)三氟甲磺酸亚铁,9.6mg(相当于1-(二氟甲基)-3-乙烯基苯的1.2mol%)配体l2和二氯甲烷(dcm)1.5ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 7ml,nfsi(1-3)788mg(2.5mmol),1-(二氟甲基)-3-乙烯基苯(18-1)156mg(1mmol),叠氮基三甲基硅烷(1-2)346μl(2.5mmol),然后投入室温(25℃)反应48小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为5-4,共424mg,产率为86%,对映选择性:93:7。
[0299]
产物样品18-4的检测数据如下:
[0300]1h nmr(400mhz,cdcl3)δ8.07(d,j=7.8hz,4h),7.66(t,j=7.5hz,2h),7.57-7.49(m,8h),6.66(t,j=56.2hz,1h),5.09(dd,j=9.5,4.2hz,1h),4.08(dd,j=15.6,
9.5hz,1h),3.75(dd,j=15.6,4.3hz,1h).
[0301]
13
c nmr(100mhz,cdcl3)δ139.0,137.3,135.2(t,2jc-f=22.4hz),134.1,129.6,129.4,129.0,128.4,126.1(t,3jc-f=5.9hz),124.3(t,3jc-f=6.1hz),114.1(t,1jc-f=237.8hz),65.2,53.1.
[0302]
19
f nmr(376mhz,cdcl3)δ-111.0(d,2jf-f=14.4hz).hrms(esi)calcd for[c
21h18
f2n4o4s2na]
+
([m+na]
+
):515.0630,found:515.0628.
[0303]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长254nm)保留时间=70.944min(主要)和49.570min(少量).
[0304]
实施例19
[0305][0306]
在反应管中加入1.8mg(相当于2-溴-1-氟-4-乙烯基苯的1.0mol%)三氟甲磺酸亚铁,4.8mg(相当于2-溴-1-氟-4-乙烯基苯的1.2mol%)配体l1和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 5ml,nfsi(1-3)394mg(1.25mmol),2-溴-1-氟-4-乙烯基苯(19-1)100mg(0.5mmol),叠氮基三甲基硅烷(1-2)173μl(1.25mmol),然后投入50℃反应36小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为2-4,共165mg,产率为61%,对映选择性:91:9。
[0307]
产物样品19-4的检测数据如下:
[0308]1h nmr(400mhz,cdcl3)δ8.05(d,j=7.9hz,4h),7.67(t,j=7.4hz,2h),7.58-7.51(m,5h),7.30-7.26(m,1h),7.11(t,j=8.4hz,1h),4.99(dd,j=9.1,4.7hz,1h),4.00(dd,j=15.6,9.1hz,1h),3.71(dd,j=15.6,4.7hz,1h).
[0309]
13
c nmr(100mhz,cdcl3)δ159.2(d,1jc-f=248.0hz),139.0,134.1,134.0(d,3jc-f=3.8hz),132.3,129.0,128.5,127.8(d,3jc-f=7.5hz),117.1(d,2jc-f=22.5hz),109.8(d,,2jc-f=21.2hz),64.4,53.2.
[0310]
19
f nmr(376mhz,cdcl3)δ
–
106.2.
[0311]
hrms(esi)calcd for[c
20h16
brfn4o4s2na]
+
([m+na]
+
):560.9673,found:560.9669.
[0312]
hplc(ad-h,0.46*25cm,5μm,正己烷/异丙醇=96/4,流速0.5ml/min,检测波长254nm)保留时间=48.079min(主要)和40.399min(少量).
[0313]
实施例20
[0314]
[0315]
在反应管中加入3.6mg(相当于苯乙烯类原料的5.0mol%)三氟甲磺酸亚铁,10.8mg(相当于苯乙烯的6mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 2ml,过氧化(2-乙基己酸)叔丁酯(1-4)151mg(0.7mmol),苯乙烯类化合物(20-1)27mg(0.2mmol),叠氮基三甲基硅烷(1-2)96μl(0.7mmol),然后投入室温(25℃)反应72小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为20-4,共27.6mg,产率为64%,对映选择性:97:3。
[0316]
产物样品20-4的检测数据如下:
[0317]1h nmr(400mhz,chloroform-d)δ7.34
–
7.23(m,5h),4.36(s,1h),1.20(s,3h),1.17(s,3h).
[0318]
13
c nmr(101mhz,chloroform-d)δ134.5,127.7,127.6,127.4,72.7,62.6,22.6,21.7.
[0319]
hrms(dart)calcd for[c
10h13
n6]
+
([m-n2]
+
):189.1135,found:189.1133.
[0320]
hplc(od-h,0.46*25cm,5μm,正己烷/异丙醇100/0,流速1ml/min,检测波长230nm),保留时间=8.006min(主要)和9.375min(少量)。
[0321]
实施例21
[0322][0323]
在反应管中加入3.6mg(相当于苯乙烯类原料的5.0mol%)三氟甲磺酸亚铁,10.8mg(相当于苯乙烯类原料的6mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 2ml,过氧化(2-乙基己酸)叔丁酯(1-4)151mg(0.7mmol),苯乙烯类化合物(21-1)40mg(0.2mmol),叠氮基三甲基硅烷(1-2)96μl(0.7mmol),然后投入室温(25℃)反应72小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为21-4,共31.2mg,产率为55%,对映选择性:93:7。
[0324]
产物样品21-4的检测数据如下:
[0325]1h nmr(600mhz,chloroform-d)δ7.68
–
7.48(m,4h),4.46(s,1h),1.28(s,3h),1.24(s,3h).
[0326]
13
c nmr(151mhz,chloroform-d)δ136.8,132.0,130.9(q,j=32.1hz),129.0,123.9(q,j=271.8hz),125.7(q,j=3.1hz),125.5(d,j=3.0hz),123.9(q,j=271.8hz),73.2,63.6,23.3,23.1.
[0327]
hrms(dart)calcd for[c
11h12
f3n6]
+
([m-n2]
+
):257.1009,found:257.1005.
[0328]
hplc(od-h,0.46*25cm,5μm,正己烷/异丙醇100/0,流速0.5ml/min,检测波长220nm),保留时间=12.043min(主要)和13.471min(少量)。
[0329]
实施例22
[0330][0331]
在反应管中加入3.6mg(相当于苯乙烯类原料的5.0mol%)三氟甲磺酸亚铁,10.8mg(相当于苯乙烯类原料的6mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 2ml,过氧化(2-乙基己酸)叔丁酯(1-4)151mg(0.7mmol),苯乙烯类化合物(22-1)32mg(0.2mmol),叠氮基三甲基硅烷(1-2)96μl(0.7mmol),然后投入室温(25℃)反应72小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为22-4,共27.6mg,产率为60%,对映选择性:85:15。
[0332]
产物样品22-4的检测数据如下:
[0333]1h nmr(600mhz,chloroform-d)δ7.29
–
7.24(m,1h),7.19
–
7.11(m,3h),4.39(s,1h),2.38(s,3h),1.26(s,3h),1.23(s,3h).
[0334]
13
c nmr(151mhz,chloroform-d)δ138.2,135.5,129.6,129.3,128.3,125.8,73.8,63.7,23.9,22.8,21.6.
[0335]
hrms(dart)calcd for[c
11h15
n6]
+
([m-n2]
+
):203.1291,found:203.1289.
[0336]
hplc(od-h,0.46*25cm,5μm,正己烷/异丙醇100/0,流速0.5ml/min,检测波长220nm),保留时间=14.584min(主要)和15.399min(少量)。
[0337]
实施例23
[0338][0339]
在反应管中加入3.6mg(相当于苯乙烯类原料的5.0mol%)三氟甲磺酸亚铁,10.8mg(相当于苯乙烯类原料的6mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 2ml,过氧化(2-乙基己酸)叔丁酯(1-4)151mg(0.7mmol),苯乙烯类化合物(23-1)42mg(0.2mmol),叠氮基三甲基硅烷(1-2)96μl(0.7mmol),然后投入室温(25℃)反应72小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为23-4,共30.8mg,产率为54%,对映选择性:89:11。
[0340]
产物样品23-4的检测数据如下:
[0341]1h nmr(600mhz,chloroform-d)δ7.55
–
7.38(m,2h),7.20(dd,j=8.3,2.1hz,1h),4.34(s,1h),1.27(s,3h),1.23(s,3h).
[0342]
13
c nmr(151mhz,chloroform-d)δ136.0,133.1,132.8,130.6,130.6,130.5,130.5,128.0,128.0,72.5,63.5,23.4,23.2.
[0343]
hrms(dart)calcd for[c
10h11
cl2n6]
+
([m-n2]
+
):257.0355,found:257.0352.
[0344]
hplc(od-h,0.46*25cm,5μm,正己烷/异丙醇100/0,流速0.5ml/min,检测波长220nm),保留时间=15.865min(主要)和19.142min(少量)。
[0345]
实施例24
[0346][0347]
在反应管中加入3.6mg(相当于苯乙烯类原料的5.0mol%)三氟甲磺酸亚铁,10.8mg(相当于苯乙烯类原料的6mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 2ml,过氧化(2-乙基己酸)叔丁酯(1-4)151mg(0.7mmol),苯乙烯类化合物(24-1)58mg(0.2mmol),叠氮基三甲基硅烷(1-2)96μl(0.7mmol),然后投入室温(25℃)反应72小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为24-4,共41.1mg,产率为55%,对映选择性:88:12。
[0348]
产物样品24-4的检测数据如下:
[0349]1h nmr(600mhz,chloroform-d)δ7.66(s,1h),7.43(s,2h),4.30(s,1h),1.28(s,3h),1.24(s,3h).
[0350]
13
c nmr(151mhz,chloroform-d)δ139.7,134.5,130.5,123.0,72.5,63.5,23.3.
[0351]
hrms(dart)calcd for[c
10h11
br2n6]
+
([m-n2]
+
):344.9345,found:344.9339.
[0352]
hplc(od-h,0.46*25cm,5μm,正己烷/异丙醇100/0,流速0.5ml/min,检测波长220nm),保留时间=15.413min(主要)和20.459min(少量)。
[0353]
实施例25
[0354][0355]
在反应管中加入3.6mg(相当于苯乙烯类原料的5.0mol%)三氟甲磺酸亚铁,10.8mg(相当于苯乙烯类原料的6mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 2ml,过氧化(2-乙基己酸)叔丁酯(1-4)151mg(0.7mmol),苯乙烯类化合物(25-1)28.8mg(0.2mmol),叠氮基三甲基硅烷(1-2)96μl(0.7mmol),然后投入室温(25℃)反应72小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为25-4,共34.2mg,产率为75%,对映选择性:95:5。
[0356]
产物样品25-4的检测数据如下:
[0357]1h nmr(400mhz,chloroform-d)δ7.46
–
7.32(m,5h),4.60(s,1h),2.46
–
2.33(m,
2)96μl(0.7mmol),然后投入室温(25℃)反应72小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为27-4,共38.5mg,dr:1.3:1,产率为73%,对映选择性:92:8。
[0372]
产物样品27-4的检测数据如下:
[0373]1h nmr(400mhz,chloroform-d)δ7.31(dd,j=5.1,1.8hz,2h),7.23
–
7.13(m,5h),6.99(dd,j=6.6,2.9hz,2h),4.59(d,j=19.6hz,2h).
[0374]
13
c nmr(101mhz,chloroform-d)δ135.84 135.8,129.0,128.7,128.7,128.6,128.0,127.7,70.7,69.7.
[0375]
hrms(dart)calcd for[c
14h13
n6]
+
([m-n2]
+
):237.1135,found:237.1132.
[0376]
hplc(od-h,0.46*25cm,5μm,正己烷/异丙醇100/0,流速0.5ml/min,检测波长220nm),保留时间=18.401min(主要)和20.707min(少量)。
[0377]
实施例28
[0378][0379]
在反应管中加入3.6mg(相当于苯乙烯类原料的5.0mol%)三氟甲磺酸亚铁,10.8mg(相当于苯乙烯类原料的6mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 2ml,过氧化(2-乙基己酸)叔丁酯(1-4)151mg(0.7mmol),苯乙烯类化合物(28-1)50mg(0.2mmol),叠氮基三甲基硅烷(1-2)96μl(0.7mmol),然后投入室温(25℃)反应72小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为28-4,共34.6mg,dr:1:1,产率为67%,对映选择性:88:12。
[0380]
产物样品28-4的检测数据如下:
[0381]1h nmr(600mhz,chloroform-d)δ7.36
–
7.34(m,1h),7.31(t,j=7.7hz,1h),7.27
–
7.24(m,3h),7.18(t,j=7.8hz,1h),7.14
–
7.07(m,2h),6.90(dt,j=7.7,1.3hz,1h),4.61(s,1h),4.57(s,1h).
[0382]
13
c nmr(151mhz,chloroform-d)δ137.6,137.5,134.8,134.7,130.1,130.0,129.4,129.2,128.1,127.8,126.2,126.0,70.0,69.0.
[0383]
hrms(dart)calcd for[c14h11n6cl2]
+
([m-n2]
+
):305.0355,found:305.0351.
[0384]
hplc(ie,0.46*25cm,5μm,正己烷/异丙醇100/0,流速0.5ml/min,检测波长220nm),保留时间=26.805min(主要)和29.579min(少量)。
[0385]
实施例29
[0386][0387]
在反应管中加入3.6mg(相当于苯乙烯类原料的5.0mol%)三氟甲磺酸亚铁,10.8mg(相当于苯乙烯类原料的6mol%)配体l2和二氯甲烷(dcm)1ml,在惰气条件下搅拌30分钟,抽走溶剂。在惰气条件下,加入磁力搅拌子,加入chcl
3 2ml,过氧化(2-乙基己酸)叔丁酯(1-4)151mg(0.7mmol),苯乙烯类化合物(29-1)23.4mg(0.2mmol),叠氮基三甲基硅烷(1-2)96μl(0.7mmol),然后投入室温(25℃)反应72小时。反应结束后,用乙酸乙酯稀释、硅藻土过滤、减压蒸馏浓缩除去溶剂,粗产品经柱色谱分离,所得产物样品记为29-4,共38mg,dr:3:2,产率为61%,对映选择性:85:15(主要r,s),92:8(次要r,r)。
[0388]
产物样品29-4的检测数据如下:
[0389]
(主要)1h nmr(600mhz,chloroform-d)δ7.43
–
7.39(m,2h),7.38
–
7.36(m,1h)7.35
–
7.33(m,2h),4.54(d,j=5.9hz,1h),3.49(ddd,j=9.4,5.9,1.5hz,1h),1.93(s,3h),1.67(d,j=12.3hz,3h),1.62
–
1.57(m,3h),1.49
–
1.40(m,6h),1.35(dd,j=15.0,1.5hz,1h),1.19(dd,j=14.9,9.4hz,1h).
[0390]
(主要)
13
c nmr(151mhz,chloroform-d)δ136.1,129.0,128.9,127.8,70.3,61.4,43.7,42.4,36.9,28.8.
[0391]
hrms(dart)calcd for[c
19h25
n6]
+
([m-n2]
+
):309.2074,found:309.2070.
[0392]
hplc(od-h,0.46*25cm,5μm,正己烷/异丙醇100/0,流速0.5ml/min,检测波长220nm),保留时间=15.518min(主要)和13.641min(少量)。
[0393]
(次要)1h nmr(600mhz,chloroform-d)δ7.42
–
7.36(m,3h),7.31
–
7.28(m,2h),4.42(s,1h),3.48(ddd,j=9.3,7.5,1.6hz,1h),1.91(s,3h),1.66(d,j=12.3hz,3h),1.58(d,j=2.5hz,2h),1.47
–
1.41(m,3h),1.38
–
1.33(m,3h),1.26
–
1.21(m,2h),1.09
–
1.04(m,1h).
[0394]
13
c nmr(151mhz,chloroform-d)δ136.6,129.1,129.0,127.8,71.2,61.8,44.8,42.4,36.9,32.0,28.5.
[0395]
hrms(dart)calcd for[c
19h25
n6]
+
([m-n2]
+
):309.2074,found:309.2070.
[0396]
hplc(ic,0.46*25cm,5μm,正己烷/异丙醇100/0,流速0.5ml/min,检测波长220nm),保留时间=13.641min(主要)和16.015min(少量)。
[0397]
以上所述,仅是本技术的几个实施例,并非对本技术做任何形式的限制,虽然本技术以较佳实施例揭示如上,然而并非用以限制本技术,任何熟悉本专业的技术人员,在不脱离本技术技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1