一种用于检测HCV1型耐药突变基因的检测方法及应用与流程
一种用于检测hcv 1型耐药突变基因的检测方法及应用
技术领域
1.本发明涉及分子生物学领域,特别是涉及一种用于检测hcv 1型耐药突变基因的检测方法及应用。
背景技术:
2.据世界卫生组织估计,全球有1.7亿人感染hcv。在我国健康人群抗hcv阳性率为0.7%~3.1%,约3800万人。直接抗病毒药物(direct anti
‑
hcv agents,daas)主要为hcv病毒非结构蛋白(ns3,ns5a,ns5b)抑制剂,而hcv基因的某些突变会显著降低这种抑制作用。因此随着直接抗病毒药物在国内上市及临床应用,hcv耐药性检测将在临床用药中起到重要的作用。但目前在hcv耐药性检测中,要把耐药基因中的多个耐药相关突变位点通过简单的检测方法进行有效检测较难实现,其难点在于难以得到有效的目的片段,或者是得到的目的片段难以囊括待检的多个突变位点。特别是当样本中目的待测物的浓度很低时,更是难以实现多个突变位点得到精准全面的检测效果。
技术实现要素:
3.基于此,本发明的目的之一在于提供一种用于检测hcv 1型ns3耐药突变基因的检测方法,可在低浓度样本中扩增得到有效覆盖了hcv 1型ns3基因耐药突变位点的目的片段,从而可以在低浓度样本中实现耐药突变位点全面检测,为全面分析hcv 1型的耐药情况提供依据。
4.实现上述目的的技术方案如下:
5.一种hcv 1型耐药突变基因的检测方法,包括如下步骤:
6.(1)获取待测hcv rna样品;
7.(2)以待测样本的rna为模板,采用扩增引物组进行两次rt
‑
pcr扩增;
8.(3)回收步骤(1)的产物,测序后进行耐药性分析。
9.在其中一些实施例中,上述耐药性分析为测序结果与hcv1型参考株的序列进行比对,确认耐药相关突变位点是否发生变异。
10.在其中一些实施例中,上述耐药相关突变位点为第36位的缬氨酸、第41位的谷氨酰胺、第43位的苯丙氨酸、第54位的苏氨酸、第55位的缬氨酸、第56位的酪氨酸、第80位的谷氨酰胺、第122位的丝氨酸、第155位的精氨酸、第156位的丙氨酸、第158位的缬氨酸、第168位的天冬氨酸、第170位的异亮氨酸/缬氨酸和第175位的亮氨酸/甲硫氨酸中的至少一种。
11.在其中一些实施例中,上述hcv1型参考株为nc_004102和/或aj238799.1。
12.在其中一些实施例中,上述扩增引物组包括至少一对外引物和至少一对内引物;所述外引物对的序列如seq id no.1
‑
seqid no.2所示,所述内引物对序列如seq id no.3
‑
seq id no.4所示。
13.在其中一些实施例中,上述扩增引物组包括至少一对外引物和至少一对内引物;所述外引物对的序列如seq id no.5
‑
seqid no.6所示,所述内引物对序列如seq id no.7
‑
seqid no.8所示。
14.在其中一些实施例中,上述扩增引物组包括至少一对外引物和至少一对内引物;所述外引物对的序列如seq id no.1
‑
seqid no.2和seq id no.5
‑
seqid no.6所示,所述内引物对序列如seq id no.3
‑
seq id no.4和seq id no.7
‑
seqid no.8所示。
15.本发明的目的之一还在于提供一种用于检测hcv 1a亚型ns3耐药突变基因的扩增引物组。
16.实现上述目的的具体技术方案如下:
17.一种用于检测hcv 1a亚型ns3耐药突变基因的扩增引物组,所述扩增引物组包括一对外引物和一对内引物;所述外引物对的序列为seq id no.1
‑
seqid no.2所示的反向互补序列,所述内引物对的序列为seq id no.3
‑
seq id no.4所示的反向互补序列;或所述外引物对的序列如seq id no.1
‑
seqid no.2所示,所述内引物对的序列如seq id no.3
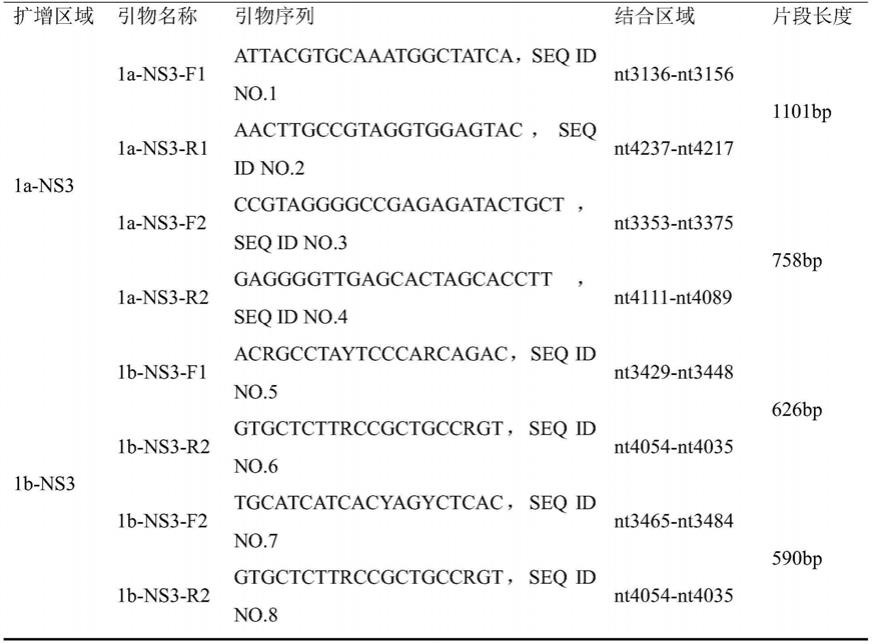
‑
seq id no.4所示的反向互补序列。
18.一种用于检测hcv 1a亚型ns3耐药突变基因的扩增引物组,所述扩增引物组包括一对外引物和一对内引物;所述外引物对的序列为seq id no.1
‑
seqid no.2所示的反向互补序列,所述内引物对的序列为seq id no.3
‑
seq id no.4所示的反向互补序列;或所述外引物对的序列如seq id no.1
‑
seqid no.2所示,所述内引物对的序列如seq id no.3
‑
seq id no.4所示的反向互补序列。
19.本发明的目的之一还在于提供一种用于检测hcv 1b亚型ns3耐药突变基因的扩增引物组。
20.实现上述目的的具体技术方案如下:
21.一种用于检测hcv 1b亚型ns3耐药突变基因的扩增引物组,所述扩增引物组包括一对外引物和一对内引物;所述外引物对的序列如seq id no.5
‑
seqid no.6所示,所述内引物对序列如seq id no.7
‑
seq id no.8所示;或所述外引物对的序列为seq id no.5
‑
seqid no.6所示的反向互补序列,所述内引物对序列如seq id no.7
‑
seq id no.8所示。
22.一种用于检测hcv 1b亚型ns3耐药突变基因的扩增引物组,所述扩增引物组包括一对外引物和一对内引物;所述外引物对的序列为seq id no.5
‑
seqid no.6所示的反向互补序列,所述内引物对的序列为seq id no.7
‑
seq id no.8所示的反向互补序列;或所述外引物对的序列如seq id no.5
‑
seqid no.6所示,所述内引物对的序列如seq id no.7
‑
seq id no.8所示的反向互补序列。
23.本发明的目的之一还在于提供一种上述扩增引物组在制备用于检测hcv 1型耐药突变基因试剂中的应用。
24.本发明的目的之一还在于提供一种用于检测hcv 1型耐药突变基因的试剂盒。
25.实现上述目的的技术方案如下:
26.一种用于检测hcv 1型耐药突变基因的试剂盒,包括上述扩增引物组。
27.与现有技术相比,本发明具有以下有益效果:
28.本发明的发明人针对1型hcv的ns3区域序列巧妙地设计了一系列特异性扩增引物组,使用该扩增引物组进行pcr扩增等检测分析时,可确保低浓度样本(病毒rna浓度高于1.00e+04iu/ml)中hcv基因1a、1b两个亚型扩增成功率100%,并获取更长的目的片段,从而有效保证ns3区域耐药相关突变位点的覆盖率。本发明有利于对低hcv rna浓度的样品进行
多个耐药突变位点全面检测,灵敏度高。从而可用于辅助分析研究1型hcv基因的耐药突变情况,为后续1型hcv患者用药方案研究提供参考。
附图说明
29.图1为实施例2有效性实验时,对20例hcv分型结果为1a亚型阳性样本rt
‑
pcr扩增产物电泳检测结果图。
30.图2为实施例2有效性实验时,对图1中5例不满足测序要求的hcv 1a亚型阳性样本进行巢式pcr扩增后电泳检测结果图。
31.图3为实施例2有效性实验时,对94例hcv分型结果为1b亚型阳性样本rt
‑
pcr扩增产物电泳检测结果图。
32.图4为实施例2有效性实验时,对图3中26例不满足测序要求的hcv 1b亚型阳性样本进行巢式pcr扩增后电泳检测结果图。
33.图5为实施例3重复性实验时,对20例hcv分型结果为1a亚型阳性样本rt
‑
pcr扩增反应电泳图。
34.图6为实施例3重复性实验时,对图5中5例不满足测序要求的hcv 1a亚型阳性样本进行巢式pcr扩增后电泳检测结果图。
35.图7为实施例3重复性检测中由技术员谭思敏完成的46例hcv 1b亚型样本rt
‑
pcr扩增反应电泳图,其中左侧电泳图使用扩增仪:jy100,右侧电泳图使用扩增仪:jy08。
36.图8为实施例3重复性检测中由技术员谭思敏完成的对图7中19例不满足测序要求的hcv 1b亚型样本巢式扩增反应电泳图。
37.图9为实施例3重复性检测中由技术员周丽珍完成的46例hcv 1b亚型样本rt
‑
pcr扩增反应电泳图,其中左侧电泳图使用扩增仪:jy100,右侧电泳图使用扩增仪:jy08。
38.图10为实施例3重复性检测中由技术员周丽珍完成对图9中32例不满足测序要求的hcv 1b亚型样本巢式扩增反应电泳图。
39.图11为实施例4中对10例hcv 1b亚型样本进行检出限检测的rt
‑
pcr电泳结果图。
40.图12为实施例4中针对图11中不满足测序要求的hcv 1b亚型样本进行巢式pcr电泳结果图。
具体实施方式
41.为了便于理解本发明,下面将参照实施例对本发明进行更全面的描述,以下给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。应理解,下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用试剂,均为市售产品。
42.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
43.实施例1检测方法的建立
44.材料和方法
45.1.1标本收集广州金域医学检验中心有限公司基因分型为1型(1a亚型20例,1b亚型94例)的丙肝患者的血浆样本。
46.1.2仪器和试剂
47.1.2.1仪器natch s全自动核酸提取仪(圣湘生物);cobas ampliprep/cobas taqman分析仪;biorad s1000 pcr仪(biorad);biorad pac300电泳仪(biorad);biorad凝胶成像系统(biorad);abi3730xl测序仪(life)。
48.1.2.2试剂核酸提取或纯化试剂(圣湘生物);丙型肝炎病毒核酸定量检测试剂盒(pcr
‑
荧光探针法);hiscript ii one step rt
‑
pcr kit(诺唯赞);2
×
phanta max master mix(诺唯赞);terminator v3.1cycle sequencing kit(life);扩增及测序引物信息见表1,文献(krishnan,p,et al,2017)中报道的引物信息见表2。
49.表1
‑
1扩增及测序引物信息
[0050][0051]
注:1a亚型引物结合位点均以参考株nc_004102(h77)为准,1b引物结合位点均以参考株aj238799.1(con1)为准。上述序列中y=c/t,r=a/g。
[0052]
表1
‑
2文献报道的hcv 1a/1b亚型ns3区域的引物及耐药位点
[0053][0054]
其中:y=c/t,r=a/g。
[0055]
1.2.3文献报道的耐药位点为v36,f43,t54,v56,q80,r155,a166,d168,我们检测的位点包括;v36、q41、f43、t54、v55、y56、q80、s122、r155、a156、v158、d168、i/v170、l/m175,相比之下,耐药位点的覆盖度较高;文献中每种亚型仅提供一对引物,本方案为了保证扩增的成功率,设计了一对外引物和一对内引物,提高了扩增的成功率。
[0056]
1.3实验方法
[0057]
1.3.1提取核酸和hcv rna定量:使用圣湘生物的核酸提取或纯化试剂和natch s全自动核酸提取仪进行核酸提取,并用圣湘生物丙型肝炎病毒核酸定量检测试剂盒(pcr
‑
荧光探针法)和life的abi7500实时荧光定量pcr仪定量hcv rna。
[0058]
1.3.2扩增hcv 1
‑
ns3基因片段使用诺唯赞的hiscript ii one step rt
‑
pcr kit和biorad的biorad s1000 pcr仪将hcv 1
‑
ns3基因片段通过一步法rt
‑
pcr扩增。反应体系如表1
‑
3,反应程序如表1
‑
4。
[0059]
表1
‑
3第一轮rt
‑
pcr反应体系(30μl)
[0060][0061]
表1
‑
4第一轮rt
‑
pcr反应程序
[0062][0063]
1.3.3琼脂糖凝胶电泳使用biorad的biorad pac300电泳仪对扩增的片段进行琼脂糖凝胶电泳,并用biorad凝胶成像系统进行凝胶成像。
[0064]
1.3.4巢式pcr没有达到测序要求的样品,则以第一轮扩增产物作为模板用诺唯赞的2
×
phanta max master mix和biorad的biorad s1000 pcr仪进行巢式pcr扩增,再进行琼脂糖凝胶电泳。反应体系如表1
‑
5,反应程序如表1
‑
6。
[0065]
表1
‑
5第二轮巢式pcr反应体系(30μl)
[0066][0067]
表1
‑
6第二轮巢式pcr反应
[0068][0069]
1.3.5sanger测序满足测序要求时,利用life的terminator v3.1cycle sequencing kit和abi3730xl测序仪进行sanger测序,得到的测序图谱用序列分析软件sequencher与hcv 1a亚型和1b亚型参考株序列进行比对,确认氨基酸位点是否发生变异。
[0070]
实施例2有效性验证
[0071]
取114例hcv 1型(1a亚型20例,1b亚型94例)阳性样本。按照实施1所述方法在同一批次内进行提取、进行ns3靶基因区域扩增并测序,计算检测成功率。hcv 1a亚型为95%(19/20),经复核后发现扩增失败的一例样本载量为5.18e+03iu/ml;hcv 1b亚型为98.94%(93/94),扩增失败的一例样本的ns3引物结合去可能存在突变,后续会对引物进一步优化。总体来说检测成功率在95%以上,该方法有效性良好。
[0072]
其中关于hcv 1a亚型扩增结果如图1,图2所示,本次验证共对20例hcv 1a亚型样本和2例质控样本进行检测,对结果进行统计分析显示,通过第一轮rt
‑
pcr共有15例样本扩增成功,对未达到测序要求的5例样本进行第二轮巢式pcr后均扩增成功,4例扩增成功,1例扩增仍无条带,原因可能为该样本hcv引物结合区突变有关,后续进一步对引物进行优化设计。该项目的有效率为95%(19/20)。
[0073]
关于hcv 1a亚型测序结果如表2
‑
1所示,将满足测序条件的扩增产物送检,进行sanger测序,所得序列在基因网站上分型并用sequencher5.4.6分析,结果见表4,100%(20/20)的样本测序成功。经统计,5%(1/20)样本发生了122号位的突变;20%(4/20)的样本发生了170号位的突变;从本次实验可看出,122号位和170号位的突变率相对较高,很有可能导致以这两个位点为靶点的直接抗病毒药物失效。
[0074]
表2
‑
1 1a亚型有效性验证测序分析结果
[0075][0076][0077]
注:1、数据以nc_004102(h77)基因序列为参考序列进行分析;2、次峰cutoff值按20%进行设置;3、阴性对照[neg]无扩增条带,阳性质控[hcv441
‑
pos(711810170054)]结果与预期结果一致,本批次结果有效。
[0078]
其中关于hcv 1b亚型扩增结果如图3,图4所示,本次验证共对94例hcv分型结果为1b亚型的样本进行检测,对结果进行统计分析显示,通过第一轮rt
‑
pcr共有68例样扩增成功,对未达到测序要求26例样本进行第二轮巢式pcr后有25例样本扩增成功,1例样本扩增失败。进入测序环节的93例样本均测序成功。针对1例样本扩增无条带,可能原因为该样本hcv ns3引物结合区突变导致。该项目的扩增及测序成功率为98.94%(93/94)。
[0079]
关于hcv 1b亚型测序结果如表2
‑
2所示,将满足测序条件的扩增产物送检,进行sanger测序,所得序列在基因网站上分型并用sequencher5.4.6分析,结果见表4,100%(93/93)的样本测序成功。经统计,2.2%(2/93)的样本发生了41号位的突变;3.2%(3/93)
的样本发生了54号位的突变,12.9%(12/93)样本发生了56号位的突变;4.3%(4/93)的样本发生了80号位的突变;79.6%(74/93)的样本发生了122号位的突变;1%(1/93)的样本发生了168号位的突变,52.7%(49/93)的样本发生了170号位的突变。从本次实验可看出,122号位和170号位的突变率极高,很有可能导致以这两个位点为靶点的直接抗病毒药物失效。
[0080]
表2
‑
2 1b亚型有效性验证测序分析结果
[0081]
[0082]
[0083]
[0084][0085]
实施例3重复性验证
[0086]
取20例hcv6 1a亚型阳性样本,46例hcv61b亚型阳性样本,采用实施例1所述检测方法,分别由两个实验员,在两台不同核酸提取仪上分别提取1次核酸,并加入反应体系,分别在两台不同biorad s1000扩增仪上进行扩增,然后在同一金域测序仪(序列号20141
‑
010)进行测序。100%(66/66)的样本扩增并测序成功,且100%的样本结果一致,说明该检测系统重复性好。
[0087]
关于hcv 1a亚型扩增结果如图5,图6所示,对20例hcv 1a亚型样本和2例质控样本(阳性质控hcv441
‑
pos,为已知确诊阳性临床样本配制;阴性质控neg,为常规无病原体血清)如实施例1所示进行验证,结果显示不同人员和不同仪器对检测结果的可重复性无影响,因此该项目的可重复性为100%(20/20)。其中,经复核样本hcv216(711805090087)hcv rna载量为5.18e+03iu/ml,无扩增条带,无法满足测序要求。
[0088]
关于hcv 1a亚型测序结果如表3
‑
1所示,对20例hcv 1a亚型样本和2例质控样本如图5,图6所示进行验证,结果显示不同人员和不同仪器对检测结果的可重复性无影响,因此该项目的可重复性为100%(20/20)。
[0089]
表3
‑
1重复性验证测序分析结果
[0090]
[0091]
[0092]
[0093]
[0094][0095]
关于hcv 1b亚型扩增结果如图7
‑
10所示,对46例hcv 1b亚型样本和2例质控样本进行验证,结果显示不同人员和不同仪器对检测结果的可重复性无影响,因此该项目的可重复性为100%(46/46)。
[0096]
关于hcv 1b亚型测序结果如表3
‑
2所示,从pcr产物电泳图和测序分析结果中可以看出,在不同技术人员、不同扩增仪、同一测序仪条件下,所有样本的检测结果均一致。因此,该项目的可重复性为100%(46/46)。
[0097]
表3
‑
2 hcv 1b亚型测序结果
[0098]
[0099]
[0100]
[0101]
[0102]
[0103]
[0104][0105]
实施例4最低检出限的检测
[0106]
本次验证实验共对10例hcv 1b亚型样本进行梯度稀释后进行检测,检测结果如图11,图12和表4
‑
1所示,显示病毒载量在1.00e+04iu/ml以上的样本,通过一次/两次扩增即可满足测序要求,1.00e+03iu/ml以上的样本,除1例样本外,其余样本均在第二轮扩增后达到测序要求。因此,将该项目的最低检出限暂定为1.00e+04iu/ml。
[0107]
表4
‑
1最低检出限电泳结果
[0108]
[0109][0110]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0111]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1