研究淡水超微真核藻群落结构多样性的固定方法
1.本发明涉及一种研究淡水超微真核藻群落结构多样性的固定方法,属于环境科学超微真核藻细胞数和群落结构监测和研究技术领域。
背景技术:
2.超微藻由于其细胞微小,许多类群缺乏明显的形态学特征,利用传统的显微镜观察法难以区分鉴别;直到21世纪初,分子生物学的迅速发展,才使得人们对超微藻多样性有了进一步的认识。根据细胞结构,超微藻可分为原核超微藻和真核超微藻。超微型真核藻并不是指系统进化阶元上的某一分类类群,而是代表粒径小于3 μm的所有真核浮游藻类的总称,因此它的物种组成十分复杂,多样性极高,可能是地球上数量最多的真核生物,淡水中的超微型真核藻直到近几年才受到广泛关注,对其的认识还十分有限。通过流式细胞术结合18s的rrna基因高通量测序是现有的研究超微真核藻多样性的最好方法。超微藻样品采集后通常需要立即进行测定,一般情况下,样品采集后为防止细胞荧光信号消失或者自溶应当立即进行分析。因为室温条件下温度变化较为频繁,且细胞处于该环境中仍会继续进行细胞代谢,导致代谢产物堆积甚至酸中毒,代谢紊乱,造成死亡,进而被微生物所分解,最终致使结果偏差较大。故应该即采即测,如若无法即刻处理则应进行固定处理,即刻中止或抑制细胞代谢,从而保证样品极大程度上处于最初的采集状态,减小测定误差。超微真核藻样品的保存,一方面要求保持藻的自发荧光,另一方面还要保证藻在低温下的细胞完整。
3.国内外有关超微藻等浮游藻类固定方法的研究颇多,目前常见的浮游藻类固定剂有lugol试剂、福尔马林(含甲醇)、乙醇、戊二醛、甲醛等,但是不同的固定方法对藻类荧光及dna的影响不同。其中大多数常用试剂会对超微藻细胞的荧光信号或者细胞形态造成重大影响,如有lugol试剂、福尔马林(含甲醇)、乙醇等,因此不能将其用作超微藻样品的固定。不少研究学者发现醛类溶液,如甲醛、戊二醛等,能较大程度上保持细胞形态结构以及细胞器的完整性,但对藻细胞的荧光信号仍有影响。特别是通常只研究了这些固定方法对超微藻荧光特性的影响,并未进一步探索样品固定对超微真核藻群落结构的影响,即与新鲜样品的差异性。截至目前,尚缺乏能保持超微真核藻初始群落结构特征的样品固定方法。
技术实现要素:
4.发明目的:针对上述现有存在的问题和不足,本发明的目的是提供一种研究淡水超微真核藻群落结构多样性的固定方法,不仅能保持超微真核藻丰度一致,更能维持超微真核群落多样性和群落结构稳定,并且适用于各湖泊样品。
5.技术方案:为实现上述发明目的,本发明采用以下技术方案:一种研究淡水超微真核藻群落结构多样性的固定方法,包括如下步骤:步骤1:按区域将水体划分为上、中和下游三个采样区域,且分别对每个区域分为上中下层的水样,等分区域并设置采样点,在不同采样点通过采水器每隔两小时取样一次,并将所有采集的水体混合,得到待固定水样;
步骤2:将步骤1获得的待固定水样置于离心管中,加入体积占比为0.01%
‑
0.05%的泊洛沙姆溶液作为固定剂,进行混匀并静置,得到混合样品;步骤3:将步骤2中得到的混合样品置于液氮中进行速冻;步骤4:将速冻好的混合样品拿出,放入超低温冰箱冷藏,得到保藏样品;步骤5:拿出保藏样品解冻,得到固定后样品。
6.进一步的,所述步骤2中加入的泊洛沙姆的体积占比为0.01%。
7.进一步的,所述步骤3中的液氮速冻温度为
‑
200~
‑
100℃,所述步骤4中的超低温冰箱冷藏的温度为
‑
90~
‑
70℃。
8.进一步的,所述步骤3中的液氮速冻温度为
‑
196℃,所述步骤4中的超低温冰箱冷藏的温度为
‑
80℃。
9.进一步的,将步骤5得到的固定后样品,提取dna后,再使用磁珠法浓缩,磁珠法具体步骤为:将磁珠液和磁珠加入解冻后的保藏样品中获得混合溶液并孵育,dna结合到磁珠上,待混合溶液澄清后移除上清液,加入无核酸酶水,静置后得到浓缩,得到浓缩dna。
10.进一步的,所述磁珠法中磁珠液使用前提前取出,静置至室温,充分混匀后将磁珠液加入解冻后的保藏样品中,使用移液器吸打混匀,将保藏样品置于磁力架上,通过室温孵育将保藏样品中dna结合至磁珠上,移去上清液后,加入100~300 μl新鲜配制的80%乙醇漂洗磁珠,再室温孵育并移去上清液,保藏样品仍置于磁力架上,重复漂洗步骤1~2次,在室温下干燥5~10min,将处理后的保藏样品取下,加入无核酸酶水,混合均匀后静置吸取上清液。
11.有益效果:与现有技术相比,本发明具有以下优点:这是一种新式的研究淡水超微真核藻群落结构多样性的固定方法,维持超微真核群落多样性和群落结构稳定的前提下,适应性强,适用于各个湖泊样品,具有良好的发展利用前景。
附图说明
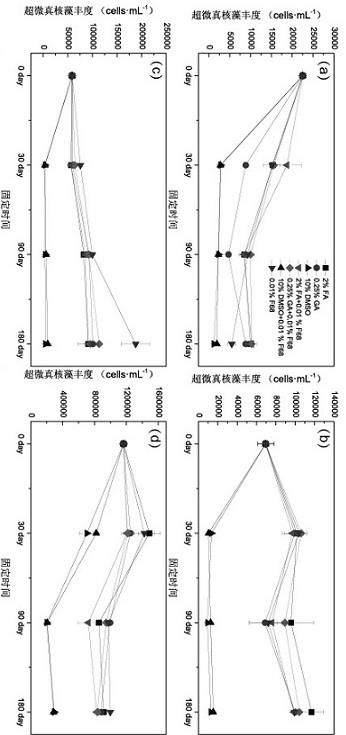
12.图1是本发明的超微藻在流式细胞仪散点图中的分布影像图;图2是本发明的不同固定方法下超微真核藻丰度变化图,图中,(a)为玄武湖,(b)为巢湖,(c)为小池塘,(d)为纯培养麦克属;fa为甲醛,ga为戊二醛,dmso为二甲基亚砜,f68为泊洛沙姆;图3本发明的不同固定方法下超微真核藻shannon变化图,图中(a)为玄武湖,(b)为巢湖,(c)为小池塘;fa为甲醛,ga为戊二醛,dmso为二甲基亚砜,f68为泊洛沙姆;图4本发明的不同固定方法下超微真核藻群落与初始群落的bray
‑
curtis距离,图中,(a)为玄武湖,(b)为巢湖,(c)为小池塘;fa为甲醛,ga为戊二醛,dmso为二甲基亚砜,f68为泊洛沙姆;图5本发明的超微真核藻群落nmds点位图,图中,(a)为玄武湖,(b)为巢湖,(c)为小池塘点位形状代表固定时间,点位颜色代表固定方法。
具体实施方式
13.下面结合附图和具体实施例,进一步阐明本发明,应理解这些实施例仅用于说明
本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本技术所附权利要求所限定的范围。
实施例
14.(1)选取巢湖、玄武湖、景观小池塘水样作为野外样品进行试验,选用纯的麦可属藻(mychonastes homosphaera)作为超微真核藻的对照;(2)利用有机玻璃采水器采集各水域水体,将水样均匀混合后装瓶;(3)往水样里添加体积占比为0.01%的泊洛沙姆,置于15ml无菌离心管中,混匀室温避光静置15min后将样品液氮速冻并于
‑
80℃冷冻保存。
15.(4)固定时间设置:以新鲜水样为对照,设定30天,90天,180天3个保存时间。
16.(5)流式细胞仪分选样品:将速冻样品室温自然溶解。流式细胞仪的设置条件如下:根据超微藻的自发叶绿素荧光差异,选择荧光fl3和fl5通道(激发波长为 488 nm和640 nm)叶绿素荧光;根据超微藻细胞个体大小,设定侧向散射光(fsc),采用 3.1μm nile(spherotm urfp
‑
30
‑
2,spherotech,ca,usa)小球溶液圈定3μm以内测量区域。将待测样品混匀后先用300目的筛绢预过滤,而后以低速率 200
‑
300 cells
•
s
‑
1进样。
17.根据所圈定的范围,得到超微藻类群的流式细胞仪影像结果如图1所示,采用富集模式(enrichment model)将 ppes 以及pcy细胞分选到 eppendorf 离心管中,每个时间段的样品根据流式细胞仪计数的浓度分选至相同数目,置于
‑
20℃保存,用于后续dna提取。
18.(6)分选样品dna提取、pcr及高通量测序利用dneasy blood & tissue kit 试剂盒(qiagen)提取样品dna。
19.流式分选藻细胞dna浓度低,需要用磁珠法对dna进行浓缩,将磁珠液提前30 min从2 ~ 8℃取出,静置使其温度平衡至室温。颠倒或旋涡振荡使磁珠液充分混匀,吸取一定体积(具体根据样品情况而定,可参考dna纯化参考条件)磁珠液加入dna样品中,使用移液器轻轻吸打10次充分混匀。室温孵育10 min,使dna结合到磁珠上。将样品置于磁力架上,待溶液澄清后(约5 min),小心移除上清。保持样品始终处于磁力架上,加入200 μl新鲜配制的80%乙醇漂洗磁珠,室温孵育30 sec,小心移除上清。重复步骤5一次,总计漂洗二次。保持样品始终处于磁力架上,室温下开盖干燥磁珠约5
ꢀ‑ꢀ
10 min。将样品从磁力架上取出,加入适量无核酸酶水,涡旋振荡或使用移液器吹打充分混匀,室温静置2 min。在磁力架上静置5 min待溶液澄清后,小心吸取上清至一个新的无核酸酶离心管中。浓缩后,dna浓度从0.6
‑
1.6 ng/
µ
l上升到 3
‑
10 ng/
µ
l。
20.流式分选藻细胞dna浓度低,需要用磁珠法对dna进行浓缩,具体操作按照vahts
® dna clean beads(vazyme)说明书操作。
21.采用真核通用引物对ek
‑
nsf573:5'
‑
cgcggtaattccagctcca
‑
3',ek
‑
nsr951: 5'
‑
ttggyraatgctttcgc
‑
3',对检测区域18s rrna v4区进行高保真pcr扩增25个循环。设置3个重复实验,同时以标准的细菌/细菌基因组dna mix作为阳性对照。随后将同一样本的3个平行扩增产物混合,加入等体积的核酸纯化磁珠agencourtampure xp(beckman)进行纯化。各样本添加特异性标签序列(多个样品混合测序时为了能区分样品而引入的一段标示其样本来源信息的序列)后,对文库进行定量、混合和质量检测,随后采用illumina miseq高通量测序平台,2
×
250 bp的双端测序策略对文库进行测序。
22.(7)高通量测序数据处理和数据分析测序所得原始序列的质量控制以及聚类过程如下:a.使用trimgalore软件去除末端质量低于20的序列、去除adapter序列以及长度小于100的序列;b.使用flash2软件进行双端合并,得到有效序列;c.使用mothur v.1.39.3软件去除序列两端引物;d.使用usearch软件去除总碱基错误率大于2以及长度小于100 bp的序列;e.使用uparse软件去除singleton序列和chimera序列,将序列按照97%的相似度聚类到不同的otus(operational taxonomic units)中,最后根据silva数据库对聚类后的otus进行注释。
23.利用r 3.3.2(http://cran.r
‑
project.org)对获得的otus 进行相关统计分析,首先利用重抽后的样本计算样品的多样性指数;利用vegan包基于bray
‑
curtis 距离进行nmds分析群落特征,并使用anosim 进行差异显著性分析;利用r包edger和pheatmap探究测序样品中不同类群微生物对固定方法的响应(p<0.001)。超微藻固定样品中的差异显著的相关统计分析(如多样性差异,藻密度差异以及相对丰度差异等)实施例所得结果:(1)固定方法对超微藻丰度的影响如图2所示,不同固定方法与固定时间对流式细胞仪分选超微真核藻丰度存在影响。在玄武湖中,随着固定时间的延长,超微真核藻的丰度显著降低(p<0.05)。10% dmso和10% dmso+0.01%f68这两种固定方法的超微真核藻丰度显著低于其他方法(p<0.05),而2%甲醛、2%甲醛+0.01%f68、0.25%戊二醛+0.01%f68这三种固定方法的超微真核藻丰度显著高于其他方法(p<0.05),其中2%甲醛+0.01%f68在固定30天后没有明显下降(p<0.05)。在巢湖中,不同固定方法随着固定时间的延长,超微真核藻的丰度变化趋势不同。10% dmso和10% dmso+0.01%f68这两种固定方法的超微真核藻丰度显著降低(p<0.05),在固定30天时,超微真核藻丰度极低。其余四种固定方法,超微真核藻显著增加,彼此之间丰度差异不显著(p>0.05)。在小池塘中,10% dmso和10% dmso+0.01%f68这两种固定方法的超微真核藻丰度依旧迅速降低(p<0.05),除0.01%f68在固定180天后超微真核藻显著增加外,其余固定方法随固定时间的增加,超微真核藻丰度并没有显著变化。对于纯培养体系中的麦克属而言,10% dmso和10% dmso+0.01%f68这两种固定方法的藻丰度显著降低(p<0.05),尤其是固定90天时,麦可属的丰度极低。而2%甲醛和0.01%f68这两种固定方法的麦可属的丰度出现先增加后减少的趋势,0.25%戊二醛、2%甲醛+0.01%f68和0.25%戊二醛+0.01%f68这三种固定方法随着固定时间的延长,丰度略有下降但是与初始藻丰度差异不明显(p>0.05)。
24.(2)固定方法对超微真核藻群落结构的影响我们将不同固定方法处理下的样品提取dna后进行高通量测序,除10% dmso 和10% dmso+0.01% f68这两种方法因为杂质信号干扰严重导致流式细胞仪无法分选超微藻细胞外,其余样品均测序成功。
25.如图3所示,不同固定方法与固定时间对超微真核藻α多样性存在影响。在玄武湖中,2%甲醛和2%甲醛+0.01%f68的超微真核藻α多样性随着固定时间的延长,并没有显著差异(p>0.05)。0.25%戊二醛和0.25%戊二醛+0.01%f68的超微真核藻α多样性与初始样品相比存在上下波动,而0.01%f68的超微真核藻α多样性显著高于初始样品。对于巢湖样品而言,各种固定方法的超微真核藻α多样性要显著高于初始样品。其中,2%甲醛组的超微真核
藻α多样性在固定30天时就显著增加,而后随固定时间的增加没有显著变化(p>0.05)。0.25%戊二醛+0.01%f68和0.01%f68在固定30天时超微真核藻α多样性仍没有发生显著变化(p>0.05),但随着时间延长其α多样性发生显著变化(p<0.05)。对于小池塘而言,各种固定方法的α多样性于30天时显著下降(p<0.05),而后又显著上升(p<0.05)。相较于其他方法,0.01%f68的α多样性下降趋势要显著小于其他方法(p<0.05)。
26.bray
‑
curtis距离是主要基于otus的计数统计比较两个群落微生物的组成差异,如图4所示,用bray
‑
curtis距离来衡量不同固定方法的超微真核藻群落组成与初始超微真核藻组成的差异。在玄武湖中,除0.25%戊二醛+0.01%f68在固定30天的bray
‑
curtis距离外,0.01% f68的bray
‑
curtis距离显著小于其它固定方法。在巢湖和小池塘中,0.01%f68这种固定方法的bray
‑
curtis距离也显著小于其它固定方法。
27.如图5所示,利用基于 bray
‑
curtis 距离的nmds分析,在otu水平上比较不同固定方法下超微真核藻的群落变化趋势。在各个湖区样品中,0.01%f68组的超微真核藻群落与初始群落点位相近,群落结构相似。此外,除玄武湖中采用0.25%戊二醛+0.01%f68固定30天的样品外,其余各个湖区样品的群落结构与初始群落结构距离较远,结构差异明显。除玄武湖外,非0.01%f68固定的样品按固定时间的不同,分别划分为30天,90天,180天三个结构类群。为了验证这种类群划分的准确性,我们利用anosim分析进行验证。各个湖泊中,新鲜样品和0.01%f68固定的超微真核藻群落结构不存在显著差异(玄武湖:p=0.138;巢湖:p=0.369;小池塘:p=0.407),这两者与其他固定方法的群落结构差异显著(玄武湖:p<0.001;巢湖:p<0.001;小池塘:p<0.001)。在玄武湖中,超微真核藻群落结构随固定时间的变化差异不显著(p>0.05)。在巢湖和小池塘中,非0.01%f68固定的样品超微真核藻群落结构随固定时间的变化差异显著(p<0.05)。
28.由此可知,超微真核藻经不同方法固定后,其群落结构变化存在差异。与其他固定方法相比,0.01%f68不仅能保持超微真核藻丰度一致,更能维持超微真核群落多样性和群落结构稳定,并且适用于各个湖泊样品。因此,使用0.01%f68固定是超微真核藻多样性研究中最有效的固定方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1