具有提高的乳酸产生能力的重组耐酸酵母的制作方法
1.本发明涉及一种具有提高的乳酸产生能力的重组耐酸酵母及使用其制备乳酸的方法。更具体地,本发明涉及其中在编码丙酮酸脱羧酶的基因已被缺失的位点上引入特定的、细菌来源的乳酸脱氢酶基因的重组耐酸酵母,以及使用该重组耐酸酵母制备乳酸的方法。
背景技术:
2.聚乳酸(pla)是可生物降解的聚合物,其通过将乳酸转化为丙交酯并在其上进行开环聚合反应来制备。聚乳酸的原料,乳酸,是通过发酵生产的。pla广泛用于一次性食品容器中,其优点在于,它能够被单独使用或以塑料中的组合物或共聚物的形式用于各种行业,包括汽车行业和纤维行业。此外,它是近年来用于3d打印的聚合物的代表性实例,并且是用于3d打印机时产生较低量的有害气体和气味的环保聚合物。
3.传统的乳酸生产工艺是使用乳酸细菌(lactic acid bacteria)进行的,并包括在使用各种形式的ca盐/ma盐或中和剂例如氨来保持6至8的中性ph 的同时进行发酵,以防止由于乳酸细菌产生和积累的乳酸而导致的细菌死亡或其生长减慢。当发酵完成时,分离微生物,并添加硫酸以将乳酸盐(lactate)转化为乳酸,同时由于难以从水中分离盐并将乳酸转化为丙交酯,以caso4的形式除去ca盐。在该方法中,产生的副产物caso4的量大于乳酸的量,从而降低了工艺效率。
4.通常,pla通过发酵产生乳酸,然后通过纯化工艺将产生的乳酸转化为丙交酯。为了转化为丙交酯,需要将乳酸转化为氢化形式的工艺,而中性发酵的ph通常为6至7,因此使用大量的硫酸将中性ph改变为酸性 ph。在该过程中,产生大量的中和盐,并且由于中和盐的价值低以及去除该中和盐的工艺的投资成本,经济可行性降低。
5.同时,乳酸具有l型光学异构体和d型光学异构体。存在各种各样的微生物种群。例如,主要产生l型光学异构体的乳酸细菌通常也产生约 5
‑
10%的d型光学异构体,主要产生d型光学异构体的菌株包括产生d型光学异构体和l型光学异构体两者的菌株,产生d型光学异构体和乙醇两者的菌株等(ellen i.garvie,microbiological reviews,106
‑
139,1980)。
6.同时,就天然产生乳酸的乳酸杆菌(lactobacillus)而言,为了商业化地生产乳酸,必须使用大量昂贵的营养物作为培养基。这些过多的营养成分极大地阻碍了下游聚合工艺或当丙交酯用作中间体时进行的丙交酯转化工艺,为了获得高产量(yield)和高纯度的聚合物或其前体,产生了例如吸附、蒸馏和离子交换的纯化工艺的成本,从而进一步增加了生产成本。为了解决这些问题,已经提出了使用酵母的研究。众所周知,即使使用廉价的营养物,酵母也可以进行生长/发酵,并且还具有高的耐酸性。
7.当使用在酸中生长良好的酵母(以下称为“耐酸酵母”)生产乳酸时,在发酵期间无需使用中和剂将培养基的ph维持在6至7,因此简化了发酵工艺,并且不需要用于去除中和剂的下游纯化工艺。此外,酵母本身会产生代谢所需的许多成分,因此与细菌(尤其是乳酸
杆菌)相比,可以在营养水平相对较低的培养基中进行培养,从而避免了下游的纯化工艺,并大大降低了生产成本。
8.然而,使用酵母生产乳酸对技术是有要求的。要求是,作为菌株发酵性能指标的乳酸的产量(yield)、生产率(productivity)和浓度必须保持在与乳酸细菌的性能相似的高水平,才能使该技术能够被商业化应用。
9.尽管已开发出使用耐酸酵母生产乳酸的技术,但在实践中,在很多情况下,通过在发酵期间进行中和反应,只有当ph值保持为至少3.7(不低于乳酸的pka值)的情况下进行发酵,才能表现出较高的发酵性能,因此,将该技术确定为实现耐酸性的实用方法是不合理的,并且很难预期降低工艺中的生产成本的效果(michael sauer et al.,biotechnology and geneticengineering reviews,27:229
‑
256,2010)。
10.因此,能够降低工艺成本的耐酸酵母只有在其能够在发酵溶液的ph 值不超过pka值的情况下完成发酵而不使用中和剂或以最小量使用中和剂,并且三个主要发酵指标达到了与乳酸细菌相似的水平时,才能被商业应用。
11.通常,当发酵葡萄糖时,酵母产生的乙醇为主要产物,副产物为甘油,几乎不产生任何乳酸。另外,由于从具有高耐酸性的微生物中选择产生乳酸的菌株的可能性非常低,因此,本发明人选择了具有优异的耐酸性的酵母菌株,并试图通过基因工程方法构建一种被赋予乳酸产生能力并且乙醇和甘油产生能力受到抑制的菌株。
12.因此,作为大力生产具有强耐酸性同时表现出与细菌菌株相似的乳酸产生能力(乳酸产生速率和浓度)以及产生副产物乙醇和甘油的能力降低的酵母菌株的结果,本发明人发现,由于通过在耐酸酵母中编码丙酮酸转化酶(pyruvate conversion enzyme)的基因位置引入源自表皮葡萄球菌 (s.epidermidis)的乳酸脱氢酶基因而增加了乳酸脱氢酶的活性,乳酸产量得到了提高,基于这一发现,完成了本发明。
技术实现要素:
13.因此,鉴于上述问题而提出了本发明,并且本发明的一个目的是提供一种具有增加的乳酸产生速率(production rate)和增加的乳酸浓度的重组菌株,该重组菌株是通过将增强的对高浓度乳酸的耐受性赋予具有乳酸产生能力的重组耐酸酵母菌株构建而成的。
14.本发明的另一个目的是使用适应性进化的方法提供一种生产具有乳酸产生能力和增强的乳酸耐受性(lactic
‑
acid resistance)的重组酵母菌株的方法。
15.本发明的另一个目的是提供一种通过该方法生产的、在高浓度的乳酸培养基中具有提高的乳酸产生能力的重组酵母菌株。
16.根据本发明的一个方面,上述和其他目的可以通过提供一种具有乳酸产生能力的重组菌株来实现,该重组菌株通过从耐酸酵母ybc菌株 (kctc13508bp)中缺失编码丙酮酸脱羧酶的基因,并在编码丙酮酸脱羧酶的基因的位置引入编码源自表皮葡萄球菌(staphylococcus epidermidis) 的乳酸脱氢酶的基因构建而成。
17.根据本发明的另一个方面,提供了一种具有乳酸产生能力的重组菌株,该重组菌株通过从耐酸酵母ybc菌株(kctc13508bp)中缺失编码将磷酸二羟丙酮转化为甘油
‑3‑
磷酸的酶的gpd1基因、编码将乳酸盐(lactate) 转化为丙酮酸盐(pyruvate)的酶的cyb2基因、编码醇脱氢酶的adh基因和编码丙酮酸脱羧酶的pdc基因,并将编码乳酸脱氢酶的基因引入
至耐酸酵母ybc菌株构建而成;
18.其中该编码乳酸脱氢酶的基因被引入缺失的adh基因的位置、缺失的pdc基因的位置和缺失的gpd1基因的位置处,并且
19.在pdc基因的位置处引入的编码乳酸脱氢酶的基因是编码源自表皮葡萄球菌的乳酸脱氢酶的基因。
20.根据本发明的另一个方面,提供了一种生产具有提高的乳酸耐受性和提高的乳酸产生能力的重组菌株的方法,该方法包括:(a)通过从在低浓度乳酸培养基中到在高浓度乳酸培养基中循序地培养具有乳酸产生能力的重组酵母菌株,来诱导该重组酵母菌株向高乳酸浓度的适应性进化; (b)选择在该高浓度乳酸培养基中具有提高的乳酸产生能力的重组酵母菌株;以及(c)在所选菌株的基因组的pdc基因的位置处引入编码源自表皮葡萄球菌的乳酸脱氢酶的基因。
21.根据本发明的另一个方面,提供了重组菌株#26
‑
5(登记号:kctc 14215bp),其通过具有乳酸产生能力的重组菌株在高乳酸浓度下的适应性进化构建而成,该具有乳酸产生能力的重组菌株通过从耐酸酵母ybc 菌株(kctc13508bp)中缺失gpd1基因(其编码将磷酸二羟丙酮 (dihydroxyacetone phosphate)转化为甘油
‑3‑
磷酸(glycerol
‑3‑
phosphate)的酶)、cyb2基因(其编码将乳酸盐转化为丙酮酸盐的酶)、adh基因(其编码醇脱氢酶(alcohol dehydrogenase))和pdc基因(其编码丙酮酸脱羧酶),并将编码乳酸脱氢酶的基因引入耐酸酵母ybc菌株构建而成。
22.根据本发明的另一个方面,提供了一种重组酵母ybc6菌株,该重组酵母ybc6菌株通过在重组菌株#26
‑
5(登记号:kctc 14215bp)的基因组的pdc基因的位置处引入编码源自表皮葡萄球菌的乳酸脱氢酶的基因构建而成,其中与ybc菌株(kctc13508bp)或ybc5菌株相比,该重组酵母 ybc6菌株具有在高乳酸浓度下提高的乳酸产生能力和减少的乙醇和甘油的产生能力。
23.根据本发明的另一个方面,提供了一种生产乳酸的方法,其包括:(a) 培养该菌株以产生乳酸;和(b)收集产生的乳酸。
24.本发明的效果
25.当使用根据本发明的重组耐酸酵母生产乳酸时,可以使用比常规细菌发酵情况下显著更少量的中和剂以与细菌发酵相似的乳酸产生能力进行乳酸发酵,因此发酵成本可以大大降低。此外,可以减少副产物乙醇和甘油的产生,因此可以降低后续纯化工艺的成本。
附图说明
26.从以下结合附图的详细描述中,将更清楚地理解本发明的上述和其他目的、特征和其他优点,其中:
27.图1为说明根据本发明的ybc5菌株在各种乳酸浓度下强制诱导适应以增加对乳酸的耐受性的过程的示意图,具体地,图1(a)示出了在第二轮适应性进化中传代培养期间细胞的生长,以确保在乳酸浓度适应过程中菌株#26
‑
5被选择,图1(b)示出了在第三轮适应性进化中传代培养期间,细胞在70g/l至80g/l乳酸浓度下的生长,以进一步提高对乳酸的耐受性。
28.图2示出了菌株#26
‑
1和菌株#26
‑
5之间的乳酸生产曲线的比较结果,它们是在根
据本发明的第二轮适应性进化中选择的两个菌株,#26菌株是在第一轮适应性进化中选择的。
29.图3示出了菌株#26
‑
5的发酵曲线,其选自通过根据本发明的ybc5菌株的适应性进化而被赋予提高的乳酸耐受性的菌落(colony);
30.图4示出了根据本发明的菌株#26
‑
5与菌株ybc5之间的发酵曲线的比较结果;
31.图5示出了用于从菌株#26
‑
5的基因组中缺失pdc1(g3002
‑
1)基因的盒(cassete)的实例,该菌株是ybc菌株、ybc1菌株和ybc5菌株的改良变体,用于在相应基因被缺失的位置处插入ldh基因,或者用于将已经插入的ldh基因与另一个ldh基因交换;
32.图6示出了ybc6的发酵曲线,其为通过将源自表皮葡萄球菌的ldh 引入#26
‑
5菌株构建而成的菌株,该菌株选自通过根据本发明的ybc5菌株的适应性进化而被赋予提高的乳酸耐受性的菌群(strain flora);
33.图7示出了根据本发明的ybc5菌株、#26
‑
5菌株和ybc6菌株在发酵过程中的乳酸产生能力的比较结果。
具体实施方式
34.除非另外定义,否则本说明书中使用的所有技术术语和科学术语具有与本发明所属领域的技术人员通常理解的相同的含义。通常,本说明书中使用的术语是本领域公知的并且是本领域中常用的。
35.耐酸酵母的特征在于,即使在酸性ph下也能以高速率消耗糖,显示出高的生长速率,并且在发酵条件下将消耗的葡萄糖转化为所需的产物。在本发明人先前的研究中,从几个酵母文库中具有这些特征的酵母中选择耐酸酵母菌株(kctc13508bp),耐酸酵母菌株(kctc13508bp)即使在 40g/l至80g/l的乳酸浓度下也具有高生长率和高糖消耗率(韩国专利申请第10
‑
2018
‑
0044509号)。
36.在本发明人先前的专利申请中,通过控制该耐酸酵母ybc菌株的代谢回路来提高其乳酸产生能力并抑制其乙醇产生能力,本发明人通过从如下获得的菌株中缺失编码将乳酸盐转化为丙酮酸盐的细胞色素b2酶的基因获得重组菌株:从该ybc菌株中缺失编码醇脱氢酶的基因和编码丙酮酸脱羧酶的基因,并将乳酸脱氢酶基因引入该ybc菌株。
37.此外,为了抑制构建的菌株中甘油的产生,本发明人通过从该菌株中缺失编码甘油
‑3‑
磷酸脱氢酶(其将磷酸羟基丙酮转化为甘油3
‑
磷酸)的基因来构建重组菌株。
38.在本发明中,为了恢复重组菌株的乳酸耐受性,将重组菌株在含有最高为80g/l的各种浓度的乳酸的培养基中传代培养,从中选择具有优异乳酸耐受性的菌株,并用源自表皮葡萄球菌的乳酸脱氢酶基因替换在所选菌株的pdc基因组位置处取代后的外源乳酸脱氢酶基因,以构建新的重组菌株,并发现该重组菌株具有高乳酸耐受性、高乳酸产生能力和被抑制的乙醇和甘油的产生能力。
39.因此,一方面,本发明涉及一种具有乳酸产生能力的重组菌株,该重组菌株通过从耐酸酵母ybc菌株(kctc13508bp)中缺失编码丙酮酸脱羧酶的基因并在该编码丙酮酸脱羧酶的基因的位置引入编码源自表皮葡萄球菌的乳酸脱氢酶的基因构建而成。
40.在本发明中,编码源自表皮葡萄球菌的乳酸脱氢酶的基因可以由 seq id no:1表示。
41.在本发明中,该重组菌株特征在于进一步缺失或失活了编码醇脱氢酶的基因,以及在于进一步缺失或失活了编码将磷酸二羟丙酮转化为甘油
‑3‑
磷酸的酶的基因。
42.在本发明中,该重组菌株特征在于进一步缺失或失活了编码将乳酸盐转化为丙酮酸盐的酶的基因。
43.在另一方面,本发明涉及具有乳酸产生能力的重组菌株,该重组菌株通过从耐酸酵母ybc菌株(kctc13508bp)中缺失gpd1基因(其编码将磷酸二羟丙酮转化为甘油
‑3‑
磷酸的酶)、cyb2基因(其编码将乳酸盐转化为丙酮酸盐的酶)、adh基因(其编码醇脱氢酶)以及pdc基因(其编码丙酮酸脱羧酶),并将编码乳酸脱氢酶的基因引入该耐酸酵母ybc菌株构建而成,
44.其中该编码乳酸脱氢酶的基因被引入缺失的adh基因的位置、缺失的pdc基因的位置和缺失的gpd1基因的位置处,并且
45.在缺失的pdc基因的位置处引入的该编码乳酸脱氢酶的基因是编码源自表皮葡萄球菌的乳酸脱氢酶的基因。
46.在本发明中,该编码源自表皮葡萄球菌的乳酸脱氢酶的基因由seq id no:1表示,其蛋白质序列(protein sequence)由seq id no:2表示,其中密码子的使用经调整以在耐酸ybc菌株中基因表达。
47.在本发明中,在缺失的adh基因的位置和缺失的gpd1基因的位置处引入的该编码乳酸脱氢酶的基因可以源自表皮葡萄球菌或植物乳杆菌 (lactobacillus plantarum)。
48.具有乳酸产生能力的重组菌株表现出高乳酸产量。然而,细胞内大量产生的乳酸和细胞内碳通量的巨大变化影响氧化还原平衡和细胞生长和调节机制,导致细胞生长速率和糖消耗速率(以及最终地,乳酸产生速率)降低的变化。基因工程导致乳酸耐受性降低的原因如下。传统的野生型微生物是即使在细胞外乳酸浓度高(40~80g/l)且ph为2至3(低于pka)的环境下也能生长良好的菌株。该菌株在基因工程(genetic engineering)后在细胞内主动产生乳酸,因此乳酸的产生受到细胞内产生的乳酸和从细胞外穿透细胞膜(通过传质(mass transfer))的乳酸的抑制。细胞内增加的乳酸浓度降低了细胞的ph,从而显示出抑制各种细胞内活性的效果,包括基因复制和蛋白质产生,导致降低的乳酸耐受性。
49.此外,当细胞外乳酸浓度增加或外部ph酸性更高,因此总乳酸的大部分以水合形式存在时,这种效果变得更强。为了解决重组菌株带来的问题,将菌株在目标环境中连续培养,例如适应性进化/强制进化,不断选择在适应环境的同时被修饰的细胞以提高性能(zhengming zhu et al., applied microbiology and biotechnology,102:4615
‑
4627,2018;eugenefletcher et al.,metabolic engineering 39(2017)19
‑
28,2017;christopher p long,current opinions in chemical engineering,22:209
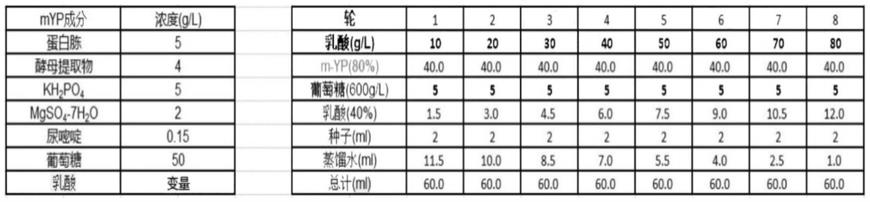
‑
215,2018)。导致突变的化合物或导致突变的物理因素(例如紫外线)可用于这种强制进化 (zhengming zhu et al.,applied microbiology and biotechnology(2018) 102:4615
‑
4627)。最初,试图应用其它方法,而不是本发明中上述的适应性进化。然而,同时增加期望的性能方面(例如,酸耐受性)和其他的性能方面(例如,生产率)的随机突变非常罕见。尽管单独监测了约100种菌株,但很难从中选择有用的菌株。考虑到需要开发能够选择优良菌落的自动化高通量系统和能够从培养并突变至108菌落/ml或更高的细胞组中检测优良菌落的基因系统(例如,与ldh表达水平成比例的荧光报告子),很难扩大进行选择的组。
50.因此,使用适应性进化方法,而不是使用突变体的方法,在高糖和高乳酸浓度下连续培养重组酵母菌株的细胞,当细胞生长良好时,乳酸浓度增加。此外,重复包括在培养的中间阶段将相应的细胞接种在含有乳酸的固体培养基上,从固体培养基中选择具有高生长速率(具有大尺寸) 的菌落,并分别用烧瓶测试菌落的乳酸产生能力的过程。选择的菌株直接与培养物的亲本菌株进行比较。当重复该操作时,能够选择具有提高的乳酸产生能力和所需的乳酸耐受性的菌株。通过基于发酵罐的培养检测到发酵性能的提高(见图7)。
51.在另一方面,本发明涉及一种生产具有提高的乳酸耐受性和提高的乳酸产生能力的重组酵母菌株的方法。该方法包括:(a)通过从在低浓度乳酸培养基中到在高浓度乳酸培养基中循序地培养具有乳酸产生能力的重组酵母菌株,来诱导该重组酵母菌株向高乳酸浓度的适应性进化;(b) 选择在该高浓度乳酸培养基中具有提高的乳酸产生能力的重组酵母菌株;以及(c)在所选菌株的基因组的pdc基因的位置处引入编码源自表皮葡萄球菌的乳酸脱氢酶的基因。
52.在本发明中,步骤(a)中具有乳酸产生能力的重组酵母菌株是通过从耐酸酵母ybc菌株(kctc13508bp)中缺失gpd1基因(其编码将磷酸二羟丙酮转化为甘油
‑3‑
磷酸的酶)、cyb2基因(其编码将乳酸盐转化为丙酮酸盐的酶)、adh基因(其编码醇脱氢酶)和pdc基因(其编码丙酮酸脱羧酶),并将编码乳酸脱氢酶的基因引入耐酸酵母ybc菌株构建而成的ybc5菌株,其中编码乳酸脱氢酶的基因被引入缺失的adh基因的位置、缺失的 pdc基因的位置和缺失的gpd1基因的位置处。
53.在另一方面,本发明涉及重组菌株#26
‑
5(登记号:kctc 14215bp),其通过具有乳酸产生能力的重组菌株在高乳酸浓度下适应性进化构建而成,该具有乳酸产生能力的重组菌株是通过从耐酸酵母ybc菌株(kctc13508bp)中缺失gpd1基因(其编码将磷酸二羟丙酮转化为甘油
‑3‑ꢀ
磷酸的酶)、cyb2基因(其编码将乳酸盐转化为丙酮酸盐的酶)、adh基因 (其编码醇脱氢酶)和pdc基因(其编码丙酮酸脱羧酶),并将编码乳酸脱氢酶的基因引入至耐酸酵母ybc菌株构建而成。
54.在另一方面,本发明涉及一种重组酵母ybc6菌株,该重组酵母ybc6 菌株通过在重组菌株#26
‑
5(登记号:kctc 14215bp)的基因组的pdc基因的位置处引入编码源自表皮葡萄球菌的乳酸脱氢酶的基因构建而成,其中该重组酵母ybc6菌株与ybc菌株(kctc13508bp)或ybc5菌株相比,具有在高乳酸浓度下提高的乳酸产生能力和被抑制的乙醇和甘油的产生能力。
55.适应性进化(adaptive evolution)是一个非常强大的工具,但是会产生副作用。在本发明中进行的适应性进化是选择适于在高浓度乳酸的存在下生长良好的菌株。在该过程中选择的适应性微生物即使在游离乳酸的浓度高时也能生长,并且获得了即使在乳酸存在下也具有针对乳酸浓度的防御机制并促进糖代谢的菌株,因为具有高乳酸产生能力的菌株在选择过程中被选中。即使当发酵培养过程中反应器中乳酸的浓度增加时,所选菌株的这一特征也可以增加反应器中微生物的浓度,并且这种高浓度的微生物可以增加总乳酸产生速率(production rate)。特别地,本发明使用的亲本菌株是在高浓度乳酸下以非常快的速度生长并且具有高葡萄糖消耗速率的菌株,这是遗传操作之前的特征。因此,适应性进化可以在通过遗传操作将碳通量从乙醇转化为乳酸的过程中,在乳酸存在的情况下,使降低的乳酸耐受性和随之降低的生长速率得以恢复。然而,从微生物的角度考虑这种适应性进
化过程,微生物必然会选择几个方向。从微生物的角度来看,在低于pka的酸性ph下,当乳酸的外部浓度增加时,未结合的水合乳酸被转移并渗透到细胞中,这降低了细胞内的ph。在这种乳酸的作用很大的状态下,在选择能够产生atp和nadh同时转化作为生长底物的糖的发酵产物(碳流)时,在进行dna复制和蛋白质生产的同时,促进生长和加速糖代谢同时提高乳酸产生性能(例如,产生速率)的进化方向,其具有与外部胁迫相同的作用,不能是自然选择的方向,但是对于生物体来说,选择一个方向是很自然的,在该方向上诱导对当前应激物的影响小于对乳酸的影响的发酵产物。此外,在本发明中使用的亲本菌株中的乳酸产生途径是从外部引入的途径,并且野生型微生物最初是在产生作为主要副产物的乙醇的同时生长的微生物,因此被加强以促进生长和增加乳酸耐受性的碳途径显然是乙醇,并且已经确定增加了乳酸产生过程的副产物乙醇。
56.为了分析适应性进化诱导的促进乳酸耐受性增加和副产物增加的遗传因素,对适应性进化前后的微生物进行了qpcr分析(转录组分析)。除了qpcr分析之外,可以对整个基因组进行分析,以检测它们之间的差异。然而,基因组中有许多基因已经被突变修饰,但事实上,只有其中一些基因是通过蛋白质表达或其调节机制作为表型出现的因子。为此,人们认为qpcr分析更适合于发现表型遗传因素,例如耐受性增加和生长速率增加。
57.为了鉴定在转录组分析中具有表达差异的基因,在所有分析的rna 序列中筛选其中与野生型菌株中的表达率相比,适应性进化菌株中表达的倍数变化(fold change)减少或增加两倍以下,或两倍以上的基因,然后使用注释分析相应的基因(见表6)。
58.在表达减少的基因库(gene pool)中,一个特定的基因是编码乳酸脱氢酶的ldh基因。如上所述,选择增加乳酸浓度、最快生长速率和乳酸产生速率(在某些情况下,最高乳酸产生浓度)的微生物,但是能够响应由乳酸引起的氧化压力或酸性ph的抑制的微生物的优选响应是减少内部产生的乳酸量。在适应性进化过程中,表达的减少在微生物中积累。当然,所选菌株也具有优异的乳酸产生能力,但这主要被认为是由于快速生长速率和细胞中糖消耗速率或糖转移速率的增加导致的微生物浓度的快速增加。认为,由于这种表达的减少,每个细胞的乳酸产生能力降低。
59.作为分析表达增加的基因库的结果,观察到执行相同功能的几个基因组(group)的表达一起增加。这些基因的分类如下。
60.a类与发酵产物有关,是一组与乙醇产生有关的基因,除了乳酸脱氢酶表达的减少之外,其目的是增加碳通量以实现生长率。特别地,当检测常规的pdc(编码丙酮酸脱羧酶的基因)和adh(醇脱氢酶)活性时,发现作为候选基因被检测但无法检测到所预期的活性的基因在目前的适应性进化中被增强。e类与己糖转运蛋白有关,是一组与最初作用于c6糖类 (即,例如葡萄糖和甘露糖的糖类)并将其转运至细胞中的蛋白质相关的基因。b类是一组锌指蛋白。有研究报道,乳酸诱导的氧化应激影响与锌指蛋白相关的功能基团,或者与锌指蛋白相关的增强涉及活性氧(ros)的减少(derek a.abbott et al.,applied and environmental microbiology, 2320
‑
2325,2009),包括乳酸在内的氧化应激与锌指蛋白之间的关系非常高(xixi zhou et al,the journal of biological chemistry,290:18361
‑
18369, 2015;b gao et al.,cell death and disease,5:e1334,2014;ananda s.prasadand bin bao,antioxidants 8:164,2019),预测所选菌株的耐酸性与这些锌指蛋白部分相关。d类是一组与硫酸盐/亚硫酸盐相关的基因,特别地,观察到硫酸盐/亚硫酸
盐还原酶的表达增加,这被认为是由于通过乳酸介导的氧化应激来减轻硫酸盐/亚硫酸盐介导的氧化应激的机制。此外,支持抵抗外部胁迫的基因结构和细胞结构的基因表达被鉴定,并被统称为d 类应激反应。
61.通过转录组分析,确定了本发明菌株的各种特征,并且当在将来包括逆向工程(reverse engineering)的进一步研究中研究每个基因的特征时,可以设计另外的开发方法。
62.在转录组分析中,没有检测到与甘油产生相关的基因表达的增加,但是从通过发酵培养鉴定的表型中检测到,通过适应性进化选择的菌株与亲本菌株相比也表现出增加的甘油产生能力。因此,认为甘油的增加是由nadh通过甘油产生途径再生(regeneration)引起的,这是由于ldh失活,而不是相关基因的表达引起的nadh再生不足,因此当ldh被激活(增强)时,甘油将再次减少。
63.总之,由于乳酸耐受性的增加,在相同的时间段内发酵罐中可以获得更多的微生物,并且由于糖代谢速率的增加,发酵速率增加。然而,与此同时,由于乳酸耐受性增加,观察到乳酸过程的副产物增加。这种现象是由于ldh的表达减少,从而甘油和乙醇产生相关基因的表达增加,导致耐受性增加。作为解决这个问题的方法,可以考虑增强ldh和除去乙醇产生相关基因。在本发明中,首先,通过进行ldh的进一步表达,每个细胞中的产生速率(production rate)增加,以进一步增加总产生速率,通过用ldh进行辅酶nadh的还原,负责甘油途径的nadh的还原减少,因此,甘油增加的水平降低,并且通过提高乳酸产生能力,其直接与使用丙酮酸作为代谢途径中的前体节点的乙醇产生能力竞争,乙醇的产生被减少。此后,如果需要,可以除去额外表达的产乙醇基因。
64.在本发明的一个方面,经历适应性进化的菌株是ybc5菌株,其中在 ybc5菌株基因组的g4423(adh)、g3002
‑
1(pdc)和g2947(cyb2)位点处取代有源自植物乳杆菌的ldh基因,由于ybc菌株的二倍体特征,总共插入了6个基因拷贝。在许多情况下,当插入相同基因的多个拷贝时,由于细胞的反馈抑制,相同基因的表达被抑制,因此没有发挥与拷贝数成比例增加的效果,并且相同基因的存在可能影响基因组的稳定性。为此,本发明发现了一种增强ldh的新方法。如本发明人的在先专利申请(韩国专利申请第2018
‑
0044509号和韩国专利申请第2019
‑
0124701号)中所述,插入ybc5菌株的g4423(adh)位点处的ldh表现出非常高的活性,并且由于g2947启动子的影响,插入g2947(cyb2)位点处的ldh在发酵后期也表现出持续的活性。然而,在g3002
‑
1(pdc)位点处插入的ldh在表型上表现出相对较低的增加乳酸产生能力的作用。特别是,qpcr显示ybc固有的pdc通过g3002
‑
1(pdc)的高活性启动子表现出高表达率。因此,对相关现象进行了进一步的研究。
65.首先,通过从野生型ybc菌株中除去g3002
‑
1并引入源自植物乳杆菌的ldh来测定乳酸产生能力。观察到该菌株通过除去pdc很好地显示了表型,但是产生非常少量的乳酸。考虑到由于g4423,源自植物乳杆菌的 ldh被强烈表达,相同基因在同一菌株内不同基因组位置处表达的极端差异不是普遍现象。当ldh在rna中表达时,预计ran翻译成蛋白质将顺利进行,总之,假设相同的基因没有在相应的pdc位点转录。为了解决这一现象,本发明人试图建立各种假设,但没有找到解决这一问题的假设。因此,本发明人假设,顺利表达被抑制取决于源自植物乳杆菌的 ldh的基因组位点和基因结构问题。要解决这一问题,引入源自另一个菌株的ldh来改变基因组结构,从而促进ldh的表达。
66.对于要引入的目标ldh,选择在酵母中具有最佳酸性ph和优异表达以适合耐酸菌株特征的基因。考虑到必要的资源,单独使用筛选从自然界存在的众多基因中找到这些基因几乎是不可能的,并且是一项需要基因组挖掘和实验验证以及许多假设的任务。本发明人首先试图从文献中选择具有相似特征的基因,而不是进行这样的基因组挖掘,将其注入到相应耐酸菌株的g3002
‑
1位点,然后测定其活性。本发明人试图通过文献检索找到以前在类似条件下验证过的基因,并靶标到源自表皮葡萄球菌的ldh和源自家牛(bos taurus)的ldh,其被发现在主题文献中测试的基因中是有效的(jae won lee et al,j.biotecho 241,2017)。
67.在将三个目标基因导入野生型ybc菌株(kctc13508bp)的g3002
‑
1 位点后,比较它们之间的乳酸产生能力。结果,发现了一个非常有趣的事实。三个基因之间的活性差异非常大,其中与源于植物乳杆菌的ldh (lpldh)相比,源于表皮葡萄球菌的ldh(seldh)基因显示出基于乳酸产量的39倍的活性增加,结果,seldh基因单独在g3002
‑
1位点获得0.39g/g 的产量,其活性与先前插入g4423位点处的lpldh相当。结果,本发明人获得了能够确保g3002
‑
1位点的高活性并恢复适应性进化菌株的ldh活性的方法。
68.然而,在各种ldh中,表皮葡萄球菌的ldh基因是以fdp
‑
激活的ldh 的形式存在的需要fdp作为辅酶(e.i garvie,bacterial lactatedehydrogenases,microbiological reviews,1980),并且这种fdp是糖酵解的中间产物。因此,与使用普通糖类例如葡萄糖、果糖和蔗糖作为底物相比,当使用其他糖类时,lpldh基因的活性很可能受到fdp的可用性的影响,并且其活性很可能因此受到影响。然而,因为在商业过程中主要使用的底物是玉米淀粉,其主要由葡萄糖、果糖和蔗糖及它们的糖化产物、甘蔗汁及其副产物组成,这种限制被最小化。
69.在本发明的一个方面,将seldh基因插入到通过适应性进化选择的菌株中,结果显示该菌株显示出从0.67g/g到0.75g/g的进一步增加的产量,并在获得从2.54g/l/小时到2.56g/l/小时的进一步增加的生产率和从 123g/l到130g/l的增加的浓度的同时显示出如预期的副产物的大量减少。
70.在本发明获得的菌株的培养物中发现了耐酸菌株发酵的atp相关需求,如现有文献中所述(antonius j.a.van maris et al.,appl.environ. microbiol.,70;2898,2004)。换句话说,随着细胞外乳酸浓度的增加,需要能量将细胞内乳酸转移到外部,并且由于消耗atp,发酵需要atp供应。 atp的消耗是由于当添加2atp/葡萄糖时产生耐酸性乳酸(acid
‑
resistantlactic acid),这可以通过在一般发酵中阻断其中的氧气的同时迫使生产菌株产生乳酸来保证。因此,在一般发酵的厌氧条件下,细胞维持所需的能量是不足的。需要氧气供应来补充能量,供应的氧气完全氧化tca途径中的底物来供应能量atp,但同时,一些底物被转化为co2,而不是乳酸,导致乳酸产量降低。因此,有必要设置最佳的通气条件,使乳酸产量的损失最小化,同时保持细胞活性。
71.此外,本发明的菌株既是酵母又是革兰氏阳性菌株,因此这应在设定发酵方法时给予考虑。众所周知,在高糖浓度下,即使在有氧条件下,革兰氏阳性菌株也会经历厌氧发酵反应,例如乙醇发酵或乳酸发酵,而不是tca发酵。相比之下,革兰氏阴性菌株在有氧条件下可以抑制发酵产物的产生,因此只能增加细胞,细胞生长期和发酵产物产生期可以分开进行。然而,这些革兰氏阴性菌株在需氧条件下导致细胞生长,并且可以确保发酵罐中的高
细胞浓度,但是细胞不能无限增加以提高发酵速率,因为在需氧条件下消耗的许多底物随着细胞生长转化为co2(此外,细胞浓度根据培养基的营养物和限制性底物(limit substrate)而受到限制是自然的)。另一方面,革兰氏阳性菌株在有氧条件下生长细胞,也产生发酵产物。因此,当发酵产物是乳酸时,糖酵解过程所需的nad可以由ldh 消耗的nadh提供,革兰氏阳性菌株在乳酸产量方面相对有利,因为与通过呼吸将底物转化(氧化)为co2来提供nad的革兰氏阴性菌株相比,减少碳损失为co2的同时乳酸可以增加。然而,发酵产物在反应器中的快速积累可能快速达到发生生长抑制的乳酸浓度,并且在增殖至所需细胞浓度方面可能存在限制。因此,为了克服这一点,需要调节最佳氧气供应速率,以最大化发酵的最佳种子浓度和初始生长率,并防止底物由于过量氧气而过度转化为co2。此外,一旦达到生长停止时的乳酸浓度,就需要通过降低氧气供应速率来调节氧气供应速率,以保持不会发生过量co2损失的微氧状态,同时供应atp,atp是如上所述将乳酸排放到细胞外部的能量。因此,对于添加用于中和的化合物和混合化合物而言,本发明的发酵不需要在发酵罐中保持高的混合速率,但是有必要控制最小的氧气供应速率,在该最小的氧气供应速率下,在发酵的早期阶段发生足够的细胞生长,并且在发酵的后期阶段发生足够的atp供应,同时减少由于过量氧气而导致的co2损失,这是一个重要的放大(scale
‑
up)因素。基于氧气供应速率的优化,可以通过许多实验找到合适的曝气速率和混合速率,并且也可以使用本领域已知的参数例如our和otr找到最佳值。
72.在本发明的一个方面,与亲本菌株ybc菌株(kctc13508bp)或源自亲本菌株的突变菌株(ybc1、ybc2/ybc3/ybc4/ybc5)相比,由于对乳酸的耐受性增加,通过适应性进化选择的菌株可以获得高细胞浓度和较快的乳酸产生速率。在本发明的另一方面,通过适应性进化选择的菌株中的ldh被增强,以实现乙醇和甘油产量的减少。
73.在本发明的另一方面,与通过在亲本菌株ybc菌株基因组的pdc (g3002
‑
1)基因位置处引入源自植物乳杆菌的ldh基因获得的乳酸产生能力相比,发现通过在该位置处引入源自表皮葡萄球菌的ldh基因获得的乳酸产生能力以产量计增加了30倍以上。
74.在本发明中,引入的编码乳酸脱氢酶的基因优选是源自瑞士乳杆菌 (l.helveticus)的ldh基因、源自米根霉(r.oryzae)的ldh基因或源自植物乳杆菌的ldh基因、源自家牛(b.taurus)的ldh基因和源自表皮葡萄球菌的ldh基因。更优选地,源自植物乳杆菌的ldh基因被引入到g4423(adh) 位点处,并且源自表皮葡萄球菌的ldh基因被引入到g3002
‑
1(pdc)位点处。
75.在本发明的一个方面,通过ybc5菌株(δ g4423::ldh/δg3002
‑
1::ldh/δg2947::ldh/δg1544)的适应性进化获得的具有显著增加的乳酸耐受性的#26
‑
5菌株表现出高乳酸生产率和高乳酸产生浓度,因此显著提高了该方法的经济效率。此外,用源自表皮葡萄球菌的 ldh取代#26
‑
5菌株g3002
‑
1的ldh构建的ybc6菌株(δ g4423::lpldh/δg3002
‑
1::seldh/δg2947::lpldh/δg1544)与ybc5和 #26
‑
5相比,表现出增加的乳酸产生速率和产生浓度,以及受抑制的乙醇和甘油的产生,从而增加产量。ybc6的发酵特性显示产量、产生速率和产生浓度已经达到可作为耐酸菌株商业化的水平。
76.因此,在另一方面,本发明涉及一种生产乳酸的方法,其包括(a)培养重组菌株以产生乳酸,和(b)收集产生的乳酸。
77.本发明能够实现一种优异的耐酸菌株,其具有达到商业化水平的大大增加的乳酸
生产率、浓度和产量,大大降低的乙醇产量,及大大降低的甘油副产物。
78.如本文所用,术语“耐酸酵母”被定义为当培养基含有浓度至少为 1m的有机酸(特别是乳酸)时,与培养基不含有机酸时相比,在低于有机酸的pka值的ph下,能够保持至少10%的生物量消耗速率(例如糖消耗速率)或至少10%的比生长速率的酵母。更具体地,术语“耐酸酵母”被定义为与ph 5以上相比,在ph 2至4时能够保持至少10%的生物量消耗率(例如糖消耗速率)或至少10%的比生长速率的酵母。
79.根据本发明的重组酵母可以通过根据常规方法将该基因插入宿主酵母的染色体中生产,或者通过将包含该基因的载体引入宿主酵母中来生产。
80.作为宿主酵母,通常使用具有高dna导入效率和导入dna的高表达效率的宿主细胞。在本发明的一个实施方案中,使用了耐酸酵母,但是本发明不限于此,可以使用任何类型的酵母,只要其能够充分表达靶 dna。
81.可以根据任何转化方法制备重组酵母。术语“转化”指将dna引入宿主体内,使dna作为染色体的一个因子或通过染色体整合进行复制的现象,意指通过将外源dna引入细胞而人为诱导遗传变化的现象。一般的转化方法包括电穿孔、乙酸锂
‑
聚乙二醇等。
82.此外,在本发明中,任何公知的基因工程方法都可以用作将基因插入宿主微生物染色体的方法。例如,有使用逆转录病毒载体、腺病毒载体、腺相关病毒载体、单纯疱疹病毒载体、痘病毒载体、慢病毒载体、非病毒载体等的方法。“载体”意指含有可操作地连接至能够在合适的宿主中表达该dna的合适的调节序列的dna序列的dna产物。载体可以是质粒、噬菌体颗粒或简单的潜在基因组插入物。当转化到合适的宿主中时,载体可以被复制或执行独立于宿主基因组的功能,或者其中一些可以与基因组整合。质粒是目前最常用的载体形式,但线性dna也是酵母基因组整合的常用形式。
83.典型的质粒载体包括(a)有效进行复制的复制起点,使得在每个宿主细胞中包含预定数量的质粒载体;(b)抗生素耐受性基因或营养缺陷型标记基因,以筛选用质粒载体转化的宿主细胞;和(c)插入外源dna片段的限制性酶切位点。即使不存在合适的限制性酶切位点,也可以按照常规方法(吉布森组装)使用合成的寡核苷酸衔接子或接头容易地将载体和外源dna连接。如果需要,也通常使用合成整个所需序列并使用的方法。
84.此外,当一个核酸序列基于它们之间的功能关系与另一个核酸序列对齐时,它被称为与其“可操作地连接”。这可以是基因和控制序列以这样的方式连接,使得当合适的分子(例如,转录激活蛋白)连接到控制序列时能够进行基因表达。例如,当作为参与多肽分泌的前蛋白表达时,用于前序列或分泌前导序列的dna可操作地连接至多肽的dna;当影响序列的转录时,启动子或增强子可操作地连接至编码序列;当影响序列的转录时,核糖体结合位点可操作地连接至编码序列;或者定位以促进翻译时,核糖体结合位点可操作地连接至编码序列。
85.通常,术语“可操作地连接”意指连接的dna序列与其接触,或者分泌前导序列与其接触并存在于阅读框中。然而,增强子不需要与之接触。这些序列的连接(linkage)是通过在方便的限制性酶切位点进行结合 (ligation)(连接)来实现的。当不存在这样的位点时,使用根据常规方法的合成寡核苷酸衔接子或接头。
86.应当理解的是,在表达本发明的dna序列时,并非所有载体的功能都相同。同样,对于同一表达系统,并非所有宿主的功能都相同。然而,本领域技术人员将能够从各种载体、
表达控制序列和宿主中进行适当的选择,而不需要过多的实验负担,并且不背离本发明的范围。例如,应该考虑宿主来进行载体的选择,因为载体应该在其中复制。还应考虑载体复制的次数、控制载体复制次数的能力以及由相应载体编码的其他蛋白质的表达,例如抗生素标记的表达。
87.在本发明中,碳源可以包括但不限于选自葡萄糖、木糖、阿拉伯糖、蔗糖、果糖、纤维素、半乳糖、葡萄糖低聚物和甘油中的一种或多种。
88.在本发明中,可以在使得微生物,例如大肠杆菌(e.coli)等不再起作用(例如,不能产生代谢物)的条件下进行培养。例如,可以在1.0至6.5的 ph,优选1.0至6.0的ph,更优选2.6至4.0的ph下进行培养,但不限于此。
89.在下文中,将参考实施例更详细地描述本发明。然而,对于本领域技术人员来说,显而易见的是,这些实施例仅用于说明本发明,并且不应被解释为限制本发明的范围。
90.实施例1:耐酸菌株ybc的适应性进化#1
91.在先前的研究中,本发明人通过对各种酵母菌株进行测试来选择具有耐酸性的菌株,并通过在酵母菌株培养开始时向培养基中添加乳酸并监测微生物的生长和糖消耗速率来确定具有最佳耐酸性的菌株,即,ybc 菌株,并将该菌株以保藏号kctc13508bp保藏在韩国典型培养物保藏中心。
92.系统发育分析(phylogenetic analysis)表明,ybc菌株(kctc13508bp) 是一种与酿酒酵母(s.cerevisiae)类似的菌株,是二倍体,并且为crabtree 阳性。
93.通过抑制乳酸消耗和抑制甘油产生同时最小化乙醇产生的抑制,从相应的ybc菌株遗传修饰的ybc5菌株获得了可商业化的产量(韩国专利申请第10
‑
2020
‑
0046779号)。
94.ybc5菌株如下获得:从ybc菌株中缺失adh(醇脱氢酶)并将ldh基因引入该菌株以构建ybc1菌株,从ybc1菌株中除去g3002
‑
1基因(pdc 基因)并在其中表达ldh以构建能够高效产生乳酸并具有被抑制的乙醇产生的ybc2菌株,将ldh基因引入ybc2菌株并除去g2947(其为消耗乳酸的基因),以构建乳酸消耗能力被去除的ybc4菌株,并从ybc4菌株中除去gpd1(g1544)基因(除去等位基因1和等位基因2,作为二倍体菌株),以构建ybc5菌株。
95.构建该菌株的方法如下:
96.ybc1菌株是通过从ybc菌株中除去作为ybc菌株的主要adh基因的g4423基因,并在g4423的位置处引入源自植物乳杆菌的seq id no.3 的ldh基因而获得的菌株。基于g4423及其utr的信息构建已除去每个基因的orf并且包含5’utr和3’utr基因盒(gene cassette),并将其用作供体dna。对于g4423的每个等位基因,相应的5’utr由seq id no.4和 seq id no.5表示,3’utr由seq id no.6和seq id no.7表示。采用如上所述的使用限制性酶的克隆方法、吉布森组装和使用基因合成的方法产生供体dna。合成seq id no.3的ldh,然后将其引入g4423的orf位点,以产生供体dna,并将供体dna引入ybc,以构建重组菌株ybc1。
97.此外,g3002
‑
1基因是在ybc菌株的基因组测序中位于骨架72处的基因,并充当pdc基因。从ybc1菌株中除去g3002
‑
1基因(位于骨架72处的基因),并将seq id no:3的ldh基因引入其中以构建重组菌株ybc2。
98.使用相应的utr作为重组位点来构建用于替代g3002基因的盒。类似于上述将ldh引入ybc1的g4423基因(adh)位点的方法,使用g3002
‑
1的utr构建该盒。然而,为了简化基因
替换的过程,在不考虑等位基因变异的情况下制备针对一个等位基因的供体盒(cassette),但是也可以为每个等位基因制备一个供体盒(cassette)。此外,对于用于基因替换的引物,除了用于产生缺失菌株的引物之外,分别使用能够检测ldh和g3002
‑
1的utr的如下一对引物,以增加基因替换验证的准确性。
99.g3002
‑
1utr
‑
ldh
‑
正向引物:gcaggatatcagttgtttg(seqidno:8)
100.g3002
‑
1utr
‑
ldh
‑
反向引物:aataccttgttgagccatag(seqidno:9)
101.此外,ybc4菌株是通过从ybc2菌株中缺失ybc2菌株的主要cyb2基因,即g2947基因,并在g2947基因的位置处引入源自植物乳杆菌的seqidno:3的ldh基因构建而成的菌株。在ybc菌株的基因组测序中g2947基因是位于骨架41处的基因。基于g2947及其utr的信息,构建已除去每个基因的orf并且包含5’utr和3’utr基因盒(genecassette),并将其用作供体dna。对于g2947的每个等位基因,相应的5’utr由seqidno:10和seqidno:11表示,3’utr由seqidno:12和seqidno:13表示。采用如上所述的使用限制性酶的克隆方法、吉布森组装和使用基因合成的方法来产生供体dna。
102.然而,为了简化基因替换的过程,在不考虑等位基因变异的情况下制备针对一个等位基因的供体盒,但是也可以为每个等位基因制备一个供体盒。
103.ybc5菌株是通过从ybc4菌株中缺失作为ybc4菌株的gpd1基因的g1544基因构建而成的菌株。在ybc菌株的基因组测序中g1544基因是位于骨架19处的基因。基于g1544及其utr的信息,构建除去每个基因的orf并且包含5’utr和3’utr和抗生素标记的基因盒,并将其用作供体dna。对于g1544的每个等位基因,相应的5’utr由seqidno:14和seqidno:15表示,而3’utr由seqidno:16和seqidno:17表示。采用如上所述的使用限制性酶的克隆方法、吉布森组装和使用基因合成的方法制备供体dna。
104.为了简化基因替换的过程,在不考虑等位基因变异的情况下制备了针对一个等位基因的供体盒(cassette),但是也可以为每个等位基因制备一个供体盒(cassette)。另外,当使用目前商业化的基因工程技术(crispr)时,可以在不使用抗生素标记的情况下制备和应用供体盒。
105.制备的重组菌株的基因型如下:
106.ybc2:δg4423::ldh/δg3002
‑
1::ldh
107.ybc4:δg4423::ldh/δg3002
‑
1::ldh/δg2947::ldh
108.ybc5:δg4423::ldh/δg3002
‑
1::ldh/δg2947::ldh/δg1544
109.然而,为了确保商业化的经济可行性,重组菌株必须在3.7以下的ph下达到2.5g/l/小时以上的产生速率和120g/l以上的乳酸浓度。因此,在以下实施例中,为了提高ybc5菌株的乳酸产生速率,进行了提高乳酸耐受性的处理。
110.如表1所示,ybc5菌株被传代培养,同时乳酸浓度从10g/l逐渐增加至80g/l。在传代培养期间,通过自然突变在细胞中出现突变体,并且高度适应高浓度乳酸的菌株生长相对较快,并逐渐成为整个菌株菌群中的优势种。在增加乳酸浓度的同时重复该过程,并检测整个菌株菌群的生长率。此外,在适当的时间点将菌株菌群置于含有乳酸的琼脂平板上,并分离产生的菌落。此时,所选择的菌落是在含有乳酸的固体培养基上因快速生长而最大的菌落。通过该过程,从在40g/l、50g/l、60g/l、70g/l和80g/l的液体浓度下生长的菌落中选择了42个菌落。
111.[表1]
[0112][0113]
在该过程中,由菌群在每种含乳酸的培养基中产生的乳酸浓度的变化如表2所示。
[0114]
[表2]
[0115]
la0培养时间(小时)od(a600)ph葡萄糖乳酸乙醇甘油10/1,14:0000.204.3454.51.00.00.010/2,15:00256.722.529.238.00.80.0
ꢀꢀꢀꢀꢀꢀꢀꢀ
la10培养时间(小时)od(a600)ph葡萄糖乳酸乙醇甘油10/1,14:0000.203.1054.211.40.00.610/2,15:00255.722.5613.942.50.80.6
ꢀꢀꢀꢀꢀꢀꢀꢀ
la20培养时间(小时)od(a600)ph葡萄糖乳酸乙醇甘油10/1,14:0000.172.9455.221.70.00.910/2,15:00426.502.536.858.00.01.3
ꢀꢀꢀꢀꢀꢀꢀꢀ
la30培养时间(小时)od(a600)ph葡萄糖乳酸乙醇甘油10/4,9:0000.212.8352.032.60.01.510/5,10:00254.062.7543.437.30.01.6
ꢀꢀꢀꢀꢀꢀꢀꢀ
la40培养时间(小时)od(a600)ph葡萄糖乳酸乙醇甘油10/5,10:0000.102.7854.541.90.02.610/7,9:00475.402.5621.664.41.13.4
ꢀꢀꢀꢀꢀꢀꢀꢀ
la50培养时间(小时)od(a600)ph葡萄糖乳酸乙醇甘油10/7,11:0000.222.7554.651.90.02.510/9,8:00451.342.7553.655.40.02.810/10,9:00705.922.6429.565.70.03.3la60培养时间(小时)od(a600)ph葡萄糖乳酸乙醇甘油10/9,8:0000.072.7354.661.60.03.13d720.252.7251.060.60.03.45d1206.233.4318.181.20.03.7la70培养时间(小时)od(a600)ph葡萄糖乳酸乙醇甘油10/12,09:0000.052.7351.768.70.03.8
6d1444.703.5230.983.10.05.5
ꢀꢀꢀꢀꢀꢀꢀꢀ
la80_1培养时间(小时)od(a600)ph葡萄糖乳酸乙醇甘油10/18,09:000na3.5553.779.20.05.910/22,15:001026.143.375.4105.61.08.5
[0116]
将42个选定的菌落接种到5ml锥形管中。因为是小规模培养,所以接种从菌落中获得的最均匀的数量(most uniform amount)以获得均匀的接种 od。本文使用的培养基是补充6%(初级)葡萄糖或12%(二级)葡萄糖的myp培养基(5g/l蛋白胨、4g/l酵母提取物、5g/l kh2po4、2g/lmgso4·
7h2o、0.15g/l尿嘧啶),并在30℃和150rpm下培养96小时。
[0117]
表3示出了5ml培养物的结果。在该培养物中,选择具有高乳酸产生浓度、高细胞浓度或高乳酸产生量的15个菌落,并对其进行以下烧瓶培养评价。
[0118]
选择的菌落如下:3、5、6、8、10、22、24、26、27、31、32、35、 37、38、41。
[0119]
[表3]
[0120]
[0121][0122]
对选择的菌落进行烧瓶培养评价,培养条件如下。将10%葡萄糖(初级)添加至m
‑
yp培养基(5g/l蛋白胨、4g/l酵母提取物、5g/l kh2po4、2g/l mgso4·
7h2o、0.15g/l尿嘧啶)中,调节总体积为50ml。将微生物接种至培养基中,并在30℃和150rpm下培养72小时。此外,接种1天后,以糖注入浓度的20%的量添加caco3溶液。
[0123]
烧瓶培养物的分析结果如表4所示。
[0124]
基于为综合判断引入的评价逻辑来分析烧瓶培养物的结果。首先,为产生速率、乳
酸产量、生长速率、乙醇浓度(按低级数(in low order))和甘油浓度(按低级数)的每一项选择前五个菌落,并将每一项中的得分和权重分配给所选择的菌落并进行汇总。至于权重,出于适应性进化的目的,优先考虑乳酸产生速率,排除生长速率较快但乳酸产生能力较低的菌落。表5示出了评价过程及其结果。
[0125]
[表4]
[0126][0127]
[表5]
[0128][0129]
如表5所示,选择了26号菌落(以下称为“#26菌株”),选择的主要原因是与乳酸产生能力的增加相比,它是其中副产物的增加最小化的菌落。当仅考虑乳酸产生能力和乳酸产量而不考虑副产物的增加时,3号菌落显示出更好的结果,但是在第一轮中首先考虑整体性能。在随后的适应性进化中也观察到了这些副产物的增加趋势。
[0130]
实施例2:耐酸酵母ybc菌株的适应性进化#2
[0131]
在实施例1的第一轮适应性进化中选择的#26菌株与ybc5相比性能有所提高(参见表4中与ybc5的比较结果),但是没有达到适合商业化的性能,因此进行了进一步的改进操作。
[0132]
由于#26菌株具有增强的对乳酸浓度的耐受性,所以在高乳酸浓度下开始培养,并且在每个浓度下的传代培养次数增加。为了提高极端条件下的生长特性,在不添加中和剂caco3的情况下进行培养。
[0133]
使用的乳酸如下制备:用0.2μm过滤器从实际发酵产生的培养基中除去杂质,然后进行浓缩以制备40
‑
50%的溶液,然后根据所需的乳酸浓度与yp培养基(20g/l蛋白胨,10g/l酵母提取物)混合。糖浓度为10%,以新鲜培养基总体积的10%的量接种传代培养基,并进行培养。
[0134]
图1(a)示出了#26菌株的传代培养结果。即使在60g/l的乳酸浓度下,也观察到菌株菌群的平稳生长。在用第23天的培养基稀释的yp培养基中培养菌株菌群,然后分离出12个菌落。菌落的选择基于尺寸进行。
[0135]
在与实施例1相同的条件下,对选择的菌落进行烧瓶培养。此时的参考性能是#26菌株的性能。通过类似于实施例1的选择过程选择5号菌落,并将其命名为#26
‑
5菌株以区别于第一轮结果。#26
‑
5的培养结果如图2所示。
[0136]
为了与菌株#26
‑
5相比进一步增加耐受性,进行了第三轮适应性进化。本文使用的目标菌株是#26
‑
5菌株和第二轮培养的菌株菌群。在第三轮开始时比较两个烧瓶中的生长。结果,从第二轮开始连续生长的菌株菌群的生长更加优异。由于在菌株菌群中存在比所选菌株#26
‑
5具有更强耐受性的突变体的可能性很高,使用菌株#26
‑
5作为起始培养菌株的适应性进化被停止。第三轮的结果如图1(b)所示。乳酸浓度增加到80g/l,观察到细胞的生长,但是观察到生长速率与60g/l的乳酸浓度相比显著降低。因此,在70g/l的降低的乳酸浓度下进行传代培养,其提供了平稳的生长速率。第三轮完成后,将相应的菌株菌群置于琼脂平板上,然后选择菌落。此时,制备含有浓度为45g/l的乳酸的ypdu琼脂平板和乳酸浓度分别为50g/l和60g/l的平板,并在其上接种菌株菌群,在含有乳酸的琼脂平板上也产生菌落。
[0137]
尽管与#26
‑
5相比,在附加的第3轮中产生的菌落具有比#26
‑
5更高的乳酸耐受性,并且因此在高乳酸浓度下能够生长更多,但是发酵产物中乳酸的比例进一步降低,并且作为副产物的乙醇和甘油的产量进一步增加。这里,应选择#26
‑
5菌株和第三轮分离的菌株中的任何一个作为商业化的目标菌株,其将在未来进一步开发。有必要做出决定,选择在中长期内对具有高乳酸耐受性的菌株进行进一步开发(关于恢复乳酸产生能力和副产物减少幅度高的研究),或者选择具有相对较低的乳酸耐受性但仍具有较好的乳酸耐受性的#26
‑
5。在本发明中,对#26
‑
5进行了进一步的研究,预期将在更短的时间内得到开发。
[0138]
实施例3:适应性进化前后基因表达的比较
[0139]
在这个实施例中,基于qpcr观察到由于适应性进化引起的ybc5 和#26
‑
5基因表达的变化。从每种ypdu培养基中在30℃和200rpm培养24小时的样品中提取总rna,通过ngs分析rna,然后分析相同基因表达水平的变化,如表6所示。
[0140]
[表6]
[0141]
ybc5和#26
‑
5菌株基因表达的变化及相应基因,a类:产物相关, b类:锌指蛋白,c类:硫酸盐/亚硫酸盐相关蛋白,d类:应激反应,e 类:己糖转运蛋白
[0142]
[0143]
[0144]
kh2po4、2g/l mgso4·
7h2o、0.3g/l尿嘧啶)中进行初次接种,并在380ml myp培养基中进行二次接种,在30℃下,以200rpm培养2 天,并收获所有细胞。将细胞接种在1.18l myp培养基中,然后在30℃下培养。此时,相对于包括额外的糖溶液和caco3溶液的1.7l的体积,调节myp培养基中每种组分的浓度。在接种od为1.73时开始培养,将 100ml 42.33%的caco3与450ml 62.5%的糖溶液在单独的进料瓶中混合,并将糖和caco3的混合物注入生物反应器中,同时用磁力搅拌器以400 rpm的速度在瓶中连续混合,使得caco3在溶液中均匀。除了这种注射 caco3与糖溶液的混合物的方法之外,在一些发酵中,可以与糖溶液分开,每2小时以预定量(5
‑
10ml)注射一次caco3。然而,考虑到当尽可能均匀地注入少量时,可以最小化由于caco3的引入而导致的co2浓度的增加,从而提高发酵性能这一事实,注入caco3与糖溶液的混合物。在商业发酵中,可以不与水混合而直接注入caco3,因此可以避免由于额外的水而导致的乳酸浓度的降低。然而,在实验室规模中,灭菌的caco3作为溶液相被注入。此外,在整个发酵过程中,可以以糖和caco3的始终如一的混合比例注入caco3。在某些情况下,大部分caco3在接种后 24小时内添加,此时初始菌株生长活跃,此后仅注入糖溶液(基于发酵id 60)。糖和caco3混合物的注入速率和通气速率在各批次中不同,但是基于表7中的发酵id f60,混合溶液的注入速率在最初2小时期间为13.5ml/ 小时,此后为15.3ml/小时。基于f60,在细胞生长阶段以0.7lpm的通气速率和700rpm的搅拌速率进行培养。20小时后,由此逐渐改变培养条件至通气速率为0.35lpm,搅拌速率为600rpm。
[0152]
使用菌株#26
‑
5的发酵培养结果示于图3中。
[0153]
#26
‑
5菌株发酵的结果示出,乳酸的产生速率为2.54g/l/小时,产量为0.67g/g,乳酸浓度为123g/l。即,乳酸的产生速率和浓度是优异的,但是与ybc5相比存在产量降低的问题。该问题是由发酵过程中各为7g/l 的乙醇和甘油的产生造成的。该问题是由于作为适应性进化(其具有增加发酵速率和增加对乳酸的耐受性的效果)的副作用发生的ldh的减弱和产乙醇基因的表达。抵消这些副作用的方法是增强ldh并除去相应的产乙醇基因,其中增强ldh的方法在实施例5至实施例7中进行。图3中所示出的糖浓度是在以补料分批方式注入糖和caco3的混合物的过程中反应器中的糖浓度。可以以分批方式进行商业发酵,其中在初始阶段注入全部量的糖,而单独注入caco3。以同样的方式,以补料分批或半补料分批的方式操作和优化发酵是可能的,其中在发酵过程中注入一部分糖作为与补料分批的适当组合。
[0154]
图4示出了发酵期间菌株#26
‑
5和菌株ybc5之间仅乳酸浓度的比较结果。与ybc5菌株相比,菌株#26
‑
5显示出发酵速率和乳酸产生浓度的增加,这被认为是由于乳酸耐受性的增加造成的。然而,如上所述,ybc5 菌株的乳酸产量为0.81g/g至0.83g/g,而#26
‑
5菌株的乳酸产量为0.63g/g 至0.72g/g,并且在ph 3附近的产量为0.67g/g至0.68g/g(参见表6中的 f59和f60)。
[0155]
已经在上文描述了通气在耐酸发酵中的作用和重要性,通气应最大化至24小时,这是细胞生长期,并且此后保持在最小值。然而,即使在细胞生长阶段,过度通气也会导致乳酸产量降低(参见表7中的f57发酵)。 24小时后维持细胞活性的通气速率对产量的影响非常敏感,因此在从 0.35lpm的最佳通气速率降低至0.3lpm以下的情况下,基于2l培养,乳酸产生速率显著降低,或者在严重的情况下,乳酸产生停止,并且当通气速率为0.4lpm以上时,产量与通气速率成反比地降低。通气速率 (aeration rate)可以表示为氧转移速率或氧流入细胞的速率。然而,通气速率受反应器的结构、搅拌器的形状和分布器的空气排放形
式的影响,因此当这些因素改变时,应该重新优化。对于那些具有微生物细胞培养相关知识的人来说,进行重新优化并不是很难。
[0156]
各种条件变化的发酵结果如下表7所示。
[0157]
[表7]
[0158]
使用#26
‑
5菌株优化培养条件(包括糖注入和通气)的结果
[0159][0160]
实施例5:在ybc菌株的g
‑
3002位点引入ldh的效果对比
[0161]
在ybc菌株的pdc(g3002
‑
1)位点处引入源自植物乳杆菌(seq idno:3)的lpldh、或源自家牛的ldh(btldh)(seq id no:58)、或源自表皮葡萄球菌的ldh(seldh)(seq id no:1)的每种的2个拷贝。
[0162]
构建该菌株的方法如下:
[0163]
除去ybc菌株的主要pdc基因,即g3002
‑
1基因,并将源自植物乳杆菌的seq id no:3的酵母密码子优化的ldh基因引入g3002
‑
1的位点处以得到一株菌株。基于g3002
‑
1及其utr的信息,除去每个基因的 orf,并在其位点处引入lpldh,产生包含g3002
‑
1的5’utr和3’utr 的基因盒,并用作供体dna(参见图5中基因盒的例子)。此外,g3002
‑
1 基因是在ybc菌株的基因组测序中位于骨架72处的基因,并作为pdc 基因。为了简化基因替换过程,供体盒是针对一个等位基因产生的,不考虑等位基因变异,但可以针对每个等位基因产生。对于g3002
‑
1的每个等位基因,相应的5’utr显示在seq id no:59和seq id no:60中,3
’ꢀ
utr显
示在seq id no:61和seq id no:62中。如上所述,使用限制性酶的克隆方法和使用吉布森组装的方法可以用于生产供体dna,但是可以合成和使用整个基因序列。该重组菌株被命名为“ybclp”。
[0164]
为了验证遗传操作的正确执行,使用以下引物鉴定转化体,并且如果需要,通过基因组部分的测序鉴定正确的转化体。
[0165]
同样,引入btldh基因的菌株被命名为“ybcbt”,引入seldh 基因的菌株被命名为“ybcse”,用于鉴定基因组的引物如下。
[0166]
用于鉴定3002
‑
1orf的正向引物:gcaggatatcagttgtttg (seq id no:63)
[0167]
用于鉴定3002
‑
1orf的反向引物:atagagaagctggaacag (seq id no:64)
[0168]
用于鉴定3002
‑
1utr的正向引物:gcaggatatcagttgtttg (seq id no:65)
[0169]
用于鉴定3002
‑
1utr的反向引物:cagaatcttagaaaggagg (seq id no:66)
[0170]
用于鉴定lpldh、btldh和seldh的引入的正向引物: gcaggatatcagttgtttg(seq id no:67)
[0171]
用于鉴定lpldh的引入的反向引物:aataccttgttgagccatag (seq id no:68)
[0172]
用于鉴定btldh的引入的正向引物:accttcttgttgtctagc (seq id no:69)
[0173]
用于鉴定seldh的引入的反向引物:ataactctttcagctggc (seq id no:70)
[0174]
通过在30℃和150rpm下的50ml烧瓶培养物对转化体进行实验,鉴定其基因型。接种量为0.1od,本文使用的培养基为yp培养基(20g/l 蛋白胨,10g/l酵母提取物),使用6%的葡萄糖并添加150mg/l尿嘧啶。
[0175]
结果如表8所示。
[0176]
[表8]
[0177]
在g3002
‑
1(pdc)位点处引入ldh的效果比较
[0178][0179]
如表8所示,由于同一基因组中ldh的变化,乳酸产量有显著差异。特别地,在ybc的g4423基因组位点处取代的lpldh显示出非常强的表达,对应于0.5g/g以上的产量,但在g3002
‑
1位点处几乎不表达;并且通过将ldh的来源改变为seldh在g3002
‑
1位点处获得的ldh活性与在g4423位点的情况中的ldh活性相当,这两个结果是迄今为止尚未报道的新现象。
[0180]
实施例6:ybc1和ybc5菌株的g3002
‑
1位点的seldh取代效果
[0181]
为了验证在上述实施例中鉴定的g3002
‑
1位点处的seldh的高活性,对ybc1菌株和#26
‑
5菌株(来自ybc5)进行了相同的遗传操作。
[0182]
目标菌株ybc1和ybc5的基因型如下:
[0183]
ybc1:δg4423::lpldh
[0184]
#26
‑
5(来自ybc5):δg4423::lpldh,δg3002
‑
72::lpldh, δg2947::lpldh,δg1544
[0185]
此处使用的盒(cassette)和方法类似于实施例5。在ybc5的情况下,目标位置的lpldh应该用seldh取代,但是为了扩增两个ldh序列之间低相似性的部分,并基于此鉴定正确的转化体,引物改变如下。
[0186]
用于鉴定lpldh的存在的正向引物:gcaggatatcagttgtttg (seq id no:71)
[0187]
用于鉴定lpldh的存在的反向引物:tttcaaaccagtaccacca (seq id no:72)
[0188]
用于鉴定seldh的存在的正向引物1:gcaggatatcagttgtttg (seq id no:73)
[0189]
用于鉴定seldh的存在的反向引物1:gaagaagaa tacaaagcacc(seq id no:74)
[0190]
用于鉴定seldh的存在的正向引物2:gcaggatatcagttgtttg (seq id no:75)
[0191]
用于鉴定seldh的存在的反向引物2:caccagctttaacagtaac (seq id no:76)
[0192]
在ybc1菌株的g3002位置处引入seldh构建的菌株命名为“ybc2se”,在ybc5菌株的g3002位置处引入seldh构建的菌株命名为“ybc6”,它们的基因型如下。
[0193]
ybc2se:δg4423::lpldh,δg3002
‑
72::seldh
[0194]
ybc6:δg4423::lpldh,δg3002
‑
72::seldh,δg2947::lpldh, δg1544
[0195]
对转化体进行实验,通过在30℃和150rpm下的50ml烧瓶培养鉴定其基因型。此时,接种od为0.1,此处使用的培养基为yp培养基(20g/l 蛋白胨,10g/l酵母提取物),ybc2和ybc2se使用5%的葡萄糖,ybc5 和ybc6使用10%的葡萄糖,并加入150mg/l尿嘧啶。
[0196]
结果示于下表9和表10。
[0197]
[表9]
[0198]
ybc1中seldh的效果鉴定(w/o ph控制)
[0199][0200][0201]
[表10]
[0202]
ybc5中seldh的效果鉴定(w/o ph控制)
[0203]
id产量(yield)(g/g)#26
‑
50.55ybc60.76
[0204]
如表9和表10所示,与相同位置处取代有lpldh的ybc2相比,位于ybc1菌株的pdc基因处的ybc2se在类似条件下表现出高产量。考虑到在耐酸条件下将乳酸运输到细胞外所需的atp产量的降低,除了 pdc阻断之外,seldh的强ldh表达导致乳酸产生与乙醇产生相比有很大提高,导致产量基本上类似于理论产量。此外,通过常规适应性进化而被赋予提高的生产率但降低的产量的菌株#26
‑
5,在相同条件下也表现出产量的大幅增加。这意味着通过适应性进化降低的ldh的活性通过在g3002
‑
1位点处强表达的seldh而大大提高。
[0205]
实施例7:使用ybc6菌株的发酵罐操作
[0206]
在该实施例中,在生物反应器中培养ybc6菌株,并测定其乳酸发酵性能。
[0207]
将ybc6菌株分别在40ml myp培养基(10g/l蛋白胨、5g/l酵母提取物、5g/l kh2po4、2g/l mgso4·
7h2o、0.3g/l尿嘧啶)中进行初次接种,并在380ml myp培养基中进行二次接种,在30℃下,以200rpm培养2 天,并收获所有细胞。将细胞接种在1.18l myp培养基中,然
后在30℃下培养。此时,相对于包括额外的糖溶液和caco3溶液的1.7l的体积,调节myp培养基中每种组分的浓度。在接种od为1.74时开始培养,将 100ml 42.33%的caco3与450ml 62.5%的糖溶液在单独的进料瓶中混合,并将糖和caco3的混合物注入生物反应器中,同时用磁力搅拌器以400 rpm的速度在瓶中连续混合,使得caco3在溶液中均匀。然而,考虑到当尽可能均匀地注入时,可以最小化由于caco3的引入而导致的co2浓度的增加(氧转移的阻碍),从而提高发酵性能这一事实,注入caco3与糖溶液的混合物。在商业发酵中,可以不与水混合而直接注入caco3。然而,在实验室规模中,灭菌的caco3作为溶液相被注入。此外,在整个发酵过程中,可以以糖和caco3的均匀混合比例注入caco3。然而,在该发酵中,大部分caco3在接种后24小时内添加,此时初始菌株生长活跃,此后仅注入糖溶液。在最初的8小时期间,糖和caco3混合物的注入速率从4.5ml/小时提高至18ml/小时,此后为22.5ml/小时。在细胞生长阶段,以0.5lpm的通气速率和600rpm的搅拌速率进行培养。12小时后,以0.35lpm的通气速率和600rpm的搅拌速率进行培养,并由此逐渐改变。33小时后,以0.4lpm的通气速率和600rpm的搅拌速率进行培养。
[0208]
使用ybc6菌株的发酵培养结果示于图6中。
[0209]
图6中示出的糖浓度是在以补料分批方式注入糖和caco3的混合物的过程中反应器中的糖浓度。可以以分批方式进行商业发酵,其中在初始阶段注入总糖量,而单独注入caco3。以同样的方式,可以在补料分批或半补料分批中操作和优化发酵,其中在发酵过程中注入一部分糖作为与补料分批的适当组合。
[0210]
培养结果示出ph 3.16时乳酸产量为0.75g/g、发酵速率为2.56g/l/ 小时、乳酸浓度为130g/l,这是迄今为止发表的耐酸菌株性能中的最佳结果。美国嘉吉公司关于耐酸菌株培养的专利(美国专利第7,232,664号) 建议将0.75g/g的产量、2.5g产物/l/小时的发酵速率和120g/l的乳酸浓度作为耐酸乳酸菌株商业化性能的标准。该实施例的结果在所有指标上都达到了上述标准。美国第7,232,664号专利的实施例公开了0.67g/g的总产量,0.8g乳酸/g细胞/小时的平均发酵速率和114g/l的浓度。本发明的发酵结果示出优于该实施例的产量和性能。
[0211]
图7示出了ybc5菌株和#26
‑
5菌株以及ybc6菌株之间仅乳酸生产能力的比较结果,并且证明了ybc6的乳酸产生的优异性,这是由于适应性进化与基因组中pdc位置处的ldh增强的组合效应。
[0212]
保藏机构名称:韩国典型培养物保藏中心
[0213]
保藏编号:kctc14215bp
[0214]
保藏日期:2020年6月15日
[0215]
地址:韩国生物科学与生物技术研究所(kribb)韩国全罗北道井邑市 ipsin街181,56212
[0216]
尽管已经详细描述了本发明的具体配置,但是本领域技术人员将理解,提供该描述是出于说明性目的以提出优选实施方案,并不应解释为限制本发明的范围。因此,本发明的实质范围由所附权利要求及其等同物来限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1