具有越膜能力的、高稳定型的超氧化物歧化酶的制备方法
1.本发明属于酶制剂的基因改造技术领域,具体涉及一种具有越膜能力的、高稳定型的超氧化物歧化酶的制备方法。
背景技术:
2.超氧自由基是人类疾病与衰老的元凶,正常情况下,体内自由基的生成量比较小,可以由自身的抗氧化系统及时清除。但是当机体收到外机强烈刺激,微生物入侵、患病、熬夜、环境污染物刺激、紫外线照射、电离辐射等情况,自由基便无法得到及时清除,此时机体就会收到自由基的攻击而产生氧化性伤害。
3.基于上述的现象,需要在适当的时候合理利用外源性的超氧化物歧化酶,阻断自由基对人体的入侵,对保持健康极为重要。但是目前超氧化物歧化酶在应用方面存在四大瓶颈性的难题:第一是活性不够高,不具备终端产品的添加可行性;第二是稳定性不好,即使刚添加到终端产品时保持有一定活性,但是随着储存、运输等环节的时间推移,活性逐渐下降,等到达消费者手中时,已经无活性;第三是无法实现液体供应,目前市面上的超氧化物歧化酶全部是以冻干粉形式提供,在使用过程中需要定量复溶极不方便;第四是超氧化物歧化酶本身是生物大分子,即便是亚基的分子量也在20000以上,细胞透过性不好,不易被细胞吸收,不易对细胞内部的超氧自由基产生清除作用。
4.因此,需要针对上述的缺点进行改进,发明一种具有越膜能力的、高稳定型的超氧化物歧化酶,真正赋予超氧化物歧化酶在终端产品(包括抗氧化护肤品、皮肤类药品等)中应用的可行性。
技术实现要素:
5.为了解决上述的技术问题, 本发明针对于上述背景技术中所提及的四大卡脖子难题,真正赋予超氧化物歧化酶在终端产品(包括抗氧化护肤品、皮肤类药品等)中应用的可行性。
6.首先,本发明实现了超氧化物歧化酶的高活力,本发明可以使每毫升超氧化物歧化酶溶液中的活力高达5万单位;图16中,根据wst
‑
8测活方法,当测活体系中的超氧化物歧化酶能够抑制wst
‑
8自氧化速率达50%附近时,所测得的酶活力最准确。上图所示,该超氧化物歧化酶的酶活力为50000u/ml以上。
7.其次,本发明实现了超氧化物的高稳定性,其常温半衰期可达一年以上,即便是在50℃的高温环境,活力依然可以保持60天以上;如附图17所示。
8.再次,本发明实现了超氧化物歧化酶的液体供应,液体储存、液体运输;最重要的,本发明实现了超氧化物歧化酶的穿越细胞膜的能力。
9.本发明是通过如下的技术方案来解决上述的技术问题的:具有越膜能力的、高稳定型的超氧化物歧化酶的制备方法,其步骤如下:从嗜热脂
肪地芽孢杆菌提取mrna,利用反转录手段合成cdna,设计特异性引物大量扩增其编码区,并连接到e.coli表达载体中,然后转化至工程菌bl21(de3)中。
10.本发明人对诱导条件进行摸索,可以确定其表达具有酶活力的蛋白,但是稳定性不够高。于是发明人利用点突变技术对其进行序列改造,经过摸索发明出一种可以大幅提高其热稳定性的序列。之后,发明人对其越膜能力进行改造,利用了越膜肽作为穿越细胞膜的能力,并摸索出连接越膜肽与超氧化物歧化酶的柔性连接子,最终发明出具有高活力、高稳定性、具有越膜能力的超氧化物歧化酶。
11.嗜热脂肪地芽孢杆菌是一种兼性厌氧菌,具有强力的抗氧化能力。cicc 收藏菌株为嗜热脂肪地芽孢杆菌编号为 cicc 10267 株,即 atcc 7953 株,其在营养琼脂上56℃培养 24h 的菌落形态呈浅黄色,表面粗糙湿润,边缘不整齐。
12.具体的,具有越膜能力的、高稳定型的超氧化物歧化酶的制备方法,包括以下的步骤:(1)设计特异性引物序列从天然的嗜热脂肪地芽孢杆菌提取其编码超氧化物歧化酶的序列;(2)将(1)中克隆的超氧化物歧化酶的序列成功连接至原核表达载体中,并设计用于鉴定阳性克隆的引物;(3)获得表达菌株;本发明从嗜热脂肪地芽孢杆菌中克隆的超氧化物歧化酶的蛋白质氨基酸序列为:mpfelpalpypydalephidketmnihhtkhhntyvtnlnaaleghpdlqnksleellsnlealpesirtavrnnggghanhslfwtilspngggeptgeladainkkfgsftafkdefskaaagrfgsgwawlvvnngeleitstpnqdspimegktpilgldvwehayylkyqnrrpeyiaafwnvvnwdevakryseakak;以上的序列是本发明所要重点保护的内容;(4)利用neb公司的点突变试剂盒,将第20位天冬氨酸突变为甘氨酸,并将141位的亮氨酸突变为天冬酰胺;(5)利用柔性多肽连接子gggsgggs,将hiv
‑
1肽段上具有越膜能力的cpp序列ygrkkrrqrrr与超氧化物歧化酶偶联表达,赋予其越膜能力。
13.进行点突变d20g与l141n点突变并且利用柔性多肽连接子gggsgggs将ygrkkrrqrrr序列与超氧化物歧化酶进行融合表达后,其氨基酸序列为: mpfelpalpypydalephigketmnihhtkhhntyvtnlnaaleghpdlqnksleellsnlealpesirtavrnnggghanhslfwtilspngggeptgeladainkkfgsftafkdefskaaagrfgsgwawlvvnngeneitstpnqdspimegktpilgldvwehayylkyqnrrpeyiaafwnvvnwdevakryseakakgggsgggsygrkkrrqrrr;以上的序列,同样也是本发明所要重点保护的内容。
14.优选的,(1)设计特异性引物序列利用rna提取试剂盒提取嗜热脂肪地芽孢杆菌的mrna,然后利用反转录试剂盒合成了该微生物的cdna,然后根据限制性内切酶位点优化特异性引物,钓取其编码超氧化物歧化酶的序列,优化特异性引物序列如下:超氧化物歧化酶钓取上游引物序列:5
’‑
catatgccctttgaactaccagcat
‑3’
超氧化物歧化酶钓取下游引物序列:
5
’‑
aagcttcttcgctttcgcctcgctg
‑3’
。
15.钓取的序列,就是下一步要表达的超氧化物歧化酶的编码序列,即为本发明的关键要点:atgccctttgaactaccagcattaccctatccctatgatgctctagaaccgcacattgacaaggagaccatgaacatccaccacaccaagcaccacaacacctacgtgaccaacctgaacgcggcgctggagggtcacccggacctgcagaacaaaagcctggaggaactgctgagcaacctggaggcgctgccggaaagcatccgtaccgcggttcgtaacaacggtggcggtcacgcgaaccacagcctgttttggaccatcctgagcccgaacggcggtggcgagccgaccggtgaactggcggacgcgattaacaagaaattcggcagctttaccgcgttcaaggatgagtttagcaaagcggcggcgggtcgtttcggtagcggttgggcgtggctggttgtgaacaacggcgagctggaaatcaccagcaccccgaaccaggacagcccgatcatggagggcaagaccccgattctgggcctggatgtgtgggaacacgcgtactatctgaaataccaaaaccgtcgtccggaatatattgcggcgttctggaatgtggtgaactgggacgaggtggcgaagcgttacagcgaggcgaaagcgaagtgaaagctt。
16.优选的,(2)中,选取pet30a载体为表达载体,扩增的序列与载体经过hindiii与ndei双酶切后,用dna凝胶回收试剂盒回收酶切产物,回收后的双酶切产物,按照dna片段:质粒=2:1的优化比例用dna连接酶16℃连接12h,连接后的连接子采用42℃热击法转化至感受态大肠杆菌工程菌e.coli bl21(de3),转化之后的工程菌涂布于含有50ug/ml卡那霉素的lb抗性平板,37℃培养18
‑
26h,形成单克隆,并对克隆进行验证;菌落pcr引物序列如下:菌落pcr上游引物序列:5
’‑
ttaccctatccctatgatgctc
‑3’
菌落pcr下游引物序列:5
’‑
cccaaccgctaccgaaac
‑3’
。
17.优选的,(3)获得表达菌株:选择验证正确的单克隆,进行表达验证,表达条件为:接种单克隆菌落至5ml lb液体培养基,所述的培养基中含卡那霉素50ug/ml,待od600值达到0.7时,加入iptg至终浓度0.5mm,在不同温度下进行诱导,诱导后收集菌体,进行超声裂解,各组分利用sds
‑
page法进行电泳检测。
18.优选的,超声裂解时,超声体积为1ml,超声条件为:超声2s停止3s,总超声时间为10min。
19.优选的,(5)采用柔性多肽连接子
‑
gggsgggs或者是ggggs,ggsggs,ggggg超氧化物歧化酶偶联表达。
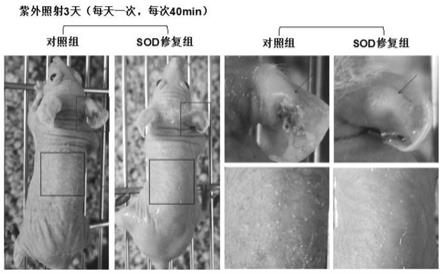
20.(3)中,对裂解上清进行超氧化物歧化酶活性测定的步骤如下:采用wst
‑
8法确定活性后,再分别采用甘油辅助加热法、盐析法、有机溶剂沉淀法、透析法进行纯化,浓缩后用wst
‑
8试剂盒法检测活力;热稳定性检测时,将纯化的超氧化物歧化酶分别置于4℃,75℃,80℃,85℃,90℃,95℃水浴中3小时后,检测酶活力。
21.甘油辅助加热法的步骤如下:在15%甘油中加热至75℃,灭活杂蛋白。
22.活性检测的结果表明,就算得到了可溶性表达的蛋白,也并非一定得获得了具有活力的酶;而本发明通过实验来验证了本发明的方法获得的酶的热稳定性较好,在75℃酶活较高,而随着温度的逐渐升高,酶活的稳定性依然较好。
23.本发明的有益效果在于:(1)本发明人通过从嗜热脂肪地芽孢杆菌提取mrna,利用反转录手段合成cdna,又
设计特异性引物大量扩增其编码区,并连接到e.coli表达载体中,然后转化至工程菌bl21(de3)中,然后又将第20位天冬氨酸突变为甘氨酸,并将141位的亮氨酸突变为天冬酰胺后,最大程度的提高该酶的热稳定性;(2)此外,本发明人将hiv
‑
1肽段上具有越膜能力的cpp序列ygrkkrrqrrr(即trans
‑
activating transcriptional activator序列)与超氧化物歧化酶偶联表达,赋予其越膜能力;最终的结果表明,本发明的超氧化物歧化酶具有优异的热稳定性能、变性剂耐受性能、抗酶解性能,以及较宽范围内的ph稳定性;并且通过在小鼠晒伤修复模型中,验证超氧化物歧化酶作用于晒后皮肤的修复效果,结果表明,本发明所提供的超氧化物歧化酶对于晒后皮肤具有优异的修复效果。
附图说明
24.图1为单克隆菌落的照片;图2为采用菌落pcr的方式鉴定阳性克隆;图3为采用sds
‑
page手段,鉴定本发明所设计的体系中目的蛋白表达情况;图4为采用wst
‑
8法测定超氧化物歧化酶活力;图5为本发明所获得的超氧化物歧化酶在不同温度下孵育后测定的超氧化物歧化酶活力;图6为利用点突变改造后得到的超氧化物歧化酶在不同温度下孵育后测定的超氧化物歧化酶活力;图7为d20g&l141n突变前后的热稳定性比较;图8为引入“越膜肽加柔性多肽连接子
‑
gggsgggs”后偶联的超氧化物歧化酶的可溶性表达与越膜分泌表达;图9为引入“越膜肽加柔性多肽连接子
‑
gggsgggs”之后,再次验证其热稳定性效果图;图10为本发明的超氧化物歧化酶在对于不同酸碱度环境的耐受性;图11为本发明的超氧化物歧化酶对变性剂sds的耐受性检测;图12为本发明的超氧化物歧化酶对消化酶的耐受性检测;图13为本发明的超氧化物歧化酶对防腐剂山梨酸钾的耐受性检测;图14为本发明的超氧化物歧化酶对皮肤晒后修复的功能性验证;图15为本发明的超氧化物歧化酶对日光性皮炎的修复和预防功能的效果验证;图16为本发明超氧化物歧化酶的酶活力为50000u/ml以上的图表;图17为常温和50℃半衰期检测结果。
具体实施方式
25.为了能使本领域技术人员更好的理解本发明,现结合具体实施方式对本发明进行更进一步的阐述。
26.本发明中所采用的试剂盒或原料等生产厂家或采购渠道如下:1.rna提取试剂盒、反转录试剂盒、dna凝胶回收试剂盒:天根生化;
2.pet30a载体:优宝生物;3.wst
‑
8法确定活性的试剂盒:购自碧云天;4. hindiii与ndei:购自abclonal;5. 点突变试剂盒q5 site
‑
directed mutagenesis kit采购自neb(new england biolabs)公司。
27.实施例1具有越膜能力的、高稳定型的超氧化物歧化酶的制备方法,包括以下的步骤:(1)利用rna提取试剂盒(购自天根生化)提取了嗜热脂肪地芽孢杆菌的rna,然后利用反转录试剂盒(购自天根生化)合成了该微生物的cdna,然后设计并根据限制性内切酶位点优化特异性引物(引物序列如下),钓取其编码超氧化物歧化酶的序列。
28.超氧化物歧化酶钓取上游引物序列:5
’‑
catatgccctttgaactaccagcat
‑3’
超氧化物歧化酶钓取下游引物序列:5
’‑ꢀ
aagcttcttcgctttcgcctcgctg
ꢀ‑3’
;(2)选取pet30a载体(购自优宝生物)为表达载体,扩增的序列与载体经过hindiii与ndei(购自abclonal)双酶切后,用dna凝胶回收试剂盒(购自天根生化)回收酶切产物,回收后的双酶切产物,按照dna片段:质粒=2:1(摩尔比)的优化比例,用dna连接酶16℃连接12小时(优化连接条件),连接后的连接子采用42℃热击法转化至感受态大肠杆菌工程菌e.coli bl21(de3),转化之后的工程菌涂布于含有50ug/ml卡那霉素的lb抗性平板,37
°
c培养18
‑
26小时。待单克隆形成后(见图1),采用菌落pcr的方式(菌落pcr引物见下列序列),对克隆进行验证(见图2)。
29.图1 为扩增的超氧化物歧化酶片段与表达载体连接图,并转化只感受态bl21(ed3)之后的工程菌涂布于含有50ug/ml卡那霉素的lb抗性平板,37
°
c培养24小时后,形成的单克隆菌落。
30.图2 采用菌落pcr的方式鉴定阳性克隆图;图中克隆1、2、3、4、5、6、9、10为阳性克隆。
31.菌落pcr上游引物序列:5
’‑
ttaccctatccctatgatgctc
‑3’
;菌落pcr下游引物序列:5
’‑
cccaaccgctaccgaaac
‑3’
;(3)选取验证正确的单克隆,进行表达验证,表达条件为:接种单克隆菌落至5ml lb液体培养基(培养基含卡那霉素50ug/ml),待od600值达到0.7时,加入iptg至终浓度0.5mm(优选的浓度),在多种温度下(16℃、37℃为优选代表)进行诱导。诱导后收集菌体,进行超声裂解(超声体积为1ml,超声条件为超2秒停3秒,总超声时间为10分钟)。
32.实验后,各组分利用sds
‑
page法进行电泳检测(见图3);图3 为采用sds
‑
page手段,鉴定本发明所设计的体系中目的蛋白表达情况。图3中lane1和lane2是点样了不同量的牛血清白蛋白第五组分(bsa
‑
v),属于技术性内参,说明该sds
‑
page工作状态良好。从图中lane3至lane5得出,本系统对于目的蛋白表达良好。从lane6至lane8得出,本系统表达的目的蛋白的可溶性较好。从lane9至lane11得出本系统表达的目的蛋白存在一定的包涵体情况。对比lane8与lane11得出,本系统的表达的蛋白,以可溶性蛋白居多,这样赋予了该蛋白发挥抗氧化的能力。
33.图3证明了本发明获得的是可溶性表达的蛋白,这是本发明成功的关键步骤,若不能获得可溶性表达的蛋白,或得到的蛋白不可溶,则证明该方法是没有实际应用的意义。
34.对所获得的裂解上清进行超氧化物歧化酶活性测定,采用wst
‑
8法(试剂盒购自碧云天)。确定活性后,摸索纯化方式,本发明分别采用甘油辅助加热法(在15%甘油中加热至75度,灭活杂蛋白)、盐析法、有机溶剂沉淀法、透析法等4种主要方法进行纯化,浓缩后用wst
‑
8试剂盒法检测活力显示,活力为24747u/ml(见图4)。
35.图4 采用wst
‑
8法测定超氧化物歧化酶活力,按照试剂盒说明书,当待测样品管的吸光值达到阳性氧化管的1/2时,测定数据最准确。如图中,第一孔表示未加氧化启动液的“阴性氧化管对照”;第二孔表示阳性氧化管(氧自由基可以催化底物产生黄色产物,黄颜色越深,氧化越严重);第三至第六孔,几乎没有颜色,说明酶活力太高无法准确估值;第七孔和第八孔,测得数值接近阳性氧化管的1/2,经计算后,活力为24747
‑
28055u/ml。
36.热稳定性检测,将纯化的超氧化物歧化酶分别置于4℃,75℃,80℃,85℃,90℃,95℃水浴中3小时后,检测酶活力(见图5)。图5 为本发明中得到的超氧化物歧化酶,在不同温度水浴环境中分别孵育3小时,然后用wst
‑
8法测定超氧化物歧化酶活力。从图5中得出结论,本发明所获得的酶具有较为良好的热稳定性,但是在超过80℃时,有较为明显的活力损失。
37.(4)提高超氧化物歧化酶的稳定性为了提高其热稳定性,发明人分析了氨基酸序列特点,筛选出对热稳定性有影响的关键氨基酸位点,并对其进行突变以提高其热稳定性。经过预试实验与研究,发明人最终发现,将第20位天冬氨酸突变为甘氨酸,并将141位的亮氨酸突变为天冬酰胺后,可以最大程度提高该酶的热稳定性(见图6、图7)。
38.图6为利用点突变改造后得到的超氧化物歧化酶,在不同温度水浴环境中分别孵育3小时,然后用wst
‑
8法测定超氧化物歧化酶活力。从结果图中得出,本发明的酶具有出色的热稳定性,即便在90℃的环境加热3小时,活力也没有超过20%的下降。
39.图7 比较d20g&l141n突变前后的热稳定性,从结果图看出,发明人对序列进行突变之后,使其热稳定大大增强。
40.(5)提高超氧化物歧化酶的越膜能力细胞膜具有天然屏障作用,一方面可以保持相对稳定的胞内环境,另一方面可以调节和选择进出细胞的物质。细胞膜由磷脂双分子层构成,因此非脂溶性物质、多肽和蛋白质生物大分子不能随意进入细胞。由于细胞膜的屏障作用,许多具有生物活性的,或者有药用价值的体外生物活性大分子不能进入细胞内发挥作用。经发明人分析,此超氧化物歧化酶并无越膜信号区,所以穿透细胞膜能力极低,本发明需要研发出具备跨膜能力的超氧化物歧化酶。
41.近年来发现一类短肽能自发穿过细胞膜,并且可携带生物大分子进入细胞,具备较强的跨膜转运能力,即细胞跨膜肽(cell penetrating peptides),简称cpp。cpp是一类由数十个氨基酸组成的短肽,能传递生物活性物质进入细胞从而发挥生物学活性产生治疗作用,不会对细胞膜产生永久性损伤,无刺激性,因此作为一种新型的药物运载工具备受青睐。发明人将hiv
‑
1肽段上具有越膜能力的cpp序列ygrkkrrqrrr(即trans
‑
activating transcriptional activator序列)与超氧化物歧化酶偶联表达,赋予其越膜能力。但是,偶
联表达要考虑到蛋白表达空间构象的问题,为了使cpp序列不影响超氧化物歧化酶的正确空间构象,本发明引入柔性多肽连接子
‑
gggsgggs (还可以选择的柔性多肽连接子有ggggs,ggsggs,ggggg), 使偶联的超氧化物歧化酶实现最大程度的可溶性表达与越膜分泌表达(见图8)。
42.图8 本发明引入“越膜肽加柔性多肽连接子
‑
gggsgggs”, 使偶联的超氧化物歧化酶实现最大程度的可溶性表达与越膜分泌表达。
43.从图8中得出,左图为发明人加入越膜肽加柔性多肽连接子
‑
gggsgggs,其目的蛋白集中于培养基中,而不是主要在菌体中。作为对照,右图中加入越膜肽加aaasaaas序列,便无法起到理想的效果。 红色箭头标注的是目的蛋白的位置。
44.引入柔性多肽连接子与cpp序列的方法:购买neb公司的q5 site
‑
directed mutagenesis kit,设计引物如下,利用高保真超长度dna聚合酶q5的能力,将质粒反向扩增,并利用试剂盒自带的kld将新扩增的质粒连成环状。
45.引物1:5
’‑
ccataacttcctcctccacttcctcctccaagctttcacttcgctttcg
‑3’
;引物2:5
’‑
tcgtaagaagcgccgtcaacgtcgccgtattcgccggcctgagctc
‑3’
;利用柔性多肽连接子与cpp序列与超氧化物歧化酶偶联表达,实现可溶性表达与越膜分泌表达后,继续验证发明产物的热稳定性(见图9)、ph稳定性(见图10)、变性剂耐受性(见图11)、抗酶解性能(见图12)、与山梨酸钾配伍性(见图13)。结果显示,本发明具有良好的热稳定性,即使在90度的高温下加热3小时,也能保持80%以上的活性;其中,图9 本发明引入“越膜肽加柔性多肽连接子
‑
gggsgggs”之后,再次验证其热稳定性。如图所示,该超氧化物歧化酶具有出色的热稳定性。
46.图10 测试本发明在对于不同酸碱度环境的耐受性。从结果图中看得出,本发明能够承受较宽的酸碱度,尤其对于碱性环境耐受性非常强,对于酸性环境的耐受性相对较弱,仅在弱酸性环境可以保持活力。
47.图11 检测本发明对变性剂sds的耐受性。从结果图中看得出,本发明对于离子型表面活性剂sds具有很强的耐受性,可见本发明可在日化等多种产品中应用。
48.图12 检测本发明对消化酶的耐受性。2h、5h分别代表胰蛋白酶(购自gibco)消化2小时和消化5小时,从结果图中看得出,本发明对于胰蛋白酶有很强的耐受性,即便是在高浓度的胰蛋白酶中消化5个小时,活力也丝毫不减弱(左图),超氧化物歧化酶蛋白分子量会随着胰蛋白酶消化时间的延长略微减小,但是活力不变,这说明胰蛋白酶仅能降解超氧化物歧化酶的部分侧链,但是不影响活性中心。
49.图13 检测本发明对防腐剂山梨酸钾的耐受性。山梨酸钾是食品与化妆品中的常用防腐剂,其常见使用终浓度为0.05%
‑
0.2%。本发明与不同浓度的山梨酸钾孵育24小时后,检测酶活性。从结果图中看得出,本发明与山梨酸钾的配伍性良好,即便是在高浓度的山梨酸钾中孵育24小时,活力也丝毫不减弱,这说明含有本发明的终端产品中,可以用山梨酸钾作为防腐剂。
50.在验证本发明出色的酶学性能之后,在小鼠晒伤修复模型中,验证皮肤验证超氧化物歧化酶的晒后修复效果(见图14、图15)。超氧化物歧化酶的作用是清除氧自由基,紫外
照射会导致皮肤迅速产生大量的自由基,所以利用裸鼠紫外照射后的修复实验来验证超氧化物歧化酶的透皮吸收性能和抗氧化性能。
51.图14 本发明对于皮肤晒后修复的功能性验证。取裸鼠(balb/c nude)两组,分别给予45分钟的紫外线照射,修复组晒后迅速涂抹200ul活力为300u/ml的本发明,而对照组不涂抹本产品。4天后,可见裸鼠皮肤有明显差异:对照组有明显的褐变、起皱、硬化等现象,而修复组皮肤依然保持健康状态。可见,本产品能够有效修复紫外照射引起的皮肤问题。
52.图15中,本发明对于日光性皮炎的修复和预防功能。取两组裸鼠每天给予40分钟的紫外线照射,修复组晒后迅速涂抹200ul活力为300u/ml的本发明,而对照组不涂抹本产品。如此重复3天后,对照组发生了日光性皮炎,而修复组皮肤无异常。可见,本产品能够有效修复紫外线引起的日光性皮炎。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1