一种海葵多肽毒素Ap-GT及其制备方法和应用
一种海葵多肽毒素ap
‑
gt及其制备方法和应用
技术领域
1.本发明涉及海葵技术领域,特别涉及一种海葵多肽毒素ap
‑
gt及其制备方法和应用。
背景技术:
2.海葵(sea anemone)又名海菊花,隶属于刺胞动物门、珊瑚虫纲、六放珊瑚亚纲。海葵是最原始的后生动物类群之一,也是现存最古老的有毒海洋动物之一,有分子证据和化石资料表明海葵最早起源于7.5亿年前。海葵种类繁多,在全球已记录海葵目1100余种,分属于50科约400属,而中国海葵物种约占世界的1/10,广泛分布在温热带和热带海域。海葵触手上具有刺细胞能够分泌毒液捕食鱼、贝类、桡足类、甲壳类动物以及蠕虫,其毒液中富含各种多肽毒素成分,是重要的海洋药物资源。《中华本草》和《中国药用动物志》记载海葵具有收敛固涩、燥湿杀虫等功效,中医用来治疗脱肛、痔疮、绕虫病等。salgado vl等研究发现shi、cpi和cgii三种海葵毒素对甲壳类动物特别致命,对昆虫(蟑螂)有中等毒性,对哺乳动物(小鼠)基本上无毒。atx
‑
i和atx
‑
ii对昆虫钠通道非常有效,与蟑螂神经膜结合亲和力高,而对大鼠脑突触体的结合亲和力低,所以atx
‑
i和atx
‑
ii优先瞄准昆虫而不是老鼠。某些海葵毒素能够特异作用于昆虫而具有较强的杀虫能力,而对哺乳动物的毒性很小或无毒副作用。海葵多肽毒素作为新型杀虫剂安全又有效。cn111876457a公开套膜海葵酶解多肽的制备及其杀虫应用,为套膜海葵的提取物,为多种序列多肽的混合物,不好以控制成分组成,均不利于提高药剂药效以及安全性。
技术实现要素:
3.鉴于此,本发明提出一种海葵多肽毒素ap
‑
gt及其制备方法和应用,解决上述技术问题。
4.本发明的技术方案是这样实现的:一种海葵多肽毒素ap
‑
gt,
5.其序列为gidctcnghngeywfgvqscngnakhdcssilgrccvy,具有6个半胱氨酸,形成3个二硫键。
6.2、根据权利要求1所述的海葵多肽毒素ap
‑
gt的制备方法,其特征在于,包括以下步骤:
7.(1)取2
‑
cl树脂,用dcm浸泡、洗涤;加入fmoc
‑
tyr(tbu)
‑
oh,加入dcm和diea反应,再加入甲醇和dcm封闭反应;
8.(2)用dmf洗涤步骤(1)处理后的树脂,加入哌啶脱除fmoc,反应后再洗涤树脂;
9.(3)取下一个氨基酸fmoc
‑
val
‑
oh和hobt,加入dmf和dic反应,反应后再洗涤树脂;
10.(4)用dmf洗涤步骤(3)处理后的树脂,加入哌啶脱除fmoc,反应后再洗涤树脂;
11.(5)重复(3),(4)步骤直到肽链结束;
12.(6)取步骤(5)得到的树脂,加入切割液,摇晃切割,过滤除去树脂,得到切割后的滤液,最后将滤液加入冰乙醚,离心,收集底部多肽,得到粗品多肽;
13.(7)将粗品多肽用hplc分离纯化多肽,干燥,得到线性肽ap
‑
gt;
14.(8)取步骤(7)得到的线性肽ap
‑
gt进行氧化折叠,得到氧化肽ap
‑
gt,采用制备型hplc对氧化肽ap
‑
gt进行分离纯化,得到纯品。
15.进一步的,步骤(1),所述2
‑
cl树脂的取代度sd=0.2mmol/g。
16.进一步的,步骤(1),加入dcm、diea反应的时间为80
‑
100min,再加入甲醇、dcm封闭反应的时间20
‑
40min。
17.进一步的,步骤(2)、步骤(4),所述反应的时间均为15
‑
25min。
18.进一步的,步骤(3),加入dic反应的时间为0.8
‑
1.2h。
19.进一步的,步骤(6),按质量百分比计,所述切割液由三氟乙酸95%、水1%、3,4
‑
乙烯二氧噻吩2%和三异丙基硅烷2%制得。
20.进一步的,步骤(6),所述切割的时间为1.8
‑
2.2h。
21.进一步的,步骤(6),所述离心条件:3000转/min离心2min。
22.本发明任一项所述的海葵多肽毒素ap
‑
gt在制备杀虫剂中的应用。
23.本发明中使用原料中文名称见下表1:
24.表1化合物中文名称
[0025][0026]
与现有技术相比,本发明的有益效果是:
[0027]
(1)本发明合成的海葵多肽毒素ap
‑
gt,其序列为gidctcnghngeywfgvqscngnakhdcssilgrccvy,对黄粉虫具有更加显著杀虫作用,半数致死剂量为14.8nm。
[0028]
(2)本发明合成特定序列的海葵多肽毒素ap
‑
gt,在应用中不但能够有效控制其添加量,而且最大发挥其功效,减少药剂用量,最大化提高安全性。
[0029]
(3)本发明获得高效杀虫效果而对哺乳动物毒性小的海洋多肽,可为研发新型、高效、安全生物杀虫剂奠定基础。
附图说明
[0030]
图1
‑
a、图1
‑
b为线性肽ap
‑
gt的高效液相分析和质谱鉴定图谱;
[0031]
图2为线性肽ap
‑
gt的动态氧化折叠过程;
[0032]
图3为hplc分析氧化肽ap
‑
gt图谱;
[0033]
图4多肽ap
‑
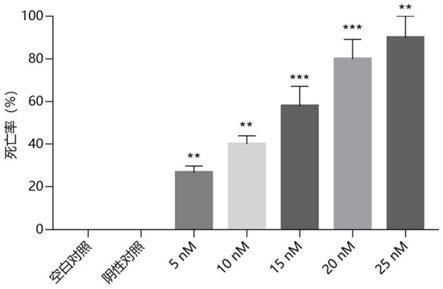
gt对黄粉虫的杀虫作用,注:实验组对比于阴性对照组,*表示具有显著性差异(**p<0.01;***p<0.001)。
具体实施方式
[0034]
为了更好理解本发明技术内容,下面提供具体实施例,对本发明做进一步的说明。
[0035]
本发明实施例所用的实验方法如无特殊说明,均为常规方法。
[0036]
本发明实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0037]
实施例
[0038]
1.材料与方法
[0039]
1.1实验材料
[0040]
色谱级三氟乙酸(trifluoroacetic acid,tfa)和色谱级乙腈(acetonitrile,acn)购自上海阿拉丁生化科技股份有限公司;water分析型c18柱(5μm,4.6mm
×
250mm)购自美国waters公司;依利特制备型c18柱(10μm,10mm
×
250mm)购自大连依利特分析仪器有限公司;质粒抽提试剂盒等常规分子生物学试剂购自天根生化科技(北京)有限公司。
[0041]
1.2实验仪器
[0042]
cem全自动微波多肽合成仪(libertyblue,美国);反相高效液相色谱(thermo fisher,德国);三重四极杆液相色谱质谱联用仪(岛津,日本);台式冻干机(赛飞,中国);酶标仪(mr
‑
96a,深圳迈瑞);膜片钳系统(axon900a,美国)。
[0043]
1.3实验方法
[0044]
1.3.1海葵多肽毒素ap
‑
gt的合成和氧化折叠
[0045]
(1)称取2
‑
cl树脂3g,取代度sd=0.2mmol/g,加入反应器中用dcm(20ml)浸泡5min,用dmf(20)洗涤2次,第三次用dcm洗涤一次,加入0.8mmol的fmoc
‑
tyr(tbu)
‑
oh,加入12ml dcm,2ml diea。反应90min,90min后补加4ml分析甲醇,10ml dcm,封闭反应30min。
[0046]
(2)用dmf洗涤4次,加入哌啶(20%哌啶+80%dmf),脱除fmoc,20min。用dmf洗涤树脂5次,取少量树脂(10
‑
20粒)加入检测管中,加入茚三酮(5g/100ml分析乙醇)2滴,吡啶2滴,100摄氏度加热2min,显色即可。
[0047]
(3)称取下一个氨基酸fmoc
‑
val
‑
oh(1.8mmol)+hobt(1.8mmol),加入反应器中,倒入10ml dmf,在加入2ml dic反应1h之后用dmf洗涤4次,取少量树脂检测,无色即可。
[0048]
(4)用dmf洗涤4次,加入哌啶(20%哌啶+80%dmf),脱除fmoc,20min。用dmf洗涤树脂5次,取少量树脂(10
‑
20粒)加入检测管中,加入茚三酮(5g/100ml分析乙醇)2滴,吡啶2滴,100摄氏度加热2min,显色即可。
[0049]
(5)重复(3),(4)步骤直到肽链结束。
[0050]
(6)把树脂用甲醇抽干放在50ml离心管,加切割液(95%tfa+1%h2o+2%edt+2%tis)40ml,摇晃切割2h,最后把切割液(过滤走树脂)平分在4个新的50ml离心管中,加入40ml冰乙醚,摇晃均匀,3000转/min离心2min,多肽留在底部,倒走上层的乙醚。得到粗品多
肽。
[0051]
(7)用hplc分离纯化多肽,得到纯品多肽,然后由真空冷冻干燥机冻干成粉末状。
[0052]
(8)称取步骤(7)得到的线性肽样品,用少量水助溶后按比例1:2加入0.1mnh4hco3搅拌,于24、48、72h取样用hplc观察动态氧化折叠过程并对其纯化得到纯品,随后用质谱进行鉴定确认。
[0053]
1.3.2昆虫注射法
[0054]
选用体重约180mg的黄粉虫进行昆虫注射法,具体步骤参照文献“芋螺毒素imi的化学合成及其杀虫活性研究”。简单描述如下:用0.7wt%nacl溶液将多肽ap
‑
gt溶解至5nm、10nm、15nm、20nm和25nm,注射5μl多肽ap
‑
gt至黄粉虫腹部。以未做任何处理黄粉虫作为空白对照,5μl 0.7wt%nacl溶液注射黄粉虫作为阴性对照组。
[0055]
1.3.3数据处理
[0056]
数据均采用软件graphpad prism6进行统计和处理,对照组和实验组间的数据采用t检验分析,*表示差异显著(p<0.05),**表示差异极显著(p<0.01)。
[0057]
2结果
[0058]
2.1多肽的合成和氧化折叠
[0059]
采用多肽固相合成法(spps)合成了线性肽ap
‑
gt,对线性肽进行hplc纯化,经质谱鉴定分子量为4112.57da(见图1
‑
b)。利用空气氧化法对合成的线性肽ap
‑
gt进行一步法氧化折叠,于24、48、72h取样用hplc观察动态氧化折叠过程(见图2)。线性肽ap
‑
gt的理论分子量为4112.57da,氧化肽ap
‑
gt的分子量为4106.62,两者相差约为6da,证明其正确形成3个二硫键。
[0060]
2.2氧化肽的分离纯化
[0061]
采用制备型hplc对氧化肽ap
‑
gt进行分离纯化,纯化后再利用分析型hplc进行分析,结果如图3所示,氧化肽ap
‑
gt的洗脱时间为17.477min,根据峰面积计算其纯度超过95%。
[0062]
2.3昆虫注射法
[0063]
实验结果如图4所示,空白对照和阴性对照组的黄粉虫死亡率均为0,表明采用注射法来评价多肽ap
‑
gt的杀虫效果是可行的。黄粉虫的死亡率均随着多肽ap
‑
gt的剂量增加而增加,与对照组相比均具有显著性差异。高剂量25nm多肽ap
‑
gt对昆虫的死亡率达到90.0%,经软件计算半数致死剂量为14.8nm。同一死亡率下多肽ap
‑
gt用量仅为套膜海葵小分子多肽混合物0.3%以下,可以显著减少杀虫药剂用量。
[0064][0065]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1