一种洛索洛芬钠工艺杂质的合成方法与流程
1.本发明涉及一种洛索洛芬钠工艺杂质的合成方法。
背景技术:
2.洛索洛芬钠(loxoprofen sodium),属于苯丙酸类非甾体消炎药,由日本三共株式会社研制,1986年日本上市,为日本非甾体抗炎药中销量第一的品种。洛索洛芬钠与同类药物相比具有更强、更快、更安全的作用特点,其结构式如下:。
3.原料药中工艺杂质是目前原料药质量控制的关键,由于杂质化学结构不同于原料药,且缺乏毒理学数据,可能会对人体产生影响,因此对未知工艺杂质进行鉴定并进行毒理学评估具有重要的意义。洛索洛芬钠各国药典质量标准中没有规定工艺杂质,日本药典用薄层色谱(tlc)技术控制有关物质,没有公开文献研究洛索洛芬钠杂质,特别是对洛索洛芬钠工艺杂质的研究。处于为患者负责,为临床提供优质产品的考虑,应该对洛索洛芬钠工艺杂质开展研究。
技术实现要素:
4.提供式iv所述洛索洛芬钠工艺杂质的制备方法,为洛索洛芬钠质量研究提供对照品。
5.申请人对国内不同厂家生产的洛索洛芬钠进行质量对比研究发现,都存在一个共同的未知工艺杂质,其大小在0.03%~0.09%之间,属于含量较大杂质,也是洛索洛芬钠主要杂质,其化学式如下:。
6.目前没有该式iv所述洛索洛芬钠杂质研究的报道,也没有市售式iv所述洛索洛芬钠杂质质量研究用对照品。因此提供式iv所述洛索洛芬钠杂质的合成方法用于洛索洛芬钠质量研究具有重要的现实意义。
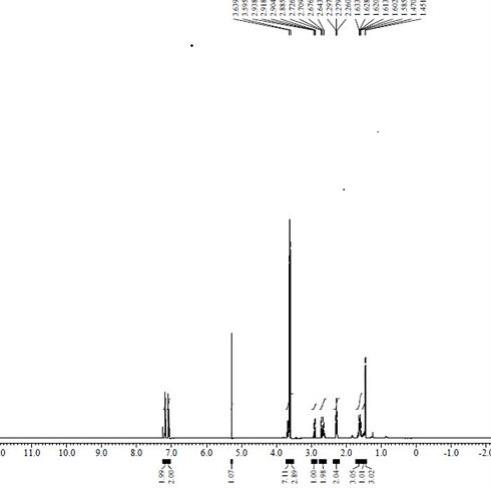
7.式iv所述洛索洛芬钠工艺杂质的1h nmr图谱参数为:1h nmr(400mhz ,dmso
‑
d6) δ12.16(s,2h),δ7.25~7.12(m,4h),δ3.62(q,1h),δ3.39(s,1h),δ2.78~2.74(m,1h),δ2.68~2.63(m,1h),δ2.51~2.49(m,1h),δ2.20~2.17(m,2h),δ1.53~1.43(m,3h),δ1.33(d,3h)。所述式ⅳ化合物的
13
cnmr图谱参数为:
13
c nmr(400mhz ,dmso
‑
d6) δ176.29,175.59,174.41,139.06,138.14,129.06,129.00,128.37,127.39,125.48, 46.78,44.42,37.40,33.65,31.35,22.50,21.20,18.6。
8.所述式ⅳ化合物的ir参数为:ir(kbr ,cm
‑
1):2947.66,1703.79,1513.94,1494.46,1457.98,1417.03,1288.96,1227.45;所述式ⅳ化合物的ms参数为:esi
‑
ms m/z 309.13(m+h
+
) ,326.16(m+nh
4+
) ,931(m+k+)。
9.式ⅳ所述洛索洛芬钠工艺杂质的合成方法,工艺路线如下:所述洛索洛芬钠工艺杂质的合成方法,工艺路线如下:。
10.具体的,本发明式ⅳ所述洛索洛芬钠工艺杂质的合成方法,包括以下步骤:步骤1. 式ⅰ化合物与式ⅱ化合物在甲醇溶剂中与甲醇钠反应得到式ⅲ化合物。
11.优选的,式ⅰ与甲醇钠投料摩尔比为1.0:2.0~3.5,更优选2.5~3.0。当甲醇钠投料摩尔数在式i摩尔数的2.0倍以下时,反应不完全,导致式ⅲ化合物纯度和收率均不高,详见对照例2。
12.优选的,反应温度为
‑
20~50℃,更优选的0~10℃。本步骤若反应温度超过50℃,会严重影响式ⅲ化合物的纯度,60℃时所得式ⅲ化合物的纯度低于90%,详见对照例1。
13.反应温度低于
‑
20℃,反应速度会明显变慢。详见对照例3。
14.步骤2. 式ⅲ化合物在无机酸的作用下发生水解反应得到式ⅳ化合物,所述无机酸选自氢溴酸、盐酸中的一种,优选盐酸。
15.水解步骤如果选择硫酸,将影响水解步骤的收率。
16.有益效果:本发明提供了一种洛索洛芬钠工艺杂质式ⅳ化合物的具体合成方法,具有工艺简单,操作简便,收率良好,纯度高等优点。为洛索洛芬钠原料药和制剂的质量控制提供了标准对照品。
17.由于洛索洛芬钠精制工艺对此杂质的去除效果较差,导致此杂质在洛索洛芬钠成品中残留,随着我国一致性评价工作的推进,制剂生产厂家对洛索洛芬钠原料药中的未知工艺杂质会越来越重视,因此定向合成该杂质对洛索洛芬钠原料药的质量控制有着重要意
义。
附图说明
18.图1. 实施例1中步骤1制得的制得式ⅲ化合物核磁共振氢谱。
19.图2. 实施例1中步骤2制得的式ⅳ化合物核磁共振氢谱。
20.图3. 实施例1中步骤2制得的式ⅳ化合物核磁共振碳谱图。
21.图4. 实施例1中步骤2制得的式ⅳ化合物质谱图。
22.图5. 实施例1中步骤2制得的式ⅳ化合物红外谱图。
23.具体实施例:实施例1步骤1. 式ⅲ化合物的制备:向1000ml三口瓶中投入无水甲醇275ml,加入式ⅱ化合物(2
‑
甲氧羰基环戊酮)(31.93g,224.6mmol),维持20~30℃加入甲醇钠(34.67g,641.71mmol),搅拌10min,降温至0~5℃,滴加式i化合物(对溴甲基异苯丙酸甲酯)(55.00g,213.9 mmol)和100ml甲醇的混合液,滴毕,于0~5℃保温反应5h ,tlc点板中控(展开剂:二氯甲烷:甲醇=10:1),显示原料点无剩余, 于45℃下减压浓缩蒸干,加入二氯甲烷100ml溶清,水50ml洗涤分层得二氯甲烷层,浓缩蒸干后得黄色油状物式ⅲ化合物66.43g, 收率88.64%, hplc纯度为96.62%。1h
‑
nmr (400 mhz, cdcl3) δ7.23(2h, d), 7.18(2h, d),3.69~3.64(7h, m),3.61(3h,d),2.94~2.89(1h,m),2.73~2.64(2h,m),2.30~2.26 (2h,m),1.63~1.59(4h,m),1.461(3h,d)。
24.步骤2. 式ⅳ化合物的制备:向250ml三口瓶中投入式ⅲ化合物 (50g, 142.69mmol), 48%氢溴酸(120.27g,713.46mmol),搅拌升温至回流反应5h,停止加热,降温搅拌至50℃,加入100.0ml乙酸乙酯,搅拌分液,上层有机相用50ml
×
3饮用水洗涤,所得有机相加入正庚烷300ml,降温至0~5℃搅拌析晶5h,抽滤,滤饼用100.0ml正庚烷淋洗,所得固体40~50℃鼓风干燥至恒重,收料得式ⅳ化合物39.74g,收率90.31%,纯度99.47%。 1
h nmr(400mhz ,dmso
‑
d6) δ12.16(s,2h),δ7.25~7.12(m,4h),δ3.62(q,1h),δ3.39(s,1h),δ2.78~2.74(m,1h),δ2.68~2.63(m,1h),δ2.51~2.49(m,1h),δ2.20~2.17(m,2h),δ1.53~1.43(m,3h),δ1.33(d,3h)。实施例2步骤1. 式ⅲ化合物的制备:向1000ml三口瓶中投入无水甲醇275ml,加入式ⅱ化合物(2
‑
甲氧羰基环戊酮)(31.93g,224.6mmol),维持20~30℃加入甲醇钠(23.11g,427.80mmol),搅拌10min,降温至0~5℃,滴加式i化合物(对溴甲基异苯丙酸甲酯) (55.00g,213.9mmol)和100ml甲醇的混合液,滴毕,升温至45~50℃保温反应3h ,tlc点板中控(展开剂:二氯甲烷:甲醇=10:1),显示原料点无剩余,于45℃下减压浓缩蒸干,加入二氯甲烷100ml溶清,水50ml洗涤分层得二氯甲烷层,浓缩蒸干后得黄色油状物式ⅲ化合物62.62g, 收率83.55%, hplc纯度为93.89%。
25.步骤2. 式ⅳ化合物的制备:向250ml三口瓶中投入式ⅲ化合物(50g, 142.69mmol), 36%盐酸(139.94g, 1.43mol),搅拌升温至回流反应5h,停止加热,降温搅拌至50℃,加入100.0ml乙酸乙酯,搅拌分液,上层有机相用50ml
×
3饮用水洗涤,所得有机相加入正庚烷300ml,降温至0~5℃搅
拌析晶5h,抽滤,滤饼用100.0ml正庚烷淋洗,所得固体40~50℃鼓风干燥至恒重,收料得式ⅳ化合物38.33g,收率87.12%,纯度97.62 %。
26.实施例3步骤1. 式ⅲ化合物的制备:向1000ml三口瓶中投入无水甲醇275ml,加入式ⅱ化合物(2
‑
甲氧羰基环戊酮)(31.93g,224.6mmol),维持20~30℃加入甲醇钠(40.45g,748.80mmol),搅拌10min,降温至0~5℃,滴加式i化合物(对溴甲基异苯丙酸甲酯)(55.00g,213.9mmol)和100ml甲醇的混合液,滴毕,升温至5~10℃保温反应4h ,tlc点板中控(展开剂:二氯甲烷:甲醇=10:1),显示原料点无剩余, 于45℃下减压浓缩蒸干,加入二氯甲烷100ml溶清,水50ml洗涤分层得二氯甲烷层,浓缩蒸干后得黄色油状物式ⅲ化合物66.30g, 收率88.46%, hplc纯度为96.90%。
[0027] 步骤2. 式ⅳ化合物的制备:向250ml三口瓶中式ⅲ化合物(50g, 142.69mmol), 48%氢溴酸(120.27g, 713.46mmol),搅拌升温至回流反应5h,停止加热,降温搅拌至50℃,加入100.0ml乙酸乙酯,搅拌分液,上层有机相用50ml
×
3饮用水洗涤,所得有机相加入正庚烷300ml,降温至0~5℃搅拌析晶5h,抽滤,滤饼用100.0ml正庚烷淋洗,所得固体40~50℃鼓风干燥至恒重,收料得式ⅳ化合物39.36g,收率89.46%,纯度99.20 %。
[0028]
实施例4步骤1. 式ⅲ化合物的制备:向1000ml三口瓶中投入无水甲醇275ml,加入式ⅱ化合物(2
‑
甲氧羰基环戊酮)(31.93g,224.6mmol),维持20~30℃加入甲醇钠(28.89g,534.80mmol),搅拌10min,降温至0~5℃,滴加式i化合物(对溴甲基异苯丙酸甲酯)(55.00g,213.9mmol)和100ml甲醇的混合液,滴毕,降温至
‑
20~
‑
15℃保温反应8h ,tlc点板中控(展开剂:二氯甲烷:甲醇=10:1),显示原料点无剩余, 于45℃下减压浓缩蒸干,加入二氯甲烷100ml溶清,水50ml洗涤分层得二氯甲烷层,浓缩蒸干后得黄色油状物式ⅲ化合物66.32g, 收率88.50%, hplc纯度为94.29%。
[0029]
步骤2. 式ⅳ化合物的制备:向250ml三口瓶中投入式ⅲ化合物(50g, 142.69mmol), 36%盐酸(139.94g, 1.43mol),搅拌升温至回流反应5h,停止加热,降温搅拌至50℃,加入100.0ml乙酸乙酯,搅拌分液,上层有机相用50ml
×
3饮用水洗涤,所得有机相加入正庚烷300ml,降温至0~5℃搅拌析晶5h,抽滤,滤饼用100.0ml正庚烷淋洗,所得固体40~50℃鼓风干燥至恒重,收料得式ⅳ化合物39.50g,收率89.8%,纯度99.62 %。
[0030]
实施例5步骤1. 式ⅲ化合物的制备:向1000ml三口瓶中投入无水甲醇275ml,加入式ⅱ化合物(2
‑
甲氧羰基环戊酮)(31.93g,224.6mmol),维持20~30℃加入甲醇钠(31.20g,577.56mmol),搅拌10min,降温至0~5℃,滴加式i化合物(对溴甲基异苯丙酸甲酯)(55.00g,213.9mmol)和100ml甲醇的混合液,滴毕,0~5℃保温反应5h ,tlc点板中控(展开剂:二氯甲烷:甲醇=10:1),显示原料点无剩余, 于45℃下减压浓缩蒸干,加入二氯甲烷100ml溶清,水50ml洗涤分层得二氯甲烷层,浓缩蒸干后得黄色油状物式ⅲ化合物66.59g, 收率88.86%, hplc纯度为95.31%。
[0031]
步骤2. 式ⅳ化合物的制备:向250ml三口瓶中投入式ⅲ化合物(50g, 142.69mmol), 48%氢溴酸(120.27g, 713.46mmol),搅拌升温至回流反应5h,停止加热,降温搅拌至50℃,加入100.0ml乙酸乙酯,搅拌分液,上层有机相用50ml
×
3饮用水洗涤,所得有机相加入正庚烷300ml,降温至0~5℃搅拌析晶5h,抽滤,滤饼用100.0ml正庚烷淋洗,所得固体40~50℃鼓风干燥至恒重,收料得式ⅳ化合物39.28g,收率89.28%,纯度99.92 %。
[0032]
对照例1步骤1. 式ⅲ化合物的制备:向1000ml三口瓶中投入无水甲醇275ml,加入式ⅱ化合物(2
‑
甲氧羰基环戊酮)(31.93g,224.6mmol),维持20~30℃加入甲醇钠(34.67g,641.71mmol),搅拌10min,降温至0~5℃,滴加式i化合物(对溴甲基异苯丙酸甲酯)(55.00g,213.9mmol)和100ml甲醇的混合液,滴毕,升温至60℃保温反应2.5h ,tlc点板中控(展开剂:二氯甲烷:甲醇=10:1),显示原料点无剩余, 于45℃下减压浓缩蒸干,加入二氯甲烷100ml溶清,水50ml洗涤分层得二氯甲烷层,浓缩蒸干后得黄色油状物式ⅲ化合物65.97g, 收率88.02%, hplc纯度为85.20%。
[0033]
步骤2. 式ⅳ化合物的制备:向250ml三口瓶中投入式ⅲ化合物(50g, 142.69mmol), 36%盐酸(139.94g,1.43mol),搅拌升温至回流反应5h,停止加热,降温搅拌至50℃,加入100.0ml乙酸乙酯,搅拌分液,上层有机相用50ml
×
3饮用水洗涤,所得有机相加入正庚烷300ml,降温至0~5℃搅拌析晶5h,抽滤,滤饼用100.0ml正庚烷淋洗,所得固体40~50℃鼓风干燥至恒重,收料得式ⅳ化合物38.75g,收率88.06%,纯度89.19 %。
[0034]
对照例2步骤1. 式ⅲ化合物的制备:向1000ml三口瓶中投入无水甲醇275ml,加入式ⅱ化合物(2
‑
甲氧羰基环戊酮)(31.93g,224.6mmol),维持20~30℃加入甲醇钠(17.33g,320.85mmol),搅拌10min,降温至0~5℃,滴加式i化合物(对溴甲基异苯丙酸甲酯)(55.00g,213.9mmol)和100ml甲醇的混合液,滴毕,升温至5~10℃保温反应4h ,tlc点板中控(展开剂:二氯甲烷:甲醇=10:1),显示原料点无剩余, 于45℃下减压浓缩蒸干,加入二氯甲烷100ml溶清,水50ml洗涤分层得二氯甲烷层,浓缩蒸干后得黄色油状物式ⅲ化合物66.08g, 收率86.16%, hplc纯度为87.25%。
[0035]
步骤2. 式ⅳ化合物的制备:向250ml三口瓶中投入式ⅲ化合物(50g, 142.69mmol), 50%硫酸(34.96g, 178.36mmol),搅拌升温至回流反应5h,停止加热,降温搅拌至50℃,加入100.0ml乙酸乙酯,搅拌分液,上层有机相用50ml
×
3饮用水洗涤,所得有机相加入正庚烷300ml,降温至0~5℃搅拌析晶5h,抽滤,滤饼用100.0ml正庚烷淋洗,所得固体40~50℃鼓风干燥至恒重,收料得式ⅳ化合物22.98g,收率52.23%,纯度89.02 %。
[0036]
对照例3步骤1. 式ⅲ化合物的制备:向1000ml三口瓶中投入无水甲醇275ml,加入式ⅱ化合物(2
‑
甲氧羰基环戊酮)(31.93g,224.6mmol),维持20~30℃加入甲醇钠(21.95g,406.41mmol),搅拌10min,降温至0~5℃,滴加式i化合物(对溴甲基异苯丙酸甲酯) (55.00g,213.9mmol)和100ml甲醇的混合
液,滴毕,降温至
‑
30℃保温反应8h ,tlc点板中控(展开剂:二氯甲烷:甲醇=10:1),显示原料点无剩余,于45℃下减压浓缩蒸干,加入二氯甲烷100ml溶清,水50ml洗涤分层得二氯甲烷层,浓缩蒸干后得黄色油状物式ⅲ化合物42.22g, 收率56.2%, hplc纯度为93.21%。
[0037]
步骤2. 式ⅳ化合物的制备:向250ml三口瓶中投入式ⅲ化合物(50g, 142.69mmol), 36%盐酸(139.94g, 1.43mol),搅拌升温至回流反应5h,停止加热,降温搅拌至50℃,加入100.0ml乙酸乙酯,搅拌分液,上层有机相用50ml
×
3饮用水洗涤,所得有机相加入正庚烷300ml,降温至0~5℃搅拌析晶5h,抽滤,滤饼用100.0ml正庚烷淋洗,所得固体40~50℃鼓风干燥至恒重,收料得式ⅳ化合物34.33g,收率78.02%,纯度95.32 %。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1