修饰的阿柏西普、组合物、方法及其在基因治疗中的应用与流程
1.本发明涉及基因治疗领域。
背景技术:
2.血管内皮生长因子(vegf)是体内最经典的血管生成因子,可促进血管生成,增强血管通 透性。vegf异常可导致包括湿性年龄相关性黄斑变性(wet
‑
amd、湿性amd)、糖尿病视网膜 病变(dr)等在内的多种眼部疾病。湿性amd的特征是视网膜下脉络膜新生血管(cnv)形成。 湿性amd影响全球超过250万人,该疾病是60岁以上患者严重视力丧失的主要原因。
3.在湿性amd和增殖期dr(proliferative stage dr)患者中,患者眼中的vegf水平相较于 健康个体显著增加。cnv与vegf表达增加之间的一致和强烈的关联性是探索抗vegf药物治 疗该疾病的疗效的合理基础。目前通常使用注射vegf重组蛋白(例如阿柏西普)和贝伐单抗来 治疗湿性amd和dr。然而,由于导致vegf增加的病理持续存在,并且vegf的产生是慢性 的,因此当vegf中和蛋白的玻璃体水平降至治疗水平以下时,血管渗漏和新血管生长会复发。 因此传统眼部注射给药面临持续给药所带来的患者耐受性差,以及注射相关的手术并发症,如眼 内炎症、孔源性视网膜脱离、眼压升高、眼出血等问题。腺相关病毒(aav)基因治疗可以通过 单次注射诱导视网膜细胞中长期的抗vegf蛋白表达,因此大大降低了多次眼内注射重组抗 vegf蛋白的风险。aav具有独特的特性(例如非致病性)并且具有持久的转基因表达,这使其 成为极具吸引力的治疗性基因递送载体。
4.目前两个针对湿性amd的aav疗法(advm
‑
022和rgx
‑
314)正在临床试验过程中。然 而,部分患者在临床试验中对目前的基因治疗反应不佳,在治疗过程中需要进行重组抗vegf蛋 白的抢救注射。例如,在一组患者中,50%的患者在rgx
‑
314治疗后的1.5年需要进行补充(rescue) 注射。因此,我们采用了多种优化策略,包括优化调节因子、使用密码子优化的转基因编码区等 来增强抗vegf蛋白的分泌。我们在体外和体内筛选了这些aav表达盒,旨在实现一致的长期 抗vegf蛋白表达以及良好的患者耐受性和维持或改善视力的功效。
5.此外,本发明还提供了同时携带阿柏西普和其他治疗性多肽编码基因(axt
‑
107、色素内皮 衍生因子(pedf)或内皮抑素(endostatin,eds))双顺反子的载体、aav病毒(如aav8等) 载体。aav基因疗法是通过视网膜下注射到眼睛中进行的。使用免疫测定法在给药后眼组织中测 量抗血管生成蛋白的表达。在啮齿动物cnv模型中测试了aav基因治疗提供双重抗血管生成蛋 白的功效。
6.axt
‑
107是一种源自iv型胶原蛋白的模拟肽。已在临床前研究中报道了该肽对新生血管形 成(nv)具有抑制作用。
7.色素内皮衍生因子(pedf)属于丝氨酸蛋白酶抑制剂(serpin)家族。在amd患者中,rpe 细胞、rpe基底层、布鲁赫膜和脉络膜基质中的pedf显著降低。这些数据表明pedf和vegf 之间存在关键平衡,并且有观点认为pedf可能能够抵消vegf的血管生成潜力。pedf的
减少 可能会破坏这种平衡并在amd中诱发脉络膜新生血管(cnv)。pedf由多个功能域组成,包括 34
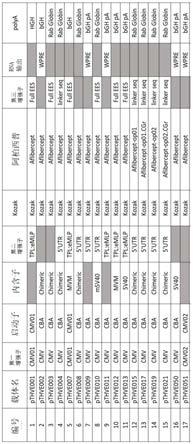
‑
mer抗血管生成域、胶原结合域、44
‑
mer细胞分化域、肝素结合域、透明质酸域、层粘连蛋白 结合域、磷酸化域、神经营养域和肿瘤细胞凋亡域。
8.内皮抑素(endostatin,eds)是血管生成的内源性抑制剂,内皮抑素是胶原xviii的20kda 的c端片段。
技术实现要素:
9.本发明的目的之一在于提供表达阿柏西普的载体,以用于最佳表达阿柏西普,进而实现更好 的治疗效果。
10.在一个实施方案中,本发明公开了一种多核苷酸,其包含cmv增强子(如seq id no:2所 示)、cba启动子(如seq id no:3所示)、嵌合内含子(如seq id no:4所示)、kozak序列(如 seq id no:6所示)、阿柏西普编码序列、wpre序列(如seq id no:12所示),和bgh polya 序列(如seq id no:13所示)。其中,本发明的表达载体中,阿柏西普编码序列可以如seq idnos:7
‑
9,18
‑
19所示。
11.在一些实施方案中,本发明的阿柏西普编码序列(如seq id nos:7
‑
9,18
‑
19)还可以在其3
’ꢀ
末端含有终止密码子(tga、tag、taa)。例如,在seq id nos:7
‑
9的3’末端添加tga,或在 seq id nos:18
‑
19的3’末端添加taa。
12.其中,本发明的多核苷酸还可以包含编码其他治疗性多肽(如axt
‑
107、内皮抑素(eds183) 或色素内皮衍生因子(pedf34))的多核苷酸。其中优选地,axt
‑
107包含seq id no:36所示 序列;eds183包含seq id no:37所示序列;pedf34包含seq id no:38所示序列。其中,阿 柏西普编码序列与所述其他治疗性多肽编码序列之间以可切割肽(如p2a或t2a)编码序列和信 号肽编码序列相连。其中,优选地,所述p2a编码序列包含选自seq id no:46,49
‑
50所示序列; 其中,优选地,所述t2a编码序列分别包含seq id no:47所示序列。其中,优选地,所述信号 肽编码序列如seq id nos:31
‑
35,48所示,更优选地,所述信号肽编码序列如seq id nos:31,35, 48所示。
13.在一个实施方案中,本发明公开了重组病毒载体,其包含如前所述的本发明的多核苷酸。其 中优选地,所述病毒载体是腺相关病毒载体(aav载体)。其中更优选地,所述aav载体选自以 下任一血清型:aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10, 或aav11。其中最优选地,所述aav是aav8。
14.在一个实施方案中,本发明公开了重组病毒载体,其包含以下元件:(a)第一aav2反向末 端重复(itr)序列(如seq id no:1所示),(b)cmv增强子(如seq id no:2所示)、(c)cba 启动子(如seq id no:3所示)、(d)嵌合内含子(如seq id no:4所示)、(e)kozak序列(如 seq id no:6所示)、(f)阿柏西普编码序列、(g)wpre序列(如seq id no:12所示)、(h)bghpolya序列(如seq id no:13所示),和(i)第二aav2 itr(如seq id no:15所示)。
15.在一个实施方案中,本发明公开了以下重组病毒载体:pthve002(seq id no:17)、 pthve075(seq id no:40)、pthve077(seq id no:41)、pthve085(seq id no:43)、pthve088 (seq id no:44)。
16.在一个实施方案中,本发明提供了包含本发明的多核苷酸或病毒载体的宿主细胞。
17.在一个实施方案中,本发明提供了包含本发明的多核苷酸或病毒载体的组合物。
18.在一个实施方案中,本发明提供了向分离的哺乳动物细胞中递送本发明的多核苷酸的方法, 其包括向所述哺乳动物细胞施用本发明的多核苷酸,病毒载体或组合物,从而将所述多核苷酸递 送至所述哺乳动物细胞。
19.在一个实施方案中,本发明提供了本发明的的多核苷酸、重组病毒载体、组合物在制备治疗 哺乳动物(如人)眼部疾病的药物中的用途,其中优选地,所述眼部疾病为新生血管(湿性)年 龄相关性黄斑变性(wet
‑
amd)、视网膜静脉阻塞后黄斑水肿、糖尿病性黄斑水肿(dme)或与dme 相关的糖尿病性视网膜病变;更优选地,所述疾病为wet
‑
amd。
20.在一个实施方案中,本发明提供了治疗哺乳动物(如人)眼部疾病的方法,其包括(1)提 供本发明的多核苷酸或病毒载体;和(2)向所述哺乳动物施用所述多核苷酸或病毒载体,其中 所述阿柏西普和或其他治疗性蛋白(如axt
‑
107、内皮抑素(eds)或色素内皮衍生因子(pedf)) 在所述哺乳动物中表达。优选地,所述疾病为新生血管(湿性)年龄相关性黄斑变性(wet
‑
amd)、 视网膜静脉阻塞后黄斑水肿、糖尿病性黄斑水肿(dme)或与dme相关的糖尿病性视网膜病变。 更优选地,所述疾病为wet
‑
amd。
21.一方面,通过玻璃体内注射或视网膜下注射的方式,将本发明的多核苷酸或病毒载体施用至 哺乳动物(如人)的眼睛。
附图说明
22.图1显示了本发明部分构建体的结构示意图。图中aflibercept序列如seq id no:7所示, aflibercept
‑
op01序列如seq id no:8所示,aflibercept
‑
op01.cgr序列如seq id no:9所示, aflibercept
‑
op02序列如seq id no:18所示,aflibercept
‑
op02.cgr序列如seq id no:19所示。
23.图2显示了aav表达载体pthve002的质粒图谱。
24.图3显示了转染了本发明的载体在hek293细胞中阿柏西普的体外表达水平,结果显示, pthve002和pthve004的阿柏西普表达水平比pthve001高15倍。
25.图4显示了pthve001和pthve002两构建体阿柏西普的体内表达情况。使用aav2.7m8 和aav8衣壳包装前述两构建体,然后将包装后的4种病毒注射入c57bl/6小鼠。aav2.7m8病 毒经由ivt(玻璃体内)和sr(视网膜下)途径注射;aav8病毒仅经由sr途径注射。结果显 示,含pthve002的aav2.7m8在ivt或sr注射后具有相似的阿柏西普表达量。与pthve001 相比,pthve002具有更好的转基因表达水平。当使用sr注射方式时,含pthve002的aav8 具有最高的阿柏西普表达量。
26.图5显示了包装有pthve001、pthve002、pthve003、pthve004、pthve008、pthve009、 pthve010、pthve011、pthve012和pthve013的aav7m8病毒在高给药剂量和低给药剂量 下,阿柏西普的体内表达水平。结果显示,无论是在高给药剂量还是在低给药剂量下,与其他载 体相比,pthve002均表现出优异的阿柏西普表达水平。
27.图6显示了含有pthve004、pthve015、pthve017、pthve019和pthve021的5种aav7m8 病毒载体在动物体内的阿柏西普表达水平。分别向野生型小鼠眼中注射2种剂量水平的前述病毒, 结果显示,与含野生型阿柏西普编码序列的pthve004相比,含密码子优化的阿柏西普序列的 pthve015、pthve017、pthve019和pthve021具有显著提高的阿柏西普体内表达
水平。
28.图7显示了本发明部分构建体的结构示意图。
29.图8显示了转染hela细胞72小时后,含有仅阿柏西普(pthve091和pthve092)、阿柏西 普和atx
‑
107(pthve076、pthve077、pthve078、pthve079、pthve080、pthve081、 pthve082、pthve093)、阿柏西普和pedf
‑
34(pthve086、pthve087、pthve088)、阿柏西 普和内皮抑素(pthve083、pthve084、pthve085)等质粒中治疗基因的体外表达情况。其中, 图8a
‑
8d分别显示了阿柏西普(图8a)、内皮抑素(eds)(图8b)、axt
‑
107(图8c)、pedf
‑
34 (图8d)在细胞上清液和细胞沉淀(cell pellet)中的表达情况。
30.图9显示了大鼠激光诱导的cnv模型中,视网膜下(sr)分别施用6种aav载体(v571,v592, v577,v588,v584,v585)的体内效果。其中v571,v592,v577,v588,v584,v585中分别含有 pthve075,pthve092,pthve077,pthve088,pthve084和pthve085表达盒。通过荧光血管 造影术(fa)测试减少血管渗漏(lesion)的功效。通过单向方差分析和dunnett多重比较检验进 行统计分析。**p<0.01。n表示每组中合格渗漏的总数。商业化的临床级eylea(活性成分为阿柏 西普蛋白)用作阳性对照,并在激光光凝后进行玻璃体内注射给药。
具体实施方式
31.下面结合具体实施例,进一步阐述本发明。所描述的实施例是本发明一部分实施例,而不是 全部的实施例。应理解,举出以下实施例是为了向本发明所属技术领域的一般专业人员就如何利 用本发明之方法和组合物提供一个完整的公开和说明,并非用于限制本发明的范围。基于本发明 中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属 于本发明保护的范围。
32.实施例1.体内模型中评估aav2.7m8在视网膜细胞中靶向和表达蛋白的能力
33.对野生型c57bl/6小鼠进行1μl体积的8x 109ssaav2.7m8
‑
gfp颗粒的眼内给药,并评 估gfp的表达。在视网膜下注射后的第21天,aav2.7m8
‑
gfp在视网膜下注射泡周围的视网 膜细胞层中以高水平表达。在pbs对照处理的动物中未检测到gfp表达。
34.实施例2.重组质粒的构建
35.通过常规分子生物学方法构建了本发明的表达盒以及含所述表达盒的病毒载体。简短来说, 合成供体载体pdonr221,并通过vector builder(addgene,pdonr 221)确认序列。合成转基因 orf(阿柏西普)并在其3’末端添加终止密码子序列,通过bp反应克隆到供体载体中以创建 基因输入载体(gene entry vector),并通过桑格测序确认序列。也合成了含有巨细胞病毒(cmv) 增强子(seq id no:2)、鸡beta肌动蛋白(cba)启动子(seq id no:3)和嵌合内含子(seq id no:4) 的启动子输入载体(promoter
‑
entry vector)。最后,使用aav骨架载体(含5’itr(seq id no:1), 增强子土拨鼠肝炎病毒(whp)转录后调控元件(wpre)(seq id no:12)序列,牛生长激素 polya信号序列(bgh pa,或称为bgh polya)(seq id no:13)和3’itr(seq id no:15))与 基因输入载体和启动子输入载体一同进行lb反应以制备pthve002(图2)。pthve002的序列 如seq id no:17所示。表达盒位于aav2的反向末端重复序列(itr)之间,用于随后将表达盒 转移到aav基因组并制备重组aav载体。图2中的所有其他表达盒都是通过正常的基因克隆技 术构建的。图1所示表达盒中元件的序列列于表1中。
36.表1
[0037][0038][0039]
实施例3.hke293细胞中转基因蛋白的体外表达
[0040]
为了在体外评估阿柏西普体外表达水平,使用lipofectamine 3000转染试剂将每个aav表达 构建体转染到293细胞中(2.5μg质粒/孔,细胞密度为1x106细胞/孔)。培养48小时后收获细胞, 对细胞培养物上清液取样并通过elisa分析以评估来自每个转染细胞培养物的分泌蛋白水平。图 3显示了pthve001、pthve002、pthve004和pthve010相对于空白pbs的阿柏西普表达水 平。其中pthve001、pthve002、pthve004和pthve010载体的元件结构示意图如图1所示。 如图3所示,pthve002和pthve004的阿柏西普体外表达水平比pthve001高15倍,比 pthve010高2.1倍。
[0041]
实施例4.小鼠中转基因蛋白的眼内表达
[0042]
将aav表达盒pthve001和pthve002(seq id no:17)包装入aav2.7m8或aav8衣壳中。 其中aav2.7m8是aav2的突变体,其特征是具有7mer的基序(lgettrp)。据dalkara等人的 报道(dalkara d,byrne lc,klimczak rr,visel m,yin l,merigan wh,flannery jg,schaffer dv.invivo
‑
directed evolution of a new adeno
‑
associated virus for therapeutic outer retinal gene delivery fromthe vitreous.sci transl med.2013jun 12;5(189):189ra76.),与aav2血清型相比,玻璃体内注射后, aav2.7m8显示出增强的穿透致密视网膜组织的能力和增强的感光细胞转导。
[0043]
使用的动物是c57bl/6小鼠。将动物麻醉并在小鼠眼中进行视网膜下(sr)或玻璃体内(ivt) 注射。以8x109vg每只眼睛进行注射,体积为1μl用于sr注射,在脉络膜上做一个小切口,并 将微玻璃毛细管针的尖端插入视网膜下空间。在手动控制下,一旦针尖在穿过巩膜/rpe后变得可 见,就用低压缓慢注射悬浮液。由于气泡形成,在视网膜下空间注射导致可见的视网膜脱离。对 于ivt注射,在脉络膜上做一个小切口,将微玻璃毛细管针的尖端直接插入玻璃体区域。随后的 程序与上述sr注射相同。在注射aav载体后的第21天取下晶状体收集整个眼睛。
[0044]
将收集的样品均质化,并通过bca蛋白质测定法测定总蛋白质浓度。基于grishanin等人 (grishanin r,vuillemenot b,sharma p,keravala a,greengard j,
gelfman c,blumenkrantz m, lawrence m,hu w,kiss s,gasmi m.preclinical evaluation of advm
‑
022,a novel gene therapy approach to treating wet age
‑
related macular degeneration.mol ther.2019 jan 2;27(1):118
‑
129)的 出版物中描述的elisa方法,通过elisa检测阿柏西普。图4显示了相对于注射pbs对照的小 鼠,在不同表达盒以及不同aav血清型的整个眼组织中转基因阿柏西普的表达。实验结果表明, 包含有pthve001的aav7m8或aav8血清型均未实现良好的体内转基因表达。sr注射后21 天,aav8中的pthve002显示出了最高的阿柏西普表达,并且该表达量超过aav7m8包装的 pthve002的2倍。令人惊讶的是,采用sr法注射包装有pthve002的aav8所产生的阿柏西普眼内表达量是aav7m8或aav8包装的pthve001(采用sr或ivt给药)眼内表达量的约24倍以上。总之,当包装在aav8中并通过视网膜下途径注射时,表达盒002(pthve002)显著 增加了阿柏西普的眼内表达水平。
[0045]
实施例5.视网膜下注射后眼内的转基因表达
[0046]
将aav表达盒pthve001、pthve002、pthve003、pthve004、pthve008、pthve009、 pthve010、pthve011、pthve012、pthve013包装入aav7m8衣壳。用每只眼1x10
10
vg的 高剂量或每只眼1x109vg的低剂量向动物进行sr注射所有上述aav载体。在注射后第21天收 集去除晶状体的整个眼睛,并使用elisa分析阿柏西普的转基因表达。如图5所示,pthve002、 pthve004、pthve008、pthve012和pthve013相较于其他表达盒具有相对较高的阿柏西普 表达。如实施例4所示,pthve002具有始终如一的高阿柏西普表达。如图1所示,除了pthve001 以外的所有表达盒都是基于cba启动子的载体(但具有不同的调控元件)。调控元件在内含子(嵌 合、mvm、sv40和msv40),或5’utr中的第二增强子,或3’utr中的第三增强子(ees)或 如增加rna输出(export)的其他增强子(wpre)上存在差异。表达盒中的polya选自如下: hgh pa,bgh pa或rab globin pa。
[0047]
实施例6.视网膜下注射后眼内的转基因表达
[0048]
将aav表达盒pthve004、pthve015、pthve017、pthve019和pthve021包装入aav7m8 衣壳中。其中如图1所示,pthve015和pthve019是密码子优化的阿柏西普;pthve017是基 于pthve015的去除了cpg的密码子优化的阿柏西普;pthve021是基于pthve019的除了cpg 的密码子优化的阿柏西普。将这些aav载体分别以高剂量(1x10
10
vg/眼)和低剂量(1x109vg/ 眼)视网膜下注射入小鼠眼中,并且通过elisa检测整个眼中阿柏西普的表达量。如图6所示, 与未进行密码子优化的pthve004相比,pthve015、pthve017和pthve021在高给药剂量下 显示出更高的转基因表达,并且在低剂量下pthve019也显示出更高的转基因表达。与pthve004 相比,pthve015、pthve017、pthve019和pthve021均具有相同的表达元件,区别仅在于 阿柏西普编码基因的密码子优化方式不同。
[0049]
实施例7.重组质粒构建
[0050]
重组质粒包含每个候选多核苷酸盒和编码阿柏西普的编码序列,并且在大肠杆菌中构建并克 隆了三种抗血管生成肽/蛋白质中的一种。简而言之,合成了供体载体pdonr221并通过vectorbuilder(addgene,pdonr 221)确认序列。合成了转基因orf(aflibercept
‑
op01.cgr或 aflibercept
‑
reg)并在其3’末端添加终止密码子,通过bp反应将其克隆入供体载体中以创建基 因进入载体(gene
‑
entry vector)。通过经桑格尔测序确认基因进入载体。合成了启动子进入载体 (promoter
‑
entry vector),该载体包含cmv增强
子、cba启动子和嵌合内含子,并通过桑格尔测 序确认序列。最后,使用含有5’itr、wpre序列、牛生长因子polya信号序列,和3’itr的aav 骨架构建体来与基因进入载体和启动子进入载体进行lb反应,以产生构建体pthve075。前述 启动子进入载体的启动子也可以为ef1a启动子。
[0051]
然后,使用类似手段构建了含有阿柏西普编码基因和其他治疗性多肽编码基因(axt
‑
107、 内皮抑素(eds183),或pedf34(又称pedf
‑
34mer))的双顺反子载体,其中阿柏西普编码基 因和其他治疗性多肽编码基因之间使用p2a或t2a连接。其中,在所述其他治疗性多肽编码基 因的5’端还含有序列优化后的hmm38、lucif、epo、il
‑
2、msa信号肽序列。构建体示意图 见图7。
[0052]
实施例8.hela细胞中转基因的体外表达
[0053]
为了确定实施例7中制备的表达盒的体外表达水平,分别将表达阿柏西普和axt
‑
107 (pthve076、pthve077、pthve078、pthve079、pthve080、pthve081、pthve082和 pthve093)的表达盒、表达阿柏西普和pedf34的表达盒(pthve086、pthve087和pthve088)、 表达阿柏西普和内皮抑素(eds183)的表达盒(pthve083、pthve084和pthve085),以及仅 表达阿柏西普的表达盒(pthve091和pthve092)包装到aav构建体中,然后使用lipofectamine3000转染试剂分别将所述构建体转染至hela细胞中(15μg质粒/100mm dish)。孵育72小时后收 获转染的细胞并收集细胞培养物上清液,并通过lc
‑
ms测定分泌到上清液中的分泌蛋白以及仍 留在细胞沉淀中的蛋白的量。
[0054]
建立了多路高效液相色谱
‑
串联质谱(lc
‑
ms/ms)方法,用于对细胞沉淀和上清液中的阿柏西 普、axt107、pedf
‑
34、eds183(内皮抑素)进行定量。基于源自优化胰蛋白酶/胰凝乳蛋白酶 消化程序的代表性特征肽的水平,同时测量前述四种蛋白质的浓度。
[0055]
图8a
‑
8d分别显示了阿柏西普(图8a)、内皮抑素(图8b)、axt
‑
107(图8c)、pedf
‑
34 (图8d)在细胞上清液和细胞沉淀(cell pellet)中的表达情况。
[0056]
实施例9.
[0057]
根据实施例8的结果,向激光诱导的cnv模型小鼠的视网膜下注射6种aav8载体(v571, v592,v577,v588,v584,v585)的体内效果。其中v571,v592,v577,v588,v584,v585中分别含 有pthve075,pthve092,pthve077,pthve088,pthve084和pthve085表达盒。通过荧光血 管造影术(fa)测试减少血管渗漏(lesion)的功效。
[0058]
具体来说,将棕色挪威大鼠麻醉并进行视网膜下注射。使用micron iii相机(phoenix research) 观察和记录镇静动物的右眼底使用通过micron iii定制激光附件连接的热激光进行激光处理。使 用的激光参数为200μm光斑尺寸、100ms持续时间和200mw功率。将记录眼底和/或oct图 像以确认激光已成功通过布鲁赫膜产生气泡。烧伤将在右眼的不同象限中产生,在2
‑
3个视神经 盘直径内,与每只动物的视神经乳头有关。左眼将保持未经处理的状态。在激光治疗后第7天(即 aav8载体注射后第35天)评估并记录血管渗漏得分。通过将每个病变与0
‑
4级进行比较来评估 fa结果,0表示不存在渗漏,4表示病变处及其周围显着渗漏。结果如图9所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1