一种牛结节性皮肤病病毒、山羊痘病毒和绵羊痘病毒的快速检测方法与流程
1.本发明属于羊痘病毒属病原微生物检测技术领域,具体涉及一种可检测鉴别羊痘病毒属牛结节性皮肤病病毒、山羊痘病毒与绵羊痘病毒的快速检测方法,以及方法所使用的引物对和探针组。
背景技术:
2.牛结节性皮肤病病毒(lumpy skin disease virus,lsdv)、山羊痘病毒(goatpox virus,gtpv)和绵羊痘病毒(sheeppox virus,sppv)同为羊痘病毒属(capripoxvirus,capv)成员,该属病毒感染后可造成发热、皮肤或黏膜结节(或丘疹)、淋巴结肿大等症状。痘病毒属病毒导致的疾病会显著降低生产性能,发病严重的动物还可导致死亡。例如牛结节性皮肤病可造成感染牛皮肤深洞致皮张无法利用,公畜不育、母畜流产,奶牛产奶量显著下降,严重时死亡。而山羊痘、绵羊痘病毒感染极其易感羊品种时死亡率可高达100%,三种疫病流行在世界范围内已造成巨大经济损失。由于牛、绵羊和山羊养殖业的经济重要性及病毒的潜在快速跨境传播,牛结节性皮肤病、山羊痘和绵羊痘均列为世界动物卫生组织(oie)法定报告疾病。
3.牛结节性皮肤病是我国的新发外来动物疫病,2019年8月我国新疆伊犁哈萨克自治州首次确诊;2020年6月来,该病在我国境内迅速蔓延,福建省、江西省、广东省、安徽省、浙江省、云南省、广西壮族自治区、重庆市、四川省、内蒙古自治区、江苏省、山东省、宁夏回族自治区、海南省等14省份报告发生。目前我国将该病暂定二类动物疫病管理,2018-2021年期间农业农村部多次发文加强该病防控工作。山羊痘和绵羊痘并称羊痘,数年来一直在我国部分地区持续流行,2020年山西、内蒙、宁夏等多地报道发生,两者均为我国一类动物疫病。
4.已有研究显示,尚无lsdv感染山羊、绵羊的报道,但gtpv、sppv均可在山羊和绵羊中传播流行。
5.目前,我国广泛采用山羊痘弱毒疫苗免疫羊来预防山羊痘和绵羊痘,采用5倍剂量山羊痘弱毒疫苗免疫牛来预防牛结节性皮肤病。但弱毒疫苗使用存在排毒并造成环境污染潜在风险,同时动物免疫后短期内可能出现注射部位肿胀、体表浅表结节及发热等局部或全身性反应。因此,实现羊痘病毒属内三种病毒快速有效鉴别,不仅对于这三种疫病检测诊断,还对流行毒株感染和弱毒疫苗免疫的区分,以针对性制定、实施防控策略具有重要意义。
技术实现要素:
6.本发明的目的是提供一种牛结节性皮肤病病毒lsdv、山羊痘病毒gtpv和绵羊痘病毒sppv的快速检测方法,以及应用于检测方法的taqman-mgb探针三重荧光pcr引物对和探针组。
7.本发明首先提供一种可鉴别检测lsdv、gtpv与sppv的引物对和探针组,其中引物对和探针组的序列信息如下:
8.capv检测正向引物capv forward:
[0009]5′‑
caaccaacaataactattatctgaa-3
′
(seq id no:1)
[0010]
capv检测反向引物capv reverse:
[0011]5′‑
tttcttctcctaaatcagttgc-3
′
(seq id no:2)
[0012]
lsdv检测探针lsdv probe:
[0013]5′‑
cgctacgggtacgt-3
′
(seq id no:3)
[0014]
gtpv检测探针gtpv probe:
[0015]5′‑
cgccacggatacgt-3
′
(seq id no:4)
[0016]
sppv检测探针sppv probe:
[0017]5′‑
tccgccacagatatgt-3
′
(seq id no:5)
[0018]
其中,检测探针lsdv probe的5
′
端进行羧基荧光素fam标记,gtpv probe的5
′
端进行六氯荧光素基团hex标记,sppv probe的5
′
端进行羧基-x-罗丹明基团rox标记,探针的3
′
端均以淬灭基团mgb标记。
[0019]
上述引物和探针用于制备鉴别羊痘病毒属三种病毒的taqman mgb三重荧光pcr检测体系。
[0020]
本发明还提供一种鉴别羊痘病毒属三种病毒的taqman mgb三重荧光pcr方法,包括如下的步骤:
[0021]
1)荧光pcr反应体系配制:
[0022]
反应液每管为20μl,含有universal u+probe master mix v2荧光pcr反应液10μl,5μmol/l的capv forward、capv reverse、lsdv probe、gtpv probe和sppv probe各0.8μl,待检测样品的dna模板2μl,双蒸水4μl;
[0023]
2)荧光pcr反应体系扩增:
[0024]
检测反应条件设置为:37℃作用2min;95℃预变性5min;95℃变性10s,58℃退火30s(同时采集fam、hex及rox信号),共40个循环;
[0025]
3)结果的判定:
[0026]
阈值设定原则以阈值线刚好超过阴性对照品扩增曲线的最高点,待检样品无ct值并且无扩增曲线,结果判为阴性;待检样品ct值≤40.0,且出现典型的扩增曲线,结果判为阳性,其中为fam信号时判为lsdv核酸阳性;为hex信号时判为gtpv核酸阳性;为rox信号时判为sppv核酸阳性。
[0027]
本发明的方法具有如下的技术优点:
[0028]
(1)灵敏度高:lsdv核酸的最低检出限可达5.41copies/μl;gtpv核酸的最低检出限可达27.70copies/μl;sppv核酸的最低检出限可达17.30copies/μl。
[0029]
(2)特异性好:特异性针对lsdv、gtpv和sppv基因组,产生相应的荧光扩增信号。经验证,对口蹄疫病毒、牛病毒性腹泻/黏膜病病毒、蓝舌病病毒、羊口疮病毒等相关反刍动物疫病病毒及健康动物来源血液、唾液、皮肤样品,均无交叉反应。
[0030]
(3)快速高通量:检测速度快,加入样品后1h内即可完成整个扩增检测过程,且根据荧光定量pcr仪的检测孔数量,可以一次性实现96~384个样品的同步检测。
[0031]
(4)操作简便:一次反应同时实现三种病毒的检测和鉴别,配置好的taqman mgb三重荧光pcr反应体系,置于荧光定量pcr仪中,即可完成整个扩增及结果判定过程,不需要通过琼脂糖凝胶电泳鉴定。同时,所用探针组基于多snp位点差异优化设计,检测背景值低,更易于结果判定。
附图说明
[0032]
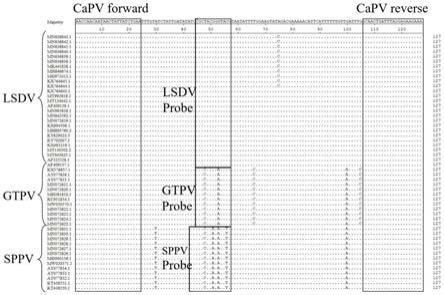
图1:本发明扩增capv orf091基因部分序列的引物和探针示意图(引物探针设计区域由方框圈出)。
[0033]
图2:阳性质粒制备电泳结果图,其中泳道1:500bp marker;泳道2:pt-lsdv;泳道3:pt-gtpv;泳道4:pt-sppv。
[0034]
图3a:taqman mgb三重荧光pcr灵敏度试验结果图(lsdv),其中1:工作标准品1;2:工作标准品2;3:工作标准品3;4:工作标准品4;5:工作标准品5;6:工作标准品6;7:工作标准品7;8:工作标准品8;9:工作标准品9;10:阴性对照。
[0035]
图3b:taqman mgb三重荧光pcr灵敏度试验结果图(gtpv),其中1:工作标准品10;2:工作标准品11;3:工作标准品12;4:工作标准品13;5:工作标准品14;6:工作标准品15;7:工作标准品16;8:工作标准品17;9:工作标准品18;10:阴性对照。
[0036]
图3c:taqman mgb三重荧光pcr灵敏度试验结果图(sppv),其中1:工作标准品19;2:工作标准品20;3:工作标准品21;4:工作标准品22;5:工作标准品23;6:工作标准品24;7:工作标准品25;8:工作标准品26;9:工作标准品27;10:阴性对照。
[0037]
图4a:taqman mgb三重荧光pcr标准曲线结果图(lsdv),其中其中1:工作标准品1;2:工作标准品2;3:工作标准品3;4:工作标准品4;5:工作标准品5;6:工作标准品6;7:工作标准品7;8:工作标准品8。
[0038]
图4b:taqman mgb三重荧光pcr标准曲线结果图(gtpv),其中1:工作标准品10;2:工作标准品11;3:工作标准品12;4:工作标准品13;5:工作标准品14;6:工作标准品15;7:工作标准品16;8:工作标准品17。
[0039]
图4c:taqman mgb三重荧光pcr标准曲线结果图(sppv),其中1:工作标准品19;2:工作标准品20;3:工作标准品21;4:工作标准品22;5:工作标准品23;6:工作标准品24;7:工作标准品25;8:工作标准品26。
[0040]
图5:taqman mgb三重荧光pcr特异性试验结果图,其中1:lsdv阳性对照;2:gtpv阳性对照;3:sppv阳性对照;4:o型/a型口蹄疫病毒;5:牛病毒性腹泻-黏膜病病毒与牛传染性鼻气管炎病病毒;6:羊口疮病毒;7:蓝舌病病毒;8:健康牛来源皮肤组织;9:健康牛来源血液;10:健康牛来源唾液;11:健康山羊来源皮肤组织;12:健康山羊来源血液;13:健康山羊来源唾液;14:健康绵羊来源皮肤组织;15:健康绵羊来源血液;16:健康绵羊来源唾液;17:阴性对照。
具体实施方式
[0041]
本发明基于taqman-mgb探针的荧光定量pcr技术,以lsdv、gtpv、sppv基因组orf091基因上snp位点差异作为分子标记,设计引物、探针并建立检测方法,通过实时监测不同标记的荧光信号来实现上述三种病毒的鉴别检测目的。
[0042]
为了对本发明的技术特征、目的和效果有更清楚的理解,现对照附图详细说明本发明实施方式。
[0043]
实施例1:引物及探针的筛选与设计
[0044]
羊痘病毒属的病毒包括lsdv、gtpv和sppv,已有研究显示三种病毒间具有较高基因组同源性。首先,申请人收集了现有技术中已有的全部27株lsdv基因组全序列(genbank登录号:mn636843.1、mn636842.1、mn636841.1、mn636840.1、mn636839.1、mn636838.1、mk4418381、mh646674.1、kx764645.1、kx764644.1、kx764643.1、mt992618.1、mt130502.1、af409137.1、mn995838.1、mn642592.1、mn072619.1、kx894508.1、mh893760.2、ky829023.3、ky829023.3、ky702007.1、kx683219.1、mt130502.2、mt643825.1、af325528.1、af409138.1),已有全部12株gtpv基因组全序列(genbank登录号:kx576657.1、ay077836.1、ay077835.1、mn072621.1、mn072620.1、mh381810.1、kc951854.1、mw020570.1、mn072622.1、mn072625.1、mn072624.1、mn072623.1)和全部13株sppv基因组全序列(genbank登录号:mn072631.1、mn072630.1、mn072629.1、mn072628.1、mn072627.1、mn072626.1、mw020571.1、mg000156.1、ay077834.1、ay077833.1、ay077832.1、kt438551.1、kt438550.1)。
[0045]
之后,利用生物信息学软件blast和lasergene megalign,逐段将上述lsdv、gtpv、sppv基因组全序列进行比较,分析筛选种特异性单核苷酸多态性位点(single nucleotide polymorphism,snp)。
[0046]
综合考虑snp位点两翼序列的保守性、碱基组成、gc含量、二级结构的形成、tm值等因素,设计可鉴别检测lsdv,gtpv和sppv的taqman mgb三重荧光pcr引物探针方案3组(表1)。
[0047]
表1:lsdv、gtpv、sppv鉴别引物对和探针组设计表
[0048][0049]
经过灵敏性、特异性及荧光背景信号验证后,采用以下方案所示的引物探针组合。以lsdv ni-2490株(genbank登录号:af325528.1)、gtpv gorgan株(genbank登录号:kx576657.1)、sppv turkey vaccine株(genbank登录号:mn072631.1)作为参考株,选取orf091基因35~161位序列设计引物和探针。引物和探针设计区域见图1,设计的具体序列如下:
[0050]
capv检测正向引物capv forward:
[0051]5′‑
caaccaacaataactattatctgaa-3
′
(seq id no:1)
[0052]
capv检测反向引物capv reverse:
[0053]5′‑
tttcttctcctaaatcagttgc-3
′
(seq id no:2)
[0054]
lsdv检测探针lsdv probe:
[0055]5′‑
cgctacgggtacgt-3
′
(seq id no:3)
[0056]
gtpv检测探针gtpv probe:
[0057]5′‑
cgccacggatacgt-3
′
(seq id no:4)
[0058]
sppv检测探针sppv probe:
[0059]5′‑
tccgccacagatatgt-3
′
(seq id no:5)
[0060]
其中,检测探针lsdv probe的5
′
端进行羧基荧光素fam标记,gtpv probe的5
′
端进行六氯荧光素基团hex标记,sppv probe的5
′
端进行羧基-x-罗丹明基团rox标记,三枚探针的3
′
端均以淬灭基团mgb标记。引物和探针均由睿博兴科(青岛)有限公司合成。
[0061]
实施例2:筛选的引物、探针的灵敏度
[0062]
1、阳性质粒标准品的制备
[0063]
(1)阳性质粒的制备
[0064]
lsdv中国流行株lsdv/china/xj/2019-1由国家外来动物疫病研究中心分离、鉴定、保存及提供;gtpv av41株来源市售商品化疫苗;sppv gl株dna模板由中国农业科学院兰州兽医研究所惠赠。采用商品化病毒基因组提取试剂盒按说明方法提取lsdv、gtpv的dna模板,进行常规pcr扩增,具体步骤如下:
[0065]
反应体系配制:反应液每管25μl,含有2
×
platinum super green pcr mix荧光pcr反应液12.5μl,10pmol/μl的capv forward和capv reverse各1μl,双蒸水8.5μl,于不同反应管分别加入lsdv、gtpv和sppv dna模板2μl。其中,platinum super green pcr mix检测试剂盒(目录号:00766789)购自invitrogen公司。反应条件设置:95℃预变性5min;95℃变性30s、55℃退火30s、72℃延伸30s,35个循环;72℃最后延伸5min;4℃保存。
[0066]
pcr产物经2%琼脂糖凝胶电泳(见图2),回收目的片段并连接pmd19-t载体,转化dh5α大肠杆菌,经pcr鉴定阳性菌株送青岛睿博兴科公司测序。测序结果符合预期作为阳性菌种,提取其质粒作为阳性质粒。
[0067]
pt-lsdv阳性质粒含lsdv orf091基因35~161位序列。序列如下:
[0068]
pt-gtpv阳性质粒含gtpv orf091基因35~161位序列。序列如下:
[0069]
pt-sppv阳性质粒含sppv orf091基因35~161位序列。序列如下:
[0070]
(注:小写部分c为加尾碱基;下划线区域表示引物匹配位置;下划线斜体区域为探针匹配位置)
[0071]
(2)阳性质粒标准品的制备
[0072]
采用超微量紫外分光光度计测定阳性质粒od260/od280比值及浓度(单位ng/μl),根据公式:质粒拷贝数(copies/μl)=(质粒浓度
×
10-9
×
稀释倍数
×
6.02
×
10
23
)/(660道尔顿/碱基
×
碱基数),计算其拷贝数。
[0073]
经测定,pt-lsdv阳性质粒od260/od280比值为1.95,初始浓度为11.82μg/ml,拷贝数为5.41
×
109copies/μl;pt-gtpv阳性质粒od260/od280比值为1.96,初始浓度为60.48μg/ml,拷贝数为2.77
×
10
10
copies/μl;pt-sppv阳性质粒od260/od280比值为1.92,初始浓度为37.52μg/ml,拷贝数为1.73
×
10
10
copies/μl。对上述三种质粒进行10倍梯度稀释,制备标准品分别为:
[0074]
工作标准品1,含有5.41
×
107copies/μl阳性质粒pt-lsdv非传染性dna片段;工作标准品2,含有5.41
×
106copies/μl阳性质粒pt-lsdv非传染性dna片段;工作标准品3,含有5.41
×
105copies/μl阳性质粒pt-lsdv非传染性dna片段;工作标准品4,含有5.41
×
104copies/μl阳性质粒pt-lsdv非传染性dna片段;工作标准品5,含有5.41
×
103copies/μl阳性质粒pt-lsdv非传染性dna片段;工作标准品6,含有5.41
×
102copies/μl阳性质粒pt-lsdv非传染性dna片段;工作标准品7,含有5.41
×
101copies/μl阳性质粒pt-lsdv非传染性dna片段;工作标准品8,含有5.41
×
100copies/μl阳性质粒pt-lsdv非传染性dna片段;工作标准品9,含有5.41
×
10-1
copies/μl阳性质粒pt-lsdv非传染性dna片段;
[0075]
工作标准品10,含有2.77
×
108copies/μl阳性质粒pt-gtpv非传染性dna片段;工作标准品11,含有2.77
×
107copies/μl阳性质粒pt-gtpv非传染性dna片段;工作标准品12,含有2.77
×
106copies/μl阳性质粒pt-gtpv非传染性dna片段;工作标准品13,含有2.77
×
105copies/μl阳性质粒pt-gtpv非传染性dna片段;工作标准品14,含有2.77
×
104copies/μl阳性质粒pt-gtpv非传染性dna片段;工作标准品15,含有2.77
×
103copies/μl阳性质粒pt-gtpv非传染性dna片段;工作标准品16,含有2.77
×
102copies/μl阳性质粒pt-gtpv非传染性dna片段;工作标准品17,含有2.77
×
101copies/μl阳性质粒pt-gtpv非传染性dna片段;工作标准品18,含有2.77
×
100copies/μl阳性质粒pt-gtpv非传染性dna片段;
[0076]
工作标准品19,含有1.73
×
108copies/μl阳性质粒pt-sppv非传染性dna片段;工作标准品20,含有1.73
×
107copies/μl阳性质粒pt-sppv非传染性dna片段;工作标准品21,含有1.73
×
106copies/μl阳性质粒pt-sppv非传染性dna片段;工作标准品22,含有1.73
×
105copies/μl阳性质粒pt-sppv非传染性dna片段;工作标准品23,含有1.73
×
104copies/μl阳性质粒pt-sppv非传染性dna片段;工作标准品24,含有1.73
×
103copies/μl阳性质粒pt-sppv非传染性dna片段;工作标准品25,含有1.73
×
102copies/μl阳性质粒pt-sppv非传染性dna片段;工作标准品26,含有1.73
×
101copies/μl阳性质粒pt-sppv非传染性dna片段;工作标准品27,含有1.73
×
100copies/μl阳性质粒pt-sppv非传染性dna片段;
[0077]
2.灵敏度试验
[0078]
采用实施例1中筛选的引物、探针制备反应体系,对系列工作标准品和阴性对照(成分为无核酸酶水)进行检测并绘制标准曲线,具体步骤如下:
[0079]
1)荧光pcr反应体系配制——反应液每管为20μl,含有universal u+probe master mix v2荧光pcr反应液10μl,5μmol/l的capv forward、capv reverse、lsdv probe、gtpv probe和sppv probe各0.8μl,待检测样品的dna模板2μl,双蒸水4μl;2)荧光pcr反应体系扩增——检测反应条件设置为:37℃作用2min;95℃预变性5min;95℃变性10s,58℃退火30s(同时采集fam、hex及rox信号),共40个循环;3)结果的判定——阈值设定原则以阈值线刚好超过阴性对照品扩增曲线的最高点,或可根据仪器噪音情况进行调整。待检样品无ct值并且无扩增曲线,结果判为阴性。待检样品ct值≤40.0,且出现典型的扩增曲线,结果判为阳性,其中为fam信号时判为lsdv核酸阳性;为hex信号时判为gtpv核酸阳性;为rox信号时判为sppv核酸阳性。
[0080]
采用工作标准品1~9和阴性对照,评估本方法检测lsdv灵敏度。结果如图3a所示,工作标准品1~8仅出现fam信号的典型扩增曲线,工作标准品9和阴性对照无扩增曲线。结果说明,采用本方法lsdv最低检出限为工作标准品8,灵敏度为5.41copies/μl。采用工作标准品1~8绘制标准曲线,如图4a所示,标准曲线的线性方程为:y=-3.374x+40.265,r2=0.999,扩增效率e=97.9%;
[0081]
采用工作标准品10~18和阴性对照,评估本方法检测gtpv灵敏度。结果如图3b所示,工作标准品10~17仅出现hex信号的典型扩增曲线,工作标准品17和阴性对照无扩增曲线。结果说明,gtpv最低检出限为工作标准品17,灵敏度为27.70copies/μl。采用工作标准品10~17绘制标准曲线,如图4b所示,标准曲线的线性方程为:y=-3.802x+41.650,r2=0.998,扩增效率e=83.3%;
[0082]
采用工作标准品19~27和阴性对照,评估本方法检测sppv灵敏度。结果如图3c所示,工作标准品19~26仅出现rox信号的典型扩增曲线,工作标准品27和阴性对照未见典型扩增曲线。结果说明,sppv最低检出限为工作标准品26,灵敏度为17.30copies/μl。采用工作标准品19~26绘制标准曲线,如图4c所示,标准曲线的线性方程为:y=-3.782x+41.473,r2=1.000,扩增效率e=83.8%。
[0083]
上述结果说明,本方法检测lsdv、gtpv、sppv三种病毒时灵敏度高,且在检测范围内模板浓度与检测ct值间呈良好线性关系。
[0084]
实施例3:重复性试验
[0085]
采用实施例1中设计的引物、探针制备反应体系,对实施例2中制备的工作标准品2~7、11~16和20~25进行三次荧光pcr重复检测,计算批间变异系数;在同次荧光pcr中重复检测三次,计算批内变异系数。按变异系数cv%=(标准偏差sd/平均值mean)
×
100%,计算批间和批内重复ct值变异系数。具体步骤如下:
[0086]
1)荧光pcr反应体系配制——反应液每管为20μl,含有universal u+probe master mix v2荧光pcr反应液10μl,5μmol/l的capv forward、capv reverse、lsdv probe、gtpv probe和sppv probe各0.8μl,待检测样品的dna模板2μl,双蒸水4μl;2)荧光pcr反应体系扩增——检测反应条件设置为:37℃作用2min;95℃预变性5min;95℃变性
10s,58℃退火30s(同时采集fam、hex及rox信号),共40个循环;3)结果的判定——阈值设定原则以阈值线刚好超过阴性对照品扩增曲线的最高点,或可根据仪器噪音情况进行调整。待检样品无ct值并且无扩增曲线,结果判为阴性。待检样品ct值≤40.0,且出现典型的扩增曲线,结果判为阳性,其中为fam信号时判为lsdv核酸阳性;为hex信号时判为gtpv核酸阳性;为rox信号时判为sppv核酸阳性。
[0087]
重复检测工作标准品2~7、11~16和20~25,结果如表2,工作标准品2~7、11~16和20~25的批内和批间重复性检测时0.16%≤批内变异系数≤2.31%、0.18%≤批间变异系数≤1.73%,表明本方法具有良好的可重复性。
[0088]
表2三重qpcr方法的批内与批间重复性试验表
[0089][0090]
实施例4:特异性试验
[0091]
采用实施例1中设计的引物、探针制备反应体系,对口蹄疫、牛病毒性腹泻/黏膜病、羊口疮等相关病毒样品,健康牛、山羊、绵羊来源全血、唾液、皮肤样品,以及阳性对照(成分为制备的lsdv、gtpv、sppv病毒来源dna模板)和阴性对照(成分为无核酸酶水)进行检测。具体步骤如下:
[0092]
特异性样品的制备:健康牛、山羊、绵羊来源全血、唾液、皮肤样品,由国家外来动物疫病研究中心采集与提供;口蹄疫病毒o型和a型二价苗(fmdv/re-o/mya98/jscz2013+fmdv/re-a/wh/09株)、牛病毒性腹泻/黏膜病病毒和牛传染性鼻气管炎病毒二联苗(nmg株+ly株)、羊口疮病毒go-bt15-30株来源市售商品化疫苗;蓝舌病病毒dna模板由军事医学科学院军事兽医研究所惠赠。lsdv中国流行株lsdv/china/xj/2019-1由国家外来动物疫病研究中心分离、鉴定、保存及提供;gtpv av41株来源市售商品化疫苗;sppv gl株dna模板由中国农业科学院兰州兽医研究所惠赠。全血、唾液、病毒样品直接采用商品化dna提取试剂盒于全自动核酸提取仪上取核酸;皮肤样品先进行匀浆,再采用商品化dna提取试剂盒于全自动核酸提取仪上取核酸,获得的核酸样本于-20℃保存备用。制备的lsdv、gtpv、sppv的dna模板,经适量稀释用于阳性对照。
[0093]
特异性样品的检测:1)荧光pcr反应体系配制——反应液每管为20μl,含有universal u+probe master mix v2荧光pcr反应液10μl,5μmol/l的capv forward、capv reverse、lsdv probe、gtpv probe和sppv probe各0.8μl,待检测样品的dna模板2μl,双蒸水4μl;2)荧光pcr反应体系扩增——检测反应条件设置为:37℃作用2min;95℃预变性5min;95℃变性10s,58℃退火30s(同时采集fam、hex及rox信号),共40个循环;3)结果的判定——阈值设定原则以阈值线刚好超过阴性对照品扩增曲线的最高点,或可根据仪器噪音情况进行调整。待检样品无ct值并且无扩增曲线,结果判为阴性。待检样品ct值≤40.0,且出现典型的扩增曲线,结果判为阳性,其中为fam信号时判为lsdv核酸阳性;为hex信号时判为gtpv核酸阳性;为rox信号时判为sppv核酸阳性。
[0094]
结果如图5,阳性对照中lsdv模板仅出现fam信号的典型扩增曲线、gtpv模板仅出现hex信号的典型扩增曲线、sppv模板仅出现rox信号的典型扩增曲线,阴性对照未出现扩增信号,实验成立。本实验中检测口蹄疫病毒、牛病毒性腹泻/黏膜病病毒、牛传染性鼻气管炎病毒、羊口疮病毒、蓝舌病病毒样本核酸均未出现扩增信号,检测健康牛、山羊、绵羊来源全血、唾液、皮肤样品核酸均未出现扩增信号。结果表明,本方法检测相关病毒及健康动物来源样品均无交叉反应,具有良好特异性。
[0095]
实施例6:实际临床样本的检测
[0096]
采用实施例1中设计的引物、探针制备反应体系,对采集自临床疑似感染动物的皮肤结节等类型临床样品,以及阳性对照(成分为实施例2中制备的工作标准品5、15和24)和阴性对照(成分为无核酸酶水)进行检测,并对pcr产物进行测序鉴定。具体步骤如下:
[0097]
临床样品的制备:临床疑似感染牛结节性皮肤病牛的全血、唾液、皮肤结节样品共计89份;疑似感染山羊痘山羊全血、唾液、皮肤结节核酸样品共计12份;疑似感染绵羊痘绵羊全血、唾液、皮肤结节来源核酸样品共计30份,由内蒙古自治区动物疫病预防与控制中心采集与提供。全血、唾液样品直接采用商品化dna提取试剂盒于全自动核酸提取仪上取核酸;结节样品先进行匀浆,再采用商品化dna提取试剂盒于全自动核酸提取仪上取核酸,获得的核酸样本于-20℃保存备用。
[0098]
临床样品的检测:1)荧光pcr反应体系配制——反应液每管为20μl,含有universal u+probe master mix v2荧光pcr反应液10μl,5μmol/l的capv forward、capv reverse、lsdv probe、gtpv probe和sppv probe各0.8μl,待检测样品的dna模板2μl,双蒸水4μl;2)荧光pcr反应体系扩增——检测反应条件设置为:37℃作用2min;95℃预变性5min;95℃变性10s,58℃退火30s(同时采集fam、hex及rox信号),共40个循环;3)结果的判定——阈值设定原则以阈值线刚好超过阴性对照品扩增曲线的最高点,或可根据仪器噪音情况进行调整。待检样品无ct值并且无扩增曲线,结果判为阴性。待检样品ct值≤40.0,且出现典型的扩增曲线,结果判为阳性,其中为fam信号时判为lsdv核酸阳性;为hex信号时判为gtpv核酸阳性;为rox信号时判为sppv核酸阳性。
[0099]
结果显示,本方法共检测lsdv核酸阳性53份、gtpv核酸阳性6份、sppv核酸阳性7份,阴性65份。将所有检测为阳性的pcr产物送睿博兴科(青岛)有限公司测序,将测序结果在genebank中blast比对复核,经验证所有样品复核结果均与pcr检测判定结果吻合一致,符合预期。
[0100]
综上,本发明的引物对、探针组及使用该引物对、探针组的taqman三重mgb荧光pcr方法特异敏感且简便快速,适用于我国羊痘病毒属三种病毒的检测及鉴别。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1