一种纯化TPO的工艺及方法与流程
一种纯化tpo的工艺及方法
技术领域
1.本发明属于生物技术领域,具体的涉及一种纯化tpo的工艺及方法。
背景技术:
2.甲状腺过氧化物酶(thyroid peroxidase,tpo)是一种含有血红素辅基的膜结合糖蛋白,整个分子分为膜内区,跨膜区和膜外区,cdna全长3kb,跨膜区的存在使tpo在表达时难以分泌出来,具有催化活性的部分伸向充满胶质滤泡腔的内部。tpo作为甲状腺激素在生物机体内合成过程中的一种重要酶,能参与催化碘的活化、甲状腺球蛋白上酪氨酸残基的碘化及碘化酪氨酸残基的偶联过程,最终生成甲状腺素(t3、t4)。tpo同时也是甲状腺微粒体的主要抗原组成成分,当生物体甲状腺发生病变,导致滤泡细胞的生物结构受到破坏时,tpo随即经过甲状腺滤泡细胞腔的边缘部分即甲状腺细胞顶部的部位向外周血进行遗漏,从而刺激机体进行免疫系统调节,免疫系统随即产生tpo抗体(anti-tpo)以应对刺激。
3.甲状腺过氧化物酶抗体(anti-tpo)常见于患有自身免疫性甲状腺疾病的人群中,是一种甲状腺自身抗体,anti-tpo阳性主要见于桥本甲状腺炎、原发性甲状腺功能减退、甲状腺功能亢进患者等,在甲状腺功能检测中检测甲状腺过氧化物酶抗体(anti-tpo),已成为甲状腺功能基本的检测指标之一。
4.因此,为了高特异性的检测anti-tpo,开发出高表达、高纯度的tpo对于临床检测和实验研究都尤为重要,但目前国内表达的tpo普遍纯度不高,纯化后的蛋白性能不佳,容易发生沉淀,且tpo蛋白应用到下游试剂线中存在回收率较低的问题,极大的限制了tpo检测的发展。
技术实现要素:
5.本发明在纯化tpo时,发现tpo纯化的纯度不高,主要是因为目前市售的ni柱纯化工艺不稳定,纯度较低,而tpo使用抗体纯化必定跨过等电点,致使过程沉淀严重影响纯化得率。因此必须找到一种洗脱方式避免跨过等电点,满足需求并不影响tpo性能。
6.为了解决纯化后蛋白容易沉淀的问题,本发明提供了一种纯化tpo的工艺,包括,
7.(1)筛选纯化tpo抗体;
8.(2)将步骤(1)中纯化后的tpo抗体与填料按一定条件混合,制成亲和层析柱;
9.(3)将需要纯化的样本加入步骤(2)制备的亲和层析柱中,利用洗脱液对亲和层析柱进行洗脱,纯化tpo蛋白;
10.优选的,所述步骤(3)中的洗脱液,包含1-5m的金属离子盐,ph=6.5-8.0。
11.优选的,所述tpo抗体与填料按一定条件混合为tpo抗体:填料=10:1混合。
12.优选的,所述金属离子盐的浓度为2-4m,ph=6.8-7.3。
13.优选的,所述金属离子盐选自nacl、licl或mgcl2,更优选的,所述金属离子盐选自mgcl2。
14.抗体纯化通常采用ph=2.7的甘氨酸进行洗脱,但将抗体原料应用到免疫反应中,
需要中性偏碱性的缓冲环境,tpo的等电点为6.13,当将洗脱下来的ph=2.7抗体溶液ph调节到中性或碱性,会经过tpo的等电点,导致tpo的沉淀,纯化出的tpo稳定性差,影响后续应用,本发明的洗脱液中添加金属离子盐,且将ph控制在偏中性的条件下,解决了纯化后tpo蛋白的稳定性问题,不会存在沉淀的现象。
15.另一方面,为了解决tpo纯化的纯度不高的问题,本发明提供了一种生产高纯度tpo的方法,包括,
16.(1)重组tpo基因转入细菌细胞制备质粒;
17.(2)步骤(1)中制备的质粒转染到sf9细胞中,制作tpo病毒;
18.(3)将tpo病毒导入sf9细胞中进行表达,得tpo蛋白;
19.(4)筛选纯化tpo抗体;
20.(5)将纯化后的tpo抗体与填料按一定条件混合,制成亲和层析柱;
21.(6)在步骤(5)中制备的亲和层析柱中加入步骤(3)中的tpo蛋白,利用洗脱液对亲和层析柱进行洗脱,纯化tpo蛋白;
22.所述重组tpo基因含有标签或不含标签。
23.所述步骤(6)中的洗脱液,包含1-5m的金属离子盐,ph=6.5-8.0。
24.优选的,所述重组基因tpo不含标签。
25.现有工艺中,利用蛋白质表面的一些氨基酸,如组氨酸、色氨酸、半胱氨酸等能和金属离子发生特殊的相互作用的原理,从而对蛋白质加以分离。这些作用包括配价键结合、静电吸附、共价键结合,其中以配价键结合为主,而且这其中又以6组氨酸标签(his-tag)应用最为广泛。通常做法为his-tag与重组蛋白融合纯化蛋白质,利用组氨酸与二价金属离子螯合的特点,带有his-tag的重组蛋白可以被ni柱吸附,便于用金属螯合亲和层析纯化蛋白质,增加蛋白的纯化率。
26.本发明创造性的发现,当利用sf9细胞作为宿主细胞,纯化tpo蛋白时,不添加组氨酸标签,蛋白的纯化效果比添加组氨酸标签效果更好。
27.优选的,所述tpo抗体与填料按一定条件混合为tpo抗体:填料=10:1混合。
28.优选的,所述步骤(6)中的洗脱液,包含1-5m的金属离子盐,ph=6.5-8.0。
29.优选的,所述金属离子盐的浓度为2-4m,ph=6.8-7.3。
30.优选的,所述金属离子盐选自nacl、licl或mgcl2,更优选的,所述金属离子盐选自mgcl2。
31.另一方面,本发明提供了一种生产高纯度tpo的方法,包括,
32.(1)重组tpo基因转入细菌细胞制备质粒;
33.(2)步骤(1)中制备的质粒转染到sf9细胞中,制作tpo病毒;
34.(3)将tpo病毒导入h.five细胞中进行表达,得tpo蛋白;
35.(4)筛选纯化tpo抗体;
36.(5)将纯化后的tpo抗体与填料按一定条件混合,制成亲和层析柱;
37.(6)在步骤(5)中制备的亲和层析柱中加入步骤(3)中的tpo蛋白,利用洗脱液对亲和层析柱进行洗脱,纯化tpo蛋白;
38.所述步骤(6)中的洗脱液,包含1-5m的金属离子盐,ph=6.5-8.0。
39.优选的,所述重组tpo基因不含有任何标签。
40.本发明更改了宿主细胞,发现利用h.five细胞,添加标签和不添加标签的影响较大,不添加标签纯化的效果更好,而添加标签甚至会影响纯化的效果。
41.相比直接用sf9细胞表达,用h.five细胞表达纯化需要两种细胞。
42.优选的,所述tpo抗体与填料按一定条件混合为tpo抗体:填料=10:1。
43.优选的,所述金属离子盐的浓度为2-4m,ph=6.8-7.3。
44.优选的,所述金属离子盐选自nacl、licl或mgcl2,更优选的,所述金属离子盐选自mgcl245.上述重组tpo基因序列如seq no.1所示。
46.有益效果
47.(1)本发明创造性的发现,纯化tpo蛋白不需要添加标签,大大的简化了纯化的步骤。
48.(2)利用本发明公开的高浓度金属离子盐洗脱液tpo,得到的tpo蛋白稳定性好,不会在保存液中沉淀,利于后续试剂盒的开发应用。
49.(3)添加了筛选纯化tpo抗体的步骤,使ni柱纯化工艺稳定,纯化出的tpo蛋白纯度高。
附图说明
50.图1:常规方法纯化tpo凝胶图
51.图2:本发明纯化tpo凝胶图;
52.图3:不同宿主细胞纯化比较凝胶图;
53.图4:线性实验;
54.图5:临床相关性实验。
具体实施方式
55.实施例
56.实施例1病毒制作
57.(一)dh10bac转化
58.1.取100ul dh10bac感受态细胞,冰上放置10min至完全融化。加入50-200ng(约1ul)质粒轻轻混匀,冰上放置30min;
59.2.42℃热激45s;
60.3.冰上放置2-5min;
61.4.加入700ul lb培养基,37℃,225rpm,4h;
62.5.取100ul涂x-gal平板,37℃倒置培养过夜;
63.6.取白色菌落在x-gal平板上划线,37℃倒置培养过夜;
64.7.过夜观察菌落仍为白色,即可认定为转化成功,也可进行菌落pcr进行再次验证。
65.(二)杆状质粒提取
66.1.挑取白色克隆于2ml lb培养基(50ug/ml卡那霉素、7ug/ml庆大霉素、10ug/ml四环素、x-gal 100ug/ml、iptg 40ug/ml),37℃摇床250-300rpm培养24h以上;
67.2.用purelink hipure plasmid dna purification kits提取杆状质粒。
68.3.提取后用水溶解质粒,测定浓度大于500ng/ul后备用
69.(三)病毒制备与扩增
70.1.液氮取出sf9细胞进行复苏,培养在t25培养瓶(培养基中添加anti/anti)中,28℃静止培养约72h。
71.2.待t25培养瓶中的sf9细胞汇合度达90%-100%后移除旧培养基,加入15ml新鲜培养基,一传三的比例接种至新的t25培养瓶中,4ml/t25培养瓶(培养基中不再添加anti/anti)。28℃干燥培养箱中,静置培养24h。
72.2.转染混合物制备:将2ug杆状质粒dna加入到200ul sf900ii培养基,10ug转染试剂加入到200ul sf900ii培养基,再将配好的杆状质粒dna工作液和转染试剂工作液轻轻混匀,室温孵育20min后,加入到4ml sf9细胞液中,然后放置于28℃培养箱静置培养。
73.3.转染24h后观察细胞状态,可见复合物颗粒,检测是否污染,以便及时应对。
74.4.转染72h后,可见细胞明显病变,细胞变圆变大。3-5天后收集上清,1500rpm/min室温进行离心。上清用0.22um过滤器过滤并定义为tpo-p0代病毒,4℃短期保存(有效期三个月),-20℃长期保存(有效期一年)。残留细胞可进行wb分析,检测tpo是否表达。确认表达后,继续扩增tpo-p1代病毒。
75.5.接种密度为1.5x106(活力大于95%)的sf9细胞共30ml在125ml摇瓶中,p0病毒按照1e6的滴度进行计算moi=0.05,加入sf9细胞中,28℃,静止培养。72h可以观察到细胞病变,3-4天后收集上清,1500rpm/min室温进行离心。上清用0.22um过滤器过滤,定义为tpo-p1代病毒,待后续滴度测定后,可直接用于tpo-p2代病毒大规模扩增。
76.6.接种密度为1.5x106(活力大于95%)的sf9细胞共1000ml在2.8l摇瓶中,p1病毒按照1e7的滴度进行计算moi=0.05,加入sf9细胞中,28℃,静止培养。72h可以观察到细胞病变,3-4天后收集上清,1500rpm/min室温进行离心。上清用0.22um过滤器过滤,定义为tpo-p2代病毒,待后续滴度测定后,可直接用于大规模侵染表达tpo蛋白。
77.7.利用荧光定量pcr方法进行滴度测定,利用tpo标准质粒作为标准品,对tpo-p2病毒dna提取后作为样品进行滴度定量,病毒滴度大于1e8可用。
78.(四)发酵表达过程
79.一.摇瓶发酵
80.1、h.five细胞悬液准备:
81.a.将细胞悬液摇匀,用移液管吸出1ml左右加入无菌1.5mlep管中,吸出10ul细胞悬液与10ul台盼蓝混匀,吸取10ul至细胞计数板,放入细胞计数仪中自动计数,并在显微镜下观察细胞状态。
82.b.细胞转染密度为3e6,体积为1l;根据活细胞数计算所需细胞悬液体积,将细胞悬液转移至50ml无菌离心管中,置于离心机中以800rpm/min离心5min,收集细胞,倒掉大部分旧培养基,剩下5-10ml旧培养基/管,重悬细胞,倒入2.8l摇瓶,1lh.five细胞新鲜培养基中添加45ml 200mm谷氨酰胺(9mm),将含9mm谷氨酰胺的培养基倒入2.8l摇瓶中至终体积为1l。
83.2、sf9细胞悬液准备:
84.a.将细胞悬液摇匀,用移液管吸出1ml左右加入无菌1.5ml、ep管中,吸出10ul细胞
悬液与10ul台盼蓝混匀,吸取10ul至细胞计数板,放入细胞计数仪中自动计数,并在显微镜下观察细胞状态,细胞活力大于98%。
85.b.细胞转染密度为3e6,体积为1l;根据活细胞数计算所需细胞悬液体积,将细胞悬液转移至50ml无菌离心管中,置于离心机中以1500rpm/min离心5min,收集细胞,用新鲜sf9细胞培养基重悬细胞,倒入2.8l摇瓶,终体积为1l。
86.2.病毒侵染:
87.a.在宿主细胞(h.five细胞或sf9细胞)中加入病毒,所需病毒=细胞密度x体积x moi/病毒滴度
88.b.按照计算结果,轻轻颠倒混匀病毒后,按照moi=2加入tpo-p2代病毒,轻轻混匀,置于28,℃120rpm/min干燥培养箱中进行震荡悬浮培养。发酵过程持续72h,每隔24h监测细胞动态参数变化,3天后收集样品。
89.3.将发酵液倒入250ml离心瓶中,配平,置于离心机中以3000rpm/min,4℃离心10min,收集上清,量取确认终体积。上清中加入终浓度为1mm/l的pmsf,发酵液保存于4℃待纯化。
90.实施例2 tpo纯化
91.纯化后的tpo需要保存在保存buffer中以备后续免疫反应的需要,免疫反应发生条件多为ph在中性附近,本实施例取ph=8,进行实验。
92.(一)常规方法纯化
93.具体步骤如下:
94.1.tpo抗体50mg在pbs(ph7.2)中4℃中透析12h,0.45um滤膜过滤透析液去除沉淀
95.2.取5ml nhs填料(ge),用50ml提前预冷的1mm hcl清洗填料。再50ml pbs(ph=7.2)清洗填料。
96.3.混合填料5ml和50mg抗体并混匀后4℃放置12h,50rpm。
97.4.回收填料,按照1:2比例加入封闭液(0.5m乙醇胺ph=8.0),室温放置3h,50rpm。
98.5.收取填料,ph=2.7甘氨酸洗脱液和pbs(ph=7.2)交替清洗5次,每次10ml。定义为纯化备用。
99.6.加入15ml平衡buffer(ph=7.2pbs)对纯化柱进行平衡。
100.7.1l上清开始上样,流速5ml/min,流完后pbs(ph=7.2)开始平衡50ml。
101.8.加入10ml洗脱buffer(ph=2.7,0.1m甘氨酸)进行洗脱,收集洗脱液。
102.9.收集的洗脱液滴入保存buffer(1m tris,ph=8.0),进行存储,发现沉淀。
103.10.存储后的tpo抗原,sds-page验证纯度。
104.结果如图1所示,泳道1:上清,泳道2:流穿,泳道3:洗脱组分1,泳道4:洗脱组分2,泳道5:洗脱组分3,泳道6:洗脱后沉淀,泳道7:marker,结果表明洗脱产物在ph=8.0的保存buffer中沉淀,且沉淀的产物为目的蛋白。
105.(二)本发明方法纯化
106.具体步骤如下:
107.(1)筛选tpo抗体
108.(a)外购tpo(购自hytest公司)进行老鼠免疫筛选,并获得35株有效抗体,将35株抗体,根据elisa反应活性初步选择反应活性为高、中、低不同的三株抗体,命名为#17、31#、
11#。
109.(b)偶联纯化验证
110.综上所述,#17、31#、11#三株抗体都能够用于纯化柱的制备,即抗体:填料=10:1制备亲和层析柱。
111.1.利用上述自制纯化柱,进行纯化
112.2.加入15ml平衡buffer(ph=7.2pbs)对纯化柱进行平衡。
113.3.1l发酵上清开始上样,流速5ml/min,流完后pbs(ph7.2)开始平衡50ml。
114.4.加入10ml洗脱buffer(3m氯化镁,ph=7.0)进行洗脱,收集洗脱液。
115.5.确认洗脱液无沉淀,并sds-page验证纯度
116.本实施例选用sf9细胞,不含his-tag标签。
117.纯化后#17、31#、11#总得率分别为96.8%,67.8%,25.2%。,因此选择#17用于后续的实验,将#17纯化出来的tpo蛋白,保存在保存buffer中,未观察到沉淀,凝胶验证纯度,结果如图2所示,泳道1:上清,泳道2:流穿,泳道3:marker,泳道4:保存以后的洗脱液。
118.结果显示,利用本发明方法洗脱和保存的抗体稳定性好,不会发生沉淀,利于后续免疫实验的需求。
119.实施例3宿主细胞和标签对纯化的影响
120.宿主细胞分别为h.five和sf9细胞,含有his-tag和不含his-tag,纯化结果如图3所示,泳道1:sf9带his-tag,泳道2:h.five带his-tag,泳道3:marker,泳道4:sf9细胞不含his-tag,泳道5:h.five不带his-tag,可以看出含有his-tag的重组蛋白,纯化的效果不如不含his-tag。
121.结果说明,利用本发明的纯化方法,选用h.five和sf9细胞作为宿主表达纯化,不需要添加标签,简化了操作,且纯化效果更好。
122.实施例4:洗脱液对纯化的影响
123.宿主细胞选择h.five细胞,不含有his-tag。
124.亲和层析柱为#17与填料的混合。
125.更换洗脱液的成分,纯度如下:
126.表1洗脱液纯化效果
[0127][0128][0129]
可以看出,洗脱液的浓度范围在1-5m,ph=6.5-8纯化出的tpo纯度较高,稳定性较好,没有沉淀,其中金属离子盐mgcl2、licl、nacl的更换不会影响纯化效果。
[0130]
实施例5 tpo性能验证
[0131]
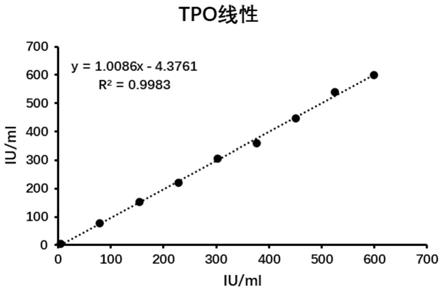
为了验证纯化出的tpo抗原应用到免疫实验中的效果,本实施例将抗原应用到试剂盒中,目前对抗体的检测主要有免疫比浊、免疫层析,化学发光等,其中化学发光对抗体的性能要求最为严格,所以本实施例选择化学发光进行测定。化学发光试剂盒可以从市面上进行采购。
[0132]
本实施例选择用实施例2中纯化的tpo抗原进行试验。
[0133]
测定试剂,包括r1,r2和磁珠溶液
[0134]
所述r1包括:生物素标记tpo抗原,使用浓度:1ug/ml.
[0135]
所述r2包括:碱性磷酸酶标记a蛋白,使用浓度0.1ug/ml
[0136]
具体操作步骤如下:
[0137]
1.实验准备:r1、r2工作液各5ml,磁珠溶液4ml,校准品,临床样本24例。(补充检测步骤)
[0138]
2.将各组分分别放入试剂盒内,再将试剂盒放入全自动化学发光免疫分析仪exi1800(来自中元汇吉生物技术股份有限公司)中,选择anti-tpo项目(样本10ul、r1 60ul、r2 125ul、磁珠溶液30ul)进行实验。
[0139]
(1)线性实验
[0140]
实验结果如表2和图4所示:
[0141]
表2线性实验
[0142][0143]
结果如图4所示,从图4中可以看出,利用本发明纯化的tpo抗原,应用到化学发光检测中,可以实现灵敏度≤3iu/ml,线性范围5-600iu/ml的检测,说明tpo抗原能优良。
[0144]
(2)临床验证
[0145]
将本发明生产的tpo制备试剂盒与市面上外购的试剂盒进行相关性分析。
[0146]
结果如图5所示,相关系数为0.99,说明产品相关性良好,适合应用于临床检测。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1