Ikaros或Aiolos介导的病症的有利疗法的制作方法
本发明提供了用于治疗由转录蛋白ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症的治疗组合物、组合及其用途,所述治疗通过泛素蛋白酶体途径降解这些蛋白进行。
背景技术:
1、ikaros家族是一系列锌指蛋白转录因子,其对于某些生理过程,特别是造血细胞和淋巴细胞发育是重要的(参见fan,y.和lu,d.“the ikaros family of zinc-fingerproteins”acta pharmaceutica sinica b,2016,6:513-521)。ikaros(ikzf1)于1992年首次被发现(参见georgopoulos,k.等人“ikaros,an early lymphoid-specifictranscription factor and a putative mediator for t cell commitment”science,1992,258:802-812),并且在随后的二十年中已经鉴定了四种另外的同源物:helios(ikzf2)、aiolos(ikzf3)、eos(ikzf4)和pegasus(ikzf5)(参见john,l.b.,和ward,a.c.“the ikaros gene family:transcriptional regulators of hematopoiesis andimmunity”mol immunol,2011,48:1272-1278)。ikaros蛋白家族的各种成员在体内的分布显著不同。
2、ikaros、helios和aiolos主要在淋巴样细胞及其相应的祖细胞中发现,在脑中另外检测到ikaros,在红细胞中检测到ikaros和helios。eos和pegasus分布广泛,见于骨骼肌、肝脏、脑和心脏(参见perdomo,j.等人.“eos and pegasus,two members of theikaros family of proteins with distinct dna binding activities:j biol chem,2000,275:38347-38354;schmitt,c.等人.“aiolos and ikaros:regulators oflymphocyte development,homeostasis and lymphoproliferation”apoptosis,2002,7:277-284;yoshida,t.和georgopoulos,k.“ikaros fingers on lymphocytedifferentiation”int jhematol,2014,100:220-229)。
3、ikaros对于适当的淋巴细胞发育是重要的。编码前三个n-末端锌指的外显子的缺失导致小鼠缺乏t-细胞、b-细胞、天然杀伤(nk)细胞及其祖细胞。ikaros的遗传改变与急性淋巴细胞白血病(all)治疗的不良结果相关。ikaros和aiolos参与多发性骨髓瘤细胞和淋巴瘤细胞的增殖。
4、多发性骨髓瘤(mm)是浆细胞恶性肿瘤,其特征通常在于单克隆免疫球蛋白的异常产生、骨髓牵连、肾功能障碍、免疫功能障碍和骨骼损伤。在美国,mm几乎占所有新癌症的1.8%。尽管患有mm的受试者的结果在过去几十年中已经显著改善,但是该疾病仍然无法治愈,目前预测的5年相对存活率为53.9%。由于可用的治疗不是治愈性的,几乎所有患者最终都会发生进展。
5、历史上mm的治疗包括化疗,包括烷化剂和皮质类固醇在内。在20世纪80年代,用自体干细胞移植进一步推进了治疗。在20世纪90年代,发现沙利度胺(首创新药,免疫调节性酰亚胺,)在骨髓瘤中的功效,导致治疗方案的巨大转变和患者结果的改善。已获得批准的跟进药物(follow-on)来那度胺和泊马度胺,现在被广泛用于治疗mm,类似于首创新药沙利度胺。这类药剂结合e3连接酶底物识别衔接蛋白羟脑苷脂(cereblon,crbn)并促进ikaros(ikzf1)和aiolos(ikzf3)的降解,导致抗肿瘤作用;影响肿瘤微环境和免疫调节,导致t细胞引发和抗肿瘤活性。许多患有mm的患者用包含这些imid之一的多种方案治疗。这些药物与包括地塞米松、抗分化簇38(cd38)抗体和蛋白酶体抑制剂(如硼替佐米(bortezomib))的药剂组合,现在被认为是治疗mm的多线疗法的标准护理。尽管这些药剂已经成功地延长了mm患者的无进展生存期,但患者通常复发,每次复发后无进展生存期更短。新药贝伦单抗和赛灵克斯(selinexor)的近期研究在多类难治性骨髓瘤中显示出改善的结局,导致近期fda加速批准;然而,应答率低(26-31%),无进展生存期短(3.7-4.9个月),因此凸显了这些患者中持续未满足的医疗需求。
6、非霍奇金淋巴瘤(nhl)是一组起源于t、b或nk细胞的异质性淋巴样恶性肿瘤。其包括弥漫性大b细胞淋巴瘤、间变性大细胞淋巴瘤、伯基特淋巴瘤、淋巴母细胞淋巴瘤、套细胞淋巴瘤、外周t细胞淋巴瘤、滤泡性淋巴瘤、皮肤t细胞淋巴瘤、淋巴浆细胞性淋巴瘤、边缘区b细胞淋巴瘤、malt淋巴瘤和小细胞淋巴细胞性淋巴瘤。b细胞nhl占大多数,而t细胞淋巴瘤较不常见。在新诊断的患有侵袭性nhl的患者中,包括环磷酰胺、长春新碱、泼尼松和柔红霉素(称为chop)的基于化疗的方案仍然是主要的治疗手段。在b细胞侵袭性淋巴瘤中,利妥昔单抗联合chop是给予新诊断患者的主要疗法。在一些患者中,特别是在那些患有t-细胞nhl的患者中,最初的化疗后进行自体干细胞拯救。在复发性难治性群体中,已经开发了各种靶向药物,因此改善了nhl的多种亚型的治疗选择,然而这些治疗选择往往不是治愈性的。另外,nhl亚型在生物学上是异质性的,这限制了治疗剂在适应症中的广泛发展。
7、在新诊断的具有侵袭性淋巴瘤的患者中,最初的治疗常常是强烈的,并且以治愈为目的施用。除了在b细胞nhl治疗中将利妥昔单抗加入chop中和在间变性大细胞淋巴瘤(alcl)中将本妥昔单抗加入chop中之外,没有其他新的靶向药物显示存活改善,因此没有其他药物被批准用于治疗初治患者。在复发性nhl中的最近治疗进展包括布鲁顿酪氨酸激酶(btk)抑制剂,特别是对于套细胞淋巴瘤(mcl)和更惰性形式的nhl,已经批准用于弥漫性大b细胞淋巴瘤(dblcl)和mcl的嵌合抗原受体t细胞(car-t)疗法,以及已经批准用于dlbcl的新型抗体药物偶联物如泊洛妥珠单抗(polatuzumab)、贝兰他单抗(belantamab)或他法西他单抗(tafasitamab)。最近批准用于t细胞nhl的药物包括罗米地辛、贝利司他和本妥昔单抗。与本方案中所研究的nhl群体相关,来那度胺已在b细胞和t细胞nhl(包括mcl、dlbcl和外周t细胞淋巴瘤(ptcl))中显示出临床活性。来那度胺在复发性/难治性(r/r)mcl群体中进行了研究,根据ii期emerge研究的结果,于2013年6月获得美国食品药品监督管理局(fda)的批准,所述ii期emerge研究检查来那度胺在接受硼替佐米治疗后的r/r mcl受试者中的疗效和安全性(总缓解率[orr]28%;中位缓解持续时间[dor]16.6个月)。来那度胺在dlbcl和ptcl中也有活性。虽然来那度胺和其他新的靶向疗法具有适度至良好的应答率,但应答的持久性在大多数nhl亚型中趋于较短。一旦患者在1-2个治疗方案后复发,中位缓解持续时间倾向于低,并且取决于患者是否有足够的体能状态和器官功能以耐受这些疗法。因此,在患有r/r nhl的患者中仍然存在未满足的医疗需求。
8、蛋白质降解是维持细胞稳态的高度可调性的基本过程。通过泛素-蛋白酶体途径(upp)实现受损的、错误折叠的或过量的蛋白质的选择性鉴别和去除。upp是几乎所有细胞过程的调节的中心,所述细胞过程包括抗原加工、细胞凋亡、细胞器的生物发生、细胞周期、dna转录和修复、分化和发育、免疫应答和炎症、神经和肌肉变性、神经网络的形态发生、细胞表面受体的调节、离子通道和分泌途径、对应激和细胞外调节剂的应答、核糖体生物发生和病毒感染。通过e3泛素连接酶将多个泛素分子共价连接到末端赖氨酸残基标记了用于蛋白酶体降解的蛋白质,其中所述蛋白质被消化成小肽并最终消化成其组成氨基酸,所述组成氨基酸充当新蛋白质的构建单元。缺陷型蛋白酶体降解与多种临床病症有关,包括阿尔茨海默病、帕金森病、亨廷顿病、肌营养不良、心血管疾病和癌症等。
9、描述某些蛋白质降解剂的专利申请包括wo2020/210630、wo2020/006262、wo2020/010227和wo2020/010177。
10、由c4医药公司提交的描述能够结合e3泛素连接酶和靶蛋白以进行降解的化合物的专利申请包括:wo/2021/127561,标题为“isoindolinone and indazole compounds forthe degradation of egfr”;wo/2021/086785,标题为“bifunctional compounds”;wo/2021/083949,标题为“bifunctional compounds for the treatment of cancer”;wo/2020/210630,标题为“tricyclic degraders of ikaros and aiolos”;wo/2020/181232,标题为“heterocyclic compounds for medical treatment”;wo/2020/132561,标题为“targeted protein degradation”;wo/2019/236483,标题为“spirocyclic compounds”;wo2020/051235,标题为“compounds for the degradation of brd9 or mth1”;wo/2019/191112,标题为“cereblon binders for the degradation of ikaros”;wo/2019/204354,标题为“spirocyclic compounds”;wo/2019/099868,标题为“degraders and degrons fortargeted protein degradation”;wo/2018/237026,标题为“n/o-linked degrons anddegronimers for protein degradation”;wo 2017/197051,标题为“amine-linked c3-glutarimide degronimers for target protein degradation”;wo 2017/197055,标题为“heterocyclic degronimers for target protein degradation”;wo 2017/197036,标题为“spirocyclic degronimers for target protein degradation”;wo 2017/197046,标题为“c3-carbon linked glutarimide degronimers for target proteindegradation”;及wo 2017/197056,标题为“bromodomain targeting degronimers fortarget protein degradation”。
11、本发明的目的是提供物质的新组合物、其组合、制剂和用途以及制备化合物的方法,用于治疗由ikaros或aiolos介导的医学病症。
技术实现思路
1、化合物1是小分子抗癌剂,其以高亲和力结合羟脑苷脂e3连接酶,从而在羟脑苷脂上产生与ikzf1和ikzf3相互作用的新表面(参见wo2020/210630)。其结果是,ikzf1和ikzf3被羟脑苷脂e3连接酶有效地泛素化并被蛋白酶体降解。化合物1的高羟脑苷脂结合亲和力使得ikzf1/3能够快速、深度和持久降解,从而在癌细胞中产生强效活性,所述癌细胞例如包括但不限于造血系统癌症,诸如多发性骨髓瘤和多种类型的非霍奇金淋巴瘤。
2、
3、现已发现,本文描述的化合物1和其他化合物可以在高效治疗方案中以每天一次或两次的低剂量方案,任选地与药物假期一起施用以治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症。例如,已发现以不超过约500、450、400、350、325、300、275、250、225、200、175、150、125或甚至100、75、50、45、40、35、30、25、20、15、10、5或1微克(μg)每天一次(qd)或每天两次(bid)的剂量使用本文描述的化合物中的一种,抗癌治疗可对患者有效。在某些实施方案中,患者是成人(通常是至少100磅或更重,有时甚至125或150磅(例如70kg或更重及通常至少18岁或更大的人)。在另一个实施方案中,患者是儿童(可以小于100、125或150磅及通常小于18岁)。不仅已经发现化合物1作为低剂量疗法是有效的,而且它还可以具有对患者有利的药物假期。例如,化合物1可以每天给药一次或两次,持续21天,然后停药7天进行递送。备选的给药方案也是有用的,例如包括但不限于增加或减少药物假期1、2、3、4、5、6或7天的那些。
4、在某些实施方案中,本文描述的化合物1或另一种化合物调节患者的免疫活性。例如,已经发现化合物1激活细胞毒性t细胞的增殖,这对于抗癌治疗可能是关键的。
5、在非限制性实施方案中,本文描述的化合物1或另一种化合物可与地塞米松每日或间歇施用。在某些实施方案中,地塞米松或另一种皮质类固醇或另一种免疫抑制剂或抗炎剂在28天周期中每天施用而没有药物假期。在其他实施方案中,地塞米松或另一种皮质类固醇或另一种免疫抑制剂或抗炎剂与药物假期一起施用,其可与本文描述的化合物1或另一种化合物的药物假期相同或不同。
6、在本发明的一个方面,低剂量ikaros(ikzf1)和/或aiolos(ikzf3)降解化合物是化合物1或其药学上可接受的盐。
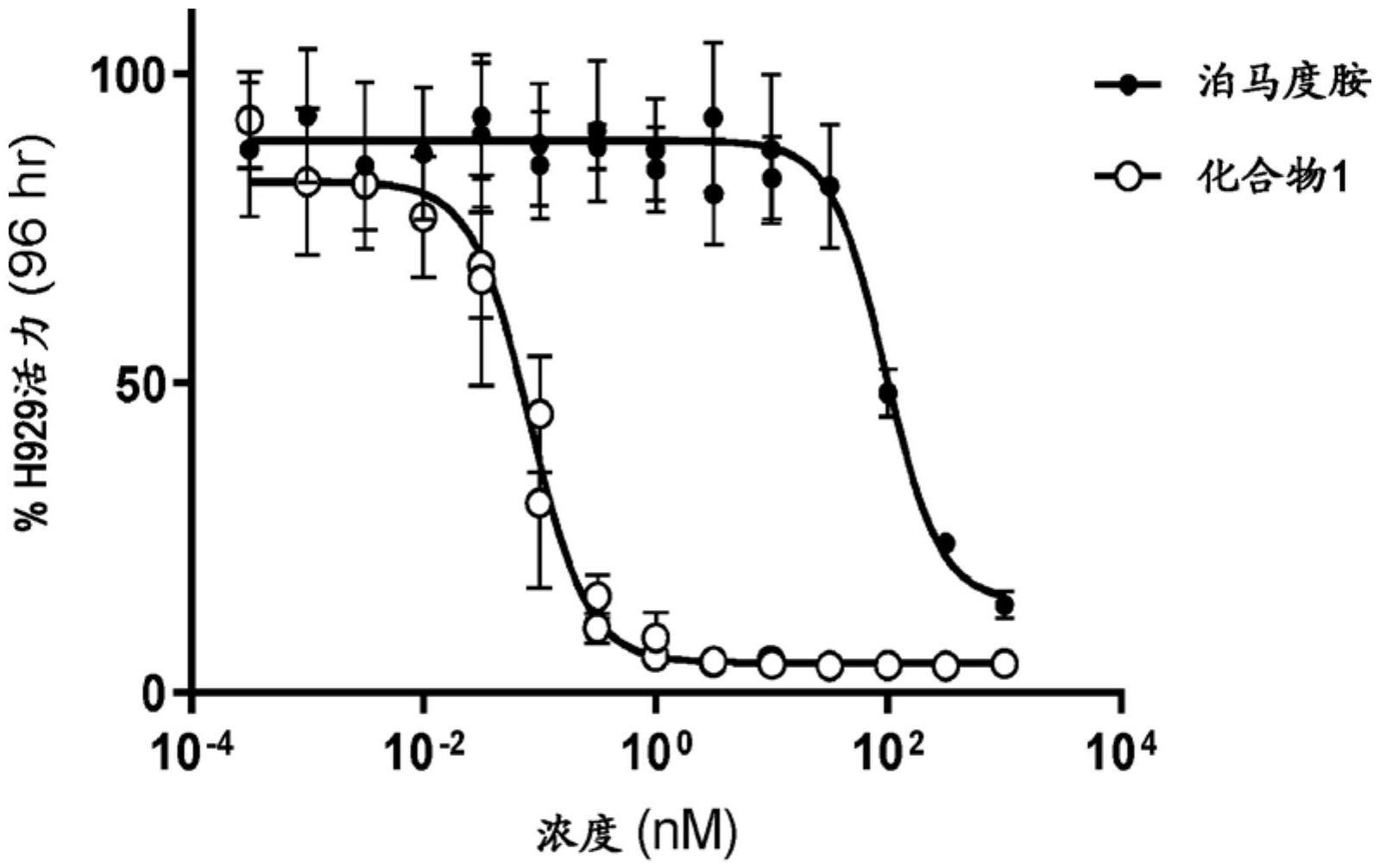
7、化合物1对羟脑苷脂具有高结合亲和力(解离常数kd=0.9nm)。化合物1在0.3nm下在1.5小时内促进多发性骨髓瘤细胞中>75%稳态ikzf1的降解。化合物1的高结合亲和力和降解催化使得在先前未处理的ncih929多发性骨髓瘤细胞系(96%最大生长抑制,平均半最大抑制浓度ic50为0.071nm)和对来那度胺和泊马度胺具有抗性的ncih929细胞(70%最大生长抑制,平均ic50为2.3nm)中的有效细胞生长抑制成为可能。
8、本文描述的化合物可用于治疗对由ikzf1或ikzf3介导的癌症的标准护理疗法(包括imid,包括泊马度胺或在背景技术或具体实施方式中描述的那些中的任一种)具有抗性、难治性或无应答的癌细胞。
9、如实施例12所示,化合物1在一组多发性骨髓瘤细胞系中显示出强抗癌活性(12种中的8种具有应答,应答细胞系中的平均ic50为0.3nm)。还在多种非霍奇金淋巴瘤亚型的几种细胞系模型中证明了化合物1的抗癌活性,包括套细胞淋巴瘤(mcl)(所测试的六种细胞系中的四种具有应答,应答细胞系中平均ic50为13nm),弥漫性大b细胞淋巴瘤(dlbcl)(十一种生发中心b细胞样dlbcl中的六种和六种活化的b细胞dlbcl细胞系中的三种具有应答,应答细胞系中平均ic50分别为12nm和1.6nm),间变性大细胞淋巴瘤(alcl)(六种细胞系中的四种具有应答,应答细胞系中平均ic50为1.7nm)和皮肤t细胞淋巴瘤(ctcl)(所测试的四种细胞系中的三种具有应答,应答细胞系中平均ic50为30nm)。在小鼠异种移植肿瘤模型中,化合物1展示3μg/kg/天至100μg/kg/天的剂量依赖性功效(参见实施例13)。在所测试的几种肿瘤异种移植物中,化合物1以30μg/kg/天至100μg/kg/天的剂量每日给药导致持久的肿瘤消退。如图45a、图45b、图45c、图52和其他图所示,在多种癌症测定中,化合物1效力比泊马度胺高超过100倍。
10、在小鼠异种移植物模型中,尽管以低10倍的剂量给药,化合物1具有比cc-92480(目前处于由百时美施贵宝的子公司celgene进行的人体临床试验中)更持久的可测量的血浆和肿瘤浓度。与泊马度胺或cc-92480相比,用化合物1处理后ikzf3水平恢复也花费显著更长的时间。例如,在nci-h929肿瘤模型中,在施用化合物1后,ikzf3水平达到其处理前水平的50%需要超过48小时,而cc-92480(以10倍更高的剂量)和泊马度胺(以30倍更高的剂量)在处理的48小时内达到ikzf3的处理前水平。
11、由于化合物1和本文描述的其他化合物的显著功效,已经发现由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症的新的有利治疗。在本发明的非限制性实施方案中,可以在如下非限制性实施例中使用本文描述的ikaros(ikzf1)和/或aiolos(ikzf3)降解化合物:
12、1.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中所述化合物以低剂量施用。例如,剂量不超过约500、450、400、350、325、300、275、250、225、200、175、150、125、100、95、90、85、80、75、70、65、60、55、50、45、40、35、30、25、20、15、10、5或1微克(μg),每天一次(qd)或每天两次(bid),任选地具有药物假期。
13、2.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中本文描述的化合物以有效量以包括药物假期的给药方案施用,例如28天治疗周期中1、2、3、4、5、6、7、8、9、10、11、12、13或14天的药物假期。
14、3.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中首先从患者采集血液或组织样品,并测定一种或多种生物标志物的浓度,例如肿瘤免疫标志物(例如细胞因子、肿瘤浸润淋巴细胞、t细胞活化和/或增殖、或b细胞标志物如bcma或m蛋白、或其组合);凋亡标志物(例如,总的和/或裂解的胱天蛋白酶-1、胱天蛋白酶-3、胱天蛋白酶-7、parp、bim或存活蛋白、或其组合);或锌指蛋白(例如,ikzf1、ikzf3、zfp91、wiz或sall4或其组合),并且其中如果患者具有统计上不同的生物标志物浓度,包括但不限于与健康人相差约5%、10%、15%或20%,则向该患者施用本文描述的化合物1或其药学上可接受的盐或另一种化合物。
15、4.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中首先从患者采集血液或组织样品,并测定一种或多种生物标志物的浓度,例如irf-1、胱天蛋白酶-3、il-2和/或ifn-γ,并且其中如果患者具有统计学上比健康人低的生物标志物浓度,包括但不限于低至多约5%、10%、15%或20%,则向该患者施用本文描述的化合物1或其药学上可接受的盐或另一种化合物。
16、5.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中首先从患者采集血液或组织样品,并测定一种或多种生物标志物的浓度,例如细胞周期蛋白d1、e2f1、zfp91、sall4、irf-4、
17、blimp1和/或myc,并且其中如果患者具有统计学上比健康人高的生物标志物浓度,包括但不限于高至多约5%、10%、15%或20%,则向该患者施用本文描述的化合物1或其药学上可接受的盐或另一种化合物。
18、6.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中向患者施用本文描述的化合物1或其药学上可接受的盐或另一种化合物,然后从患者采集血液或组织样品,并测定一种或多种生物标志物的浓度,例如irf-1、胱天蛋白酶-3、il-2和/或ifn-γ,其中如果生物标志物的浓度没有显著增加,例如增加至少约1.25、
19、1.5、1.75或2倍,则增加化合物的剂量。治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中向患者施用本文描述的化合物1或其药学上可接受的盐或另一种化合物,然后从患者采集血液或组织样品,并测定一种或多种生物标志物的浓度,例如细胞周期蛋白d1、e2f1、zfp91、sall4、irf-4、blimp1和/或myc,其中如果生物标志物的浓度没有显著降低,例如降低约1.25、1.5、1.75或2倍,则增加化合物的剂量。
20、7.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中向患者施用本文描述的化合物1或其药学上可接受的盐或另一种化合物,然后从患者采集血液或组织样品,并测定一种或多种生物标志物的浓度,例如肿瘤免疫标志物(例如细胞因子、肿瘤浸润淋巴细胞、t细胞活化和/或增殖、及b细胞标志物如bcma或m蛋白、或其组合);凋亡标志物(例如,总的和/或裂解的胱天蛋白酶-1、胱天蛋白酶-3、胱天蛋白酶-7、parp、bim或存活蛋白、或其组合);或锌指蛋白(例如,ikzf1、ikzf3、zfp91、wiz或sall4或其组合),其中如果生物标志物的浓度没有显著改变,例如改变至少约1.25、1.5、1.75或2倍,则增加化合物的剂量。
21、8.用有效量的本文描述的化合物或其药学上可接受的盐治疗活化的弥漫性大b细胞淋巴瘤、生发中心弥漫性大b细胞淋巴瘤、结外自然杀伤(nk)细胞淋巴瘤或结外t细胞淋巴瘤。
22、9.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中所述化合物以低剂量施用。例如,剂量不超过约500、450、400、350、325、300、275、250、225、200、175、150、125或甚至100、75、50或25微克(μg),每天一次(qd)或每天两次(bid),任选地具有药物假期。
23、10.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中本文描述的化合物与btk抑制剂组合使用,例如选自阿卡替尼(acalabrutinib)、斯贝布替尼(spebrutinib)、泽布替尼(zanubrutinib)、loxo-305、依伏替尼(evobrutinib)、tg-1701、妥布替尼(tolebrutinib)、biib091、dzd-9008、hz-a-018、奥布替尼(orelabrutinib)、ac0058ta、sn1011、利扎鲁替尼(rilzabrutinib)、arq 531、dtrmwxhs-12、jnj-64264681、布拉布替尼(branebrutinib)、依鲁替尼、和非奈布替尼(fenebrutinib)的btk抑制剂。
24、11.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中本文描述的化合物与cd38抗体组合使用,例如选自菲泽妥单抗、达雷木单抗、gbr 1342、tak-573、cid-103、okt10、sti-6129、sgx301、tak-079、和迈泽妥单抗的cd38抗体。
25、12.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中本文描述的化合物与蛋白酶体抑制剂组合使用,例如选自硼替佐米、卡非佐米、柠檬酸艾沙佐米、奥普佐米、德兰佐米、乳胞素、环氧酶素、mg132、mg-262、cep-18770、neosh101、tqb3602和kzr-616的蛋白酶体抑制剂。
26、13.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中本文描述的化合物与imid组合使用,例如选自沙利度胺、泊马度胺、来那度胺、伊贝托胺(ibedomide)、cc-92480、cc-90009和cc-99282的imid。
27、14.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中本文描述的化合物与hdac抑制剂组合使用,例如选自trapoxin b、苯丁酸钠、乙酰地那林、莫西替司他、brd73954、bg45、多马司他(domatinostat)、cay10603、hpob、tmp269、nexturastat a、santacruzamate a、splitomicin、lmk-235、丁酸钠、丁酸新戊酰氧基甲酯、pyroxamide、abexinostat、resminost、givinostat、quisinostat、psammaplin a、kd5170、1-丙氨酸衣原蛋白(alaninechlamydocin)、depudecin、帕比司他(panobinostat)、ricolinostat、伏林司他(vorinostat)和cudc-101的hdac抑制剂。
28、15.治疗由ikaros(ikzf1)和/或aiolos(ikzf3)介导的病症,其中本文描述的化合物与另外的化合物组合使用,例如选自赛灵克斯(selinexor)、奥沙普那胺(oxaphenamide)、贝伦莫多汀(belantamab mafodotin)、地诺单抗(denosumab)、唑来膦酸(zoledronic acid)、普乐沙福(plerixafor)、艾曲波帕(eltrombopag)、伊匹单抗(ipilumumab)、帕博西尼(palbociclib)、ricolinostat、阿呋塞替尼(afuresertib)、dinaciclib、filanesib、indatuximab ravtansine、马赛替尼(masitinib)、索尼德吉(sonidegib)、sotatercept、ulocuplumab、和urelumab的化合物。
29、16.由ikaros(ikzf1)和/或aiolos(ikzf3)介导的癌症的治疗,包括施用有效量的化合物1以激活t细胞的增殖。
30、这些新的治疗提供了优于目前批准的癌症治疗的优点。例如,本文描述的化合物可以以比第一代imid更低的剂量施用;能够穿透血脑屏障以治疗中枢神经系统(cns)相关癌症,例如cns相关淋巴瘤;能够治疗已经复发或用标准护理方案(包括第一代imid治疗)难治的癌症;和/或可以向患者提供比第一代imid(例如沙利度胺、泊马度胺和来那度胺)更长的无进展生存期。在某些实施方案中,本文描述的化合物在体内的效力是沙利度胺、泊马度胺、来那度胺或cc-92480的约30、40、50、60、70、80、90、100、500或甚至1000倍。在某些实施方案中,本文描述的化合物引起ikzf1和/或ikzf3的持久降解(例如ikzf1和/或ikzf3水平需要12小时、18小时、24小时、36小时、48小时或更长时间来恢复至处理前水平)。这种持久的降解是体内高效力、代谢稳定性和/或选择性的结果。
31、在一个方面,本文描述的治疗中使用的化合物选自:
32、
33、
34、
35、或其药学上可接受的盐。
36、本文描述的化合物调节免疫系统活性,例如激活ifn-α、ifn-β或ifn-γ。通过激活免疫系统,所述化合物可以更有效地治疗癌症。这种免疫调节活性增加了本文描述的化合物与另一种抗癌剂诸如达雷木单抗的功效。
37、在某些实施方案中,ikzf1和ikzf3从恶性b或t细胞的降解导致肿瘤细胞死亡,并且它们从肿瘤微环境的耗竭导致t细胞活化。
38、化合物可以例如提供用于口服、肠胃外或局部递送。在某些实施方案中,化合物以用于口服递送的固体、凝胶或液体剂型提供,或可以静脉内提供。在一些实施方案中,所选化合物作为用于口服施用的软壳胶囊或固体剂型片剂提供。在某些实施方案中,药物组合物的剂量强度为约1μg、5μg、10μg、15μg、20μg、25μg、50μg、75μg、100μg、125μg、150μg、175μg、200μg、225μg、250μg、275μg、300μg、325μg、350μg、375μg、400μg、425μg、450μg、475μg、500μg、525μg、550μg、575μg、600μg、625μg、650μg、675μg、700μg、725μg、750μg、775μg、或800μg,在一个非限制性方面,其可在28天治疗周期的第1-21天每日一次(qd)或每日两次(bid)施用。
39、化合物可以例如提供用于口服或肠胃外递送。在某些实施方案中,化合物以用于口服递送的固体、凝胶或液体剂型提供,或可以静脉内提供。在一些实施方案中,所选化合物作为用于口服施用的软壳胶囊或片剂提供。在某些实施方案中,固体或凝胶剂型的剂量强度为25μg、50μg、100μg、200μg、300μg或400μg,在一个非限制性方面,其可在28天周期的第1-21天每日一次(qd)施用。
40、在一个主要方面,用于本文描述的治疗的化合物是化合物1或其药学上可接受的盐。
41、在某些实施方案中,本文描述的任何化合物具有至少一种所需的原子同位素取代,其量约为同位素的天然丰度,即是富集的。在某些实施方案中,化合物包含一个或多个氘原子。
42、根据以下具体实施方式和权利要求,本发明的其他特征和优点将是显而易见的。
- 还没有人留言评论。精彩留言会获得点赞!