一种产氨肽酶的重组菌株及其在高效蛋白水解中的应用
1.本发明涉及一种产氨肽酶的重组菌株及其在高效蛋白水解中的应用,属于基因工程、酶工程及食品工程技术领域。
背景技术:
2.氨肽酶(aminopeptidases,简称aps,ec 3.4.11)是一类外切蛋白酶,它能够选择性地降解多肽链和蛋白质n末端氨基酸残基,释放出游离氨基酸。具有降低酪蛋白和大豆蛋白等蛋白水解液苦味的用途,被广泛应用于食品加工等行业。氨肽酶来源广泛、种类繁多,大量存在于植物、动物、微生物中,目前已报道的氨肽酶主要来源于微生物,包括大肠杆菌(escherichia coli)、沙克乳酸杆菌(lactobacillus sakei)、毕赤酵母(pichia pastoris)、米曲霉(aspergillus oryzae)、黑曲霉(aspergillus niger)、枯草芽孢杆菌(bacillus subtilis)等。
3.蛋白质水解物是各种多肽和氨基酸的混合物,具有优于蛋白质的理化性质和营养特性,是现代食品加工行业的重要原料。为提高食品的营养或改善其风味等性质,通常在糕点或饮料等食品中添加蛋白水解物。畜牧业也会选择在饲料中添加蛋白质水解物,作为营养补充剂增加动物的生长性能,提高免疫力。但是,蛋白质水解物存在一定的苦味,限制其在现代工业中的广泛应用。
4.蛋白质水解物的苦味主要来自于水解物中的苦味肽。苦味肽一般是n末端带有疏水性氨基酸的多肽。天然蛋白质由于疏水性氨基酸被包裹在分子内部,不与味蕾接触,因此感觉不到苦味。当天然蛋白质被水解后,分子内部的疏水性氨基酸暴露出来,与味蕾接触,尝到苦味。苦味肽的疏水性氨基酸通常有缬氨酸、亮氨酸、苯丙氨酸、脯氨酸等。氨肽酶通过催化降解苦味肽n末端的疏水性氨基酸残基,可达到降低苦味的目的。因此,利用氨肽酶可以显著改善酪蛋白和大豆蛋白水解液的水解程度,降低苦味。氨肽酶酶法脱苦的水解效率高,条件温和,易于操作,因此被广泛应用于食品等现代工业中。
5.氨肽酶具有巨大的商业应用价值,然而很少天然氨肽酶能够在生产便捷和经济节约等条件下,高效率地催化人们所期望的反应。现有的氨肽酶普遍存在产量低、酶活力较差且在高温条件下容易失活等问题。在食品加工等领域缺乏高催化活性和稳定性的氨肽酶。
6.目前针对氨肽酶的异源表达研究,大部分集中在大肠杆菌,因为大肠杆菌具有遗传背景清晰、繁殖速度快、易培养且蛋白表达量多等特点。但目的蛋白在大肠杆菌中只能胞内表达,且部分外源基因在表达时容易形成包涵体,这极大地提高了下游纯化的成本。此外,大肠杆菌的内毒素也限制了氨肽酶在食品方面的应用。
7.为保障食品安全,产氨肽酶菌株需要使用合格的食品工业用菌。枯草芽孢杆菌具有较清晰的遗传代谢途径,非致病性,无密码子偏好性,发酵周期短,适合高细胞密度培养。除此之外,枯草芽孢杆菌蛋白分泌能力强,并且可直接分泌到胞外。因此,枯草芽孢杆菌作为常用的食品安全级菌株。但枯草芽孢杆菌高效表达系统仍限制很多异源蛋白的表达,目前仅限于少量工业化酶的生产。原因在于枯草芽孢杆菌自身胞外表达的大量蛋白酶,能够
识别并降解外源蛋白。因此,实现氨肽酶在枯草芽孢杆菌胞外的高效表达对其工业化生产具有重要意义。
技术实现要素:
8.[技术问题]
[0009]
本发明要解决的技术问题是现有的氨肽酶存在异源表达的安全性且表达量低,酶活力不高,利用枯草芽孢杆菌进行表达时,存在外源蛋白被降解的问题。
[0010]
[技术方案]
[0011]
本发明提供一种来源于地衣芽孢杆菌(bacillus licheniformis e7)的氨肽酶,具有seq id no.1所示的氨基酸序列,编码所述氨肽酶的基因的核苷酸序列如seq id no.2所示。
[0012]
所述氨肽酶应用于蛋白水解中,与碱性蛋白酶协同水解大豆蛋白,能大幅度提高蛋白水解液的水解程度,释放出种类丰富的游离氨基酸和小分子活性肽。
[0013]
本发明还提供携带所述编码氨肽酶的基因的载体,所述载体包括但不限于pma0911。
[0014]
本发明还提供表达所述氨肽酶的重组微生物细胞,所述微生物包括但不限于枯草芽孢杆菌168。
[0015]
在一种实施方式中,所述重组微生物为重组枯草芽孢杆菌,以pma0911为载体,在枯草芽孢杆菌168中表达seq id no.1所示的氨肽酶。
[0016]
本发明还提供构建所述重组菌的方法,包括如下步骤:将核苷酸序列为seq id no.1所示的氨肽酶基因与载体pma0911连接,将获得的重组表达载体转化到枯草芽孢杆菌168中,获得重组菌。
[0017]
本发明还提供一种可溶性表达氨肽酶的方法,所述方法将所述重组枯草芽孢杆菌接种到培养基中,在30~35℃培养24~48h。
[0018]
在一种实施方式中,培养温度为30℃,培养时间为48h。
[0019]
在一种实施方式中,所述培养基配方为蛋白胨12g/l,酵母粉24g/l,甘油5g/l,磷酸二氢钾2.3g/l,磷酸氢二钾12.5g/l。
[0020]
本发明还提供含有所述氨肽酶的酶制剂。
[0021]
在一种实施方式中,所述酶制剂为所述氨肽酶的冻干粉,含有所述氨肽酶及其保护剂。
[0022]
本发明还提供所述重组菌,或所述氨肽酶,或所述酶制剂在蛋白水解领域的应用。
[0023]
在一种实施方式中,所述的蛋白水解包括但不限于大豆蛋白。
[0024]
在一种实施方式中,所述方法用于蛋白高效水解。
[0025]
[有益效果]
[0026]
本发明筛选了一株产氨肽酶的地衣芽孢杆菌(bacillus licheniformis e7),使用染色体步移技术从其基因组dna中克隆出完整的氨肽酶基因,构建表达载体,使其在枯草芽孢杆菌(bacillus subtilis)168中进行表达,获得了高效表达及高酶活的重组氨肽酶,为下游分离制备重组氨肽酶减少了成本。该重组氨肽酶应用于蛋白水解中,与碱性蛋白酶协同水解大豆蛋白,能大幅度提高蛋白水解液的水解程度,释放出种类丰富的游离氨基酸
和小分子活性肽。
[0027]
本发明成功构建了能高效表达目的基因的重组菌株b.subtilis 168/pma0911-pepn并将其应用于蛋白水解。重组菌表达的粗酶液经过his-trap hp层析柱纯化后得到重组纯酶blpepn
ex
(胞外酶)和blpepn
in
(胞内酶)。纯酶blpepn
ex
和blpepn
in
的最适反应ph分别为ph 9.0和7.0,在ph 6.0
–
9.0范围内酶活稳定,在4℃孵育2d后仍能保留超过65%以上的酶活性,因此重组氨肽酶能够与更广泛的蛋白酶协同作用,节约反应时间,提高蛋白水解效率。blpepn
ex
和blpepn
in
的最适反应温度都为45℃,在30
–
45℃温度范围内,孵育1h后仍保留超过80%以上的酶活性。在最适反应条件下,纯酶blpepn
ex
和blpepn
in
的比酶活分别为401.3u/mg和113.8u/mg。重组菌所产氨肽酶blpepn
ex
和blpepn
in
具有酶活性高、ph适用范围较广以及温度稳定性良好的特点。
[0028]
重组氨肽酶blpepn
ex
和blpepn
in
属于丙氨酸氨肽酶,具有较强的底物特异性。
[0029]
将重组氨肽酶应用于大豆分离蛋白水解中,能够高效提高大豆分离蛋白水解程度,释放出丰富多样的游离氨基酸和小分子活性肽,水解液中500da以下的小肽高达75%,其中,150da以下的小肽占比达44%,为提高蛋白质的深度水解和富含蛋白质生物资源的增值提供了重要酶制剂。
具体实施方式
[0030]
实施例1氨肽酶基因pepn的获得
[0031]
(1)产氨肽酶菌株的分离
[0032]
样品:源于中国江苏省无锡市富含蛋白质土壤
[0033]
培养基(g/l):氯化钠5,硫酸镁0.1,磷酸二氢钾0.5,氯化钙0.2,酵母抽提物0.3,胰蛋白0.3,ph 6.0。将样品置于培养基中,于37℃、200r/min振荡培养24h得到培养液。将以梯度稀释的培养液置于含有按质量计1%酪蛋白、1%蛋白胨、1%氯化钠、0.5%酵母粉、2%琼脂、ph7.0的平板上,于37℃条件下培养24h,选择具有明显透明圈的平板。
[0034]
(2)产氨肽酶菌株的鉴定
[0035]
根据bergey手册,使用细菌学测试对分离株进行鉴定,分析了菌株的形态生理和化学性质,初步鉴定该菌株为芽孢杆菌(bacillus.sp)。通过构建系统进化树,对比16s rrna序列的相似性,判定该菌株为地衣芽孢杆菌(b.licheniformis),命名为b.licheniformis e7。
[0036]
(3)地衣芽孢杆菌氨肽酶部分氨基酸序列分析
[0037]
用sds-page分析地衣芽孢杆菌(b.licheniformis)e7产生的蛋白质,然后切取氨肽酶产生的蛋白条带,用胰蛋白酶消化。通过质谱maldi-tof-ms对释放的短肽序列进行分析,获得氨肽酶的部分氨基酸序列。
[0038]
(4)氨肽酶pepn基因的克隆和序列分析
[0039]
使用快速细菌基因组dna分离试剂盒(sangon biotech.co.上海,中国)提取基因组dna,结合质谱maldi-tof-ms测定得到的部分氨基酸序列设计相应的简并引物,引物序列如下:
[0040]
p1:ctngcntcntaygcngcngarctngcngcn(seq id no.3);
[0041]
p2:gcnacnacntcncartcntcntgyttyggnccn(seq id no.4);
[0042]
利用简并引物扩增目的基因的部分序列,具体方法如下:
[0043]
pcr扩增条件:98℃预变性30s,然后进行以下循环:98℃变性30s,55℃退火30s,72℃延伸1min,30个循环;72℃延伸10min,4℃保温。以地衣芽孢杆菌(b.licheniformis e7)基因组为模板,以引物p1和p2进行pcr反应,扩增目的基因的部分序列(837bp)。
[0044]
为获取氨肽酶的完整基因,采用两轮反向pcr扩增已知片段的侧翼序列。基于部分基因序列(837bp)设计引物p3、p4、p5和p6,引物序列如下:
[0045]
p3:gcaaggggattacgttcgacactggtggtt;(seq id no.5)
[0046]
p4:cgactaaaccgatgacatcgtcccaagttt;(seq id no.6)
[0047]
p5:gtgcatctggatattgccgggac;(seq id no.7)
[0048]
p6:tggttgccgtcccggcaatatc;(seq id no.8)
[0049]
利用aflⅱ切割目的基因,通过t4 dna连接酶将目的基因进行自连接,以引物p3和p4进行第一轮反向pcr反应扩增侧翼片段(1.2kb)。利用nco i切割目的基因,通过t4 dna连接酶将目的基因进行自连接,以引物p5和p6进行第二轮反向pcr反应扩增侧翼片段(1.5kb)。利用snap gene 2.3.2对基因片段进行分析,可能的起始密码子atg位于1.2kb片段中,可能的终止密码子taa位于1.5kb片段中,组装三个片段获得完整的编码基因pepn(1446bp)。
[0050]
实施例2重组质粒pma0911-pepn的获得
[0051]
利用质粒提取试剂盒(南京诺唯赞生物科技股份有限公司)提取质粒pma0911。用限制性内切酶ecor i和bamh i对表达载体pma0911进行双酶切,酶切体系(50μl)为:待酶切质粒30μl、q.cut buffer 5μl、ecor i 1μl、bamh i 1μl、ddh2o 13μl。置于37℃金属浴,酶切1h。通过1%琼脂糖凝胶电泳分离酶切产物,使用胶回收试剂盒回收表达载体pma0911。
[0052]
测定目的基因pepn与表达载体pma0911的浓度。按照目的基因与载体的摩尔比为7:1,且二者的总添加量为8.5μl,构建连接体系(10μl),其中10
×
t4 buffer 1μl,t4连接酶0.5μl。将上述组分轻轻混匀,于16℃条件下连接12~16h,连接产物即重组质粒pma0911-pepn。
[0053]
实施例3重组枯草芽孢杆菌b.subtilis 168/pma0911-pepn的构建
[0054]
在每管500μl b.subtilis 168感受态细胞悬液中加入10μl实施例2得到的连接产物,轻轻混匀后,于45℃金属浴热激90s,然后于37℃,200rpm振荡培养2.5h。5,000rpm离心收集菌体,取50μl上清重新悬浮菌体,涂布于含有50μg/ml硫酸卡那霉素的lb平板上,37℃倒置培养过夜。
[0055]
阳性克隆的选择:挑取单菌落于含有50μg/ml硫酸卡那霉素的5ml液体lb中,置于37℃,200rpm振荡培养9h,然后利用质粒提取试剂盒提取质粒。双酶切体系(10μl)为:质粒8μl、buffer 1μl、ecor i 0.5μl、bamh i 0.5μl。将上述组分轻轻混匀,于37℃金属浴酶切1h。1%琼脂糖凝胶电泳验证酶切产物条带大小,观察有无适当大小的目标条带。双酶切验证后送至无锡天霖生物科技有限公司测序,获得阳性质粒pma0911-pepn,相应的单菌落为阳性克隆。
[0056]
实施例4:氨肽酶的发酵生产
[0057]
挑取阳性克隆单菌落b.subtilis 168/pma0911-pepn,置于50ml含50μg/ml硫酸卡那霉素的tb液体培养基(蛋白胨12g/l、酵母粉24g/l、甘油5g/l、磷酸二氢钾2.3g/l、磷酸氢
二钾12.5g/l,ph7.0),于30℃诱导培养48h。10,000rpm、4℃离心10min分离发酵上清液和菌体。用缓冲液a(20mm tris-hcl,150mm nacl,ph 8.0)将菌体重悬,在冰浴条件下用超声破碎仪对细胞进行破碎处理,将破碎液于10,000rpm、4℃离心30min,分离菌体破碎上清液和沉淀。发酵上清液和菌体破碎上清液分别用0.22μm水系滤头过滤,得到的滤液作为样品进行镍离子亲和层析柱纯化。
[0058]
将发酵上清液和菌体破碎上清液分别使用蛋白纯化系统进行纯化。首先,用缓冲液a(20mm tris-hcl,150mm nacl,ph 8.0)对histrap hp柱(ge healthcare,芝加哥,美国)平衡5个柱体积。上样后,用2%的缓冲液b(20mm tris-hcl,150mm nacl,1m咪唑,ph 8.0)洗杂蛋白,然后用10%的缓冲液b洗脱目的蛋白,收集的滤液分别为b.subtilis168胞外纯酶液blpepn
ex
和b.subtilis 168胞内纯酶液blpepn
in
。
[0059]
用脱盐柱对酶液进行脱盐处理,除去酶液中的咪唑。先分别用超纯水和缓冲液a冲洗和平衡柱子2~3次,每次加入3.5ml。然后上样,待脱盐结束后用缓冲液a将样品洗脱下来。收集完样品,再用缓冲液a和超纯水平衡和冲洗脱盐柱2~3次。脱盐后的纯酶液进行sds-page电泳,观察条带结果确定是否获得单一的目的纯化蛋白。
[0060]
实施例5:氨肽酶酶学性质测定
[0061]
(1)酶活力的测定:
[0062]
以aminoacyl-p-nitroanilines为底物,氨肽酶可以催化酰胺键的断裂,生成对硝基苯胺(p-nitroaniline),游离的对硝基苯胺呈黄色,引起405nm处吸光度的增加。因此可通过测定反应过程中405nm处吸光度的变化来衡量氨肽酶的活力。反应体系为:50mm tris-hcl(ph8.0)缓冲液,2mm ala-pna和适量的酶液,37℃进行反应,利用酶标仪连续测定405nm处的吸光值,以测定数值呈线性部分的斜率计算酶活。
[0063]
酶活定义:37℃下每分钟催化底物生成1μmol对硝基苯胺所需的酶量为一个酶活单位。
[0064]
酶活的计算公式:酶活(u)=ew
×v×
103/(9870
×
0.5)
[0065]
比酶活的计算公式:比酶活(u/mg)=酶活(u)/蛋白量(mg)
[0066]
其中,ew:1min内405nm处吸光度的变化;v:反应液的体积(ml);9870:摩尔消光系数(l/mol/cm);0.5:光程距离(cm)。
[0067]
(2)最适反应ph
[0068]
在具有不同ph的缓冲液中测定了重组氨肽酶blpepn
ex
和blpepn
in
的最适反应ph:0.2m的磷酸二氢钠-磷酸氢二钠缓冲液(ph 6.0);50mm的tris-hcl缓冲液(ph 7.0和8.0),50mm甘氨酸-naoh缓冲液(ph 9.0和10.0)。
[0069]
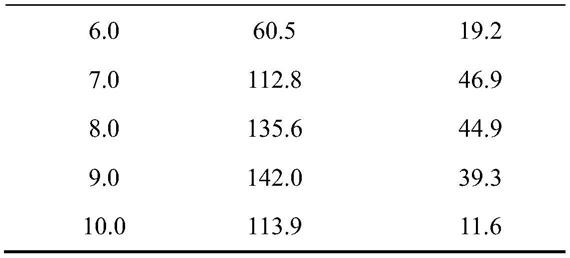
不同ph下测得的重组氨肽酶blpepn
ex
和blpepn
in
的比酶活如表1所示。blpepn
ex
和blpepn
in
的最适ph分别为9.0和7.0。在ph 8.0
–
10.0时,重组酶blpepn
ex
酶活力达到总活性的80%以上;在ph 7.0
–
9.0时,重组酶blpepn
in
酶活力达到总活性的80%以上。
[0070]
表1重组氨肽酶在不同ph下的比酶活
[0071]
[0072][0073]
注:测定温度为37℃。
[0074]
(3)最适反应温度
[0075]
为了确定温度对酶活性的影响,将重组氨肽酶blpepn
ex
和blpepn
in
分别置于30至55℃的温度梯度下,测定其酶活力。不同温度下计算得到的重组酶的比酶活如表2所示。重组氨肽酶blpepn
ex
和blpepn
in
的最适反应温度都为45℃,比酶活分别为401.3u/mg和113.8u/mg,胞外酶活力是胞内酶活力的3.5倍;blpepn
ex
在50℃时仍保留了总活性的88%以上。
[0076]
表2重组氨肽酶在不同温度下的比酶活
[0077][0078]
注:测定blpepn
ex
和blpepn
in
的最适反应温度时所用缓冲液的ph分别为9.0和7.0。
[0079]
(4)ph稳定性
[0080]
将重组氨肽酶blpepn
ex
和blpepn
in
在不同ph的缓冲液中(0.2m的磷酸二氢钠-磷酸氢二钠缓冲液,ph 6.0;50mm的tris-hcl缓冲液,ph 7.0和8.0;50mm甘氨酸-naoh缓冲液,ph 9.0和10.0)于4℃孵育2d,以孵育前的酶活为100%计算残余酶活力。在不同ph下的残余酶活力如表3所示。重组氨肽酶blpepn
ex
和blpepn
in
具有良好的ph稳定性:blpepn
ex
在ph 6.0
–
9.0孵育2d后,酶活力保持在65%以上;blpepn
in
在ph 6.0
–
10.0孵育2d后,酶活力保持在70%以上。
[0081]
表3重组氨肽酶在不同ph下保温2d后的残余酶活力
[0082][0083]
(5)温度稳定性
[0084]
将重组氨肽酶blpepn
ex
和blpepn
in
在不同温度下(30
–
55℃)保温1h,以4℃保温相同时间的酶活力定义为100%,计算残余酶活力。在不同温度下保温1h后的残余酶活数据如表4所示。重组酶blpepn
ex
和blpepn
in
可耐受30至45℃的温度,在保温1h后仍保留超过80%以上的酶活力。在最适反应温度45℃条件下,blpepn
ex
的残余酶活为83%,blpepn
in
的酶活力则几乎不受影响。因此重组酶blpepn
ex
和blpepn
in
可以在最适反应温度下稳定发挥其催化作用,为其在蛋白水解应用中提供了潜在的优势。
[0085]
表4重组氨肽酶在不同温度下保温1h后的残余酶活力
[0086][0087]
注:测定blpepn
ex
和blpepn
in
的温度稳定性时,所用缓冲液ph分别为9.0和7.0。
[0088]
(6)底物特异性
[0089]
选择不同的底物(ala-pna、arg-pna、lys-pna、leu-pna、val-pna、met-pna、pro-pna)测定重组氨肽酶的底物特异性。以酶活力最高的底物为100%,计算其它底物的相对酶活力。
[0090]
重组氨肽酶的底物特异性如表5所示。在测定的7种底物中,ala-pna是重组氨肽酶的最适底物,其次为arg-pna和lys-pna,其相对酶活在15%
–
30%。重组氨肽酶对其余4种底物(leu-pna、val-pna、met-pna、pro-pna)只展现出微小或几乎没有检测到酶活力。因此,重组氨肽酶blpepn
ex
和blpepn
in
属于丙氨酸氨肽酶,具有较强的底物特异性。重组氨肽酶blpepn兼具良好的催化活性和稳定性,在丙氨酸特异性催化降解中具有重要的应用价值。
[0091]
表5重组氨肽酶的底物特异性
[0092][0093]
实施例6:重组氨肽酶在大豆蛋白水解中的应用
[0094]
碱性蛋白酶是一类内切型蛋白酶,它能将蛋白质从内部水解成短肽。氨肽酶作为外切型蛋白酶,特异性地催化多肽链n末端氨基酸残基的释放,将短肽进一步切割成更小的小肽或游离氨基酸。因此,选择碱性蛋白酶和氨肽酶协同作用,探究其对大豆蛋白的水解效果。
[0095]
取一定量大豆分离蛋白溶于50mm tris-hcl(ph 8.0)中,使得反应体系终浓度为1%(w/v)。将样品在沸水浴中煮沸5min,确保大豆分离蛋白完全溶解。待冷却至室温后,分别加入0.5mg/ml碱性蛋白酶(酶活力为400,000u/g)和0.5mg/ml blpepn
ex
或blpepn
in
,对照组只添加碱性蛋白酶。反应在最适反应温度45℃下进行,反应时间为6h,间隔1h取样。反应结束后,将样品放入沸水中煮沸5min以终止反应。将反应液于10,000
×
g离心5min,分离上清,用0.22μm水系滤膜处理后,样品进行高效液相色谱(hplc)分析水解液中多肽分布和疏水性氨基酸的含量。
[0096]
不同反应时间大豆蛋白水解液的底物剩余量情况如表6所示。随着反应时间的增加,不论是碱性蛋白酶单独水解,还是碱性蛋白酶和重组氨肽酶共同水解,反应前4h蛋白水解液的底物剩余量明显减少,之后变化波动不大。反应6h后,碱性蛋白酶单独水解的底物剩余量约是双酶协同水解的底物剩余量的4倍。
[0097]
反应6h后,大豆分离蛋白水解液中的游离氨基酸含量如表7所示。碱性蛋白酶单独水解时水解液中的游离氨基酸含量为43.81mg/l,主要释放的氨基酸种类有asp、glu、ala、tyr和leu,其中leu占总氨基酸含量的64.6%。当碱性蛋白酶和重组酶blpepn
ex
或blpepn
in
共同水解时,水解液中的游离氨基酸总量分别为2381.95mg/l和2186.93mg/l,是碱性蛋白酶单独水解的50倍。其中his、arg、cys和leu的增加最为明显,含量均超过200mg/l;疏水性氨基酸(ala、val、met、phe、ile和leu)的含量占游离氨基酸总量的35%。
[0098]
反应6h后,大豆分离蛋白水解液中的多肽分子量分布情况如表8所示。当碱性蛋白酶单独水解时,水解液中多肽分子量主要分布为》2000da(~8%),1000-2000da(~12%),500-1000da(~23%),150-500da(~44%)以及《150da(~13%)。其中,绝大部分多肽集中
在150-1000da范围内,占比为67%。当碱性蛋白酶和重组酶blpepn
ex
或blpepn
in
共同水解时,水解液中的多肽分子量主要分布为》2000da(~6%),1000-2000da(~7%),500-1000da(~13%),150-500da(~30%)以及《150da(~44%)。其中,《500da的多肽占比高达74%。
[0099]
因此,重组氨肽酶blpepn
ex
或blpepn
in
的添加,提高了大豆分离蛋白的水解,将其更高效地水解成种类丰富的游离氨基酸以及较短的多肽(《500da),促进了疏水性氨基酸的释放,增添水解液的风味。
[0100]
表6大豆分离蛋白水解液的底物剩余量
[0101][0102]
表7大豆分离蛋白水解液游离氨基酸含量(mg/l)
[0103][0104]
表8大豆分离蛋白水解液中多肽分子量分布
[0105][0106]
[0107]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1