一种具备B谱系分化潜能的人造血祖细胞的制备方法及其应用与流程
一种具备b谱系分化潜能的人造血祖细胞的制备方法及其应用
技术领域
1.本发明属于免疫学技术领域,尤其涉及一种具备b谱系分化潜能的人造血祖细胞的制备方法及其应用。
背景技术:
2.b细胞是人体体液免疫系统的关键细胞成分,b细胞功能低下或缺陷的患者,比如老年人或者有基础疾病的患者,将会导致体液免疫受损,甚至出现严重的病原体感染。此外,基因工程改造的b细胞(engineering b cells)在临床上的抗感染、抗肿瘤以及疾病治疗领域有非常可观的应用前景。
3.然而,临床上b细胞以及b细胞衍生的丙种球蛋白制剂等药物来源于人体的外周血或者骨髓库,资源有限,制备耗时较长,成本较高。多能干细胞(pluripotent stem cells,pscs)是一类具有无限增殖潜能、多谱系分化潜力、方便进行基因编辑修饰的细胞,是细胞疗法再生医学研究的热点。因此,实现多能干细胞诱导人b细胞种子再生将有望造福众多体液免疫系统异常的患者,极大地推动基因工程改造的b细胞疗法的应用。但是,目前关于多能干细胞诱导人b细胞再生的研究报道非常少,迄今为止没有实质性进展与突破,更没有临床转化的案例。这说明b细胞再生领域还有很高的壁垒需要克服。
4.研究表明,人多能干细胞在体外与基质细胞共培养可以依次诱导出造血祖细胞、b祖细胞以及cd19
+
sigm
+
b细胞(french, anna et al. human induced pluripotent stem cell-derived b lymphocytes express sigm and can be generated via a hemogenic endothelium intermediate. stem cells and development vol. 24,9 (2015): 1082-95.)。但是体外无法诱导产生成熟的b细胞,且体外诱导的方式耗时较长、效率较低。直接从体外诱导出有功能、成熟的人b细胞的技术方法存在很大的困难,因此研究人员开始考虑通过体内移植的方式实现人b细胞再生。
5.目前仅有少量关于体内b细胞再生的研究,主要是通过体外诱导多能干细胞诱产生b祖细胞,再将其移植入动物模型中实现b细胞再生。但是存在以下的问题:第一,b细胞在体内存在的时间很短暂,同时在移植后6~8周后就检测不到分泌的抗体(potocnik, a j et al. reconstitution of b cell subsets in rag deficient mice by transplantation of in vitro differentiated embryonic stem cells. immunology letters vol. 57,1-3 (1997): 131-7);第二,不能获得对适应性体液免疫应答更重要的b2细胞(lin, yang et al. long-term engraftment of esc-derived b-1 progenitor cells supports hsc-independent lymphopoiesis. stem cell reports vol. 12,3 (2019):572-583)。以上研究表明,多能干细胞体外诱导b祖细胞以及b祖细胞移植后进行体内b细胞再生的系统存在一定的缺陷,推测可能缺乏了特定的转录因子导致再生的b淋巴细胞谱系存在一定的缺陷。
6.在前期研究中,发现在内皮生血转化和淋巴细胞生成中发挥重要作用的关键造血
调控转录因子runx1和hoxa9,以及对造血干祖细胞的永生化起着重要作用且高表达于多个pre-b细胞系的lhx2,这三个因子的协同表达可以促进小鼠多能干细胞体外诱导产生b谱系种子细胞,将其移植后可以产生所有类型的成熟b细胞,并可以进行适应性免疫应答(zhang,qi et al. regeneration of immunocompetent b lymphopoiesis from pluripotent stem cells guided by transcription factors. cell mol immunol)。但目前还没有关于在体外诱导人多能干细胞分化产生具备b谱系分化潜能的造血祖细胞(即b谱系种子细胞)、且移植后可实现人b细胞再生的相关报道。
7.因此,如何提供一种高效的诱导人多能干细胞产生人b谱系细胞的方法,已成为亟待解决的问题。
技术实现要素:
8.针对现有技术的不足和实际需求,本发明提供一种具备b谱系分化潜能的人造血祖细胞的制备方法及其应用,在人多能干细胞诱导分化体系的细胞中导入特定转录因子,在转录因子组合作用下,诱导分化产生具备b谱系分化潜能的人造血祖细胞,移植后可以实现人b细胞再生,具有很高的临床应用价值。
9.为达此目的,本发明采用如下技术方案:第一方面,本发明提供一种具备b谱系分化潜能的人造血祖细胞的制备方法,所述制备方法包括:将runx1、hoxa9和lhx2三个转录因子同时或者分别导入人多能干细胞诱导分化体系的细胞,并进行诱导表达与诱导分化,得到所述具备b谱系分化潜能的人造血祖细胞;所述人多能干细胞诱导分化体系的细胞包括人多能干细胞、中胚层细胞、生血内皮细胞或造血祖细胞中的任意一种或至少两种的组合;所述转录因子的导入的方法包括基因过表达、内源基因激活或基因编辑中的任意一种或至少两种的组合;所述诱导分化的方法包括基于基质细胞共培养的单层培养诱导分化或类器官三维培养诱导分化。
10.本发明中,将runx1、hoxa9和lhx2三个转录因子导入人多能干细胞诱导分化体系的细胞,进行诱导表达与诱导分化,获得具备b谱系分化潜能的人造血祖细胞,诱导效率高,诱导效果好;制备得到的具备b谱系分化潜能的人造血祖细胞进一步可以分化为人的b细胞,为b细胞的再生及体液免疫系统的重建创造了条件;制备得到的b细胞还可以分泌相关的治疗性蛋白以及抗体等,可以用于相关细胞制剂的制备中,为b细胞疗法在临床上的应用与转化创造了条件。
11.优选地,所述基因过表达包括dna转染和/或mrna转染。
12.优选地,所述内源基因激活包括rna激活和/或crispr-dcas9。
13.优选地,所述基因编辑包括同源重组、crispr/cas9、talen、zfn、慢病毒感染或逆转录病毒感染中的任意一种或至少两种的组合。
14.本发明中,所述三个转录因子runx1、hoxa9和lhx2可以同时导入人多能干细胞诱导分化体系的细胞,所述人多能干细胞诱导分化体系的细胞包括人多能干细胞、中胚层细胞、生血内皮细胞(hec)或造血祖细胞(hpc)中的任意一种或至少两种的组合。
15.本发明中,所述三个转录因子runx1、hoxa9和lhx2可以分别导入人多能干细胞诱导分化体系的细胞,作为本发明的一个优选技术方案,首先将runx1和hoxa9一起导入,在后续阶段导入lhx2基因。
16.优选地,首先将runx1和hoxa9一起导入人多能干细胞,在后续中胚层细胞或生血内皮细胞(hec)阶段导入lhx2基因,三个转录因子runx1、hoxa9和lhx2共同诱导生成造血祖细胞(hpc),再进行移植。
17.优选地,首先将runx1和hoxa9一起导入人多能干细胞,进行后续中胚层细胞诱导、生血内皮细胞诱导以及造血祖细胞生成,再在造血祖细胞阶段导入lhx2基因,三个转录因子runx1、hoxa9和lhx2共同存在下继续培养一段时间,可选为1~20天,例如可以是1天、5天、10天、15天或20天等,优选4-15天,再进行移植。
18.优选地,首先将runx1和hoxa9一起导入中胚层细胞,进行后续生血内皮细胞诱导以及造血祖细胞生成,再在造血祖细胞中导入lhx2基因,三个转录因子runx1、hoxa9和lhx2共同存在下继续培养一段时间,可选为1-20天,例如可以是1天、5天、10天、15天或20天等,优选4-15天,再进行移植。
19.作为本发明的一个优选技术方案,通过将包含runx1、hoxa9和lhx2三个转录因子的表达载体转染入人多能干细胞,使runx1、hoxa9和lhx2插入至基因组的安全位点,构建三个转录因子表达或共表达的人多能干细胞系;所述表达载体含有runx1、hoxa9或lhx2中的任意一种或至少两种的组合;所述表达载体还包括荧光标记基因、抗性基因和基因表达调控系统。
20.优选地,所述荧光标记基因包括但不限于gfp、yfp、rfp或td tomato等,优选为gfp。
21.优选地,所述抗性基因包括但不局限于嘌呤霉素抗性基因(puror)、潮霉素抗性基因(hygror)或氨苄青霉素抗性基因(ampr)等,优选为puror。
22.优选地,所述基因表达调控系统包括但不局限于四环素诱导表达tet-on系统或类固醇激素诱导的cre-er系统等,优选为四环素衍生物强力霉素(doxycycline,dox)诱导表达tet-on系统。
23.优选地,所述runx1、hoxa9和lhx2三个转录因子同时或分别进行诱导表达,所述诱导表达开始于中胚层细胞、生血内皮细胞或造血祖细胞,优选为于中胚层细胞开始进行表达。
24.对于所述将runx1、hoxa9和lhx2三个转录因子分别导入人多能干细胞诱导分化体系的细胞,可选的首先runx1和hoxa9开始诱导表达,lhx2基因再进行表达。
25.优选的,首先runx1和hoxa9在中胚层细胞开始诱导表达,lhx2基因再在生血内皮细胞或造血祖细胞中进行表达。
26.优选地,所述表达载体转染的方法包括但不局限于电转化法、脂质体转染法或磷酸钙沉淀法等,优选为电转化法。
27.优选地,所述安全位点包括但不局限于aavs1或hipp11等,优选为aavs1位点。
28.优选地,所述人多能干细胞包括人诱导性多能干细胞和/或人胚胎多能干细胞。
29.本发明中,基于crispr/cas9系统结合同源重组,将sgrna和打靶载体电转入hpscs 18~24 h后,加入含有嘌呤霉素(终浓度0.25~1 μm)的hescs培养基进行药物筛选和阳性克
隆富集。药物筛选8~12天后,采用无嘌呤霉素的培养基进行培养扩增和传代。通过流式分选仪ariaii sorp(bd bioscience)分选出多个荧光单细胞进行克隆化培养,最后对每个克隆的细胞进行细胞基因组提取,通过pcr鉴定出阳性克隆。根据细胞状态和生长密度,进行传代、扩增和冻存。
30.作为本发明的一个优选技术方案,所述诱导分化的方法为基于基质细胞共培养的单层培养诱导分化,包括三个诱导阶段:诱导人多能干细胞产生中胚层细胞(d0~d2)、诱导生血内皮细胞分化(d2~d9)和诱导造血祖细胞分化和成熟(d9~d16或d9~d24)。
31.优选地,所述诱导人多能干细胞产生中胚层细胞中使用d0培养基和d1培养基;所述诱导生血内皮细胞分化中使用d2培养基;所述诱导造血祖细胞分化和成熟中使用d9培养基和/或d16培养基。
32.本发明中,在所述诱导造血祖细胞分化和成熟中加入促进b细胞增殖分化的因子rhil-6、rhil-7和胸腺基质淋巴细胞生成素(tslp),可以提高b细胞的再生效率。
33.优选地,所述d0培养基包括人碱性成纤维细胞生长因子(hbfgf)、重组人活化素(rhactivin a)、重组人骨形态发生蛋白(rhbmp4)、gsk-3α/β抑制剂chir99021、pi3k抑制剂ly294002和tesr-e6培养基。
34.优选地,所述d1培养基包括重组人骨形态发生蛋白(rhbmp4)、alk5抑制剂a83-01、wnt通路抑制剂iwr-1-endo和tesr-e6培养基。
35.优选地,所述d2培养基包括维生素c、重组人fms样酪氨酸激酶3配体(rhflt3l)、人碱性成纤维细胞生长因子(hbfgf)、人血管内皮生长因子(hvegf)、重组人干细胞因子(rhscf)、重组人白介素3(rhil-3)、粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)、丁酸钠和stempro-34培养基。
36.优选地,所述d9培养基包括重组人促血小板生成素(rhtpo)、重组人白介素3(rhil-3)、重组人干细胞因子(rhscf)、重组人白介素11(rhil-11)、人胰岛素样生长因子1(higf-1)、人血管内皮生长因子(hvegf)、人碱性成纤维细胞生长因子(hbfgf)、重组人骨形态发生蛋白(rhbmp4)、重组人fms样酪氨酸激酶3配体(rhflt3l)、粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)、强力霉素(dox)和stempro-34培养基。
37.优选地,所述d16培养基包括血清替代物b27、rock抑制剂y-27632、重组人促血小板生成素(rhtpo)、重组人干细胞因子(rhscf)、重组人白介素3(rhil-3)、重组人fms样酪氨酸激酶3配体(rhflt3l)、粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)、强力霉素(dox)和stempro-34培养基。
38.优选地,所述d0培养基包括5~40 ng/ml hbfgf、10~50 ng/ml rhactivin a、10~60 ng/ml rhbmp4、2~10 μm chir99021和5~20 μm ly294002,其中,hbfgf的浓度例如可以是5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、35 ng/ml或40 ng/ml等,rhactivin a的浓度例如可以是10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、35 ng/ml、40 ng/ml、45 ng/ml或50 ng/ml等,rhbmp4的浓度例如可以是10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、35 ng/ml、40 ng/ml、45 ng/ml、50 ng/ml、55 ng/ml或60 ng/ml等,chir99021的浓度例如可以是2 μm、3 μm、4 μm、5 μm、6 μm、7 μm、8 μm、9 μm或10 μm等,ly294002的浓度例如可以是5 μm、10 μm 、15 μm或20 μm等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
39.优选地,所述d1培养基包括10~60 ng/mlrhbmp4、0.5~3 μm a83-01和0.5~5 μm iwr-1-endo,其中rhbmp4的浓度例如可以是10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、35 ng/ml、40 ng/ml、45 ng/ml、50 ng/ml、55 ng/ml或60 ng/ml等,a83-01的浓度例如可以是0.5 μm、1 μm、1.5 μm、2 μm、2.5 μm或3 μm等,iwr-1-endo的浓度例如可以是0.5 μm、1 μm、1.5 μm、2 μm、2.5 μm、3 μm、3.5 μm、4 μm、4.5 μm或5 μm等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
40.优选地,所述d2培养基包括1~3 mm glutamax
tm-i、0.5~3 mm neaa、0.05~0.2 mm β-巯基乙醇、25~75 ng/ml维生素c、10~40 ng/ml rhflt3l、1~10 ng/ml hbfgf、25~75 ng/ml hvegf、25~75 ng/ml rhscf、5~40 ng/ml rhil-3、5~25 ng/ml gm-csf、5~25 ng/ml m-csf、0.1~1 mm丁酸钠和0.5-2 μg/ml dox,其中,glutamax
tm-i的浓度例如可以是1 mm、1.5 mm、2 mm、2.5 mm或3 mm等,neaa的浓度例如可以是0.5 mm、1 mm、1.5 mm、2 mm、2.5 mm或3 mm等,β-巯基乙醇的浓度例如可以是0.05 mm、0.1 mm、0.15 mm或0.2 mm等,维生素c的浓度例如可以是25 ng/ml、30 ng/ml、35 ng/ml、40 ng/ml、45 ng/ml、50 ng/ml、55 ng/ml、60 ng/ml、65 ng/ml、70 ng/ml或75 ng/ml等,rhflt3l的浓度例如可以是10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、35 ng/ml或40 ng/ml等,hbfgf的浓度例如可以是1 ng/ml、2 ng/ml、3 ng/ml、4 ng/ml、5 ng/ml、6 ng/ml、7 ng/ml、8 ng/ml、9 ng/ml或10 ng/ml等,hvegf的浓度例如可以是25 ng/ml、30 ng/ml、35 ng/ml、40 ng/ml、45 ng/ml、50 ng/ml、55 ng/ml、60 ng/ml、65 ng/ml、70 ng/ml或75 ng/ml等,rhscf的浓度例如可以是25 ng/ml、30 ng/ml、35 ng/ml、40 ng/ml、45 ng/ml、50 ng/ml、55 ng/ml、60 ng/ml、65 ng/ml、70 ng/ml或75 ng/ml等,rhil-3的浓度例如可以是5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、35 ng/ml或40 ng/ml等,gm-csf的浓度例如可以是5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml或25 ng/ml等,m-csf的浓度例如可以是5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml或25 ng/ml等,丁酸钠的浓度例如可以是0.1 mm、0.2 mm、0.3 mm、0.4 mm、0.5 mm、0.6 mm、0.7 mm、0.8 mm、0.9 mm或1 mm等,dox的浓度例如可以是0.5 μg/ml、1 μg/ml、1.5 μg/ml或2 μg/ml等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
41.优选地,所述d9培养基包括10~60 ng/ml rhtpo、1~10 ng/ml rhil3、25~75 ng/ml rhscf、2~20 ng/ml rhil-11、10~50 ng/ml higf-1、2~20 ng/ml hvegf、1~20 ng/ml hbfgf、5~25 ng/ml rhbmp4、5~25 ng/ml rhflt3l、5~25 ng/ml gm-csf、5~25 ng/ml m-csf和0.5~2 μg/ml dox,其中,rhtpo的浓度例如可以是10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、35 ng/ml、40 ng/ml、45 ng/ml、50 ng/ml、55 ng/ml或60 ng/ml等,rhil3的浓度例如可以是1 ng/ml、2 ng/ml、3 ng/ml、4 ng/ml、5 ng/ml、6 ng/ml、7 ng/ml、8 ng/ml、9 ng/ml或10 ng/ml等,rhscf的浓度例如可以是25 ng/ml、30 ng/ml、35 ng/ml、40 ng/ml、45 ng/ml、50 ng/ml、55 ng/ml、60 ng/ml、65 ng/ml、70 ng/ml或75 ng/ml等,rhil-11的浓度例如可以是2 ng/ml、4 ng/ml、6 ng/ml、8 ng/ml、10 ng/ml、12 ng/ml、14 ng/ml、16 ng/ml、18 ng/ml或20 ng/ml等,higf-1的浓度例如可以是10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、35 ng/ml、40 ng/ml、45 ng/ml或50 ng/ml等,hvegf的浓度例如可以是2 ng/ml、4 ng/ml、6 ng/ml、8 ng/ml、10 ng/ml、12 ng/ml、14 ng/ml、16 ng/ml、18 ng/ml或20 ng/ml等,hbfgf的浓度例如可以是1 ng/ml、2 ng/ml、4 ng/ml、6 ng/ml、8 ng/ml、10 ng/ml、12 ng/ml、14 ng/ml、16 ng/ml、18 ng/ml或20 ng/ml等,rhbmp4的浓度例如可以
是5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml或25 ng/ml等,rhflt3l的浓度例如可以是5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml或25 ng/ml等,gm-csf的浓度例如可以是5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml或25 ng/ml等,m-csf的浓度例如可以是5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml或25 ng/ml等,dox的浓度例如可以是0.5 μg/ml、1 μg/ml、1.5 μg/ml或2 μg/ml等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
42.优选的,所述d16培养基包括2%~10%血清替代物b27、5~20 μm y-27632、10~50 ng/ml rhtpo、20~70 ng/ml rhscf、5~20 ng/ml rhil-3、1~10 ng/ml rhflt3l、5~25 ng/ml gm-csf、5~25 ng/ml m-csf和0.5~2 μg/ml dox,其中,b27的体积分数例如可以是2%、3%、4%、5%、6%、7%、8%、9%或10%等,y-27632的浓度例如可以是5 μm、10 μm、15 μm或20 μm等,rhtpo的浓度例如可以是10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、35 ng/ml、40 ng/ml、45 ng/ml或50 ng/ml等,rhscf的浓度例如可以是20 ng/ml、30 ng/ml、40 ng/ml、50 ng/ml、60 ng/ml或70 ng/ml等,rhil-3的浓度例如可以是5 ng/ml、10 ng/ml、15 ng/ml或20 ng/ml等,rhflt3l的浓度例如可以是1 ng/ml、2 ng/ml、3 ng/ml、4 ng/ml、5 ng/ml、6 ng/ml、7 ng/ml、8 ng/ml、9 ng/ml或10 ng/ml等,gm-csf的浓度例如可以是5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml或25 ng/ml等,m-csf的浓度例如可以是5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml或25 ng/ml等,dox的浓度例如可以是0.5 μg/ml、1 μg/ml、1.5 μg/ml或2 μg/ml等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
43.作为优选技术方案,上述培养基的组分如下:所述d0培养基为15 ng/ml人碱性成纤维细胞生长因子、20 ng/ml重组人活化素、30 ng/ml重组人骨形态发生蛋白、4 μm gsk-3α/β抑制剂chir99021和6 μm pi3k抑制剂ly294002,余量为tesr-e6培养基。
44.所述d1培养基为20 ng/ml重组人骨形态发生蛋白、0.5 μm alk5抑制剂a83-01和1 μm wnt通路抑制剂iwr-1-endo,余量为tesr-e6培养基。
45.所述d2培养基为2 mm glutamax
tm-i、1 mm neaa、0.1 mm β-巯基乙醇、50 ng/ml维生素c、10 ng/ml重组人fms样酪氨酸激酶3配体、2 ng/ml人碱性成纤维细胞生长因子、40 ng/ml人血管内皮生长因子、40 ng/ml重组人干细胞因子、10 ng/ml重组人白介素3、5 ng/ml粒细胞-巨噬细胞集落刺激因子、10 ng/ml巨噬细胞集落刺激因子、0.15 mm丁酸钠和1 μg/ml强力霉素,余量为stempro-34培养基。
46.所述d9培养基为20 ng/ml重组人促血小板生成素、5 ng/ml重组人白介素3、40 ng/ml重组人干细胞因子、2 ng/ml重组人白介素11、20 ng/ml人胰岛素样生长因子1、2.5 ng/ml人血管内皮生长因子、2.5 ng/ml人碱性成纤维细胞生长因子、5 ng/ml重组人骨形态发生蛋白、5 ng/ml重组人fms样酪氨酸激酶3配体、5 ng/ml粒细胞-巨噬细胞集落刺激因子、10 ng/ml巨噬细胞集落刺激因子和1 μg/ml强力霉素,余量为stempro-34培养基。
47.所述d16的培养基为2%血清替代物b27、5 μm rock抑制剂y-27632、20 ng/ml重组人促血小板生成素、40 ng/ml重组人干细胞因子、5 ng/ml重组人白介素3、2.5 ng/ml重组人fms样酪氨酸激酶3配体、5 ng/ml粒细胞-巨噬细胞集落刺激因子、10 ng/ml巨噬细胞集落刺激因子和1 μg/ml强力霉素,余量为stempro-34培养基。
48.作为优选技术方案,本发明所述具备b谱系分化潜能的人造血祖细胞的制备方法,包括以下步骤:
通过基因编辑技术将含有runx1、hoxa9和lhx2三个转录因子的表达载体导入人多能干细胞基因组的安全位点;筛选阳性克隆后,再基于基质细胞共培养的单层培养诱导分化方法进行三个阶段的诱导分化,得到所述具备b谱系分化潜能的人造血祖细胞,其中,第一阶段为诱导人多能干细胞产生中胚层细胞(d0至d2):使用d0培养基和d1培养基进行培养,d0和d1细胞换液时使用dpbs清洗2次;第二阶段为诱导生血内皮细胞(haemogenic endothelium cell,hec)分化(d2至d9):使用d2培养基进行培养;d2时,使用消化液将诱导的中胚层细胞消化成单细胞,其中所述消化液包含但不局限于accutase酶、0.5 mm edta或0.05%胰酶中的任意一种或至少两种的组合,优选为accutase酶和0.5 mm edta的等体积混合液;培养过程中每天或每两天进行补液,d9时,使用消化液消化诱导的hec,hec可以选择直接铺至新的培养皿中进行后续的hpc诱导培养;也可以选择铺至提前铺好基质细胞的培养皿中进行共培养来诱导后续的hpc,优选为与基质细胞共培养的方式来诱导hpc;所用消化液可包含但不局限于trypletm express、0.05%胰酶、accutase酶等,优选为trypletm express(thermo fisher scientific),所用基质细胞可包含但不局限于op9、op9-dl1、op9-dl4、op9-dl1-apln、op9-dl4-apln、改造后的op9细胞、aft024、aft024-dl1、aft024-lhx2或改造后的aft024细胞中的任意一种或至少两种的组合,优选为op9-dl1;第三阶段为诱导造血祖细胞(hpc)分化和成熟(d9~d16或d9~d24):其中,选择d9~d16方式的步骤为:使用d9培养基培养至d16;培养过程中每天或每两天进行补液。d13~d16时,转移上清,贴壁细胞用消化液消化2~3 min,通过流式分选仪分析诱导的hpc表型并分选cd34
+
hpc。染色方案包括但不限于:gfp、cd45-apc/cy7、lineage(cd3/4/8/14/19/20)-biotin-percp/cy5.5、cd11b-pe/cy7、cd201-apc、cd34-pe和dapi,使用flowjo软件对数据进行分析;所述消化液可包含但不局限于0.25%胰酶和trypletm express等;其中,选择d9~d24方式时,还包括使用d16培养基共培养至d24的步骤:d16分选得到的cd34
+
hpc与提前辐照处理的基质细胞共培养,进行扩增并维持干性,所用基质细胞可包含但不局限于op9、op9-dl1、op9-dl4、op9-dl1-apln、op9-dl4-apln、改造后的op9细胞、aft024、aft024-dl1、aft024-lhx2或改造后的aft024细胞中的任意一种或至少两种的组合。
49.第二方面,本发明提供一种具备b谱系分化潜能的人造血祖细胞,所述具备b谱系分化潜能的人造血祖细胞通过第一方面所述的具备b谱系分化潜能的人造血祖细胞的制备方法制备得到;所述具备b谱系分化潜能的人造血祖细胞移植后实现人b细胞再生。
50.优选地,所述具备b谱系分化潜能的人造血祖细胞分化的b细胞类型包括且不限于b祖细胞(b progenitor cells)、非成熟b细胞(immature b cells)、成熟b细胞(mature b cells)或浆细胞中的任意一种或至少两种的组合。
51.优选地,所述b祖细胞(b progenitor cells)包括且不限于pro-b细胞和/或pre-b细胞。
52.优选地,所述成熟b细胞包括且不限于b1细胞和/或b2细胞。
53.优选地,所述b1细胞包括且不限于b1a和/或b1b细胞。
54.优选地,所述b2细胞包括且不限于滤泡b细胞(follicular b,fo b)和/或边缘区b细胞(marginal zone,mz b)。
55.第三方面,本发明提供一种细胞产物,所述细胞产物包括第一方面中所述的人多能干细胞诱导分化体系的细胞及其经基因工程改造后的细胞、第二方面所述的具备b谱系分化潜能的人造血祖细胞及其经基因工程改造后的细胞、第二方面所述的具备b谱系分化潜能的人造血祖细胞分化形成的b细胞及其经基因工程改造后的细胞或第二方面所述的具备b谱系分化潜能的人造血祖细胞分化形成的b细胞及其经基因工程改造后的细胞的分泌产物。
56.优选地,所述人多能干细胞诱导分化体系的细胞包括人多能干细胞、中胚层细胞、生血内皮细胞或造血祖细胞中的任意一种或至少两种的组合。
57.优选地,所述经基因工程改造后的细胞包括通过基因工程技术构建的表达目标蛋白、目标细胞因子、目标抗体或嵌合抗原受体的细胞中的任意一种或至少两种的组合。
58.优选地,所述b细胞及其经基因工程改造后的细胞的分泌产物包括抗体、细胞因子或蛋白中的任意一种或至少两种的组合。
59.第四方面,本发明提供一种体内b淋巴细胞谱系再生的方法,所述体内b淋巴细胞谱系再生的方法包括:将第二方面所述的具备b谱系分化潜能的人造血祖细胞移植到体内。
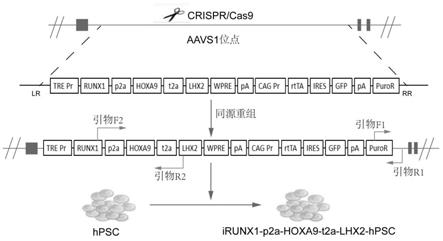
60.优选地,所述体内b淋巴细胞谱系再生的方法还包括对移植后体内的人造血细胞进行检测的步骤。
61.本发明中,诱导分化产生的hpc可作为b谱系种子细胞,直接或分选cd34
+
细胞后移植给经过亚致死辐照处理的免疫缺陷小鼠中(剂量为0.5~5 million/只),进行体内b淋巴细胞谱系再生。移植方法包含且不局限于内眦静脉注射、骨髓腔注射或尾静脉注射中的任意一种,优选为内眦静脉注射。
62.移植6周后,取受体鼠外周血、骨髓、脾脏和淋巴结,通过流式细胞仪lsr fortessa(bd bioscience)分析hpscs来源的血液细胞比例以及cd19
+
b细胞比例,以证实hpscs诱导分化的人造血祖细胞可以实现体内b淋巴细胞谱系重建。
63.从受体鼠骨髓、淋巴结和脾脏中分选gfp
+
hcd45
+
细胞,使用细胞基因组提取试剂盒(天根)提取基因组,利用敲入基因序列的特异性引物进行pcr鉴定,并将pcr扩增得到的序列进行测序,从基因组水平上确认受体小鼠中的gfp
+
hcd45
+
造血细胞(主要是b细胞)来源于移植的人造血祖细胞。
64.同时,移植4~8周后,通过elisa检测未免疫受体鼠血清中免疫球蛋白的种类含量,以验证hpscs来源的b细胞的抗体分泌功能。
65.最后,用特定抗原免疫受体鼠后,检测受体鼠体内是否产生特异性抗体,以证实hpscs来源的b细胞能够产生特异性抗体,具有分泌特异性抗体的功能。初次抗原刺激一段时间后,再次使用抗原刺激,通过流式检测是否产生浆细胞和记忆性b细胞,以证明hpscs来
源的b细胞可以有效地参与适应性免疫应答。
66.本发明中,在hpc移植时,给受体鼠注射促进b细胞发育的因子,如rhil-6、rhil-7和胸腺基质淋巴细胞生成素(tslp)等,可以提高hpc移植的成功率。
67.第五方面,本发明提供第一方面所述的具备b谱系分化潜能的人造血祖细胞的制备方法、第二方面所述的具备b谱系分化潜能的人造血祖细胞或第三方面所述的细胞产物中的任意一种或至少两种的组合在制备药物组合物中的应用。
68.第六方面,本发明提供一种药物组合物,所述药物组合物含有第二方面所述的具备b谱系分化潜能的人造血祖细胞和/或第三方面所述的细胞产物。
69.优选地,所述药物组合物还包括药学上可接受的辅料。
70.优选地,所述药学上可接受的辅料包括载体、赋形剂或稀释剂中的任意一种或至少两种的组合。
71.第七方面,本发明提供第六方面所述的药物组合物在制备疾病预防药物、疾病治疗药物或疫苗中的应用。
72.优选地,所述疾病预防药物包括提高机体免疫响应的药物。
73.优选地,所述免疫响应包括体液免疫和/或细胞免疫。
74.优选地,所述疾病治疗药物包括b细胞免疫缺陷治疗药物、抗病原体感染药物、抗肿瘤药物、自身免疫病治疗药物或遗传性疾病治疗药物中的任意一种或至少两种的组合。
75.优选地,所述遗传性疾病包括血友病、溶酶体贮积症、低磷酸酯酶症或苯丙酮尿症中的任意一种或至少两种的组合。
76.优选地,所述药物包括抗体药物。
77.本发明中,所述药物组合物还可以作为细胞载体分泌和/或输送治疗性药物,用来治疗相关疾病,或作为蛋白质或酶的替代疗法。
78.相比于现有技术,本发明具有如下有益效果:(1)本发明通过向人多能干细胞诱导分化体系的细胞中导入runx1、hoxa9和lhx2三个转录因子,经过诱导表达及诱导分化,获得了具备b谱系分化潜能的人造血祖细胞;通过对诱导过程以及培养基配方进行优化,显著提高了细胞的诱导效率,获得的人造血祖细胞数量多,活性高;(2)本发明制备得到的人造血祖细胞在移植后可以在动物模型中再生人的b细胞,所述b细胞可以在体内成熟并且分泌相应的抗体,实现了人源化动物的体液免疫系统的再生,最终以望在人体内实现b细胞的再生,并将推动b细胞疗法在临床上的应用与转化;(3)本发明中再生的b细胞经过基因工程改造后可以分泌大量的目标抗体、目标细胞因子及功能性蛋白等细胞产物,可应用于相关药物的制备中,具有极高的应用价值。
附图说明
79.图1a为实施例1中敲入的可诱导表达序列的结构示意图;图1b为实施例1中引物f2/r2的扩增产物的电泳结果图片,图中,泳道m:标准dna分子量marker,泳道1:阴性对照,泳道2~4:3个阳性克隆的扩增产物;图1c为实施例1中引物f1/r1的扩增产物的电泳结果图片,图中,泳道m:标准dna分子量marker,泳道1:阴性对照,泳道2~4:3个阳性克隆的扩增产物;
图2a为实施例2中人多能干细胞诱导分化产生造血祖细胞的流程示意图;图2b为实施例2中诱导人多能干细胞产生中胚层细胞过程中细胞的明场图(比例尺=200 μm);图2c为实施例2中hpc的流式分选的结果图片;图3为实施例3中移植cd34
+
细胞的受体鼠外周血的流式分析结果图片;图4a为实施例4中敲入的可诱导表达序列的结构示意图;图4b为实施例4中hpc的流式分选的结果图片;图5a为实施例5中慢病毒表达质粒prrlsin-lhx2-egfp的质粒图谱;图5b为实施例5中病毒感染及共培养的流程示意图;图5c为实施例5中感染效率的流式检测结果图片;图5d为实施例5中移植人hpc的受体鼠外周血的流式分析结果图片,图中,#1、#2:两只移植受体鼠。
具体实施方式
80.为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
81.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
82.实施例1 诱导性表达外源runx1、hoxa9和lhx2基因的人多能干细胞的制备本实施例基于crispr/cas9系统,通过电转化法在人多能干细胞(human pluripotent stem cells,hpsc)的aavs1位点定点敲入可诱导表达序列,敲入序列包含runx1-p2a-hoxa9-t2a-lhx2串联序列、荧光蛋白基因gfp和抗性筛选的嘌呤霉素抗性基因序列,结构示意图如图1a所示。
83.将sgrna和打靶载体电转入hpsc,20 h后,加入含有嘌呤霉素(1 μm)的hpsc培养基,每天更换培养基。其中,所用sgrna对应的靶向序列如seq id no.1所示。
84.seq id no.1:5
’‑
gtcaccaatcctgtccctagtgg-3’(haavs1-sgrna)。
85.使用嘌呤霉素筛选10天后,采用无嘌呤霉素的培养基进行培养、扩增和传代。通过流式分选仪分选多个gfp
+
单细胞于96孔板中进行培养,单细胞形成克隆后,采用0.5 mm edta消化克隆,传代至12孔板进行扩增培养。
86.最后从每个克隆中收取相应的细胞,提取细胞基因组(天根细胞基因提取试剂盒),设计pcr引物,通过pcr鉴定出阳性克隆,pcr引物与位点的对应关系见图1a,序列如下:引物f1(seq id no.2):5
’‑
aggcccgttccaagcca-3’;引物r1(seq id no.3):5
’‑
agatgcccaggtggcag-3’;引物f2(seq id no.4):5
’‑
gtagcgtgggcatggatcc-3’;引物r2(seq id no.5):5
’‑
ctaagaacttgggaacagccacagc-3’。
87.其中,f1/r1扩增产物的大小为1541 bp,f2/r2扩增产物的大小为2560 bp。
88.扩增产物的电泳结果如图1b与图1c所示。最终得到3个阳性克隆,根据细胞状态和
生长密度,进行传代、扩增和冻存。
89.实施例2 runx1、hoxa9和lhx2三基因修饰人多能干细胞诱导分化产生造血祖细胞人多能干细胞诱导分化产生造血祖细胞(hpc)的流程示意图如图2a所示。
90.采用基于基质细胞共培养的单层培养诱导分化体系,诱导分化过程分为三个阶段:(1)第一阶段为诱导人多能干细胞产生中胚层细胞(d0至d2),图2b所示为诱导中胚层细胞过程中细胞的明场图:分别使用d0培养基和d1培养基进行培养;d0培养基配方为:15 ng/ml hbfgf(peprotech)、20 ng/ml rhactivin a(peprotech)、30 ng/ml rhbmp4(r&d)、4 μm chir99021(selleck)和6 μm ly294002(selleck),余量为tesr-e6基础培养基(stemcell technologies);d1培养基配方为:20 ng/ml rhbmp4、0.5 μm a83-01(selleck)和1 μm iwr-1-endo(selleck),余量为tesr-e6基础培养基;d2时,使用消化液(accutase酶《sigma-aldrich》和0.5 mm edta《gibco》的等体积混合液)将诱导的中胚层细胞消化成单细胞。
91.(2)第二阶段为诱导生血内皮细胞(hemogenic endothelium,hec)分化(d2至d9):使用d2培养基进行培养;d2培养基配方为:2 mm glutamaxtm-i(thermo fisher scientific)、1 mm neaa(thermo fisher scientific)、0.1 mm β-巯基乙醇(sigma-aldrich)、50 ng/ml维生素c(sigma-aldrich)、10 ng/ml rhflt3l(peprotech)、2 ng/ml hbfgf(peprotech)、40 ng/mlhvegf(peprotech)、40 ng/mlrhscf(peprotech)、10 ng/ml rhil-3(peprotech)、5 ng/mlgm-csf(peprotech)、10 ng/mlm-csf(peprotech)、0.15 mm nab(selleck)和1 μg/ml强力霉素(上海蓝木化工),余量为stempro-34培养基;培养过程中每1~2天进行补液,d9时,使用消化液tryple
tm express(thermo fisher scientific)消化诱导的hec重新铺至提前铺好基质细胞op9-dl1的培养皿中,进行共培养。
92.(3)第三阶段为诱导造血祖细胞分化和成熟(d9-d16):使用d9培养基进行共培养;d9培养基配方为:20 ng/ml rhtpo、5ng/ml rhil3、40 ng/ml rhscf、2 ng/ml rhil-11、20 ng/ml higf-1、2.5 ng/ml hvegf、2.5 ng/ml hbfgf、5 ng/ml rhbmp4、5 ng/ml rhflt3l、10 ng/ml gm-csf、10 ng/ml m-csf和1 μg/ml dox,余量为stempro-34培养基;培养过程中每1~2天进行补液。d16时,转移上清后,使用0.25%胰酶(thermo fisher scientific)消化贴壁细胞,通过流式分选仪分析hpc的表型(如图2c所示)并分选cd34
+
细胞。染色方案如下:gfp、cd45-apc/cy7、lineage(cd3/4/8/14/19/20)-biotin-percp/cy5.5、cd11b-pe/cy7、cd201-apc、cd34-pe和dapi(上述抗体均购自biolegend),使用flowjo软件对数据进行分析。
93.实施例3 irunx1-p2a-hoxa9-t2a-lhx2-hpsc来源的造血祖细胞(b谱系种子细胞)移植入免疫缺陷鼠并检测b细胞的再生
将d16分选获得cd34
+
细胞通过内眦静脉注射的方式移植到亚致死辐照(2~3 gy)的免疫缺陷ncg小鼠(集萃药康)中,剂量为1 million/只。
94.在移植6周、8周和10周时,通过尾静脉采血的方式获取受体鼠外周血进行流式分析,染色方案如下:gfp、mter119-percp/cy5.5、hcd45-pe/cy7、hcd19-bv785、hcd33-pe、hcd3/4/8-apc和dapi(上述抗体均购自biolegend)。使用flowjo软件对数据进行分析。
95.结果如图3所示,由图可知,irunx1-p2a-hoxa9-t2a-lhx2-hpc可以作为b谱系种子细胞在受体鼠体内再生cd19
+
b细胞。
96.实施例4 制备诱导性表达外源runx1和hoxa9基因的人多能干细胞并诱导分化产生造血祖细胞本实施例基于crispr/cas9系统,通过电转化法在hpsc的aavs1位点定点敲入可诱导表达序列,敲入序列包含runx1-p2a-hoxa9串联序列、荧光蛋白基因gfp和抗性筛选的嘌呤霉素抗性基因序列,结构示意图如图4a所示。
97.采用实施例1中同样的方法敲入表达序列,进行药物筛选以及基因组pcr鉴定阳性克隆,最终得到2个阳性克隆。
98.采用实施例2中同样的方法诱导表达外源runx1c和hoxa9基因的hpsc分化产生hpc。
99.在诱导分化d16时,通过流式分析hpc的表型,染色方案如下:gfp、hcd45-apc/cy7、cd43-pe/cy7、cd34-pe和dapi,使用flowjo软件对数据进行分析。
100.结果如图4b所示,runx1-p2a-hoxa9-hpsc可以诱导分化产生cd34
+
造血祖细胞。
101.实施例5 runx1-p2a-hoxa9-hpsc诱导来源的cd34
+
造血祖细胞感染lhx2病毒制备造血祖细胞,并将其移植入免疫缺陷鼠体内后检测b细胞的再生本实施例构建了表达lhx2基因的慢病毒表达质粒prrlsin-lhx2-egfp与慢病毒包装质粒pspax2和pmd2.g,或vsvg、plp1和plp2(addgene)在pei的作用下转染293t细胞(atcc),进行病毒包被。其中,prrlsin-lhx2-egfp质粒图谱如图5a所示。
102.在转染48 h和72 h时收集病毒液,通过超速离心(50000 g,2 h)浓缩病毒,将浓缩病毒液梯度稀释感染jarkat细胞(暨南大学)测定病毒滴度,感染48 h后流式检测感染效率(即gfp
+
细胞比例),根据gfp
+
比例计算病毒滴度。
103.d16时,换成d16培养基,培养分选获得runx1-p2a-hoxa9-hpsc来源的cd34
+
造血祖细胞,进行后续病毒感染及共培养,流程示意图如图5b所示。将浓缩的lhx2病毒感染上述诱导的d16 hpc,病毒感染复数moi为20.0。病毒感染12~24 h后,使用dpbs洗去病毒,与经过辐照处理(总量为10~20 gy,1 gy/min)的基质细胞aft024-lhx2(aft024细胞来源于atcc,通过基因打靶构建aft024-lhx2)在33℃低温培养箱中共培养1周左右并维持干性。
104.d16的培养基配方为:2%血清替代物b27(gibco)、5 μm rock抑制剂y-27632、20 ng/ml rhtpo、40 ng/ml rhscf、5 ng/ml rhil-3、2.5 ng/ml rhflt3l、5 ng/ml gm-csf、10 ng/ml m-csf和1 μg/ml dox,余量为stempro-34培养基。
105.病毒感染48 h后,取少量细胞流式检测感染效率,未感染的hpc作为空白对照,感染效率流式检测结果如图5c所示,结果显示lhx2病毒感染hpc的效率在90%以上。
106.共培养1周后得到的人造血祖细胞通过眼静脉注射的方式移植到亚致死辐照(2~3 gy)的免疫缺陷ncg小鼠中,剂量为0.7 million/只。
107.在移植6周时,通过尾静脉采血的方式获取受体鼠外周血进行流式分析,染色方案如下:gfp、mter119-percp/cy5.5、hcd45-pe/cy7、hcd19-bv785、hcd33-pe、hcd3/4/8-apc和dapi。使用flowjo软件对数据进行分析。
108.结果如图5d所示,图片表明lhx2病毒感染的irunx1c-p2a-hoxa9-hpc可以作为b谱系种子细胞在受体鼠体内再生b细胞。
109.综上所述,本发明通过将runx1、hoxa9和lhx2三个因子转入人多能干细胞中,制备得到具备b谱系分化潜能的人造血祖细胞;通过对诱导及分化的条件进行优化,提高了诱导的效率以及诱导后的人造血祖细胞的活性;所述人造血祖细胞具有b谱系分化潜能,可以在移植后检测到cd19
+
b细胞,从而实现体内b淋巴细胞的谱系重建,为相关的治疗提供了理论基础;诱导分化中衍生的细胞以及人造血祖细胞最终分化形成的b细胞具备分泌包括细胞因子以及功能蛋白在内的多种细胞产物的能力,可应用于多种药物的制备,具有实际临床应用的价值。
110.申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1