DNA甲基化标志物组合及应用、卵巢癌早期检测引物探针及试剂盒的制作方法
dna甲基化标志物组合及应用、卵巢癌早期检测引物探针及试剂盒
技术领域
1.本发明涉及基因检测技术领域,具体涉及一组dna甲基化标志物组合和应用,以及针对标志物所设计的卵巢癌早期检测引物探针和试剂盒。
背景技术:
2.在我国,卵巢癌发病率居妇科恶性肿瘤第三位,约占所有女性生殖道肿瘤的23%,呈逐年上升的趋势。我国每年死于卵巢癌的女性约为2.5万,居妇科恶性肿瘤之首。由于卵巢深居盆腔,体积小,缺乏典型症状,难以早期发现,确诊时60%-70%已属晚期,其5年生存率20%-30%,卵巢癌患者手术中发现肿瘤局限于卵巢的不足30%,大多数已扩散到盆腹腔器官。而i期卵巢癌5年生存率可高达90%,但是早期诊断非常困难。
3.目前,监测卵巢癌的治疗和复发主要有经阴道超声(tvus)、ca125血液测试、ct(学名contrast-enhanced computed tomography)、磁共振成像(mri)、组织病理学检查等。tvus利用超声波回声传输影像学图像,可以帮助识别卵巢潜在的增生,并确定它们是实体增生还是囊肿(囊肿是非癌变的、充满液体的囊)。如果发现了坚实的肿块,医生可能会要求进行活检,以确定肿块的良恶性。b超快捷、经济、无创、可重复,是首选检查方法。但较小的卵巢肿块的形态、内部结构以及与周围组织的关系往往显示不清,不易测出直径《1cm的实性肿瘤。
4.ca125血液测试是测量血液中ca125蛋白的含量。许多卵巢癌患者会出现血液中ca125水平升高的现象。并非每位卵巢癌患者的血液中ca125水平都有所升高。根据卵巢癌研究基金联盟(ocrfa)的数据,大约80%的晚期卵巢癌患者ca125水平较高,而50%的患者在发病初期ca125水平较高。另外,其他一些疾病如:盆腔炎和子宫内膜异位症患者也会出现血液中ca125水平升高的现象。
5.ct扫描通过特殊x射线对腹部进行扫描。计算机对结果进行处理,生成横断面图像,使医生能够看到腹腔和骨盆的各个部分。ct检查可对盆腔肿瘤进行定位和定性,并可了解肝、肺及腹膜后淋巴结有无转移,盆腔淋巴结造影可判断卵巢肿瘤有无淋巴道转移。但卵巢原发性肿瘤和转移瘤在ct上的表现无显著差异。诊断卵巢癌时,无论有无原发性病灶,均应与转移瘤鉴别,进行全面细致的排查。
6.mri软组织分辨率高,能够多平面成像,无创。在观察子宫内膜病变侵犯肌层的深度、宫颈肿瘤与膀胱或直肠的界限方面非常占优势,在卵巢癌盆腔病变的诊断和鉴别诊断中具有重要作用。但mri的成本也较ct高,有宫内节育器的患者,也要取出后才能做mri。
7.经腹或后穹窿穿刺抽取腹水进行细胞学检查,有助于卵巢恶性肿瘤诊断。活检结果是卵巢癌最终诊断的一个重要因素。对于最后的组织病理学虽然是金标准,但是那时候的卵巢癌大部分已是中晚期,达不到早期诊断的目的。
8.非侵入性且成本低是癌症早期筛查的理想特征。然而,对于卵巢癌,目前在临床上还没有有效的早期筛查方法。dna甲基化是表观遗传学的一种修饰方式,研究报告,dna甲基
化能影响正常哺乳细胞的基因表达和沉默;同时,在人类肿瘤研究中发现,dna甲基化通常能导致肿瘤抑制基因启动子区域的cpg岛变化。肿瘤抑制基因启动子区域的高甲基化或者低甲基化都可能导致细胞转化,而使dna甲基化状态成为肿瘤检测的潜在标志物。
9.dna甲基化主要发生在基因的启动子区域,通常与抑癌基因的表达失活紧密相关。目前应用于基因甲基化检测的方法主要有:甲基化特异性pcr(methylation-specific pcr,msp)、亚硫酸氢盐测序法(bisμlfite sequencing pcr,bsp)和高分辨率熔解曲线法(high resolution melting,hrm)等。甲基化特异性pcr主要依靠引物与目标模板的结合以进行pcr扩增来检测甲基化位点;亚硫酸氢盐测序法依靠测序引物进行pcr扩增,在此基础上进行后续测序以实现对甲基化位点的检测;高分辨率溶解曲线法主要通过样本中的cg含量的变化导致的溶解温度的变化以此对甲基化与非甲基化情况进行区分。每种方法都有各自的特点,bsp法结果准确性较高,易于直观进行判读,但灵敏度较低,操作相对更为繁琐且成本高;hrm法灵敏度相对较低,同时结果分析略复杂;pcr法检测灵敏度高,对样本的要求相对较低,同时检测时长较短、成本较低,结果易于判读。
10.随着对肿瘤研究的深入,逐渐发现在癌症的诊断和治疗过程中组织活检技术有一定的局限性。主要表现为:肿瘤具有异质性;某些患者因各种原因很难获取组织;接受穿刺活检时,也有加速肿瘤转移的风险;组织活检的滞后性对患者的治疗也是不利的。因此对于癌症的诊断和检测技术有更高的要求。
11.液体活检技术的出现,解决了上述的问题,也提前了癌症的诊断时间。液体活检是一种技术,更是一种临床解决方案。液体活检的优势就在于能通过非侵入性取样降低组织活检的危害,而且有效延长患者生存期,性价比高。相对组织较易获得,且对患者无创。但血浆中游离dna的量较少,且易发生降解。因此,检测血浆中基因的甲基化难度相对较大,不仅样本的前处理过程极其重要,包括血浆的收集和bis-dna回收率及完整性,同样要求后续的pcr扩增检测体系的高灵敏性。因此,对于此类检测试剂盒的开发需要具备两个方面的要求:样本前处理的稳定型以及pcr扩增检测体系的准确性。目前的检测产品还无法满足这些要求。
技术实现要素:
12.本发明的目的在于针对现有技术中的上述不足,提供一组dna甲基化标志物组合及应用、卵巢癌早期检测引物及试剂盒本。具有检测准确性高的特点,可为卵巢癌的临床诊断提供可靠参考依据,检测引物和试剂盒能够以血浆作为检测样本,不会对患者造成损伤,更易于被患者接受。
13.本发明技术方案详述如下:
14.第一方面,本发明提供了一组dna甲基化标志物组合,包括以下pcdhb18p、cdo1、hoxa9和lypd5四种基因每种任意至少一段甲基化片段:
15.pcdhb18p基因:
16.chr5:141235136-141235232:seq id no:1,
17.chr5:141235796-141235918:seq id no:2,
18.chr5:141235982-141236064:seq id no:3;
19.cdo1基因:
20.chr5:115816656-115816755:seq id no:4,
21.chr5:115816502-115816579:seq id no:5,
22.chr5:115816382-115816460:seq id no:6;
23.hoxa9基因:
24.chr7:27166431-27166523:seq id no:7,
25.chr7:27166020-27166126:seq id no:8,
26.chr7:27165835-27165919:seq id no:9;
27.lypd5基因:
28.chr19:43820817-43820923、seq id no:10,
29.chr19:43820625-43820694、seq id no:11,
30.chr19:43820271-43820377:seq id no:12。
31.通过对卵巢癌相关基因种类,以及每个基因甲基化区域进行联合筛选,最终筛选出上述四个目标基因(或称为靶基因、标志物基因),及其对应的功能最优甲基化区域,能够通过各目标基因甲基化区域的甲基化结果的互补性确定判读界值,各甲基化区域结果相互结合作为标志物用于卵巢癌的早期检测时,结果具有高阳性预测值,准确性高,能够给临床医生提供辅助诊断参考。
32.可选或优选的,上述标志物组合,由以下甲基化片段组成:
33.pcdhb18p基因:chr5:141235796-141235918:seq id no:2;
34.cdo1基因:chr5:115816656-115816755:seq id no:4;
35.hoxa9基因:chr7:27165835-27165919:seq id no:9;
36.lypd5基因:chr19:43820625-43820694:seq id no:11。
37.第二方面,本发明提供了上述标志物组合在制备卵巢癌早期筛查诊断试剂中的应用。
38.第三方面本发明提供了一组卵巢癌早期筛查诊断用检测引物组,包括对应检测上述标志物组合中甲基化片段的甲基化状态的目标基因检测引物,所述目标基因检测引物的核苷酸序列5’端带有5-10bp长度且与3’端互补配对但不与3’端的末端的cg碱基进行配对的序列;所述目标基因检测引物的核苷酸序列的tm值高于pcr反应体系退火温度2~4℃。
39.所述目标基因检测引物的核苷酸序列采用卡环式设计结构,一是因发卡结构的tm值高于退火温度,在退火的过程中优先保持自身形成卡环结构而不与其他的引物形成双链,因此引物二聚体不会形成,确保不同的目标基因检测引物之间的扩增不会产生干扰,对于多重引物的扩增来说优势明显。二是具有高特异性,因检测引物与目标基因的甲基化区域核苷酸序列结合自由能δg大于引物自身形成的发卡自由能δg 5-10kcal mol-1
,因此当检测引物3’端存在不匹配碱基时,包含卡环式结构的检测引物几乎很难与非甲基化的序列进行结合,保持引物扩增具有更好的特异性。
40.可选或优选的,上述检测引物组中,所述目标基因检测引物的核苷酸序列带有锁核酸修饰碱基。
41.采用锁核酸修饰的方式,有利于将检测引物与目标基因序列模板的结合自由能提高10-20δgkcal mol-1
,提高引物与目标基因模板的捕获效率,增加检测灵敏度,所以可以使用血浆样本,血浆中游离dna呈现片段化(150bp左右),含量低于10ng,仍能检测到。
42.可选或优选的,上述检测引物组中,所述目标基因检测引物的核苷酸序列如下所示:
43.pcdhb18p目标基因:
44.chr5:141235136-141235232检测引物的核苷酸序列:seq id no:13~14,
45.chr5:141235796-141235918检测引物的核苷酸序列:seq id no:16~17,
46.chr5:141235982-141236064检测引物的核苷酸序列:seq id no:19~20;
47.cdo1目标基因:
48.chr5:115816656-115816755检测引物的核苷酸序列:seq id no:22~23,
49.chr5:115816502-115816579检测引物的核苷酸序列:seq id no:25~26,
50.chr5:115816382-115816460检测引物的核苷酸序列:seq id no:28~29;
51.hoxa9目标基因:
52.chr7:27166431-27166523检测引物的核苷酸序列:seq id no:31~32,
53.chr7:27166020-27166126检测引物的核苷酸序列:seq id no:34~35,
54.chr7:27165835-27165919检测引物的核苷酸序列:seq id no:37~38;
55.lypd5目标基因:
56.chr19:43820817-43820923检测引物的核苷酸序列:seq id no:40~41,
57.chr19:43820625-43820694检测引物的核苷酸序列:seq id no:43~44,
58.chr19:43820271-43820377检测引物的核苷酸序列:seq id no:46~47。
59.第四方面,本发明提供了一种卵巢癌早期筛查诊断用检测试剂盒,包括以上任一所述引物组。
60.可选或优选的,上述试剂盒中,还包括对应检测以上所述标志物组合中甲基化片段的甲基化状态的目标基因检测探针,所述目标基因检测探针的核苷酸序列如下所示:
61.pcdhb18p基因:
62.chr5:141235136-141235232检测探针的核苷酸序列:seq id no:15,
63.chr5:141235796-141235918检测探针的核苷酸序列:seq id no:18,
64.chr5:141235982-141236064检测探针的核苷酸序列:seq id no:21;
65.cdo1基因:
66.chr5:115816656-115816755检测探针的核苷酸序列:seq id no:24,
67.chr5:115816502-115816579检测探针的核苷酸序列:seq id no:27,
68.chr5:115816382-115816460检测探针的核苷酸序列:seq id no:30;
69.hoxa9基因:
70.chr7:27166431-27166523检测探针的核苷酸序列:seq id no:33,
71.chr7:27166020-27166126检测探针的核苷酸序列:seq id no:36,
72.chr7:27165835-27165919检测探针的核苷酸序列:seq id no:39;
73.lypd5基因:
74.chr19:43820817-43820923检测探针的核苷酸序列:seq id no:42,
75.chr19:43820625-43820694检测探针的核苷酸序列:seq id no:45,
76.chr19:43820271-43820377检测探针的核苷酸序列:seq id no:48。
77.所述目标基因检测探针也采用卡环式结构,不同的是核苷酸序列的5’端增加一段
5-10bp长度的且与靠近3’端末端进行互补配对的序列,发卡结构的tm值应高于pcr反应体系中退火温度5-6℃,同时增加锁核酸修饰形式,目标在于引物与序列模板的结合自由能提高δg15-25kcal mol-1
,提高探针捕获血浆游离dna中的低拷贝目标甲基化区域。另外,目标基因检测探针采用卡环式结构还有一个好处,即标记荧光基团和淬灭基团后,序列的荧光基团与淬灭基团相距较近,荧光相互吸收效果更好,不会产生额外背景荧光,因此荧光本底低,同样不会产生引物二聚体。第三个好处是具有很高的特异性,探针为卡环式设计结构,序列本身很难与非甲基化序列结合,确保探针序列只会与匹配的甲基化序列相结合。第四个好处是适用于多重扩增反应,探针序列标记不同荧光基团,能够适用于多基因联合同步检测,同时各基因进行独立判读,展现出每个基因在不同样本中的甲基化状态,最终进行功能互补性联合检测。
78.可选或优选的,上述试剂盒中,还包括针对内参基因gapdh的内参基因检测引物和内参基因检测探针,所述内参基因检测引物的核苷酸序列如seq id no:49~50所示,内参基因检测探针的核苷酸序列如seq id no:51所示。
79.可选或优选的,上述试剂盒中,所述目标基因检测探针和内参基因检测探针的核苷酸序列5’端均标记荧光基团,3’端均标记淬灭基团,同一检测体系中各目标基因检测探针之间以及和内参基因检测探针之间标记的荧光基团不同。
80.荧光基团包括但不限于:fam、rox、cy5、hex,淬灭基团包括但不限于bhq1、bhq2。
81.不同荧光通道标记的目标基因检测探针可放在一管中反应,保证样本中不同目标基因的扩增效率最佳,荧光曲线为标准的s型扩增曲线,与各基因单重扩增相比荧光曲线保持一致的趋势。
82.可选或优选的,上述试剂盒中,还包括pcr反应液,所述pcr反应液每一人份由浓度1u/μl的甲基化特性的taq dna聚合酶1~1.5μl、浓度10mm的dntps 5~8μl、浓度2~5mm的mg
2+
3~6μl、10
×
dna聚合酶buffer 5μl和纯化水补足至25μl组成。
83.与现有技术相比,本发明具有如下有益效果:
84.1、本发明筛选出pcdhb18p、cdo1、hoxa9和lypd5四个卵巢癌相关的分子标志物基因,并筛选确定各基因中最优的甲基化区域,组合后能够相互补充用于卵巢癌的早期检测。所筛选出的区域不仅包括基因的启动子区域,还包括基因的编码区域,由于卵巢癌种类多样性及异质性,通过样本前处理技术及功能互补的多基因甲基化联合检测技术的检测流程,显著提升对卵巢癌检出的灵敏度,同时保持对正常及卵巢良性肿瘤的高特异性。该检测组合物通过分子表观遗传手段,利用甲基化检测技术对妇科恶性肿瘤可能的患者提早检出,结果准确性非常高,能够给临床医生提供辅助诊断参考,提早进行预防治疗。
85.2、针对四个联合目标基因的甲基化区域设计特异性引物和探针,均采用卡环式设计结构和锁核酸修饰形式,对甲基化模板可以进行双重识别(引物和探针同时捕获甲基化区域模板),增强pcr扩增体系的灵敏度和特异性,减少检测的误差。尤其对于以血浆作为样本、dna量少,dna甲基化量更少的情况来说,提高灵敏度是至关重要的。本发明采用特殊的引物探针设计形式,目的是增加在血浆游离dna中对模板的捕获效率,能够以少量样本得出准确的检测结果,更适合临床应用。
86.所有引物和探针构成的检测体系,还可以采用多基因多通道荧光检测手段,利用五种荧光探针标记通过特异性引物探针与甲基化序列准确识别,以及最优的pcr反应液,对
pcdhb18p、cdo1、hoxa9和lypd5基因甲基化位点精确检测,批量完成多基因甲基化位点检测,检测方法操作简单、判读直观、8个小时内出结果,通用的荧光定量pcr仪均能满足检测需求,实现实验流程采用一站式全封闭形式,操作更简便,也避免了交叉污染的可能。
87.3、检测引物和探针以及试剂盒能够以血浆作为样本,其基于血浆游离dna分析为卵巢癌早期检测提供了另一条途径,克服了肿瘤内异质性的问题。在目标基因检测引物和探针的设计上采用卡环式结构,增加了扩增的灵敏度和特异性。试剂盒中扩大pcr反应液至25μl,总反应体系达到50μl,增强pcr反应体系的扩增能力,捕获低拷贝甲基化模板的效率。
88.4、试剂盒结合特异性引物探针,配合样本前处理试剂、pcr反应液的taq聚合酶等,保证了试剂盒使用时对低浓度的模板保持高灵敏度,对早期卵巢癌的检测非常灵敏。本试剂盒检测的高灵敏性适用于卵巢癌的早期检测。
附图说明
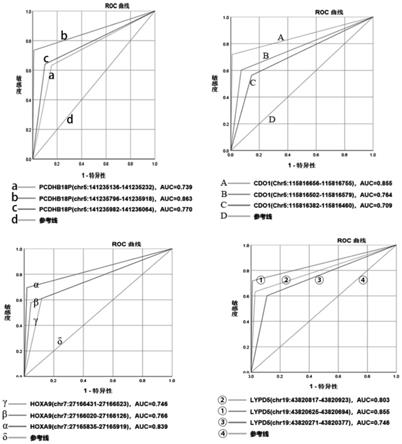
89.图1为pcdhb18p、cdo1、hoxa9和lypd5各目标基因筛选甲基化区域的roc曲线;
90.图2为pcdhb18p、cdo1、hoxa9和lypd5四个目标基因最佳的甲基化区域联合检测的roc曲线。
具体实施方式
91.下面结合附图和较佳的具体实施例,对本发明的技术方案进行详细解释和说明,以便本领域技术人员能够更好地理解本发明并予以实施。
92.实施例1
93.通过选择20例卵巢癌和20例卵巢良性石蜡包埋组织样本进行illumina infinium methylationepic beadchip芯片(包含853,307个cpg位点)卵巢癌甲基化基因的筛选。
94.通过商业化核酸提取或纯化试剂及甲基化检测样本前处理试剂盒对上述40例组织样本进行基因组dna的提取及dna的重亚硫酸盐转化过程,获得质量合格的转化后bis-dna进行后续的甲基化芯片筛选检测。通过显著性甲基化差异位点算法,将卵巢癌和卵巢良性样本的结果进行比对分析,筛选出deltabeta(卵巢癌组织样本的甲基化水平-卵巢良性对照样本的甲基化水平)靠前的4个基因(pcdhb18p=0.895,cdo1=0.818,hoxa9=0.812,lypd5=0.807),因每个基因中的cpg的区域分布比较多,需要转入rt-pcr进行验证分析每个基因特定的甲基化位置。最终在每个基因中确定了三个甲基化区域片段,如seq id no.1-2所示。
95.实施例2
96.针对实施例1所筛选出的四个目标基因甲基化区域,根据甲基化区域的具体序列进行引物设计和筛选,获得如表1所示的甲基化区域检测引物和探针具体核苷酸序列。
97.表1.目标基因不同甲基化区域对应的检测引物和探针序列
[0098][0099]
[0100]
注:f表示正向检测引物,r表示反向检测引物,fp表示检测探针。本表格中,所展示的探针序列已经进行了荧光基团标记和淬灭基团标记。
[0101]
利用上述表1所列引物和探针,制备检测试剂盒(pcr扩增体系试剂盒),包括pcr反应液、引物探针混合液、阳性质控品和阴性质控品,成分如下表2所示:
[0102]
表2.pcr扩增体系试剂盒组成
[0103][0104]
选取已知明确病理信息结果的128例卵巢癌样本:62例鉴定为卵巢高级别浆液性癌、28例卵巢低级别浆液性癌、13例卵巢粘液性癌、13例卵巢子宫内膜样癌;12例卵巢透明细胞癌;110例为卵巢良性样本。以上样本均为血浆样本留样获得。
[0105]
一、样本甲基化前处理
[0106]
血浆中游离dna的片段化,主要在150bp左右,而且含量很低(低于10ng)。因此样本前处理试剂以及后续的pcr反应液都较为重要,决定是否能检测到血浆游离dna中基因甲基化的变化。
[0107]
样本甲基化前处理试剂包括细胞基因组dna提取试剂和dna重亚硫酸盐转化试剂。使用该样本甲基化前处理试剂时,包括两个过程,一个是血浆游离ddna的提取过程,另一个是重亚硫酸盐的转化过程,每一个步骤均要做好质控。
[0108]
1、采用血浆游离dna提取试剂盒核酸提取或纯化试剂作为血浆游离dna提取试剂,对上述238例血浆样本进行游离dna的提取,同时进行dna质量监控。提取2ml血浆dna的浓度在0.3ng/ul以上,总量在6ng-10ng之间,确保游离dna的提取质量满足要求。
[0109]
2、采用重亚硫酸盐转化试剂盒甲基化检测样本前处理试剂盒作为dna重亚硫酸盐转化试剂,对提取好的dna进行重亚硫酸盐转化,dna中未甲基化的胞嘧啶(c)转变为尿嘧啶(u),而甲基化的胞嘧啶(c)不变,得到转化后的bis-dna。
[0110]
转化过程几个重要的质控指标:一是监控样本游离dna的量和完整性,二是监控重
亚硫酸氢盐的转化回收率;三是监控重亚硫酸氢盐转化的完整性。以便为后续的pcr扩增反应提供高质量的bis-dna。
[0111]
二、bis-dna进行荧光定量pcr扩增
[0112]
1、配制pcr反应液和引物探针混合液;
[0113]
表3.pcr反应液(25μl/人份)
[0114]
组分一人份加入量(μl)甲基化特性的dna聚合酶(1u/μl)1.5dntps(10mm)7mg
2+
(2-5mm)510
×
dna聚合酶buffer5纯化水补足至25μl
[0115]
上述pcr反应体系中,重要的成分为甲基化特异性的taq聚合酶,主要具有以下优势:针对重亚硫酸盐转化之后的模板序列进行扩增,能特异性识别转化后序列,提高引物对转化后序列的扩增效率。taq酶较少会影响扩增效率下降,taq酶过多也很容易引起非特异性扩增,因此对于taq酶多少的选择直接影响pcr扩增结果。另外,体系中dntps、mg
2+
、10
×
dna聚合酶buffer之间的配比关系同样直接影响到引物探针组合的扩增效率。
[0116]
该pcr反应体系是特异性扩增重亚硫酸盐转化之后的bis-dna,且同时是多重引物扩增,因此pcr反应液的扩增能力尤其重要,要确保pcr反应体系中各基因引物探针的扩增效率与其对应的单重扩增时保持一致。因此需要对不同抗体修饰的甲基化特异性taq聚合酶以及与dntps、mg
2+
、10
×
dna聚合酶buffer组分之间的配比进行筛选测试验证,确定最终的pcr反应液组成,pcr反应体系的扩增效率最佳。
[0117]
表4.引物探针混合液(5μl/人份)
[0118]
组分一人份加入量(μl)cdo1/celf1/hand2/hs3st2-f(100μm)0.2-0.4cdo1/celf1/hand2/hs3st2-r(100μm)0.1-0.3cdo1/celf1/hand2/hs3st2-fp(100μm)0.15-0.25gapdh基因-f(100μm)0.05gapdh基因-r(100μm)0.05gapdh基因-fp(100μm)0.05纯化水补足至5μl
[0119]
2、加样
[0120]
由于使用样本为血浆游离dna,含量极低,因此表3中pcr反应液扩大至25μl,扩大pcr扩增反应体系至50μl。需要将扩增bis-dna模板扩大至20μl,以进一步提升血浆游离dna中目标基因甲基化检出率。
[0121]
向上述配制的体系中分别加入20μl阴、阳性质控品和转化好的bis-dna临床样本。进行pcr反应,条件为:96℃预变性5min;94℃变性15s,60℃退火延伸35s,45个循环;25℃保持10min。
[0122]
3、扩增程序如下:
[0123]
step1:96℃预变性5min;
[0124]
step2:94℃变性15s,60℃退火延伸35s,45个循环;
[0125]
step3:25℃,10min;
[0126]
信号收集,60℃收集fam、hex、rox、joe以及cy5信号。
[0127]
4、结果判读
[0128]
(1)根据内标曲线的拐点进行判读,内标通道有s型扩增曲线且ct值≤35.4为结果有效;
[0129]
(2)根据内标曲线的拐点进行判读,依次读出pcdhb18p、cdo1、hoxa9和lypd5扩增ct值。
[0130]
(3)综合上述4个基因的ct值,根据roc曲线确定目标基因多个甲基化区域的界值和性能(包括特异性、灵敏度、阴性预测值、阳性预测值),确定最优甲基化区域,以及4个目标基因的判读方式。
[0131]
5、检测结果分析
[0132]
利用上述试剂盒反应体系检测共238例样本,其中包括卵巢癌样本128例,卵巢良性样本110例。
[0133]
对比临床病理结果,在238例血浆样本中,
[0134]
pcdhb18p(chr5:141235136-141235232)在卵巢癌中的阳性率为63.3%(81/128),在良性样本中的特异性为84.5%(93/110),roc面积为0.739;
[0135]
pcdhb18p(chr5:141235796-141235918)在卵巢癌中的阳性率为73.4%(94/128),在良性样本中的特异性为99.1%(109/110),roc面积为0.863;
[0136]
pcdhb18p(chr5:141235982-141236064)在卵巢癌中的阳性率为64.1%(82/128),在良性样本中的特异性为90%(99/110),roc面积为0.770;
[0137]
cdo1(chr5:115816656-115816755)在卵巢癌中的阳性率为71.9%(92/128),在良性样本中的特异性为99.1%(109/110),roc面积为0.855;
[0138]
cdo1(chr5:115816502-115816579)在卵巢癌中的阳性率为60.2%(77/128),在良性样本中的特异性为92.7%(102/110),roc面积为0.764;
[0139]
cdo1(chr5:115816382-115816460)在卵巢癌中的阳性率为56.3%(72/128),在良性样本中的特异性为85.5%(94/110),roc面积为0.709;
[0140]
hoxa9(chr7:27166431-27166523)在卵巢癌中的阳性率为60.9%(78/128),在良性样本中的特异性为88.2%(97/110),roc面积为0.746;
[0141]
hoxa9(chr7:27166020-27166126)在卵巢癌中的阳性率为57.8%(74/128),在良性样本中的特异性为95.5%(105/110),roc面积为0.766;
[0142]
hoxa9(chr7:27165835-27165919)在卵巢癌中的阳性率为69.5%(89/128),在良性样本中的特异性为98.2%(108/110),roc面积为0.839;
[0143]
lypd5(chr19:43820817-43820923)在卵巢癌中的阳性率为63.3%(81/128),在良性样本中的特异性为97.3%(107/110),roc面积为0.803;
[0144]
lypd5(chr19:43820625-43820694)在卵巢癌中的阳性率为71.9%(92/128),在良性样本中的特异性为99.1%(109/110),roc面积为0.855;
[0145]
lypd5(chr19:43820271-43820377)在卵巢癌中的阳性率为60.2%(77/128),在良性样本中的特异性为89.1%(98/110),roc面积为0.746。
[0146]
经过pcdhb18p、cdo1、hoxa9和lypd5多甲基化区域对比分析,pcdhb18p基因选择的最佳甲基化区域为chr5:141235796-141235918,cdo1基因选择的最佳甲基化区域为chr5:115816656-115816755,hoxa9基因选择的最佳甲基化区域为chr7:27165835-27165919,lypd5选择的最佳甲基化区域为chr19:43820625-43820694。
[0147]
根据pcdhb18p、cdo1、hoxa9和lypd5的各最佳甲基化区域进行联合检测,不同基因组合进行对比判读,最后得出最优的判读方式。可以得到如下表5结果:
[0148]
表5.两个目标基因的最佳甲基化区域联合检测性能
[0149][0150]
表6.三个目标基因的最佳甲基化区域联合检测性能
[0151][0152]
表7.四个目标基因的最佳甲基化区域联合检测性能
[0153]
[0154][0155]
上述三个表格数据中,pcdhb18p、cdo1、hoxa9和lypd5四个目标基因的最佳甲基化区域联合检测且任一基因阳性则判读该样本为阳性的情况下,在283例血浆样本中灵敏度和特异性综合最优,在卵巢癌中的灵敏度为95.3%(122/128),在良性样本中的特异性为98.2%(108/110),检测得到的roc面积为0.971。
[0156]
同时pcdhb18p、cdo1、hoxa9和lypd5四个目标基因的最佳甲基化区域联合检测(任一基因为阳性则判读为甲基化检测为阳性)与临床上常用检测手段肿瘤分子标志物ca125检测作为对比分析,对比结果参见表8。从表8得出:四基因的最佳甲基化区域的甲基化状态联合检测的阳性预测值(0.984)显著高于肿瘤分子标志物ca125的阳性预测值(0.736)。
[0157]
表8.甲基化区域联合检测与ca125检测的对比分析
[0158][0159]
通过样本研究检验,证明dna甲基化对于卵巢癌早期检测具有很高阳性预测值,并且通过血浆样本即可检测。本发明运用了特殊的引物探针设计技巧(用于特意捕获低拷贝血浆游离dna片段),多目标基因甲基化区域联合检测,功能互补,显著提高对早期卵巢癌的检出。
[0160]
本文中应用了具体个例对发明构思进行了详细阐述,以上实施例的说明只是用于帮助理解本发明的核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离该发明构思的前提下,所做的任何显而易见的修改、等同替换或其他改进,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1