一株发酵乳杆菌及其应用
1.本发明属于微生物技术领域,尤其涉及一株发酵乳杆菌及其应用。
背景技术:
2.乳酸菌是一种具有免疫调节功能的肠道共生菌,包括50多种不同的种类。越来越多的证据表明,乳酸菌能够影响宿主免疫功能,但具体的免疫反应知之甚少,可能的机制是诱导免疫细胞的激活,促进细胞因子的产生,进而调节先天性和适应性免疫反应。
3.肠道是人体最大的免疫系统,肠道相关淋巴组织主要包括固有层淋巴细胞、肠系膜淋巴结、上皮内淋巴细胞以及派氏集合淋巴结等。派尔集合淋巴结(peyer patch,pps)是肠黏膜免疫系统的重要组成部分,是诱导黏膜免疫应答的重要部位。在肠道淋巴组织中含有众多的t淋巴细胞,执行各种调节和效应功能。t淋巴细胞在肠道黏膜聚集,受到微生物刺激,可分化成效应t细胞。效应t细胞包括辅助性(th1细胞和th2细胞)、细胞毒性和调节性t细胞(treg)等亚群。th1细胞主要诱导巨噬细胞、nk细胞、b细胞和cd
8+
t细胞的活化在抗感染免疫中起着重要的免疫调节作用。
4.乳酸菌作为肠道中的有益菌群,粘附、定殖在肠道粘膜层,能够调节固有免疫和适应性免疫系统的体液成分和细胞。例如,特定的乳酸杆菌菌株能够刺激t细胞和自然杀伤(nk)细胞中ifn-γ和il-12细胞因子的分泌,来增强细胞杀伤活力。il-12与ifn-γ可以诱导th1优势细胞免疫应答,并促进巨噬细胞产生炎性细胞因子(肿瘤坏死因子-α[tnf-α]、il-6和一氧化氮[no]),有效地进行病原菌的清除,包括胞内菌。
[0005]
目前,对发酵乳杆菌的免疫调节功能主要体现在抑菌活性、诱导血清中炎性细胞因子分泌等方面,而对发酵乳杆菌对肠道派氏结中t淋巴细胞介导的免疫功能调控有待深入研究。因此,能提供一株具有较强免疫调节活性的功能性乳酸菌菌株,对于维持肠道免疫平衡具有重要意义。
技术实现要素:
[0006]
有鉴于此,本发明的目的在于提供一株发酵乳杆菌,能提高派氏结中t淋巴细胞的活性,诱导th1型细胞的分化,促进th1型细胞因子的分泌表达,增强肠道抗微生物感染的免疫调控能力。
[0007]
为了实现上述发明目的,本发明提供了以下技术方案:
[0008]
一株发酵乳杆菌,命名为发酵乳杆菌(lactobacillus fermentum)ml-03,保藏于中国微生物菌种保藏管理委员会普通微生物菌种保藏中心,保藏编号为cgmcc no.22207。
[0009]
优选的,所述发酵乳杆菌来源于发酵乳制品。
[0010]
本发明还提供了一种发酵乳杆菌菌剂,活性成分为上述发酵乳杆菌(lactobacillus fermentum)ml-03。
[0011]
本发明还提供了上述发酵乳杆菌或发酵乳杆菌菌剂在制备提高肠道黏膜的免疫应答药物中的应用。
[0012]
优选的,所述发酵乳杆菌能促进肠道派氏结中t淋巴细胞的增殖。
[0013]
优选的,所述发酵乳杆菌能上调肠道派氏结内中th1型细胞的分化。
[0014]
优选的,所述发酵乳杆菌能促进th1型细胞因子的分泌。
[0015]
优选的,所述细胞因子包括ifn-r和il-12。
[0016]
优选的,所述产品还包括载体,制备成胶囊、片剂、颗粒或者粉剂。
[0017]
优选的,所述产品中发酵乳杆菌的浓度大于等于1
×
107cfu/g。
[0018]
相对于现有技术,本发明具有如下有益效果:
[0019]
本发明发酵乳杆菌(lactobacillus fermentum)ml-03具有较强的胃肠道耐受特性,能提高派氏结中t淋巴细胞的活性,诱导th1型细胞的分化,促进th1型细胞因子的分泌表达,增强肠道抗微生物感染的免疫调控能力。
[0020]
生物保藏信息
[0021]
本发明所述发酵乳杆菌ml-03,拉丁文为lactobacillus fermentum,保藏于中国微生物菌种保藏管理委员会普通微生物菌种保藏中心,保藏编号为cgmcc no.22207,保藏日期为2021年04月19日,保藏地址为北京市朝阳区北辰西路1号院3号。
附图说明
[0022]
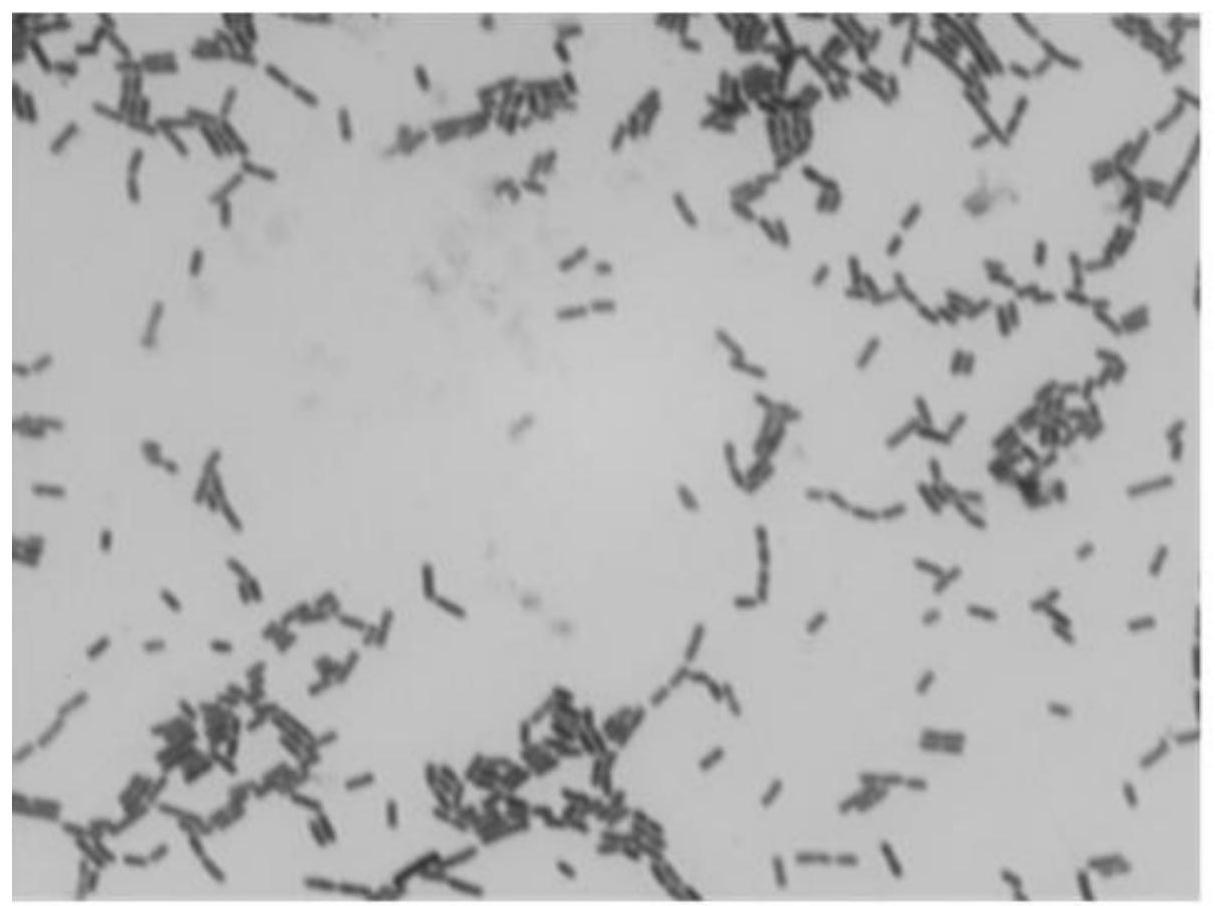
图1为本发明发酵乳杆菌ml-03革兰氏染色形态示意图;
[0023]
图2为本发明发酵乳杆菌ml-03对脾脏指数的示意图;
[0024]
图3为本发明发酵乳杆菌ml-03对肠道派氏结中t淋巴细胞增殖的影响示意图;
[0025]
图4为本发明发酵乳杆菌ml-03对肠道派氏结中th1细胞的活化示意图;
[0026]
图5为本发明发酵乳杆菌ml-03对血清中th1型细胞因子il-12的分泌影响示意图;
[0027]
图6为本发明发酵乳杆菌ml-03对血清中th1型细胞因子inf-r的分泌影响示意图。
具体实施方式
[0028]
本发明提供了一株发酵乳杆菌,命名为发酵乳杆菌(lactobacillus fermentum)ml-03,保藏于中国微生物菌种保藏管理委员会普通微生物菌种保藏中心,保藏编号为cgmcc no.22207。
[0029]
在本发明中,所述发酵乳杆菌来源于发酵乳制品,为革兰氏染色阳性菌。
[0030]
本发明还提供了一种发酵乳杆菌菌剂,活性成分为上述发酵乳杆菌(lactobacillus fermentum)ml-03。
[0031]
本发明还提供了上述发酵乳杆菌或发酵乳杆菌菌剂在制备提高肠道黏膜的免疫应答产品中的应用。
[0032]
在本发明中,所述发酵乳杆菌优选能促进肠道派氏结中t淋巴细胞的增殖,上调肠道派氏结内中th1型细胞的分化,促进th1型细胞因子的分泌,所述细胞因子优选包括ifn-r和il-12。
[0033]
在本发明中,所述产品优选为食品或保健品;所述产品还优选包括载体,制备成胶囊、片剂、颗粒或者粉剂。
[0034]
在本发明中,所述产品中发酵乳杆菌的浓度优选大于等于1
×
107cfu/g。
[0035]
本发明对未提及原料的来源没有特殊的限定,采用本领域技术人员熟知的常规市
售产品即可。
[0036]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0037]
实施例1
[0038]
发酵乳杆菌(lactobacillus fermentum)ml-03的分离、纯化与鉴定
[0039]
1、发酵乳杆菌菌株分离纯化
[0040]
收集传统的发酵乳制品,用无菌的pbs进行稀释。用移液管吸取200μl的混悬液在含caco3的mrs固体平板上涂布,置于厌氧罐中,放在37℃恒温培养箱中培养48h。挑取阳性单菌落于mrs液体培养基中进行扩增,并进行革兰氏染色鉴定。该菌株革兰氏染色阳性。菌体革兰氏染色特性见图1。
[0041]
2、发酵乳杆菌16s rdna测序鉴定
[0042]
按照生工细菌基因组试剂盒进行乳酸菌dna的提取。利用16s rdna通用引物(27f和1492r,引物序列为27f:5
’‑
agagtttgatcctggctcag-3’(见序列表1);1492r:5
’‑
ggttaccttgttacgactt-3’(见序列表2))对菌株16s rdna基因进行pcr扩增,pcr产物送至华大基因有限公司进行测序,菌株的16s rdna的核苷酸序列见序列表3。经过blast基因比对,与genebank中的与发酵乳杆菌lactobacillus fermentum strain csl54的同源性达99%,说明这是一株发酵乳杆菌,命名为发酵乳杆菌ml-03。
[0043]
实施例2
[0044]
发酵乳杆菌(lactobacillus fermentum)ml-03的产酸能力以及耐受性能评价
[0045]
1、发酵乳杆菌ml-03菌株的产酸能力评价
[0046]
将活菌接种于mrs液体培养基,放入37℃恒温培养箱中进行厌氧培养。分别于培养0h、12h、24h后,取5ml菌液,5000r/min离心10min。吸取上清液,并利用ph计测量ph值的测定。实验结果如表1所示:
[0047]
表1发酵乳杆菌ml-03的产酸能力表
[0048]
菌株0h,ph12h,ph24h,phml-036.43
±
0.154.87
±
0.033.95
±
0.03
[0049]
由表1可知,对照mrs液体培养基ph值为6.43,在培养12h发酵乳杆菌ml-03上清液ph值为4.87,并且ph随培养时间而逐步降低,这表明发酵乳杆菌ml-03具有较强的产酸能力。
[0050]
2、发酵乳杆菌ml-03的耐酸能力评价
[0051]
将活菌接种于mrs液体培养基中,放入37℃培养箱中厌氧培养18h。配制无菌的1mol/l的盐酸溶液,调整mrs液体培养基的ph值。按照2%比例将菌液接入ph为1.5,4和6.8的mrs液体培养基中,置于37℃中进行厌氧培养。分别在培养1h和3h的时候,进行浓度梯度稀释,稀释数次使浓度稀释至10-5,取150μl涂布于mrs固体平板上,放入培养箱中37℃厌氧培养24h后计数菌落,根据公式,记录结果并计算菌株在酸性条件下的存活率。存活率=细菌培养3小时菌落数/细菌培养0小时菌落数
×
100%。实验结果如表2所示:
[0052]
表2 ml-03在不同ph值的mrs液体培养基中的存活率表
[0053][0054]
由表2可知,分离所得发酵乳杆菌ml-03在ph值为4.0的mrs培养基中培养三小时后仍具有很高的存活率,达到93.67%。由此可见,发酵乳杆菌ml-03具有较强的耐酸能力,可耐受胃酸的环境。
[0055]
3、发酵乳杆菌ml-03菌株的耐胆盐能力评价
[0056]
将活菌接种于mrs液体培养基中,放入37℃培养箱中厌氧培养18h。配制无菌的胆盐浓度为0.2%、0.3%和0.4%的mrs液体培养基。按照2%比例将菌液接入含胆盐的mrs液体培养基中,置于37℃中进行厌氧培养。在培养1h和3h时候,分别进行浓度梯度稀释,稀释数次使浓度稀释至10-5,取150μl涂布于mrs固体平板上,放入培养箱中37℃厌氧培养24h后计数菌落,根据公式,记录结果并计算两株菌株在酸性条件下的存活率。存活率=细菌培养3小时菌落数/细菌培养0小时菌落数
×
100%。实验结果如表3所示:
[0057]
表3 ml-03在不同胆盐浓度的mrs液体培养基中的存活率表
[0058][0059]
由表3可知,分离所得发酵乳杆菌ml-03在胆盐含量为0.3%的条件下存活率高达91.55%,说明发酵乳杆菌ml-03具有较强的耐胆盐性能,能够适应肠道中的环境。
[0060]
实施例3
[0061]
发酵乳杆菌(lactobacillus fermentum)ml-03对小鼠脾脏指数的影响
[0062]
脾脏指数是反映机体脾脏免疫功能的重要指征之一,其数值高低的变化可以反映机体免疫功能的状态。选取balb/c小鼠,雌性,4-5周龄,体重约为20g,分为对照组与发酵乳杆菌灌胃组。对照组灌服500μl无菌pbs,发酵乳杆菌组灌胃500μl的ml-03(5
×
109cfu),连续灌服9天。处死小鼠,在超净工作台中分离脾脏、肠道组织和派氏结。剥离脾脏后立即用电子天平称重。指数计算采用以下公式:脾脏指数=脾脏重量/体质量。
[0063]
由图2可知,发酵乳杆菌ml-03组的小鼠脾脏指数相对于对照组有增高的趋势。
[0064]
实施例4
[0065]
发酵乳杆菌(lactobacillus fermentum)ml-03对肠道派氏结中th1细胞的活化的影响
[0066]
用1%血清的pbs研磨派氏结,得到的细胞悬液用200目的滤网进行过滤。1700rpm、4℃离心10min,pbs洗涤1次,直至细胞变成白色沉淀。对照组与发酵乳杆菌ml-03灌胃组小鼠的细胞进行抗体孵育,在无菌干燥离心管中加入20ul cd3抗体cd4抗体,震荡混匀后室温避光孵育30分钟。然后用5mlpbs洗涤一次,1500rpm离心10分钟,用清洁吸管弃去上清液,吸水纸吸干。加入100μl固定剂(fix&perm reagent a)后震荡混匀细胞,室温避光孵育20分钟。用3mlpbs洗涤一次,1500rpm离心10分钟,用清洁吸管弃去上清液。加入l00μl破膜剂后震荡混匀细胞,室温避光孵育25分钟。用3ml pbs洗涤一次,1500rpm离心10分钟,用100μl pbs重悬固定破膜后的细胞,加入20μl ifn-γ抗体和20μl抗人il-4抗体,室温下避光孵育
30分钟。用3ml pbs洗涤一次,1500rpm离心10分钟,用600μl pbs重悬细胞,30min内使用流式细胞仪进行检测。
[0067]
图3中,其数值代表t细胞cd3
+
cd4
+
细胞群增殖的比例,图4中其数值代表th1细胞cd3
+
cd4
+
ifn-γ
+
il-4-细胞群占总细胞的比例。由图3和图4可知,发酵乳杆菌ml-03可以明显增强肠道派氏结中t淋巴细胞的增殖,并且能够促进th1细胞的活化比例,进而发挥细胞免疫的功能。
[0068]
实施例5
[0069]
发酵乳杆菌(lactobacillus fermentum)ml-03对血清中th1型细胞因子的分泌的影响
[0070]
小鼠眼球取血,放置于1.5ml ep管中,室温放置30min血清析出后,3000rpm,4℃离心20min,分装40μl/1.5ml ep管,血清用于elisa检测th1细胞相关因子ifn-r及il-12的表达。
[0071]
由图5和图6可知,发酵乳杆菌ml-03可以增强th1细胞因子的ifn-r及il-12的表达。
[0072]
综上可知,本发明发酵乳杆菌(lactobacillus fermentum)ml-03具有较强的胃肠道耐受特性,能提高派氏结中t淋巴细胞的活性,诱导th1型细胞的分化,促进th1型细胞因子的分泌表达,增强肠道抗微生物感染的免疫调控能力。
[0073]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1