一种对胰蛋白酶和胃蛋白酶抗性提高的玉米赤霉烯酮水解酶
1.本发明涉及玉米赤霉烯酮水解酶,特别涉及到对胰蛋白酶抗性和胃蛋白酶抗性提高的玉米赤霉烯酮水解酶。
背景技术:
2.玉米赤霉烯酮水解酶(简称zhd101),又称为玉米赤霉烯酮降解酶。玉米赤霉烯酮降解酶zhd101基因是粉红螺旋聚孢霉中的一个编码泛解酸内酯水解酶的基因,该基因编码的蛋白zhd101能够特异性结合并降解玉米赤霉烯酮。其反应降解机制是zhd101将zen的酯键断开,变成带有开放侧链的二羟基苯基衍生物,随后丢失co2得到一种无毒的烷基间苯二酚产物,该产物无毒。因此,它常被用作饲料添加剂以提高饲料利用率。
3.zhd101分为水解酶折叠中心结构域和帽子结构。两个结构的连接处形成一个较大的凹槽,此凹槽经底物复合体结构证实为底物结合位点。底物zen间苯环部分主要被氢键固定,内酯环部分主要通过疏水作用力结合到活性中心。由结构分析的结果,zhd101的催化三联体是s102,h242和e126,收集底物复合体的结构s102突变为a102。s102作为亲核试剂攻击底物内酯环中的羰基c,使得底物被水解。
4.迄今,有关玉米赤霉烯酮水解酶和玉米赤霉烯酮降解酶的研究主要集中于发现和筛选来自不同来源的产不同特征的玉米赤霉烯酮水解酶的菌株或通过基因重组方法获得产不同特征的玉米赤霉烯酮水解酶的菌株,以及玉米赤霉烯酮水解酶的制备与应用等。检索中国专利文库,发现有关玉米赤霉烯酮降解酶的专利有近70个,关于发现或筛选来自不同微生物来源的具有不同特征的玉米赤霉烯酮降解酶及其编码基因的专利包含多个方面:其中,关于提高玉米赤霉烯酮降解酶ph适用范围的专利有:cn202010272789.1、cn201711180443.3等;关于提高玉米赤霉烯酮降解酶酶活力的专利有:cn201910825318.6、cn201910823208.6、cn201911024030.5、cn201110082679.x等;关于提升玉米赤霉烯酮降解酶稳定性的专利有:cn202011381340.5、cn201810010538.9、cn201710516347.5等;关于提高玉米赤霉烯酮降解酶蛋白表达量的专利有:cn201910823034.3、cn201910822888.x、cn201910321167.0、cn201610156145.x等;通过基因重组方法获得产玉米赤霉烯酮水解酶的菌株或突变体的专利有:cn201911024030.5、cn201911023315.7、cn201711180443.3、cn202110157570.1、cn201810010538.9、cn201710322734.5等;关于玉米赤霉烯酮水解酶制备方法的专利有:cn201611249978.7、cn201510943066.9、cn201910308008.7、cn201611250033.7等;关于构建产玉米赤霉烯酮毒素降解酶基因工程菌方法的专利有:cn202110124614.0、cn202110124609.x、cn201610156145.x、cn201911018173.5、cn202011381340.5、cn201911023315.7等;关于发现或筛选不同微生物来源的产玉米赤霉烯酮降解酶的菌株的专利有:cn202011325114.5、cn201910556331.6、cn202010991141.x、cn201911186458.x、cn201910556331.6、cn201410147140.1、cn201410047870.4等;关于玉米赤霉烯酮降解酶应用的专利有:cn201911327678.x、cn201911038267.9、cn201910693874.2、cn201910298924.7、cn201610372613.7、cn201480055221.7、
cn200910241454.7、cn201310356776.2、cn201310083469.1、cn201511015441.x、cn201910938276.7、cn201910228804.x等。检索中国学位论文库有关玉米赤霉烯酮降解酶的主要研究包括挖掘具有高效降解率的玉米赤霉烯酮降解酶的基因资源、研究酶学性质、催化反应机理、酶基因克隆与表达、酶的定向改造及在饲料工业等中的应用等。而有关具有胰蛋白酶抗性和胃蛋白酶抗性提高的玉米赤霉烯酮水解酶的研究和专利,迄今尚未见报道。
技术实现要素:
5.本发明的首要目的是提供一种对胰蛋白酶抗性和胃蛋白酶抗性提高的玉米赤霉烯酮水解酶。
6.本发明是对玉米赤霉烯酮水解酶的基因(称为zdh101基因)进行定点突变。由粉红螺旋聚孢霉(clonostachys rosea)中获得的玉米赤霉烯酮水解酶的基因序列的genbank登录号为kr363960.1。该酶的成熟蛋白的氨基酸序列为ali16790.1(seq id no.1)。
7.本发明通过对玉米赤霉烯酮水解酶进行突变筛选到了一株玉米赤霉烯酮水解酶突变体,经实验表明,所获得的zhd101突变体对玉米赤霉烯酮的水解功能不受影响,对胰蛋白酶的抗性半衰期比野生型zhd101延长了32%,对胃蛋白酶的抗性半衰期比野生型zhd101延长了43%,命名为zhd101
k254q/y115h
。
8.本发明所述的对胰蛋白酶抗性和胃蛋白酶抗性提高的玉米赤霉烯酮水解酶,它是由氨基酸序列为seq id no.1的来源于粉红螺旋聚孢霉(clonostachys rosea)的玉米赤霉烯酮水解酶中制造多个氨基酸取代而产生的、对胰蛋白酶抗性和胃蛋白酶抗性提高的酶,所述的氨基酸取代是第115和254位的取代。
9.根据本发明所述的定点突变改造的玉米赤霉烯酮水解酶的进一步特征,所述在第115位的氨基酸取代是用组氨酸取代酪氨酸;第254位的氨基酸取代是用谷氨酰胺取代赖氨酸。所述的定点突变改造的玉米赤霉烯酮水解酶的氨基酸序列为seq id no.2。
10.本发明所述的玉米赤霉烯酮水解酶突变体(zhd101
k254q/y115h
),经模拟人工胰液(ph为6.8,浓度为1mg/ml的胰蛋白酶在40℃条件下)消化处理100分钟后,测得突变体zhd101
k254q/y115h
半衰期约166min,而野生型zhd101
wt
半衰期约125min,显示突变体zhd101
k254q/y115h
对胰蛋白酶的抗性比野生型zhd101
wt
提高了。该玉米赤霉烯酮水解酶突变体,经模拟人工胃液(ph为1.2,浓度为0.012mg/ml的胃蛋白酶在40℃条件下)消化处理80分钟后,测得突变体zhd101
k254q/y115h
半衰期约66min,而野生型zhd101
wt
半衰期约46min。由此显示突变体zhd101
k254q/y115h
比野生型zhd101
wt
提高了对胃蛋白酶的抗性。
11.进一步地,本发明提供了一种dna分子,其编码本发明所述的对胰蛋白酶抗性和胃蛋白酶抗性提高的玉米赤霉烯酮水解酶。
12.本发明所述的突变体dna分子的核苷酸序列为seq id no.3。
13.本发明的另一个目的是提供一种载体,其含有本发明所述的dna分子。
14.本发明的又一个目的是提供一种宿主细胞,其含有本发明所述的dna分子,或者含有本发明所述的载体。
15.上述载体和宿主细胞都可以通过本领域公知的技术手段进行制备。
16.本发明还提供了本发明所述的对胰蛋白酶抗性和胃蛋白酶抗性提高的玉米赤霉
烯酮水解酶的生产方法,包括:在适于玉米赤霉烯酮水解酶表达的条件下培养本发明所述的宿主细胞,并从培养基中分离所述的玉米赤霉烯酮水解酶。
17.当本发明所述的dna分子以合适的取向和正确的阅读框插入到所述的载体,或者转入所述的宿主细胞中,所述的dna分子可以在任何真核或者原核表达系统中表达。许多宿主-载体系统都可以用来表达蛋白质编码序列。宿主-载体系统包括但不限于:用噬菌体、质粒或粘粒转化的细菌;含有酵母载体的微生物,如酵母;用病毒感染的哺乳动物细胞系统;用病毒感染的昆虫细胞系统;用细菌感染的植物细胞系统。本发明优选的载体包括病毒载体、质粒、粘粒或者寡核苷酸。
18.本发明优选的宿主为真核系统如毕赤酵母;本发明优选的蛋白质表达方法为毕赤酵母分泌表达。
19.本发明的另一个方面是提供了所述的对胰蛋白酶抗性和胃蛋白酶抗性提高的玉米赤霉烯酮水解酶的用途,具体是所述的对胰蛋白酶抗性和胃蛋白酶抗性提高的玉米赤霉烯酮水解酶在制备食品添加剂或饲料添加剂中的应用。
附图说明
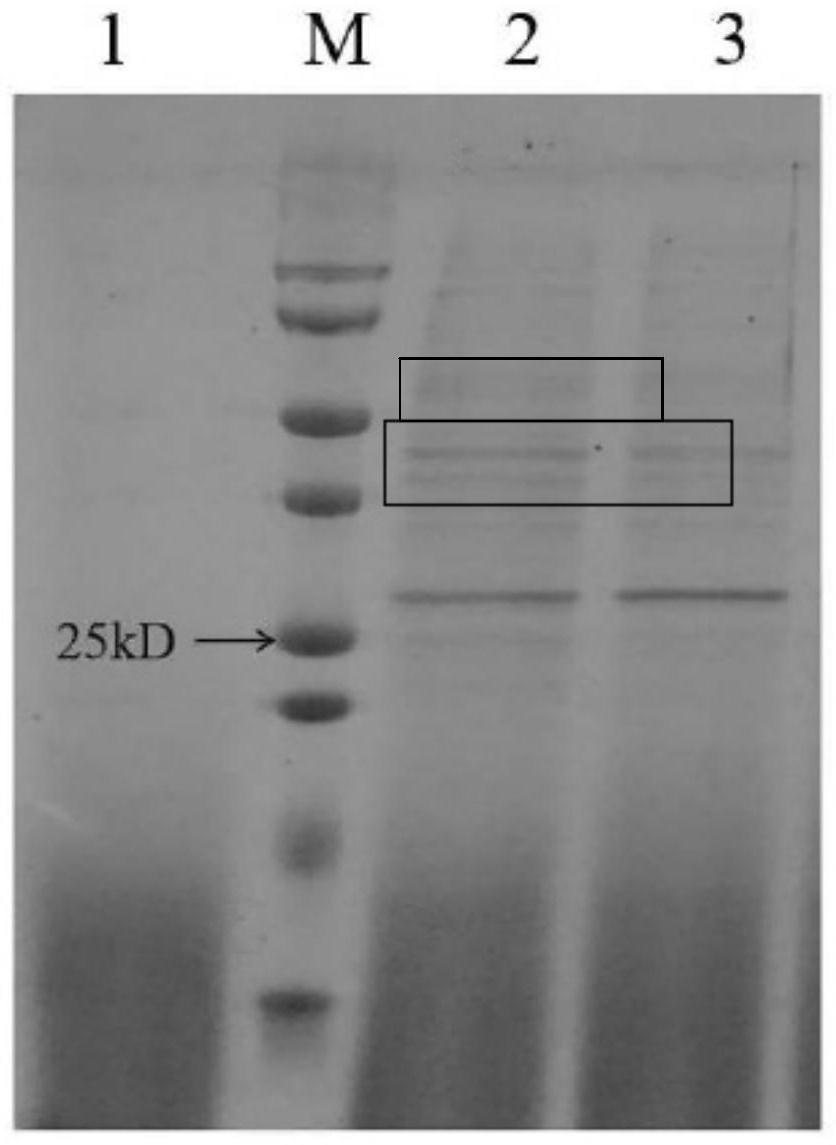
20.图1是sds-page蛋白电泳图,黑色箭头所指处为marker 25kd条带,黑色方框中为目的蛋白,大小为29kd左右。其中,泳道1为不含目的基因的野生型毕赤酵母gs115对照样品;泳道2为野生型玉米赤霉烯酮水解酶蛋白培养上清;泳道3为突变体玉米赤霉烯酮水解酶蛋白培养上清。
21.图2是本发明所述的野生型zhd101
wt
与突变体zhd101
k254q/y115h
蛋白灰度扫描数据结果图。人工胰液中含胰蛋白酶。
22.图3是本发明所述的野生型zhd101
wt
与突变体zhd101
k254q/y115h
蛋白灰度扫描数据结果图。人工胃液中含胃蛋白酶。
23.图4是本发明所述的野生型zhd101
wt
和突变体zhd101
k254q/y115h
的最适温度。
24.图5是本发明所述的野生型zhd101
wt
和突变体zhd101
k254q/y115h
的温度稳定性。
25.图6是本发明所述的野生型zhd101
wt
和突变体zhd101
k254q/y115h
的最适ph。
26.图7是本发明所述的野生型zhd101
wt
和突变体zhd101
k254q/y115h
的ph稳定性。
具体实施方式
27.本文中所采用的术语,除非另有说明,均为本领域技术人员所通常理解的含义。以下提供在本发明中使用的一些特殊术语的定义。
[0028]“zhd101
wt”表示野生型玉米赤霉烯酮水解酶,其基因以斜体“zhd101
wt”表示。
[0029]“zhd101
k254q/y115h”表示突变体玉米赤霉烯酮水解酶,其基因以斜体“zhd101
k254q/y115h”表示。
[0030]
实施例1:玉米赤霉烯酮水解酶基因的合成
[0031]
本发明采用clonostachys rosea来源的野生型玉米赤霉烯酮水解酶的基因(genbank注册号为kr363960.1),由上海捷瑞基因公司合成(其它具有全基因合成的商业公司同样可以完成)。
[0032]
实施例2:玉米赤霉烯酮水解酶基因(zhd101)与克隆载体taox+pght+bbpb的连接
[0033]
1.将全基因合成的含zhd101目的基因的pgh质粒和克隆载体taox+pght+bbpb(发明人所在的的实验室自行构建)分别用限制性内切酶ecori和spei/xbai于37℃酶切30min,酶切条件如下表1:
[0034]
表1:
[0035][0036]
2.酶切产物经1%的琼脂糖凝胶电泳后分别回收两个目的片段,用t
4 dna连接酶连接,连接体系如下表2:
[0037]
表2:
[0038]
zhd101酶切产物7.0μl克隆载体酶切产物1.0μlt
4 dna连接酶1.0μlt
4 dna连接酶缓冲液1.0μlddh2o1.0μl总体积10.0μl
[0039]
用dna连接酶16℃连接16h,连接产物转化dh5α感受态细胞扩增后用质粒抽提试剂盒抽提质粒,用ecori和psti双酶切后跑电泳结果显示有3.8kb和6.3kb两条带,表明连接成功,通过dna测序,确定为玉米赤霉烯酮水解酶基因。
[0040]
经过以上两个步骤成功将玉米赤霉烯酮水解酶基因(zhd101)与克隆载体taox+pght+bbpb进行连接,得到了克隆载体m+taox+pght+pb。
[0041]
实施例3:基因片段paox+pgap+ss1与克隆载体m+taox+pght+pb连接
[0042]
1.基因片段paox-+pgap+ss1由由发明人所在的研究机构(暨南大学微生物研究所)保存的克隆载体paox+ss1+pb中调出,使用ecori和spei内切酶双酶切并纯化回收获得;在克隆载体m+taox+pght+pb中插入基因片段paox+pgap+ss1,最终可实现zhd101蛋白的胞外表达,有利于蛋白后期纯化。
[0043]
2.克隆载体m+taox+pght+pb由实施例2获得,基因片段paox+pgap+ss1与克隆载体m+taox+pght+pb的连接方法同实施例2。
[0044]
经过以上两个步骤成功将基因片段paox+pgap+ss1插入克隆载体m+taox+pght+pb中,表达盒构建成功。
[0045]
实施例4:突变体突变位点的确定
[0046]
构建玉米赤霉烯酮水解酶基因(zhd101)随机突变文库,筛选zhd101蛋白的突变体文库,测定突变体的玉米赤霉烯酮水解酶的酶学性质和胰蛋白酶抗性和胃蛋白酶抗性,筛
选得到本发明所述的突变体,其基因为zhd101
k254q/y115h
,该突变体是在第115位和第254位氨基酸发生突变。发明人确定对第115位和第254位进行定点突变,突变后的突变体zhd101
k254q/y115h
基因由上海捷瑞基因公司合成,也可以由其它具有全基因合成的商业公司完成基因合成。
[0047]
实施例5:野生型zhd101
wt
基因与突变体zhd101
k254q/y115h
基因分别整合毕赤酵母基因组及重组蛋白的分泌表达
[0048]
本实施例的目的是对于前一实施例筛选得到的突变体用于分泌表达
[0049]
用限制性内切酶xba i和spe i对biobricks进行线性化,以除去质粒骨架的biobricks序列,随后利用biobricks两端所设计的整合位点paox和taox可以通过同源重组双交换的方式,得到稳定的携带目的基因的重组子。本实验的受体菌为毕赤酵母gs115,电转化后使用md平板进行初步筛选,然后挑取md平板上的单克隆于2ml的ypg液体培养基中培养14~16h后抽取毕赤酵母基因组进行pcr验证和进一步筛选阳性克隆重组子。
[0050]
经过md平板筛选和pcr验证,得到电转成功的阳性克隆重组子。
[0051]
实施例6:野生型zhd101
wt
及突变体zhd101
k254q/y115h
重组蛋白的sds-page电泳检测
[0052]
(1)配置10ml 10%的分离胶,混匀后用微量移液器往玻璃板中灌胶,直到离短玻璃板上沿2~3厘米处停止,然后用蒸馏水封住胶面,可轻轻抬起制胶器一端然后放下使胶面平整,聚合40min后到弃蒸馏水,用滤纸吸去多余水分;
[0053]
(2)配置4ml 5%的浓缩胶,均匀的灌在分离胶之上,插入相应规格的梳子同时应避免产生气泡,聚合30min待胶凝固;
[0054]
(3)装好电泳槽,将槽内灌电泳液,体积宜大于电泳槽体积的一半,把制好的胶移入电泳槽中,小心拔去梳子;
[0055]
(4)依次点样,点样量不宜过多,15μl每孔为合适;
[0056]
(5)电泳开始时先设置90v跑胶,指示剂至浓缩胶部分将电压改为120v继续电泳,目的条带跑到中间位置时可停止电泳(目的条带对应于maker的相应条带,事先可获知);
[0057]
(6)小心剥下凝胶,考马斯亮蓝r-250染色30min后,脱色液脱色至背景较浅蛋白条带清晰即可;
[0058]
(7)凝胶成像并观察结果。sds-page蛋白电泳结果如图1所示。
[0059]
如图1所示,黑色箭头所指处为marker 25kd条带,黑色方框中为目的蛋白,大小为29kd左右。泳道1为不含目的基因的毕赤酵母gs115对照样品。该结果表明目的基因在毕赤酵母gs115中成功表达,可扩大培养并分离纯化目的蛋白以进行下一步实验。
[0060]
实施例7:电泳检测野生型zhd101
wt
及突变体zhd101
k254q/y115h
重组蛋白的胰蛋白酶抗性和胃蛋白酶抗性检测
[0061]
将野生zhd101
wt
和突变体zhd101
k254q/y115h
用人工胰液(ph为6.8,浓度为1mg/ml的胰蛋白酶在40℃条件下)消化(野生型zhd101
wt
蛋白与突变体zhd101
k254q/y115h
蛋白的添加量相同,人工胰液和酶蛋白含量按照质量比为1:50的比例)分别在0、10、20、30、40、60、80、100min取出20μl并加入7μl蛋白电泳缓冲液终止消化并立即煮沸5min,然后进行sds-page电泳检测胰蛋白酶的消化效果,对sds-page电泳蛋白条带进行灰度扫描检测残留蛋白量,计算野生型zhd101
wt
与突变体zhd101
k254q/y115h
蛋白经胰蛋白酶处理前和处理后的酶半衰期。
[0062]
结果如图2所示。本发明所述的玉米赤霉烯酮水解酶突变体(zhd101
k254q/y115h
),经模拟人工胰液(ph为6.8,浓度为1mg/ml的胰蛋白酶在40℃条件下)消化处理100分钟后,测得半衰期约166min,而野生型zhd101
wt
半衰期约125min,zhd101
k254q/y115h
的半衰期比野生型延长了32%。由此显示突变体zhd101
k254q/y115h
对胰蛋白酶的抗性比野生型zhd101
wt
提高了。
[0063]
将野生zhd101
wt
和突变体zhd101
k254q/y115h
用人工胃液(ph为1.2,浓度为0.012mg/ml的胃蛋白酶在40℃条件下)消化(野生型zhd101
wt
蛋白与突变体zhd101
k254q/y115h
蛋白的添加量相同)分别在0、10、20、30、40、50、60、80min取出20μl并加入7μl蛋白电泳缓冲液终止消化并立即煮沸5min,然后进行sds-page电泳检测胃蛋白酶的消化效果,对sds-page电泳蛋白条带进行灰度扫描检测残留蛋白量,计算野生型zhd101
wt
与突变体zhd101
k254q/y115h
蛋白经胃蛋白酶处理前和处理后的酶半衰期。
[0064]
结果如图3所示。本发明所述的玉米赤霉烯酮水解酶突变体(zhd101
k254q/y115h
),经模拟人工胃液(ph为1.2,浓度为0.012mg/ml的胃蛋白酶在40℃条件下)消化处理80分钟后,测得半衰期约66min,而野生型zhd101
wt
半衰期约46min,zhd101
k254q/y115h
的半衰期比野生型延长了43%。由此显示突变体zhd101
k254q/y115h
对胃蛋白酶的抗性比野生型zhd101
wt
提高了。实施例8:野生型zhd101
wt
及突变体zhd101
k254q/y115h
重组蛋白的酶学性质分析
[0065]
1、最适温度及温度稳定性分析
[0066]
纯化后得到的野生型zhd101
wt
及突变体zhd101
k254q/y115h
重组蛋白适当稀释后,在ph为7.4的反应缓冲液中,梯度温度(10℃、20℃、30℃、40℃、50℃、60℃)下测定酶活,以最高的酶活为100%计算其他温度下的相对酶活,每组设置三个平行。
[0067]
纯化后得到的野生型zhd101
wt
及突变体zhd101
k254q/y115h
重组蛋白适当稀释后,在梯度温度(10℃、20℃、30℃、40℃、50℃、60℃)温育15min后,测定酶活,以最高的酶活为100%计算其他温度下的相对酶活,每组设置三个平行。
[0068]
酶活测定方法如下:
[0069]
在一定的反应条件下,zhd101能以zen作为水解底物发生反应,通过hplc检测,以zen的峰面积的变化来表示底物减少量,进而对zhd101的酶活进行表征。反应体系如表3所示:
[0070]
表3:
[0071][0072]
30℃反应10min,加入300μl甲醇终止反应。产物过滤后取20μlhplc检测,吸光度检测波长233nm,60%乙腈0.6ml/min洗脱。
[0073]
将测定条件下,每分钟降解1μg zen所需的酶量定义为1个单位的zen降解酶活。酶活(u/mg)的计算公式为:
[0074][0075]
其中x为底物降解量,单位为μg。
[0076]
如图4所示,野生型zhd101
wt
和突变体zhd101
k254q/y115h
的最适温度都是40℃,当反应温度超过50℃时,酶活快速下降。如图5所示,野生型zhd101
wt
和突变体zhd101
k254q/y115h
在50℃孵育15min后,各酶的残余酶活均下降至30%以下。
[0077]
2、最适ph及ph稳定性分析
[0078]
纯化后得到的野生型zhd101
wt
及突变体zhd101
k254q/y115h
重组蛋白适当稀释后,在温度30℃,梯度ph(4、5、6、7、7.5、8、9、10、11)的反应缓冲液中根据“最适温度及温度稳定性分析”中的酶活测定方法测定酶活以最高的酶活为100%计算其他ph下的相对酶活,每组设置三个平行。
[0079]
纯化后得到的野生型zhd101
wt
及突变体zhd101
k254q/y115h
重组蛋白适当稀释后,置于梯度ph(4、5、6、7.5、9、10、11)的反应缓冲液中30℃温育30min后,根据“最适温度及温度稳定性分析”中的酶活测定方法测定酶活,以最高的酶活为100%计算其他温度下的相对酶活,每组设置三个平行。
[0080]
如图6所示,野生型zhd101
wt
和突变体zhd101
k254q/y115h
在不同过的ph条件下反应的表现相似,最适ph都是9,在酸性的环境中活性被抑制,随着ph升高,酶活上升,在ph5~11的环境下有活性。如图7所示,野生型zhd101
wt
和突变体zhd101
k254q/y115h
均在ph7.5~10的范围内显示出较好的稳定性。综合以上两个实验可看出,突变体zhd101
k254q/y115h
的其他酶学性质与野生型野生型zhd101
wt
水解酶基本一致。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1