BBOX1-AS1作为复发性流产诊断标志物和治疗靶点的应用
bbox1-as1作为复发性流产诊断标志物和治疗靶点的应用
技术领域
1.本发明属于生药医药和分子生物学技术领域,具体涉及bbox1-as1作为复发性流产诊断标志物和治疗靶点的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.复发性流产(recurrent pregnancy loss,rpl)指在妊娠28周之前与同一配偶连续发生3次及3次以上的胎儿丢失,发病率为1%,在临床上通常被定义为连续两次或两次以上的妊娠失败,发病率升高至5%。根据目前的研究表明,造成复发性流产的病因有很多,主要包括:双亲或胚胎染色体异常;生殖器官畸形或宫颈机能不全;感染因素;内分泌疾病;免疫功能紊乱;血栓形成倾向等,然而还有许多复发性流产的患者病因尚不清楚,这部分病例约占复发性流产的50%左右,临床上称其为不明原因复发性流产。近年来,人们越来越重视生殖健康,但rpl的发病率却逐年上升,严重影响孕期妇女的身心健康,目前不明原因复发性流产的发病机制尚不明确,临床上尚无有效的预防和治疗措施,是亟待解决的临床问题。
4.复发性流产的发生是一个复杂的过程。大量研究提示了早期妊娠滋养细胞的增殖分化不良,浸润能力受损是许多妊娠合并综合征的病因之一,在妊娠早期,滋养层细胞侵入蜕膜化的子宫内膜,重塑子宫螺旋动脉,以增加流向胎盘绒毛的母体血液,这对母体和胎儿血液之间的废物和营养物质交换至关重要。滋养层功能受损将导致严重的不良妊娠结局,包括不明原因复发性流产,子痫前期等。因此对于滋养细胞功能学的研究不仅可以为复发性流产的发病机理和治疗提供依据,同时对疾病的发生发展和治疗也有很大的意义。
5.lncrna是一类长度大于200nt,但不编码蛋白质的rna,物种间保守性低,广泛存在于动植物中。它们曾长期被误认为是遗传暗物质,但近些年研究证实这类rnas在生物的生命活动过程中起着重要的调控作用。最近的研究表明,lncrna以细胞类型特异性或组织特异性的方式发挥作用,表明lncrna可能是细胞特异性反应的驱动因素。lncrna参与多种生物过程,包括基因组印记、细胞增殖和分化以及细胞发育过程。近年来,有研究报道lncrna与许多生殖疾病相关,包括子痫前期、早发性卵巢功能不全、胎儿生长受限、复发性流产等。但其潜在机制仍不完全清楚。
技术实现要素:
6.针对现有技术存在的不足,本发明提供bbox1-as1作为复发性流产诊断标志物和治疗靶点的应用。本发明首先采用高通量的lncrna表达谱芯片筛选rpl绒毛组织与正常妊娠绒毛组织中差异表达的lncrna。检测差异lncrna bbox1-as1对滋养细胞增殖、凋亡、迁移、侵袭等生理功能的影响,并进一步进行相关机制研究。最后选择胎盘组织中表达量高的lncrna做为初步筛选目标,在孕妇血浆中进一步检测及筛选,从而了解不明原因复发性流
产的发生与lncrna作为早期诊断标志物的相关性。有助于深入了解不明原因复发性流产的发病机理,进一步完善母-胎免疫耐受机制,为其早期诊断及预防提供参考。
7.具体的,本发明涉及以下技术方案:
8.本发明的第一个方面,提供bbox1-as1作为标志物在制备复发性流产诊断或辅助诊断产品中的应用。
9.其中,所述bbox1-as1即为lncrnabbox1反义rna 1(bbox1-as1)。
10.本发明通过研究发现,与正常妊娠者相比,bbox1-as1在复发性流产患者的绒毛组织中呈显著高表达。进一步通过检测复发性流产患者血液(血清)中bbox1-as1,其表达同样升高,在绘制受试者工作特征曲线(roc曲线)并计算曲线下面积(auc),表明血清中bbox1-as1具有较高的诊断效能,auc为0.8144。
11.本发明的第二个方面,提供一种产品,所述产品包含用于检测上述bbox1-as1的物质,所述产品用于诊断或辅助诊断复发性流产。
12.本发明的第三个方面,提供一种用于诊断或辅助诊断复发性流产的系统,所述系统包括:
13.i)分析单元,所述分析单元包含:用于确定受试者的待测样品中选自bbox1-as1表达水平的检测物质,以及;
14.ii)评估单元,所述评估单元包含:根据i)中确定的所述bbox1-as1表达水平判断所述受试者是否患有复发性流产;
15.本发明的第四个方面,提供一种诊断或辅助诊断复发性流产的方法,所述方法包括:
16.a)从受试者分离待测样品;
17.b)在所述受试者的待测样品中检测上述bbox1-as1表达水平,以及;
18.c)将样品中的表达水平与参照中的表达水平进行比较;
19.其中,与参照中的水平相比,样品中bbox1-as1表达水平的上调,则所述受试者为或候选为复发性流产患者;反之,所述受试者不为或不候选为复发性流产患者。
20.本发明的第五个方面,提供bbox1-as1作为靶点在复发性流产治疗和/或筛选复发性流产相关药物中的应用。
21.本发明的第六个方面,提供抑制所述bbox1-as1的表达水平的物质在制备产品中的应用;
22.所述产品的功能为如下任意一种或多种:
23.(a1)促进滋养细胞增殖;
24.(a2)抑制滋养细胞凋亡;
25.(a3)促进滋养细胞迁移;
26.(a4)促进滋养细胞侵袭;
27.(a5)促进滋养细管状形成;
28.(a6)抑制p38/jnk mapk信号通路的激活(磷酸化);
29.(a7)抑制与hnrnpk结合,进而抑制gadd45a表达;
30.(a8)预防和/或治疗复发性流产。
31.本发明的第七个方面,提供一种产品,其活性成分包括如下任意一种或多种:
32.(b1)抑制bbox1-as1的表达水平的物质;
33.(b2)抑制hnrnpk的表达水平的物质。
34.上述第六至第七方面中的产品可以为药物或者实验试剂,所述实验试剂可供基础研究使用。
35.本发明的第八个方面,提供一种预防和/或治疗复发性流产的方法,所述方法包括:向受试者施用治疗有效剂量的上述药物。
36.以上一个或多个技术方案的有益技术效果:
37.上述技术方案首次发现bbox1-as1的表达量与复发性流产紧密相关,表明在复发性流产绒毛组织上调的bbox1-as1在体外调控滋养细胞的增殖、迁移和侵袭,并参与激活p38/jnk mapk信号通路。另外,上述技术方案还研究了bbox1-as1通过结合蛋白hnrnpk来促进gadd45a表达,最终引起滋养细胞功能的改变,促进复发性流产的发生。最后在复发性流产患者血清中bbox1-as1表达升高,说明bbox1-as1作为rpl早期诊断标志物的潜在可能性。
38.综上,上述技术方案中发现的bbox1-as1及其分子机制将有助于深入了解rpl发病机制,也将有助于为临床诊断、预防及治疗复发性流产提供潜在的标志物及治疗靶点,因此具有良好的实际应用之价值。
附图说明
39.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
40.图1是本发明实施例中采用高通量的lncrna表达谱芯片筛选正常妊娠和rpl患者绒毛组织中差异lncrna的结果图;a.来自对照组(n=3)和rpl患者(n=3)差异表达的lncrna表达谱芯片的热图。b.火山图c.从lncrna表达谱芯片中筛选5个差异倍数最显著的lncrna,并在对照组(n=20)和rpl患者(n=18)绒毛组织进行验证。
41.图2为本发明实施例中在40对正常妊娠和rpl患者绒毛组织中及3种滋养细胞系中检测bbox1-as1的表达相关图。a:在40对正常妊娠和rpl患者绒毛组织中通过qrt-pcr检测bbox1-as1的表达。b:在4种滋养细胞系中通过qrt-pcr检测bbox1-as1的表达。c:在滋养细胞系中过表达bbox1-as1后,检测其过表达效率。d:在滋养细胞系htr8/svneo、jar中敲减bbox1-as1后,检测bbox1-as1敲减效率。
42.图3是本发明实施例中bbox1-as1在体外抑制滋养细胞增殖,促进细胞凋亡相关图。a、c、e:cck8实验(a)、edu实验(c)、克隆形成实验(e)检测过表达bbox1-as1后,对滋养细胞增殖的影响。b、d、f:cck8实验(b)、edu实验(d)、克隆形成实验(f)检测敲减bbox1-as1后,对滋养细胞增殖的影响。g:流式细胞仪检测过表达bbox1-as1后,对滋养细胞凋亡的影响。h-i:流式细胞仪检测过表达bbox1-as1后,对凋亡相关蛋白的影响。
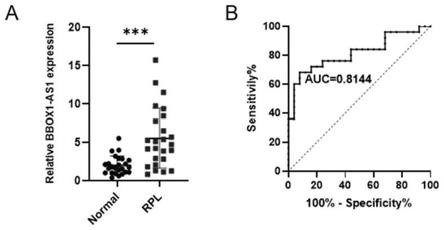
43.图4是本发明实施例中bbox1-as1在体外抑制滋养细胞迁移和侵袭。a-b:transwell实验检测过表达或敲减bbox1-as1后,对滋养细胞迁移和侵袭的影响。c-d:过表达或敲减bbox1-as1,检测其对htr-8/svneo细胞管状形成能力的影响。e-f:过表达或敲减bbox1-as1的绒毛外植体体外培养,检测对其迁移距离的影响。
44.图5为本发明实施例中bbox1-as1调控mapk信号通路,并促进gadd45a基因表达。a:qrt-pcr检测bbox1-as1对临近基因bbox1表达的影响。b-e:对过表达bbox1-as1的htr-8/
svneo细胞和其对照细胞进行rna-seq;其中,b:火山图,c:热图,d:go分析,e:kegg分析。f:western blot检测过表达bbox1-as1激活p38/jnk mapk信号通路。g-h:qrt-pcr验证rna-seq所得部分靶基因。i:western blot检测过表达bbox1-as1,对gadd45a蛋白表达的影响。j:qrt-pcr检测绒毛组织中gadd45a的表达k:western blot检测正常妊娠和rpl患者的绒毛组织中p38/jnk mapk信号通路及gadd45a的表达。l.绒毛组织中bbox1-as1的表达和gadd45a mrna的表达呈正相关性。m:western blot检测敲低gadd45a,对p38/jnk mapk信号通路的影响。n:western blot检测敲低gadd45a的同时过表达bbox1-as1对p38/jnk mapk信号通路的影响。
45.图6是本发明实施例中bbox1-as1通过gadd45a调节滋养细胞增殖、侵袭和管状形成相关图。a:克隆形成实验检测转染pcdna3.1+sictrl、bbox1-as1+sictrl、pcdna3.1+gadd45a、bbox1-as1+gadd45a在htr-8/svneo和jar细胞中的增殖能力。b:transwell实验检测转染的上述四种质粒在htr-8/svneo和jar细胞中的迁移和侵袭能力。c:绒毛外植体用上述四种质粒转染24h,然后转移到matrigel上进一步培养,分别在24h和48h在光学显微镜下测量绒毛外植体尖端的迁移距离。每个实验用于评估来自三个独立胎盘的九个外植体。d:用上述4种质粒处理的htr-8/svneo细胞进行的管状形成实验的典型图像和统计数据。
46.图7为本发明实施例中bbox1-as1与hnrnpk特异性结合。a-b:荧光原位杂交(fish)实验(a)和细胞核质分离试验(b)检测滋养细胞中bbox1-as1的定位。c-d:rna pulldown实验,结合质谱(ms)鉴定bbox1-as1内源性结合蛋白.e:蛋白银染实验检测rna pull down拉下来的蛋白。f:rip实验验证bbox1-as1在htr-8/svneo细胞中的hnrnpk免疫沉淀中特异性富集。g-i.在滋养细胞中敲减hnrnpk,检测gadd45a在mrna水平(g-h)和蛋白水平上(h)表达变化。
47.图8为本发明实施例中bbox1-as1与hnrnpk结合促进gadd45a mrna稳定性。a:qrt-pcr水平检测敲低hnrnpk后,bbox1-as1表达水平变化。b-c:qrt-pcr和wb检测在滋养细胞htr-8/svneo、jar过表达bbox1-as1后hnrnpk表达的变化。d:双荧光素酶报告基因实验检测过表达bbox1-as1和对照组的荧光强度有无差异。e:使用放线菌酮(chx)经不同作用时间(0、2、4、8h)诱导过表达bbox1-as1的htr-8/svneo、jar滋养细胞,wb检测gadd45a蛋白的降解程度。f:在过表达bbox1-as1和敲减hnrnpk的滋养细胞使用放线菌素d(actd)处理不同时间(0、4、8、12h),qrt-pcr检测gadd45a mrna的降解速率。
48.图9为本发明实施例中敲低hnrnpk可部分逆转bbox1-as1对滋养细胞增殖、迁移和侵袭的抑制。a-b:敲低hnrnpk可部分逆转bbox1-as1对滋养细胞迁移和侵袭的抑制作用。c:敲低hnrnpk可部分逆转bbox1-as1对滋养细胞增殖的抑制作用。
49.图10为本发明实施例中检测rpl患者血清中bbox1-as1的表达。a:qrt-pcr检测rpl患者(n=25)和正常早期妊娠妇女(n=25)血清中bbox1-as1的表达。b:roc曲线分析图。
具体实施方式
50.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
51.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根
据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。下列具体实施方式中如果未注明具体条件的实验方法,通常按照本领域技术内的分子生物学的常规方法和条件,这种技术和条件在文献中有完整解释。参见例如sambrook等人,《分子克隆:实验手册》中所述的技术和条件,或按照制造厂商所建议的条件。
52.结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件,或按照销售公司所推荐的条件;实施例中所用的材料、试剂等,如无特殊说明,均可通过商业途径购买得到。
53.本发明的一个典型具体实施方式中,用于bbox1-as1作为标志物在制备复发性流产诊断或辅助诊断产品中的应用。
54.其中,所述bbox1-as1即为lncrna bbox1反义rna 1(bbox1-as1)。当然,本发明中的bbox1-as1还可以与其他可作为复发性流产诊断或辅助诊断的ncrna(mirna和/或lncrna)进行组合,使得临床医生更易准确诊断复发性流产,从而降低不良妊娠结局的风险。
55.本发明通过研究发现,与正常妊娠者相比,bbox1-as1在复发性流产患者的绒毛组织中呈显著高表达。进一步通过检测复发性流产患者血液(血清)中bbox1-as1,其表达同样升高,在绘制受试者工作特征曲线(roc曲线)并计算曲线下面积(auc),表明血清中bbox1-as1具有较高诊断效能,auc为0.8144。
56.本发明的又一具体实施方式中,提供一种产品,所述产品包含上述用于检测bbox1-as1的物质,所述产品用于诊断或辅助诊断复发性流产。
57.其中,检测bbox1-as1的物质包括但不限于用于rt-pcr、基因芯片、原位杂交以及基因测序检测bbox1-as1的表达水平的物质。
58.所述产品包括但不限于检测待测样本中所述bbox1-as1表达水平的引物、探针、芯片、试剂或试剂盒。
59.所述待测样本可为人源样本和非人源样本,更具体的,所述待测样本包括受试者细胞、组织、器官和体液;
60.其中,所述细胞可以为滋养细胞;
61.所述组织可以为绒毛组织;
62.所述器官可以为胎盘或子宫;
63.所述体液可以为血液、淋巴液等,优选为血液;所述血液可以为血清或血浆。采用血液作为待测样品进行检测,减少受试者创伤,使得受试者的适应性、顺从性更佳,同时本发明的linc01088作为复发性流产标志物在血液(血清)中具有较高的特异性和灵敏度,且配合其他复发性流产标志物的联合使用,可进一步提高检测的特异性和灵敏度。
64.更进一步的,所述除上述bbox1-as1生物标志物之外,所述产品还可以包括目前适于检测复发性流产的其他的生物标志物及其组合的物质。
65.本发明的又一具体实施方式中,提供一种用于诊断或辅助诊断复发性流产的系统,所述系统包括:
66.i)分析单元,所述分析单元包含:用于确定受试者的待测样品中选自上述bbox1-as1表达水平的检测物质,以及;
67.ii)评估单元,所述评估单元包含:根据i)中确定的所述bbox1-as1表达水平判断所述受试者是否患有复发性流产。
68.本发明的又一具体实施方式中,以上所述待测样品可以包括受试者的细胞、组织、器官和体液;
69.所述细胞可以为滋养细胞;所述组织可以为绒毛组织;所述器官可以为胎盘或子宫;
70.所述体液可以为血液、淋巴液等,优选为血液;所述血液可以为血清或血浆。采用血液作为待测样品进行检测,从而对受试者创伤性小、安全性高,受试者适应性、顺从性更佳,同时本发明的bbox1-as1作为复发性流产标志物在血液(血清)中具有较高的特异性和灵敏度,同时,通过配合其他复发性流产标志物的联合使用,可进一步提高检测的灵敏度和特异性。
71.需要说明的是,本发明中的bbox1-as1还可以与其他可作为复发性流产诊断或辅助诊断的ncrna(mirna和/或lncrna)进行组合,而通过不同ncrna的优化组合,从而有助于提高检测的特异度和灵敏度,从而为临床医生准确诊断复发性流产,降低不良妊娠结局的风险。
72.本发明的又一具体实施方式中,以上所述检测物质包括但不限于用于rt-pcr、基因芯片、原位杂交以及基因测序检测bbox1-as1的表达水平的物质。
73.本发明的又一具体实施方式中,所述评估单元具体评估流程包括:
74.与参照相比,所述受试者的待测样品中的bbox1-as1表达水平上调,则所述受试者为或候选为复发性流产患者;反之,所述受试者不为或不候选为复发性流产患者。
75.其中,“参照”可以是合适的对照样品,例如来自正常健康受试者的样品,其没有复发性流产相关症状并且没有异常的生理及病理学发现,参照也可以是来自同一受试者的在表现出病症或疾病症状之前或在诊断出复发性流产之前的样品。参照可以是经标准化的样品。
76.本发明的又一具体实施方式中,提供一种诊断或辅助诊断复发性流产的方法,所述方法包括:
77.a)从受试者分离待测样品;
78.b)在所述受试者的待测样品中检测上述lncrna表达水平,以及;
79.c)将样品中的表达水平与参照中的表达水平进行比较;
80.与参照中的水平相比,样品中表达水平的上调,则所述受试者为或候选为复发性流产患者;反之,所述受试者不为或不候选为复发性流产患者。
81.其中,“参照”可以是合适的对照样品,例如来自正常健康受试者的样品,其没有复发性流产相关症状并且没有异常的生理及病理学发现,参照也可以是来自同一受试者的在表现出病症或疾病症状之前或在诊断出复发性流产之前的样品。参照可以是经标准化的样品。
82.本发明的又一具体实施方式中,提供上述bbox1-as1作为靶点在复发性流产治疗和/或筛选复发性流产药物中的应用。
83.本发明的又一具体实施方式中,所述复发性流产药物为预防和/或治疗复发性流产的药物。
84.本发明的又一具体实施方式中,所述筛选复发性流产药物的方法包括:
85.1)采用候选物质处理表达和/或含有bbox1-as1的体系;设置不采用候选物质处理的平行对照;
86.2)完成步骤1)后,检测体系中bbox1-as1的表达水平;与平行对照相比,如果采用候选物质处理的体系中所述bbox1-as1的表达量显著降低,所述候选物质可作为候选的复发性流产药物。
87.本发明的又一具体实施方式中,所述体系可为细胞体系、亚细胞体系、溶液体系、组织体系、器官体系或动物体系。
88.所述细胞体系中的细胞可以为滋养细胞;所述组织体系中的组织可以为绒毛组织;所述器官体系中的器官可以为胎盘、子宫;所述动物体系中的动物可以为哺乳动物,包括小鼠、大鼠、豚鼠、兔、猴、猩猩、人等。
89.本发明的又一具体实施方式中,提供抑制bbox1-as1的表达水平的物质在制备产品中的应用;
90.所述产品的功能为如下任意一种或多种:
91.(a1)促进滋养细胞增殖;
92.(a2)抑制滋养细胞凋亡;
93.(a3)促进滋养细胞迁移;
94.(a4)促进滋养细胞侵袭;
95.(a5)促进滋养细管状形成;
96.(a6)抑制p38/jnk mapk信号通路的激活(磷酸化);
97.(a7)抑制与hnrnpk结合,进而抑制gadd45a表达;
98.(a8)预防和/或治疗复发性流产。
99.本发明的又一具体实施方式中,提供一种产品,提供一种产品,其活性成分包括如下任意一种或多种:
100.(b1)抑制bbox1-as1的表达水平的物质;
101.(b2)抑制hnrnpk的表达水平的物质。
102.所述产品的功能为如下任意一种或多种:
103.(a1)促进滋养细胞增殖;
104.(a2)抑制滋养细胞凋亡;
105.(a3)促进滋养细胞迁移;
106.(a4)促进滋养细胞侵袭;
107.(a5)促进滋养细管状形成;
108.(a6)抑制p38/jnk mapk信号通路的激活(磷酸化);
109.(a7)抑制与hnrnpk结合,进而抑制gadd45a表达;
110.(a8)预防和/或治疗复发性流产。
111.本发明的又一具体实施方式中,所述抑制bbox1-as1的表达水平的物质可以以bbox1-as1为靶序列且能够抑制所述bbox1-as1表达的干扰分子,具体可包括shrna、小干扰
rna,dsrna、微小rna、反义核酸,或者,能表达或形成所述shrna、小干扰rna,dsrna、微小rna、反义核酸的构建物;当然还可以包括化合物类抑制剂。
112.本发明的又一具体实施方式中,上述产品可以为药物或者实验试剂,所述实验试剂可供基础研究使用。
113.当上述产品为药物时,所述药物还可包含一种或多种药学上或食品学上可接受的辅料。所用辅料可为固态或液态。固态形式的制剂包括粉剂、片剂、分散颗粒、胶囊、药丸及栓剂。液态形式的制剂包括溶液、悬浮液及乳液。此外,还可制成注射用小水针、注射用冻干粉针、大输液或小输液。
114.本发明的又一具体实施方式中,提供一种预防和/或治疗复发性流产的方法,所述方法包括:向受试者施用治疗有效剂量的上述药物。
115.所述受试者是指已经是治疗、观察或实验的对象的动物,可以是人和非人哺乳动物,如小鼠、大鼠、豚鼠、兔、狗、猴、猩猩等,最优选指人。所述“治疗有效量”是指包括本发明化合物在内的活性化合物或药剂的量,该量可引起研究者、兽医、医生或其他医疗人员所追求的组织系统、动物或人的生物学或医学响应,这包括减轻或部分减轻受治疗的疾病、综合征、病症或障碍的症状。
116.可以知晓的是,本发明所述活性成分的最佳给药剂量和间隔是由其性质和诸如给药的形式、路径和部位以及所治疗的特定哺乳动物等外部条件决定的,而这一最佳给药剂量可用常规的技术确定。同时最佳的疗程,即同时化合物在额定的时间内每日的剂量,可以用本领域内公知的方法确定。
117.以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。
118.实施例
119.一、材料与方法
120.1.1lncrna表达谱芯片
121.使用trizol试剂(invitrogen,carlsbad,ca,usa)从3例对照组(正常早期妊娠妇女)和3例rpl患者的绒毛组织中提取总rna。使用nd-1000测定rna浓度和纯度,采用甲醛变性琼脂凝胶电泳检测rna质量。采用arraystar human lncrna microarray v5.0(gpl26963)(arraystar,美国)检测lncrna表达谱。康成生物(上海,中国)进行了微阵列扫描和数据分析。基因上调和下调的阈值分别为fold change》1.5和p值《0.05。
122.1.2样本信息
123.收集2019年9月至2021年12月在山东大学第二医院妇产科接受人工流产的41名正常孕妇(20-28岁)和39名rpl患者(20-30岁)的绒毛组织样本。这些rpl病例经历连续2次及以上不明原因流产。排除了染色体异常、子宫解剖结构异常、感染、免疫因素和恶性肿瘤的病例。对照组由随机选择的妇女组成,她们在怀孕5-10周之间因非医疗原因终止妊娠。这些绒毛标本立即储存在-150℃,然后用于rna和蛋白质提取。本研究经山东大学第二医院伦理委员会批准,所有患者均提供书面知情同意书。
124.1.3细胞培养
125.人滋养层细胞系(htr8/svneo、jar)购自中国科学院细胞库。htr8/svneo在dulbecco改良eagle培养基(dmem)/f12中培养,jar细胞在rpmi1640补充10%胎牛血清
(fbs)(新西兰奥克兰gibco)、1%青霉素/链霉素(life technologies/gibco)。所有细胞都保持在37℃和5%co2的潮湿环境中。
126.1.4细胞转染
127.质粒(pcdna3.1、pcdna3.1-bbox1-as1、pcdna3.1-gadd45a)由genepharma(中国上海)构建。bbox1-as1 smart silencer是3种sirna和3种aso的混合物,由锐博(中国广州)设计合成,gadd45a和hnrnpk三种不同的特异性sirna和scrambled si-nc购自genepharma(中国上海)。滋养细胞htr-8/svneo和jar在6孔板中培养(2
×
105个细胞/孔)。根据生产商的方案,细胞被转染质粒使用(polyplus,法国)或转染sirna使用(ployplus,法国)。所有sirna序列都列在(表1)中。
128.表1 sirna序列
[0129][0130]
[0131][0132]
1.5 rna提取和qrt-pcr
[0133]
根据厂商协议,使用trizol(invitrogen,carlsbad,ca,usa)或rnafast200(fastagen,上海,中国)从绒毛组织或培养细胞中分离总rna,并用逆转录试剂盒(toyobo life science,osaka,japan)逆转录成cdna,使用sybrgreen master mix(toyobo life science,osaka,japan)和特异性引物进行实时定量pcr。采用2
‑△△
ct法计算基因的相对rna水平。标准化为甘油醛3-磷酸脱氢酶(gapdh)并转换为倍数变化。所有实验均进行3次独立重复试验。
[0134]
1.6细胞增殖实验
[0135]
接种转染的htr8/svneo或jar细胞在96孔板(3000个细胞/孔)中,添加cck8缓冲液(bestbio,shanghai,china)10μl/孔到培养基中孵育1小时,根据spectramax i3x(molecular devices,美国)每24小时测量的450nm吸光度评估细胞活力。每个点重复5次,
所有实验均进行3次独立重复试验。
[0136]
1.7 edu实验
[0137]
使用edu掺入试验作为检测细胞增殖的补充方法。将转染的htr8/svneo和jar细胞接种于96孔板(3000个细胞/孔)中培养24小时,根据厂家说明,使用cell-light edu apollo567 cell tracking kit(ribobio,广州,中国)进行检测,最后100μl hoechst33342染色30分钟后,荧光显微镜(zeiss,德国)捕获edu阳性细胞并检测细胞增殖率。实验独立重复3次。
[0138]
1.8克隆形成实验
[0139]
转染的htr-8/svneo和jar细胞(1000cells/well)接种在六孔板中,培养7天。然后将磷酸盐缓冲盐水(pbs)洗涤后的细胞用100%甲醇固定30min并用0.1%结晶紫染色风干。计算细胞集落(超过50个细胞)形成的效率。至少三次独立实验.
[0140]
1.9流式检测细胞凋亡
[0141]
转染的htr-8/svneo和jar细胞在六孔板中培养24小时。使用不含edta(0.25%)的胰酶(solarbio,beijing,china)消化细胞并收获,细胞用膜联蛋白v-异硫氰酸荧光素(fitc)和pi(percp-cy5-5)(bestbio,shanghai,china)染色以评估细胞凋亡。根据制造商的建议,通过流式细胞术(bd lsrfortessa;bd biosciences)分析收获的细胞。至少三次独立的实验。
[0142]
1.10 transwell实验
[0143]
使用transwell室(8μm孔径;costar)用于细胞迁移和侵袭测定。对于迁移测定,htr-8/svneo和jar细胞(5
×
104个细胞/孔)悬浮在200μl无血清的培养基中接种在上室。下腔室加入600μl含10%fbs的培养基,孵育24小时后,用棉签去除上腔细胞,甲醇固定下膜表面细胞,0.1%结晶紫溶液染色。对于细胞侵袭测定,需要将细胞铺在包被有matrigel(bd bioscience,san jose,ca,usa)的膜的上室,细胞数目加倍,孵育时间为48小时,其余步骤同细胞迁移实验。然后,在放大倍数为
×
100的光学显微镜下对细胞进行计数,选择五个随机视野进行拍照。实验独立重复至少3次。
[0144]
1.11绒毛外植体培养
[0145]
从正常妊娠早期(6-10周)的绒毛组织中获取小组织切片,用pcdna3.1-bbox1-as1质粒或si-bbox1-as1或si-gadd45a质粒转染小组织切片培养24小时,并测试转染效率,然后将小组织切片转移至包被有基质胶(bd bioscience,san jose,ca,usa)的24孔培养皿,在含有10%fbs和1%青霉素/链霉素的dmem/f12培养基中继续培养48小时,分别于培养第24h和第48h在光学显微镜下拍摄外植体照片,并测量绒毛尖端的迁移距离。
[0146]
1.12管状形成实验
[0147]
用预冷(dmem)/f12培养基以1:1的比例稀释matrigel(冰上操作),96孔板每孔加入50μl上述稀释的matrigel,置于37℃培养箱孵育1h使凝胶凝固,接种不同处理组的htr-8/svneo细胞(2
×
104/孔),置于37℃培养箱中培养12小时,倒置显微镜下观察并采集图像,使用imagej软件测量管腔总长度,每孔取3-5个不同视野拍照测量,并取平均值。
[0148]
1.13免疫蛋白印迹
[0149]
使用ripa裂解缓冲液(beyotime,beyotime,china)裂解总细胞和组织,并辅以蛋白酶抑制剂(ncm biotech,suzhou,china)和磷酸酶抑制剂(ncm biotech,suzhou,china)。
使用bca蛋白测定试剂盒(beyotime,上海,中国)进行蛋白定量。蛋白质通过sds聚丙烯酰胺凝胶电泳(sds-page)分离并转移到0.22mm的pvdf膜(millipore,usa)上。在室温下用5%牛血清白蛋白封闭2小时,之后将膜敷上一抗在4℃下过夜。然后与相应辣根过氧化物酶偶联的二抗室温下孵育1h,使用高灵敏度ecl化学发光检测试剂盒(vazyme,nanjing,china)以及增强化学发光分析系统(bio-rad,上海,中国)检测印迹。
[0150]
1.14 rna荧光原位杂交实验
[0151]
根据制造商的说明,使用荧光原位杂交试剂盒(genepharma,shanghai,china)检测bbox1-as1的亚细胞定位,cy3标记的bbox1-as1探针由吉玛(genepharma,shanghai,china)设计和合成。最后,图像由共聚焦显微镜(zeiss,germany)产生。对于核质分离实验,根据制造商的说明,使用核质分离试剂盒(thermofisher,#am1921)分离和纯化细胞质和核rna。
[0152]
1.15 rna pulldown实验
[0153]
生物素标记的bbox1-as1全长片段在体外转录(promega,美国)。根据制造商的说明,使用pierce
tm magnetic rna-protein pull-down kit(thermo fisher scientific)进行rna pull-down试验,接下来,htr-8/svneo全细胞裂解液与生物素标记的rna和链霉亲和素磁珠一起在4℃下孵育过夜,洗脱lncrna相互作用蛋白,蛋白混合物进行质谱(ms)(中科新生命,上海,中国)分析或蛋白质印迹。
[0154]
1.16 rip实验(rna结合蛋白免疫沉淀)
[0155]
根据制造商的说明,使用magna rip rna结合蛋白免疫沉淀试剂盒(milli pore,美国)来确定目标rna与特定蛋白质的结合。首先,收获htr-8/svneo和jar细胞并用rip裂解缓冲液裂解,裂解物与抗hnrnpk抗体(santa)或正常免疫球蛋白g(igg,阴性对照)和磁珠悬浮液在4℃下孵育过夜。沉淀物被洗脱、纯化并溶解在无rnase的水中,然后提取共免疫沉淀的rna进行qrt-pcr分析。
[0156]
1.17 rna测序
[0157]
使用rneasy mini kit(qiagen,germany,cat#74106)从过表达bbox1-as1的htr-8/svneo细胞和对照细胞中提取总rna。使用agilent bioanalyzer 2100(agilent technologies,santa clara,ca,us)进行质检(纯度和完整性),根据制造商的说明,进行文库构建,并使用illumina novaseq 6000(illumina,美国)进行配对末端(pe)测序。获取测序数据并进行生物信息学分析。
[0158]
1.18双荧光素酶报告基因实验
[0159]
构建gadd45a启动子区域并将其插入到pgl3初级载体的荧光素酶报告基因下游,该基因含有萤火虫荧光素酶的修饰编码区。海肾荧光素酶区域的tk载体用作对照。使用(polyplus,法国)将三种质粒共转染到htr-8/svneo和jar细胞中。转染48小时后,根据制造商的说明使用双荧光素酶报告系统试剂盒(promega,美国,cat#e1910)检测荧光素酶信号。重复3次测试。
[0160]
1.19数据分析
[0161]
通过graphpad prism 8软件(la jolla,ca,usa)进行统计分析。每个实验至少独立重复3次,数据以平均值
±
标准差表示。使用student t检验或非参数mann-whitney检验来比较两组,多组之间的比较采用单向方差分析(anova),p值小于0.05认为差异是显著的。
[0162]
二、实验结果
[0163]
2.1正常妊娠和rpl患者绒毛组织中差异lncrna的筛选
[0164]
首先,选取3对正常妊娠和rpl患者绒毛组织,采用高通量的lncrna表达谱芯片筛选差异表达的lncrna。选取rpl组差异倍数最显著的5个lncrna,通过qrt pcr在正常妊娠及rpl患者绒毛标本中进行验证,发现bbox1-as1在rpl患者中具有显著的差异,因此选择bbox1-as1进行后续研究(见图1)。
[0165]
2.2通过qrt-pcr分析rpl患者绒毛组织和滋养细胞细胞系中的bbox1-as1的表达并验证bbox1-as1过表达或敲减效率
[0166]
在40对正常妊娠和rpl患者绒毛组织中及3种滋养细胞系中检测bbox1-as1的表达。并在htr-8/svneo、jar两个细胞系中分别构建过表达或敲减bbox1-as1的细胞系(见图2)。
[0167]
2.3 bbox1-as1体外抑制滋养细胞增殖,促进细胞凋亡
[0168]
评估过表达或者敲低bbox1-as1对htr-8/svneo、jar滋养细胞生物学功能的影响,发现过表达bbox1-as1可以抑制滋养细胞增殖、促进滋养细胞凋亡。敲减bbox1-as1则导致相反的结果(见图3)。
[0169]
2.4 bbox1-as1体外抑制滋养细胞迁移、侵袭和管状形成能力
[0170]
通过transwell实验和成管实验评估bbox1-as1对htr-8/svneo、jar细胞迁移、侵袭和管状形成能力的影响。发现过表达bbox1-as1抑制滋养层细胞迁移、侵袭和管状形成能力,而敲减bbox1-as1具有相反的效果。另外,将pcdna3.1或bbox1-as1质粒转染绒毛外植体,发现转染bbox1-as1质粒的绒毛外植体迁移速度减慢,这与来自细胞系的检测结果一致(见图4)。
[0171]
2.5 bbox1-as1调控mapk信号通路,并影响gadd45a基因表达
[0172]
进一步探究bbox1-as1对滋养细胞功能影响的机制。对过表达bbox1-as1的htr-8/svneo细胞及其对照细胞进行rna-seq,结果发现bbox1-as1可以调控p38/jnk mapk信号通路。接下来,验证在rna-seq中差异倍数明显的部分基因,结果显示gadd45a的mrna表达水平升高最显著。最后,研究bbox1-as1是否通过gadd45a调节mapk信号通路,实验结果显示敲低gadd45a在很大程度上逆转了过表达bbox1-as1介导的p38/jnk mapk信号通路的磷酸化。以上这些结果表明bbox1-as1通过gadd45a调控mapk信号通路(见图5)。
[0173]
2.6 bbox1-as1通过gadd45a调节滋养细胞增殖、侵袭和管状形成
[0174]
在过表达bbox1-as1的htr-8/svneo、jar滋养细胞中敲减gadd45a,结果显示敲减gadd45a逆转bbox1-as1对滋养细胞的增殖、侵袭和管状形成能力的抑制作用。进一步研究敲减gadd45a对绒毛外植体迁移能力的影响,发现敲减gadd45a逆转bbox1-as1对绒毛外植体的迁移能力的抑制作用。综上,bbox1-as1可以通过调控gadd45a介导滋养细胞增殖、侵袭和成管能力(见图6)。
[0175]
2.7 bbox1-as1与hnrnpk特异性结合调控gadd45a
[0176]
为了确定bbox1-as1调节gadd45a表达的分子机制,检测bbox1-as1在细胞中的定位,发现bbox1-as1在细胞质和细胞核中均存在。rna pulldown实验结合质谱鉴定bbox1-as1内源性结合蛋白,在bbox1-as1的有义链上检测到hnrnpk的质谱肽,同时,rip实验进一步说明bbox1-as1在htr-8/svneo细胞中的hnrnpk免疫沉淀中特异性富集。使用qrt-pcr和
免疫蛋白印迹检测sihnrnpk是否引起gadd45a表达的变化,结果发现gadd45a在mrna水平和蛋白水平上表达明显降低。这些结果表明hnrnpk介导bbox1-as1调控gadd45a的表达(见图7)。
[0177]
2.8 bbox1-as1与hnrnpk结合促进gadd45a mrna稳定性
[0178]
进一步探究bbox1-as1促进gadd45a表达的潜在分子机制。双荧光素酶报告基因实验显示bbox1-as1不影响gadd45a的转录水平。放线菌酮(chx)实验发现过表达bbox1-as1并未影响放线菌酮处理的gadd45a蛋白稳定性。
[0179]
放线菌素d(actd)实验发现过表达bbox1-as1后gadd45a的mrna稳定性增强,此外,将敲减hnrnpk的htr-8/svneo、jar滋养细胞使用放线菌素d处理后,gadd45a mrna的稳定性减低。上述这些结果表明bbox1-as1可能通过与hnrnpk结合增强gadd45a mrna的稳定性(见图8)。
[0180]
2.9敲低hnrnpk对滋养细胞增殖、迁移和侵袭的影响
[0181]
进一步评估敲减hnrnpk后,对滋养细胞增殖、迁移和侵袭能力的影响。结果表明敲低hnrnpk可部分逆转bbox1-as1对滋养细胞增殖、迁移和侵袭的抑制作用(见图9)。
[0182]
2.10 bbox1-as1在rpl患者血清中表达升高
[0183]
进一步检测rpl患者血清中bbox1-as1的表达。经roc曲线分析显示血清中bbox1-as1具有较高的诊断效能,auc为0.8144(见图10)。
[0184]
综上,本发明实施例表明在rpl绒毛组织上调的bbox1-as1在体外调控滋养细胞的增殖、迁移和侵袭,并参与激活p38/jnk mapk信号通路。另外,本发明还研究了bbox1-as1通过结合蛋白hnrnpk来促进gadd45a表达,最终引起滋养细胞功能的改变,促进rpl的发生。最后在rpl血清中bbox1-as1表达升高,说明bbox1-as1作为rpl早期诊断标志物的潜在可能性。本研究中发现的bbox1-as1及其分子机制将有助于深入了解rpl发病机制,也将有助于为临床诊断、预防及治疗rpl提供潜在的标志物及治疗靶点。
[0185]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1