一种L-天冬氨酸α-脱羧酶及其应用
一种l-天冬氨酸
α-脱羧酶及其应用
技术领域
1.本发明属于酶工程和微生物工程技术领域,涉及一种高催化活性的l-天冬氨酸α-脱羧酶及其应用。
背景技术:
2.l-天冬氨酸α-脱羧酶(l-aspartate-α-decarboxylase,ec 4.1.1.11,简称adc),又称l-天冬氨酸l-脱羧酶,能够特异性识别l-天冬氨酸,催化其脱掉α-羧基生成β-丙氨酸。β-丙氨酸(β-alanine)又名3-氨基丙酸,是自然界中唯一存在的β型氨基酸,是一种非蛋白氨基酸。β-丙氨酸及其衍生物广泛应用于医药、美容、食品、饲料及化工等领域,市场需求量呈上升趋势。
3.β-丙氨酸合成方法主要有化学合成法和生物合成法。化学合成法是现在β
‑ꢀ
丙氨酸大规模生产的主要方法。其中丙烯酸法和丙烯腈法为国内厂家使用最广泛的方法,生产β-丙氨酸的转化率及纯度均达到了95%以上。但化学合成法需要在高温高压、强酸强碱等条件下进行,反应条件比较极端。相较于化学合成法,生物合成法具有副产物少,操作简便,绿色环保等优点。其中利用发酵法生产β
‑ꢀ
丙氨酸的底物来源丰富,但是微生物代谢网络复杂,副产物较多,产物不容易分离纯化。酶转化法生产β-丙氨酸生产强度高、绿色环保,是目前β-丙氨酸研究的热点。
4.l-天冬氨酸α-脱羧酶是酶法制备β-丙氨酸的关键酶。但是,用于催化生成β
‑ꢀ
丙氨酸的l-天冬氨酸α-脱羧酶普遍存在催化活性低,且具有机理性失活问题,限制了β-丙氨酸的生物法大规模制备。例如,李寅等人通过在e.coli bl21(de3) 表达系统中实现枯草芽孢杆菌来源l-天冬氨酸α-脱羧酶基因的高效异源表达,结果显示该酶发酵活力为2.09u/ml,转化催化l-天冬氨酸生成β-丙氨酸 178g/l。冯志彬等人通过在e.coli bl21(de3)中高效诱导表达特基拉芽孢杆菌(bacillus tequilensis)来源的l-天冬氨酸α-脱羧酶基因得到了可生产l-天冬氨酸α-脱羧酶的e.coli bl21(de3)基因工程菌,将此工程菌在2l体系中全细胞催化10h,其上清液中的β-丙氨酸产量仅为66.4g/l;王超等人通过在e.colibl21(de3)中高效诱导表达昆虫赤拟谷盗(tribolium castaneum)来源的l
‑ꢀ
天冬氨酸α-脱羧酶基因得到了可生产l-天冬氨酸α-脱羧酶的e.coli bl21(de3) 基因工程菌,结果显示该酶的比活力为0.29u/mg;将此工程菌全细胞催化50h,其酶转化上清液中的β-丙氨酸含量为143g/l。由于野生酶存在催化活性低且易失活等问题,因此转化过程中加酶量(或含酶的全细胞量)非常大,例如,周哲敏等人在10ml体系中利用od
600
=200的菌体进行全细胞催化l-天冬氨酸生成β-丙氨酸,导致成本偏高。此外,有研究者对l-天冬氨酸α-脱羧酶进行分子改造,虽然l-天冬氨酸α-脱羧酶的机理性失活问题得到了一定的缓解,稳定性得到了提高,但是突变酶与野生酶相比催化活力提高幅度非常有限,仍然没有解决加酶量大的问题。另外,需注意的是,加酶量大会向反应体系中引入更多的杂质,导致后续分离提取困难,进一步提高生产成本。因此,急需开发一种具有高催化活性的l-天冬氨酸α-脱羧酶以降低加酶量,提高β-丙氨酸的生产效率。
技术实现要素:
5.发明目的:本发明的目的是提供了一种高催化活性的l-天冬氨酸α-脱羧酶及其应用,以提高转化l-天冬氨酸脱羧制备β-丙氨酸的应用效果。
6.技术方案:本发明所述的一种高催化活性的l-天冬氨酸α-脱羧酶,所述l
‑ꢀ
天冬氨酸α-脱羧酶的氨基酸序列如seq id no.1所示。
7.在本发明的一种实施方式中,所述l-天冬氨酸α-脱羧酶来源于阿氏芽孢杆菌(bacillus aryabhattai)gel-09;所述阿氏芽孢杆菌(bacillus aryabhattai)gel-09 已于2017年6月9日保藏于中国典型培养物保藏中心,保藏编号为cctcc no: m 2017320,保藏地址为中国,武汉,武汉大学。
8.本发明还提供了编码上述l-天冬氨酸α-脱羧酶的基因。
9.在本发明的一种实施方式中,所述基因的核苷酸序列如seq id no.2所示。
10.本发明还提供了携带上述基因的重组质粒。
11.在本发明的一种实施方式中,所述重组质粒的载体为pet载体。
12.在本发明的一种实施方式中,所述重组质粒的载体为pet24a(+)载体。
13.本发明还提供了携带上述基因或上述重组质粒的宿主细胞。
14.在本发明的一种实施方式中,所述宿主细胞为大肠杆菌、芽孢杆菌或或酵母菌。
15.在本发明的一种实施方式中,所述宿主细胞为大肠杆菌e.coli bl21(de3)。
16.本发明还提供了上述l-天冬氨酸α-脱羧酶的制备方法,所述方法为将上述宿主细胞接种至发酵培养基中进行发酵。
17.本发明还提供了应用上述方法制备得到的l-天冬氨酸α-脱羧酶。
18.本发明还提供了上述l-天冬氨酸α-脱羧酶或上述基因或上述重组质粒或上述宿主细胞或上述制备方法或上述制备得到的l-天冬氨酸α-脱羧酶在水解l-天冬氨酸制备β-丙氨酸方面的应用。
19.本发明还提供了一种制备β-丙氨酸的方法,所述方法为将上述l-天冬氨酸α
‑ꢀ
脱羧酶或上述宿主细胞或上述制备得到的l-天冬氨酸α-脱羧酶加入l-天冬氨酸溶液中进行酶转化反应。
20.有益效果:本发明与现有技术相比,本发明的特点:1、本发明的l-天冬氨酸α-脱羧酶具有高催化活力,将携带本发明l-天冬氨酸α-脱羧酶的大肠杆菌摇瓶发酵36h,将破碎菌体上清液中的l-天冬氨酸α-脱羧酶进行纯化,纯化后l
‑ꢀ
天冬氨酸α-脱羧酶在底物为l-天冬氨酸时,纯酶比活力高达33.9u/mg;2、本发明的l-天冬氨酸α-脱羧酶非常稳定,该酶最适温度为75℃,在70℃保温12 h后的残留酶活为初始酶活的75%以上,具有良好的热稳定性;3、本发明的l
‑ꢀ
天冬氨酸α-脱羧酶用于l-天冬氨酸转化制备β-丙氨酸,在相同条件下转化效果优于枯草芽孢杆菌l-天冬氨酸α-脱羧酶;本发明的l-天冬氨酸α-脱羧酶具有适用于工业化生产及应用的潜力。
附图说明
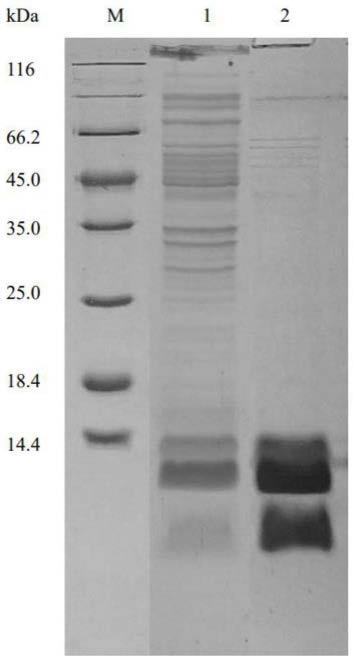
21.图1是本发明中重组菌e.coli bl21(de3)/pet24a(+)-pandba发酵液的破碎菌体上清液组分、上样样品组分以及纯酶组分的sds-page电泳结果示意图;其中,m为蛋白分子量标准;1为破碎菌体上清液组分;2为上样样品组分;3 为纯酶组分;
22.图2是本发明实施例中l-天冬氨酸α-脱羧酶在不同ph条件下的酶活变化对比图;
23.图3是本发明实施例中l-天冬氨酸α-脱羧酶在不同ph条件下保存6h后的酶活变化对比图;
24.图4是本发明实施例中l-天冬氨酸α-脱羧酶在不同温度条件下的酶活变化对比图;
25.图5是本发明实施例中l-天冬氨酸α-脱羧酶在不同温度条件下保存12h期间的酶活变化对比图;
26.图6是本发明实施例中l-天冬氨酸α-脱羧酶在不同金属螯合剂与金属离子条件下孵育1h后的酶活变化对比图。
具体实施方式
27.下面结合附图及实施例对本发明作进一步的说明。
28.下述实施例中涉及的大肠杆菌e.coli bl21(de3)购自北京索莱宝科技有限公司,阿氏芽孢杆菌cctcc no:m 2017320保存于中国典型培养物保藏中心,枯草芽孢杆菌168(atcc 23857),购于美国典型培养物保藏中心,pet24a(+) 载体购自novagen公司。
29.下述实施例中涉及的培养基如下:
30.lb液体培养基:酵母粉5.0g
·
l-1
、胰蛋白胨10.0g
·
l-1
、nacl 10.0g
·
l-1
。
31.lb固体培养基:酵母粉5.0g
·
l-1
、胰蛋白胨10.0g
·
l-1
、nacl 10.0g
·
l-1
、琼脂粉15g
·
l-1
。
32.tb培养基:甘油5.0g
·
l-1
、胰蛋白胨12.0g
·
l-1
、酵母粉24.0g
·
l-1
、 k2hpo4·
3h2o 16.4g
·
l-1
、kh2po
4 2.3g
·
l-1
。
33.下述实施例中涉及的检测方法如下:
34.l-天冬氨酸α-脱羧酶酶活的测定方法:
35.分别吸取500μl底物(所用底物为375mm,ph 6.5的l-天冬氨酸溶液)、 1.5ml 10mm ph为6.5的mes缓冲液加入到15ml的具塞试管中,混匀后置于37℃水浴锅中进行预热,10min后加入酶液500μl立即摇匀,37℃孵育10 min,利用高效液相色谱检测方法测定β-丙氨酸产物的生成量并计算酶活;
36.酶活力(u)定义为:在上述分析测定条件下,每分钟催化产生相当于1μmol β-丙氨酸的酶量定义为一个活力单位(1u)。
37.实施例1:编码本发明l-天冬氨酸α-脱羧酶的基因的扩增以及含有编码本发明l-天冬氨酸α-脱羧酶的基因的重组菌的构建:
38.具体步骤如下:
39.(1)、阿氏芽孢杆菌基因组dna的抽提:
40.将阿氏芽孢杆菌cctcc no:m 2017320接种lb液体培养基中,于37℃、 200rpm的条件下振荡培养12h,然后在10000rpm的条件下离心1min,收集菌体。将收集的菌体悬浮于200μl tris-edta缓冲液中,得到重悬液;先加入20μl 溶菌酶,于37℃下保温30min,然后加入5μl rna酶,于37℃下继续保温 30min,再加入30μl 10%的sds和15μl蛋白酶k,于37℃下保温60min,最后加入100μl nacl(5m)和80μl ctab,于65℃下保温20min;将上述反应液用700μl的酚:氯仿:异戊醇(25:24:1)进行抽提后,于12000rpm 的条件下离心,收集上清液;将上
清液用700μl的氯仿:异戊醇(24:1)抽提后,于12000rpm再次离心,收集上清液;将上清液与1400μl体积的冰异戊醇混合后,于-20℃沉淀30min,于12000rpm离心,得到沉淀;将沉淀用200μl 70%的乙醇清洗后,于12000rpm离心,收集沉淀;将沉淀用tris-edta缓冲液溶解,即得阿氏芽孢杆菌基因组dna;
41.(2)、编码阿氏芽孢杆菌l-天冬氨酸α-脱羧酶的基因的扩增:
42.pcr用引物:
43.pandba-f:5
’‑
catatgttcagaacaatgatg-3’(seq id no.3)
44.pandba-r:5
’‑
gaattcttataatatcgttcctgcaggtt-3’(seq id no.4)
45.利用上述引物,以(1)中提取的阿氏芽孢杆菌基因组为模板,pcr扩增l
‑ꢀ
天冬氨酸α-脱羧酶基因pandba;pcr反应在50μl体系中进行,反应条件为94℃预热4min变性,随后进入循环,于94℃加热变性30s后于56℃降温退火30s,然后升温至72℃延伸30s,一共循环30次;随后72℃保存10min后置于12℃保存;
46.将扩增得到的大小约400bp的pcr片段割胶回收,将回收产物与经双酶切 (nde i和ecor i)后pet24a载体进行连接,连接产物转化大肠杆菌jm109,转化产物涂布于含30ng
·
ml-1
卡那霉素的lb固体培养基,于37℃培养过夜,在lb固体培养基上挑取3个转化子,接入含有30ng
·
ml-1
卡那霉素的lb液体培养基培养,培养12h后提取质粒,将此质粒进行序列测定,结果表明此l-天冬氨酸α-脱羧酶基因全长为384bp个核苷酸(如seq id no.2所示),编码127 个氨基酸(如seq id no.1所示);
47.(3)、编码阿氏芽孢杆菌l-天冬氨酸α-脱羧酶的基因的验证
48.将测序正确的质粒热激转化e.coli bl21(de3)宿主菌,于含30ng/ml卡那霉素的lb固体培养基上于37℃培养过夜,挑选转化子,验证得到的重组菌 bl21(de3)/pet24a(+)-pandba。
49.对比例1:含有编码枯草芽孢杆菌l-天冬氨酸α-脱羧酶的基因的重组菌的构建
50.枯草芽孢杆菌l-天冬氨酸α-脱羧酶是目前已经报道的众多来源l-天冬氨酸α-脱羧酶中性能最为优秀的一种;该酶比活力和稳定性高,应用效果好,因此以该酶为对照进行对比研究。
51.步骤如下:
52.(1)、枯草芽孢杆菌基因组dna的抽提:
53.采用与实施例1中阿氏芽孢杆菌相同的培养和基因组抽提方法,抽提获得枯草芽孢杆菌基因组dna;
54.(2)、编码枯草芽孢杆菌l-天冬氨酸α-脱羧酶的基因的扩增:
55.pcr用引物:
56.pandbs-f:5
’‑
catatgtatcgaacaatgat-3’(seq id no.5)
57.pandbs-r:5
’‑
gaattc ctacaaaattgtacggg-3’(seq id no.6)
58.利用上述引物,以对比例1(1)中提取的枯草芽孢杆菌基因组为模板,pcr 扩增l-天冬氨酸α-脱羧酶基因pandbs:pcr反应条件同实施例1(2);
59.将扩增得到的大小约400bp的pcr片段割胶回收,将回收产物与经双酶切(nde i和ecor i)后pet24a载体进行连接,连接产物转化大肠杆菌jm109,转化产物涂布于含30ng
·
ml-1
卡那霉素的lb固体培养基,于37℃培养过夜,在lb固体培养基上挑取3个转化子,接入含
有30ng
·
ml-1
卡那霉素的lb液体培养基培养,培养12h后提取质粒,将此质粒进行序列测定,结果表明此l-天冬氨酸α-脱羧酶基因全长为384bp个核苷酸(如seqidno.7所示),编码127个氨基酸(如seqidno.8所示);
60.(3)、编码枯草芽孢杆菌l-天冬氨酸α-脱羧酶的基因的验证:
61.将测序正确的质粒热激转化e.colibl21(de3)宿主菌,于含30ng/ml卡那霉素的lb固体培养基上于37℃培养过夜,挑选转化子,验证得到的对比重组菌bl21(de3)/pet24a(+)-pandbs。
62.实施例2:不同l-天冬氨酸α-脱羧酶的制备及酶活力的检测:
63.具体步骤如下:
64.挑取实施例1制备得到的重组菌e.colibl21(de3)/pet24a(+)-pandba及与对比例1制备得到的重组菌e.colibl21(de3)/pet24a(+)-pandbs单菌落分别接种到lb液体培养基中,于37℃、200rpm的条件下摇床培养8h,得到种子液;再分别取2.5ml种子液添加到tb培养基中,于37℃、200rpm的条件下摇床培养3h后,加入终浓度为13.3g/l乳糖继续诱导培养36h,得到重组菌e.colibl21(de3)/pet24a(+)-pandba发酵得到的发酵液a及e.colibl21(de3)/pet24a(+)-pandbs发酵得到的发酵液b;
65.将发酵液a和b于8000rpm的条件下离心10min,得到发酵菌体a和b,检测破碎菌体上清液a和b中的l-天冬氨酸α-脱羧酶酶活,检测结果为:破碎菌体上清液a中的l-天冬氨酸α-脱羧酶酶活为12.34u/ml、破碎菌体上清液b中的l-天冬氨酸α-脱羧酶酶活为6.44u/ml;
66.可见,在相同条件下,e.colibl21(de3)/pet24a(+)-pandba菌株发酵产l-天冬氨酸α-脱羧酶酶活比对比菌株更高。
67.实施例3:氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶pandba的纯化:
68.具体步骤如下:
69.通过硫酸铵分级沉淀的方法确定30%(w/v)的硫酸铵可使大部分l-天冬氨酸α-脱羧酶盐析,因此,在实施例2得到的破碎菌体上清液a中缓慢加入30%(w/v)的硫酸铵进行盐析,12h后,于8000rpm、4℃的条件下离心10min,得到沉淀;用适量缓冲液a(100mmpbs,ph7.0)将沉淀溶解,4℃透析12h后经膜过滤(0.22μm),得到上样样品;将deae阴离子交换柱用缓冲液a平衡后上样,依次用缓冲液a、含0~1mnacl的缓冲液a、含1m氯化钠的缓冲液a洗脱结合蛋白,流速为1ml/min,得到纯酶;
70.检测纯酶的酶活并收集酶活力组分进行蛋白电泳分析(蛋白电泳分析以购自碧云天生物技术公司的蛋白质分子量标准(14.4-116kd)为标准品),结果显示,最终获得的氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶纯酶的比酶活为33.9u/mg,纯化倍数为3.8,得率为21%(具体可见表1),氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶纯化后为一条带,分子量约为13.7kda(具体可见图1);
71.其中,比酶活是指每毫克酶蛋白所具有的酶活力,单位是u/mg,其计算公式为:比酶活=酶活(u)/总蛋白(mg);
72.纯化倍数是指纯化后酶的比活力比纯化前酶的比活力提高的倍数,其计算方法/公式为:纯化倍数=纯化后酶的比活力/纯化前酶的比活力;
73.回收率是指某纯化步骤后酶的总活力与该纯化步骤前酶的总活力之比,其计算方法/公式为:回收率=某纯化步骤后酶的总活力/该纯化步骤前酶的总活力。
74.表1氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶的纯化
75.纯化步骤总蛋白(mg)酶活(u)比活力(u/mg)纯化倍数回收率(%)发酵上清液485.84395.79.01100上样样品101.51155.211.381.326纯酶27.3926.633.93.821
76.对比例2:枯草芽孢杆菌l-天冬氨酸α-脱羧酶pandbs的纯化
77.采用与实施例3中重组阿氏芽孢杆菌l-天冬氨酸α-脱羧酶pandba相同的纯化方法,纯化获得枯草芽孢杆菌l-天冬氨酸α-脱羧酶;
78.检测纯化过程收集样品的酶活并收集酶活力组分进行蛋白电泳分析和蛋白浓度测定,结果显示,枯草芽孢杆菌l-天冬氨酸α-脱羧酶pandbs纯酶的比酶活为15.6u/mg。
79.实施例4:氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶pandba的酶学性质研究:
80.具体步骤如下:
81.(1)、氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶的最适ph及ph稳定性:
82.配制ph值分别为3.5、4.0、4.5、5.0的醋酸缓冲液及5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5的na2hpo
4-柠檬酸缓冲液代替l-天冬氨酸α-脱羧酶活力测定方法2中的缓冲液,在37℃下利用高效液相色谱方法测定l-天冬氨酸α-脱羧酶活力,以酶活最高的为100%,其余酶活与之相比计算相对酶活,以考察酶的最适作用ph(检测结果见图2);
83.配制ph值分别为3.5、4.0、4.5、5.0的醋酸缓冲液及5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5的na2hpo
4-柠檬酸缓冲液代替l-天冬氨酸α-脱羧酶活力测定方法2中的缓冲液,将纯化得到的酶分别在上述缓冲体系下于4℃保存6h后,在37℃下利用高效液相色谱法测定l-天冬氨酸α-脱羧酶活力,以初始酶活为100%,保存后酶活与之相比计算残留酶活,以考察其ph稳定性(检测结果见图3);
84.由图2可知,氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶的最适ph为5.5,这一最适ph与大多数其他种类的细菌来源的l-天冬氨酸α-脱羧酶非常接近,当ph为5.0~6.5时,氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶比较稳定,保存了最高酶活力的80%,但是,当ph低于5.0或者高于6.5时,氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶的活性下降很快;
85.如图3所示,在ph为5.0~6.5的条件下保存一段时间后,氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶比较稳定,说明其具有较宽的ph适应范围;
86.(2)、氨基酸序列如seqidno.1所示的l-天冬氨酸α-脱羧酶的最适温度及温度稳定性:
87.分别在30℃、37℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃、90℃、95℃的条件下利用酶活测定方法2测定l-天冬氨酸α-脱羧酶酶活,以酶活最高的为100%,其余酶活与之相比计算相对酶活,以考察酶的最适作用温度(检测结果见图4);
88.将纯酶分别放置于30℃、37℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃和85℃条件下保温12h,在37℃水浴中反应10min后,加入100μlnaoh(1mol/l)终止反应,每个温度做三组平行实验;利用酶活测定方法2计算相对酶活,以放置0h的酶液的酶活为
100%,保温后酶活与之相比计算残留酶活,以考察其温度稳定性(检测结果见图5);
89.由图4可知,氨基酸序列如seq id no.1所示的l-天冬氨酸α-脱羧酶的最适温度为75℃,并且在65℃时仍具有85%的活性;
90.由图5可知,氨基酸序列如seq id no.1所示的l-天冬氨酸α-脱羧酶在70℃保温12h后,酶活仍然保留75%以上;
91.(3)、金属螯合剂与金属离子对氨基酸序列如seq id no.1所示的l-天冬氨酸α-脱羧酶的影响:
92.将金属离子cu
2+
,zn
2+
,fe
2+
,ca
2+
,mn
2+
,co
2+
和mg
2+
及金属螯合剂edta 母液分别加入试管中使金属离子cu
2+
,zn
2+
,fe
2+
,ca
2+
,mn
2+
,co
2+
和mg
2+
及金属螯合剂edta母液在试管中的终浓度分别为1mm和5mm,得到混合液,在37℃、ph 6.0条件下,以不加入金属离子和金属螯合剂的样品(control组) 测定的酶活力为100%,其余酶活力与之相比计算l-天冬氨酸α-脱羧酶在不同金属螯合剂与金属离子下的相对酶活力(结果见表2);
93.由表2可知,大多数加入金属离子的酶活测定结果与control组相差不大,只有ca
2+
、mn
2+
、fe
2+
的酶活有了明显提高,证明ca
2+
、mn
2+
、fe
2+
对氨基酸序列如seq id no.1所示的l-天冬氨酸α-脱羧酶的催化反应有一定的促进作用。
94.表2金属离子和金属螯合剂对酶活力的影响
95.金属离子或螯合剂(1mm)相对活性金属离子或螯合剂(5mm)相对活性对照100control100cu
2+
101cu
2+
74zn
2+
104zn
2+
82fe
2+
107fe
2+
132ca
2+
109ca
2+
124mn
2+
112mn
2+
124co
2+
102co
2+
101mg
2+
109mg
2+
108edta100edta80
96.对比例3:枯草芽孢杆菌l-天冬氨酸α-脱羧酶pandbs的酶学性质分析:
97.采用与实施例4中相同的分析方法,对枯草芽孢杆菌l-天冬氨酸α-脱羧酶酶学性质进行分析;
98.结果显示,枯草芽孢杆菌l-天冬氨酸α-脱羧酶pandbs纯酶的最适ph为 6.0,最适温度为60;在70℃保温12h后,酶活会快速下降至20%以下。
99.实施例5:氨基酸序列如seq id no.1所示的l-天冬氨酸α-脱羧酶pandba 的转化应用:
100.具体步骤如下:
101.取20μl甘油管保藏的菌液至10ml lb种子培养基内,在37℃,200rpm 条件下培养8h-10h;培养结束后,以5%(v/v)的转接量转接至tb发酵培养基中进行全细胞催化反应;通过分批投料的方式添加底物l-天冬氨酸,并控制反应温度为37℃,初始ph为7.0,经过18h的转化后,使用hplc测定样品中β-丙氨酸的含量,通过产物的生成计算l-天冬氨酸的摩尔转化率;转化检测结果为:产物浓度为197.9g/l,的摩尔转化率为98.54%。
102.对比例4:枯草芽孢杆菌l-天冬氨酸α-脱羧酶pandbs的转化应用:
103.采用与实施例5中相同的转化方法,对枯草芽孢杆菌l-天冬氨酸α-脱羧酶应用性能进行分析;转化检测结果为:反应18h,产物浓度为144.9g/l,摩尔转化率为80.20%。
104.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1