三种肺泡结构细胞与胶原共同三维立体培养模型的方法与流程
1.本发明属于肺损伤体外研究模型技术领域,具体涉及三种肺泡结构细胞与胶原共同三维立体培养模型的方法。
背景技术:
2.细胞三维立体培养技术应用已经比较成熟,不同于平板二维培养,它可以模拟类似活体内组织,进行更为接近生理病理状态的研究。但目前所报道的三维立体培养多为某种特定组织细胞在不同基质中进行三维立体培养,没有把某种组织的完整结构模拟出来。肺泡组织是由肺泡上皮细胞构成的气体交换面、成纤维细胞和细胞基质胶原等构成的间质层(中间层)、另外一面是血管内皮细胞构成的气血交换面,完整的肺泡结构必须包含上述三个细胞和基质成分。还有某些研究采用其它构架来进行三维结构培养,构架材料不同,有些不是人体成分,尚未见到把肺泡结构所需的三种细胞混合有序培养于基质胶原中体外模拟肺泡损伤和炎症研究的报道。
3.在肺损伤病理生理过程中,肺或全身感染(如新冠病毒,细菌等)可以破坏上皮结构,而炎性介质、细胞因子风暴可以损伤内皮结构,这些细胞受损后会释放多种炎性因子和组织蛋白酶,引起肺泡结构的支架-基质降解破坏,整个肺泡结构遭到毁灭性的损伤,发生气血交换障碍、肺水肿、呼吸衰竭。因此模拟完整肺泡结构的模型是最为理想的研究肺损伤的体外研究模型。
技术实现要素:
4.本发明的目的在于提供三种肺泡结构细胞与胶原共同三维立体培养模型的方法,解决了现有三维立体培养方法不能模拟肺泡组织完整结构的问题。
5.本发明所采用的技术方案是:三种肺泡结构细胞与胶原共同三维立体培养模型的方法,包括以下步骤:
6.步骤1、向已灭菌的培养板中各孔移入肺泡上皮细胞混悬液,静置观察细胞贴附在孔底后,移液枪吸取上清培养液;
7.步骤2、向位于冰盒中的离心管内加入naoh,之后加入i型胶原醋酸溶液混匀,再加入dmem混匀,形成dmem等渗等离子胶原溶液;
8.步骤3、向步骤2的离心管内加入成纤维细胞混悬液混匀,取成纤维细胞-胶原溶液分配于步骤1的培养板孔内,室温静置观察胶原溶液凝固形成三维立体成纤维细胞-肺泡上皮细胞-胶原;
9.步骤4、向步骤3的培养板孔内加入血管内皮细胞混悬液于已经凝固的成纤维细胞-肺泡上皮细胞-胶原上面,形成血管内皮细胞层面,待血管内皮细胞贴于胶原后,用消毒药铲将胶原与培养板分离并浸漂在培养液中培养。
10.本发明的特点还在于,
11.步骤1中移入的肺泡上皮细胞混悬液为0.1-0.5ml,细胞浓度为1
×
105/ml。
12.步骤2中加入的naoh浓度为0.1mol/l,i型胶原醋酸溶液中i型胶原的浓度为5mg/ml、醋酸溶液的浓度为0.1mol/l,加入的dmem为5
×
dmem;naoh、i型胶原醋酸溶液与5
×
dmem的体积比为1:3:0.8。
13.步骤3中加入的成纤维细胞混悬液为3100-7460ul,细胞浓度为5
×
105/ml。
14.步骤3取0.1-0.6ml成纤维细胞-胶原溶液分配于步骤1的培养板孔内中。
15.步骤4中加入的血管内皮细胞混悬液为0.1-0.5ml,细胞浓度为1
×
105/ml。
16.步骤4中待血管内皮细胞贴于胶原后,再加入0.2-0.9ml无血清培养液,用消毒匙铲将胶原与培养板分离并浸漂在培养液中培养。
17.本发明的有益效果是:本发明的三种肺泡结构细胞与胶原共同三维立体培养模型的方法,建立的模型最符合肺泡组织基本结构,可以用来研究肺损伤时细胞之间的互相作用,以及对炎症的促进或抑制保护机制。在共同三维立体培养条件下,细胞分裂、增值近似于体内状态,模拟各种损伤因子加入培养基中,可以观察到共同受到刺激后,不同的细胞对刺激反应不完全一致;可以观察药物对炎症因子所诱导的肺组织损伤保护作用。
附图说明
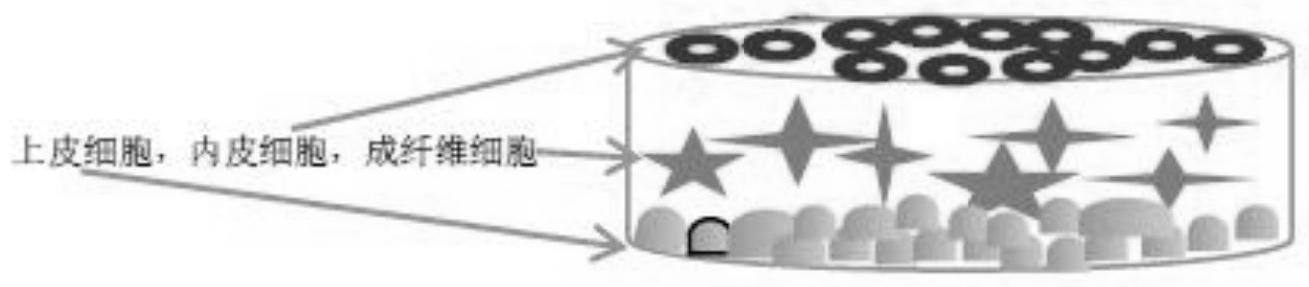
18.图1是本发明得到的肺泡组织的结构示意图;
19.图2是本发明得到的三维立体培养的肺泡组织中内皮细胞上层的倒置显微镜下图像;
20.图3是本发明得到的三维立体培养的肺泡组织中间质层成纤维细胞的倒置显微镜下图像;
21.图4是本发明得到的三维立体培养的肺泡组织中底层上皮细胞的倒置显微镜下图像。
具体实施方式
22.下面结合附图以及具体实施方式对本发明进行详细说明。
23.本发明提供了一种三种肺泡结构细胞与胶原共同三维立体培养模型的方法,包括以下步骤;
24.步骤1、用灭菌的12、48或96孔细胞培养板,每孔移入已经制备好的人ⅱ型肺泡上皮细胞(hpaeic)混悬液0.1-0.5ml,细胞浓度为1
×
105/ml,培养箱内静置2-3h,观察细胞贴附在孔底后,移液枪吸取上清培养液。
25.步骤2、此步骤需在冰盒操作,取naoh(0.1m)300ul(用于中和胶原中乙酸),置于离心管内,然后取900ul 5mg/ml i型胶原醋酸(0.1m)溶液,混匀,再加入5
×
dmem 240ul,混匀,形成1
×
dmem等渗等离子胶原溶液。其中,naoh、i型胶原醋酸溶液与5
×
dmem的体积比为300ul:900ul:240ul,即1:3:0.8,此比例制成胶原溶液浓度为3.4mg/ml,为等渗等离子胶原溶液,可按照需要制成所需胶原溶液量,参照此比例分别加入并混合。1:3的0.1m naoh与0.1m胶原醋酸溶液中和后ph为7.0左右。
26.步骤3、在步骤2已经制成的等离子等渗胶原液离心管内,加入人胚肺成纤维细胞(hfl,细胞浓度为5
×
105/ml)混悬液3100-7460ul并混匀,使细胞混合胶原溶液中胶原浓度为0.5-1mg/ml,最终成纤维细胞浓度为2-4
×
105/ml。取0.1-0.6ml成纤维细胞-胶原溶液,
分配于已经含有上皮细胞的培养板孔内,室温静置约20-30分钟后,观察胶原溶液已经凝固,上皮细胞也嵌入胶原底层,形成三维立体成纤维细胞-肺泡上皮细胞-胶原。
27.步骤4、在步骤3完成的含有胶原-细胞三维培养的板孔内,根据培养板孔径,加入人肺微血管内皮细胞(hlmvec)(1
×
105/ml)混悬液0.1-0.5ml于已经凝固的成纤维细胞-肺泡上皮细胞-胶原上面,形成血管内皮细胞层面。待血管内皮细胞贴于胶原后,约2-3h,再加入0.2-0.9ml无血清培养液。用消毒匙铲分离三维胶,使其浸漂在培养液中,四面均可以接触培养液;也可以将三维胶原移到100mm培养皿中,该皿含有3-5ml预置的无血清培养基,使其浸漂于较大的培养皿中继续在37℃及5%co2箱内培养,每皿可以放置3个平行胶原。在转移胶原的过程中注意使血管内皮细胞或肺泡上皮细胞统一面向上,以便有序观察。
28.其中,人胚肺成纤维细胞(hfl),人肺微血管内皮细胞(hlmvec),人ⅱ型肺泡上皮细胞(hpaeic),均可以从atcc细胞库购得。在不同培养基进行平板培养,待融合增值后以0.25%胰酶消化,离心取得不同细胞浓度的细胞混悬液待用。
29.通过上述方式,本发明的三种肺泡结构细胞与胶原共同三维立体培养模型的方法,得到的肺泡组织的结构模型如图1所示,圆柱体代表混合立体培养胶原,表层是肺血管内皮细胞,为血气交换层面,直接接触血液进行物质和气体交换;中间层是基质或间质层,为肺成纤维细胞在胶原内形成星状形态,这和活体内肺泡间质的结构相似,气体和物质交换必须通过这一层才能到内层内皮血液或上皮外界,它是肺泡结构的支撑组织;底层是胶原最下面,为平面生长密集排列的肺泡上皮细胞层,也是肺内气体进入血液的必经之路,是接触外界的上皮结构,也是最容易受到侵入的病原体感染损伤的外层结构。建立的三维立体培养模型结构最符合肺泡组织基本结构,在实验中按照不同设计,在培养基中加入所需细胞因子、刺激因子、病原体、药物等,可观察细胞间对各种刺激的反应,对胶原收缩的影响,对基质金属蛋白酶的分泌活化和影响,对基质降解的影响。研究肺损伤时细胞之间的互相作用,以及对炎症的促进或抑制保护机制,在共同三维立体培养条件下,细胞分裂,增值近似于体内状态。模拟各种损伤因子加入培养基中,可以观察到共同受到刺激后,不同的细胞对刺激反应不完全一致,有的可以产生促炎因子,有的则产生抑制炎症因子,这些因子作用与单独一种细胞培养时不同,有些可能协同,有的可能拮抗,尤其对基质的作用反应差异很大。我们已经观察到内皮细胞可以抑制成纤维细胞介导的胶原收缩和降解,这对肺纤维化形成过程有明显影响;可以观察药物对炎症因子所诱导的肺组织损伤保护作用,我们已经观察到糖皮质激素可以保护基质降解有利于炎症改善,渗出水肿改善,和拮抗纤维化形成。
30.实施例1
31.步骤1、用灭菌的96孔细胞培养板,每孔移入已经制备好的人ⅱ型肺泡上皮细胞(hpaeic)混悬液0.1ml,细胞浓度为1
×
105/ml,培养箱内静置2h,观察细胞贴附在孔底后,移液枪吸取上清培养液。
32.步骤2、此步骤需在冰盒操作,取naoh(0.1m)300ul(用于中和胶原中乙酸),置于离心管内,然后取900ul 5mg/ml i型胶原醋酸(0.1m)溶液,混匀,再加入5
×
dmem 240ul,混匀,形成1
×
dmem等渗等离子胶原溶液体。
33.步骤3、在步骤2已经制成的等离子等渗胶原液离心管内,加入人胚肺成纤维细胞(hfl)(5
×
105/ml)混悬液5800ul,混匀,使终胶原浓度为0.7mg/ml。取0.3ml成纤维细胞-胶
原溶液,分配于已经含有上皮细胞的培养板孔内,室温静置约20分钟后,观察胶原溶液已经凝固,形成三维立体胶原。
34.步骤4、在步骤3完成的含有胶原-细胞三维培养的板孔内,在含有胶原细胞三维培养的板孔内,加入人肺微血管内皮细胞(hlmvec)(1
×
105/ml)混悬液0.1ml,形成血管内皮细胞层面。静置培养箱内2h后,待血管内皮细胞贴于胶原表层后,再加入无血清dmem培养液0.7ml,用消毒匙铲分离三维胶,使其浸漂在培养液中,四面均可以接触培养液。
35.实施例2
36.步骤1、用灭菌的48孔细胞培养板,每孔移入已经制备好的人ⅱ型肺泡上皮细胞(hpaeic)混悬液0.2ml,细胞浓度为1
×
105/ml,培养箱内静置2.5h,观察细胞贴附在孔底后,移液枪吸取上清培养液。
37.步骤2、此步骤需在冰盒操作,取naoh(0.1m)300ul(用于中和胶原中乙酸),置于离心管内,然后取900ul 5mg/ml i型胶原醋酸(0.1m)溶液,混匀,再加入5
×
dmem 240ul,混匀,形成1
×
dmem等渗等离子胶原溶液体。
38.步骤3、在步骤2已经制成的等离子等渗胶原液离心管内,加入人胚肺成纤维细胞(hfl)(5
×
105/ml)混悬液3100ul,混匀,使终胶原浓度为1.0mg/ml。取0.1ml成纤维细胞-胶原溶液,分配于已经含有上皮细胞的培养板孔内,室温静置约25分钟后,观察胶原溶液已经凝固,形成三维立体胶原。
39.步骤4、在步骤3完成的含有胶原-细胞三维培养的板孔内,在含有胶原细胞三维培养的板孔内,加入人肺微血管内皮细胞(hlmvec)(1
×
105/ml)混悬液0.2ml,形成血管内皮细胞层面。静置培养箱内2.5h后,待血管内皮细胞贴于胶原表层后,再加入无血清dmem培养液0.2ml,用消毒匙铲分离三维胶,使其浸漂在培养液中,四面均可以接触培养液。
40.实施例3
41.步骤1、用灭菌的12孔细胞培养板,每孔移入已经制备好的人ⅱ型肺泡上皮细胞(hpaeic)混悬液0.5ml,细胞浓度为1
×
105/ml,培养箱内静置3h,观察细胞贴附在孔底后,移液枪吸取上清培养液。
42.步骤2、此步骤需在冰盒操作,取naoh(0.1m)300ul(用于中和胶原中乙酸),置于离心管内,然后取900ul 5mg/ml i型胶原醋酸(0.1m)溶液,混匀,再加入5
×
dmem 240ul,混匀,形成1
×
dmem等渗等离子胶原溶液体。
43.步骤3、在步骤2已经制成的等离子等渗胶原液离心管内,加入人胚肺成纤维细胞(hfl)(5
×
105/ml)混悬液7460ul,混匀,使终胶原浓度为0.5mg/ml。取0.6ml成纤维细胞-胶原溶液,分配于已经含有上皮细胞的培养板孔内,室温静置约30分钟后,观察胶原溶液已经凝固,形成三维立体胶原。
44.步骤4、在步骤3完成的含有胶原-细胞三维培养的板孔内,在含有胶原细胞三维培养的板孔内,加入人肺微血管内皮细胞(hlmvec)(1
×
105/ml)混悬液0.5ml,形成血管内皮细胞层面。静置培养箱内3h后,待血管内皮细胞贴于胶原表层后,再加入无血清dmem培养液0.9ml,用消毒匙铲分离三维胶,使其浸漂在培养液中,四面均可以接触培养液。
45.结果分析
46.在倒置显微镜下,如图2所示,三维立体培养胶最表层,内皮细胞在胶原最上层,呈现正常内皮结构,细胞下部分嵌入胶原内,上部分暴露于液面,细胞形成类似血管的管状结
构;倒置显微镜再往下调聚焦,如图3所示,可以观察到,混合培养的胶原中间层,成纤维细胞呈星状结构,形成胶原基质,与肺泡壁间质层非常相似;倒置显微镜下再往下调焦距,如图4所示,观察到上皮细胞位于胶原底层,已经与胶原紧密结合形成类似上皮层结构。这样三层肺泡结构完全呈现在一个三维立体培养胶原,如果受到损伤因子攻击,有些可能作用于内皮细胞,有些可能作用于上皮细胞,有的可能直接作用于间质纤维细胞,损伤降解基质从而导致肺泡完整性破坏。也可以用此胶原进行组织切片观察病理结构的改变和对细胞凋亡的影响。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1