1.本技术涉及一种使用动物尸体制备基质胶的方法,属于生物化学技术领域。
背景技术:2.基质胶在生物学实验中具有广泛应用,可用于细胞培养板的处理以促进细胞的粘附;可用于铺transwell小室以研究肿瘤细胞的侵袭能力;可用于细胞系或者病人来源的细胞的3d培养,生成类器官以用于抗肿瘤药物的筛选。
3.基质胶是由可溶性细胞外基质组成的复合物,主要包括胶原蛋白、层纤黏连蛋白、巢蛋白等。目前基质胶的主要来源ehs(engelbreth-holm-swarm)基质胶。ehs基质胶是由ehs细胞提取而来的。ehs细胞是不可体外培养的细胞,因此不方便大规模扩增,这给基质胶的生产带来很大的不便。同时ehs基质胶的制备需要在小鼠体内接种骨肉瘤,对于动物福利是一个不利的因素。
4.目前基质胶的主要制备材料是ehs细胞瘤,也有报道使用肌肉、皮肤、肝脏、子宫瘤等组织作为起始材料制备基质胶。在此之前没有使用整只动物尸体作为起始材料制备基质胶的报告。很多动物实验只需要取动物的部分组织或血液,动物尸体的其余部分需进行无害化处理,费事费力,因此,寻求一种更好的处理动物尸体的方法有着重要的意义。
技术实现要素:5.本发明的目的是提供一种使用动物尸体制备基质胶的方法,本发明方法取材方便,基质胶产量高。
6.本发明采用的技术手段为:
7.一种使用动物尸体制备基质胶的方法,其步骤包括:
8.(1)对动物尸体进行消毒处理;
9.(2)去除动物尸体的皮肤和内脏,将其余剩余动物组织用液氮冷冻后粉碎;
10.(3)抽提细胞外基质组分,使用硫酸铵沉淀细胞外基质组分;
11.(4)重新溶解细胞外基质组分,离心,取上清液,上清液即为基质胶。
12.优选的,步骤(3)中抽提细胞外基质组分具体指待液氮挥发完全后,在粉碎的动物组织中加入预冷的pbs溶液,4℃搅拌过夜,离心,弃沉淀,取上清。
13.优选的,步骤(3)中使用硫酸铵沉淀去除细胞外基质组分的杂质具体为在上清中缓慢添加饱和硫酸铵溶液,至体系中的硫酸铵浓度为10-30%,离心,取沉淀,即为细胞外基质组分。其中硫酸铵浓度10%是指每100ml溶液中含有10g硫酸铵。
14.优选的,步骤(4)具体为:将沉淀使用pbs溶解,离心去除不溶物,上清液即为基质胶。
15.优选的,步骤(4)中上清液再进行透析处理。
16.优选的,步骤(1)具体为将动物尸体使用75%乙醇浸泡1分钟以上。
17.优选的,还包括步骤(5):对上清液进行蛋白质定量,控制蛋白质浓度在2~30mg/
ml。
18.本发明方法可以用动物实验中剩下的动物尸体来制备基质胶,实现动物尸体的再利用。在基质胶产量要求大的时候,也可以饲养动物来制备基质胶。本发明方法取材方便,基质胶产量高,而且基质胶性能满足3d细胞培养要求。使用本发明方法,一只小鼠能得到约10ml基质胶,一只大鼠能制备得到50ml基质胶。
附图说明
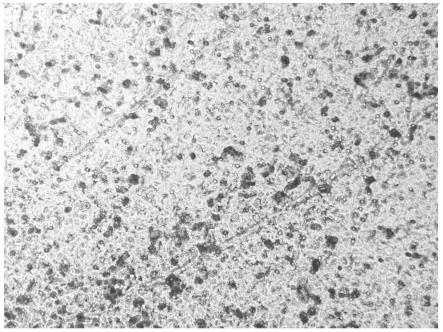
19.图1是本发明制备的基质胶用于细胞侵袭实验的结果。
20.图2是本发明制备的基质胶用于3d细胞培养的实验结果。
具体实施方式
21.实施例1
22.取一只8周龄的balb/c小鼠,称重23克,二氧化碳窒息处理后,剥去皮毛,清理掉内脏,剩余部分约16克。将小鼠尸体使用手术剪刀剪碎,在液氮速冻,使用研钵小心研磨成粉末。液氮挥发完之后,加入32ml预冷的pbs溶液,4℃搅拌过夜以抽提细胞基质蛋白。8000g离心后,弃沉淀。上清慢慢添加饱和硫酸铵至20%饱和度,4℃静置沉淀30分钟,8000g离心收集沉淀。沉淀用8mlpbs溶解,使用7kd的透析袋,透析过夜。换透析液,使用dmem高糖培养基继续透析过夜。超净台中在冰上,将基质胶分装至离心管,bca法测蛋白浓度8.7mg/ml,基质胶冻于-20℃备用。
23.实施例2
24.取一只8周龄的sd鼠,称重232克,二氧化碳窒息处理后,剥去皮毛,清理掉内脏,剩余部分约137克。将小鼠尸体使用液氮粉碎机粉碎。液氮挥发完之后,加入270ml预冷的pbs溶液,4℃搅拌过夜以抽提细胞基质蛋白。8000g离心后,弃沉淀。上清慢慢添加饱和硫酸铵至20%饱和度,4℃静置沉淀30分钟,8000g离心收集沉淀。沉淀用40mlpbs溶解,使用7kd的透析袋,透析过夜。换透析液,使用dmem/f12培养基继续透析过夜。超净台中在冰上,将基质胶分装至离心管,bca法测蛋白浓度15.3mg/ml冻于-20℃备用。
25.实施例3
26.hepg2细胞生长至汇合度60%~80%,pbs轻柔润洗3遍,更换无血清培养基,置于37℃、5%co2饱和湿度的细胞培养箱内继续培养24h(血清饥饿);实施例1制备的小鼠来源的基质胶在4度解冻。transwell上室加入1:8稀释的基质胶(用无血清的dmem培养基稀释)70μl,置于37℃、5%co2饱和湿度的细胞培养箱内孵育8h后,弃上清,用pbs轻柔漂洗2遍;每孔加入100μl无血清dmem培养基于37℃水化3~4h;hepg2细胞弃培养基,pbs轻柔润洗3遍后,用胰蛋白酶消化细胞;终止消化后制备并收集单细胞悬液,1500rpm离心3min;弃上清,用无血清dmem培养基重悬细胞,血球计数板计数细胞后,用无血清dmem培养基调整细胞浓度为2.5
×
104个细胞/ml。transwell上室加入200μl的细胞悬液,置于600μl含20%血清培养基的transwell下室中,于37℃、5%co2饱和湿度的细胞培养箱内继续培养24h;取出transwell上室,pbs漂洗后用棉签轻柔的将小室内部未迁移的细胞擦去,置于4%多聚甲醛中固定15min后,用0.1%的结晶紫染液室温染色30min,用pbs充分漂洗。各组小室于200
×
倒置相差显微镜下观察,随机拍照,并计数迁移的细胞数目(图1)。平均迁移的细胞数为137
±
22。
27.实施例4
28.24孔细胞培养板、移液枪头置冰上预冷,基质胶置冰上或4℃缓融,取对数生长期的hepg2细胞,pbs轻柔润洗后,用胰蛋白酶消化细胞,终止消化后制备并收集单细胞悬液,1500rpm离心3min;弃上清,用dmem完全培养基重悬细胞,血球计数板计数细胞后,用调整细胞浓度为1.5
×
105个细胞/ml。取缓融的实施例2制备的基质胶和调整好浓度的单细胞悬液1:1冰上轻轻混匀,用预冷的200μl移液枪头取40~50μl上述混匀单细胞悬液垂直滴于预冷24孔板中,使其形成拱型细胞液滴,于37℃、5%co2饱和湿度的细胞培养箱内稳定30min后,每孔加入1~2ml dmem完全培养基继续培养,每天观察并拍照记录。图2为第四天的3d培养结果。
29.上面结合附图和具体的实施案例对本发明的实施方式进行了进一步的说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
