一种基于脂肪酸和油脂促进柚皮素合成的方法及其应用
1.本发明涉及一种基于脂肪酸和油脂促进柚皮素合成的方法及其应用,属于生物工程技术 领域。
背景技术:
2.(2s)-柚皮素((2s)-naringenin)是一种天然的黄酮类化合物,普遍存在于高等植物中,具有 抗氧化和抗炎等生理活性,近年来,(2s)-柚皮素广泛应用于食品、药品和化妆品领域等。由 于(2s)-柚皮素具有2-苯基色原酮母核c
6-c
3-c6的基本结构,经过羟基化,甲基化和异戊烯基 化等修饰,可以用于合成其他重要的黄酮类化合物,是重要的平台化合物,因此(2s)-柚皮素 的合成越来越受到人们的关注。由于微生物具有生长迅速、不受季节和区域限制、生产效率 高、产物单一且提取过程相对简单、绿色环保等优势,微生物法合成高附加值天然产物越来 越受到研究者们的关注。近年来,利用微生物法合成(2s)-柚皮素越来越受到人们的青睐。
3.(2s)-柚皮素的合成是以对香豆酸为前体,在4-香豆酸:coa连接酶(4-coumarate:coaligase,4cl)催化下,生成对香豆酰辅酶a,对香豆酰辅酶a与3分子的丙二酰辅酶a在查 尔酮合成酶(chalcone synthase,chs)催化下转化为柚皮素查尔酮,柚皮素查尔酮在查尔酮异 构酶(chalcone isomerase,chi)的催化下转化为柚皮素。由于该合成过程需要3分子的丙二酰 辅酶a,而丙二酰辅酶a在细胞质中浓度较低,因此限制了相关衍生物的高效合成。近年来, 学者们尝试通过多种途径提高微生物细胞内丙二酰辅酶a的量,krivoruchko a等通过提高细 胞内乙酰辅酶a的含量促进丙二酰辅酶a的形成,miyahisa等通过过表达谷氨酸棒状杆菌 (corynebacterium glutamicum)由accbc和dtsr1基因编码的两个乙酰辅酶a羧化酶亚基大幅 提高胞内丙二酰辅酶a的浓度,使柚皮素和生松素产量达到60mg/l。
4.乙酰辅酶a是丙二酰辅酶a的直接合成前体,提高乙酰辅酶a的浓度将有助于提高丙 二酰辅酶a的合成。在酿酒酵母中,活化后的脂肪酸分别在脂酰辅酶a氧化酶fox1p,双功 能的羟酰辅酶a脱氢酶/烯酰辅酶a水合酶fox2p和乙酰辅酶a酰基转移酶fox3p催化下生 成脂酰辅酶a和乙酰辅酶a。由于乙酰辅酶a是过氧化物酶体中脂肪酸β氧化过程的产物, 已有文献报道通过调控过氧化物酶体的脂肪酸β氧化途径强化乙酰辅酶a衍生物的合成,表 明脂肪酸β氧化途径的调控是一种促进乙酰辅酶a衍生物合成的潜在策略。在专利 cn111575310a中通过在酿酒酵母中过表达小窝蛋白cav1基因使得柚皮素的产量达到275 mg/l。
5.脂肪酸是脂肪酸β氧化过程的底物,可通过添加脂肪酸强化脂肪酸β氧化过程。油脂在脂 肪酶(ec 3.1.1.3,甘油三酯水解酶)水解下生成脂肪酸和甘油。与脂肪酸相比,油脂价格低, 来源广,可以节约生产成本,适合工业化生产。
6.
技术实现要素:
7.本发明基于强化脂肪酸β氧化过程,提供一种促进乙酰辅酶a衍生物-柚皮素合成的方法, 本发明低成本工业化生产柚皮素具有潜在的指导价值和指导意义。
8.本发明的第一个目的是提供一种重组酿酒酵母,所述重组酿酒酵母过表达柚皮素合成途 径、脂肪酶和/或脂肪酸β氧化强化相关蛋白。
9.在本发明的一种实施方式中,所述重组酿酒酵母过表达柚皮素合成途径;或,过表达柚 皮素合成途径和脂肪酶;或,过表达柚皮素合成途径和脂肪酸β氧化强化相关蛋白;或,过表 达柚皮素合成途径、脂肪酶和脂肪酸β氧化强化相关蛋白。
10.在一种实施方式中,所述柚皮素合成途径包括矮牵牛来源的查尔酮合成酶chs,紫苜蓿 来源的查尔酮异构酶chi和香芹菜来源的4-香桂酸:辅酶a连接酶4cl。
11.在一种实施方式中,所述查尔酮合成酶chs,查尔酮异构酶chi和4-香桂酸:辅酶a连 接酶4cl氨基酸序列的genebank登录号分别为“aaf60297.1”,“p28012.1”,“p14912.1”。
12.在一种实施方式中,所述脂肪酶前端连接有α-factor信号肽。
13.在一种实施方式中,所述脂肪酶来源于短小芽孢杆菌(bacillus pumilus)、枯草芽孢杆菌 (bacillus subtilis)、米曲霉(aspergillus oryzae)、米根霉(rhizopus oryzae)、解脂亚洛酵母(yarrowialipolytica)或酿酒酵母(saccharomyces cerevisiae)。
14.在一种实施方式中,所述脂肪酶的氨基酸序列的genebank登录号分别为“afu81785.1”,
ꢀ“
np_388152.1”,“xp_023093192.1”,“aaf32408.1”,“cab91111.1”,“np_014044.1”。
15.在一种实施方式中,所述α-factor信号肽的核苷酸序列如seq id no.1所示。
16.在一种实施方式中,所述脂肪酸β氧化强化相关蛋白包括脂酰辅酶a氧化酶fox1p,双功 能的羟酰辅酶a脱氢酶/烯酰辅酶a水合酶fox2p或乙酰辅酶a酰基转移酶fox3p。
17.在一种实施方式中,所述脂酰辅酶a氧化酶fox1p,双功能的羟酰辅酶a脱氢酶/烯酰辅 酶a水合酶fox2p或乙酰辅酶a酰基转移酶fox3p氨基酸序列的genebank登录号分别为
ꢀ“
np_011310.1”,“np_012934.1”,“np_012106.1”。
18.在一种实施方式中,过表达柚皮素合成途径是将编码chs的基因,编码chi的基因和 编码4cl的基因连接到py26系列载体;过表达脂肪酶是将脂肪酶连接到prs系列载体上; 过表达脂肪酸β氧化强化相关蛋白是将脂肪酸β氧化强化相关蛋白连接到prs系列载体上。
19.在一种实施方式中,编码chs的基因由启动子pgal10起始转录,编码chi的基因由 启动子pgal1起始转录,编码4cl的基因由启动子pgal7起始转录。
20.在一种实施方式中,所述pgal10的核苷酸序列如seq id no.2所示,pgal1的核苷酸 序列如seq id no.3所示,pgal7的核苷酸序列如seq id no.4所示。
21.在一种实施方式中,所述酿酒酵母以酿酒酵母c800为宿主细胞。
22.本发明的第二个目的是提供一种生产柚皮素的方法,所述方法为以油脂或脂肪酸为底物, 利用上述重组酿酒酵母进行柚皮素的合成。
23.在一种实施方式中,所述油脂包括棕榈油、椰子油、大豆油、玉米油、花生油、橄榄油 和/或废弃油脂。
24.在一种实施方式中,所述脂肪酸包括肉豆蔻酸、硬脂酸、棕榈酸、棕榈油酸、油酸、亚 油酸和/或亚麻酸。
25.本发明的第三个目的是提供一种促进酿酒酵母合成柚皮素的方法,所述方法为在酿酒酵 母细胞中过表达柚皮素合成途径、脂肪酶和/或脂肪酸β氧化强化相关蛋白。
26.在本发明的一种实施方式中,所述方法为过表达柚皮素合成途径;或,过表达柚皮素合 成途径和脂肪酶;或,过表达柚皮素合成途径和脂肪酸β氧化强化相关蛋白;或,过表达柚皮 素合成途径、脂肪酶和脂肪酸β氧化强化相关蛋白。
27.在一种实施方式中,所述柚皮素合成途径包括矮牵牛来源的查尔酮合成酶chs,紫苜蓿 来源的查尔酮异构酶chi和香芹菜来源的4-香桂酸:辅酶a连接酶4cl。
28.在一种实施方式中,所述查尔酮合成酶chs,查尔酮异构酶chi和4-香桂酸:辅酶a连 接酶4cl氨基酸序列的genebank登录号分别为“aaf60297.1”,“p28012.1”,“p14912.1”。
29.在一种实施方式中,所述脂肪酶前端连接有α-factor信号肽。
30.在一种实施方式中,所述脂肪酶来源于短小芽孢杆菌(bacillus pumilus)、枯草芽孢杆菌 (bacillus subtilis)、米曲霉(aspergillus oryzae)、米根霉(rhizopus oryzae)、解脂亚洛酵母(yarrowialipolytica)或酿酒酵母(saccharomyces cerevisiae)。
31.在一种实施方式中,所述脂肪酶的氨基酸序列的genebank登录号分别为“afu81785.1”,
ꢀ“
np_388152.1”,“xp_023093192.1”,“aaf32408.1”,“cab91111.1”,“np_014044.1”。
32.在一种实施方式中,所述α-factor信号肽的核苷酸序列如seq id no.1所示。
33.在一种实施方式中,所述脂肪酸β氧化强化相关蛋白包括脂酰辅酶a氧化酶fox1p,双功 能的羟酰辅酶a脱氢酶/烯酰辅酶a水合酶fox2p或乙酰辅酶a酰基转移酶fox3p。
34.在一种实施方式中,所述脂酰辅酶a氧化酶fox1p,双功能的羟酰辅酶a脱氢酶/烯酰辅 酶a水合酶fox2p或乙酰辅酶a酰基转移酶fox3p氨基酸序列的genebank登录号分别为
ꢀ“
np_011310.1”,“np_012934.1”,“np_012106.1”。
35.在一种实施方式中,过表达柚皮素合成途径是将编码chs的基因,编码chi的基因和 编码4cl的基因连接到py26系列载体;过表达脂肪酶是将脂肪酶连接到prs系列载体上; 过表达脂肪酸β氧化强化相关蛋白是将脂肪酸β氧化强化相关蛋白连接到prs系列载体上。
36.在一种实施方式中,编码chs的基因由启动子pgal10起始转录,编码chi的基因由 启动子pgal1起始转录,编码4cl的基因由启动子pgal7起始转录。
37.在一种实施方式中,所述pgal10的核苷酸序列如seq id no.2所示,pgal1的核苷酸 序列如seq id no.3所示,pgal7的核苷酸序列如seq id no.4所示。
38.在一种实施方式中,所述酿酒酵母为酿酒酵母c800。
39.本发明还保护上述重组酿酒酵母,或上述生产柚皮素的方法,或上述促进酿酒酵母合成 柚皮素的方法在制备含有柚皮素的产品中的应用。
40.本发明还保护上述重组酿酒酵母,或上述生产柚皮素的方法,或上述促进酿酒酵母合成 柚皮素的方法在在食品、医药领域中的应用。
41.本发明的有益效果:
42.(1)本发明通过在柚皮素合成底盘细胞cy100中表达脂肪酸β氧化相关蛋白,发现在不 添加脂肪酸条件下,工程菌株cy110、cy120和cy130的柚皮素产量分别是44.0mg/l、22.5 mg/l和33.0mg/l,与柚皮素合成底盘细胞cy100相比(柚皮素产量21.1mg/l),柚皮素
产量 有一定的提高,表明脂肪酸β氧化过程的强化有利于柚皮素的合成;在培养基中分别添加不同 的脂肪酸条件下促进了工程菌株cy110、cy120和cy130的生长和柚皮素产量,柚皮素产量 最高可达157.1mg/l。
43.(2)本发明通过在柚皮素合成底盘细胞cy100中表达不同来源的脂肪酶,发现在添加 油脂的情况下,可以促进菌株合成柚皮素或促进菌株生长。
44.(3)本发明通过构建脂肪酶和脂肪酸β氧化相关蛋白,发现添加不同的油脂提高了柚皮 素的产量。与脂肪酸相比,油脂价格低,来源广,适合工业化生产。油脂在脂肪酶的水解下 生成脂肪酸和甘油,脂肪酸可作为脂肪酸β氧化过程的底物,甘油可作为细胞生长代谢的碳源。 产量达43.1~48mg/l。
45.(4)本发明构建的重组酿酒酵母可以利用工业废弃油脂进行柚皮素的合成,绿色环保的 同时,以低廉的底物合成高附加值产物,实现了废弃油脂的再利用,解决了工业化废弃油脂、 废弃食用油的后处理问题。
附图说明
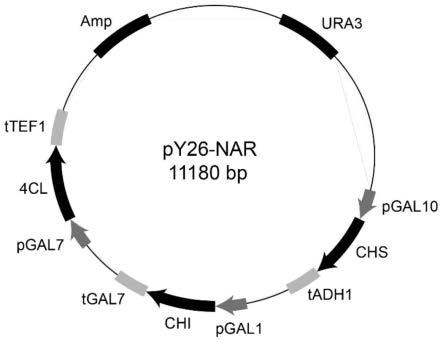
46.图1为py26-nar的穿梭质粒图谱。
47.图2为酿酒酵母c800在添加不同脂肪酸下的细胞生长曲线和细胞外的脂肪酸残留量。 (a:c800在ynb培养基中添加800mg/l不同脂肪酸条件下的细胞生长曲线;b:c800在 ynb培养基中添加800mg/l不同脂肪酸条件下细胞外的脂肪酸残留量的变化情况)
48.图3为不同脂肪酸对柚皮素合成底盘细胞cy100的影响。
49.图4为不同脂肪酸对重组酿酒酵母的影响,(a:菌株cy110在添加不同脂肪酸条件下的 od
600
和柚皮素产量,b:菌株cy120在添加不同脂肪酸条件下的od
600
和柚皮素产量,菌株 cy130在添加不同脂肪酸条件下的od
600
和柚皮素产量)。
50.图5为不同油脂对重组酿酒酵母的影响,(a:出发菌株cy100在添加不同油脂下的od
600
和柚皮素产量,b:cy100表达来源于短小芽孢杆菌(bacillus pumilus)脂肪酶的菌株cy100-bp 在添加不同油脂下的od
600
和柚皮素产量,c:cy100表达来源于枯草芽孢杆菌(bacillus subtilis) 脂肪酶的菌株cy100-bs在添加不同油脂下的od
600
和柚皮素产量,d:cy100表达来源于米 曲霉(aspergillus oryzae)脂肪酶的菌株cy100-ao在添加不同油脂下的od
600
和柚皮素产量, e:cy100表达来源于米根霉(rhizopus oryzae)脂肪酶的菌株cy100-ro在添加不同油脂下的 od
600
和柚皮素产量,f:cy100表达来源于解脂亚洛酵母(yarrowia lipolytica)脂肪酶的菌株 cy100-yl在添加不同油脂下的od
600
和柚皮素产量,g:cy100表达来源于酿酒酵母 (saccharomyces cerevisiae)脂肪酶的菌株cy100-sce在添加不同油脂下的od
600
和柚皮素产 量。a:ypd培养基,b:添加1%棕榈油,c:添加1%椰子油,d:添加1%大豆油,e: 添加1%玉米油,f:添加1%花生油,g:添加1%橄榄油)。
51.图6为不同油脂对表达bp脂肪酶和yl脂肪酶工程菌株的影响,(a和b:菌株的od
600
; c和d:菌株的柚皮素产量;cy100-bp:柚皮素底盘细胞cy100表达来源于bacillus pumilus 的脂肪酶;cy100-bp-fox1:底盘细胞cy100-bp过表达β氧化基因fox1;cy100-bp-fox2: 底盘细胞cy100-bp过表达β氧化基因fox2;cy100-bp-fox3:底盘细胞cy100-bp过表达 β氧化基因fox3;cy100-yl:柚皮素底盘细胞cy100表达来源于yarrowia lipolytica的脂肪 酶;cy100-yl-fox1:底盘细胞cy100-yl过表达β氧化基因fox1;cy100-yl-fox2:底 盘细胞
cy100-yl过表达β氧化基因fox2;cy100-yl-fox3:底盘细胞cy100-yl过表达β氧化基因fox3。a:ypd培养基,b:添加1%棕榈油,c:添加1%椰子油,d:添加1%大豆油,e:添加1%玉米油,f:添加1%花生油,g:添加1%橄榄油)。
具体实施方式
52.(一)培养基
53.lb培养基(luriabroth):酵母提取物5g/l,蛋白胨10g/l,氯化钠10g/l,固体培养基加入20g/l琼脂粉。使用时加入0.1g/l的氨苄青霉素钠。
54.ypd培养基:酵母提取物10g/l,蛋白胨20g/l,葡萄糖20g/l,固体培养基加入20g/l琼脂粉。
[0055]1×
ynb培养基:酵母氮源(无氨基酸和硫酸铵)1.74g/l,硫酸铵5g/l,葡萄糖20g/l,过滤除菌,4℃保存。使用时加入1%的氨基酸母液。
[0056]
10
×
ynb培养基:酵母氮源(无氨基酸和硫酸铵)17.4g/l,硫酸铵50g/l,过滤除菌,4℃保存。
[0057]
氨基酸母液:尿嘧啶5g/l、色氨酸5g/l、亮氨酸5g/l和组氨酸5g/l。
[0058]
ynb-fa培养基:酵母氮源(无氨基酸和硫酸铵)1.74g/l,硫酸铵5g/l,葡萄糖20g/l,脂肪酸800mg/l,tween802g/l,磷酸氢二钾5g/l,按需添加1%的氨基酸母液。(脂肪酸为肉豆蔻酸、硬脂酸、棕榈酸、棕榈油酸、油酸、亚油酸或亚麻酸)
[0059]
ypd-fa培养基:酵母提取物10g/l,蛋白胨20g/l,葡萄糖20g/l,脂肪酸800mg/l,tween802g/l,磷酸氢二钾5g/l。(脂肪酸为肉豆蔻酸、硬脂酸、棕榈酸、棕榈油酸、油酸、亚油酸或亚麻酸)
[0060]
ypd-o培养基:酵母提取物10g/l,蛋白胨20g/l,葡萄糖20g/l,油脂1%,tween802g/l,磷酸氢二钾5g/l。(油脂为棕榈油、椰子油、大豆油、玉米油、花生油、橄榄油或废弃油脂)
[0061]
(二)培养条件:
[0062]
a)酿酒酵母细胞c800在添加不同脂肪酸条件下的培养条件:c800接种于10ml的1
×
ynb培养基中(添加1%(v/v)的氨基酸母液),30℃,220rpm培养18h,以2%(v/v)转接于30ml的ynb-fa培养基,30℃,220rpm培养120h。每隔12h取样检测od
600
,每隔24h取样用于细胞外脂肪酸含量的检测。
[0063]
b)工程菌株在添加不同脂肪酸/油脂条件下的培养条件:工程菌株接种于10ml的1
×
ynb培养基中(按需添加对应的1%(v/v)的氨基酸母液),30℃,220rpm培养18h,以2%(v/v)转接于30ml的ypd-fa/ypd-o培养基,30℃,220rpm培养,在第24h添加500mg/l的对香豆酸,在第72h取样检测od
600
和柚皮素产量。
[0064]
(三)柚皮素hplc测定:采用shimadzu高效液相色谱进行测定。lc条件:色谱柱,thermohypersilods-2column;流动相a,含有1
‰
甲酸的超纯水;流动相b,含有1
‰
甲酸的乙腈;流动相比例条件,0-10min,10-40%b,10-30min,40-80%b,30-35min,80-80%b,35-37min,80-10%b,37-40min,10-10%b;流速:1ml/min;柱温:40℃;进样量:10μl;检测器:紫外检测器a350。
[0065]
(四)醋酸锂转化法:将酿酒酵母细胞在ypd平板划线,30℃培养3天,挑取单菌落接
种于5ml的ypd液体培养基中,30℃220rpm振荡培养16h,以od
600
值为0.3转接于50ml的ypd液体培养基中,30℃220rpm振荡培养5h左右至od
600
值为1.2-1.6之间;
[0066]
收集菌液于冰上预冷5min,以5000
×
g离心5min收集菌体,加入25ml预冷的无菌水重悬菌体,以5000
×
g离心5min收集菌体,加入1ml的0.1mm的醋酸锂重悬菌体,以5000
×
g离心1min收集菌体,加入400μl的0.1mm的醋酸锂溶液重悬菌体,取50ul的重悬液依次加入240μlpeg3350,36μl的1mm的醋酸锂溶液,25μl的2mg/ml的ssdna,震荡30s混匀体系,30℃培养30min,42℃水浴热激25min,以5000
×
g离心1min收集菌体,加入1ml的无菌水重悬菌体,取100μl涂板于不含组氨酸的ynb平板上,30℃培养3天。醋酸锂转化法具体操作见参考文献:gietz,r.d.,andschiestl,r.h.(2007)quickandeasyyeasttransformationusingtheliac/sscarrierdna/pegmethod.nat.protoc.2(1),35-37.
[0067]
(五)柚皮素合成途径质粒的构建:将来源于矮牵牛的查尔酮合成酶chs(氨基酸序列的genebank登录号:aaf60297.1)紫苜蓿的查尔酮异构酶chi(氨基酸序列的genebank登录号:p28012.1)和香芹菜的4-香桂酸:辅酶a连接酶4cl(氨基酸序列的genebank登录号:p14912.1)构建至表达载体py26的,其中编码chs的基因由启动子pgal10起始转录,编码chi的基因由启动子pgal1起始转录,编码4cl的基因由启动子pgal7起始转录。构建得重组质粒py26-nar(py26-pgal10-chs-pgal1-chi-pgal7-4cl),质粒图谱如图1所示。pgal10的核苷酸序列如seqidno.2所示,pgal1的核苷酸序列如seqidno.3所示,pgal7的核苷酸序列如seqidno.4所示。
[0068]
(六)柚皮素合成底盘细胞cy100的构建:将构建的柚皮素合成途径质粒py26-nar(py26-pgal10-chs-pgal1-chi-pgal7-4cl)通过醋酸锂转化法转入酿酒酵母细胞c800(cen.pk2-1d,matα;ura3-52;leu2-3,112;trp1-289;his3δ1;mal2-8c;suc2;gal80::kanmx,公开于公布号为cn111424020a的专利文件中),涂布于ynb平板(添加1%(v/v)的不含尿嘧啶的氨基酸母液)上,30℃培养3天,至长出单菌落;挑取单菌落于ynb培养基(添加1%(v/v)的不含尿嘧啶的氨基酸母液)中,220rpm培养24h;将培养得到的菌液进行pcr验证,挑取正确的克隆子得cy100,菌落pcr验证的引物对:
[0069]
f-jp1:5
’‑
aatcgccatcaccgtcgc-3’;
[0070]
r-jp1:5
’‑
ataggtatgcagcggcagatgc-3’。
[0071]
实施例1:构建表达脂肪酶的基因工程菌
[0072]
(1)合成分泌信号肽和脂肪酶基因
[0073]
外泌信号肽α-factor序列由生工生物工程(上海)股份有限公司合成(核苷酸序列如seqidno.1所示)。不同来源的脂肪酶基因的来源和基因id如下表1所示,脂肪酶基因序列基于酿酒酵母密码子优化并由生工生物工程(上海)股份有限公司合成。
[0074]
表1不同来源的脂肪酶
[0075][0076]
(2)构建prs424-α-factor基础载体
[0077]
使用引物f-af-424和r-af-424为上游和下游引物(表2),以信号肽α-factor为模板,pcr 扩增并进行产物纯化(纯化试剂盒购自上海生工公司),得到α-factor片段。
[0078]
使用引物f-424-αf和r-424-αf为上游和下游引物(表2),以prs424-ptef为模板,pcr 扩增并进行产物纯化(纯化试剂盒购自上海生工公司),得到线性化prs424-ptef载体。
[0079]
用seamless cloning kit(生工生物工程(上海)股份有限公司,b632219)的方法将α-factor 片段和线性化prs424-ptef载体重组为prs424-α-factor基础载体,并转化大肠杆菌jm109。 将菌液提取质粒并送上海生工测序,测序正确的质粒即为prs424-α-factor。
[0080]
(3)构建分泌表达不同脂肪酶的重组质粒
[0081]
使用引物f-lipase-424af和r-lipase-424af(lipase指不同的脂肪酶基因bp,bs,ao,ro, yl和sce)为上游和下游引物(表2),以步骤(1)中不同脂肪酶的基因序列为模板(表1), pcr扩增并进行产物纯化(纯化试剂盒购自上海生工公司),得到各个lipase片段(bp、bs、ao、 ro、yl、sce)。
[0082]
使用引物f-424af-lipase和r-424af-lipase(lipase指不同的脂肪酶基因bp,bs,ao,ro,yl和sce)为上游和下游引物(表2),以步骤(2)中prs424-α-factor为模板,pcr扩增并 进行产物纯化(纯化试剂盒购自上海生工公司),得到与各个lipase对应的线性化载体 prs424-α-factor(lipase)(prs424-α-factor(bp),prs424-α-factor(bs)、prs424-α-factor(ao)、 prs424-α-factor(ro)、prs424-α-factor(yl)、prs424-α-factor(sce))。
[0083]
用seamless cloning kit(生工生物工程(上海)股份有限公司,b632219)的方法将各个 lipase片段与对应的线性化载体prs424-α-factor(lipase)进行重组,并分别转化大肠杆菌 jm109。将菌液提取质粒并送上海生工测序,测序正确的质粒即为prs424-bp,prs424-bs, prs424-ao,prs424-ro,prs424-yl和prs424-sce。
[0084]
构建所用引物如下表2所示,构建的重组质粒如下表3所示。
[0085]
表2构建分泌表达脂肪酶质粒所用引物
[0086][0087]
注:下划线部分为同源臂
[0088]
表3分泌表达脂肪酶重组质粒
[0089][0090]
(4)构建工程菌株cy100-bp,cy100-bs,cy100-ao,cy100-ro,cy100-yl和 cy100-sce
[0091]
将步骤(3)构建的质粒prs424-bp,prs424-bs,prs424-ao,prs424-ro,prs424-yl 和prs424-sce通过醋酸锂转化法分别转入柚皮素合成底盘细胞cy100,构建工程菌株 cy100-bp,cy100-bs,cy100-ao,cy100-ro,cy100-yl和cy100-sce,涂布于ynb 平板(添加
1%(v/v)的不含色氨酸和尿嘧啶的氨基酸母液)上,30℃培养3天,至长出单 菌落;挑取单菌落于ynb培养基(添加1%(v/v)的不含色氨酸和尿嘧啶的氨基酸母液)中, 220rpm培养24h;将培养得到的菌液进行pcr验证,分别挑取正确的克隆子得cy100-bp, cy100-bs,cy100-ao,cy100-ro,cy100-yl和cy100-sce。
[0092]
表4菌落pcr验证引物
[0093][0094]
实施例2:构建强化脂肪酸β氧化过程的基因工程菌
[0095]
(1)构建强化脂肪酸β氧化过程相关质粒
[0096]
使用引物对f/r-fox1-425,f/r-fox2-425和f/r-fox3-425,以酿酒酵母s288c基因组 为模板,分别扩增fox1(ncbi上locus tag为ygl205w),fox2(ncbi上locus tag为 ykr009c)和fox3(ncbi上locus tag为yil160c),将pcr产物进行产物纯化(纯化试剂盒 购自上海生工公司),得到fox1,fox2和fox3基因片段。
[0097]
使用引物对f/r-425-fox1,f/r-425-fox2和f/r-425-fox3,以prs425-ptef为模板, pcr扩增并进行产物纯化(纯化试剂盒购自上海生工公司),分别得到线性化载体 prs425-ptef(fox1),prs425-ptef(fox2)和prs425-ptef(fox3)。
[0098]
用seamless cloning kit(生工生物工程(上海)股份有限公司,b632219)的方法分别将 fox1,fox2和fox3片段与对应的线性化载体prs425-ptef(fox1),prs425-ptef(fox2) 和prs425-ptef(fox3),重组为prs425-fox1,prs425-fox2和prs425-fox3,并转化大 肠杆菌jm109。将菌液提取质粒并送上海生工测序,测序正确的质粒即为prs425-fox1, prs425-fox2和prs425-fox3。
[0099]
构建所用引物如下表5所示,构建所得的重组质粒如下表6所示。
[0100]
表5构建肪酸β氧化过程强化的质粒所用引物
[0101][0102]
注:下划线部分为同源臂
[0103]
表6强化脂肪酸β氧化过程相关质粒
[0104][0105][0106]
(2)构建菌株cy110,cy120和cy130
[0107]
将步骤(1)构建的质粒prs425-fox1,prs425-fox2和prs425-fox3通过醋酸锂转 化法分别转入柚皮素合成底盘细胞cy100,构建得到工程菌株cy110,cy120和cy130,在 ynb平板(添加1%(v/v)的不含亮氨酸和尿嘧啶的氨基酸母液)上,30℃培养3天,至长 出单菌落;挑取单菌落于ynb培养基(添加1%(v/v)的不含亮氨酸和尿嘧啶的氨基酸母液) 中,220rpm培养24h;将培养得到的菌液进行pcr验证,分别挑取正确的克隆子得到工程 菌株cy110,cy120和cy130。
[0108]
表7菌落pcr验证引物
[0109][0110]
实施例3:构建表达脂肪酶和强化脂肪酸β氧化过程的基因工程菌
[0111]
将实施例2构建的质粒prs425-fox1,prs425-fox2和prs425-fox3通过醋酸锂转化 法分别转入实施例1构建的酿酒酵母细胞cy100-bp,分别得到工程菌株cy100-bp-fox1, cy100-bp-fox2和cy100-bp-fox3;以及将实施例2构建的质粒prs425-fox1, prs425-fox2和prs425-fox3通过醋酸锂转化法分别转入实施例1构建的酿酒酵母细胞 cy100-yl,分别得到工程菌株cy100-yl-fox1,cy100-yl-fox2和cy100-yl-fox3, 在ynb平板(添加1%(v/v)的不含亮氨酸,色氨酸和尿嘧啶的氨基酸母液)上,30℃培养 3天,至长出单菌落;挑取单菌落于ynb培养基(添加1%(v/v)的不含亮氨酸,色氨酸和 尿嘧啶的氨基酸母液)中,220rpm培养24h;将培养得到的菌液进行pcr验证,分别挑取 正确的克隆子得cy100-bp-fox1,cy100-bp-fox2,cy100-bp-fox3,cy100-yl-fox1, cy100-yl-fox2和cy100-yl-fox3。
[0112]
表8菌落pcr验证引物
[0113][0114]
实施例4:脂肪酸对细胞生长和细胞对脂肪酸的利用情况
[0115]
将酿酒酵母细胞c800接种于10ml的1
×
ynb培养基(添加1%(v/v)的氨基酸母液)中, 30℃,220rpm培养18h,体积比按2%(v/v)转接于30ml含有不同脂肪酸的ynb-fa培养 基,30℃,220rpm培养120h。每隔12h取样检测od
600
,每隔24h取样用于细胞外脂肪酸 含量的检测。
[0116]
实验结果如图2所示,除月桂酸外,其余脂肪酸的添加均促进了酿酒酵母细胞c800生 长,其中,不饱和脂肪酸对细胞生长的促进作用较为明显;随着时间的推移,脂肪酸的残留 量减少,说明细胞能吸收胞外的脂肪酸转运到细胞内供细胞利用。因此,说明脂肪酸的添加 能被细胞吸收利用,除月桂酸外,其余脂肪酸的添加都能促进细胞生长。
[0117]
实施例5:不同脂肪酸的添加对柚皮素合成的影响
[0118]
将柚皮素合成底盘细胞cy100接种于10ml的1
×
ynb培养基中(添加100μl组氨酸, 100μl色氨酸和100μl亮氨酸),30℃,220rpm培养18h,按体积比为2%(v/v)分别转接 于30ml含有不同脂肪酸的ypd-fa培养基和ypd培养基,30℃,220rpm培养,在第24h 添加
500mg/l的对香豆酸,在第72h取样检测od
600
和柚皮素产量。
[0119]
实验结果如图3所示,在添加不同的脂肪酸条件下,柚皮素合成底盘细胞cy100的生长 和合成柚皮素的能力各有不同。肉豆蔻酸(myristic acid c14:0)、硬脂酸(stearic acid c18:0)、 棕榈油酸(palmitoleic acid c16:1)、油酸(oleic acid c18:1)、亚油酸(linoleic acid c18:2)和亚麻 酸(α-linolenic acid c18:3)的添加对细胞生长有一定促进作用。
[0120]
与未添加脂肪酸的对照相比(柚皮素产量21.1mg/l),肉豆蔻酸(myristic acid c14:0)、棕榈 油酸(palmitoleic acid c16:1)、油酸(oleic acid c18:1)、亚油酸(linoleic acid c18:2)和亚麻酸 (α-linolenic acid c18:3)的添加促进细胞合成柚皮素,柚皮素的产量分别是68.9mg/l、60.0 mg/l、70.0mg/l、79.0mg/l、92.4mg/l。该结果表明,脂肪酸的添加可以促进柚皮素合成 底盘细胞cy100合成柚皮素。
[0121]
实施例6:基于脂肪酸β氧化强化后添加不同脂肪酸对柚皮素合成的影响
[0122]
将实施例2构建的工程菌株cy110、cy120和cy130分别接种于10ml的1
×
ynb培养 基中(添加100μl组氨酸和100μl色氨酸),30℃,220rpm培养18h,按体积比为2%(v/v) 分别转接于30ml含有不同脂肪酸的ypd-fa培养基和ypd培养基,30℃,220rpm培养, 在第24h添加500mg/l的对香豆酸,在第72h取样检测od
600
和柚皮素产量。
[0123]
实验结果如图4所示,在不添加脂肪酸条件下,工程菌株cy110、cy120和cy130的柚 皮素产量分别是44.0mg/l、22.5mg/l和33.0mg/l,与柚皮素合成底盘细胞cy100相比(柚 皮素产量21.1mg/l),柚皮素产量有一定的提高,表明脂肪酸β氧化过程的强化有利于柚皮素 的合成。
[0124]
在培养基中分别添加不同的脂肪酸条件下,除肉豆蔻酸和棕榈酸外,其余脂肪酸的添加 促进了工程菌株cy110的生长。不饱和脂肪酸的添加显著促进了细胞合成柚皮素。其中,工 程菌株cy110在添加不饱和脂肪酸(棕榈油酸、油酸、亚油酸、亚麻酸)的条件下,柚皮素 的产量分别是147.8mg/l、115.0mg/l、152.4mg/l、157.1mg/l,与未添加脂肪酸的对照相 比(柚皮素产量44.0mg/l),柚皮素产量明显提高。该结果表明,强化β氧化的同时,添加脂肪 酸可以促进柚皮素的合成。
[0125]
表9柚皮素产量
[0126][0127]
yl-fox1,cy100-yl-fox2和cy100-yl-fox3分别接种于10ml的1
×
ynb培养 基中(添加100μl组氨酸),30℃,220rpm培养18h,按体积比为2%(v/v)分别转接于30ml 添加不同油脂的ypd-o培养基和ypd培养基,30℃,220rpm培养,在第24h添加500mg/l 的对香豆酸,在第72h取样检测od
600
和柚皮素产量。
[0138]
实验结果如图6所示,在表达来源于短小芽孢杆菌(bacillus pumilus)脂肪酶的菌株 cy100-bp基础上过表达β氧化途径关键基因fox,明显促进柚皮素的合成。在添加大豆油的 条件下,对照菌株cy100-bp的柚皮素是26.4mg/l,而在其基础上过表达fox1、fox2和 fox3的柚皮素产量分别是48.0mg/l,42.6mg/l和43.1mg/l。在表达来源于解脂亚洛酵母 (yarrowia lipolytica)脂肪酶的菌株cy100-yl基础上强化脂肪酸β氧化过程明显促进细胞生 长。
[0139]
实施例9重组酿酒酵母的应用
[0140]
以废弃油脂为底物,利用本发明构建的重组酿酒酵母发酵生产柚皮素。
[0141]
以实施例3构建的菌株cy100-bp-fox1,cy100-bp-fox2,cy100-bp-fox3, cy100-yl-fox1,cy100-yl-fox2和cy100-yl-fox3分别接种于10ml的1
×
ynb培养 基中(添加100μl组氨酸),30℃,220rpm培养18h,按体积比为2%(v/v)分别转接于30 ml添加不同来源的工业废弃油脂的ypd-o培养基,30℃,220rpm培养,在第24h添加500 mg/l的对香豆酸,在第72h取样检测od
600
和柚皮素产量。实验结果显示,本发明构建的重 组酿酒酵母可以利用工业废弃油脂进行柚皮素的合成,绿色环保的同时,以低廉的底物合成 高附加值产物,实现了废弃油脂的再利用,解决了工业化废弃油脂、废弃食用油的后处理问 题。
[0142]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人, 在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以 权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1