一种提高博落回中血根碱含量的方法及应用
1.本发明属于博落回种质资源研究技术领域,具体涉及一种提高博落回中血根碱含量的方法及应用。
背景技术:
2.博落回[macleaya cordata(willd.)r.br.]提取物中以血根碱为主的苄基异喹啉类生物碱在养殖和食品安全领域有着非常重要的作用,已作为饲用抗生素的天然来源替代品广泛应用于畜禽水产等养殖业中。然而,在现有的野生变家种博落回资源中,活性成分血根碱的含量仅在0.3-2.0%区间且不稳定,利用传统的育种技术如选育、杂交育种等很难显著提高博落回中的血根碱含量,且面临着育种周期长和成本高的问题。
[0003]
对基因进行定点修饰,是生物研究领域重要的方法之一。随着科学的发展,越来越多的沉默技术发展迅速。从经典的mes随机诱变,t-dna或转座子插入失活到锌指结构(zfs)与转录激活因子样效应物核酸酶(talens)定点突变,这些技术都大大促进了研究基因功能的进程。但由于锌指核糖核酸酶(zfn)与转录激活因子样效应物核酸酶(talens)技术需要针对每一个目的基因设计特定的内切酶,且构建过程繁琐,大大限制了其应用范围。与其他沉默体系相比,crispr定点突变技术有其无法比拟的优点,逐渐被广泛地应用与基因定点修饰研究中。
[0004]
crispr/cas体系最早是在大肠杆菌中发现的,是细菌针对噬菌体等外源dna的获得性免疫系统,该系统主要依赖于crrna与cas蛋白形成的核糖核蛋白复合物识别靶序列上的pam结构,进而对入侵噬菌体或质粒进行特异性切割。crispr系统主要有三种类型,其中ii型体系仅需要一个cas9蛋白、crrna与tracrrna就能行使其功能。有研究表明将crrna与tracrrna整合成sgrna并不影响crispr/cas9体系的作用。2013年8月,自然生物技术期刊上首次同时发表了三篇有关crispr/cas9体系成功应用于植物基因修饰的研究。之后,crispr/cas9体系被广泛地应用于拟南芥、烟草、水稻、高粱等模式植物及作物研究上,药用植物博落回在已构建的crispr/cas9基因编辑体系的基础上,可以考虑进一步应用于实际的育种研究中。
[0005]
博落回中的mcsmt基因是位于白屈菜红碱分支通路中的一个关键的甲基转移酶基因,该酶主要催化金黄紫堇碱生成四氢非洲防己碱后再通过系列转化生成白屈菜红碱。白屈菜红碱分支为血根碱合成通路的竞争通路,且两条通路效率基本相当,若能将白屈菜红碱合成通路有效截断,只保留血根碱合成通路,将有可能实现以提高血根碱含量为目标的博落回种质创新。
技术实现要素:
[0006]
本发明的首要目的是提供一种提高博落回中血根碱含量的方法。该方法构思新颖,操作简单,使得博落回中血根碱含量得到显著提升,具有广阔的实际生产意义。
[0007]
本发明通过沉默博落回中的mcsmt基因表达或者敲除mcsmt基因,提高博落回中血
根碱含量,所述的mcsmt基因全长序列及cds区序列如seq id no.1和2所示。
[0008]
所述的提高博落回中血根碱含量的方法,采用crispr/cas9基因编辑体系敲除mcsmt基因。
[0009]
所述的提高博落回中血根碱含量的方法,具体包括以下步骤:
[0010]
1)博落回mcsmt基因靶位点引物设计与合成;
[0011]
2)博落回基因敲除载体构建;
[0012]
3)根癌农杆菌介导的博落回遗传转化。
[0013]
所述的提高博落回中血根碱含量的方法,
[0014]
步骤1)博落回mcsmt基因靶位点引物设计与合成:
[0015]
①
、使用植物基因组编辑靶位点设计软件,在博落回mcsmt基因的编码区避开内含子区域设计一个mcsmt基因靶位点guide1,靶位点的设计原则有:a、靶位点主要包括20个碱基,并且这20个碱基3’端是n为任意碱基的ngg的3个碱基的pam区;b、靶位点选择在基因编码区的前端;c、guide1序列的第一个碱基必须是g,当设计的guide1序列第一个碱基不是g时,将需要在前面加一个g碱基;优选:guide1序列为gccgcggatgtgtgggtact;如seq id no.3所示;
[0016]
②
、以
①
中设计的基因靶位点guide1,结合prgeb32质粒(购买于淼灵质粒平台)bsa i酶切位点粘性末端设计靶位点引物对prgeb32-smt-guide 1-oligo 1和prgeb32-smt-guide 1-oligo 2,具体序列:
[0017]
prgeb32-smt-guide 1-oligo 1:ggcagccgcggatgtgtgggtact;如seq id no.4所示;prgeb32-smt-guide 1-oligo 2:aaacagtacccacacatccgcggc,如seq id no.5所示。
[0018]
所述的提高博落回中血根碱含量的方法,
[0019]
步骤2)博落回基因敲除载体构建:
[0020]
①
、将prgeb32质粒用bsa i酶切成线性化质粒,电泳,回收纯化目标片段;
[0021]
②
、将合成的靶位点oligos序列进行退火磷酸化反应,获得靶点双链;
[0022]
③
、将
②
中的靶点双链序列通过连接酶与prgeb32线性化载体相连接,连接产物转染至dh5α感受态细胞细胞中,震荡培养,抗生素筛选,菌落pcr鉴定筛选阳性克隆,鉴定正确重组载体命名为:prgeb32-smt1。
[0023]
所述的提高博落回中血根碱含量的方法,
[0024]
步骤3)根癌农杆菌介导的博落回遗传转化:
[0025]
①
、将已构建好的重组质粒prgeb32-smt1转化根癌农杆菌,震荡培养,抗生素筛选,得到根癌农杆菌单菌落;
[0026]
②
、挑选根癌农杆菌单克隆提取质粒,pcr鉴定筛选阳性克隆测序,阳性克隆进行扩大培养,菌液进行博落回外植体侵染;
[0027]
③
、完成侵染的博落回外植体进行共培养,后进行筛选培养,完成整个组培过程,获得博落回转基因阳性幼苗。
[0028]
所述的提高博落回中血根碱含量的方法,
[0029]
载体构建鉴定引物
[0030]
m13r:gagcggataacaatttcacacagg,如seq id no.6所示;
[0031]
prgeb32-r:gacccgaatttgtggacctg,如seq id no.7所示。
[0032]
所述的提高博落回中血根碱含量的方法,
[0033]
mcsmt基因靶位点突变鉴定引物:
[0034]
smt-f:atggatgccaaattagaagaagcga;如seq id no.8所示;
[0035]
smt-r:tgaaactcaatgacatggagacctt;如seq id no.9所示。
[0036]
所述的提高博落回中血根碱含量的方法,
[0037]
基因编辑结果鉴定:
[0038]
农杆菌介导的prgeb32-smt1质粒遗传转化获得再生植株提取总dna,使用引物对smt-f/smt-r扩增包含基因靶位点的目的片段,测序鉴定靶位点碱基突变。
[0039]
本发明的第二个目的是提高博落回中血根碱含量的方法的应用,用于培育提高血根碱含量的博落回新种质。主要针对目前博落回传统育种无法快速获得高血根碱含量种质材料的问题,首次在博落回植物应用基因编辑技术获得具有重要应用价值的高血根碱博落回种质材料。
[0040]
本发明的有益效果:
[0041]
1、为首次利用crispr/cas9基因编辑技术对博落回中苄基异喹啉类生物碱代谢通路进行编辑;2、成功获得血根碱含量显著提升的博落回植株。
[0042]
本发明中:
[0043]
crispr/cas9:为clustered regularly interspaced short palindromic repeats(规律成簇的间隔短回文重复)/crispr-associated protein 9(crispr相关蛋白9)的缩写,是第三代“基因组定点编辑技术”。
[0044]
smt基因:为scoulerine-9-o-methyltransferase的缩写,是一个甲基转移酶基因,在苄基异喹啉类生物碱的生物合成过程中能催化金黄紫堇碱生成四氢非洲防己碱。
[0045]
dna:脱氧核糖核酸,是生物细胞内含有的四种生物大分子之一核酸的一种。
[0046]
pcr:聚合酶链式反应,是一种用于放大扩增特定的dna片段的分子生物学技术。
[0047]
pam:(protospacer adjacent motif)前间区序列邻近基序,这是一种见于crrna分子的短核苷酸基序,可以被cas9蛋白特异性识别并切割。
附图说明
[0048]
图1:博落回mcsmt基因靶位点设计(阴影部分序列为guide1,方框中序列为pam区)
[0049]
图2:prgeb32质粒图谱;
[0050]
图3:博落回mcsmt基因编辑转基因阳性幼苗;
[0051]
图4:博落回mcsmt基因敲除植株载体片段扩增电泳图;
[0052]
说明:m为dl2000 marker,编号代表不同植株,目标条带大小616bp;
[0053]
图5:博落回mcsmt基因靶位点突变及对应的峰图;
[0054]
图6:白屈菜红碱分支通路化合物含量比较;
[0055]
注:柱状图分别对应上部白屈菜红碱通路化合物,从左至右分别为(s)-四氢小檗碱、(s)-cis-n-甲基四氢小檗碱、别隐品碱、二氢白屈菜红碱、白屈菜红碱。星号表示显著差异(*表示p《0.05,**表示p《0.01,***表示p《0.005,****表示p《0.001);
[0056]
图7:分支前通路化合物含量比较;
[0057]
注:柱状图分别对应上部分支前通路化合物,从左至右分别为(s)-去甲基衡州乌
药碱、衡州乌药碱、(s)-n-甲基衡州乌药碱、3-羟基-n-甲基衡州乌药碱、(s)-网脉荔枝碱、(s)-金黄紫堇碱;星号表示显著性差异(*表示p《0.05,**表示p《0.01,***表示p《0.005,****表示p《0.001);
[0058]
图8:血根碱分支通路化合物含量比较;
[0059]
注:柱状图分别对应上部血根碱通路化合物,从左至右分别为(s)-碎叶紫堇碱标准曲线、(s)-刺罂粟碱、(s)-cis-n-甲基刺罂粟碱、原阿片碱、二氢血根碱、血根碱;星号表示显著差异(*表示p《0.05,**表示p《0.01,***表示p《0.005,****表示p《0.001)。
具体实施方式
[0060]
以下结合实施例旨在进一步说明本发明,而非限制本发明。
[0061]
实施例1:
[0062]
1)博落回mcsmt基因靶位点引物设计与合成:
[0063]
①
、使用植物基因组编辑靶位点设计软件crispr-p 2.0(http://crispr.hzau.edu.cn/crispr2/),在博落回mcsmt基因的编码区避开内含子区域设计一个mcsmt基因靶位点guide1(图1中阴影部分序列),靶位点的设计原则有:a、靶位点主要包括20个碱基,并且这20个碱基3’端是ngg(n为任意碱基)3个碱基的pam区(protospacer adjacent motif,pam)(图1中方框部分序列);b、靶位点尽量选择在基因编码区的前端;c、guide序列的第一个碱基必须是g,当设计的guide序列第一个碱基不是g时,将需要在前面加一个g碱基。图1:博落回mcsmt基因靶位点设计(阴影部分序列为guide1,方框中序列为pam区)
[0064]
②
、以
①
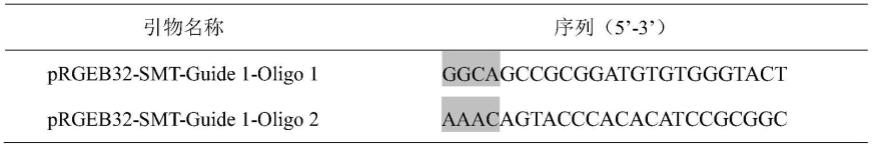
中设计的基因靶位点guide1(20bp),结合prgeb32质粒(图2)bsa i酶切位点粘性末端设计靶位点引物对prgeb32-smt-guide 1-oligo 1和prgeb32-smt-guide 1-oligo 2,具体序列见表1,阴影部分为与prgeb32质粒bsa i酶切粘性末端相互补的碱基片段,引物合成委托北京擎科生物科技有限公司完成。
[0065]
表1:mcsmt基因靶位点引物(阴影部分为与prgeb32质粒bsa i酶切粘性末端互补片段)
[0066][0067]
③
、鉴定引物设计与合成:
[0068]
a、使用primer premier 6.0引物设计软件在prgeb32载体靶位点连接位点的上下游各约300-400bp左右分别设计pcr扩增的上下游引物,引物序列见表2,重组质粒扩增目标条带616bp,主要用于载体构建结果的鉴定。
[0069]
表2:载体构建鉴定引物
[0070][0071]
b、使用primer premier 6.0引物设计软件在mcsmt基因靶位点上下游各约300-400bp左右分别设计pcr扩增的上下游引物,引物序列见表3,扩增目标条带约703bp,主要用于后期靶位点突变鉴定。
[0072]
表3:mcsmt基因靶位点突变鉴定引物
[0073][0074]
2)博落回基因敲除载体构建:
[0075]
①
、将prgeb32质粒用bsa i酶切成线性化质粒,反应条件为37℃,15min,并进行1%的琼脂糖凝胶电泳,电泳条件为120v,20min,切胶回收目标片段,用凝胶回收试剂盒纯化目的dna,片段大小约15868bp。
[0076]
②
、将合成的靶位点oligos序列进行退火磷酸化反应,反应条件为37℃,30min,转95℃,5min,再以5℃/min降温速度降至25℃,获得靶点双链。
[0077]
③
、将
②
中的靶点双链序列通过连接酶与prgeb32线性化载体相连接,连接条件为室温放置10min,取5μl的连接产物至50μl的dh5α感受态细胞中,并混合(刚在冰上解冻时加入),冰上孵育30min,42℃热激90s,然后立即放入冰水中静置3min,向离心管中加入500μl的lb液体培养基,37℃,180r条件下震荡培养45min,涂布于含卡那霉素的lb固体筛选培养基上,37℃培养12h,菌落pcr鉴定(m13r/prgeb32-r引物对)筛选阳性克隆,鉴定正确的重组载体命名为:prgeb32-smt1。
[0078]
3)根癌农杆菌介导的博落回遗传转化
[0079]
①
、吸取5μl已构建好的重组质粒prgeb32-smt1,加入到刚在冰上融化的100μl的gv3101根癌农杆菌感受态中,用移液枪吹打混匀约20次后转移至100μl的电转杯中,盖好杯盖,冰上静置5min,于电穿孔仪的agr模式电击,冰上放置2min后,加入500μl无抗lb液体培养基后置于震荡培养箱中28℃,180rpm震荡培养2h,涂布于含卡那霉素和利福平的lb固体筛选培养基上,28℃培养48h,待长出根癌农杆菌单菌落。
[0080]
②
、挑选根癌农杆菌单克隆提取质粒,pcr鉴定(m13r/prgeb32-r引物对)筛选阳性克隆,并提取质粒委托北京擎科生物科技有限公司进行测序,测序正确阳性克隆进行扩大培养,培养至od
600
为0.6-0.8时进行博落回外植体(茎段及叶盘)的侵染。
[0081]
②
、完成侵染的博落回外植体转移至含有乙酰丁香酮的ms培养基中共培养三天,后转移至含潮霉素和特美汀的ms筛选培养基进行筛选培养,完成整个组培过程,获得博落回转基因阳性幼苗(图3)。
[0082]
4)基因编辑结果鉴定:
[0083]
农杆菌介导的prgeb32-smt1质粒遗传转化首次获得再生植株12株,这些植株生长
良好,表现与野生型植株表现一致,至植株地上部分生长至6-8cm高时(图3),每株各剪取一片叶片并提取总dna,电泳鉴定转基因阳性情况,结果显示12株均为质粒成功转入的转基因阳性植株(图4),使用引物对smt-f/smt-r扩增包含基因靶位点的目的片段,测序鉴定靶位点碱基突变,结果显示在mcsmt基因的靶位点出现两种类型的单碱基插入突变,分别为插入一个碱基“t”与一个碱基“a”(图5),且12株阳性植株测序峰图均为突变位点的单碱基套峰,表明所有突变植株均为两种突变均有的杂合突变。
[0084]
说明:wt代表无突变的野生型博落回测序结果;ko-smt1代表mcsmt基因靶位点突变类型1;ko-smt2代表mcsmt基因靶位点突变类型2。图中方框碱基为pam序列及靶位点序列,三角形所指位点为cas9蛋白的剪切位点,箭头所指为基因突变插入的一个碱基。
[0085]
5)苄基异喹啉类生物碱通路化合物定量分析:
[0086]
①
、白屈菜红碱分支通路化合物定量分析。用uplc-qqq ms对6株mcsmt基因敲除突变体植株及6株野生型植株的全株(含根、茎、叶)进行白屈菜红碱分支通路化合物含量定量分析,根据峰面积和标准曲线计算各化合物含量,结果如图6所示,整体来看,与野生型植株比较,在敲除该分支通路关键基因mcsmt后,(s)-金黄紫堇碱不能被有效催化生成(s)-四氢非洲防己碱,直接导致位于通路下游的(s)-四氢小檗碱、(s)-cis-n-甲基四氢小檗碱、别隐品碱、二氢白屈菜红碱、白屈菜红碱等化合物含量均显著降低至极低的水平,表明白屈菜红碱分支通路被有效截断。
[0087]
②
、分支前通路化合物定量分析。对6株mcsmt基因敲除突变体植株及6株野生型植株全株(含根、茎、叶)进行分支前通路化合物含量定量分析,根据峰面积和标准曲线计算各化合物含量,结果如图7所示,整体来看,与野生型植株比较,在截断白屈菜红碱分支通路后,分支前的化合物(s)-去甲基衡州乌药碱、衡州乌药碱、(s)-n-甲基衡州乌药碱、3-羟基-n-甲基衡州乌药碱、(s)-网脉荔枝碱、(s)-金黄紫堇碱等化合物含量除(s)-网脉荔枝碱外均显著升高。
[0088]
注:柱状图分别对应上部分支前通路化合物,从左至右分别为(s)-去甲基衡州乌药碱、衡州乌药碱、(s)-n-甲基衡州乌药碱、3-羟基-n-甲基衡州乌药碱、(s)-网脉荔枝碱、(s)-金黄紫堇碱。星号表示显著性差异(*表示p《0.05,**表示p《0.01,***表示p《0.005,****表示p《0.001)
[0089]
③
、血根碱分支通路化合物定量分析。对6株mcsmt基因敲除突变体植株及6株野生型植株全株(含根、茎、叶)进行血根碱分支通路化合物含量定量分析,根据峰面积和标准曲线计算各化合物含量,结果如图8所示,与野生型植株相比较,在敲除白屈菜红碱分支通路关键基因mcsmt后,血根碱分支通路化合物(s)-碎叶紫堇碱标准曲线、(s)-刺罂粟碱、(s)-cis-n-甲基刺罂粟碱、原阿片碱、二氢血根碱、血根碱等化合物含量除(s)-刺罂粟碱外均明显提升,尤其是二氢血根碱和血根碱,提高的极为显著,平均含量分别提高了4.95倍和3.29倍。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1