PfAgo蛋白介导的B19病毒核酸检测试剂盒及检测方法
pfago蛋白介导的b19病毒核酸检测试剂盒及检测方法
技术领域
1.本发明属于b19病毒检测技术领域,具体涉及一种pfago蛋白介导的b19病毒核酸检测试剂盒及检测方法。
背景技术:
2.b19病毒属细小病毒科红细胞病毒属,是目前为止能够感染并引起人类疾病的仅有的两种细小病毒之一。作为一种重要病原,b19病毒感染不同人群能够引起如儿童传染性红斑、急性再障危象、胎儿水肿甚至死胎等疾病,同时,由于其可经输血和血液制品传播,b19病毒还与输血安全及血液制品的病毒安全性密切相关,因此,开发新的病毒检测技术具有重要应用价值。
3.目前,b19病毒核酸检测主要包括斑点杂交法、原位杂交法、聚合酶链反应法。近年来,随着以crispr/cas9为代表的新型基因编辑技术的出现并广泛应用于病原微生物等的检测,使得传统分子诊断技术迈入了低成本、高灵敏性、高特异性的新型分子诊断阶段。作为dna病毒,b19病毒的新型检测系统e-cripsr法也已成功建立,主要是基于crispr-cas12a特异性切割dna性质,其检测灵敏度达到pmol级别,这表明基于新型基因编辑酶crispr/cas系统的分子诊断方法在b19病毒检测过程中具有潜在的应用前景。但是,鉴于crispr/cas系统中grna的合成费用昂贵问题,开发新的分子诊断方法具有重要意义。
4.argonaute蛋白是核酸引导的核酸内切酶,在真核生物中,该蛋白参与了rna沉默或rna向导的rna切割;而在原核生物中,该蛋白可在短的dna序列的引导下切割ssdna或ssrna,其中ngago曾经被认为是替代cas9的新型基因编辑酶。目前,尽管基于agos的基因编辑方法并未建立成功,但是其在体外分子诊断方面的应用仍获得了重要进展。pfago是一种从嗜热古生火球菌(pyrococcus furiosus)提取出的argonaute蛋白,可在短的dna序列的引导下切割ssdna或ssrna。同时,pfago切割产生的短单链dna可与apo-pfago蛋白结合,在同一反应体系中启动下游靶标的第二轮切割,基于该原理发明人已经建立的pfago介导的核酸检测(pand)技术,可实现对人乳头瘤病毒(hpv)和sars-cov2的核酸检测(he r,wang l,wang f,li w,liu y,li a,wang y,mao w,zhai c,ma l.pyrococcus furiosus argonaute-mediated nucleic acid detection.chem commun(camb).2019,55(88):13219-22;wang f,yang j,he r,yu x,chen s,liu y,wang l,li a,liu l,zhai c,ma l.pfago-based detection of sars-cov-2.biosens bioelectron.2021,177:112932)。
技术实现要素:
5.有鉴于此,本发明的目的在于利用pfago介导的核酸检测技术实现对b19病毒的检测,并建立一套高灵敏度和特异性的b19病毒的核酸检测系统。
6.为了实现上述目的,本发明的技术方案具体如下:
7.一种检测试剂盒,包括:
8.引导pfago蛋白靶向b19病毒ns1基因的gdna,具体为如序列seq id no:1所示的
gt-b19、如序列seq id no:2所示的gf-b19以及如序列seq id no:3所示的gr-b19,或仅为如序列seq id no:2所示的gf-b19;
9.带有荧光基团和猝灭基团的分子信标;
10.以及pfago蛋白。
11.优选地,分子信标的核苷酸序列如seq id no:4所示。
12.优选地,检测试剂盒中还包括用于特异性扩增ns1基因上靶标序列的扩增试剂;更加优选地,扩增试剂包括如序列seq id no:5~6所示的引物对。
13.上述检测试剂盒能够用于鉴定或辅助鉴定b19病毒。
14.基于上述检测试剂盒,本发明建立了pfago蛋白介导的b19病毒核酸检测方法,具体步骤如下:
15.s1、对待测样本扩增得到tdna;
16.s2、设立包括5’磷酸化的gdna、pfago蛋白、tdna、pfago反应缓冲液和分子信标的反应体系,进行切割反应;
17.s3、反应结束后,对上述反应体系进行荧光检测。
18.优选地,步骤s2的反应体系中,gdna与pfago蛋白的摩尔比为1∶460。
19.优选地,切割反应的温度为90~98℃;最佳地,切割反应温度为95℃。
20.优选地,步骤s2的反应体系中,tdna的含量≥0.1pmol。
21.优选地,pfago反应缓冲液包括:200mm hepes(ph=8.0),2.5m氯化钠和5mm氯化锰。
22.本发明的有益效果为:
23.1)相比于cas9系统的向导rna,本发明使用的向导ssdna不仅能方便、稳定的获得,而且具有成本优势。同时,通过对检测系统中gdna的优化,不仅减少了实验过程中gdna的用量,也减少了筛选能特异性切割靶dna的gdna的过程,更降低了实验过程中必要的5’磷酸化反应程序,从而降低检测的成本,减少费时费力的繁杂过程。
24.2)本检测系统中tdna低至pmol级别后仍能被检测到,与pcr技术联用后其检测灵敏度可达到am,超过了e-cripsr法。
附图说明
25.图1为本发明制备的his-pfago蛋白表达载体的构建和表达纯化鉴定图;
26.图2为本发明制备的his-pfago融合蛋白在gdna介导下切割dna活性的表征图;
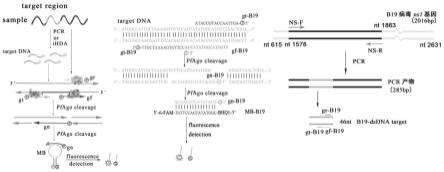
27.图3为实施例1中pfago介导的靶向b19病毒ns1基因的核酸检测方法原理图;
28.图4为实施例1构建的检测体系的测试结果图,其中a为gdna-b19引导pfago特异性切割b19病毒ns1基因产物的胶图,b为荧光强度检测结果分析图;
29.图5为实施例1构建的检测体系的灵敏度检测结果图;
30.图6为实施例2中pfago介导的靶向b19病毒ns1基因的核酸检测方法原理图;
31.图7为实施例2构建的检测体系的测试结果图,其中a为gf-b19引导pfago特异性切割b19病毒ns1基因产物的胶图,b为荧光强度检测结果分析图;
32.图8为实施例2构建的检测体系的灵敏度检测结果图;
33.图9为不同组guide引导pfago特异性切割分子信标和tdna的胶图。
具体实施方式
34.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明作进一步地详细描述。显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。
35.本发明构建了pfago介导的靶向b19病毒ns1基因的检测系统,先设计了靶向b19病毒ns1基因的gdna,gdna引导pfago特异性切割b19病毒ns1基因片段,进而生成靶向荧光分子信标的gn-dna,再通过第二轮切割,实现对b19病毒高灵敏性检测。
36.pfago蛋白既可以是从生物体内直接获取的天然蛋白,也可以为重组蛋白。本发明实施例使用的pfago蛋白为重组蛋白,其制备过程如下:
37.(1)重组pfago表达载体的构建及诱导表达与鉴定
38.利用pfu dna聚合酶扩增pfago基因(扩增引物为pfago-f/r,其序列如seq id no.9~10所示)和反向扩增pet-23a,通过t5核酸外切酶介导的同源重组法进行基因克隆,重组质粒经nde i和xho i酶切后利用0.8%琼脂糖凝胶检测。结果如图1中a所示(其中,m为1kb dna marker,1为xhoi/nde i酶切,2为xhoi酶切,3为nde i酶切,4为pet-23a-pfago对照),双酶酶切产物大小与预期结果一致,初步表明pet-23a-pfago表达载体构建成功,然后将酶切正确质粒送上海生工测序进一步验证正确。
39.将pet-23a-pfago表达载体转化e.coli bl21-de3菌株,经1.0mm iptg低温诱导表达20h,收集菌体,超声破菌,离心取上清后经70~80℃水浴除去大量杂蛋白,再次离心取上清,用滤膜过滤后加至ni柱亲和层析纯化柱中,封口后放置于静音混合器上4℃孵育2h。依次用含终浓度10mm、20mm、50mm、100mm、200mm咪唑的pfago裂解缓冲液(含有20mm tris-盐酸ph=8.0,200mm氯化钠以及0.2mm氯化锰)洗脱,并收集目的蛋白。经超滤透析浓缩,测得蛋白浓度为1.312mg/ml。
40.图1中b为pet-23a-pfago诱导表达产物的8%sds-page凝胶电泳图,其中,m为protein marker,1为全菌体,2为破菌上清,3为破菌沉淀,4为高温处理上清,5为流穿,6~10依次为10、20、50、100和300mm咪唑洗脱。结果显示:经高温处理后his-pfago蛋白清晰可见,且与预期大小90.4kda一致,ni柱亲和层析纯化显示目的蛋白获得了较好的纯化。
41.图1中c为pet-23a-pfago诱导表达产物基于anti-his一抗的western blot验证结果,其中m为protein marker,1为未诱导组,2为iptg诱导组。该图进一步证实了his-pfag蛋白的成功表达,值得注意的是,未诱导也检测到his-pfago蛋白表达,其原因在于pet23a-pfago存在本底表达。
42.另外,诱导表达条件优化实验显示,诱导时间在20h左右最优,而iptg的浓度对蛋白表达量的影响不大。
43.(2)his-pfago融合蛋白核酸内切酶活性的鉴定
44.设立反应体系:将合成的阳性gdna进行5’磷酸化,加入his-pfago蛋白(二者摩尔比1∶350),0.5pmol单链靶tdna(target dna,tdna)和pfago反应缓冲液(含有200mm hepes ph=8.0,2.5m氯化钠以及5mm氯化锰),95℃反应30min。具体的,gdna介导pfago蛋白切割tdna的示意图如图2中a所示,其中箭头表示切割位点。
45.反应结束后加入2
×
tbe-page电泳上样缓冲液,95℃孵育5min,经20%tbe-page电泳,sybr gold核酸染料避光染色3~5min验证酶切情况。结果如图2中b所示,其中1为体系中只含tdna,2为无pfago蛋白对照,3为无5’磷酸化的gdna对照,4为目的样品酶切结果。表
明在5’磷酸化的gdna介导下pfago蛋白切割45nt的单链tdna产生34nt的dna产物,故纯化的his-pfago融合蛋白具有gdna介导的切割dna的活性。
46.实施例1
47.本实施例中的靶序列为由引物对b19-ns1-f/r(序列如seq id no:5~6所示)扩增得到的pcr产物,记作b19 ns-p。设计合成的3条靶向b19 ns-p的gdna分别记为gt-b19(序列如seq id no:1所示)、gf-b19(序列如seq id no:2所示)和gr-b19(序列如seq id no:3所示)。对应的分子信标mb-b19的序列如seq id no:4所示。
48.构建反应检测体系具体如下:
49.将上述三条gdna-b19分别进行5’磷酸化,然后加入his-pfago蛋白,0.5pmol b19 ns-p,pfago反应缓冲液,以及5pmol分子信标mb-b19。在本反应体系中,三条gdna与his-pfago蛋白摩尔比均为1∶460。
50.反应体系的工作原理如图3所示:三条gdna-b19引导pfago切割b19病毒ns1基因双链dna,然后利用产生的gn-b19切割分子信标mb-b19。
51.使上述反应检测体系在95℃反应30min,经20%tbe-page电泳及荧光检测,结果如图4所示。a为gdna-b19引导pfago特异性切割b19病毒ns1基因产物图(1、3为无pfago的阴性对照,2、4为g-b19(gr,gt,gf)+b19 ns-p+pfago,1、2为sybr gold核酸染料染色,3、4为未核酸染色直接成像),显示b19 ns-p在gdna-b19(gr,gt,gf)介导下被切割得到5’p-gn-b19(如seq id no:7所示),其与pfago结合靶向28nt的荧光标记分子信标mb-b19产生16nt的dna产物。b为荧光强度检测结果分析图,显示pfago切割分子信标mb-b19后的荧光值约是不加pfago对照组的2.3倍,表明该反应中可实现对分子信标的切割。
52.故对于该反应检测体系,若电泳检测到16nt产物,或荧光值相对于阴性对照有增加,说明待测样本中存在b19病毒。
53.灵敏性检测:根据上述反应检测体系,梯度减少反应体系中加入的b19病毒ns1基因的pcr产物(b19 ns-p)的量,且体系中其他物质含量不变;在95℃反应30min后,检测反应组与不加pfago对照组的荧光值情况。结果如图5所示:体系中所含pcr产物在0.1pmol情况下,仍可以检测到荧光值增加。
54.实施例2
55.实施例1建立的检测系统需要三条guide介导,增加了反应的复杂性。考虑第一轮切割产生的g-mb-b19需5’磷酸化及其与mb-b19的配对关系,本实施例通过扩增新的tdna(记作b19 ns-p’,其扩增引物如seq id no:1和seq id no:6所示),使其可以仅在gf-b19介导下被pfago切割得到首轮产物(记作g-mb-b19,序列seq id no:8所示),从而简化反应体系,工作原理见图6所示。
56.设立靶向b19病毒ns1基因pcr产物(b19 ns-p’)的反应体系:将5’磷酸化的gf-b19(即5’p-gf-b19)和pfago融合蛋白(二者摩尔比1:460),0.5pmol b19ns-p’,5pmol分子信标mb-b19(同实施例1)以及pfago反应缓冲液混合后,置于95℃反应30min,经20%tbe-page电泳检测及荧光强度检测。
57.电泳检测结果如图8中a(图中,1为无pfago的阴性对照,2为gf-b19+b19ns-p’+pfago,左侧图为sybr gold核酸染料染色,右侧图为紫外凝胶成像仪直接成像)所示:b19 ns-p’在单个5’p-gf-b19介导下被切割得到5’p-g-mb-b19,进而与pfago结合靶向28nt的荧
光标记分子信标mb-b19产生16nt的dna产物。
58.荧光强度检测结果如图7中b所示,pfago切割分子信标mb-b19后的荧光值约是不加pfago对照组的2.4倍。表明单个gdna介导的pfago检测系统也可用于b19病毒的核酸检测。
59.灵敏性检测:根据上述反应检测体系,梯度减少反应体系中加入的b19病毒ns1基因的pcr产物(b19 ns-p’)的量,且体系中其他物质含量不变;在95℃反应30min后,检测反应组与不加pfago对照组的荧光值情况。结果表明,该体系靶pcr产物量同样可以达到0.1pmol级别(如图8)。
60.对比例1
61.与实施例1不同的是,本实施例改变了gdna序列以及其靶向的b19病毒ns1基因片段。本实施例中,三条guide分别记作gt-b19-1(seq id no:11)、gf-b19-1(seq id no:12)和gr-b19-1(seq id no:13),第一轮切割产物记作gn-b19-1(seq id no:14),分子信标记作mb-b19-1(seq id no:15)。
62.对比例2
63.与实施例1不同的是,本实施例改变了gdna序列以及其靶向的b19病毒ns1基因片段。本实施例中,三条guide分别记作gt-b19-2(seq id no:16)、gf-b19-2(seq id no:17)和gr-b19-2(seq id no:18),第一轮切割产物记作gn-b19-2(seq id no:19),分子信标记作mb-b19-2(seq id no:20)。
64.对比实施例1、对比例1、2的检测结果,具体如图9所示,其中2-7泳道依次为gn-b19、gn-b19-1、gn-b19-2引导切割相对应分子信标,9-10泳道依次为三组guide引导下切割pcr产物后第二轮切割分子信标。从图中可知,实施例1中的gn-b19可实现对分子信标mb-b19的切割,而对比例1、2中的切割效果较差,不利于检测。
65.综上所述,本发明采用pfago介导的核酸检测技术,成功实现了三条或单条gdna引导pfago靶向b19病毒ns1保守区的核酸检测,不仅检测成本低且灵敏度高。这将为其他细小病毒如犬细小病毒(canine parvovirus,cpv)、猪细小病毒(porcine parvovirus,ppv)等重要动物细小病毒的病原检测提供重要的工具,更将为人类和动物病原微生物传染病以及流行病监测和预防提供重要的支撑,具有重要的实际应用价值。
66.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
67.68.69.70.71.72.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1