一种细胞膜囊泡及其制备方法与应用
1.本发明涉及生物医药技术领域,尤其涉及一种细胞膜囊泡及其制备方法与应用。
背景技术:
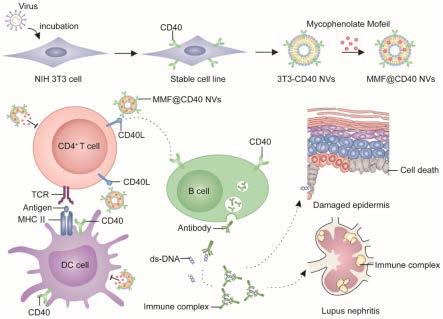
2.系统性红斑狼疮(systemic lupus erythematosus,sle)是一种多发于女性的具有潜在致命性、慢性、多器官性的自身免疫性疾病。sle在遗传缺陷和环境因素共同作用下,免疫系统无法识别“自我”,产生大量自身抗核抗体并形成免疫复合物,进而导致包括皮肤、肾脏、中枢神经和关节炎症反应以及组织损伤。sle的症状包括皮疹(如面部“蝴蝶斑”)、口腔溃疡、关节炎和神经症状,重要脏器如肾脏可产生进一步并发症,导致肾功能衰竭甚至导致死亡。紫外线照射、eb病毒感染和化学毒素等会诱导人体细胞凋亡或坏死,死亡细胞释放atp、高迁移率族蛋白b1(hmgb1)和热休克蛋白等“危险信号”,诱导巨噬细胞和中性粒细胞吞噬和清除凋亡小体和坏死的细胞碎片,从而维持机体的稳定和平衡。然而,中性粒细胞细胞功能的紊乱,使得细胞凋亡和坏死的细胞碎片不能及时清除,核抗原则会暴露给机体的免疫细胞。浆细胞样树突状细胞(pdcs)通过核酸识别受体tlr7和tlr9(toll-like receptor,tlr)对积累的核抗原反应,分泌1型干扰素(type 1interferon,ifn)。i型ifn和其他因子促进b细胞成熟和失去免疫耐受。b细胞激活后,会进行克隆增殖,进而成熟成浆细胞分泌自身抗核抗原并形成记忆性b细胞。b细胞分泌的自身抗原进一步与核抗原形成免疫复合物。t细胞在sle发病中起着核心作用。t细胞在b细胞的活化过程中起着免疫检查点的作用,t-b淋巴细胞异常相互作用在自身抗体的产生过程中同样发挥着重要作用。t细胞通过表面配体与b细胞直接相互作用,或通过分泌il-21促进b细胞分化成熟。此外,调节性t细胞在维持周边免疫耐受中也发挥着核心作用,低剂量的il-2可以有效促进treg细胞的数量,缓解系统性红斑狼疮的症状。
3.尽管随着科学进步,其他自身免疫疾病的治疗已经取得进展,然而sle的药物开发突破仍旧较少。在当前的临床治疗中,主要采用糖皮质激素(cgs)、免疫抑制剂(如环磷酰胺、吗替麦考酚、硫唑嘌呤)、羟氯喹和新药baff单抗综合搭配使用来改善系统性红斑狼疮的症状。羟氯喹是标准的基础护理用药,主要通过影响脂代谢和糖代谢来预防血栓和动脉粥样硬化,同时搭配阿司匹林来使用。糖皮质激素可以快速缓解症状。以上药物虽然可以用于治疗一些症状较轻的sle患者,但长期使用存在感染风险。b细胞在红斑狼疮的发病机制中处于核心位置,目前的生物制剂的临床前研究和临床研究大多集中在b细胞。针对b细胞的选择性marker蛋白(cd19、cd20、cd22)、b细胞存活信号(baff、il-6、il-17、il-21)和b细胞活化共刺激因子信号(cd40-cd40l、icos-icosl)是药物研发的最重要靶点。目前,针对这些靶点的单抗药物已经应用或尝试应用于系统性红斑狼疮的临床治疗。但是cd20单抗药物具有严重的感染致死风险,cd19没有临床疗效,因而均停止了临床应用。baff的单抗药物rituxmab和belimumab在临床治疗中取了较好地效果,但是其有效率约在48.4%-61.4%,且伴随着感染的风险。因此,目前仍缺乏治疗sle的特效药物。cd4
+
t细胞表达cd40l与b细胞表面的cd40相互作用,促进b细胞的分化成熟。在系统性红斑狼疮病人中,cd4
+
t细胞、cd8
+
t
细胞、巨核细胞均过表达cd40l。cd40l转基因小鼠,也表现出系统性红斑狼疮的症状。因此,阻断cd40-cd40l信号轴,有望治疗系统性红斑狼疮。
技术实现要素:
4.本发明的首要目的在于克服现有技术的缺点与不足,提供一种细胞膜囊泡。
5.本发明的另一目的在于提供上述细胞膜囊泡的制备方法。
6.本发明的再一目的在于提供上述细胞膜囊泡的应用。
7.本发明的目的通过下述技术方案实现:一种细胞膜囊泡,制备细胞膜囊泡的细胞膜表面表达cd40蛋白。
8.优选地,所述细胞膜来源于nih 3t3细胞系。
9.上述细胞膜囊泡的制备方法,包括以下步骤:
10.(1)将cd40基因进行慢病毒包装,纯化病毒,利用病毒感染细胞,抗药性筛选,获得稳定表达cd40的细胞系;
11.(2)培养稳定表达cd40的细胞系,胰酶消化,收集并裂解细胞,两次离心后取上清,再次离心后收取沉淀,过滤,得到细胞膜囊泡。
12.优选地,步骤(1)所述慢病毒包装的原载体为plv-egfp-n,xhoi-noti插入cd40序列(seq id no.1),重组得到目的质粒plv-cd40-egfp-n,病毒包装质粒为ph1和ph2;更优选地;所述目的质粒plv-cd40-egfp-n、病毒包装质粒ph1和ph2的质量比为4:3:1配比。
13.优选地,步骤(1)所述感染细胞采用的细胞密度为50-60%。
14.优选地,步骤(1)所述感染细胞加入终浓度为6μg/ml的polybrene。
15.优选地,步骤(1)所述病毒感染的细胞为小鼠成纤维细胞系nih 3t3细胞。
16.优选地,步骤(1)所述抗药性筛选采用嘌呤霉素。
17.优选地,步骤(2)所述裂解细胞利用低渗溶液裂解,并在冰上研磨。
18.所述低渗溶液组分为0.25m sucrose、1mm edta、20mm hepes-naoh,ph为7.4。
19.优选地,步骤(2)所述两次离心取上清为1000rpm离心5min后取上清,再3000g离心5min,取上清。
20.优选地,步骤(2)所述离心后收取沉淀为4℃、100,000g离心30min后收取沉淀。
21.优选地,步骤(2)所述过滤为依次采用过0.8和0.22μm滤头过滤7次。
22.上述细胞膜囊泡在制备系统性红斑狼疮治疗药物中的应用。
23.优选地,所述系统性红斑狼疮治疗药物采用细胞膜囊泡作为载体,装载治疗系统性红斑狼疮的药物得到。
24.优选地,所述治疗sle的药物为吗替麦考酚(mmf)。
25.优选地,所述装载的方式为:将细胞膜囊泡与治疗统性红斑狼疮的药物共孵育,4℃条件下离心,去上清,得到。
26.优选地,所述共孵育的时间为2-3h。
27.优选地,所述离心为100,000g离心20-40min。
28.与现有技术相比,本发明具有以下有益效果:
29.本发明的细胞膜囊泡的细胞膜表面表达cd40蛋白,通过竞争性与t细胞表面的cd40l相互作用,阻断cd40-cd40l信号轴,阻止b细胞的分化成熟,从而减少自身免疫活化水
平。同时细胞膜囊泡作为靶向给药系统用来负载免疫抑制剂,缓解sle小鼠的症状。
附图说明
30.图1a是过表达cd40的nih 3t3细胞激光共聚焦显微镜图;图1b是western blot验证表达cd40的nih 3t3细胞蛋白表达结果图;图1c是利用流式细胞术验证nih 3t3-cd40细胞系构建结果图;图1d是细胞膜囊泡透射电子显微镜图;图1e是细胞膜囊泡激光共聚焦显微镜图;图f是细胞膜囊泡动态光散射图;图1g是western blot验证细胞膜囊泡蛋白表达结果图。
31.图2a是共聚焦显微镜观察cd40 nvs与cd4
+
t细胞共孵育结合情况结果图;图2b是共聚焦显微镜观察free nvs与cd4
+
t细胞共孵育结合情况结果图;图2c是细胞膜囊泡在血液中的循环滞留时间曲线图;图2d是细胞膜囊泡在小鼠器官中的分布图。
32.图3a是系统性红斑狼疮小鼠治疗实验方案图;b是组织免疫荧光法检测igg免疫复合物沉积情况;c是组织免疫化学法检测补体c3沉积情况;g1为pbs组,g2为free nvs组,g3为mmf-free nvs组,g4为mmf组,g5为cd40 nvs组,g6为mmf-cd40 nvs组。
33.图4a是利用流式细胞术检测脾脏b细胞的数量;b是流式细胞术检测脾脏gc b细胞的数量;c是利用流式细胞术检测脾脏中dc成熟情况;d是利用组织免疫荧光法检测b细胞和gc b细胞的数量;g1为pbs治疗,g2为free nvs治疗,g3为mmf-free nvs治疗,g4为mmf治疗,g5为cd40 nvs治疗,g6为mmf-cd40 nvs治疗。
34.图5是细胞膜囊泡的作用原理图。
35.图6是目的质粒plv-cd40-egfp-n图谱。
具体实施方式
36.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
37.实施例1建立稳定表达cd40的成纤维细胞系
38.(1)分子克隆:将目的质粒plv-cd40-egfp-n(cd40序列插入到原载体plv-egfp-n(图6)中,克隆位点为xhoi-noti)、病毒包装质粒ph1和ph2(北京英茂盛业生物科技有限公司)分别进行扩增,步骤如下:将transstbl3感受态细胞(全式金)置于冰上解冻,在超净台环境条件下分别加入500ng上述3种质粒,轻弹混匀,冰上静置30min,42℃、水浴热激50s,冰浴3min,在超净台中加入200μl lb培养基,37℃、220rpm摇1.5h,得到培养物。吸200μl培养物涂布amp平板培养基(60μg/ml),在细菌培养箱中培养12h。挑平板培养基上的单菌落分别至含有60μg/ml氨卞青霉素的lb摇菌管,37℃、220rpm摇12h,得到菌液。每管吸200μl菌液,送到擎科生物科技有限公司进行碱基测序。剩余的菌液暂存4℃冰箱。测序结果与ncbi上gene数据库的cd40碱基序列(chromosome 2,nc_000068.8)一致,将剩余菌液用天根高纯度质粒小提试剂盒进行质粒提取,步骤按照说明书进行。提取的质粒测浓度和纯度,要求od
260
/od
280
》1.8,od
260
/od
230
》2。检测完毕后,质粒保存在-20℃。
39.(2)构建稳定细胞系:提前一天将hek 293t细胞(丰晖生物,crl-11268)铺板到
10cm皿,密度为50%。第二天,在生物安全柜内,向2管15ml离心管内分别加入4ml mem基础培养基,不含血清和抗生素,加入终浓度为6μg/ml的polybrene(碧云天)。其中一管加入目的质粒6μg目的质粒plv-cd40-egfp-n、病毒包装质粒ph14.5μg、病毒包装质粒ph21.5μg。另外一管加入15μl(lipofectamine 3000)静止5min,两管混合再静止30min。将混合管加入10cm皿,放入37℃培养箱培养72h,在此期间收集上清。收集72h的上清液后,500g,10min,4℃离心,去除沉淀即细胞。加入病毒纯化试剂(origene,tr30025),轻微混匀,4℃过夜。第二天,3500g,25min,4℃离心,去除上清。使用100ul pbs重悬。完成纯化病毒步骤后,将纯化后的病毒加入铺小鼠成纤维细胞系nih 3t3细胞(丰晖生物,cl0244)的10cm皿里,感染96h后部分nih 3t3细胞表达绿色荧光蛋白融合的cd40蛋白,加入2μm的嘌呤霉素对细胞进行抗药性筛选,最终获得稳定表达cd40的成纤维细胞系。
40.(3)检测cd40蛋白在成纤维细胞中的表达:在激光共聚焦显微镜下观察到绿色荧光,初步证明egfp-cd40融合蛋白表达(图1a)。再采用蛋白免疫印迹的方法(western blot)检测cd40蛋白的表达,将空白对照、cd40稳定表达成纤维细胞系铺板于六孔板,密度高达90%,过夜。在冰上用细胞刮对细胞进行收样,4℃、3500rpm摇10min,然后将细胞用1
×
pbs洗两次,用150μl加了蛋白酶抑制剂的ripa裂解液(赛默飞)重悬细胞,超声波细胞破碎仪进行细胞破碎,于冰上25%功率超声3s后暂停3s,重复超声4次。将超声后的内容物离心,4℃、3500g离心10min,取上清。然后采用bca蛋白浓度测定试剂盒(碧云天)对各组蛋白浓度进行检测,步骤按照说明书进行。测完浓度后,每组取120μg,用ripa裂解液补充体积至150μl,加入37.5μl 5
×
sds-page蛋白上样缓冲液,混匀后,100℃加热10min,然后进行western blot步骤:
41.1)配制浓度为10%的sds-page凝胶,每孔上样品20μl,70v电压下进行电泳;
42.2)预先用甲醇活化pvdf膜,按黑板-海绵-滤纸-胶-pvdf膜-滤纸-海绵-白板制作转膜“三明治”。将转膜槽置于冰中,恒流转膜,250ma、2h;
43.3)配制5%脱脂奶粉,室温封闭pvdf膜1h;
44.4)剪膜,分别孵cd40抗体(abcam,ab252328)和β-actin抗体(santa cruz,sc-47778),4℃、50rpm摇床过夜;
45.5)在摇床上用tbst洗膜三次,每次10min,室温孵育二抗(hrp抗鼠二抗,invitrogen,31430;hrp抗兔二抗,invitrogen,31460)1h;
46.6)在摇床上用tbst洗膜三次,每次10min;
47.7)将buffera和bufferb按1:1比例配置ecl发光液(北京英格恩生物),曝光。
48.western blot结果见图1b,有cd40蛋白明显条带,证明cd40蛋白在成纤维细胞中表达。
49.(4)流式细胞术检测稳定细胞系的构建:将空白nih 3t3细胞、cd40稳定表达成纤维细胞铺板于六孔板。待细胞密度为90%时去除原培养基,加入pbs用细胞刮轻轻收取细胞。在1,000rpm下离心5min,用1
×
pbs洗一次。去除上清后,分别用1ml 1
×
pbs重选细胞沉淀。上机,选用fitc通道检测两种细胞的信号强度。检测结果见图1c,证明稳定细胞系构建成功。
50.实施例2cd40细胞膜纳米囊泡的制备及其生物学表征
51.(1)提取细胞膜:培养cd40稳定表达成纤维细胞系,通过胰酶消化,离心收集细胞。
利用低渗溶液(0.25m sucrose、1mm edta、20mm hepes-naoh,ph 7.4)裂解细胞,并使用组织研磨器在冰上研磨裂解细胞。充分裂解后,1000rpm离心5min,取上清,去除沉淀即细胞。再3000g离心5min,取上清,去除沉淀即碎片。再将其100,000g,4℃,30min离心,去上清,用pbs重悬沉淀,通过0.8和0.22μm滤头分别过滤7次,即细胞膜囊泡。
52.(2)电镜检测细胞膜囊泡的形态:利用透射电镜对制备的细胞膜囊泡的形态和粒径进行观察和测量。将5ul(500ug/ml)的细胞膜囊泡滴在铜网上,静置30秒,用滤纸吸去溶液,再用醋酸铀复染30秒,最后在透射电镜下检测细胞膜囊泡的形貌,结果见图1d,细胞膜囊泡为双层膜结构。
53.(3)检测细胞膜囊泡的粒径和表面电位:采用动态光散射(dls)检测细胞膜囊泡的粒径和囊泡的膜表面电位,结果见图1f,细胞膜囊泡的直径约为120nm。
54.(4)激光共聚焦显微镜和western blot检测细胞膜纳米囊泡上cd40蛋白表达:cd40蛋白融合表达绿色荧光蛋白,利用激光共聚焦显微镜检测囊泡上的绿色荧光,鉴定cd40是否表达并定位在细胞膜囊泡上,结果见图1e,细胞膜囊泡带有egfp-cd40融合蛋白。另外,利用western blot实验来检测细胞膜囊泡上cd40的表达,结果见图1g,证明了制备的细胞膜囊泡带有egfp-cd40融合蛋白。
55.实施例3体外细胞膜囊泡与cd4
+
t细胞结合的影响
56.从中国基础医学细胞中心购买cd4
+
t细胞,即ci.ly1
+
2-/9。将实施例2得到的表达cd40的细胞膜囊泡cd40 nvs与cd4
+
t细胞共同孵育过夜,与此同时以未表达cd40的细胞膜囊泡free nvs作为阴性对照。用hoechst染细胞核10min,之后在共聚焦显微镜下观察细胞膜囊泡与cd4
+
t细胞的结合,结果见图2a、b,证明所制备的cd40 nvs能够以cd40依赖方式与cd4
+
t细胞结合。
57.实施例4cd40细胞膜囊泡在小鼠血液中的循环滞留时间及其在各器官分布的研究
58.(1)细胞膜囊泡的荧光标记:利用cy5.5标记细胞膜囊泡,将cy5.5溶液与细胞膜囊泡室温共孵育20min,洗去未反应的cy5.5,离心收集细胞膜囊泡,待用。
59.(2)细胞膜纳米囊泡在小鼠体内的循环时间研究:采用cy5.5标记细胞膜囊泡尾静脉注射小鼠,定时取血(2min、0.5h、1h、2h、8h、24h和48h),通过酶标仪检测cy5.5的吸收峰,从而测算血液中细胞膜囊泡的残余量,得到细胞膜囊泡在小鼠血液中的循环滞留时间曲线,结果见图2c,表明细胞膜囊泡在血液中有较好的滞留能力。
60.(3)细胞膜囊泡在小鼠体内器官分布研究:将cy5.5标记的细胞膜囊泡尾静脉注射小鼠,定时(24h)取出小鼠的器官(胰腺、心脏、肝脏、脾脏、肺和肾脏),利用小动物活体成像仪检测细胞膜囊泡在不同器官中的分布,结果见图2d,表明细胞膜囊泡主要分布在小鼠的肾脏、肝脏和脾脏部位。
61.实施例5细胞膜囊泡调控mrl/lpr系统性红斑狼疮小鼠肾炎的研究
62.(1)细胞膜囊泡对系统性红斑狼疮小鼠自身抗体的影响:采用雌性mrl/lpr小鼠(常州卡文斯有限公司)进行实验(图3a)。动物实验在中山大学动物实验伦理委员会批准下进行。对12周龄mrl/lpr小鼠开始进行抗anti-ds-dna抗体水平监测。一旦小鼠发病,开始对系统性红斑狼疮小鼠进行尾静脉注射药物(体系为150μl)治疗:pbs组(1
×
pbs 150μl);free nvs组(对照细胞膜囊泡);cd40 nvs组(细胞膜囊泡);mmf组;free nvs@mmf组(对照细胞膜囊泡+mmf;cd40 nvs@mmf组(细胞膜囊泡+mmf);每组5只。对照细胞膜囊泡free nvs是
将不表达cd40的nih 3t3细胞采用与实施例2细胞膜囊泡相同的方法制备。free nvs@mmf组和cd40 nvs@mmf组药物的制备:将300μg对照细胞膜囊泡、细胞膜囊泡分别与10mg/ml免疫抑制剂mmf 37℃共孵育2h,4℃条件下100,000g离心30min,去上清,用1
×
pbs重悬沉淀洗3次,得到。每2天注射一次细胞膜囊泡,每两周利用elisa测量一次小鼠的ds-dna抗体水平,直至终点(20周),最后处死小鼠,进行下一步实验分析。
63.(2)细胞膜囊泡治疗对小鼠肾功能的影响:将尾静脉注射细胞膜囊泡治疗后的小鼠的肾脏组织进行冷冻切片以及石蜡切片,利用组织免疫荧光法和组织免疫化学法检测igg和c3免疫复合物沉积情况,结果分别见图3b和c证明mmf-cd40 nvs能够有效减少免疫复合物在小鼠肾小球中的沉积。
64.实施例6细胞膜囊泡对系统性红斑狼疮小鼠脾脏中b和dc细胞数量和活性的影响
65.(1)组织免疫荧光法检测b和dc细胞的数量:将实施例5中尾静脉注射细胞膜囊泡治疗后的小鼠的脾组织用1
×
pbs洗两次,滤纸吸干水分,用oct包埋剂包埋,置于-20℃冰箱冻到oct包埋剂凝固。将冷冻切片机预冷,切片厚度调为7μm,进行切片。将切好的片子室温放置2h,再进行下游操作,防止脱片。将恢复到室温的切片在1
×
pbs中浸泡15min,去除oct包埋剂。用滤纸吸走大部分水分,用免疫组化笔离组织远一点画圈,避免边缘效应。加入100μl 3%bsa配制的0.2%trixton-x100,室温孵育30min,吸走液体后,加入一抗(cd20:thermo ma1-7634;gl7:thermo 14-5902),放于湿盒中,4℃过夜。第二天,回收一抗,用1
×
pbs浸泡,在摇床上洗三次,每次10min。用滤纸吸走液体后,加入荧光二抗混合液,室温避光孵育1h。吸走二抗(anti-rat igg,alexa flour 647thermo a48289;anti-mouse,alexa flour 488thermo a32723)后,用1
×
pbs浸泡,在摇床上洗三次,每次10min。用滤纸吸走大部分水分后,加入终浓度为1μg/ml的dapi染液,室温避光孵育15min。吸走染液后,用1
×
pbs浸泡,在摇床上洗三次,每次10min。吸走水分后,滴加防荧光淬灭剂封片,盖上盖玻片,用指甲油固定盖玻片四周。尽快用激光共聚焦显微镜观察和拍片。
66.(2)细胞膜囊泡对系统性红斑狼疮小鼠脾组织b细胞和成熟dc细胞数量及活性的研究:实施例5中尾静脉注射细胞膜囊泡治疗后第8周,颈椎脱臼处死小鼠后,剥离小鼠脾脏,用1
×
pbs洗两次,去除血丝。用滤纸吸干后,称重脾脏,做好记录。称重后,将脾脏置于70μm细胞筛网上,筛网下接着50ml离心管,全程冰上操作。加入含有2%fbs的1
×
pbs润湿后,轻轻研磨,过程不断加入含有2%fbs的1
×
pbs冲洗,得到单细胞悬液。将单细胞悬液置在4℃条件下,350g离心5min,去上清,然后加入2%fbs的1
×
pbs洗两次,用500μl 2%fbs的1
×
pbs重悬,悬液分到1.5ml ep管中。利用流式细胞仪检测b细胞以及成熟dc细胞的数量和活性进行分析,流式步骤如下:
67.1、细胞表面分子检测:
68.1)用2%fbs的1
×
pbs重悬每管悬液体积至50μl,加入流式抗体(biotin anti-mouse b220,biolegend s19021b;biotin anti-mouse cd19,biolegend 115503;biotin anti-mouse gl7 biolegend 144602;biotin anti-mouse cd11c biolegend 117314;biotin anti-mouse cd80 biolegend 16-10a1;biotin anti-mouse cd86 biolegend 105006),4℃孵育30min。
69.2)染色结束后,用2%fbs的1
×
pbs洗两次,加500μl 2%fbs的1
×
pbs重悬细胞,尽快上机检测。
70.本发明的细胞膜囊泡作用原理见图5,质粒plv-cd40-egfp-n图谱见图6。
71.以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1