一种联苯-1,2,3-三氮唑偶联物及其制备方法和应用
1.本发明涉及生物医药领域,具体涉及一种联苯-1,2,3-三氮唑偶联物及其制备方法和应用。
技术背景
2.自1967年burnet发明了被称为免疫监视的敏感和特异性识别功能的免疫系统,药物化学领域兴起了在癌症免疫治疗药物上探索的狂潮。免疫检查点封锁(icb)抗癌疗法在过去几年中已经取得了显著的成就。最引人注目的免疫检查点受体是细胞程序性死亡蛋白-1(pd-1)和程序性死亡配体-1(pd-l1)。pd-1通过活化的t细胞、b细胞和自然杀伤细胞表达;pd-l1通常出现在抗原递呈细胞(apc)和许多不同的肿瘤细胞表面。1992年,日本京都大学tasuku honjo领导的团队在一项t细胞程序性死亡分子研究中发现了pd-1的基因编码。pd-1配体pd-l1于2000年和pd-l2于2001年的鉴定揭示了pd-1是一种免疫调节受体,在自身免疫、肿瘤免疫和免疫赦免中发挥重要作用。
3.肿瘤细胞上过表达的pd-l1可与活化的t细胞上的pd-1相互作用,诱导t细胞反应的抑制和细胞毒性t细胞功能障碍。基于这些效应,癌细胞可以利用pd-1/pd-l1通路逃避与适应性免疫抵抗机制相关的免疫监视。pd-1/pd-l1通路阻断剂的早期临床发现指出了增强抗肿瘤免疫和增强t细胞反应的广泛而多样的机会。
4.近年来,以研发免疫抗肿瘤药物治疗癌症为内容的研究是目前生命科学中前沿、重要的研究领域。尤其,以免疫检查点为靶点的药物治疗是将来治疗相关癌症的重要研究发展方向,比如:皮肤癌、头颈癌、肺癌、乳腺癌、淋巴瘤、胃癌和肾癌等癌症的治疗。直至目前,基于靶向免疫检查点的抗pd-1/pd-l1抗体类药物,美国fda批准上市了六种药物(nivolumab,pembrolizumab,cemiplimab-rwlc,atezolizumab,avelumab,durvalumab)。其中前三种单克隆抗体为靶向pd-1蛋白;而后三种则靶向pd-l1蛋白。这些单抗类药物在治疗黑色素瘤、非小细胞肺癌、头颈癌以及肾癌等癌症均有较好的表现,并且也陆续在国内上市。在国内,这方面的研究也是如火如荼,更有四款抗pd-1抗体药物获得cfda批准上市(特瑞普利单抗、信迪利单抗等)。因此,在靶向pd-1/pd-l1方面的抗肿瘤免疫抑制剂研发是目前我国重大新药创新专项的新动向之一。
5.另一方面,抗体药物存在生产成本高、半衰期长、免疫原性差等问题。小分子药物比单克隆抗体具有显著的优势,如口服给药、稳定性和膜通透性。因此,靶向pd-1/pd-l1的小分子免疫检查点抑制剂开发非常有价值。寻找有效的pd-1/pd-l1小分子抑制剂一直是学术界和工业界药物化学的主要挑战。最近,百时美施贵宝的研究人员已经报道了小分子(式a)抑制剂,它能够与pd-l1结合从而抑制其活性。aurigene研究人员也报道了恶二唑(式b)和噻二唑(式c),两个化合物能够破坏pd-1/pd-l1的相互作用的小分子。
[0006][0007]
1,2,3-三氮唑是最重要的含氮杂环化合物之一。1,2,3-三唑类化合物可以形成多种具有不同生物活性的非共价键,如氢键、疏水相互作用、范德华力和偶极-偶极键等。含头孢三嗪的1,2,3-三唑(式d)和羧基酰胺三唑(式e)用作抗癌剂。近年来,许多抗癌药物基于1,2,3-三唑与药物杂交的方法开发出来。这些杂合分子也表现出更好的活性,对抗耐药性和药物敏感性癌症与其独立的作用机制。因此本发明设计了新的抑制pd-1/pd-l1的小分子,合成了含1,2,3-三唑结构骨架化合物,并且其抗癌活性和pd-1/pd-l1的抑制活性值得研究。
[0008]
技术实现要素:
[0009]
针对目前靶向pd-1/pd-l1抗肿瘤小分子的研究存在的技术问题,本发明的目的在于提供一种新型的含有1,2,3-三唑结构的联苯-1,2,3-三氮唑偶合物及其制备方法和应用,并测定其抗肿瘤活性和与pd-1/pd-l1蛋白作用能力。此类化合物能够在体外很好的作用于人类癌细胞中高表达的pd-1/pd-l1蛋白,能够抑制pd-1/pd-l1蛋白相互作用从而抑制免疫逃逸的发生;并对肿瘤细胞进行体外毒理实验的筛选,该系列化合物对多种高表达pd-l1蛋白的肿瘤细胞产生了较强的抑制作用。这项发明对新发现的抗肿瘤小分子药物,尤其是促进1,2,3-三氮唑类衍生物的临床药物研发具有重要价值。
[0010]
一种联苯-1,2,3-三氮唑偶联物,其结构通式如式(ⅰ)所示:
[0011][0012]
其中式(ⅰ)中苯环上各取代基的选取,采用下列情况之一:
[0013]
1)r4为h,r
1-r3仅且其中之一选取下列取代基,其余均为h:
[0014]
—r1为h、br或ch3,
[0015]
—r2为h、cn、cf3、och3或ch2r5,
[0016]
—r3为f、br、och3或ch2r5,
[0017]
其中:
[0018]
—r5为cl、oh、n(ch3)(ch2)2oh、nh(ch2)2oh、nh(ch2)2r6或nh(ch2)3r6,
[0019]
—r6为oh、nhcoch3或n(ch2ch2oh)2,
[0020]
2)r2为h,r1为br,r3和r4仅且其中之一选取下列非氢取代基,另一个为h:
[0021]
—r3为ocf3、f、cl或no2,
[0022]
—r4为ocf3、f、ch3或cf3,
[0023]
3)r1和r3均为f,r2和r4均为h。
[0024]
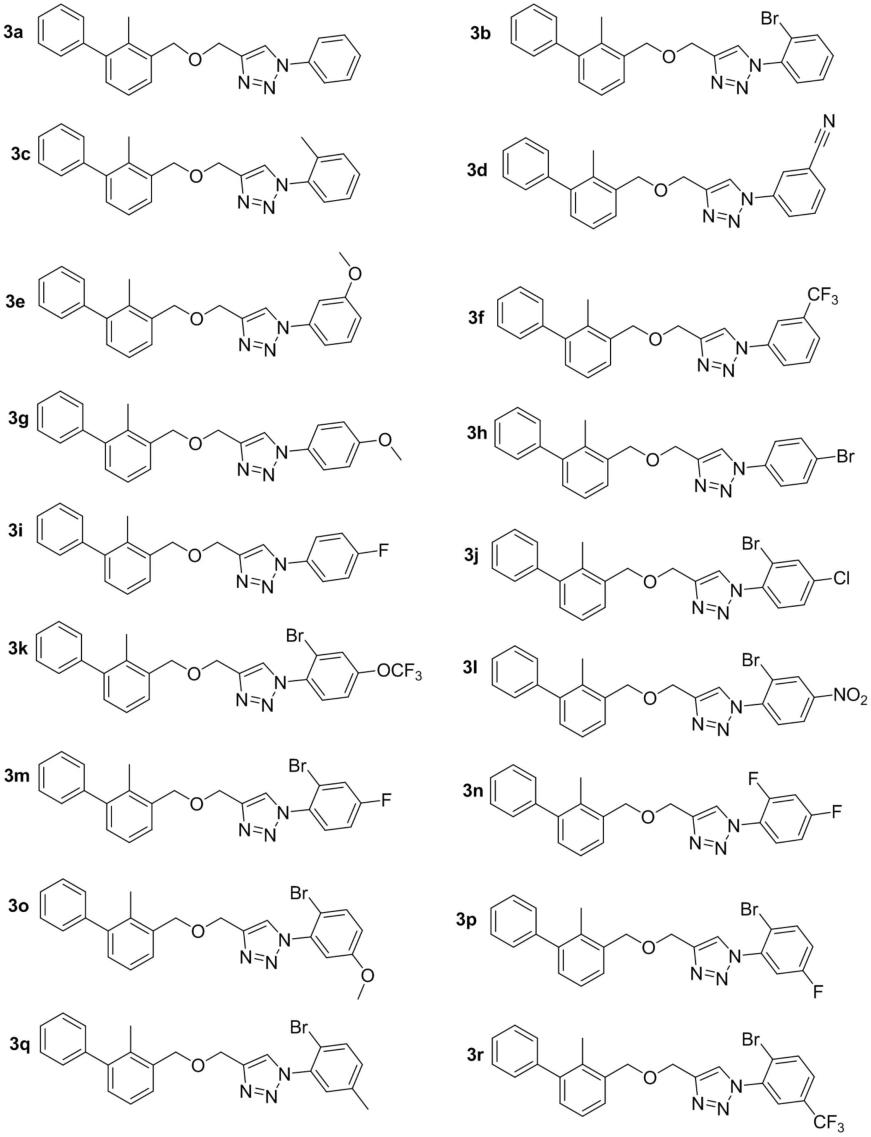
进一步地,所述的一种联苯-1,2,3-三氮唑偶联物选自下列之一:
[0025]
[0026][0027]
所述的一种联苯-1,2,3-三氮唑偶联物的制备方法,包括如下步骤:
[0028]
1)在氢化钠存在下,式(ⅱ)所示的(2-甲基联苯-3-基)甲醇与炔丙基溴反应得到式(ⅲ)所示的(2-甲基-3-(2-炔氧基)甲基)联苯;
[0029]
2)选用体积比1:0.5~2四氢呋喃/水混合液作为反应溶剂,式(ⅲ)所示的(2-甲基-3-(2-炔氧基)甲基)联苯在天冬氨酸钠、五水硫酸铜催化下与各种取代苯基叠氮化物通过点击化学反应,反应结束后反应液经后处理制得如化合物3a-r、4a-b任一所示的联苯-1,2,3-三氮唑偶联物;其中取代苯基叠氮化物的苯环上的取代基,与对应的化合物3a-r、4a-b的端部苯基上的取代基相同;
[0030]
3)化合物4a-b经氯化亚砜处理,反应结束后反应液经后处理能够制得化合物5a-b所示的联苯-1,2,3-三氮唑偶联物;
[0031]
4)在碳酸钾和乙腈存在下,化合物5a-b与各种脂肪胺反应即可得到化合物6a-h所示的联苯-1,2,3-三氮唑偶联物;其中所述脂肪胺为nh(ch3)(ch2)2oh、nh2(ch2)2oh、nh2(ch2)2r6或nh2(ch2)3r6,r6为oh、nhcoch3或n(ch2ch2oh)2;
[0032][0033]
进一步地,步骤1)中反应是在室温下进行,反应时间7~10小时,式(ⅱ)所示的(2-甲基联苯-3-基)甲醇与炔丙基溴投料摩尔比为1:0.8~1.2。式(ⅱ)所示的(2-甲基联苯-3-基)甲醇与氢化钠的投料摩尔比为1:2.5~4,优选为1:3。
[0034]
进一步地,步骤2)中点击化学反应的反应温度为室温,反应时间7-9h,优选为8小时。步骤2)中(2-甲基-3-(2-炔氧基)甲基)联苯、取代苯基叠氮化物、五水硫酸铜及天冬氨酸钠的投料摩尔比为5.0-5.5:5.0-5.5:0.8~1.2:1,优选摩尔比为5.25:5.25:1:1;
[0035]
步骤2)中的后处理方法如下:先减压出去四氢呋喃,再用乙酸乙酯萃取,用饱和盐水溶液洗涤,用无水硫酸钠干燥,真空浓缩得粗产品;最后通过柱色谱法用含20%-40%(体积分数)乙酸乙酯的石油醚混合溶剂作为洗脱液提纯,制得如化合物3a-r、4a-b任一所示的联苯-1,2,3-三氮唑偶联物。
[0036]
进一步地,步骤3)中反应温度为室温,搅拌反应1.5-4h,优选为2小时;化合物4a-b与氯化亚砜的投料摩尔比为1:1.0-3.0,优选摩尔比为1:2.0。
[0037]
步骤3)中后处理方法如下:反应经tlc检测完成后,饱和碳酸氢钠水溶液加入反应混合物中,然后用二氯甲烷萃取产物,收集有机层,用无水硫酸钠干燥,真空浓缩得粗产品;最后通过柱色谱法用含10%-30%(体积分数)乙酸乙酯的石油醚混合溶剂作为洗脱液提纯,制得化合物5a-b所示的联苯-1,2,3-三氮唑偶联物。
[0038]
进一步地,步骤4)中反应温度为室温,搅拌反应6-12h,优选为8小时;化合物5a-b、各种脂肪胺、碳酸钾的投料摩尔比为1:0.8-1.5:1.0-3.0,优选摩尔比为1:1:1.2~1.5。
[0039]
进一步地,步骤4)中后处理方法如下:反应经tlc检测完成后,溶剂通过减压移除,然后用乙酸乙酯萃取,收集有机层,用无水硫酸钠干燥,真空浓缩得粗产品;最后通过柱色谱法用含5%-15%(体积分数)甲醇的二氯甲烷混合溶剂作为洗脱液提纯,得到化合物6a-h所示的联苯-1,2,3-三氮唑偶联物。
[0040]
本发明所述的联苯-1,2,3-三氮唑偶联物(3a-r,4a-b,5a-b,6a-h)在制备抗肿瘤药物中的应用,具体为:在基因分子水平上,所述目标化合物作用于人类癌症细胞中高表达的pd-1/pd-l1蛋白,能够抑制pd-1/pd-l1蛋白相互作用从而抑制免疫逃逸的发生;在细胞水平上,所述目标化合物与人类非小细胞肺癌a549、hcc827细胞和乳腺癌mda-mb-231细胞的作用,检测化合物对三种人类癌细胞生长抑制能力和细胞迁移、浸润作用的抑制能力。
[0041]
进一步地,本发明联苯-1,2,3-三氮唑偶联物用于制备抑制a549、hcc827或mda-mb-231的抗肿瘤药物。
[0042]
通过采用上述技术,与现有技术相比,本发明的有益效果如下:
[0043]
1)本发明综合反应中避免了反应温度过高、导致反应副产物增多的技术问题,在
能保证合理反应时间的同时,提高反应产率;
[0044]
2)本发明以(2-甲基联苯-3-基)甲醇为原料,在氢化钠存在下用炔丙基溴化物溶液处理,得到(2-甲基-3-(2-炔氧基)甲基)联苯中间体,并在天冬氨酸钠、五水硫酸铜催化下与各种芳香叠氮化物通过点击化学反应,设计、合成了联苯-1,2,3-三氮唑偶联物(3a-r,4a-b),其制备方法简单、对设备要求低,且所制得的化合物收率和纯度高,其纯度高达98%以上,其结构通过核磁和质谱均得以验证;
[0045]
3)本发明通过应用所制得的化合物与人类癌症细胞中高表达的pd-1/pd-l1蛋白,进行了体外分子水平选择性抑制pd-1/pd-l1蛋白结合能力的研究。均相时间分辨荧光实验(htrf)结果表明:大部分化合物对人类癌症细胞中高表达的pd-1/pd-l1蛋白结合能力的htrf曲线呈现倒s型,意味着在本发明的实验条件下,pd-1/pd-l1蛋白结合受到了抑制。通过htrf实验,发现4a-b、5a-b、6a-h系列的联苯-1,2,3-三氮唑偶联物对pd-1/pd-l1蛋白相互结合具有更强的抑制能力;
[0046]
4)本发明通过应用制得的化合物从细胞水平对人类非小细胞肺癌细胞(a549、hcc827)和乳腺癌细胞(mda-mb-231)进行了毒理活性的研究,结果表明:大部分化合物,尤其是4a-b、5a-b、6a-h系列化合物对三种癌细胞的生长产生了较好的抑制活性,其中化合物6d、6e、6h对三种癌细胞产生了明显的毒理活性。
附图说明
[0047]
图1.联苯-三氮唑偶联物对的a549、hcc827、mda-mb-231肿瘤细胞活力的影响;
[0048]
图2.htrf方法检测联苯-三氮唑偶联物对pd-1/pd-l1相互作用的影响能力结果。
具体实施方式
[0049]
以下结合具体实施例对本发明作进一步的描述,但本发明的保护范围并不仅限于此:
[0050]
本发明实施例给出3a-r、4a-b、5a-b、6a-h共30个目标化合物,它通过以在氢化钠存在下,以(2-甲基联苯-3-基)甲醇(ⅱ)为原料,用炔丙基溴化物溶液处理,通过点击化学反应原理,得到了中间体(2-甲基-3-(2-炔氧基)甲基)联苯(ⅲ),该中间体进一步分别和各种芳香叠氮化物,在四氢呋喃:水=1:1(体积比)体系中与五水硫酸铜、天冬氨酸钠反应得到3a-r、4a-b。(4-((2-甲基联苯-3-基)甲氧基)-1h-1,2,3-三唑-1-基)苯基)甲醇(4a-b)分别在二氯甲烷中经室温反应得到5a-b。在k2co3和乙腈存在下,各种脂肪胺与5a-b反应生成6a-h。(原料,购买于aladdin试剂公司)。
[0051]
其制备的反应方程式如下:
[0052][0053]
本发明实施例中30个目标化合物,其中化合物3a-r和4a-b通过第一、二步合成,化合物5a-b通过第三步由4a-b合成,化合物6a-h通过第四步由5a-b合成。
[0054]
实施例1.化合物3a的制备。
[0055]
其合成路线如下所示:
[0056][0057]
1)中间体ⅲ的制备:在0℃条件下,向含有化合物ⅱ(5.04mmol)的四氢呋喃(5ml)混合溶液加入氢化钠(15.13mmol)和炔丙基溴化物(5.54mmol),然后,反应温度升至室温,搅拌8小时。tcl检测,直到反应完全。在冷却条件下将水缓慢加入反应混合物中,然后用乙酸乙酯萃取(3
×
10ml)。收集有机层、用无水硫酸钠干燥有机层、浓缩后,使用石油醚做洗脱液,用柱色谱法纯化产品,得到棕色液体即为中间体ⅲ,得率为79%。
[0058]
化合物ⅲ:2-甲基-3-(2-丙炔氧基)甲基联苯,
[0059][0060]
棕色液体,1h-nmr(500mhz,chloroform-d)δ7.43-7.41(m,2h),7.39
–
7.35(m,2h),7.31(dd,j=6.7,1.5hz,2h),7.27-7.24(m,1h),7.22(dd,j=7.7,1.9hz,1h),4.70(s,2h),4.26(d,j=2.4hz,2h),2.50(t,j=2.4hz,1h),2.26(s,3h).esi-ms(m/z):calcd.for c
17h16
o236.12,found 237.19[m+h]
+
.
[0061]
2)目标化合物3a的制备。将化合物ⅲ(0.84mmol)和苯基叠氮化物(0.84mmol)加入到体积比1:1四氢呋喃-水(2ml)溶液中,然后将五水硫酸铜(0.16mmol)和天冬氨酸钠(0.16mmol)加入上述反应液中,混合物在室温中搅拌反应8小时。tcl检测,直到反应完全,
使用减压旋蒸法除去四氢呋喃。用乙酸乙酯萃取残液,收集混合有机层,用饱和盐水溶液洗涤,在无水硫酸钠上干燥,真空浓缩得粗产品。用柱色谱法将该产品进一步提纯,使用含30%体积分数的乙酸乙酯的石油醚混合溶剂做洗脱液柱层析得到目标化合物。目标化合物的结构通过1h nmr、
13
c nmr和质谱(esi-ms)表征。
[0062]
目标化合物的产率、熔点、纯度以及谱图数据如下所示:
[0063]
化合物3a:4-(((2-甲基联苯-3-基)甲氧基)甲基)-1-苯基-1h-1,2,3-三氮唑(3a)
[0064]
(1)3a化学结构式:
[0065][0066]
经纯化后得到白色固体(3a),收率86.43%;m.p.89-91℃,纯度:99.73%(hplc)。表征数据:
[0067]1h nmr(500mhz,chloroform-d)δ8.02(s,1h),7.77
–
7.73(m,2h),7.56
–
7.52(m,2h),7.47
–
7.45(m,1h),7.43
–
7.41(m,3h),7.38
–
7.33(m,1h),7.32
–
7.29(m,2h),7.28
–
7.25(m,1h),7.22(dd,j=7.6,1.6hz,1h),4.86(s,2h),4.75(s,2h),2.25(s,3h).esi-ms(m/z):calcd.for c
23h21
n3o 355.16,found 356.22[m+h]
+
.
[0068]
实施例2.化合物3b的制备。以下3b-r和4a-b的制备采用制备3a相同的步骤和方法,不同的是“使用同等摩尔量的不同取代苯基叠氮化合物进行替换,其中取代苯基叠氮化物的苯环上的取代基,与对应的化合物3a-r、4a-b的端部苯基上的取代基相同”。
[0069]
化合物3b:1-(2-溴苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3b)
[0070]
(1)3b化学结构式:
[0071][0072]
(2)化学反应步骤:
[0073]
经纯化后得到棕色固体(3b),收率85.96%;m.p.97-99℃,纯度:96.24%(hplc)。表征数据:
[0074]1h nmr(500mhz,chloroform-d)δ7.99(s,1h),7.78(dd,j=8.0,1.4hz,1h),7.57(dd,j=7.9,1.7hz,1h),7.50(td,j=7.7,1.4hz,1h),7.43
–
7.40(m,4h),7.37
–
7.34(m,1h),7.32
–
7.29(m,2h),7.25(d,j=7.5hz,1h),7.22(dd,j=7.6,1.7hz,1h),4.89(s,2h),4.75(s,2h),2.25(s,3h).esi-ms(m/z):calcd.for c
23h20
brn3o 433.07,found 434.15[m+h]
+
.
[0075]
实施例3.化合物3c的制备
[0076]
化合物3c:4-(((2-甲基联苯-3-基)甲氧基)甲基)-1-邻甲苯基-1h-1,2,3-三氮唑(3c)
[0077]
(1)3c化学结构式:
[0078][0079]
(2)化学反应步骤:
[0080]
经纯化后得到棕色固体(3c),收率71.21%;m.p.90-92℃,纯度:94.21%(hplc)。表征数据:
[0081]1h nmr(500mhz,chloroform-d)δ7.76(s,1h),7.42
–
7.37(m,5h),7.37
–
7.34(m,1h),7.33
–
7.32(m,2h),7.30
–
7.27(m,2h),7.24(d,j=7.8hz,1h),7.20(dd,j=7.6,1.7hz,1h),4.86(s,2h),4.73(s,2h),2.23(s,3h),2.22(s,3h).
13
c nmr(151mhz,cdcl3)δ145.15,142.85,142.10,136.53,136.29,134.36,133.71,131.50,129.87,129.41,128.15,128.05,126.86,126.78,126.01,125.43,124.14,71.67,64.00,17.92,16.10.esi-ms(m/z):calcd.for c
24h23
n3o 369.18,found 370.25[m+h]
+
.
[0082]
实施例4.化合物3d的制备
[0083]
化合物3d:3-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三唑-1-基)苯甲腈(3d)
[0084]
(1)3d化学结构式:
[0085][0086]
(2)化学反应步骤:
[0087]
经纯化后得到棕色固体(3d),收率74.53%;m.p.96-98℃,纯度:91.62%(hplc)。表征数据:
[0088]1h nmr(500mhz,chloroform-d)δ8.08(t,j=1.8hz,1h),8.06(s,1h),8.04(ddd,j=8.3,2.3,1.2hz,1h),7.76
–
7.73(m,1h),7.68(t,j=7.9hz,1h),7.44
–
7.39(m,3h),7.37
–
7.34(m,1h),7.31
–
7.29(m,2h),7.28
–
7.24(m,1h),7.22(dd,j=7.7,1.7hz,1h),4.86(s,2h),4.75(s,2h),2.25(s,3h).
13
c nmr(126mhz,cdcl3)δ146.91,142.88,141.97,137.55,136.04,134.34,132.04,130.90,129.94,129.35,128.07,128.04,126.81,125.42,124.41,123.57,120.41,117.36,114.19,71.90,63.84,16.08.esi-ms(m/z):calcd.for c
24h20
n4o 380.16,found 381.21[m+h]
+
.
[0089]
实施例5化合物3e的制备
[0090]
化合物3e:1-(3-甲氧基苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3e)
[0091]
(1)3e化学结构式:
[0092][0093]
(2)化学反应步骤:
[0094]
经纯化后得到棕色固体(3e),收率76.07%;m.p.95-96℃,纯度:99.46%(hplc)。表征数据:
[0095]1h nmr(500mhz,chloroform-d)δ8.00(s,1h),7.44
–
7.40(m,4h),7.38
–
7.34(m,2h),7.33
–
7.29(m,2h),7.29
–
7.25(m,2h),7.22(dd,j=7.6,1.7hz,1h),6.99(ddd,j=8.4,2.5,0.9hz,1h),4.86(s,2h),4.74(s,2h),3.89(s,3h),2.25(s,3h).esi-ms(m/z):calcd.for c
24h23
n3o2385.17,found 386.24[m+h]
+
.
[0096]
实施例6.化合物3f的制备
[0097]
化合物3f:4-(((2-甲基联苯-3-基)甲氧基)甲基)-1-(3-(三氟甲基)苯基)-1h-1,2,3-三氮唑(3f)
[0098]
(1)3f化学结构式:
[0099][0100]
(2)化学反应步骤:
[0101]
经纯化后得到棕色固体(3f),收率72.54%;m.p.85-86℃,纯度:97.71%(hplc)。表征数据:
[0102]1h nmr(500mhz,chloroform-d)δ8.06(s,1h),8.05
–
8.03(m,1h),7.98(dt,j=7.8,1.8hz,1h),7.75
–
7.67(m,2h),7.45
–
7.40(m,3h),7.38
–
7.33(m,1h),7.32
–
7.29(m,2h),7.27(d,j=6.0hz,1h),7.23(dd,j=7.7,1.7hz,1h),4.87(s,2h),4.75(s,2h),2.26(s,3h).
13
c nmr(151mhz,cdcl3)δ146.69,142.90,142.03,137.38,136.15,134.38,132.79,132.57,132.35,132.13,130.60,129.94,129.39,128.11,128.06,126.82,126.05,125.44,125.40,125.38,125.35,124.24,123.56,122.44,120.63,117.50,117.47,117.44,117.42,71.88,63.92,16.11.esi-ms(m/z):calcd.for c
24h20
f3n3o 423.15,found424.22[m+h]
+
.
[0103]
实施例7.化合物3g的制备
[0104]
化合物3g:1-(4-甲氧基苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3g)
[0105]
(1)3g化学结构式:
[0106][0107]
(2)化学反应步骤:
[0108]
经纯化后得到褐色固体(3g),收率82.82%;m.p.80-81℃,纯度:97.67%(hplc)。表征数据:
[0109]1h nmr(500mhz,chloroform-d)δ7.93(s,1h),7.65
–
7.62(m,2h),7.43
–
7.40(m,3h),7.37
–
7.33(m,1h),7.31
–
7.29(m,2h),7.25(t,j=7.5hz,1h),7.21(dd,j=7.7,1.7hz,1h),7.05
–
7.02(m,2h),4.85(s,2h),4.73(s,2h),3.88(s,3h),2.25(s,3h).esi-ms(m/z):calcd.for c
24h23
n3o2385.17,found 386.23[m+h]
+
.
[0110]
实施例8.化合物3h的制备
[0111]
化合物3h:1-(4-溴苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3h)
[0112]
(1)3h化学结构式:
[0113][0114]
(2)化学反应步骤:
[0115]
经纯化后得到棕色固体(3h),收率70.72%;m.p.133-135℃,纯度:98.75%(hplc)。表征数据:
[0116]1h nmr(500mhz,chloroform-d)δ7.99(s,1h),7.68
–
7.63(m,4h),7.44
–
7.39(m,3h),7.38
–
7.34(m,1h),7.31
–
7.29(m,2h),7.26(t,j=7.5hz,1h),7.22(dd,j=7.7,1.7hz,1h),4.85(s,2h),4.74(s,2h),2.25(s,3h).
13
c nmr(151mhz,cdcl3)δ146.42,142.87,142.04,136.17,136.02,134.37,132.93,129.92,129.39,128.10,128.06,126.81,125.44,122.43,121.94,120.57,71.81,63.94,16.11.esi-ms(m/z):calcd.for c
23h20
brn3o 433.07,found 434.15[m+h]
+
.
[0117]
实施例9.化合物3i的制备
[0118]
化合物3i:1-(4-氟苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3i)
[0119]
(1)3i化学结构式:
[0120][0121]
(2)化学反应步骤:
[0122]
经纯化后得到棕色固体(3i),收率77.72%;m.p.131-132℃,纯度:97.96%(hplc)。表征数据:
[0123]1h nmr(500mhz,chloroform-d)δ7.94(s,1h),7.72
–
7.69(m,2h),7.42
–
7.38(m,3h),7.35
–
7.32(m,1h),7.30
–
7.27(m,2h),7.24(d,j=2.6hz,1h),7.23
–
7.21(m,2h),7.20
–
7.19(m,1h),4.83(s,2h),4.72(s,2h),2.23(s,3h).esi-ms(m/z):calcd.for c
23h20
fn3o 373.15,found374.22[m+h]
+
.
[0124]
实施例10.化合物3j的制备
[0125]
化合物3j:1-(2-溴-4-氯苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3j)
[0126]
(1)3j化学结构式:
[0127][0128]
(2)化学反应步骤:
[0129]
经纯化后得到棕色固体(3j),收率82.60%;m.p.87-89℃,纯度:96.54%(hplc)。表征数据:
[0130]1h nmr(500mhz,chloroform-d)δ7.97(s,1h),7.79(d,j=2.0hz,1h),7.52
–
7.48(m,2h),7.42-7.39(m,3h),7.37
–
7.34(m,1h),7.31
–
7.29(m,2h),7.28
–
7.25(m,1h),7.22(dd,j=7.6,1.8hz,1h),4.87(s,2h),4.74(s,2h),2.24(s,3h).
13
c nmr(126mhz,cdcl3)δ145.26,142.82,142.03,136.57,136.15,135.21,134.34,133.55,129.87,129.36,128.84,128.79,128.12,128.02,126.76,125.40,124.62,119.09,71.64,63.79,16.09.esi-ms(m/z):calcd.for c
23h19
brcln3o 467.04,found 468.09[m+h]
+
.
[0131]
实施例11.化合物3k的制备
[0132]
化合物3k:1-(2-溴-4-(三氟甲氧基)苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3k)
[0133]
(1)3k化学结构式:
[0134][0135]
(2)化学反应步骤:
[0136]
经纯化后得到棕色固体(3k),收率78.39%;m.p.84-86℃,纯度:98.32%(hplc)。表征数据:
[0137]1h nmr(500mhz,chloroform-d)δ8.00(s,1h),7.68
–
7.65(m,1h),7.62(d,j=8.7hz,1h),7.44
–
7.39(m,4h),7.37
–
7.34(m,1h),7.32
–
7.30(m,2h),7.28
–
7.24(m,1h),7.23(dd,j=7.6,1.8hz,1h),4.89(s,2h),4.76(s,2h),2.26(s,3h).
13
c nmr(126mhz,cdcl3)δ149.86,149.85,145.35,142.83,142.02,136.14,135.14,134.33,129.87,129.35,129.19,128.11,128.01,126.76,126.17,125.40,124.62,120.74,119.41,71.66,63.77,16.08.esi-ms(m/z):calcd.for c
24h19
brf3n3o2517.06,found 518.12[m+h]
+
.
[0138]
实施例12.化合物3l的制备
[0139]
化合物3l:1-(2-溴-4-硝基苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3l)
[0140]
(1)3l化学结构式:
[0141][0142]
(2)化学反应步骤:
[0143]
经纯化后得到棕色固体(3l),收率83.82%;m.p.133-134℃,纯度:98.37%(hplc)。表征数据:
[0144]1h nmr(500mhz,chloroform-d)δ8.66(d,j=2.5hz,1h),8.36(dd,j=8.7,2.4hz,1h),8.14(s,1h),7.82(d,j=8.7hz,1h),7.44
–
7.39(m,3h),7.38
–
7.34(m,1h),7.31
–
7.29(m,2h),7.26(t,j=7.5hz,1h),7.22(dd,j=7.7,1.8hz,1h),4.89(s,2h),4.76(s,2h),2.26(s,3h).esi-ms(m/z):calcd.for c
23h19
brn4o3478.06,found 479.14[m+h]
+
.
[0145]
实施例13.化合物3m的制备
[0146]
化合物3m:1-(2-溴-4-氟苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3m)
[0147]
(1)3m化学结构式:
[0148][0149]
(2)化学反应步骤:
[0150]
经纯化后得到棕色固体(3m),收率79.41%;m.p.95-97℃,纯度:94.46%(hplc)。表征数据:
[0151]1h nmr(500mhz,chloroform-d)δ7.94(s,1h),7.55(dd,j=8.8,5.3hz,1h),7.52(dd,j=7.8,2.7hz,1h),7.43
–
7.39(m,3h),7.37
–
7.34(m,1h),7.32
–
7.29(m,2h),7.25
–
7.24(m,1h),7.23
–
7.20(m,2h),4.88(s,2h),4.74(s,2h),2.24(s,3h).esi-ms(m/z):calcd.for c
23h19
brfn3o 451.06,found452.11[m+h]
+
.
[0152]
实施例14.化合物3n的制备
[0153]
化合物3n:1-(2,4-二氟苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3n)
[0154]
(1)3n化学结构式:
[0155][0156]
(2)化学反应步骤:
[0157]
经纯化后得到白色固体(3n),收率90.57%;m.p.119-121℃,纯度:96.15%(hplc)。表征数据:
[0158]1h nmr(500mhz,chloroform-d)δ8.04(d,j=2.8hz,1h),7.92(td,j=9.0,8.6,5.7hz,1h),7.40(ddd,j=8.1,6.6,4.9hz,3h),7.36
–
7.31(m,1h),7.31
–
7.27(m,2h),7.26
–
7.22(m,1h),7.20(dd,j=7.7,1.7hz,1h),7.10
–
7.03(m,2h),4.84(s,2h),4.72(s,2h),2.23(s,3h).esi-ms(m/z):calcd.for c
23h19
f2n3o 391.14,found 392.21[m+h]
+
.
[0159]
实施例15.化合物3o的制备
[0160]
化合物3o:1-(2-溴-5-甲氧基苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3o)
[0161]
(1)3o化学结构式:
[0162][0163]
(2)化学反应步骤:
[0164]
经纯化后得到棕色固体(3o),收率84.43%;m.p.131-133℃,纯度:95.94%(hplc)。表征数据:
[0165]1h nmr(500mhz,chloroform-d)δ8.00(s,1h),7.62(d,j=8.9hz,1h),7.43
–
7.40(m,3h),7.37
–
7.33(m,1h),7.32
–
7.29(m,2h),7.25(t,j=7.5hz,1h),7.21(dd,j=7.7,1.7hz,1h),7.12(d,j=3.0hz,1h),6.97(dd,j=8.9,3.0hz,1h),4.88(s,2h),4.74(s,2h),3.85(s,3h),2.25(s,3h).
13
c nmr(151mhz,cdcl3)δ159.57,144.98,142.83,142.09,137.02,136.27,134.38,134.24,129.86,129.41,128.16,128.04,126.77,125.41,124.74,117.74,113.37,108.31,71.60,63.85,55.91,16.13.esi-ms(m/z):calcd.for c
24h22
brn3o2463.08,found 464.15[m+h]
+
.
[0166]
实施例16.化合物3p的制备
[0167]
化合物3p:1-(2-溴-5-氟苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3p)
[0168]
(1)3p化学结构式:
[0169][0170]
(2)化学反应步骤:
[0171]
经纯化后得到棕色固体(3p),收率85.68%;m.p.87-89℃,纯度:96.77%(hplc)。表征数据:
[0172]1h nmr(500mhz,chloroform-d)δ8.04(s,1h),7.74(dd,j=8.9,5.4hz,1h),7.44
–
7.40(m,3h),7.39
–
7.35(m,2h),7.32
–
7.29(m,2h),7.26(t,j=7.5hz,1h),7.22(dd,j=7.7,1.8hz,1h),7.19
–
7.15(m,1h),4.88(s,2h),4.74(s,2h),2.25(s,3h).esi-ms(m/z):calcd.for c
23h19
brfn3o 451.06,found452.12[m+h]
+
.
[0173]
实施例17.化合物3q的制备
[0174]
化合物3q:1-(2-溴-5-甲基苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3q)
[0175]
(1)3q化学结构式:
[0176][0177]
(2)化学反应步骤:
[0178]
经纯化后得到棕色固体(3q),收率75.33%;m.p.98-100℃,纯度:99.39%(hplc)。表征数据:
[0179]1h nmr(500mhz,chloroform-d)δ7.97(s,1h),7.63(d,j=8.2hz,1h),7.43
–
7.38(m,4h),7.37
–
7.33(m,1h),7.32
–
7.29(m,2h),7.25(t,j=7.5hz,1h),7.21(dt,j=8.4,1.9hz,2h),4.88(s,2h),4.74(s,2h),2.40(s,3h),2.24(s,3h).
13
c nmr(151mhz,cdcl3)δ144.95,142.82,142.11,139.07,136.30,136.22,134.37,133.51,131.99,129.85,129.41,128.78,128.16,128.04,126.77,125.41,124.75,114.91,71.54,63.88,20.80,16.13.esi-ms(m/z):calcd.for c
24h22
brn3o 447.09,found448.16[m+h]
+
.
[0180]
实施例18.化合物3r的制备
[0181]
化合物3r:1-(2-溴-5-(三氟甲基)苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(3r)
[0182]
(1)3r化学结构式:
[0183][0184]
(2)化学反应步骤:
[0185]
经纯化后得到棕色固体(3r),收率86.54%;m.p.100-102℃,纯度:96.88%(hplc)。表征数据:
[0186]1h nmr(500mhz,chloroform-d)δ8.04(s,1h),7.93(d,j=8.4hz,1h),7.86(d,j=2.1hz,1h),7.67(dd,j=8.4,2.2hz,1h),7.44
–
7.40(m,3h),7.37
–
7.34(m,1h),7.32
–
7.29(m,2h),7.26(t,j=7.5hz,1h),7.22(dd,j=7.7,1.7hz,1h),4.89(s,2h),4.75(s,2h),2.25(s,3h).esi-ms(m/z):calcd.for c
24h19
brf3n3o 501.06,found 502.15[m+h]
+
.
[0187]
实施例19.化合物4a的制备
[0188]
化合物4a:3-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三唑-1-基)苯甲醇(4a)
[0189]
(1)4a化学结构式:
[0190][0191]
(2)化学反应步骤:
[0192]
经纯化后得到棕色固体(4a),收率96.93%;m.p.109-110℃,纯度:99.12%(hplc)。表征数据:
[0193]1h nmr(500mhz,chloroform-d)δ8.02(s,1h),7.78(t,j=1.9hz,1h),7.65
–
7.62(m,1h),7.49(t,j=7.8hz,1h),7.43
–
7.39(m,4h),7.37
–
7.33(m,1h),7.31
–
7.28(m,2h),7.25(t,j=7.5hz,1h),7.21(dd,j=7.7,1.7hz,1h),4.83(s,2h),4.79(s,2h),4.73(s,2h),2.24(s,3h).esi-ms(m/z):calcd.for c
24h23
n3o2385.17,found 386.25[m+h]
+
.
[0194]
实施例20.化合物4b的制备
[0195]
化合物4b:4-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑-1-基)苯甲醇(4b)
[0196]
(1)4b化学结构式:
[0197][0198]
(2)化学反应步骤:
[0199]
经纯化后得到白色固体(4b),收率82.78%;m.p.115-117℃,纯度:96.09%(hplc)。表征数据:
[0200]1h nmr(500mhz,chloroform-d)δ8.00(s,1h),7.73(d,j=8.5hz,2h),7.54(d,j=8.6hz,2h),7.44
–
7.39(m,3h),7.37
–
7.33(m,1h),7.32
–
7.29(m,2h),7.28(s,1h),7.22(dd,j=7.6,1.5hz,1h),4.85(s,2h),4.80(s,2h),4.74(s,2h),2.25(s,3h).
13
c nmr(151mhz,cdcl3)δ146.02,142.86,142.05,141.96,136.18,136.15,134.38,129.90,129.39,128.12,128.05,126.80,125.43,120.82,120.59,71.76,64.24,63.94,16.10.esi-ms(m/z):calcd.for c
24h23
n3o2385.17,found 386.22[m+h]
+
.
[0201]
实施例21.化合物5a的制备。
[0202]
其合成路线如下所示:
[0203][0204]
目标化合物5a的制备:将化合物4a(2.59mmol)加入到ch2cl2(5ml)中冰浴冷却(0℃)后,在惰性条件下缓慢加入氯化亚砜(5.19mmol)。将混合物置于室温下搅拌反应2小时。tcl检测,直到反应完全,在冰水浴中将饱和碳酸氢钠溶液加入反应混合物中,用二氯甲烷萃取。收集混合有机层,在无水硫酸钠上干燥,真空浓缩得粗产品。用柱色谱法将该产品进一步提纯,用含20%乙酸乙酯的石油醚作为流动相,柱层析得到目标化合物。目标化合物的结构通过1h nmr和质谱(esi-ms)表征。
[0205]
目标化合物的产率,熔点以及谱图数据如下所示:
[0206]
化合物5a:1-(3-(氯甲基)苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三唑(5a)
[0207]
(1)5a化学结构式:
[0208][0209]
经纯化后得到棕色固体(5a),收率78.65%;m.p.86-88℃,纯度:92.51%(hplc)。
[0210]
表征数据:
[0211]1h nmr(500mhz,chloroform-d)δ8.01(s,1h),7.79(t,j=2.0hz,1h),7.67(ddd,j=7.9,2.2,1.1hz,1h),7.50(t,j=7.8hz,1h),7.45(dt,j=7.7,1.4hz,1h),7.41
–
7.38(m,3h),7.35
–
7.31(m,1h),7.29
–
7.27(m,2h),7.25
–
7.22(m,1h),7.20(dd,j=7.7,1.7hz,1h),4.84(s,2h),4.72(s,2h),4.63(s,2h),2.23(s,3h).esi-ms(m/z):calcd.for c
24h22
cln3o 403.14,found404.21[m+h]
+
.
[0212]
实施例22.化合物5b的制备
[0213]
化合物5b:1-(4-(氯甲基)苯基)-4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑(5b)
[0214]
(1)5b化学结构式:
[0215][0216]
(2)化学反应步骤:
[0217]
试验方法及步骤同实施例21中化合物5a的制备步骤,不同之处仅在于“将化合物4a替换为同等摩尔量的化合物4b”。经纯化后得到棕色固体(5b),收率75.43%;m.p.91-92℃,纯度:97.39%(hplc)。表征数据:
[0218]1h nmr(500mhz,chloroform-d)δ8.01(s,1h),7.76(d,j=8.6hz,2h),7.57(d,j=8.5hz,2h),7.44
–
7.39(m,3h),7.38
–
7.33(m,1h),7.30(dd,j=8.1,1.4hz,2h),7.27(d,j=9.0hz,1h),7.22(dd,j=7.7,1.7hz,1h),4.86(s,2h),4.74(s,2h),4.66(s,2h),2.25(s,3h).esi-ms(m/z):calcd.for c
24h22
cln3o 403.14,found 404.23[m+h]
+
.
[0219]
实施例23.化合物6a的制备
[0220]
其合成路线如下所示:
[0221]
[0222]
目标化合物6a的制备:将化合物5a(0.74mmol)加入到乙腈(1.5ml)中,加入碳酸钾(0.15g)、乙醇胺(0.74mmol),在室温下搅拌反应8小时。tcl检测,直到反应完全,在减压条件下除去溶剂,用乙酸乙酯萃取残渣,收集混合有机层,在无水硫酸钠上干燥,真空浓缩得粗产品。用柱色谱法将该产品进一步提纯,用含10%甲醇的二氯甲烷作为流动相,柱层析得到目标化合物。目标化合物的结构通过1h nmr、
13
c nmr和质谱(esi-ms)表征。
[0223]
目标化合物的产率,熔点以及谱图数据如下所示:
[0224]
化合物6a:2-(3-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三唑-1-基)苄氨基)乙醇(6a)
[0225]
(1)6a化学结构式:
[0226][0227]
经纯化后得到棕色固体(6a),收率78.12%;m.p.109-111℃,纯度:97.99%(hplc)。表征数据:
[0228]1h nmr(500mhz,chloroform-d)δ8.02(s,1h),7.75(t,j=1.9hz,1h),7.60(ddd,j=8.0,2.3,1.2hz,1h),7.47(t,j=7.8hz,1h),7.42
–
7.38(m,4h),7.36
–
7.31(m,1h),7.30
–
7.27(m,2h),7.24(t,j=7.5hz,1h),7.20(dd,j=7.7,1.7hz,1h),4.83(s,2h),4.72(s,2h),3.91(s,2h),3.70
–
3.68(m,2h),2.84
–
2.81(m,2h),2.23(s,3h).esi-ms(m/z):calcd.for c
26h28
n4o2428.22,found429.29[m+h]
+
.
[0229]
以下6b-d的制备采用制备6a相同的步骤和方法,不同的是“使用同等摩尔量的不同脂肪胺进行替换”。例如,实施例24中化合物6b试验方法及步骤同实施例23中化合物6a的制备步骤,不同之处仅在于“将乙醇胺替换同等摩尔量的nh(ch3)(ch2)2oh”。
[0230]
实施例24.化合物6b的制备
[0231]
化合物6b:2-(n,n-甲基-(3-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑-1-基)苄基)氨基)乙醇(6b)
[0232]
(1)6b化学结构式:
[0233][0234]
(2)化学反应步骤:
[0235]
试验方法及步骤参照6a。经纯化后得到棕色固体(6b),收率81.87%;m.p.81-82℃,纯度:98.73%(hplc)。表征数据:1h nmr(500mhz,chloroform-d)δ8.02(s,1h),7.71(t,j=1.9hz,1h),7.61(ddd,j=8.0,2.3,1.1hz,1h),7.47(t,j=7.8hz,1h),7.41
–
7.38(m,
4h),7.35
–
7.31(m,1h),7.30
–
7.27(m,2h),7.24(t,j=7.5hz,1h),7.20(dd,j=7.7,1.7hz,1h),4.83(s,2h),4.72(s,2h),3.67
–
3.64(m,4h),2.63(t,j=5.4hz,2h),2.26(s,3h),2.23(s,3h).esi-ms(m/z):calcd.for c
27h30
n4o2442.23,found 443.31[m+h]
+
.
[0236]
实施例25.化合物6c的制备
[0237]
化合物6c:n-(2-(3-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑-1-基)苄氨基)乙基)乙酰胺(6c)
[0238]
(1)6c化学结构式:
[0239][0240]
(2)化学反应步骤:
[0241]
试验方法及步骤参照6a。经纯化后得到棕色固体(6c),收率76.91%;m.p.105-106℃,纯度:98.56%(hplc)。表征数据:
[0242]1h nmr(500mhz,chloroform-d)δ8.03(s,1h),7.80(t,j=1.9hz,1h),7.59(ddd,j=8.0,2.3,1.1hz,1h),7.47(t,j=7.8hz,1h),7.41
–
7.37(m,4h),7.35
–
7.32(m,1h),7.30
–
7.27(m,2h),7.24(t,j=7.5hz,1h),7.20(dd,j=7.6,1.7hz,1h),6.15(s,1h),4.83(s,2h),4.72(s,2h),3.89(s,2h),3.37(q,j=5.7hz,2h),2.81(t,j=5.8hz,2h),2.23(s,3h),1.98(s,3h).esi-ms(m/z):calcd.for c
28h31
n5o2469.24,found 470.29[m+h]
+
.
[0243]
实施例26.化合物6d的制备
[0244]
化合物6d:2,2
’‑
(3-(3-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑-1-基)苄氨基)丙亚胺)二乙醇(6d)
[0245]
(1)6d化学结构式:
[0246][0247]
(2)化学反应步骤:
[0248]
试验方法及步骤参照6a。经纯化后得到棕色固体(6d),收率84.21%;m.p.116-118℃,纯度:98.17%(hplc)。表征数据:
[0249]1h nmr(500mhz,chloroform-d)δ8.12(s,1h),7.78(t,j=1.8hz,1h),7.65
–
7.62(m,1h),7.46(t,j=7.8hz,1h),7.41
–
7.37(m,4h),7.35
–
7.31(m,1h),7.30
–
7.27(m,2h),
7.23(t,j=7.5hz,1h),7.19(dd,j=7.7,1.7hz,1h),4.83(s,2h),4.71(s,2h),3.84(s,2h),3.60(t,j=5.2hz,4h),2.77(t,j=6.1hz,2h),2.64(t,j=6.2hz,2h),2.59(t,j=5.2hz,4h),2.23(s,3h),1.69(p,j=6.1hz,2h).esi-ms(m/z):calcd.for c
31h39
n5o3529.30,found 530.37[m+h]
+
.
[0250]
实施例27.化合物6e的制备
[0251]
化合物6e:2-(4-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑-1-基)苄氨基)乙醇(6e)
[0252]
(1)6e化学结构式:
[0253][0254]
(2)化学反应步骤:
[0255]
试验方法及步骤参照6a,不同的是“将化合物5a替换为同等摩尔量的化合物5b”。经纯化后得到棕色固体(6e),收率78.61%;m.p.114-116℃,纯度:97.85%(hplc)。表征数据:
[0256]1h nmr(500mhz,chloroform-d)δ8.00(s,1h),7.70(d,j=8.5hz,2h),7.50(d,j=8.5hz,2h),7.43
–
7.39(m,3h),7.37
–
7.33(m,1h),7.31
–
7.29(m,2h),7.25(t,j=7.5hz,1h),7.22(dd,j=7.7,1.7hz,1h),4.85(s,2h),4.74(s,2h),3.91(s,2h),3.72
–
3.70(m,2h),2.87
–
2.84(m,2h),2.24(s,3h).esi-ms(m/z):calcd.for c
26h28
n4o2428.22,found 429.29[m+h]
+
.
[0257]
实施例28.化合物6f的制备
[0258]
化合物6f:2-(n,n-甲基-(4-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑-1-基)苄基)氨基)乙醇(6f)
[0259]
(1)6f化学结构式:
[0260][0261]
(2)化学反应步骤:
[0262]
试验方法及步骤参照6b,不同的是“将化合物5a替换为同等摩尔量的化合物5b”。经纯化后得到棕色固体(6f),收率87.13%;m.p.83-84℃,纯度:99.03%(hplc)。表征数据:1h nmr(500mhz,chloroform-d)δ7.99(s,1h),7.69(d,j=8.5hz,2h),7.46(d,j=8.5hz,2h),7.41-7.38(m,3h),7.36
–
7.31(m,1h),7.29(dd,j=6.9,1.7hz,2h),7.24(t,j=7.5hz,1h),7.20(dd,j=7.7,1.7hz,1h),4.84(s,2h),4.72(s,2h),3.66(t,j=5.4hz,2h),3.63(s,2h),2.63(t,j=5.4hz,2h),2.26(s,3h),2.23(s,3h).esi-ms(m/z):calcd.for c
27h30
n4o2442.23,found443.29[m+h]
+
.
[0263]
实施例29.化合物6g的制备
[0264]
化合物6g:n-(2-(4-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑-1-基)苄氨基)乙基)乙酰胺(6g)
[0265]
(1)6g化学结构式:
[0266][0267]
(2)化学反应步骤:
[0268]
试验方法及步骤参照6c。不同的是“将化合物5a替换为同等摩尔量的化合物5b”。经纯化后得到白色固体(6g),收率75.9%;m.p.110-112℃,纯度:99.63%(hplc)。表征数据:1h nmr(500mhz,chloroform-d)δ7.99(s,1h),7.67(d,j=8.5hz,2h),7.46(d,j=8.5hz,2h),7.42
–
7.38(m,3h),7.35
–
7.31(m,1h),7.29
–
7.27(m,2h),7.24(t,j=7.5hz,1h),7.20(dd,j=7.6,1.7hz,1h),6.17(s,1h),4.83(s,2h),4.72(s,2h),3.85(s,2h),3.37(q,j=5.7hz,2h),2.78(t,j=5.9hz,2h),2.23(s,3h),1.98(s,3h).
13
c nmr(151mhz,cdcl3)δ170.38,146.05,142.85,142.05,140.98,136.21,136.00,134.34,129.87,129.37,129.36,128.09,128.03,126.78,125.40,120.77,120.63,71.73,63.96,52.82,48.21,39.19,23.31,16.08.esi-ms(m/z):calcd.for c
28h31
n5o2469.24,found 470.31[m+h]
+
.
[0269]
实施例30.化合物6h的制备
[0270]
化合物6h:2,2
’‑
(3-(4-(4-(((2-甲基联苯-3-基)甲氧基)甲基)-1h-1,2,3-三氮唑-1-基)苄氨基)丙基亚胺)二乙醇(6h)
[0271]
(1)6h化学结构式:
[0272][0273]
(2)化学反应步骤:
[0274]
试验方法及步骤参照6d。不同的是“将化合物5a替换为同等摩尔量的化合物5b”。经纯化后得到棕色固体(6h),收率79.12%;m.p.120-121℃,纯度:99.37%(hplc)。表征数据:
[0275]1h nmr(500mhz,chloroform-d)δ7.99(s,1h),7.72
–
7.67(m,2h),7.50(d,j=8.5hz,2h),7.43
–
7.38(m,3h),7.37
–
7.33(m,1h),7.30(dd,j=6.9,1.7hz,2h),7.27(d,j=4.6hz,1h),7.21(dd,j=7.6,1.7hz,1h),4.85(s,2h),4.73(s,2h),3.85(s,2h),3.64(t,j=5.2hz,4h),2.79(t,j=6.0hz,2h),2.68(t,j=6.2hz,2h),2.63(t,j=5.2hz,4h),2.24(s,3h),1.71(p,j=6.1hz,2h).
13
c nmr(151mhz,cdcl3)δ145.98,142.83,142.07,140.03,136.22,136.05,134.34,129.84,129.77,129.38,128.09,128.03,126.76,125.40,120.84,120.64,71.68,63.92,59.72,56.20,53.22,52.98,47.80,26.82,16.08.esi-ms(m/z):
calcd.for c
31h39
n5o3529.30,found 530.38[m+h]
+
.
[0276]
实施例31.本发明30个化合物对癌细胞细胞毒性的影响,cck-8实验分析:
[0277]
将细胞在rpmi 1640、10%fbs、penicillin-streptomycine培养基里于5%co2中37℃恒温培养。然后以每孔5000个细胞数量的95μl细胞悬浮液种植在96孔板中,继续培养4h。再次,将5μl含不同浓度化合物的dmso溶液以及培养基混合液(1μl含化合物的dmso溶液加入4μl细胞培养基)加入到96孔板的每个孔中,使每孔中化合物的浓度为(0.2,0.4,0.8,1.6,3.2,6.4μm),对照组加入5μl不含化合物的dmso以及培养基混合液(1μldmso加入4μl细胞培养基),继续于5%co2中37℃恒温培养48h。最后每孔板加入10μl cck-8试剂,继续在37℃恒温条件下培养1h,用酶标仪molecular devices m4读取96孔板每孔在450nm光波长下的吸光度值,计算细胞的增殖活力,三次实验结果平均值
±
sd作为实验最终结果,并用prism 8.0作图(见图1)。紫杉醇(paclitaxel)和bms202(pd-l1抑制剂)作为阳性对照。细胞的增殖活力计算公式:细胞活力(%)=[a(加药组)-a(空白组)]/[a(0加药组)-a(空白组)]
×
100;其中,a(加药组):具有细胞、cck-8试剂和化合物溶液的孔的吸光度;a(空白组):具有培养基和cck-8试剂而没有细胞的孔的吸光度;a(0加药组):具有细胞、cck-8试剂、1%dmso而没有药物溶液的孔的吸光度。其中化合物6d、6e、6h对人类非小细胞肺癌细胞(a549、hcc827)和乳腺癌细胞(mda-mb-231)的毒理活性测试结果,如表1半数抑制浓度ic
50
(μm)。联苯-三氮唑偶联物对hcc827、a549、mda-mb-231肿瘤细胞活力的影响结果见图1。其中,图1中分图a、b、c的横坐标从左到右分别为1%dmso、paclitaxel、bms202以及浓度为10μm的化合物3a-r、4a-b、5a-b和6a-h。图1中分图d、e、f的横坐标测试的是1%dmso以及浓度依次为0.2、0.4、0.8、1.6、3.2、6.4μm的paclitaxel、6d、6e和6h。图1中纵坐标为肿瘤细胞存活率。
[0278]
表1.化合物6d、6e、6h对三种癌细胞半数抑制浓度ic
50
(μm)a[0279][0280]a平均值
±
标准偏差(n=3)(p《0.05).
[0281]
实施例32.本发明中30个化合物对pd-1/pd-l1阻断活性影响,htrf实验分析。
[0282]
首先将蛋白稀释到各自要求的浓度,解冻tag1-pd-l1蛋白溶液,用ppi铕检测缓冲液稀释5倍;解冻tag2-pd1蛋白溶液,用ppi铕检测缓冲液稀释5倍;解冻anti-tag1-eu3+溶液,用ppi铕检测缓冲液稀释100倍;解冻anti-tag2-xl665溶液,用ppi铕检测缓冲液稀释25倍;解冻10mm化合物,用ppi铕检测缓冲液稀释至0.32mm。
[0283]
然后在384孔板中实验组每孔分别加入2μl不同梯度的抑制剂小分子溶液和对照抗体溶液,4μlpd-l1-tag1,4μlpd-1-tag2。室温保存15min。再加入5μl anti-tag1-eu
3+
和5μl anti-tag2-xl665的混合液,密封避光室温保存2h。
[0284]
设置阴性对照和阳性对照组:阳性对照(bms202),阴性对照(ppi铕检测缓冲液),使得每孔溶液体积都为20μl,操作同实验组。最后在320nm激发波长激发下分别检测665nm
和620nm波长处荧光发射,按公式ratio=(signal 665nm)/(signal 620nm)
×
104处理数据,signal 665nm和signal 620nm分别表示于665nm和620nm处的荧光发射信号强度。htrf方法测定小分子对pd-1/pd-l1相互作用的影响能力结果见图2。结果显示化合物5a具有最好的抑制pd-1/pd-l1相互作用的能力,具有良好的生物活性,结果如图2。图2中横坐标从左到右分别为浓度为32μm的bms202以及化合物3a-r、4a-b、5a-b和6a-h。图2中纵坐标为pd-1/pd-l1结合活性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1