一种不对称催化合成手性1,4-二氢吡啶化合物的方法及其应用
1.本发明属于化学合成技术领域,具体涉及一种不对称催化合成手性1,4-二氢吡啶化合物的方法及其应用。
背景技术:
2.1,4-二氢吡啶化合物作为一种高效的钙离子通道阻滞剂而被广泛的用于心血管疾病的临床治疗,目前市面在售用于治疗高血压的1,4-二氢吡啶药物分子包括:非洛地平、氨氯地平、尼群地平、尼莫地平、尼索地平等,这类药物分子c-4位取代基的立体化学极大的影响该类结构的药理活性。因此,合成光学纯的1,4-二氢吡啶药物分子将有利于增强该类药物分子的临床治疗效果。目前,已公开了手性诱导、拆分以及不对称催化合成该类手性药物分子的策略。
3.拆分:
4.f.doll
é
等人利用手性高效液相色谱(hplc)实现了钙通道拮抗剂s11568的拆分反应,能分别以50%的收率得到两种构型的产物(bioorg.med.chem.1997,5,749);尹永梅和郗日沫等人利用手性超临界流体色谱(sfc)实现了对1,4-二氢吡啶药物分子的手性拆分,通过对流速以及溶剂的调节,完成了对尼莫地平、氨氯地平、阿折地平、贝尼地平、西尼地平、尼索地平和非洛地平药物分子的拆分(j.ofsupercriticalfluids2016,107,129)。
[0005][0006]
s.p.sonawane等人利用(+)-l-酒石酸盐对氨氯地平药物分子进行拆分(org.process res.dev.2010,14,640)。在该反应中,以dmf/水(v/v=85:15)作为混合溶剂,(s)-氨氯地平与(+)-l-酒石酸盐以共结晶的形式析出,而(r)-氨氯地平则溶解在dmf/水混合溶液中。随后(s)-氨氯地平在异丙醇/水的混合溶剂中与苯磺酸在室温下即可转换成手性药物分子(s)-苯磺酸氨氯地平。
[0007][0008]
f.rebolledo等人利用脂肪酶实现了1,4-二氢吡啶药物分子衍生物的动力学拆分(tetrahedron2015,71,3976)。产物以34-51%的转换率得到58-98%ee对映选择性的水解产物。
[0009][0010]
手性诱导:
[0011]
s.sundell课题组利用手性醇为原料,先后经历上保护基、酯化、加成脱水串联反应、去保护基、水解再酯化六步反应,以37%的收率得到手性felodipine药物分子(tetrahedron lett.1989,30,6423)。
[0012][0013]
h.-y.lee等人利用手性缩水甘油为起始原料,同样经历多步衍生,最终以22%的总收率得到(s)-felodipine(tetrahedron2011,67,10222)。
[0014][0015]
不对称催化:
[0016]
龚流柱等人利用手性联萘磷酸为催化剂、苯甲腈为溶剂、在50℃下反应24h,以31
–
93%的收率以及66
–
98%ee的对映选择性得到一系列手性1,4-二氢吡啶化合物(angew.chem.int.ed.2008,47,2458)。然而该类1,4-二氢吡啶产物难以转换成3,5-二羧酸酯基取代的手性1,4-二氢吡啶药物分子。
[0017][0018]
c.bressy,x.bugaut以及j.rodriguez等人利用硫脲衍生物为手性有机小分子催化剂,二氯甲烷为反应溶剂,在37℃下反应24h,最终以25
–
71%的收率以及58
–
96%ee的对映选择性得到手性1,4-二氢吡啶化合物,该化合物结构同样难以转换为3,5-二羧酸酯取代的手性1,4-二氢吡啶药物分子(angew.chem.int.ed.2016,55,1401)。在氧化剂的作用下,该类1,4-二氢吡啶结构被氧化为吡啶,实现中心手性到轴手性的转变。
[0019][0020]
吴建一课题组利用金鸡纳碱衍生的手性小分子催化剂实现了尼群地平分子的不对称构建(advancedmaterialsresearch,2012,518-523,3943)。由于产物手性中心两端取代基分别为区分度较小的甲酯以及乙酯,因此该产物的手性控制较差,只能以41%ee的对映选择性得到尼群地平,且与该产物结构类似的其它1,4-二氢吡啶药物家族的不对称合成并未有涉及。
[0021][0022]
综上所述,目前关于直接合成手性1,4-二氢吡啶药物分子及其衍生物的策略主要依靠拆分以及手性诱导。然而拆分最高只能做到50%的收率,原子经济性差;而手性诱导则需要提前制备底物,步骤冗长,收率较低,原子经济性差。虽然目前有一些小分子催化剂能够实现1,4-二氢吡啶化合物的不对称构建,并且有不错的手性控制,然而该类1,4-二氢吡啶化合物结构特殊,难以转换为真正的手性1,4-二氢吡啶药物分子。关于催化不对称合成手性1,4-二氢吡啶药物分子只有一例报道,但是手性控制较差,且只局限于尼群地平药物分子的合成。因此,有必要发展一种简单、高效、环境友好、底物普适性好的合成手性1,4-二氢吡啶化合物及其药物分子的方法。
技术实现要素:
[0023]
本发明的目的在于通过2-取代-3-氧代丁酸酯与3-氨基巴豆酸酯的不对称1,4-加成/亲核加成/脱水串联反应一步构建1,4-二氢吡啶化合物,为合成一系列手性1,4-二氢吡啶药物分子提供一种高效、高选择性不对称催化新方法。
[0024]
本发明的目的是通过以下技术方案来实现的:
[0025]
一种不对称催化合成手性1,4-二氢吡啶化合物的方法,包括以下步骤:
[0026]
以化合物ⅰ和化合物ⅱ为原料,手性氧化胺与金属化合物形成的配合物为催化剂,手性氧化胺与金属化合物在有机溶剂中搅拌即可形成配合物,优选的搅拌时间是10-60min,在有机溶剂中反应得到所述手性1,4-二氢吡啶化合物;
[0027]
反应式如下:
[0028][0029]
式中,r1为芳基、杂环芳基或烷基;
[0030]
r2为芳基、杂环芳基或烷基;
[0031]
r3为芳基、杂环芳基或烷基;
[0032]
r4为芳基、杂环芳基或烷基;
[0033]
r5为芳基、杂环芳基或烷基;
[0034]
r1,r2,r3,r4,r5中所述芳基、杂环芳基或烷基分别被一个或多个各自独立的r
x
的取代基取代;所述r
x
为氢原子、卤素、烷基、氟取代基、硝基、氰基、酯基、烯基、炔基、烷氧基、取代氨基、芳基、羟基、氨基、酰胺基和磺酰胺中的一种或多种;
[0035]
所述手性氧化胺的结构式为:
[0036][0037]
中的一种或多种;
[0038]
式中,r为烷基、芳基或杂环,所述烷基、芳基和杂环分别被一个或多个各自独立的ry所取代;所述ry为氢原子、烷基、烷氧基、酯基、芳基以及卤素中的一种或多种;m=0~6;优选的,手性氧化胺为m=1,r为2,3,4,5,6-me5c6,记为l
3-pime5;优选的,手性氧化胺为m=1,r为2,6-et2c6h3,记为l
3-peet2;
[0039]
所述金属化合物为:三氟甲磺酸镁[mg(otf)2]、高氯酸镁[mg(clo4)2]、双(三氟甲基磺酰)亚胺镁[mg(ntf2)2]、三氟甲磺酸钪[sc(otf)3]、三氟甲磺酸亚铁[fe(otf)2]、三氟甲磺酸铁[fe(otf)3]、三氟甲磺酸镍[ni(otf)2]、镍二(三氟甲基磺酰基)亚胺[ni(ntf2)2]、六水合四氟硼酸镍[ni(bf4)2]
·
6h2o、六水合高氯酸镍[ni(clo4)2]
·
6h2o、三氟甲磺酸铜[cu(otf)2]、双(三氟甲基磺酰基)酰亚胺铜[cu(ntf2)2]、三氟甲磺酸锌[zn(otf)2],三氟甲磺酸钇[y(otf)3]、三氟甲磺酸镧[la(otf)3]、三氟甲磺酸铈[ce(otf)3]、三氟甲磺酸镨[pr(otf)3]、三氟甲磺酸钕[nd(otf)3]、三氟甲磺酸钐[sm(otf)3]、三氟甲磺酸铕[eu(otf)3]、三氟甲磺酸钆[gd(otf)3]、三氟甲磺酸铽[tb(otf)3]、三氟甲磺酸镝[dy(otf)3]、三氟甲磺酸钬[ho(otf)3]、三氟甲磺酸铒[er(otf)3]、三氟甲磺酸铥[tm(otf)3]、三氟甲磺酸镱[yb(otf)3]、三氟甲磺酸镥[lu(otf)3]、三氟甲磺酸钴[co(otf)2]和双(三氟甲基磺酰基)亚钴[co(ntf2)2]、三氟甲磺酸铝[al(otf)3]、三氟甲磺酸铟[in(otf)3]、三氟甲磺酸镓[ga(otf)3]中的一种或多种。
[0040]
进一步的,式中,
[0041]
r1为c6h5,2f-c6h4,3f-c6h4,4f-c6h4,2cf
3-c6h4,2cf
3-c6h4,2cf
3-c6h4,2cl-c6h4,3cl-c6h4,4cl-c6h4,2brc6h4,3brc6h4,4brc6h4,2me-c6h4,3me-c6h4,4me-c6h4,2ome-c6h4,3ome-c6h4,4ome-c6h4,2no
2-c6h4,3no
2-c6h4,4no
2-c6h4,4oet-c6h4,4ph-c6h4,2cn-c6h4,3cn-c6h4,4cn-c6h4,2co2me-c6h4,3co2me-c6h4,4co2me-c6h4,3,4-me
2-c6h3,3cl-4f-c6h3,2-thienyl,3-thienyl,piperonyl,2-naphthyl,1-naphthyl,2,3-cl
2-c6h3,2nme2c6h4,3nme2c6h4,4nme2c6h4,4-(methylsulfonyl)-benzenyl,2-(methylsulfonyl)-benzenyl,
[0042]
3-(methylsulfonyl)-benzenyl,me,et,isopropyl,tertiarybutyl,isobutyl,cyclopropyl,cyclopentyl,cyclohexyl,cycloheptyl,
[0043]
和/或,r2为ch3,et,isopropyl,tertiarybutyl,isobutyl,c6h5,2f-c6h4,3f-c6h4,4f-c6h4,2cf
3-c6h4,2cf
3-c6h4,2cf
3-c6h4,2cl-c6h4,3cl-c6h4,4cl-c6h4,2brc6h4,3brc6h4,
4brc6h4,2me-c6h4,3me-c6h4,4me-c6h4,2ome-c6h4,3ome-c6h4,4ome-c6h4,2no
2-c6h4,3no
2-c6h4,4no
2-c6h4,4oet-c6h4,4ph-c6h4,2cn-c6h4,3cn-c6h4,4cn-c6h4,2co2me-c6h4,3co2me-c6h4,4co2me-c6h4,3,4-me
2-c6h3,3cl-4f-c6h3,2-thienyl,3-thienyl,piperonyl,2-naphthyl,1-naphthyl,2,3-cl
2-c6h3,2nme2c6h4,3nme2c6h4,4nme2c6h4,4-(methylsulfonyl)-benzenyl,2-(methylsulfonyl)-benzenyl,3-(methylsulfonyl)-benzenyl,cyclopropyl,cyclopentyl,cyclohexyl,cycloheptyl,ch2co
2n
pr,c2h4ome,ome,
[0044]
和/或,r3为ch3,et,isopropyl,tertiarybutyl,isobutyl,c2h4ome,c6h5,2f-c6h4,3f-c6h4,4f-c6h4,2cf
3-c6h4,2cf
3-c6h4,2cf
3-c6h4,2cl-c6h4,3cl-c6h4,4cl-c6h4,2brc6h4,3brc6h4,4brc6h4,2me-c6h4,3me-c6h4,4me-c6h4,2ome-c6h4,3ome-c6h4,4ome-c6h4,2no
2-c6h4,3no
2-c6h4,4no
2-c6h4,4oet-c6h4,4ph-c6h4,2cn-c6h4,3cn-c6h4,4cn-c6h4,2co2me-c6h4,3co2me-c6h4,4co2me-c6h4,3,4-me
2-c6h3,3cl-4f-c6h3,2-thienyl,3-thienyl,piperonyl,2-naphthyl,1-naphthyl,2,3-cl
2-c6h3,2nme2c6h4,3nme2c6h4,4nme2c6h4,4-(methylsulfonyl)-benzenyl,2-(methylsulfonyl)-benzenyl,3-(methylsulfonyl)-benzenyl,cyclopropyl,cyclopentyl,cyclohexyl,cycloheptyl,
[0045]
和/或,r4为ch3,et,isopropyl,tertiarybutyl,isobutyl,cyclopropyl,cyclopentyl,cyclohexyl,cycloheptyl,c6h5,2f-c6h4,3f-c6h4,4f-c6h4,2cf
3-c6h4,2cf
3-c6h4,2cf
3-c6h4,2cl-c6h4,3cl-c6h4,4cl-c6h4,2brc6h4,3brc6h4,4brc6h4,2me-c6h4,3me-c6h4,4me-c6h4,2ome-c6h4,3ome-c6h4,4ome-c6h4,2no
2-c6h4,3no
2-c6h4,4no
2-c6h4,4oet-c6h4,4ph-c6h4,2cn-c6h4,3cn-c6h4,4cn-c6h4,2co2me-c6h4,3co2me-c6h4,4co2me-c6h4,3,4-me
2-c6h3,3cl-4f-c6h3,2-thienyl,3-thienyl,piperonyl,2-naphthyl,1-naphthyl,2,3-cl
2-c6h3,2nme2c6h4,3nme2c6h4,4nme2c6h4,4-(methylsulfonyl)-benzenyl,2-(methylsulfonyl)-benzenyl或3-(methylsulfonyl)-benzenyl;
[0046]
和/或,r5为ch3,et,isopropyl,tertiary butyl,isobutyl,cyclopropyl,cyclopentyl,cyclohexyl,cycloheptyl,c6h5,2f-c6h4,3f-c6h4,4f-c6h4,2cf
3-c6h4,2cf
3-c6h4,2cf
3-c6h4,2cl-c6h4,3cl-c6h4,4cl-c6h4,2brc6h4,3brc6h4,4brc6h4,2me-c6h4,3me-c6h4,4me-c6h4,2ome-c6h4,3ome-c6h4,4ome-c6h4,2no
2-c6h4,3no
2-c6h4,4no
2-c6h4,4oet-c6h4,4ph-c6h4,2cn-c6h4,3cn-c6h4,4cn-c6h4,2co2me-c6h4,3co2me-c6h4,4co2me-c6h4,3,4-me
2-c6h3,3cl-4f-c6h3,2-thienyl,3-thienyl,piperonyl,2-naphthyl,1-naphthyl,2,3-cl
2-c6h3,2nme2c6h4,3nme2c6h4,4nme2c6h4,4-(methylsulfonyl)-benzenyl,2-(methylsulfonyl)-benzenyl或3-(methylsulfonyl)-benzenyl。
[0047]
进一步的,所述化合物ⅰ与化合物ⅱ的摩尔比为1:0.5-5;优选的,所述化合物ⅰ与化合物ⅱ的摩尔比为1:1.2;
[0048]
和/或,所述化合物ⅰ与催化剂的摩尔比为1:0.01-1;优选的,所述化合物ⅰ与催化剂的摩尔比为1:0.1;
3-氧代丁酸酯、nabar
4f
和二氯甲烷进行活化反应,再加入3-氨基巴豆酸乙酯反应即可得到所述尼群地平;
[0062]
更进一步的,合成方法具体包括:取三氟甲磺酸镍[ni(otf)2](0.01mmol)、手性氧化胺l
3-pime5(0.01mmol),2-取代-3-氧代丁酸酯(0.10mmol)以及nabar
4f
(0.10mmol);加入二氯甲烷2.0ml,于30℃下活化30min后,将反应转移至20℃继续搅拌10min;在20℃下缓慢加入3-氨基巴豆酸乙酯(0.12mmol),并继续在20℃下反应72h,经石油醚/乙酸乙酯柱层析分离纯化得产物尼群地平nitrendipine,产物的对映体过量用高效液相色谱(daicel chiralcel ig,v正己烷:v异丙醇=95:5,流速1.0ml/min)测定;
[0063]
反应式如下:
[0064][0065]
进一步的,所述尼莫地平的合成方法包括:选择化合物ⅰ为化合物ⅱ为即可合成所述尼莫地平;
[0066]
进一步的,所述尼莫地平的合成方法包括:取三氟甲磺酸镍、手性氧化胺、2-取代-3-氧代丁酸酯、nabar
4f
和二氯甲烷进行活化反应,再加入3-氨基巴豆酸异丙酯反应即可得到所述尼莫地平;
[0067]
更进一步的,合成方法具体包括:取三氟甲磺酸镍[ni(otf)2](0.01mmol)、手性氧化胺l
3-pime5(0.01mmol),2-取代-3-氧代丁酸酯(0.10mmol)以及nabar
4f
(0.10mmol);加入二氯甲烷2.0ml,于30℃下活化30min后,缓慢加入3-氨基巴豆酸异丙酯(0.12mmol),并继续在30℃下反应96h,经石油醚/乙酸乙酯柱层析分离纯化得产物尼莫地平nimodipine,产物的对映体过量用高效液相色谱(daicel chiralcel if,v正己烷:v异丙醇=95:5,流速1.0ml/min)测定;
[0068]
反应式如下:
[0069]
[0070]
进一步的,所述非洛地平的合成方法包括:选择化合物ⅰ为化合物ⅱ为可合成所述非洛地平;
[0071]
进一步的,所述非洛地平的合成方法包括:取三氟甲磺酸钕、手性氧化胺l
3-peet2、2-取代-3-氧代丁酸酯和乙酸乙酯进行活化反应,再加入3-氨基巴豆酸乙酯反应即可得到所述非洛地平;
[0072]
更进一步的,合成方法具体包括:取三氟甲磺酸钕[nd(otf)3](0.01mmol)、手性氧化胺l
3-peet2(0.01mmol)以及2-取代-3-氧代丁酸酯1d(0.10mmol);加入乙酸乙酯2.0ml,于30℃下活化30min后,将反应转移至20℃继续搅拌10min;在20℃下加入3-氨基巴豆酸乙酯2a(0.12mmol),并继续在20℃下反应72h,经石油醚/乙酸乙酯柱层析分离纯化得产物非洛地平felodipine,产物的对映体过量用高效液相色谱(daicel chiralcel ic,v正己烷:v异丙醇=95:5,流速1.0ml/min)测定;
[0073]
反应式如下:
[0074][0075]
本发明的有益效果是:
[0076]
1、本发明利用手性氧化胺-三氟甲磺酸镍/三氟甲磺酸钕配合物催化2-取代-3-氧代丁酸酯与3-氨基巴豆酸酯的不对称1,4-加成/亲核加成/脱水串联反应,以高收率、高对映选择性的实现1,4-二氢吡啶化合物及其药物分子的一步构建,底物普适性好;
[0077]
2、本发明的产物易与催化剂以及原料分离;
[0078]
3、本发明的反应体系简单清洁,符合绿色化学原子经济性;
[0079]
4、运用该方法能以高收率以及对应选择上实现一系列具有潜在生物活性的手性1,4-二氢吡啶化合物的一步构建,如尼群地平、尼莫地平、伊拉地平、氨氯地平、尼索地平、巴尼地平、阿泽尼地平、贝尼地平、西尼地平或非洛地平,特别是手性药物分子非洛地平、尼群地平和尼莫地平。
附图说明
[0080]
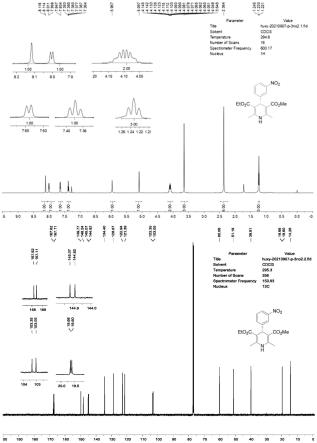
图1为实施例3制备的尼群地平的核磁谱图;
[0081]
图2为实施例4制备的尼莫地平的核磁谱图;
[0082]
图3为实施例5制备的非洛地平的核磁谱图。
具体实施方式
[0083]
为了更好的理解本发明的内容,下面结合具体实例来做进一步的说明,但具体的实施方式并不是对本发明的内容所做的限制。
[0084]
实施例1不同金属化合物的效果对比
[0085]
在反应瓶中分别加入金属盐[al(otf)3、in(otf)3、zn(otf)2、sc(otf)3、fe(otf)3、fe(otf)2、la(otf)3、y(otf)3、cu(otf)2、mg(otf)2、ni(otf)2、co(otf)2(0.01mmol)]、手性氧化胺l
3-piet2(0.01mmol)、2-取代-3-氧代丁酸酯1a(0.1mmol)、搅拌子以及1,2-二氯乙烷(1.0ml),于30℃下搅拌30min,在30℃下加入底物2a(0.12mmol)并继续在此温度下反应24h,经石油醚/乙酸乙酯柱层析分离纯化,产物的对映体过量用高效液相色谱(daicel chiralcelic,v正己烷:v异丙醇=95:5,流速1.0ml/min)测定。反应式结构如下:
[0086][0087][0088][0089]a标准反应条件下1.0ml二氯甲烷做反应溶剂。
[0090]
实施例2不同手性氧化胺的效果对比
[0091]
在反应瓶中加入三氟甲磺酸镍[ni(otf)2](0.01mmol)、手性氧化胺(0.01mmol)、nabar
4f
(0.01mmol)、2-取代-3-氧代丁酸酯1a(0.1mmol)、搅拌子以及二氯甲烷(2.0ml),于30℃下活化30min,将反应转移至20℃下继续搅拌10min,加入底物2a(0.12mmol)并在此温度下反应48h。反应完成后,产物经石油醚/乙酸乙酯柱层析分离纯化,产物的对映体过量用高效液相色谱(daicelchiralcel ic,v正己烷:v异丙醇=95:5,流速1.0ml/min)测定。反应式和手性氧化胺配体结构如下:
[0092][0093][0094]
a 10℃下反应72h。
[0095]
实施例3手性药物分子尼群地平(nitrendipine)的合成
[0096][0097]
在反应瓶中加入三氟甲磺酸镍[ni(otf)2](0.01mmol)、手性氧化胺l
3-pime5(0.01mmol),2-取代-3-氧代丁酸酯1b(0.10mmol)以及nabar
4f
(0.10mmol);加入二氯甲烷2.0ml,于30℃下活化30min后,将反应转移至20℃继续搅拌10min;在20℃下缓慢加入3-氨基巴豆酸乙酯2a(0.12mmol),并继续在20℃下反应72h,经石油醚/乙酸乙酯柱层析分离纯化得产物nitrendipine(98%yield,92%ee),产物的对映体过量用高效液相色谱(daicel chiralcel ig,v正己烷:v异丙醇=95:5,流速1.0ml/min)测定。
[0098]
实施例4手性药物分子尼莫地平(nimodipine)的合成
[0099][0100]
在反应瓶中加入三氟甲磺酸镍[ni(otf)2](0.01mmol)、手性氧化胺l
3-pime5(0.01mmol),2-取代-3-氧代丁酸酯1c(0.10mmol)以及nabar
4f
(0.10mmol);加入二氯甲烷2.0ml,于30℃下活化30min后,在此温度下加入3-氨基巴豆酸异丙酯2b(0.12mmol),并继续在30℃下反应96h,经石油醚/乙酸乙酯柱层析分离纯化得产物nimodipine(75%yield,87%ee),产物的对映体过量用高效液相色谱(daicel chiralcel if,v正己烷:v异丙醇=95:5,流速1.0ml/min)测定。
[0101]
实施例5:手性药物分子非洛地平(felodipine)的合成
[0102][0103]
在反应瓶中加入三氟甲磺酸钕[nd(otf)3](0.01mmol)、手性氧化胺l
3-peet2(0.01mmol)以及2-取代-3-氧代丁酸酯1d(0.10mmol);加入乙酸乙酯2.0ml,于30℃下活化30min后,将反应转移至20℃继续搅拌10min;在20℃下加入3-氨基巴豆酸乙酯2a(0.12mmol),并继续在20℃下反应72h,经石油醚/乙酸乙酯柱层析分离纯化得产物felodipine(65%yield,91%ee),产物的对映体过量用高效液相色谱(daicel chiralcel ic,v正己烷:v异丙醇=95:5,流速1.0ml/min)测定。
[0104]
以上所述仅是本发明的优选实施方式,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1