一种抗GD2抗体、含其的CAR、CAR组合及其应用的制作方法
一种抗gd2抗体、含其的car、car组合及其应用
技术领域
1.本发明属于分子生物学、细胞生物学和免疫肿瘤学领域。本发明涉及一种抗gd2抗体、含其的嵌合抗原受体(car)、car组合及其应用。
背景技术:
2.恶性神经胶质瘤(malignant gliomas,mg),包括多形性成胶质细胞瘤和胶质母细胞瘤,在美国每年的新增病例有20000例。根据美国脑部肿瘤协会的统计,截至2010年,美国有140000人患有恶性的脑部肿瘤。尽管mg是一种罕见的疾病,但是它的恶性程度以及致死率是非常高的。现有的标准治疗手段,效果非常有限,外科手术以及放疗后的五年生存率也非常低。对于手术后复发的病人,新的治疗选择也非常少。因此,开发新的靶点,新的治疗手段是广大病人的迫切需求。由于肿瘤的异质性,目前本领域面临的主要问题是单一car-t无法完全清除病灶内的肿瘤细胞,从而产生免疫逃逸。
技术实现要素:
3.为了解决上述问题,本发明提供一种抗gd2抗体、含其的car、car组合及其应用。尤其是本发明提供(1)靶向il13ra2与cd40转换受体联用mrna瞬时表达t细胞治疗神经胶质瘤的应用;(2)靶向il13ra2与cd40转换受体联用慢病毒稳定表达t细胞治疗神经胶质瘤的应用;(3)靶向il13ra2与gd2嵌合抗原受体及cd40转换受体联用mrna瞬时表达t细胞治疗神经胶质瘤的应用。本发明提供的car组合可增强car-t细胞对il13ra2高表达的神经胶质瘤细胞系的杀伤能力;且laco融合蛋白引入到h08 car上后可促进h08 car-t的肿瘤清除能力,并延长小鼠的生存时长。同时,car组合可破坏u87肿瘤细胞的异质性,双向靶向u87,避免肿瘤的逃逸。并且,当laco融合加入至car组合中,这种杀伤作用更加明显,说明laco融合蛋白同样可以增强t细胞的杀伤功能。laco融合蛋白及gd2 car均能提高il13ra2 car-t对标志物的激活水平以及增强细胞因子的分泌。
4.本发明一方面提供一种抗gd2抗体,其包含vl
gd2
和vh
gd2
,所述vl
gd2
包含序列如seq id no: 1所示的cdr1、序列如seq id no: 2所示的cdr2和序列如seq id no: 3所示的cdr3;所述vh gd2
包含序列如seq id no: 4所示的cdr1、序列如seq id no: 5所示的cdr2和序列如seq id no: 6所示的cdr3。
5.在某些较佳实施方案中,所述vl
gd2
包含如seq id no: 7所示的氨基酸序列,且所述vh
gd2
包含如seq id no: 8所示的氨基酸序列。
6.在某些较佳实施方案中,所述抗gd2抗体以scfv形式存在,例如所述scfv的氨基酸序列如seq id no: 9所示,核苷酸序列如seq id no: 26所示。
7.本发明另一方面提供一种嵌合抗原受体(car),其包含如本发明上述一方面所述的抗gd2抗体、信号肽、铰链区、穿膜区、胞内信号域和/或cd3ζ区域。
8.较佳地,所述信号肽为cd8信号肽,所述胞内信号域为4-1bb胞内信号域;更佳地,所述嵌合抗原受体从n末端至c末端依次为:cd8信号肽、抗gd2抗体、cd8铰
链区、cd8穿膜区、胞内信号域4-1bb、cd3ζ区域。
9.本发明另一方面提供一种嵌合抗原受体组合,其包含car il13ra2
分子和如本发明上述方面所述的嵌合抗原受体,所述car il13ra2
分子包含含有vl
il13ra2
和vh
il13ra2
的scfv il13ra2
。
10.较佳地,所述vl
il13ra2
包含如seq id no: 10所示的氨基酸序列,且所述vh
il13ra2
包含如seq id no: 11所示的氨基酸序列;更佳地,所述scfv il13ra2
的氨基酸序列如seq id no: 12所示。
11.在某些较佳实施方案中,所述car il13ra2
分子从n末端至c末端依次为:cd8信号肽、scfv il13ra2
、cd8铰链区、cd8穿膜区、胞内信号域4-1bb、cd3ζ区域。
12.本发明所述的car il13ra2
分子即为抗il13ra2抗体(即h08)以嵌合抗原受体的形式存在。
13.较佳地,所述抗il13ra2抗体包含vl il13ra2
和vh il13ra2
,所述vl il13ra2
包含序列如seq id no: 20的cdr1、序列如seq id no: 21示的cdr2和序列如seq id no: 22的cdr3;所述vh il13ra2
包含序列如seq id no: 23的cdr1、序列如seq id no: 24的cdr2和序列如seq id no: 25的cdr3。
14.本发明所述的嵌合抗原受体组合较佳地进一步包括含laco融合蛋白,所述laco融合蛋白包含氨基酸序列如seq id no: 13所示的scfv cd40
。
15.较佳地,所述laco融合蛋白从n末端至c末端依次为:cd8信号肽、scfv cd40
、cd8铰链区、cd28穿膜区和cd28胞内区。
16.在某些较佳实施方案中,本发明所述的cd8信号肽的序列如seq id no: 14所示,所述cd8铰链区的序列如seq id no: 15所示,所述cd8穿膜区的序列如seq id no: 16所示,所述胞内信号域4-1bb的序列如seq id no: 17所示,或,所述cd3ζ区域的序列如seq id no: 18所示。
17.本发明另一方面提供一种嵌合抗原受体融合蛋白,其由本发明所述嵌合抗原受体组合中所定义的car il13ra2
分子和本发明上述的所述嵌合抗原受体融合而成。
18.优选地,嵌合抗原受体融合蛋白融合了laco融合蛋白,所述laco融合蛋白如本发明上述嵌合抗原受体组合中所定义,其中,所述laco融合蛋白包含氨基酸序列如seq id no: 13所示的scfv cd40
。
19.所述嵌合抗原受体融合蛋白中,所述car il13ra2
分子、所述嵌合抗原受体和所述laco融合蛋白之间的融合方式可为本领域常规,例如通过连接子(例如f2a)连接;例如所述嵌合抗原受体融合蛋白从n末端至c末端依次为car il13ra2
分子、所述嵌合抗原受体和所述laco融合蛋白,或者为所述嵌合抗原受体、car il13ra2
分子和所述laco融合蛋白。
20.所述f2a为本领域常见的2a肽,其核苷酸序列如seq id no: 19所示。
21.本发明另一方面提供一种分离的核酸,其编码如本发明上述方面所述的抗gd2抗体、所述的嵌合抗原受体、所述的嵌合抗原受体组合或所述的嵌合抗原受体融合蛋白。
22.本发明另一方面提供一种重组表达载体,其包含如本发明上述方面所述的分离的核酸。
23.较佳地,所述重组表达载体为质粒、粘粒、噬菌体或病毒载体,所述病毒载体优选逆转录病毒载体、慢病毒载体、腺病毒载体或腺相关病毒载体。
24.更佳地,所述慢病毒载体为plv或ptrpe。
25.本发明另一方面提供一种转化体,其包含如本发明上述方面所述的重组表达载体。
26.优选地,所述转化体的宿主细胞为原核细胞或真核细胞。
27.更优选地,所述真核细胞为酵母细胞或哺乳动物细胞,例如所述哺乳动物细胞为293t细胞或cho细胞。
28.本发明另一方面提供一种基因修饰的细胞,其包含如本发明上述方面所述的嵌合抗原受体、所述的嵌合抗原受体组合或所述的嵌合抗原受体融合蛋白。
29.较佳地,所述基因修饰的细胞为真核细胞,优选分离的人细胞;更优选免疫细胞,如t细胞。
30.本发明另一方面提供一种嵌合抗原受体、嵌合抗原受体组合或嵌合抗原受体融合蛋白的制备方法,其包含以下步骤:培养如上述方面所述的转化体,从培养物中获得所述嵌合抗原受体组合。
31.本发明另一方面提供一种药物组合物,其包含如本发明上述方面所述的抗gd2抗体、所述的嵌合抗原受体、所述的嵌合抗原受体组合或所述的嵌合抗原受体融合蛋白,以及药学上可接受的载体。
32.较佳地,所述car
il13ra2
分子与所述嵌合抗原受体的质量比为(0.5~3):1例如1:1,所述car
il13ra2
分子与所述laco融合蛋白的质量比为(0.5~3): 1例如1:1。
33.更佳地,所述药物组合物还含有由激素制剂、靶向小分子制剂、蛋白酶体抑制剂、成像剂、诊断剂、化疗剂、溶瘤药物、细胞毒性剂、细胞因子、共刺激分子的激活剂、抑制性分子的抑制剂以及疫苗组成的群组中的一种或多种。
34.本发明另一方面提供一种套装药盒,其包含药盒a和药盒b,其中:所述药盒a包含如本发明上述方面所述的抗gd2抗体、所述的嵌合抗原受体、所述的嵌合抗原受体组合或所述的嵌合抗原受体融合蛋白。
35.较佳地,所述药盒b含有其他抗肿瘤抗体或者包含所述其他抗肿瘤抗体的药物组合物,和/或由激素制剂、靶向小分子制剂、蛋白酶体抑制剂、成像剂、诊断剂、化疗剂、溶瘤药物、细胞毒性剂、细胞因子、共刺激分子的激活剂、抑制性分子的抑制剂以及疫苗组成的群组中的一种或多种。
36.本发明另一方面提供一种如本发明上述方面所述的抗gd2抗体、所述的嵌合抗原受体、所述的嵌合抗原受体组合或所述的嵌合抗原受体融合蛋白、所述的基因修饰的细胞和/或所述的药物组合物在制备治疗、诊断和/或预防肿瘤的药物中的应用。
37.较佳地,所述肿瘤为il13ra2阳性和/或gd2阳性肿瘤,例如神经胶质瘤。
38.本发明另一方面还提供了一种治疗、诊断和/或预防肿瘤的方法,包括向有需要的患者施用治疗有效量的如本发明所述的抗gd2抗体、所述的嵌合抗原受体、所述的嵌合抗原受体组合或所述的嵌合抗原受体融合蛋白、所述的基因修饰的细胞和/或所述的药物组合物治疗有需要的患者。
39.较佳地,上述方法中,所述肿瘤为il13ra2阳性和/或gd2阳性肿瘤,例如神经胶质瘤。
40.本发明另一方面还提供了本发明所述的抗gd2抗体、所述的嵌合抗原受体、所述的嵌合抗原受体组合或所述的嵌合抗原受体融合蛋白、所述的基因修饰的细胞和/或所述的
药物组合物用于治疗、诊断和/或预防肿瘤;较佳地,所述肿瘤为il13ra2阳性和/或gd2阳性肿瘤,例如神经胶质瘤。
41.本发明所用试剂和原料均市售可得。
42.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
43.本发明的积极进步效果在于:本发明提供的car组合可增强car-t细胞对il13ra2高表达的神经胶质瘤细胞系的杀伤能力;且laco融合蛋白引入到h08 car上后可促进h08 car-t的肿瘤清除能力,并延长小鼠的生存时长。同时,car组合可破坏u87肿瘤细胞的异质性,双向靶向u87,避免肿瘤的逃逸。并且,当laco融合加入至car组合中,这种杀伤作用更加明显,说明laco融合蛋白同样可以增强t细胞的杀伤功能。laco融合蛋白及gd2 car均能提高il13ra2 car-t对标志物的激活水平以及增强细胞因子的分泌。
附图说明
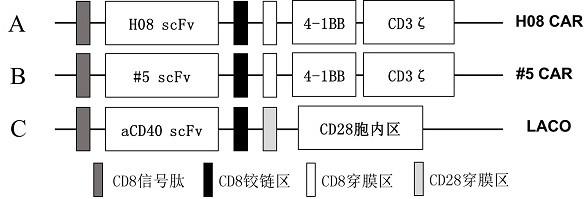
44.图1:靶向il13ra2 car元件及laco元件模式图。
45.图2:瞬时表达car-t细胞中il13ra2 car及laco的表达。
46.图3:神经肿瘤细胞系中il13ra2及cd40的表达。
47.图4:瞬时表达car-t细胞对u87的杀伤能力检测。
48.图5:稳定表达car-t及laco元件模式图。
49.图6:稳定表达car-t细胞中il13ra2 car及laco的表达。
50.图7:稳定表达car-t细胞对神经肿瘤细胞的杀伤能力检测。
51.图8:稳定表达car-t细胞与肿瘤细胞共孵育后cd137的表达。
52.图9:u87肿瘤细胞系的流式分选。
53.图10:免疫缺陷鼠荷瘤实验检测car-t功能。
54.图11:靶向il13ra2,gd2 car元件及laco模式图。
55.图12:瞬时表达car-t细胞中il13ra2 car,gd2 car及laco的表达。
56.图13:瞬时表达car-t细胞对u87的杀伤能力检测。
57.图14:瞬时表达car-t细胞活化标志物的表达。
58.图15:瞬时表达car-t细胞细胞因子分泌能力检测。
具体实施方式
59.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
60.本发明涉及的序列信息如下表:
实施例1 瞬时表达靶向il13ra2 嵌合抗原受体及laco的car-t细胞的制备和功能靶向il13ra2的car元件及laco的制备:本专利从wo2019178078 a1中获得靶向il13ra2的scfv序列(即h08),并通过噬菌体展示筛选出靶向il13ra2的更加特异的scfv序列(#5),同时从本公司专利wo2022037520a1中获得淋巴细胞-抗原提呈细胞共刺激分子laco序列,通过重组pcr的方法将h08及#5与cd8信号肽,cd8铰链区,cd8穿膜区相连,并在其后串联4-1bb及cd3ζ胞内信号域,制备成靶向il13ra2的car结构(图1的a和b);而laco的序列包含cd8信号肽,抗cd40 scfv,cd8铰链区,cd28穿膜区及cd28胞内信号域(图1的c)。
61.构建了用于产生靶向il13ra2 car及laco的mrna的载体:将car元件克隆到可以体外转录的pda载体中用于转录靶向il13ra2的car mrna:h08及#5,并将laco元件克隆到pda载体中。通过体外转录(ivt)制备了可以表达laco及靶向il13ra2 car的mrna。pda-car质粒通过spe1酶切线性化,并通过pcr cleanup试剂盒进行纯化。用nanodrop测量dna浓度并通过运行琼脂糖dna凝胶检查后,按照制造商的操作指南(thermofisher, cat no: am13455)进行ivt。通过nanodrop测定rna产物的浓度,并运行page凝胶进行检查。
62.使用电穿孔转染的方式将il13ra2 car 及laco mrna导入t细胞:收集t细胞(妙顺公司购买获得细胞血样,发明人使用prodigy分离获得pbmc,然后用cd4 cd8磁珠阳性分选得到该t细胞),用opti-mem培养基清洗两遍,并用opti-mem培养基以1
×
107/ml重悬,将5
ꢀµ
g h08 mrna,#5 mrna,laco mrna分别与5
ꢀµ
g 无义 mrna混匀,作为单靶向组:h08组,#5组及laco组。将5
ꢀµ
g h08 mrna和#5 mrna分别与5
ꢀµ
g laco mrna混匀,作为双靶向组:h08+laco组、#5+laco组。将上述混合的mrna分别与100
ꢀµ
l 浓度为1e8/ml的t细胞混匀,进行电穿孔,参数如下(btx机):500v,0.7ms;然后将细胞转移到预热的r10培养基(加100 u/ml il2)上,在37℃下培养24小时。将未与任何mrna混合的电转t细胞作为对照组:ntd组。
63.通过facs染色检测il13ra2 car-t细胞与il13ra2-fc重组蛋白的结合。如图2的a所示,h08组,h08+laco组,#5组,#5+laco组在电转后24小时表达的car 97%以上都可以结合il13ra2蛋白,而ntd及laco组不能结合il13ra2蛋白。
64.通过facs染色检测laco t细胞与cd40-fc重组蛋白的结合。如图2的b所示, h08+laco组,#5+laco及laco组在电转后24小时表达的car 98%以上都可以结合cd40蛋白,而h08组,#5组及ntd组均不能结合cd40蛋白蛋白。
65.肿瘤细胞筛选:对人神经胶质瘤细胞株u87(购自浙江美森),u251(购自中科院)及人神经母细胞瘤sy5y(购自上海艺佳)进行il13ra2和cd40的表达水平检测。通过对同型对照或抗il13ra2抗体对三种细胞进行facs染色,以检测肿瘤细胞中il13ra2的表达。如图3的a所示,u87细胞中约50%表达il13ra2,u251细胞中均表达il13ra2,sy5y细胞中约10%表达il13ra2。通过对同型对照或抗cd40抗体对三种细胞进行facs染色(图3的b)发现,u87细胞有cd40的表达,而u251和sy5y细胞中均未检测到cd40的表达。
66.体外细胞杀伤实验:通过慢病毒感染的方法制备表达gfp的u87细胞系,用实时荧光法检测不同电转mrna组的car-t细胞对u87细胞系(同时表达il13ra2及cd40)的杀伤能力,胰酶消化处于对数生长期的u87-gfp细胞系,用r10培养基洗两遍,重悬于r10培养基中,调整密度为1e5/ml,将100 μl 肿瘤细胞悬液加至96孔平底板中作为靶向细胞;收集电转后24小时的t细胞,用r10培养基洗两遍后,重悬于r10培养基中,调整密度为1e5/ml,将100 μl 不同电转组t细胞悬液加至靶向细胞中,e:t = 1:1。将孔板放入incucyte s3机器中,并设置扫描参数。扫描3天后,分析总绿色物体积分强度 (gcu
ꢀ×ꢀµm²
/孔) 以计算杀伤效率。如图4所示(h08+laco 》 h08 》 #5+laco 》 #5 》laco ≈ ntd),相对于未转导car-t细胞(ntd)组,laco组对u87无杀伤作用,靶向il13ra2的h08及#5组car-t细胞均对u87有杀伤作用,且同时表达laco的h08及#5组 car-t细胞对u87的杀伤有显著的增强作用。这表明laco与il13ra2联用可增强car-t细胞对il13ra2高表达的神经胶质瘤细胞系的杀伤能力。
67.实施例2 稳定表达靶向il13ra2 嵌合抗原受体及laco的car-t细胞的制备和功能慢病毒质粒制备:为了验证靶向il13ra2 car与laco联用的长时间清除肿瘤的能力,我们在原有il13ra2 car(图5的a和b)的基础上,制备了能够同时表达il13ra2 car及laco的元件,我们将laco与两种car通过f2a进行串联,制备成了表达laco及h08的car元件:ah(图5的c),及表达laco及#5的car元件:a#5(图5的d)。将这4种元件克隆到慢病毒载体ptrpe中,测序比对成功后,将所得质粒转化至x-blue菌株中,涂板筛选,过夜后挑出卡那霉素阳性单克隆,接种至200 ml lb培养基中,摇菌过夜后用qiagen质粒大提试剂盒提取质粒,得到表达car及laco的ptrpe慢病毒质粒。
68.慢病毒包装:将以上四种ptrpe质粒作为主质粒,分别与病毒包装质粒(prre,rev,pmd.2g)混合于opti-mem培养基中,以质量比为1:1加入peipro混合20分钟后,将混合液加至对数生长期的市面常用的293t细胞中,24小时和48小时后收集上清,超速离心后得到慢病毒,用倍比稀释法在激活的t细胞系中做病毒滴度检测。
69.稳转car-t细胞的制备及检测:复苏冻存的t细胞,重悬于r10(加100 u/ml il2)中,将抗cd3/cd28磁珠加至t细胞中,磁珠:t细胞 = 1:1,过夜激活后将病毒加至激活的t细胞,病毒:t细胞 = 3:1。五天后用磁力架除去磁珠,得到的car-t细胞继续培养,调整密度为5e5/ml,隔天换液,计数并记录细胞大小,待细胞大小降至350 μm3左右(约13天后)进行功能实验。通过facs染色测量car-t细胞与laco的表达。如图6所示,相对于未转染t细胞(ntd组),h08单独表达组(h组)car的表达率约为63.5%;#5单独表达组(#5)car的表达率约为62.3%;h08和laco共表达组(ah)car和laco的表达分别约为51.9%和56.7%左右,#5和laco共表达组(a#5)car和lcao的表达分别约为49.3%和49.6%。
70.体外功能实验:(1)杀伤能力检测:胰酶消化il3ra2表达的u87,u251,sy5y细胞株,以及il3ra2及cd40均不表达的aspc-1细胞株,pbs洗两遍后用r10培养基重悬,调整密度为1e5/ml,将100 μl肿瘤细胞重悬液铺至96孔平底板中;将处于静息状态的t细胞(细胞大小《 350 um3)用pbs洗两遍,用r10培养基重悬,调整密度为1e5/ml,将100 ul t细胞与孔板中的肿瘤细胞混合,放入incucyte s3机器中,并设置扫描参数。扫描3天后,分析总绿色物体积分强度 (gcu
ꢀ×ꢀµm²
/孔) 以计算杀伤效率。如图7所示(ah》h≈a#5》#5》ntd),相对于ntd组,h组对u87,u251及sy5y均有较明显的杀伤作用,且ah组显示laco的引入能少量增强杀伤效果;#5组对u87,u251及sy5y的杀伤效果明显不如h组,但是a#5组的杀伤效果却明显提升了,说明laco的引入明显增强了#5的杀伤能力。而所有t细胞组对aspc-1均没有杀伤能力,提示laco的引入并不会引起非特异性杀伤的发生。
71.(2)细胞活化水平检测:将各组t细胞及肿瘤细胞调整密度为1e5/ml,将100 μl 肿瘤细胞铺至96孔平底板中,将100 μl静息状态下的各组t细胞分别与肿瘤细胞混匀,24小时后收取细胞,用cd3-bv421,cd8-af800,cd137-bv605抗体进行染色,分析cd3+cd8+细胞群中cd137的表达情况。如图8所示(ah≈h》a#5》#5》ntd),相对于单独car-t细胞,laco的引入能明显增加cd8 t细胞群中cd137的表达,提示laco的引入增强了car-t细胞的活化功能。
72.体内功能实验:为了更加清楚地看到laco对car-t细胞的影响,我们采用免疫缺陷鼠(nsg)荷瘤实验来观察各组t细胞对肿瘤的清除能力。首先我们对u87-gfp-luciferase细胞进行了流式分选,选择了il13ra2阳性的u87-gfp-luciferase细胞(图9)进行小鼠荷瘤。在肿瘤长至14天时,肿瘤大小达到150-200 mm3左右进行t细胞静脉输注治疗,观察小鼠体重,肿瘤大小,肿瘤荧光及生存率的变化,结果显示,治疗后小鼠体重均无明显改变(图10的a:ah≈h≈a#5≈#5≈ntd),h及ah组的肿瘤大小在治疗后第12天左右基本消失,而a#5组的肿瘤大小显著低于#5组(图10的b:ah≈h》a#5》 #5≈ntd),提示laco促进了car-t的肿瘤清除能力。同时我们也发现laco的引入能较快的清除肿瘤细胞(图10的c:ah≈h》a#5》#5≈ntd),且laco也延长了小鼠的生存时长(图10的d:ah》h》a#5》 #5≈ntd)。
73.实施例3 瞬时表达il13ra2, gd2 car和il13ra2,gd2 car,laco car t细胞的制备和功能瞬时靶向gd2的car载体的制备:同上,通过重组pcr的方法将gd2 scfv与cd8信号
肽,cd8铰链区,cd8穿膜区相连,并在其后串联4-1bb及cd3ζ胞内信号域,制备成靶向gd2的car结构(图11)。将car元件克隆到可以体外转录的pda载体中,同样用体外转录的方法得到表达靶向gd2的car mrna。
74.将5 μg gd2 car mrna电转至t细胞中作为gd2 car-t组,将5 μg h08 car mrna电转至t细胞中作为il13ra2 car-t组;将5 μg gd2 car mrna和5 μg h08 car mrna电转至t细胞中作为gd2+il13ra2组;将5 μg gd2 car mrna和5 μg h08 car mrna和5 μg laco mrna电转至t细胞中作为gd2+il13ra2+laco组,将为与mrna混合的电转t细胞作为ntd组。在电转后24小时,用il13ra2-fc抗原检测不同组t细胞中il13ra2 car的表达,用cd40-fc抗原检测不同组t细胞中laco的表达,用抗fab抗体检测gd2的表达,结果显示,电转car及laco的表达效率均在90%以上(图12)。
75.体外杀伤实验:用实时荧光法检测不同电转mrna组的car-t细胞对u87细胞系的杀伤能力,将u87细胞与t细胞按照e:t = 1:1接种于96孔平底板中。将孔板放入incucyte s3机器中,并设置扫描参数。扫描3天后,分析总绿色物体积分强度 (gcu
ꢀ×ꢀµm²
/孔) 以计算杀伤效率。如图13所示(gd2+il13ra2+laco》gd2+il13ra2》il13ra2》gd2≈ntd),相对于未转导car-t细胞(ntd)组,gd2组对u87的杀伤作用不显著,而il13ra2 car-t组对u87有较强的杀伤作用,然而il13ra2+gd2 car组 t细胞对u87的杀伤作用要强于单独car-t组,说明gd2与il13ra2的联用可破坏u87肿瘤细胞的异质性,双向靶向u87,避免肿瘤的逃逸。并且,当laco加入至双car-t中,这种杀伤作用更加明显,说明laco同样可以增强t细胞的杀伤功能。
76.细胞激活标志物检测:在t细胞与肿瘤细胞共培养24小时后,检测t细胞的活化分子cd69及cd25的表达发现,gd2 car-t虽然杀伤作用不明显,但是cd69 cd25双阳细胞群相对于ntd却明显上调(66.4%),且gd2+il13ra2组的双阳细胞群明显增加(83.9%),同时,gd2+il13ra2+laco组的双阳细胞群可达到93.1%(图14的a)。在对cd137的检测发现,gd2 car-t几乎不表达cd137,而il13ra2组的cd137表达约为58.4%,同时,我们发现gd2+il13ra2+laco组的cd137表达可达到75.5%(图14的b),提示laco及gd2 car的表达均能提高il13ra2 car-t的激活水平。
77.细胞因子检测:在t细胞与肿瘤细胞共培养24小时后,去上清进行elisa检测,图15(gd2+il13ra2+laco》gd2+il13ra2》il13ra2》gd2》ntd)结果显示gd2 car-t与肿瘤细胞共培养后,分泌il2及ifnγ的能力较弱,而与il13ra2 car联用时,相对于il13ra2单独car-t细胞,il2及ifnγ的分泌能力变强;且laco的引入也能增加car-t细胞il2及ifnγ的分泌能力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1